




Preview text:
TRƯỜN `G THCS MAI LÂM
CHÀO MỪNG CÁC THẦY CÔ
VỀ DỰ GIỜ THĂM LỚP MÔN KHTN LỚP 7A
Giáo viên: Trần Thị Mận Năm học: 2022 - 2023 Chương I NGUYÊN TỬ.
SƠ LƯỢC VỀ BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HOÁ HỌC Tiết 6 -Bài 2 CHỦ ĐỀ :NGUYÊN TỬ ( Tiết 1) NỘI DUNG 01 Quan niệm ban
03 Mô hình nguyên tử đầu về nguyên tử của Rơ-dơ-pho-Bo 02 Cấu tạo 04 Khối lượng nguyên tử nguyên tử 01 Quan niệm ban đầu về nguyên tử NGUY I) ÊN T Qu Ử a CÓ n KÍCH niệTHƯ m ỚC NHƯ ban THẾ đ N ầ ÀO
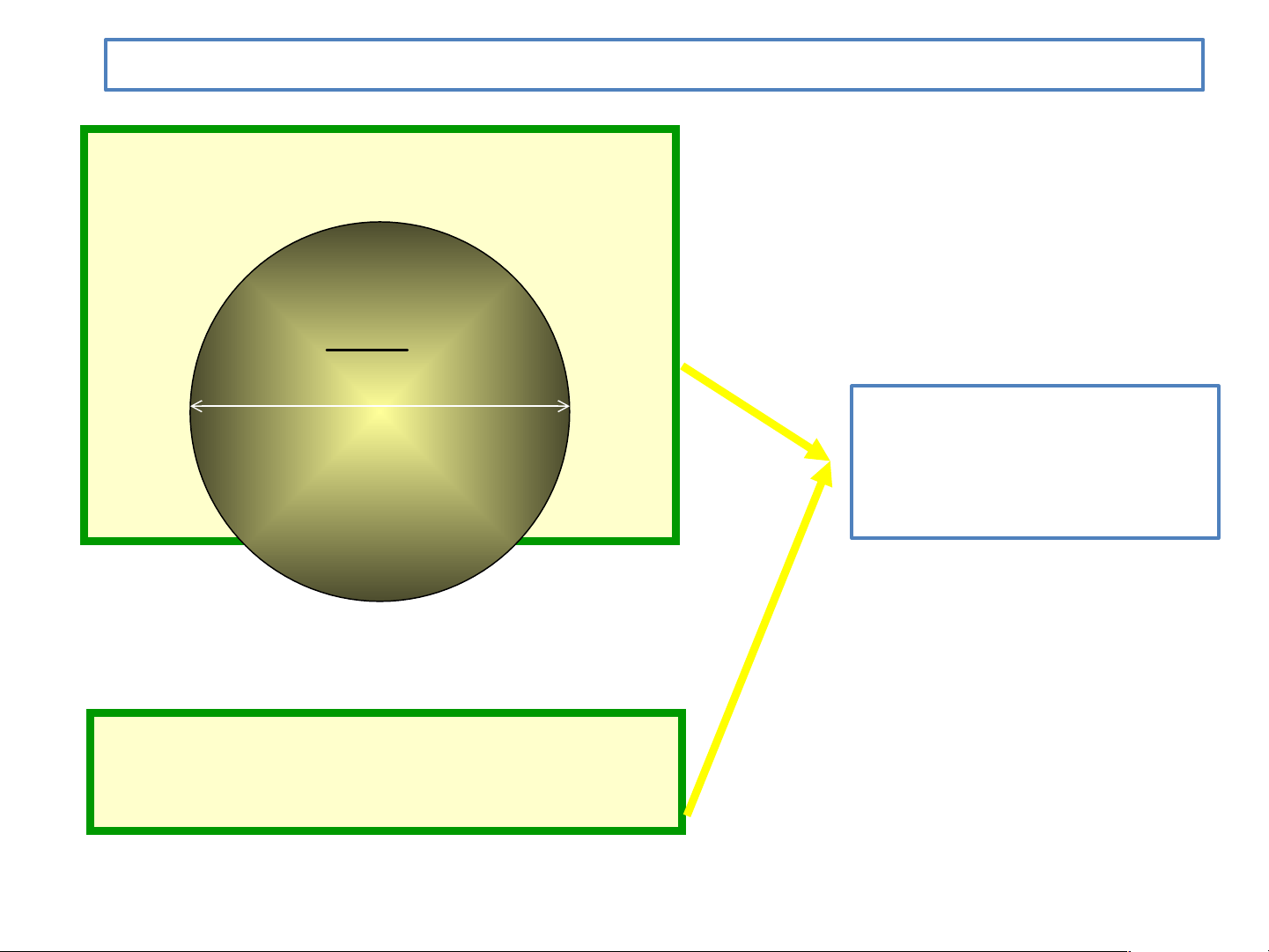
u ?về nguyên tử NGUYÊN TỬ 1 cm 8 10
Nguyên tử là hạt vô cùng Nguyên tử là hạt vô cùng nhỏ.
4 triệu nguyên tử sắp xếp thành hàng dọc
liền nhau có chiều dài 1 mm. Nguyên tử là những hạt vô cùng nhỏ, không thể phân chia nhỏ hơn được nữa, tạo nên các vật Democritus Các chất tác dụng với với nhau theo các lượng
xác định, có các đơn vị
tối thiểu (nguyên tử) để
chúng kết hợp vừa đủ với nhau J. Dalton (1766 – 1844) Bài 2 NGUYÊN TỬ
I. Quan niệm ban đầu về nguyên tử
- Theo Democritus: Nguyên tử là những hạt rất
nhỏ cấu tạo nên chất, không thể phân chia được nữa.
- Theo Dalton: Các đơn vị chất tối thiểu (nguyên
tử) kết hợp vừa đủ với nhau theo các lượng xác
định trong phản ứng hoá học". 02 Mô hình nguyên tử của Rơ-dơ-pho - Bo Hãy cho biết các thành
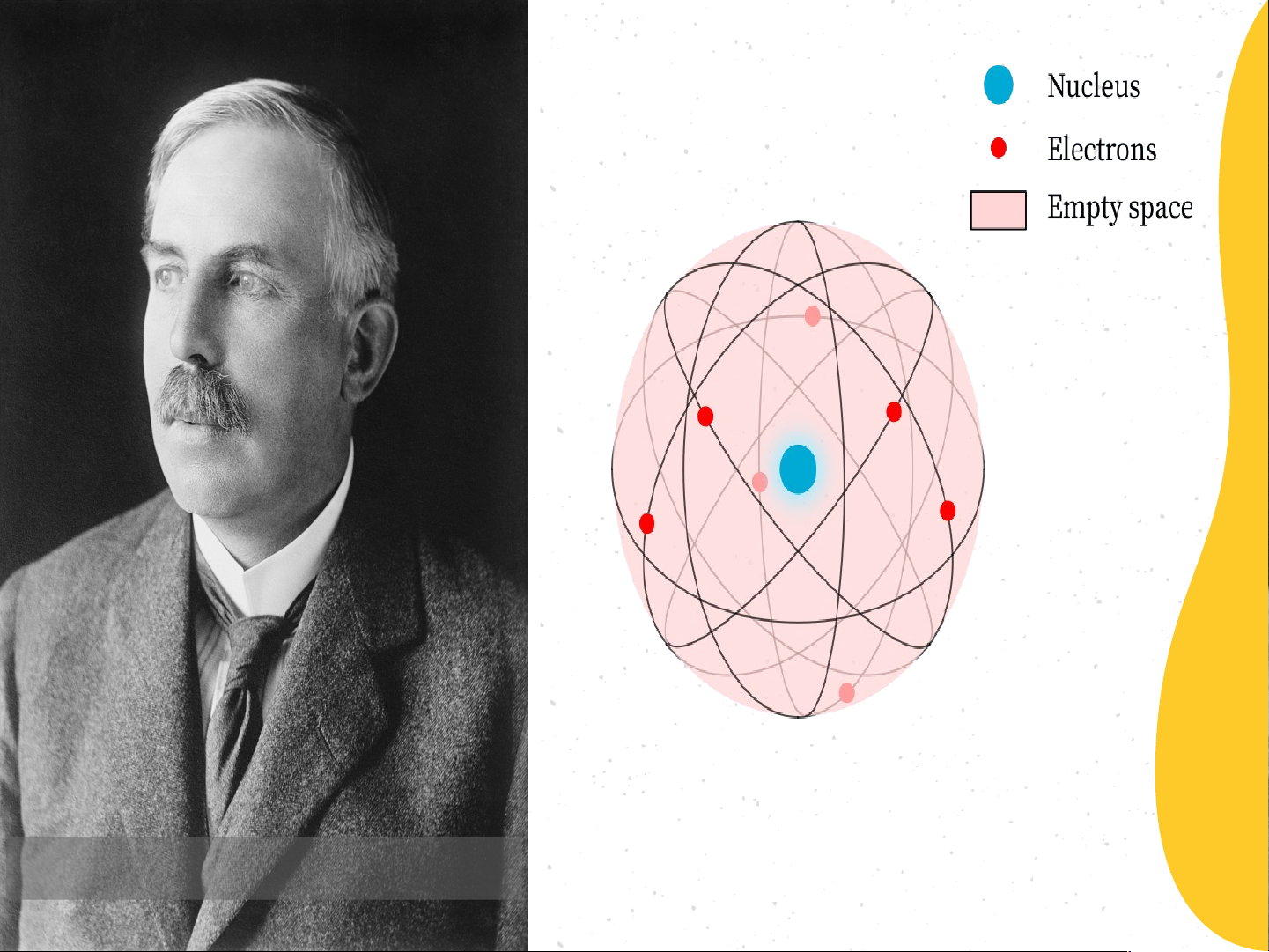
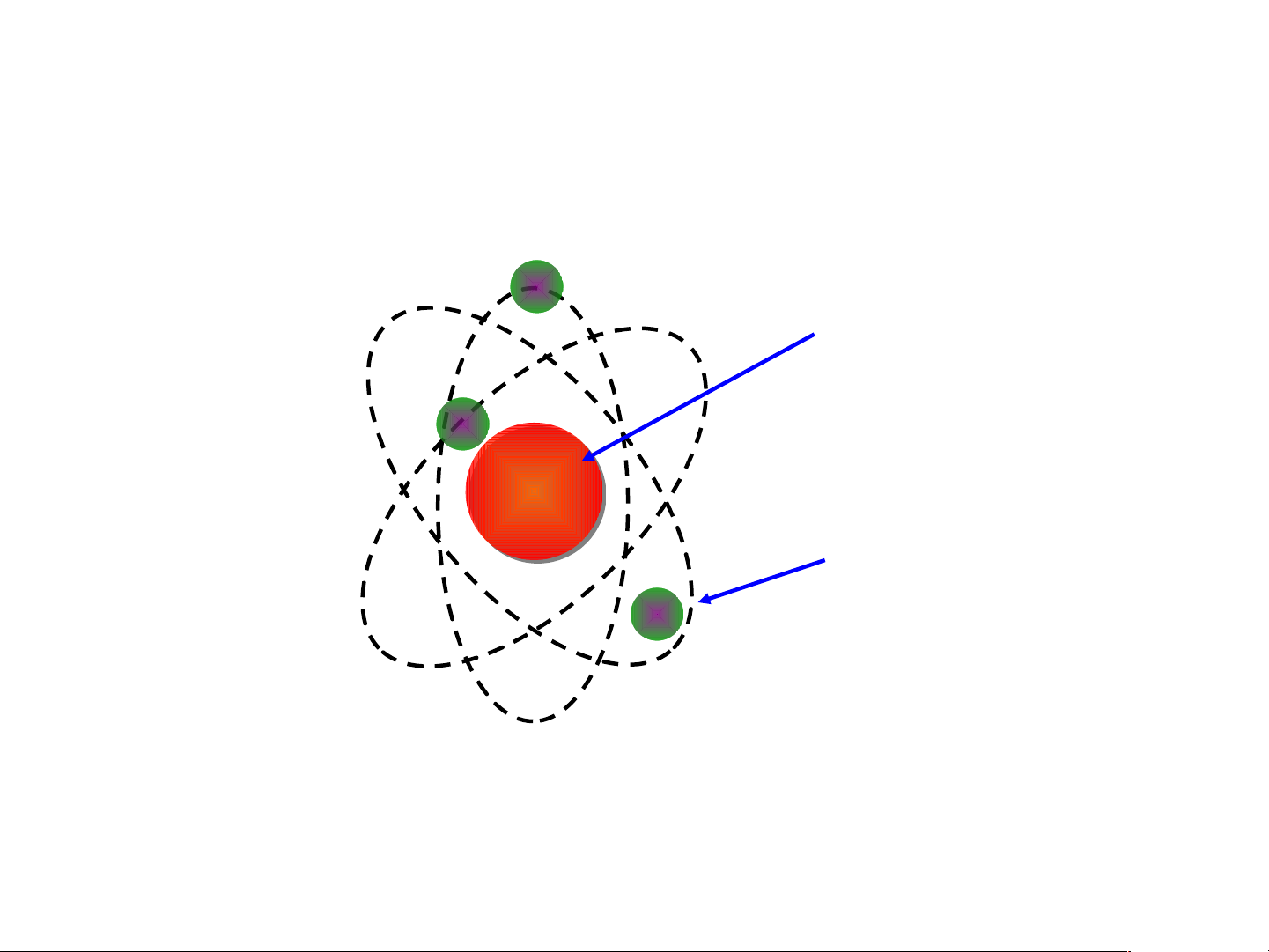
phần cấu tạo nên nguyên tử. E. Rutherford (1871 – 1937)
? Theo E.Rutheford cấu tạo nguyên tử gồm thành
phần nào? Thành phần đó mang điện tích gì? Hạt nhân mang điện tích dương Các electron mang điện tích âm
Mô hình đơn giản của nguyên tử - Hạt nhân - +++ Electron -
Mô phỏng cấu tạo nguyên tử oxygen 8+
? Các electron chuyển động như thế nào? Bài 2 NGUYÊN TỬ
II.Mô hình nguyên tử của Rơ-dơ-pho - Bo
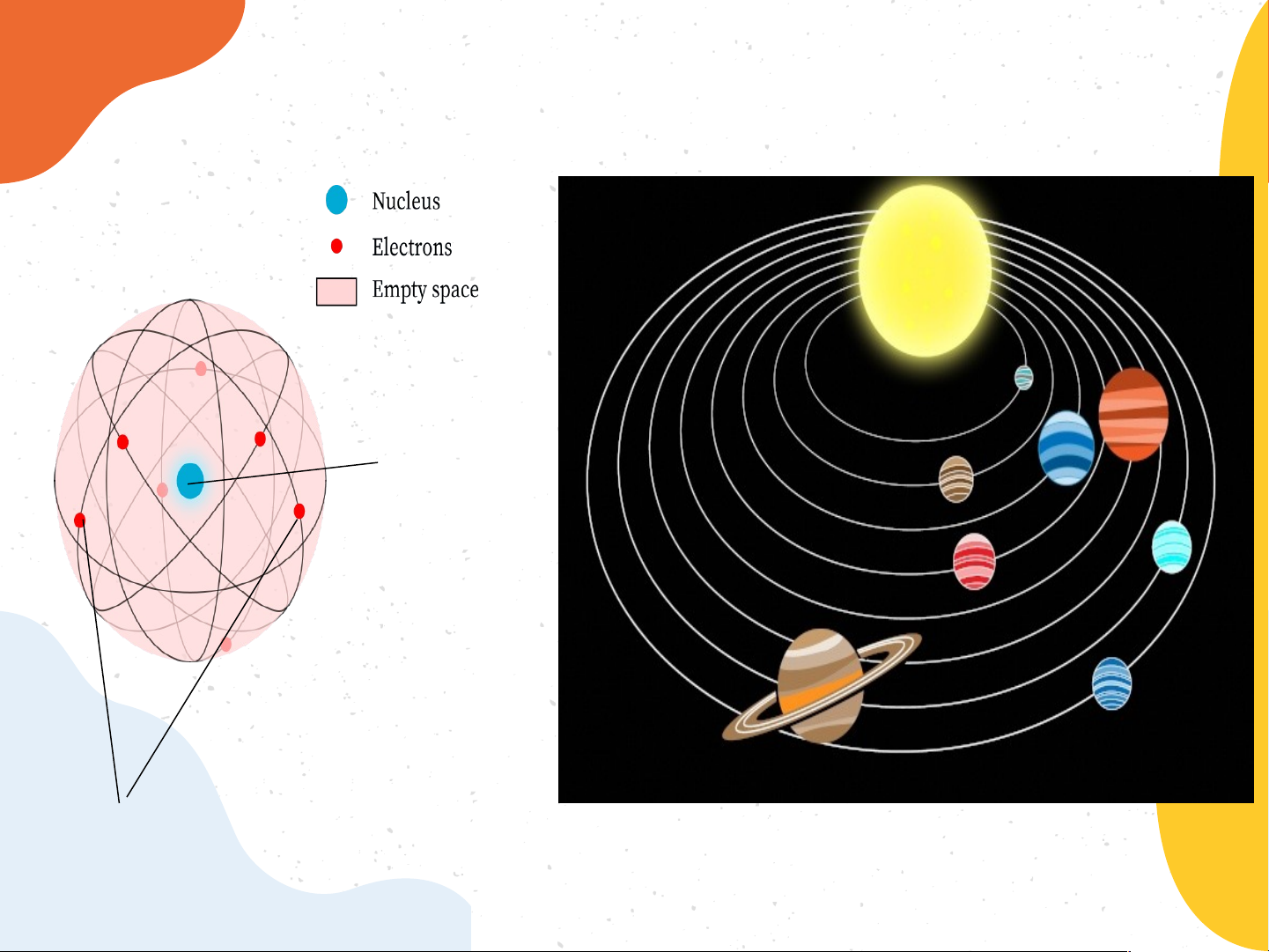
* Mô hình nguyên tử của E.Rutherford
- Nguyên tử có cấu tạo rỗng. - Cấu tạo nguyên tử:
+ Hạt nhân ở tâm mang điện tích dương;
+ Electron(e): ở lớp vỏ mang điện tích âm;
+ Electron chuyển động xung quanh hạt nhân như
các hành tinh quay quanh Mặt Trời.
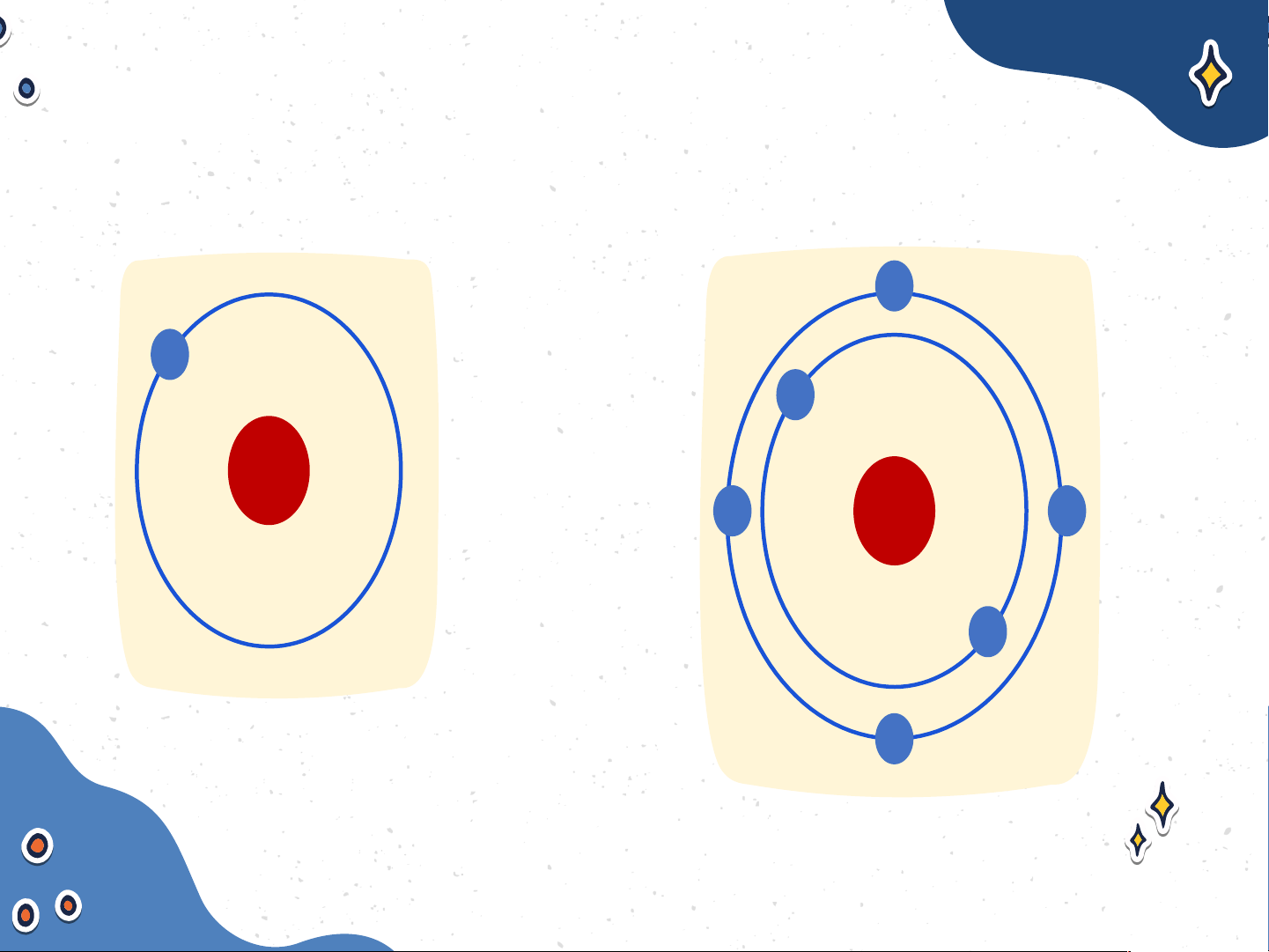
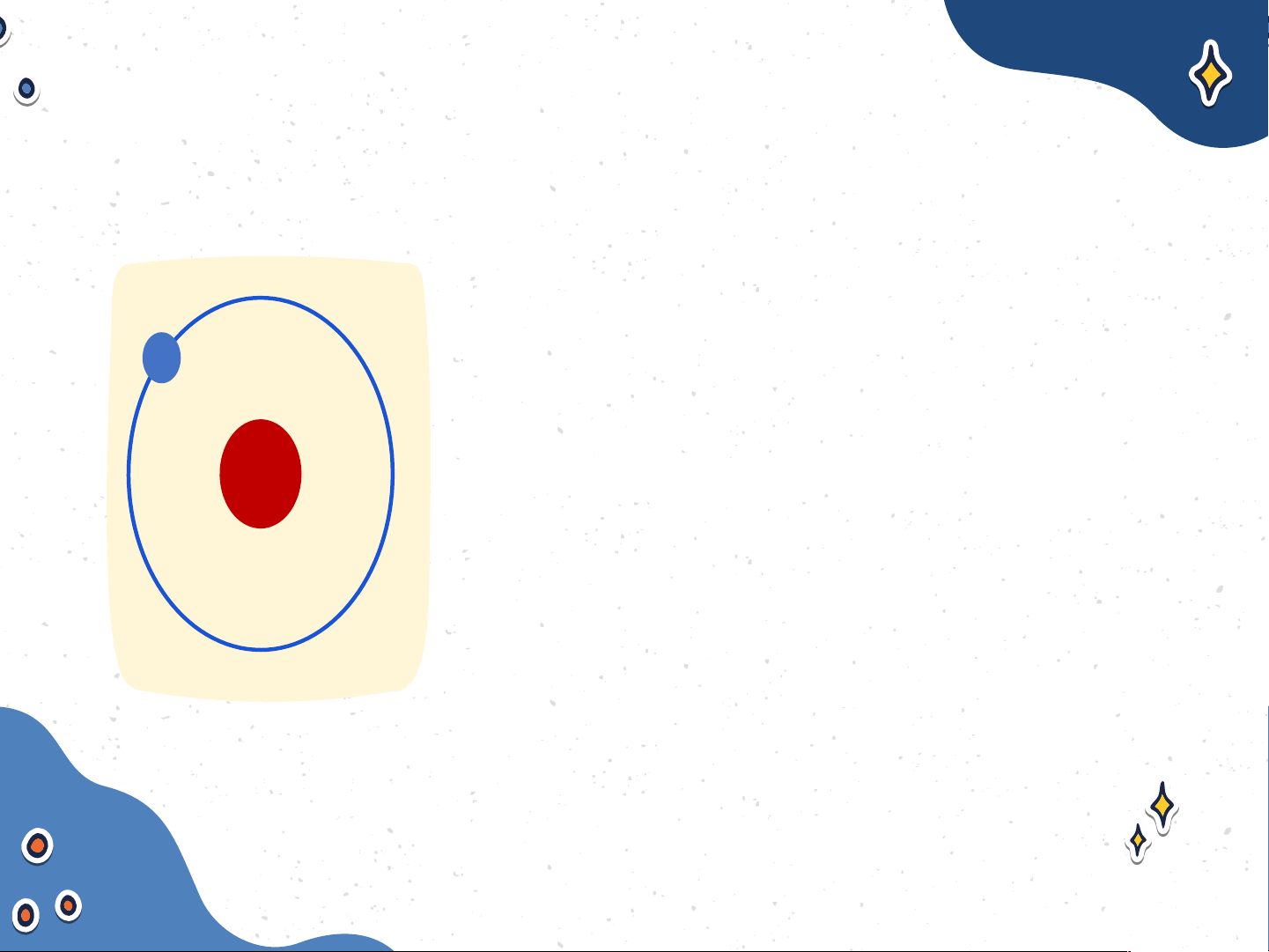
Mô tả cấu tạo nguyên tử
hydrogen và nguyên tử carbon Nguyên tử hydrogen Nguyên tử carbon Nguyên tử hydrogen gồm
hạt nhân ở tâm nguyên tử và
một electron ở lớp electron
thứ nhất của nguyên tử Nguyên tử hydrogen
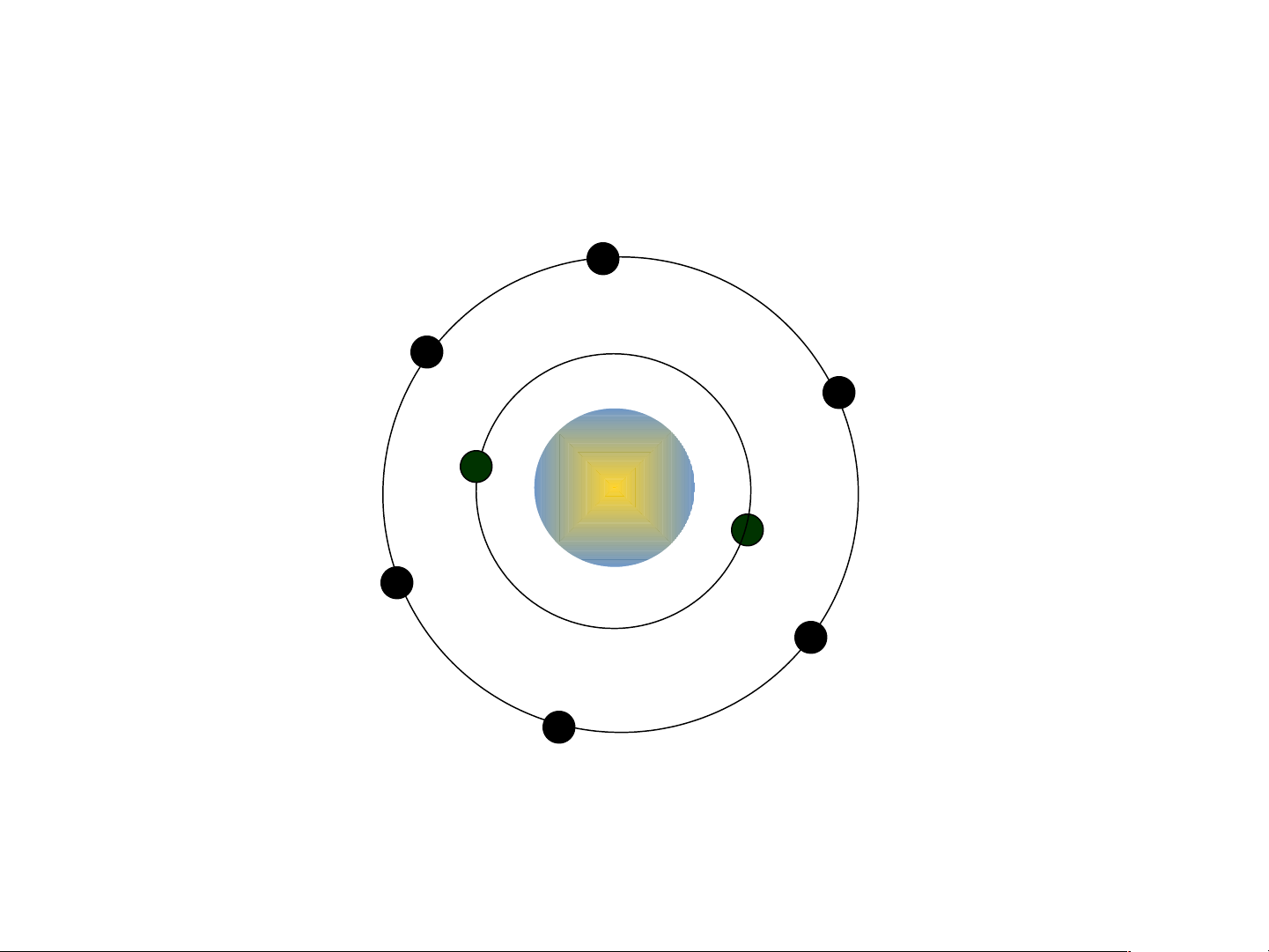
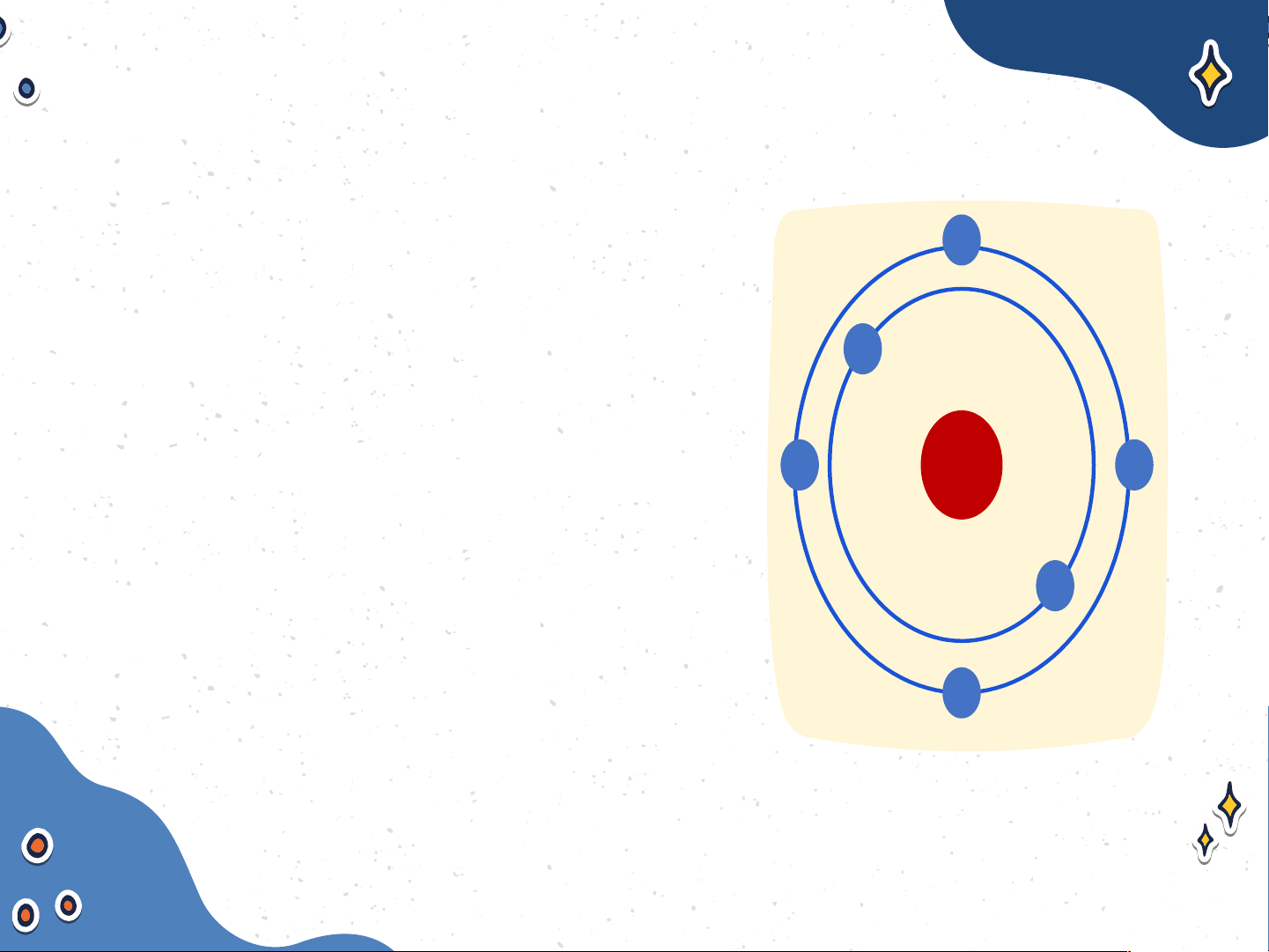
Nguyên tử carbon có hạt nhân
ở tâm nguyên tử và hai lớp
electron: lớp electron thứ nhất
có 2 electron và lớp electron thứ hai có 4 electron Nguyên tử carbon
Thảo luận nhóm (5’)
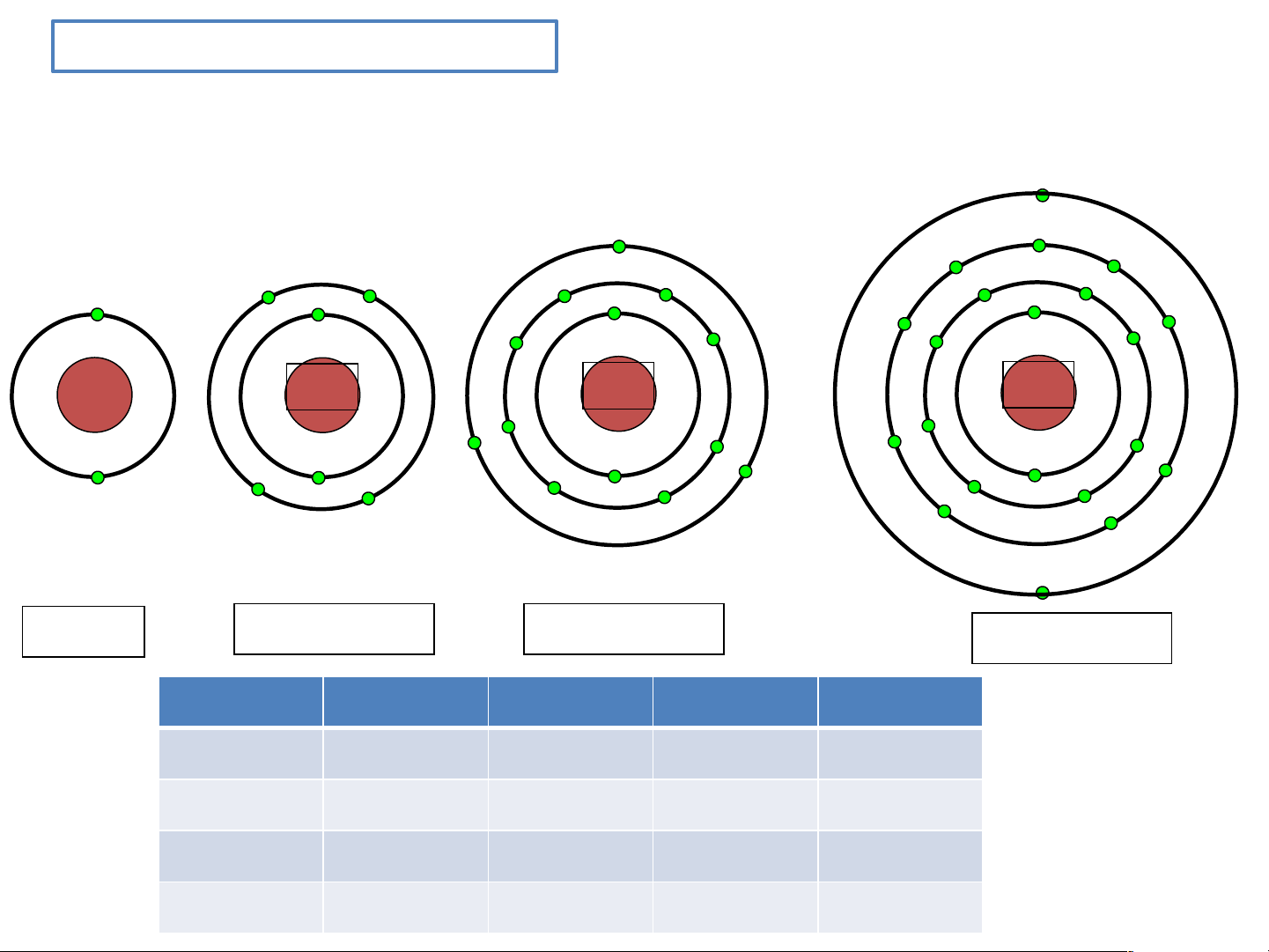
Cho biết sơ đồ một số nguyên tử theo N.Bohr sau:
Hãy chỉ ra: số e trong nguyên tử, số electron ở mỗi lớp của mỗi nguyên tử ? 2+ 6+ 13+ 20+ Helium Carbon Aluminium Calcium Helium Carbon
Aluminium Calcium Em có nhận xét gì Lớp 1 2e 2e 2e 2e về số e ở mỗi lớp? Elec tron ở lớp Lớp 2 4e 8e 8e nào bị hạt nhân Lớp 3 3e 8e hút mạnh nhất ?vì Lớp 4 2e sao? Bài 2 NGUYÊN TỬ
2. Mô hình nguyên tử của Rơ-dơ-pho - Bo
* Mô hình nguyên tử của Bo: Các electron chuyển
động xung quanh hạt nhân theo từng lớp khác nhau:
+ Lớp trong cùng có 2 electron, bị hạt nhân hút mạnh nhất.
+ Các lớp khác chứa tối đa 8 electron hoặc nhiều
hơn, bị hạt nhân hút yếu hơn.
BT1:Theo Rutherford – Bohr, nguyên tử có cấu tạo như thế nào? Trả lời:
Theo Rutherford – Bohr, nguyên tử gồm các electron được sắp
xếp thành từng lớp và chuyển động xung quanh hạt nhân theo quỹ
đạo giống như hành tinh trong hệ Mặt Trời.
Trong nguyên tử, các electron chuyển động rất nhanh xung quanh
hạt nhân và phân bố theo từng lớp với số lượng electron nhất định
trên mỗi lớp ở vỏ nguyên tử. Lớp đầu tiên gần sát hạt nhân chứa
tối đa 2 electron, lớp thứ hai chứa tối đa 8 electron,…
Các electron được sắp xếp vào các lớp theo thứ tự từ trong ra ngoài cho đến hết.
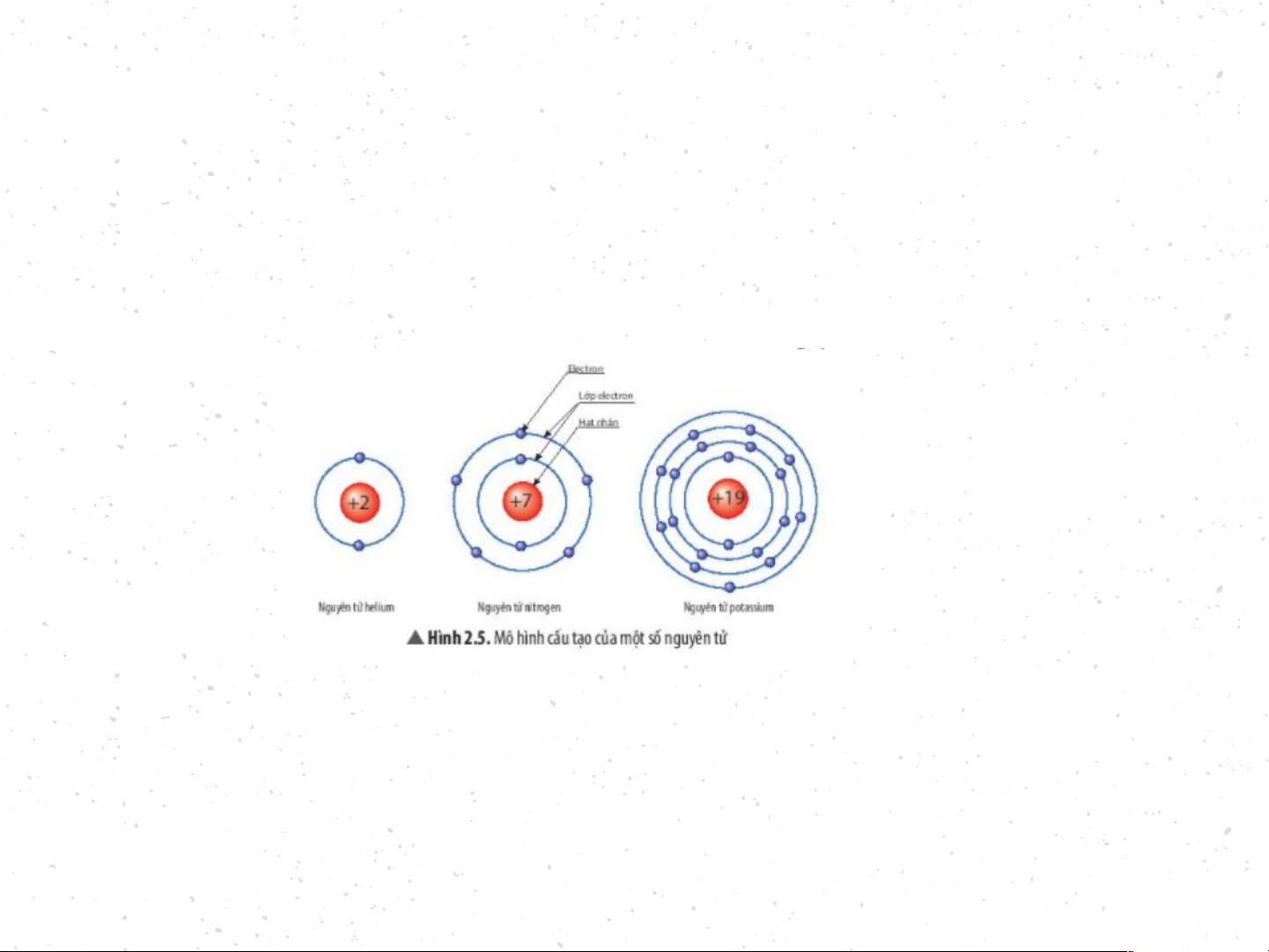
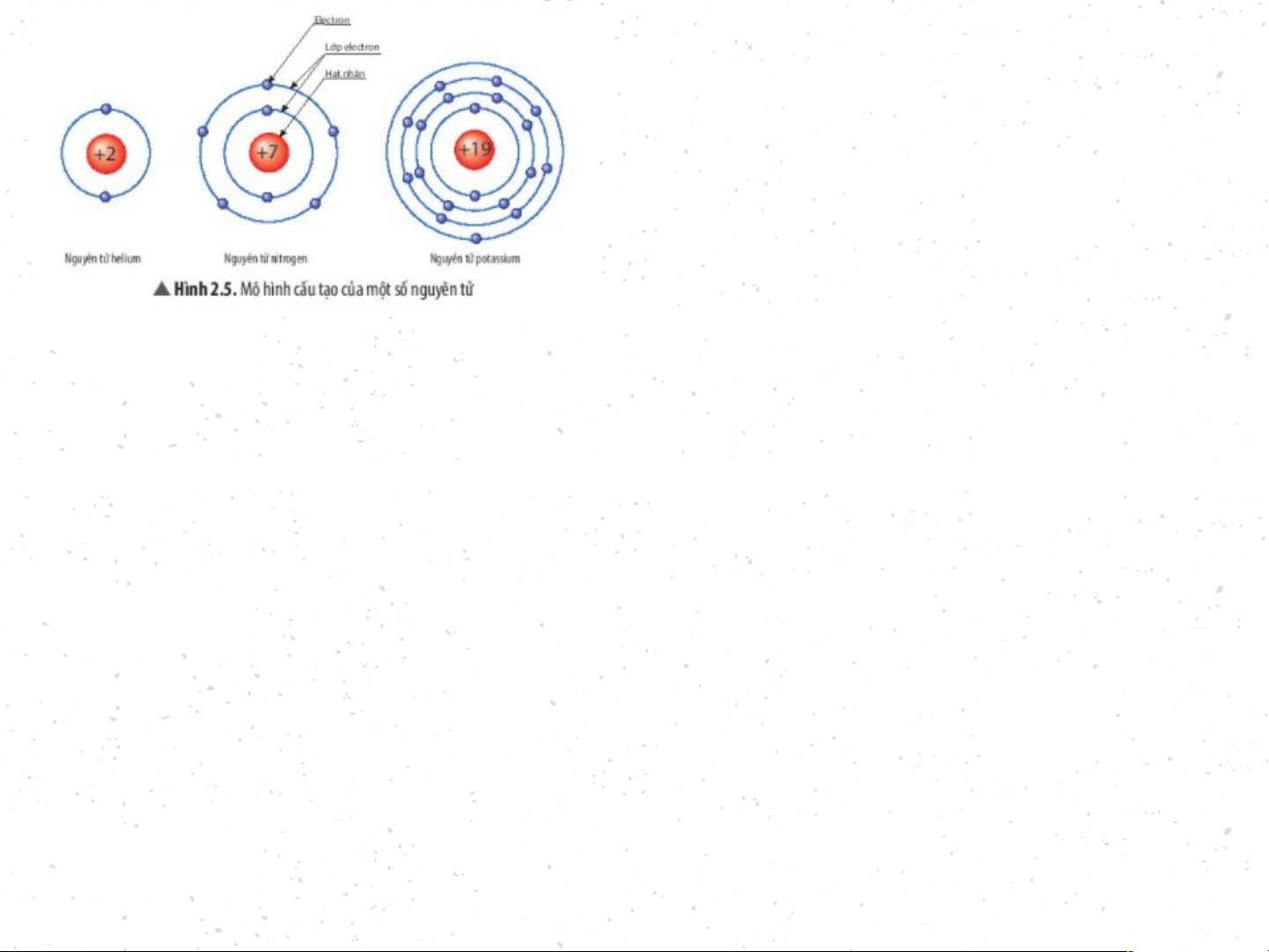
BT1:Quan sát Hình 2.5, hãy cho biết nguyên tử nitrogen và potassium có bao nhiêu
a) điện tích hạt nhân nguyên tử? b) lớp electron? c) electron trên mỗi lớp? Nguyên tử nitrogen có:
+ Điện tích hạt nhân nguyên tử là +7 + Có 2 lớp electron
+ Lớp thứ nhất có 2 electron. Lớp thứ 2 có 5 electron. - Nguyên tử potassium có:
+ Điện tích hạt nhân nguyên tử là +19 + Có 4 lớp electron
+ Lớp thứ nhất có 2 electron. Lớp thứ hai có 8 electron. Lớp thứ
ba có 8 electron. Lớp thứ tư có 1 electron Dặn Dò Tiết sau mỗi nhóm mang
+ Bìa cứng,kéo,giấy màu,hồ dán, các viên bi màu khác nhau.Bút màu,compa
=> Để tiết sau làm mô hình nguyên tử
Document Outline
- `
- Slide 2
- CHỦ ĐỀ :NGUYÊN TỬ ( Tiết 1)
- 02
- Quan niệm ban đầu về nguyên tử
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- 02
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Dặn Dò




