






















Preview text:
KHỞI ĐỘNG
- Mỗi học sinh chuẩn bi giấy ghi đáp án đúng cho
mỗi câu hỏi trong vòng 10 giây suy nghĩ. Khi
chuông reo các bạn giơ đáp án.
-Học sinh nào có đáp án sai sẽ dừng cuộc chơi và
ngồi xuống thành khán giả.
- Người chiến thắng là người trả lời đúng nhiều câu hỏi nhất.
Đơn chất là những chất được tạo nên từ? Một nguyên tố hóa học Hai nguyên tố hóa học Một nguyên tử
Hợp chất là những chất được tạo nên từ
Một nguyên tố hóa học
Hai nguyên tố hóa học trở lên Hai nguyên tử trở lên
Dãy các chất thuộc loại hợp chất là? MgO, O HF. 2, HCl, NH MgO 3, H S, CO O 2 2, 3
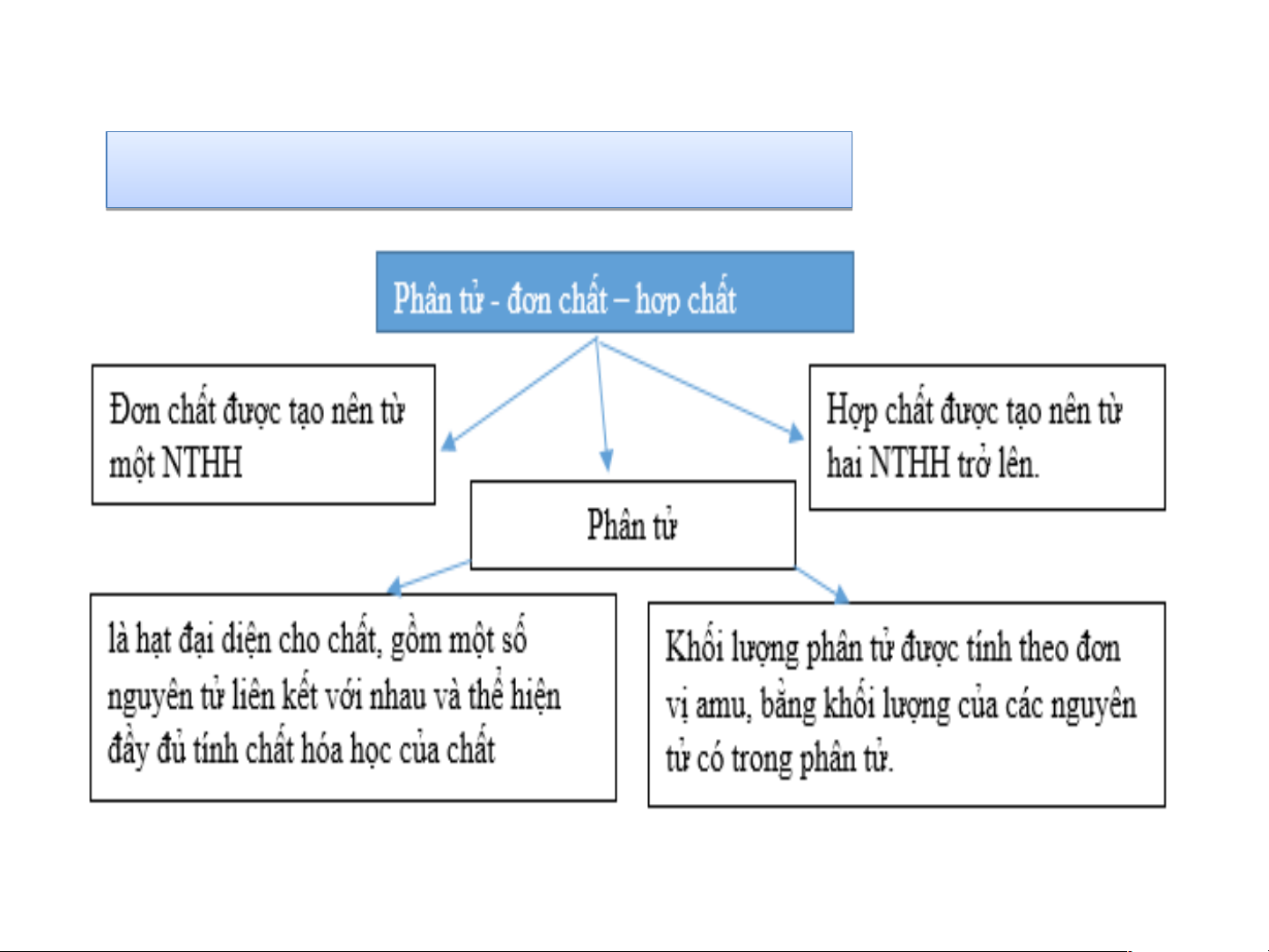
Hạt đại diện cho chất, gồm một số
nguyên tử liên kết với nhau và thể hiện
đầy đủ tính chất hoá học của chất được gọi là Nguyên tố Phân tử Nguyên tử
Khối lượng phân tử nước gồm
2 nguyên tử H và 1 nguyên tử O là bao nhiêu? 16 amu 18 amu 20 amu
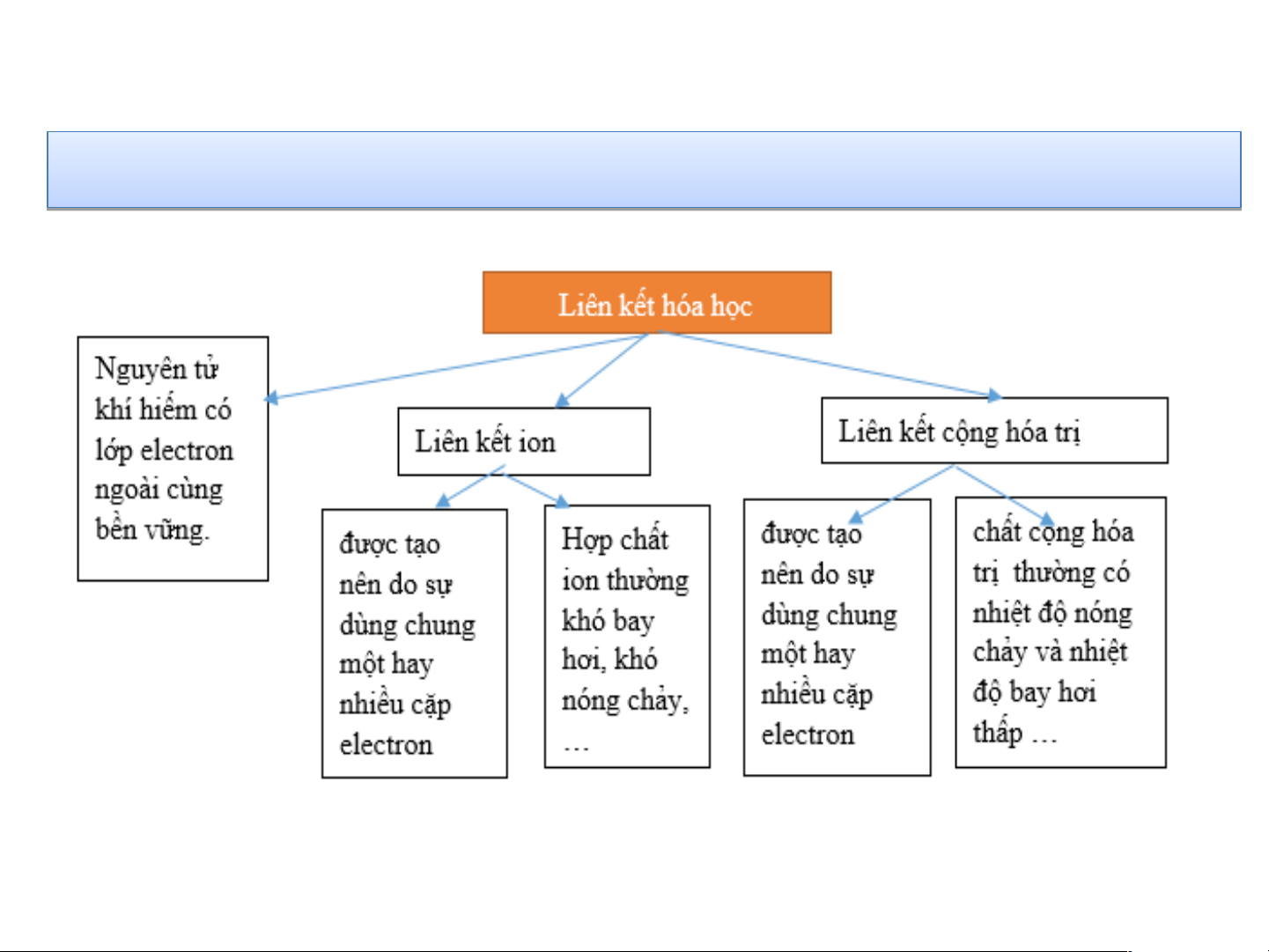
Liên kết ion là liên kết được hình thành
do các nguyên tử nhường và nhận electron
do sự dùng chung một hay nhiều cặp electron
bởi lực hút giữa các ion mang điện tích trái dấu
Liên kết cộng hoá trị được tạo nên
do sự dùng chung một hay nhiều cặp electron
do các nguyên tử nhận electron
bởi lực hút giữa các ion mang điện tích trái dấu
Phân tử chất nào có liên kết ion? Nước ( H O) 2
Đường ăn ( C H O ) 12 22 11 Muối ăn (NaCl)
Trong phân tử Nitrogen, khi hai nguyên tử
Nitrogen liên kết với nhau, mỗi nguyên tử
N đã góp chung bao nhiêu electron? 1 electron 2 electron 3 electron
Nguyên tử trung hòa về điện, khi nguyên tử
nhường electron nó trở thành phần tử mang điện gọi là anion ion dương ion âm Chúc mừng TIẾT TIẾT 26 ÔN TẬP ÔN GIỮA KÌ GIỮA 2 14
TIẾT 26: ÔN TẬP GIỮA KÌ 2 I. K . I K ẾN T HỨ H C CẦ C N N HỚ H II I . I BÀ B I I T Ậ T P Khái h n iệm L iên i k ết thóa h a ọc -Tí T nh n được đ kh k ố h i ố - Đơ Đ n c n hất. h Liên k n ế k t ion lượng p n h g p ân h t ân ử . ử - Hợp c ợp hất h . Liên k n ế k t cộng ộn -P - h P ân h ân bi b ệ i t ệ đượ đ c c đơ đ n n - Ph P ân h t ân ử hóa t h rị chấ h t ấ và v hợ h p p chất h . ất -Xác X đị đ nh n đ h ược đ sự hì h nh n th h àn à h l h iên k n ết hóa h h ọ óa h c tron r g một on số chất. h
I. KIẾN THỨC CẦN NHỚ 1. Phân tử - đơ ử n chất – hợp ợ chất 2. Liên kết hóa học h II. Bài tập HOẠT ĐỘNG NHÓM
Bài 1: Cho biết đâu là đơn chất, hợp chất ? Tính khối lượng phân tửC Á C C Á củaH C PH P các  c N Âh C Nất H CsaIA u: N A H N IỆM ỆM VỤ V Ụ TR O TR NG N NH N ÓM
a/ Copper sulfate biết mỗi phân tử gồm 1 nguyên tử Cu,
1 nguyên tử S và 4 nguyên tử O 1. Phân loại
b/ Oxygen biết mỗi phân tử gồm 2 nguyên tử O
2. Tìm khối lượng nguyên tử
c/ Muối ăn biết mỗi phân tử gồm 1 nguyên tử Na và 1 3. Bấm máy tính nguyên t 4 ử . Gh
Cl i kết quả và đơn vị d/ K 5. Báo hí amonia c biáo ết / đánh giá
mỗi phân tử gồm 1 nguyên tử N và 3 nguyên tử H. ĐÁP ÁN
a/ Copper sulfate là hợp chất. 1 đ
Khối lượng phân tử =64+32+ 16.4=160 (amu) 1,5đ
b/ Oxygen: là đơn chất 1 đ
Khối lượng phân tử = 16.2 = 32 (amu) 1,5 đ
c/ Muối ăn là hợp chất. 1 đ
Khối lượng phân tử = 23+35,5 = 58,5 (amu) 1,5 đ
d/ Khí amonia là hợp chất 1 đ
Khối lượng phân tử = 14 + 1.3 = 17 (amu) 1,5 đ Bài 2
Hãy mô tả sự hình thành liên kết trong các
phân tử hydrogen và magnesium oxide.
• Thảo luận nhóm 2 phút.
• Đại điện lên báo cáo, mô tả theo hình.
Nhóm lẻ. Mô tả sự hình thành phân tử hydrogen Cặp e dùng H H chung H +1 H +1 H +1 H+1
Nhóm chẵn. Mô tả sự hình thành phân tử magnesium oxide
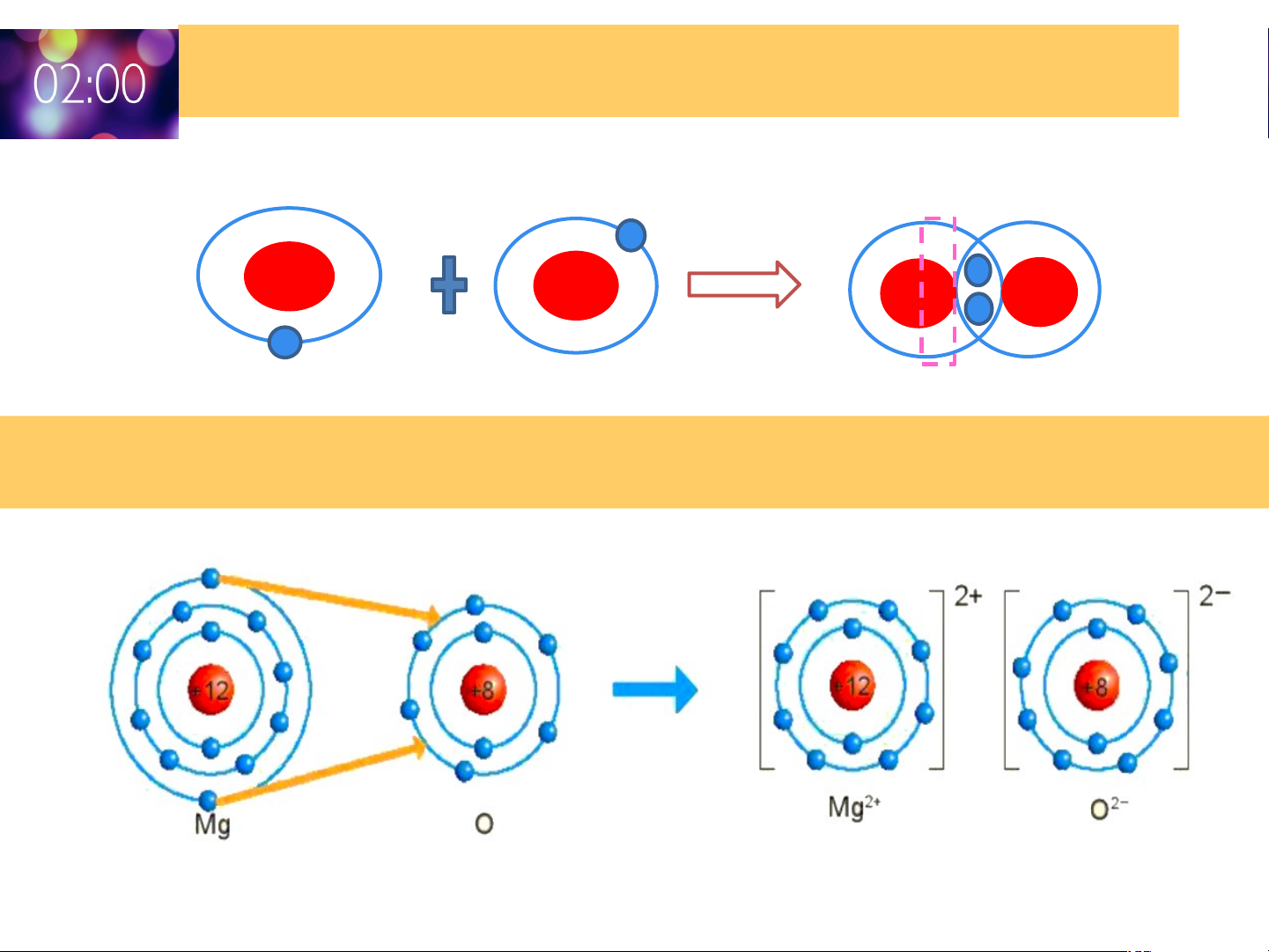
Mô tả sự hình thành liên kết cộng hóa trị trong phân tử khí hydrogen?
Sự hình thành liên kết cộng hoá trị trong
phân tử H : Mỗi nguyên tử H có 1 electron ở 2
lớp ngoài cùng. Trong phân tử H , mỗi nguyên 2
tử H góp 1 electron ở lớp ngoài cùng của nó
tạo thành 1 cặp electron dùng chung. Như vậy
mỗi nguyên tử H đều có 2 electron lớp ngoài
cùng giống khí hiếm Helium
Mô tả sự hình thành liên kết ion trong phân tử magnesium oxide?
Khi hình thành phân tử magnesium oxide đã có sự
nhường và nhận electron:
Nguyên tử Mg nhường 2 electron ở lớp ngoài cùng
cho nguyên tử O để tạo ion dương Mg2+ có vỏ bền
vững như nguyên tử khí hiếm Ne.
Nguyên tử O nhận 2 electron vào lớp ngoài cùng
của nó tạo thành ion âm O2- có vỏ giống vỏ nguyên tử khí hiếm Ne.
Hai ion được tạo thành mang điện tích trái dấu hút
nhau để hình thành liên kết ion trong phân tử.
Bài 3: Vận dụng khái niệm liên kết hóa học để giải thích:
Vì sao trong tự nhiên, muối ăn ở trạng
thái rắn, khó nóng chảy, khó bay hơi, còn
đường ăn, nước đá ở thể rắn dễ nóng chảy
và nước ở thể lỏng dễ bay hơi? Bài 3:
Muối ăn là hợp chất ion => khó bay hơi, khó nóng chảy.
- Đường ăn và nước đá là hợp chất cộng hóa trị
=>có nhiệt độ nóng chảy và nhiệt độ sôi thấp. Hoạt động nối tiếp
ÔN LẠI KIẾN THỨC ĐÃ HỌC , CHUẨN
BỊ KIỂM TRA GIỮA KÌ 2.
Xin chân thành cảm ơn
Document Outline
- Slide 1
- KHỞI ĐỘNG
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Bài 2
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29




