












Preview text:
CHỦ ĐỀ 1: NGUYÊN TỬ - NGUYÊN TỐ HOÁ HỌC –
SƠ LƯỢC VỀ BẢNG TUẦN HOÀN
CÁC NGUYỀN TỐ HOÁ HỌC
THẦY CÔ SCAN ĐỂ NHẬN TOÀN BỘ
BÀI GIẢNG MÔN KHTN 7 – Người dạy: Nguyễn Hoàng Sơn
Hoặc thầy cô copy đường dẫn này và dán vào
youtube:https://www.youtube.com/watch?
v=a91qU6tt0ak&list=PL4t7JCy7eX7nHukk
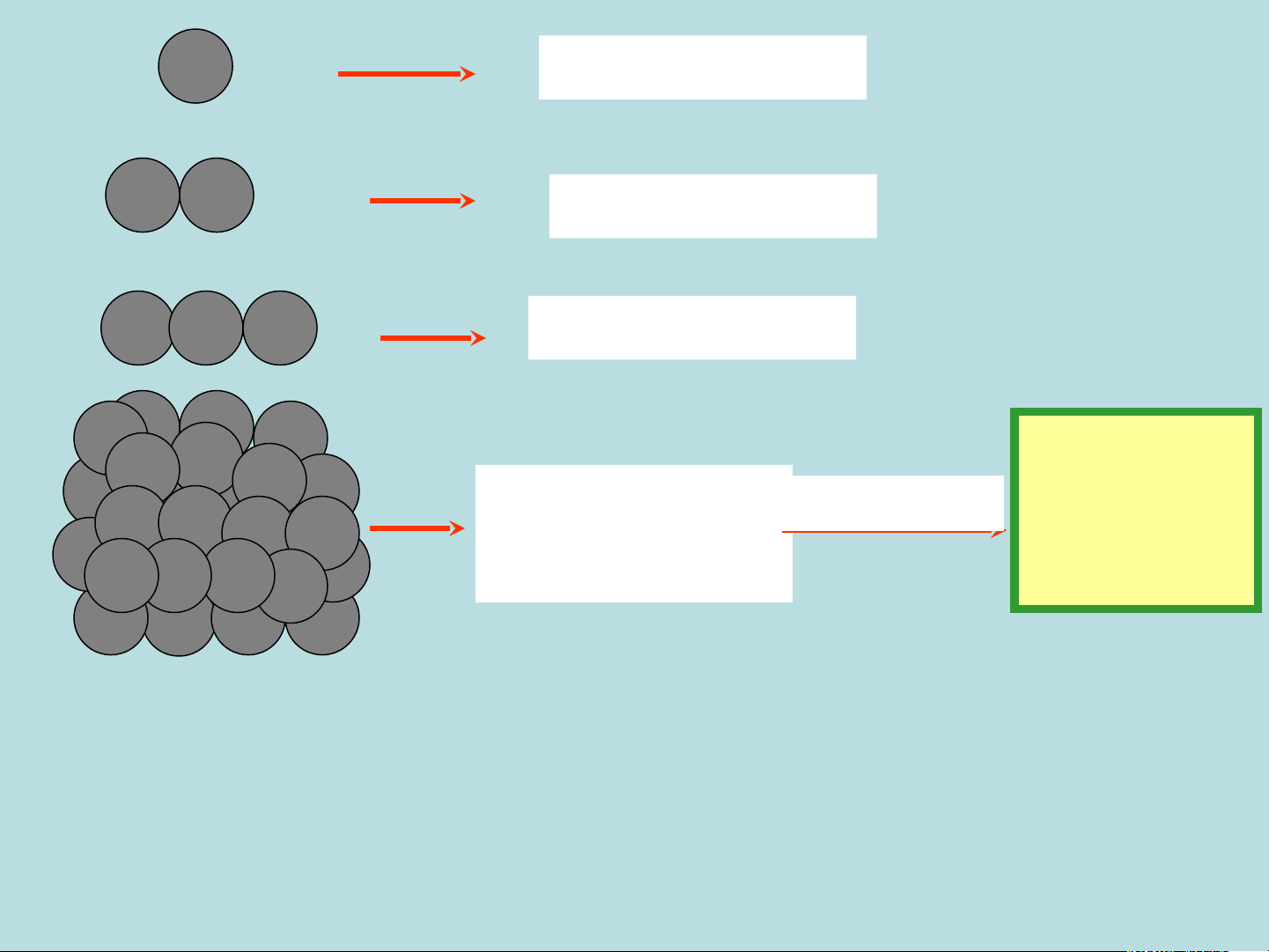
G7mkSeejLjQqlAzpL&index=9 Fe 1 nguyên tử sắt Fe Fe 2 nguyên tử sắt Fe Fe Fe 3 nguyên tử sắt e F Fe Fe Fe Fe Fe Fe Fe Tập hợp những Nguyên tố
Được gọi là Fe Fe Fe Fe Fe nguyên tử sắt Sắt Fe Fe Fe Fe Fe Fe Fe Fe
3 vạn tỉ tỉ nguyên tử oxi 1 gam nước
Các nguyên tử cùng loại
6 vạn tỉ tỉ nguyên tử hidro
Các nguyên tử cùng loại
Tập hợp các nguyên Nguyên tố hóa tử cùng loại học
BÀI 3: NGUYÊN TỐ HÓA HỌC
I- Nguyên tố hoá học là gì?
BÀI 3: NGUYÊN TỐ HÓA HỌC
I- Nguyên tố hoá học là gì? 1. Khái niệm:
Quan sát tranh ảnh về mẫu Than chì và
Kim cương, kết hợp đọc thông tin SGK.
Cho biết thành phần cấu tạo nên Than chì và Kim cương?
=> Một viên kim cương hay một mẩu
than chì đều được tạo nên từ hàng tỉ
nguyên tử giống nhau.
Một viên kim cương hay một mẩu than chì đều được tạo
nên từ hàng tỉ nguyên tử giống nhau. Kim cương và Than chì
được tạo từ một nguyên tố hoá học là Carbon. Nguyên tố hoá
học là gì? Kí hiệu hóa học của chúng như thế nào?
BÀI 3: NGUYÊN TỐ HÓA HỌC
I- Nguyên tố hoá học là gì? 1. Khái niệm:
Giao nhiệm vụ học tập: - Chia HS lớp thành 4 nhóm
- Yêu cầu mỗi nhóm quan sát hình trong SGK
(hoặc dùng máy chiếu phóng to hình) và thảo
luận để trả lời câu hỏi
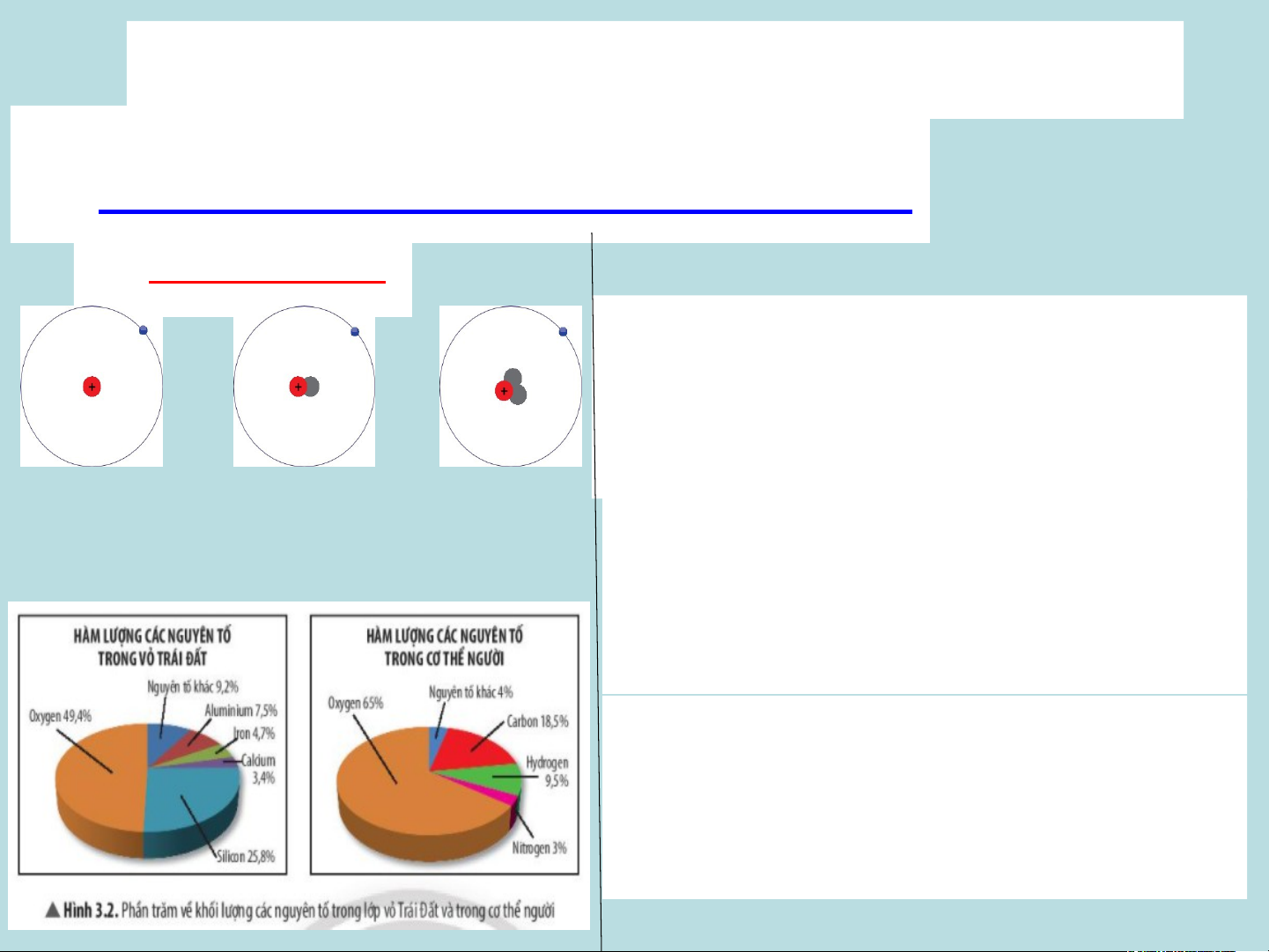
Hình 3.1: Mô hình cấu tạo *Quan sát Hình 3.1:
của 3 nguyên tử khác nhau
1. Cho biết sự khác nhau về câu tạo giữa 3
thuộc cùng nguyên tố nguyên tử hydrogen? hydrogen
2. Vì sao 3 nguyên tử trong Hình 3.1 lại thuộc
cùng một nguyên tố hoá học? *Quan sát Hình 3.2:
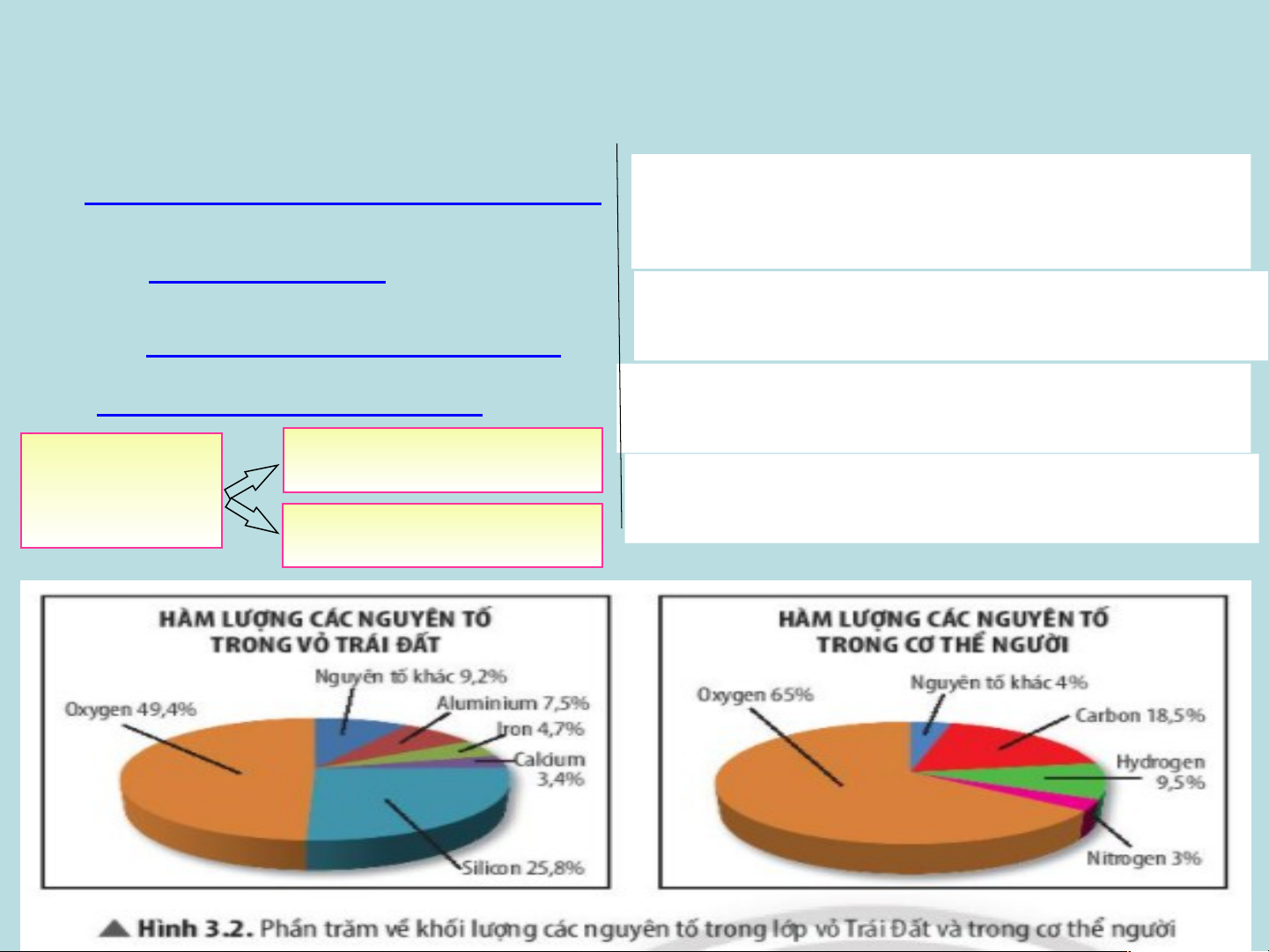
1. Nguyên tố nào chiếm hàm lượng cao nhất trong vỏ Trái Đất?
2. Nguyên tố nào chiếm tỉ lệ phần trăm lớn
nhất trong cơ thể người?
BÀI 3: NGUYÊN TỐ HÓA HỌC *Quan sát Hình 3.1:
I- Nguyên tố hoá học là gì? 1. Cho biết sự khác nhau về câu tạo giữa 3 nguyên tử hydrogen? 1. Khái niệm:
=> Khác nhau ở số neutron trong hạt nhân.
2. Vì sao 3 nguyên tử trong Hình 3.1 lại thuộc
- Nguyên tố hoá học là tập hợp cùng một nguyên tố hoá học?
của những nguyên tử cùng loại, => Vì cả 3 nguyên tử đều có cùng số proton trong hạt nhân.
có cùng số proton trong hạt
nhân. Hình 3.1: Mô hình cấu tạo
tập hợp của những
của 3 nguyên tử khác nhau
nguyên tử cùng loại
thuộc cùng nguyên tố hydrogen
Nguyên tố hoá học có cùng số proton trong hạt nhân.
Nguyên tố hoá học là gì?
BÀI 3: NGUYÊN TỐ HÓA HỌC
I- Nguyên tố hoá học là gì?
Các nguyên tử của cùng
một nguyên tố hoá học có 1. Khái niệm:
tính chất hoá học giống nhau hay không?
- Nguyên tố hoá học là tập hợp
của những nguyên tử cùng loại, Các nguyên tử thuộc cùng
có cùng số proton trong hạt nhân.
một nguyên tố hoá học có
cùng số p cùng số e nên
- Các nguyên tử của cùng một có tính chất hoá học giống
NTHH đều có tính chất hóa học nhau. Ví dụ giống nhau
Tập hợp tất cả các nguyên tử
- Số p là số đặc trưng của một
có số p = 8 đều là nguyên tố NTHH. oxi.
Các nguyên tử oxi đều có tính
chất hoá học giống nhau .
BÀI 3: NGUYÊN TỐ HÓA HỌC *Quan sát Hình 3.2:
I- Nguyên tố hoá học là gì? Nghiên cứu SGK: Cho biết số
1. Nguyên tố nào chiếm hàm lượng cao nhất 1. Khái niệm: trong l vỏ ượn Trái g c Đ ác ất
N?THH hiện nay?
=> Hàm lượng oxygen trong vỏ Trái Đất
2. Số lượng các nguyên
chiếm tỉ lệ cao nhất.
2. Nguyên tố nào chiếm tỉ lệ phần trăm lớn tổ hoá học hiện nay:
nhất trong cơ thể người? Đã có 118 98 NT tự nhiên
=> Nguyên tố oxygen chiếm tỉ lệ phần trăm lớn NTHH
nhất trong cơ thể người. 20 NT nhân tạo
BÀI 3: NGUYÊN TỐ HÓA HỌC
I- Nguyên tố hoá học là gì? Em có biết: 1. Khái niệm:
Có một thời, các nhà hoá học sử dụng nhiều
kí hiệu khác nhau để biểu diễn cho nguyên tử
2. Số lượng các nguyên
của các nguyên tố hoá học. Tuy nhiên, những
kí hiệu này lại rất rắc rối và không thống nhất
tổ hoá học hiện nay: giữa các nhà khoa học.
Do đó, để thuận tiện cho việc học tập và
nghiên cứu, IUPAC (*) đã thống nhất tên gọi
II - Kí hiệu hóa học:
và kí hiệu hoá học của các nguyên tố.
Vậy KÍ HIỆU HÓA HỌC của nguyên tố
như thế nào? Ta tiếp tục tìm hiểu
Bài 3: NGUYÊN TỐ HÓA HỌC
I. Nguyên tố hóa học là gì? 1. Định nghĩa:
2. Số lượng các nguyên tổ hoá học hiện nay:
II. Ký hiệu hóa học:
- Mỗi nguyên tố hóa học chỉ có 1 ký hiệu hóa học,
gồm có 1 hoặc 2 chữ cái.
- Cách viết ký hiệu hóa học
+ Chữ cái đầu tiên phải viết in hoa.
+ Chữ cái thứ 2 (nếu có) phải viết thường, bé hơn, thấp hơn. Ví dụ: Hidro: H (hát) Oxi: O (ô) Lưu huỳnh: S (ét) Flo: F (ép) Cacbon: C (xê) Photpho: P (pê) Sắt: Fe (ép - e) Canxi: Ca (xê - a) Clo: Cl (xê lờ) Đồng: Cu (xê - u) Nhôm: Al (a lờ) Chì: Pb (pê - bê)
+ Chữ cái đầu tiên phải viết in hoa.
+ Chữ cái thứ 2 (nếu có) phải viết thường, bé hơn, thấp hơn.
Một số nguyên tố hóa học thường gặp. STT KHHH Tên tiếng Việt Tên Latinh 1 Na Natri Natrium 2 Mg Magie Magnesium 3 Al Nhôm Aluminium 4 K Kali Kalium 5 Ca Canxi Calcium 6 Fe Sắt Ferrum Tiếng việt
(Có thể giống nhau Tiếng Latinh.
hoặc không giống nhau)
Mỗi nguyên tố được biểu diễn bằng bao nhiêu KHHH?
→ (Chỉ có 1 KHHH duy nhất)
Câu 2: Vì sao phải dùng kí hiệu hóa học để biểu diễn nguyên tố?
Vì tên các nguyên tố hóa học rất dài nên trong hóa
học người ta cần ngắn gọn → mỗi nguyên tố có
một kí hiệu hóa học (KHHH) riêng. VD:
Ta viết: H chỉ 1 nguyên tử Hiđro.
Ta viết: 2H chỉ 2 nguyên tử Hiđro.
Ta viết: 3Fe chỉ 3 nguyên tử Sắt.
Ta viết: 5N chỉ 5 nguyên tử Nitơ.
Ta viết: 2O chỉ 2 nguyên tử Oxi.
Ta viết: 4Na chỉ nguyên tử Natri. Số Nguyên Số Nguyên Tên nguyên tố KHHH Tên nguyên tố KHHH proton tử khối proton tử khối 1 Hiđro H 1 16 Lưu huỳnh "Sulfur" S 32 2 Heli He 4 17 Clo Cl 35,5 3 Liti Li 7 18 Agon Ar 39,9 4 Beri Be 9 19 Kali K 39 5 Bo B 11 20 Canxi Ca 40 6 Cacbon C 12 24 Crom Cr 52 7 Nitơ N 14 25 Mangan Mn 55 8 Oxi O 16 26 Sắt "Ferrum" Fe 56 9 Flo F 19 29 Đồng "Cuprus" Cu 64 10 Neon Ne 20 30 Kẽm "Zink" Zn 65 11 Natri Na 23 35 Brom Br 80 12 Magie Mg 24 47 Bạc "Argentium" Ag 108 Nhôm 13 "Alumen"/ Al 27 56 Bari Ba 137 "Aluminis" Thủy ngân 14 Silic 80 Hg 201 "Silics" Si 28 "Hydrargyrum" 15 Photpho "Phosphoros" P 31 82 Chì "Plumbum" Pb 207 LUYỆN TẬP:
1. Hoàn thành bảng sau bằng cách xác định các thông tin chưa biết. TÊN NGUYÊN TÔ Kí hiệu hóa học Hydrogen H Carbon C Aluminium AI Tên nguyên tố Kí hiệu hoá học Fluorine F Phosphorus P Argon Ar
2. Kí hiệu hoá hoc nào sau đây viết sai?
Nếu sai, hãy sửa ląi cho đúng: H, Li, NA, O, Ne, AL, CA, K, N. NA sửa lại thành: Na AL sửa lại thành: Al CA sửa lại thành: Ca.
3. Cho các nguyên tử được kí hiệu bởi các chữ
cái và số proton trong mỗi nguyên tử như sau: Nguyên X Y Z R E Q tử Số S 8 17 6 9 17 proton
Các nguyên tử thuộc cùng một nguyên tố hoá học là: A.X, Y. C. R, E. B. Z, Q. D. Y, E.
4. Kí hiệu hoá học của nguyên tố chlorine là A. CL. B. cl. C. cL. D. Cl.
5. Nguyên tử của nguyên tố R có khối lượng nặng gấp
14 lần nguyên tử hydrogen. Hãy cho biết:
- Nguyên tử R là nguyên tố nào?
- Số p, số e trong nguyên tử. Đáp số:
- R = 14 (đ.v.C) R là nguyên tố nitrogen (N).
- Số p là 7 số e là 7 (vì số p = số e).
6: Hãy điền những thông tin còn thiếu vào ô trống trong bảng sau: Tên Kí hiệu Tổng số số p số e số n nguyên tố hoá học hạt trong nguyên tử Sodium Na 34 11 11 12 Phosphorus P 46 15 15 16 Carbon C 18 6 6 6 Sulfur S 48 16 16 16 Bài tập 7:
a/ Các cách viết 2C, 5O, 3Ca lần lượt chỉ ý gì?
b/ Hãy dùng chữ số và kí hiệu hóa học diễn đạt
các ý sau: - Ba nguyên tử Nitrogen - Bảy nguyên tử Calcium - Bốn nguyên tử Sodium
Giải: a/ - 2C chỉ 2 nguyên tử Carbon
- 5O chỉ 5 nguyên tử Oxygen
- 3Ca chỉ 3 nguyên tử Calcium
b/ - Ba nguyên tử Nitrogen: 3 N
- Bẩy nguyên tử Calcium: 7 Ca
- Bốn nguyên tử Sodium: 4 Na
BÀI CA NGUYÊN TỬ KHỐI Hydrogen là 1. 27 Aluminium la lớn. 64 Copper nổi cáu. 12 cột Carbon.
Cạnh tôi Silicon 28 đây Bởi kém Zinc 65. Nitrogen 14 tròn.
31, 32 Phosphorus và Sulfur 80 . Bromine nằm. Oxygen trăng 16.
Khác người thật là tài. Xa Silver 108. Sodium hay láu táu Chlorine 35,5.
Barium buồn chán ngán, Nhảy tót lên 23. Potassium thích 39. 137 ít chi.
Khiến Magnesium gần nhà, Calcium tiếp 40.
Kém người ta còn gì,
Ngậm ngùi nhận 24. 55 Manganese cười. Mercury 201. Iron đây rồi 56
Còn tôi đi sau chót.
HƯỚNG DẪN VỀ NHÀ
- Bài 3.1; 3.2; 3.3 (SBT).
- Học thuộc KHHH, TÊN VÀ NGUYÊN TỬ
KHỐI của 20 số nguyên tố đầu tiên
- Xem trước bài 4: Sơ lược bảng tuần hoàn các NTHH
Document Outline
- CHỦ ĐỀ 1: NGUYÊN TỬ - NGUYÊN TỐ HOÁ HỌC – SƠ LƯỢC VỀ BẢNG TUẦN HOÀN CÁC NGUYỀN TỐ HOÁ HỌC
- PowerPoint Presentation
- Slide 3
- I- Nguyên tố hoá học là gì?
- Slide 5
- Slide 6
- => Khác nhau ở số neutron trong hạt nhân.
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23




