























Preview text:
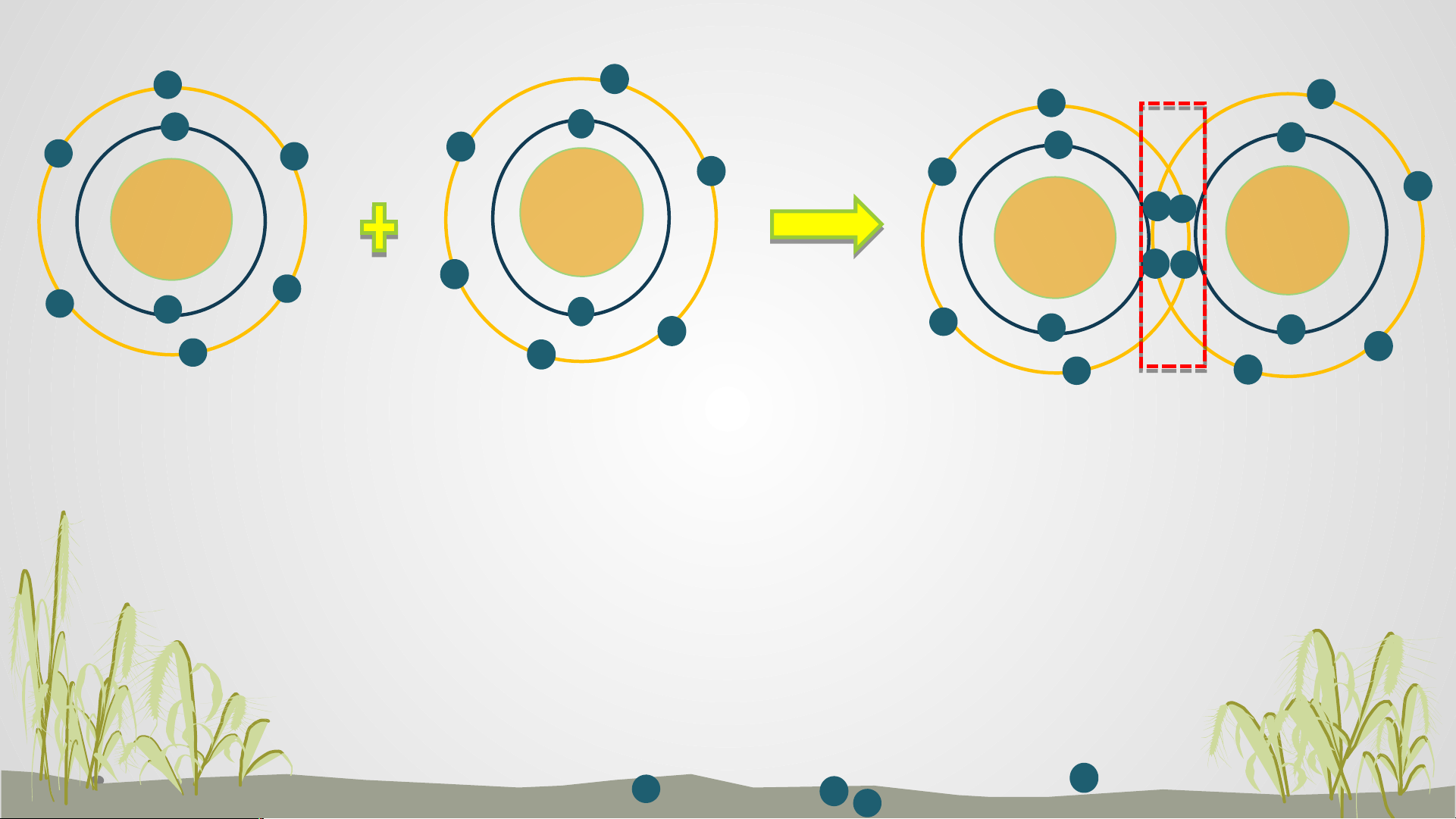
GV: HÀ VÂN ANH HOẠT ĐỘNG MỞ ĐẦU 8+ 8+ 8+ 8+ Oxygen khí oxygen
? Hãy mô tả sự hình thành liên kết cộng hóa trị trong phân tử khí oxygen
? Liên kết cộng hóa trị là gì CHƯƠNG 2
PHÂN TỬ - LIÊN KẾT HOÁ HỌC BÀI 6: GIỚI THIỆU VỀ
LIÊN KẾT HOÁ HỌC (TT)
Hình thành kiến thức HOẠT ĐỘNG
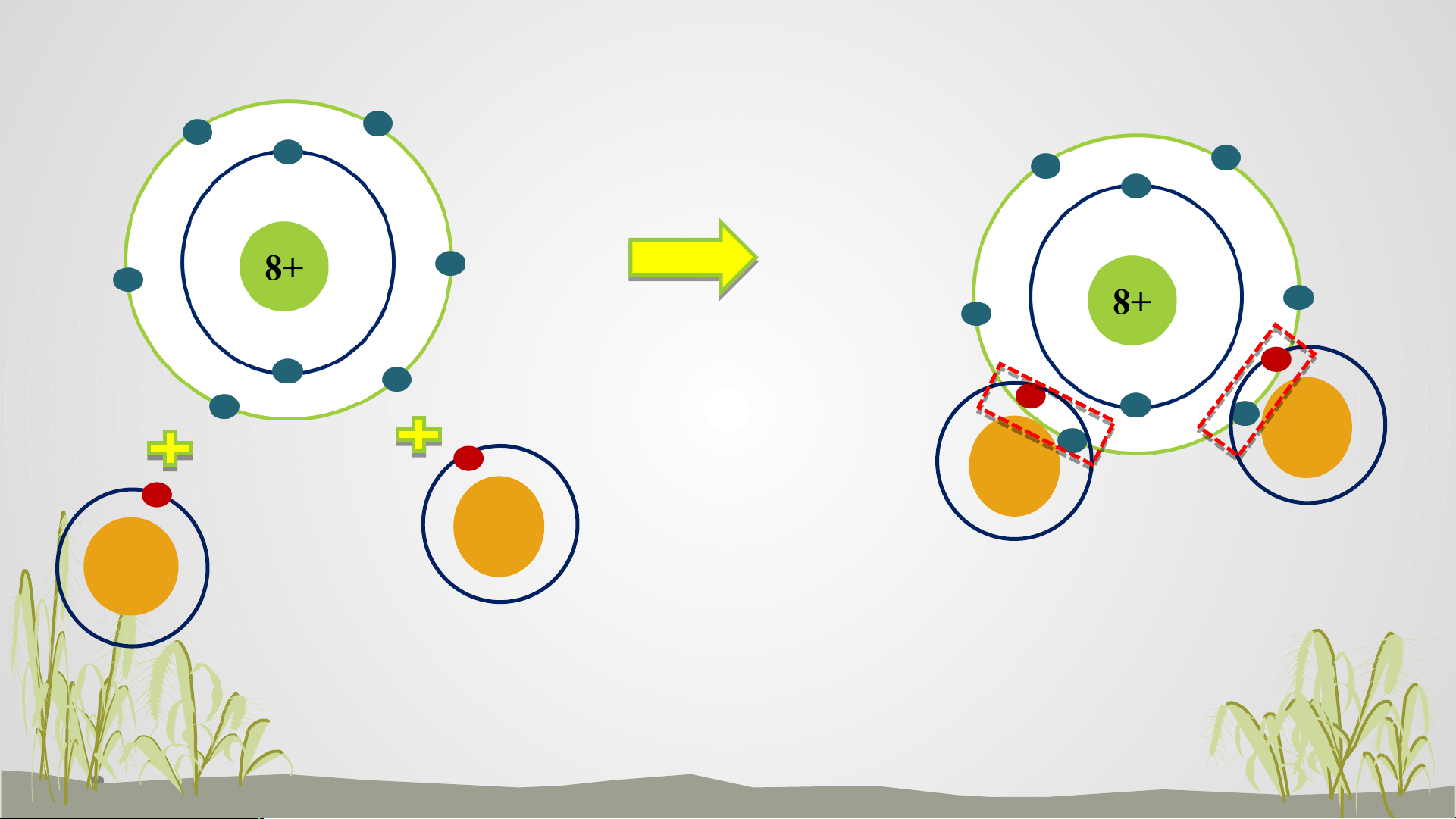
Tiết 27. Bài 6. GIỚI THIỆU VỀ LIÊN KẾT HOÁ HỌC Oxygen 1+ 1+ 1+ 1+ Hydrogen Nước
? Em hãy mô tả quá trình tạo thành liên kết cộng hóa
trị trong phân tử nước?
- Khi O kết hợp với H, nguyên tử O góp 2 electron, mỗi nguyên tử H góp
1 electron => Giữa nguyên tử O và nguyên tử H có 1 đôi electron dùng chung
- Hạt nhân nguyên tử O và H cùng hút đôi electron dùng chung, liên kết
với nhau tạo ra phân tử nước
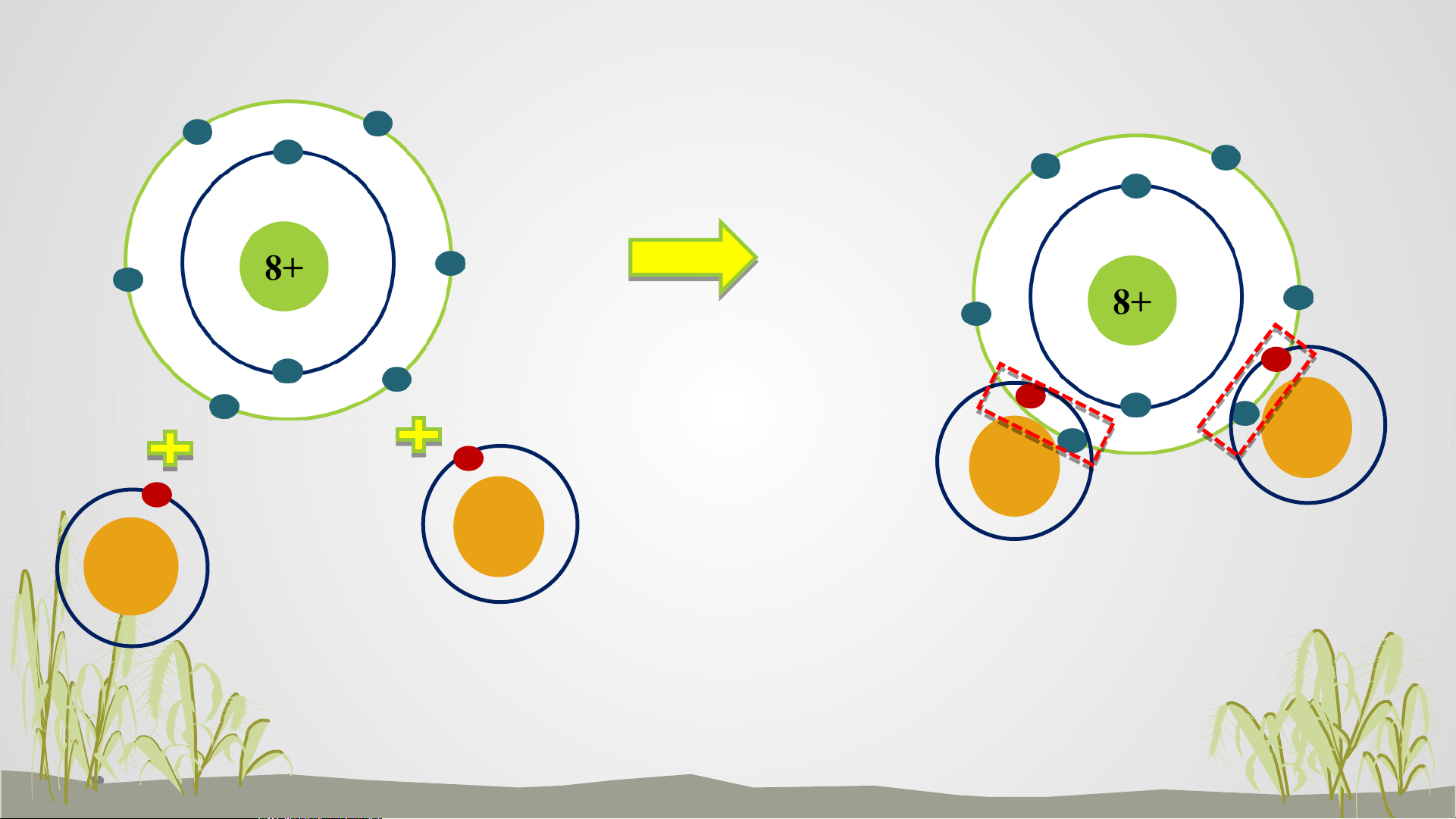
Tiết 27. Bài 6. GIỚI THIỆU VỀ LIÊN KẾT HOÁ HỌC Oxygen 1+ 1+ 1+ 1+ Hydrogen Nước
? Hãy cho biết số electron dùng chung của nguyên tử H và
nguyên tử O. Trong phân tử nước, số electron ở lớp ngoài cùng
của O và H là bao nhiêu và giống với khí hiếm nào?
- Số electron dùng chung của nguyên tử H và O là 4 - Trong phân tử nước:
+ Nguyên tử O có 8 electron lớp ngoài cùng => Giống khí hiếm Ne
+ Nguyên tử H có 2 electron lớp ngoài cùng => Giống khí hiếm He
Tiết 27. Bài 6. GIỚI THIỆU VỀ LIÊN KẾT HOÁ HỌC carbon dioxid 8+ 6+ 8+
? Hãy mô tả sự hình thành liên kết cộng hóa trị trong phân tử carbon dioxid
- Xét phân tử Carbon dioxide: gồm 1 nguyên tử C và 2 nguyên tử O =>
Liên kết cộng hóa trị. Khi C kết hợp với O, nguyên tử C góp 4
electron, mỗi nguyên tử O góp 2 electron
=> Giữa nguyên tử C và nguyên tử O có 2 cặp electron dùng chung 1+ 1+ Nitrogen 7+ 7+ 1+ 1+ 1+ 1+ Hydrogen ammonia
? Hãy mô tả sự hình thành liên kết cộng hóa
trị trong phân tử ammonia
Tiết 27. Bài 6. GIỚI THIỆU VỀ LIÊN KẾT HOÁ HỌC - Xét phân tử ammonia:
Nguyên tử H có 1 electron ở lớp ngoài cùng
Nguyên tử N có 5 electron ở lớp ngoài cùng
=> Nguyên tử H cần thêm 1 electron và N cần thêm 3 electron
để đạt cấu hình electron bền vững của khí hiếm
=> Khi 3 nguyên tử H và 1 nguyên tử N liên kết với nhau, mỗi
nguyên tử H góp 1 electron và nguyên tử N góp ra 3 electron để
tạo ra 3 đôi electron dùng chung
Tiết 27. Bài 6. GIỚI THIỆU VỀ LIÊN KẾT HOÁ HỌC
* Các chất chỉ ch a ứ liên k t ế hóa tr ị đư c ợ g i là c ọ h t c ấ n ộ g hóa trị VD: khí oxygen, nư c ớ , khí amonia,
hydrogen chloride, methane, nitrogen oxide - Ch t ấ c n ộ g hóa tr : t ị ồn t i ạ c ở 3 t ả h ể trong đi u k ề i n ệ thư n ờ g, có nhi t ệ đ sô ộ i và nhi t ệ đ n ộ óng ch y ả th p ấ , không d n ẫ đi n ệ Luyện tập HOẠT ĐỘNG
Tiết 27. Bài 6. GIỚI THIỆU VỀ LIÊN KẾT HOÁ HỌC
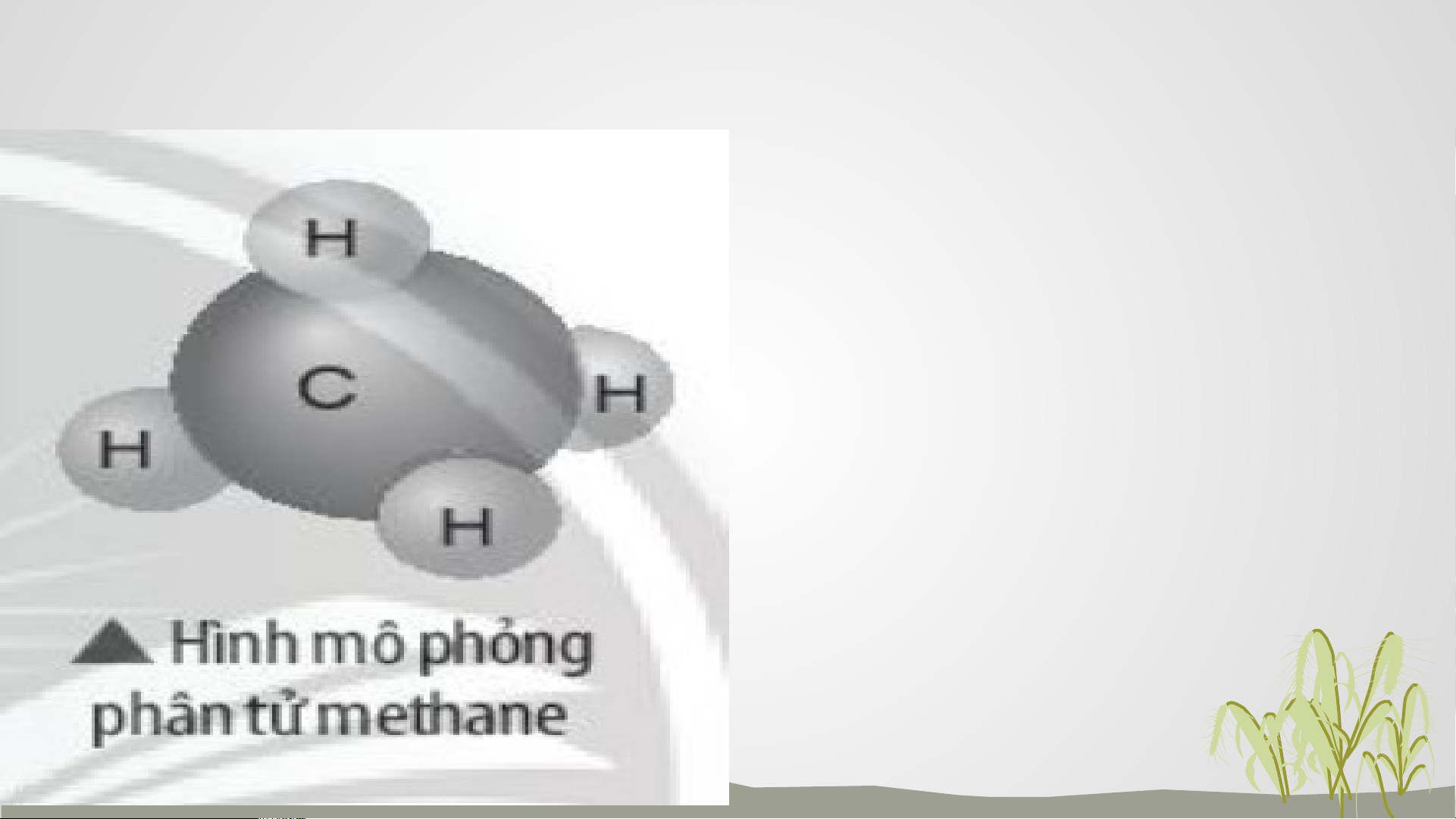
Câu 1: Khí methane là thành phần
chính của khí thiên nhiên và khí mỏ
dầu. Khí này còn được tạo ra từ hầm
biogas. Methane là nguồn nhiên liệu
quan trọng trong đời sống và có
nhiều ứng dụng trong công nghiệp.
Em hãy vẽ sơ đồ hình thành liên kết
trong phân tử methane và liệt kê một
số ứng dụng của nó thông qua tìm
hiểu trên sách báo, internet… 1+ 1+ 1+ 1+ 6+ Carbon 6+ 1+ 1+ 1+ 1+ Hydrogen Khí methane
Tiết 27. Bài 6. GIỚI THIỆU VỀ LIÊN KẾT HOÁ HỌC
Câu 1: - Nguyên tử H có 1 electron ở lớp ngoài cùng
- Nguyên tử C có 4 electron ở lớp ngoài cùng
=> Nguyên tử H cần thêm 1 electron và N cần thêm 4 electron
để đạt cấu hình electron bền vững của khí hiếm
=> Khi 4 nguyên tử H và 1 nguyên tử C liên kết với nhau, mỗi
nguyên tử H góp 1 electron và nguyên tử C góp ra 4 electron
để tạo ra 4 đôi electron dùng chung
Tiết 27. Bài 6. GIỚI THIỆU VỀ LIÊN KẾT HOÁ HỌC Câu 2: Khói c a nú ủ i l a n ử g m ầ phun trào t d ừ ư i ớ bi n ể có ch a ứ m t ộ s c ố hất nh : ư h i ơ nư c ớ , sodium chloride, potassium
chloride, carbon dioxide, sulfur dioxide. a) Hãy cho bi t ế ch t ấ nào là h p ợ chất ion, ch t ấ nào là h p ợ ch t ấ c n ộ g hóa trị b) Nguyên t ử c a n ủ guyên t ố nào trong các ch t ấ trên có s ố electron ở l p ớ ngoài cùng nhi u ề nhất Câu 2: a) - H i ơ nư c ớ : gồm 2 nguyên t l
ố à H (phi kim) và O (phi kim) => Chất c n ộ g hóa trị - Sodium chloride: g m ồ 2 nguyên t ố là Na (kim lo i ạ ) và Cl (phi kim) => Ch t ấ ion - Potassium chloride: g m ồ 2 nguyên t ố là K (kim lo i ạ ) và Cl (phi kim) => Ch t ấ ion - Carbon dioxide: g m ồ 2 nguyên t
ố là C (phi kim) và O (phi kim) => Chất c n ộ g hóa trị - Sulfur dioxide: g m ồ 2 nguyên t l
ố à S (phi kim) và O (phi kim) => Chất c n ộ g hóa trị
b) Các nguyên tố xuất hiện trong các chất trên là: H, O, Na, Cl, K, C, S
+ Nguyên tử H ở nhóm IA => Có 1 electron ở lớp ngoài cùng
+ Nguyên tử O ở nhóm VIA => Có 6 electron ở lớp ngoài cùng
+ Nguyên tử Na ở nhóm IA => Có 1 electron ở lớp ngoài cùng
+ Nguyên tử Cl ở nhóm VIIA => Có 7 electron ở lớp ngoài cùng
+ Nguyên tử K ở nhóm IA => Có 1 electron ở lớp ngoài cùng
+ Nguyên tử C ở nhóm IVA => Có 4 electron ở lớp ngoài cùng
+ Nguyên tử S ở nhóm VIA => Có 6 electron ở lớp ngoài cùng
=> Nguyên tử của nguyên tố Chlorine có số electron ở lớp ngoài cùng nhiều nhất HOẠT VẬN DỤNG ĐỘNG
TRÒ CHƠI : THỬ TÀI HIỂU BIẾT
Câu hỏi : Vận dụng khái niệm liên kết hóa học để giải thích
được vì sao trong tự nhiên, muối ăn ở dạng rắn, khó nóng chảy,
khó bay hơi, còn đường ăn, nước đá ở thể rắn dễ nóng chảy và
nước ở thể lỏng dễ bay hơi. Đáp án:
- Muối ăn là hợp chất ion nên là chất rắn ở điều kiện thường, khó bay hơi, khó nóng chảy.
- Đường ăn và nước đá là hợp chất cộng hóa trị nên ở thể rắn, dễ
nóng chảy và nước ở thể lỏng sẽ dễ bay hơi do các chất cộng hóa trị
thường có nhiệt độ nóng chảy và nhiệt độ sôi thấp.
Câu hỏi: Khi cơ thể bị mất nước do tiêu chảy, nôn mửa, … người ta
thường cho bệnh nhân uống dung dịch oresol. Tìm hiểu qua sách báo và
internet, hãy cho biết thành phần của oresol có các loại chất nào (chất ion,
chất cộng hóa trị)? Trong trường hợp không có oresol thì có thể thay thế
bằng cách nào khác không? Giải thích
- Thành phần của oresol: + Sodium chloride: Chất ion
+ Potassium chloride: Chất ion
+ Glucose khan: Chất cộng hóa trị
+ Sodium bicarbonate: Chất ion
- Trong trường hợp không có oresol, có thể hòa tan nửa thìa muối
nhỏ (Sodium chloride) và 6 thìa nhỏ đường (thành phần có glucose)
trong 1 lít nước đun sôi để nguội. Hoặc có thể sử dụng nước dừa,
nước cơm (thành phần có glucose) thêm một chút xíu muối (sodium
chloride) để thay thế trong trường hợp khẩn cấp
Câu hỏi: Hãy giải thích hiện tượng sau: Nước tinh khiết hầu như
không dẫn điện, nhưng nước biển lại dẫn được điện. Đáp án:
- Nước là hợp chất cộng hóa trị giữa nguyên tử O và 2
nguyên tử H => Không dẫn điện
- Nước biển có thành phần chủ yếu là muối ăn (NaCl): đây
là hợp chất ion được tạo bởi kim loại điển hình (Na) và phi
kim điển hình (Cl) => Dẫn điện
Câu hỏi: Hãy giải thích hiện tượng sau: Khi cho đường ăn
vào chảo rồi đun nóng sẽ thấy đường ăn nhanh chóng chuyển
từ thể rắn sang thể lỏng, làm như vậy với muối ăn thấy muối ăn vẫn ở thể rắn Đáp án:
- Đường ăn là hợp chất cộng hóa trị giữa các nguyên tử C, H và O
=> Nhiệt độ nóng chảy thấp => Khi đun nóng nhanh chóng chuyển
từ thể rắn sang thể lỏng
- Muối ăn là hợp chất ion được tạo bởi kim loại điển hình (Na) và
phi kim điển hình (Cl) => Nhiệt độ nóng chảy cao => Khi đun nóng
trên chảo muối ăn vẫn ở thể rắn
HƯỚNG DẪN VỀ NHÀ
• - Học vài và làm các bài tập trong SBT/ • - Nghiên cứu bài 7 Thank you
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- HƯỚNG DẪN VỀ NHÀ
- Slide 28




