







Preview text:
Bài 4 : Sơ lược bảng tuần hoàn hoá học
I. Nguyên tắc xây dựng bảng tuần hoàn các nguyên tố hoá học
Điện tích hạt nhân / số thứ tự ô / số proton / số e - Các nguyên tố hoá học trong bảng tuần hoàn được sắp xếp theo chiều tăng dần của điện tích hạt nhân .
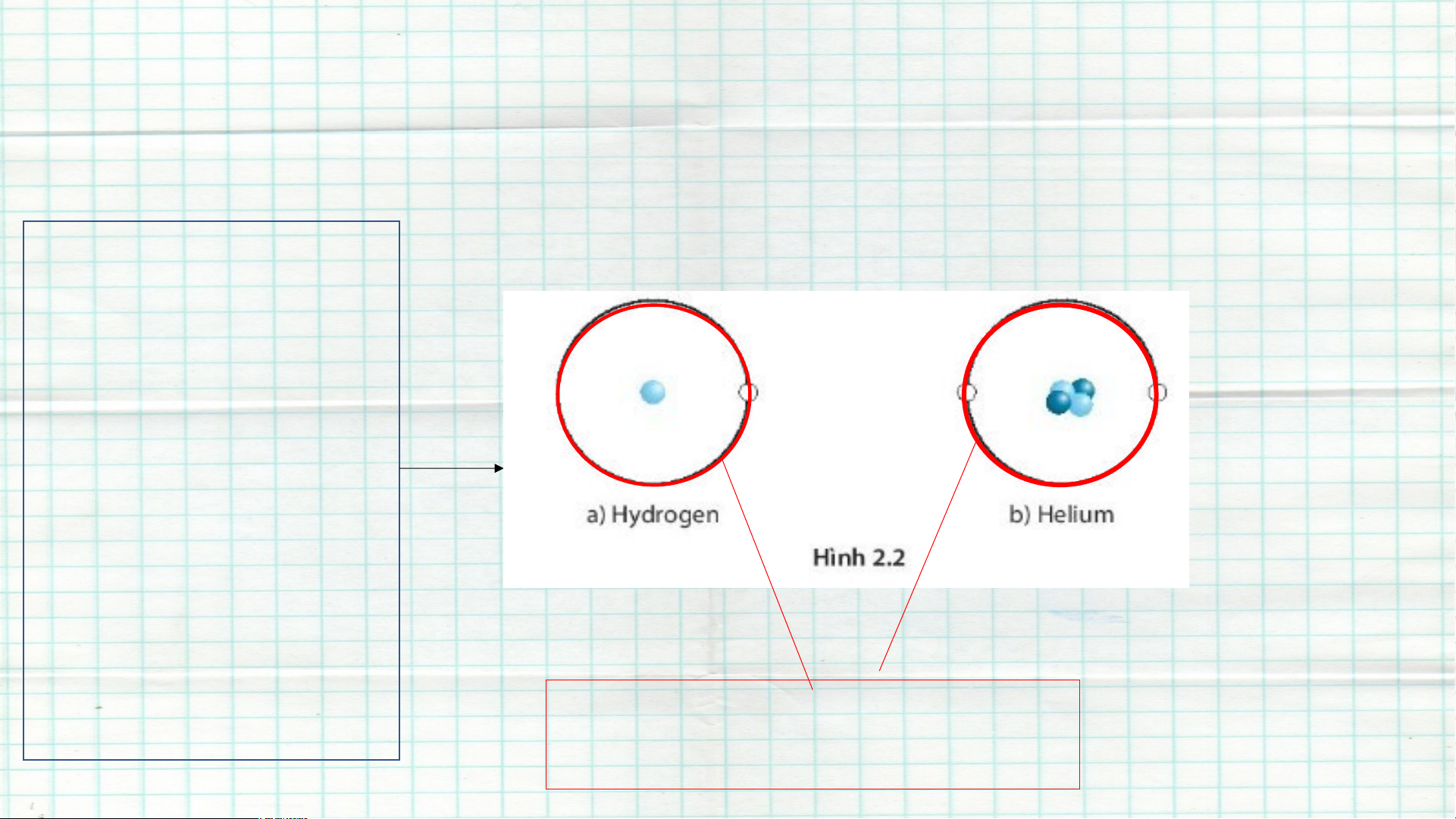
I. Nguyên tắc xây dựng bảng tuần hoàn các nguyên tố hoá học - Các nguyên tố hoá học có cùng số electron trong nguyên tử được xếp thành một hàng .
Vì nguyên tố Hydrogen và nguyên tử Helium có cùng 1 lớp electron
=> Hydrogen và Helium được xếp cùng 1 hàng
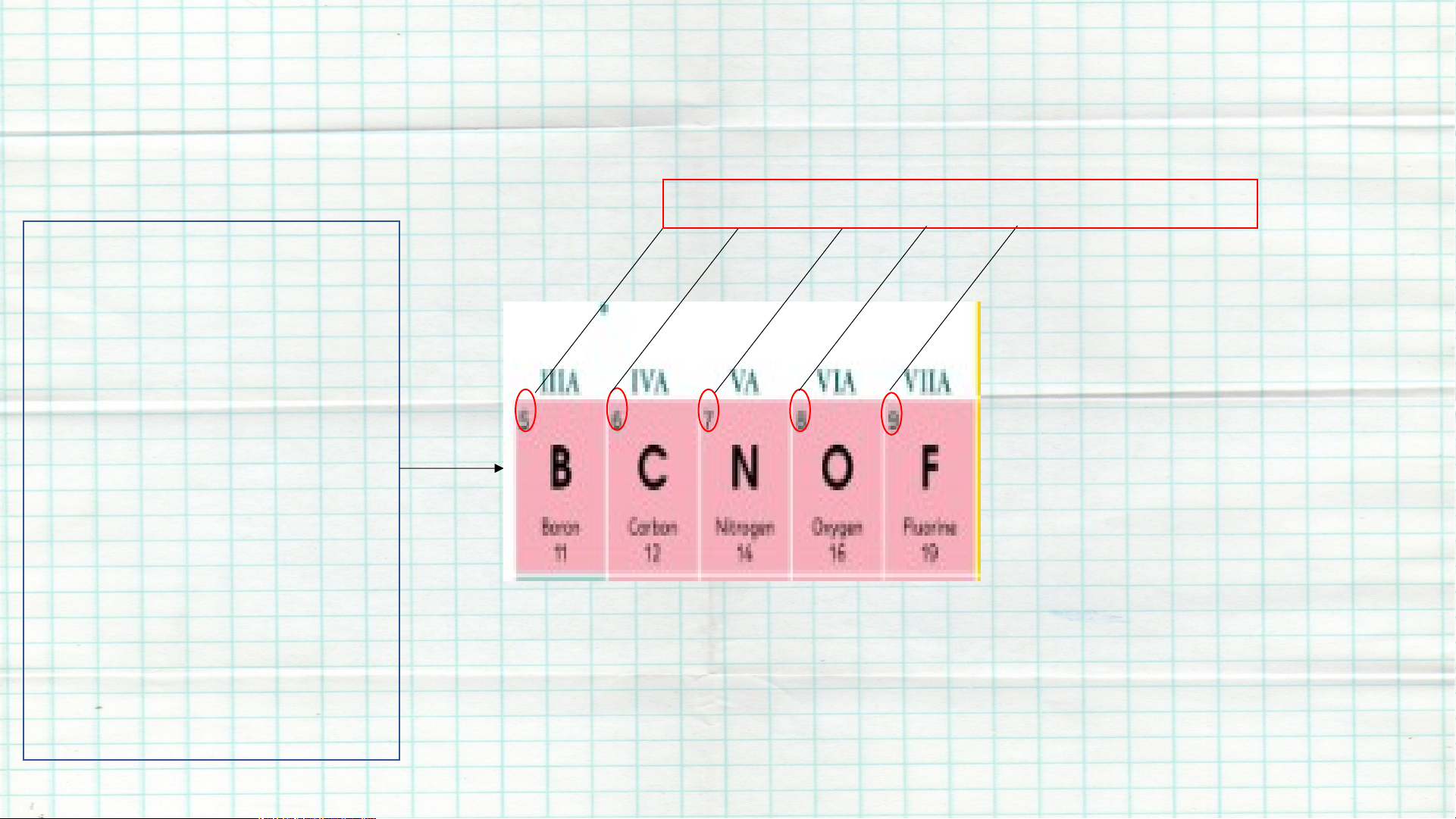
I. Nguyên tắc xây dựng bảng tuần hoàn các nguyên tố hoá học - Các nguyên tử có cùng một
Ta có : Nguyên tố Hydrogen và tính chất hoá
nguyên tố Lithium có cùng một học được xếp tính chất hoá học
=> Nguyên tố Hydrogen và thành một cột
nguyên tố Lithium được xếp cùng 1 hàng .
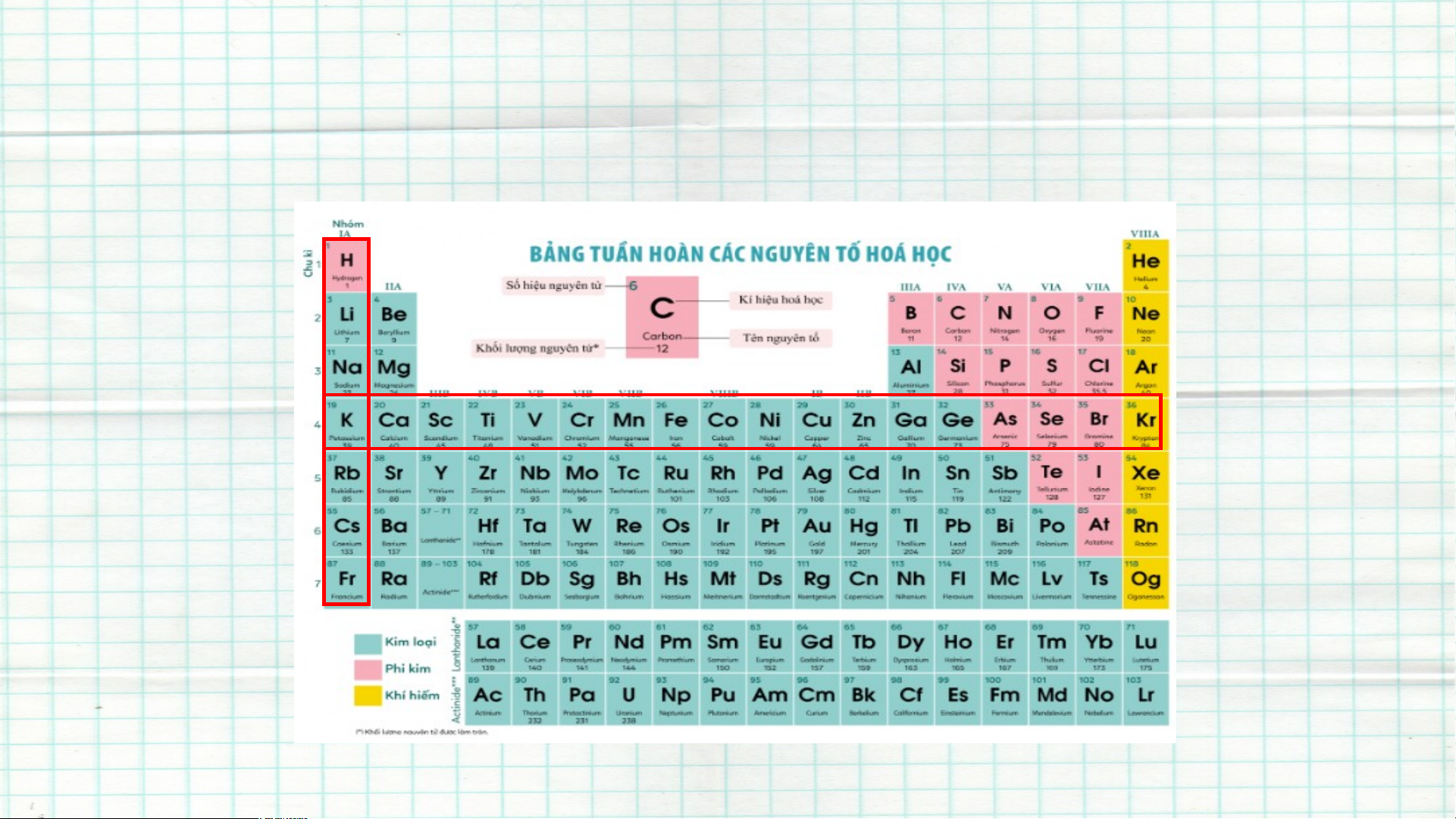
II. Cấu tạo bảng tuần hoàn các nguyên tố hoá học a. Ô nguyên tố
- Mỗi nguyên tố hoá học được xếp vào một ô của bảng tuần
hoàn hoá học , gọi là ô nguyên tố
- Ô nguyên tố cho biết : số hiệu nguyên tử , kí hiệu hoá học , tên nguyên tố
và khối lượng của nguyên tố đó
- => Số hiệu nguyên tử = số đơn vị đơn vị điện tích hạt nhân = số proton =
số electron trong nguyên tử của nguyên tố . b. Chu kì
- Các nguyên tố hoá học có cùng số
lớp electron trong nguyên tử được
sắp xếp vào cùng một hàng ngang
trong bảng tuần hoàn, gọi là chu kì. Chu kì
- Hiện nay trong bảng tuần hoàn có tất cả 7 chu kì . Nếu xét về số lượng các nguyên tố
trong mỗi chu kì thì người ta chia làm hai loại chu kì như sau :
+ Chu kì nhỏ gồm các chu kì 1,2,3
+ Chu kì lớn gồm các chu kì 4,5,6,7 c. Nhóm
- Nhóm gồm các nguyên tố có this chất hoá học tương tự nhau ,
được xếp thành cọt theo chiều tang dân của điện tích hạt nhân .
- Nhóm A được đánh số thứ tự bằng La Mã lần lợt từ nhóm IA đến VIIA .
- => Số thứ tự nhóm A = số electron lớp ngoài cùng trong nguyên
tử của nguyên tố thuộc nhóm đó .
III. Các nguyên tố kim loại
• - Các nguyên tố kim loại nhóm A gồm nhóm IA
( trừ nguyên tố hydrogen ) , nhóm IIA , nhóm IIIA
( trừ nguyên tố boron ) ,…
• - Các nguyên tố kim loại thuộc nhóm IA gọi là nhóm kim loại kiềm . • Ghi nhớ :
• - Hơn 80% các nguyên tố hoá học trong bảng tuần
hoàn là kim loại , bao gồm một số nguyên tố nhóm
A và tất cả các nguyên tố nhóm B . IV. Các nguyên tố phi kim
• Nhóm nguyên tố phi kim chủ yếu tập trung ở
góc bên phải của bảng tuần hoàn các nguyên tố hoá học . • Ghi nhớ :
• - Các nguyên tố phi kim gồm :
• + Nguyên tố Hydrogen ở nhóm IA
• + Một số nguyên tố nhóm IIA và IVA
• + Hầu hết các nguyên tố thuộc nhóm VA , VIA và VIIA
V. Nhóm các nguyên tố khí hiếm
• - Nhóm cuối cùng của bảng tuần hoàn là nhóm các
nguyên tố khí hiếm ( nhóm VIIIA ) .
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- III. Các nguyên tố kim loại
- IV. Các nguyên tố phi kim
- V. Nhóm các nguyên tố khí hiếm
- Slide 12




