











































Preview text:
CHÀO MỪNG CÁC EM ĐẾN VỚI TIẾT HỌC HÔM NAY Chúng ta cùng nhau coi một đoạn video nhé! Bài 4
SƠ LƯỢC BẢNG TUẦN HOÀN
CÁC NGUYÊN TỐ HOÁ HỌC : : :
GV thực hiện: Nguyễn Thị Tuyết Nhung NỘI DUNG BÀI HỌC
• NGUYÊN TẮC XÂY DỰNG BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC
• CẤU TẠO BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC
• CÁC NGUYÊN TỐ KIM LOẠI • CÁC NGUYÊN TỐ PHI KIM
• CÁC NGUYÊN TỐ KHÍ HIẾMa
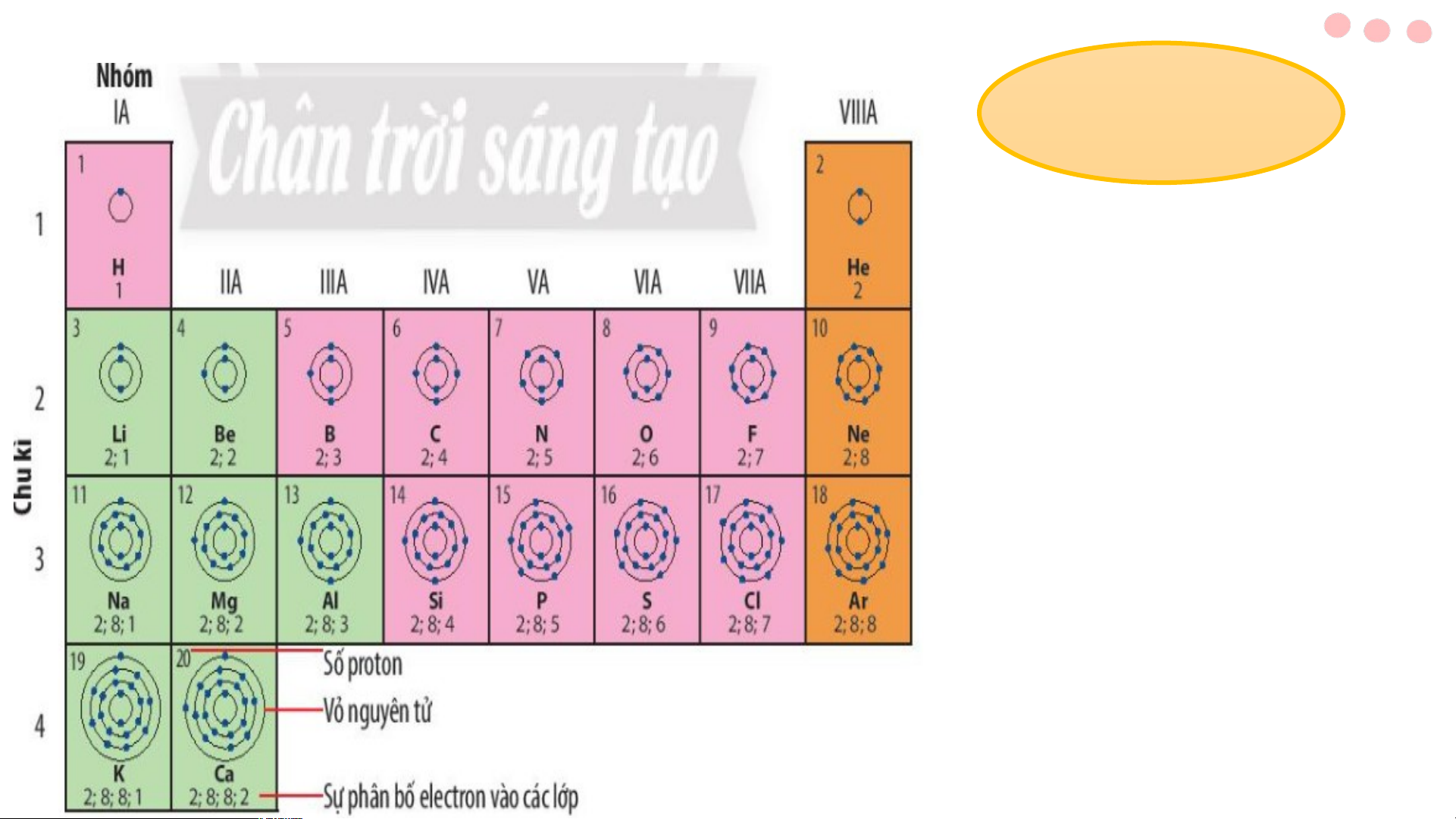
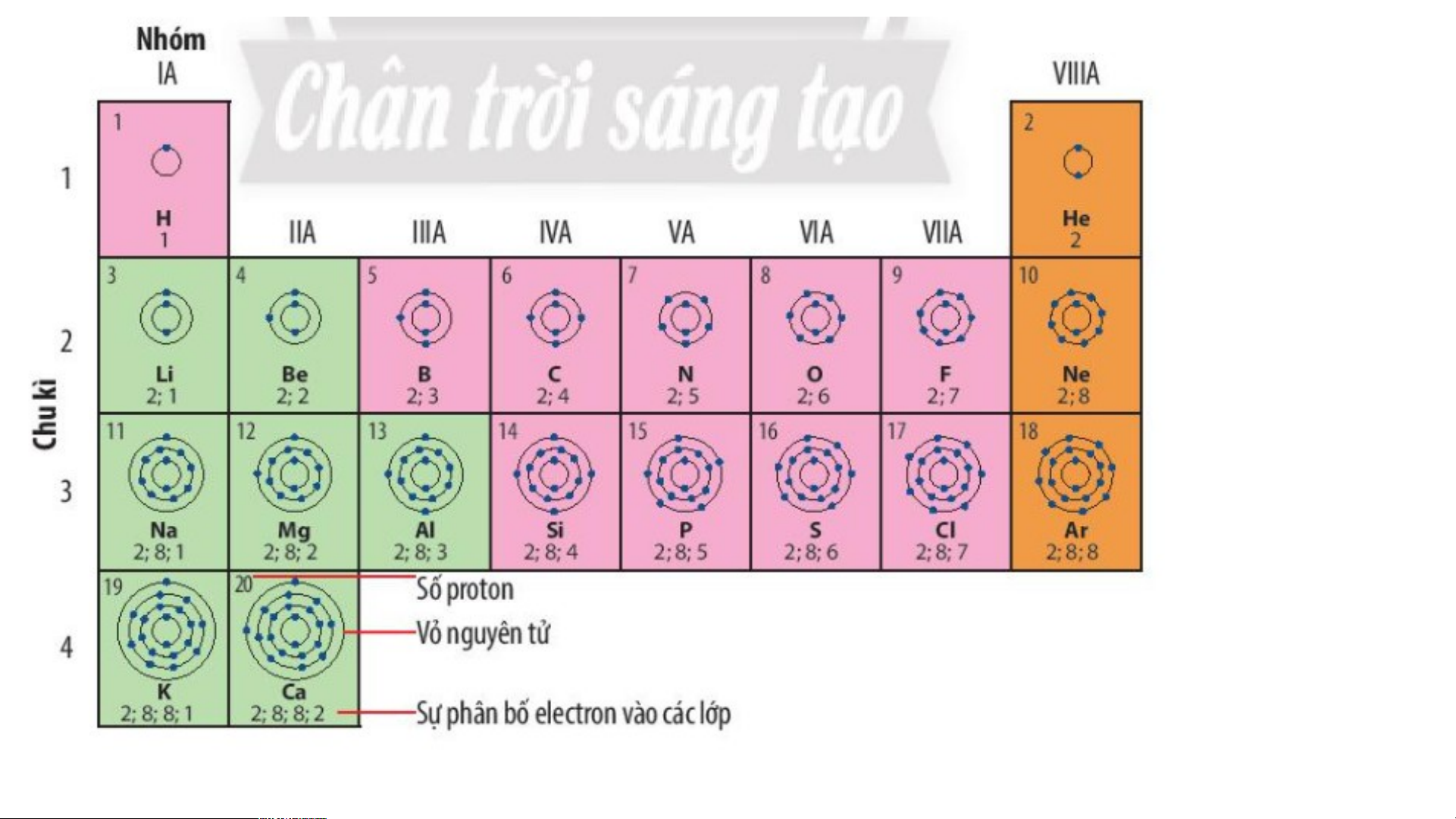
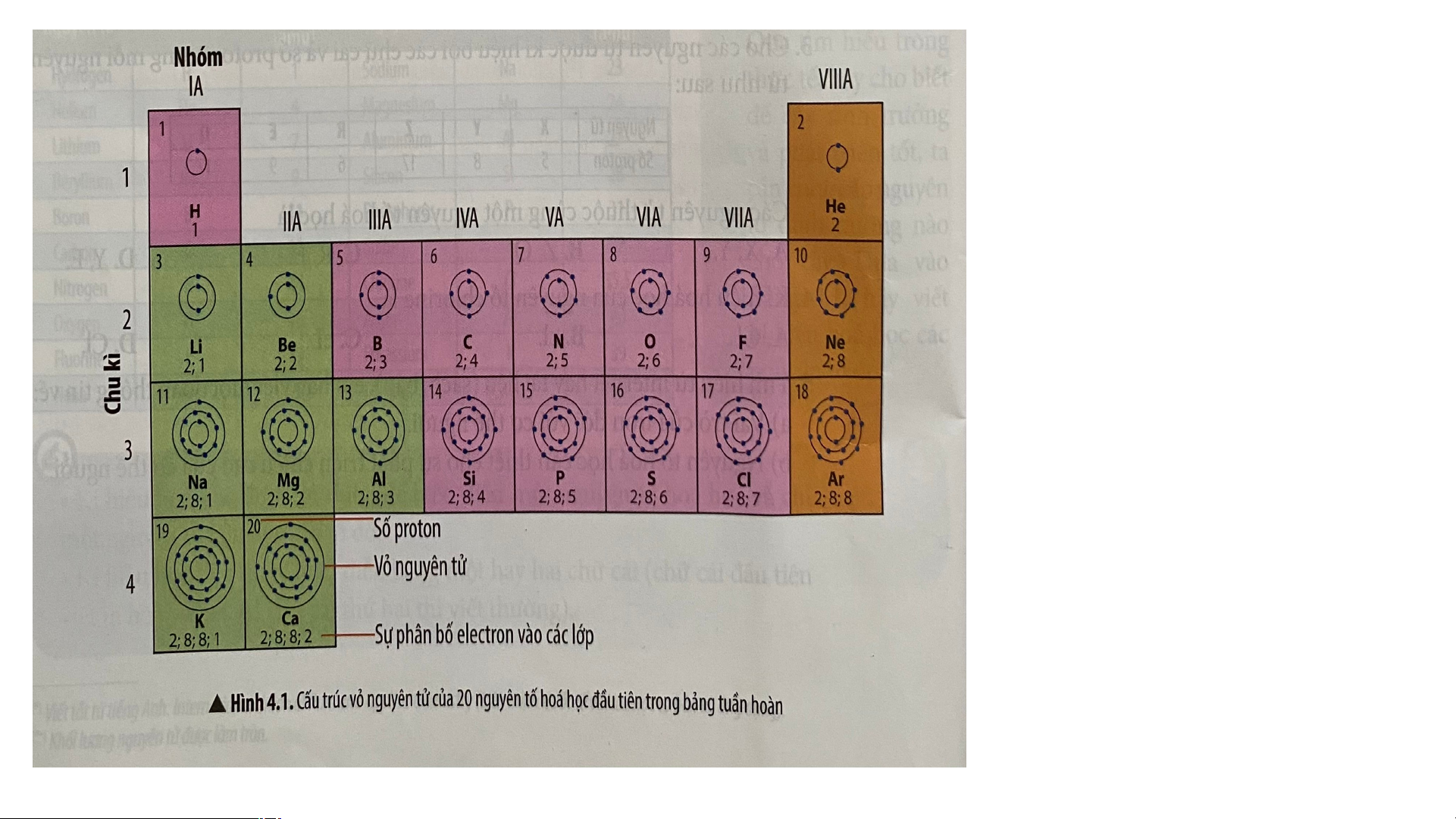
BÀI 4: SƠ LƯỢC BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC HOẠT ĐỘNG NHÓM Quan sát hình 4.1 trang 22 SGK cho biết: a) Nguyên tử của những nguyên tố nào có cùng số lớp electron? b) Nguyên tử của những nguyên tố nào có số
electron ở lớp ngoài cùng bằng nhau?
1. Nguyên tắc xây dựng bảng tuần hoàn các nguyên tố hóa học
a) Nguyên tử của những nguyên tố có cùng số lớp electron.
• Các nguyên tử của các nguyên tố có cùng số lớp electron là: • 1 lớp: H, He
• 2 lớp: Li, Be, B, C, N, O, F, Ne
• 3 lớp: Na, Mg, Al, Si, P, S, Cl, Ar • 4 lớp: K,Ca
1. Nguyên tắc xây dựng bảng tuần hoàn các nguyên tố hóa học
a) Nguyên tử của những nguyên tố có cùng số lớp electron.
b) Nguyên tử của những nguyên tố có số electron ở lớp ngoài cùng bằng nhau: N, P • 1 electron:……… H … , Li …… , Na, K
• 5 electron: …………….. O, S • 2 electron: ……… Be, …… Mg., Ca, He
• 6 electron:……………… F, Cl • 3 electron:…… B… , … Al ….
• 7 electron:……………… Ne, Ar • 4 electron:…… C… , … Si …….
• 8 electron: …………………
- Riêng He chỉ có 2 electron ở lớp ngoài cùng, lại được xếp vào nhóm VIIIA.
Vậy em có nhận xét gì về nguyên tắc xây dựng bảng tuần hoàn? KẾT LUẬN
• Các nguyên tố hóa học trong bảng tuần hoàn được sắp xếp
theo chiều tăng dần điện tích hạt nhân của nguyên tử.
• Các nguyên tố hóa học có cùng số lớp electron trong nguyên tử
được xếp thành một hàng.
• Các nguyên tố có tính chất hóa học tương tự nhau được xếp thành một cột
1. Nguyên tắc xây dựng bảng tuần hoàn các nguyên tố hóa học
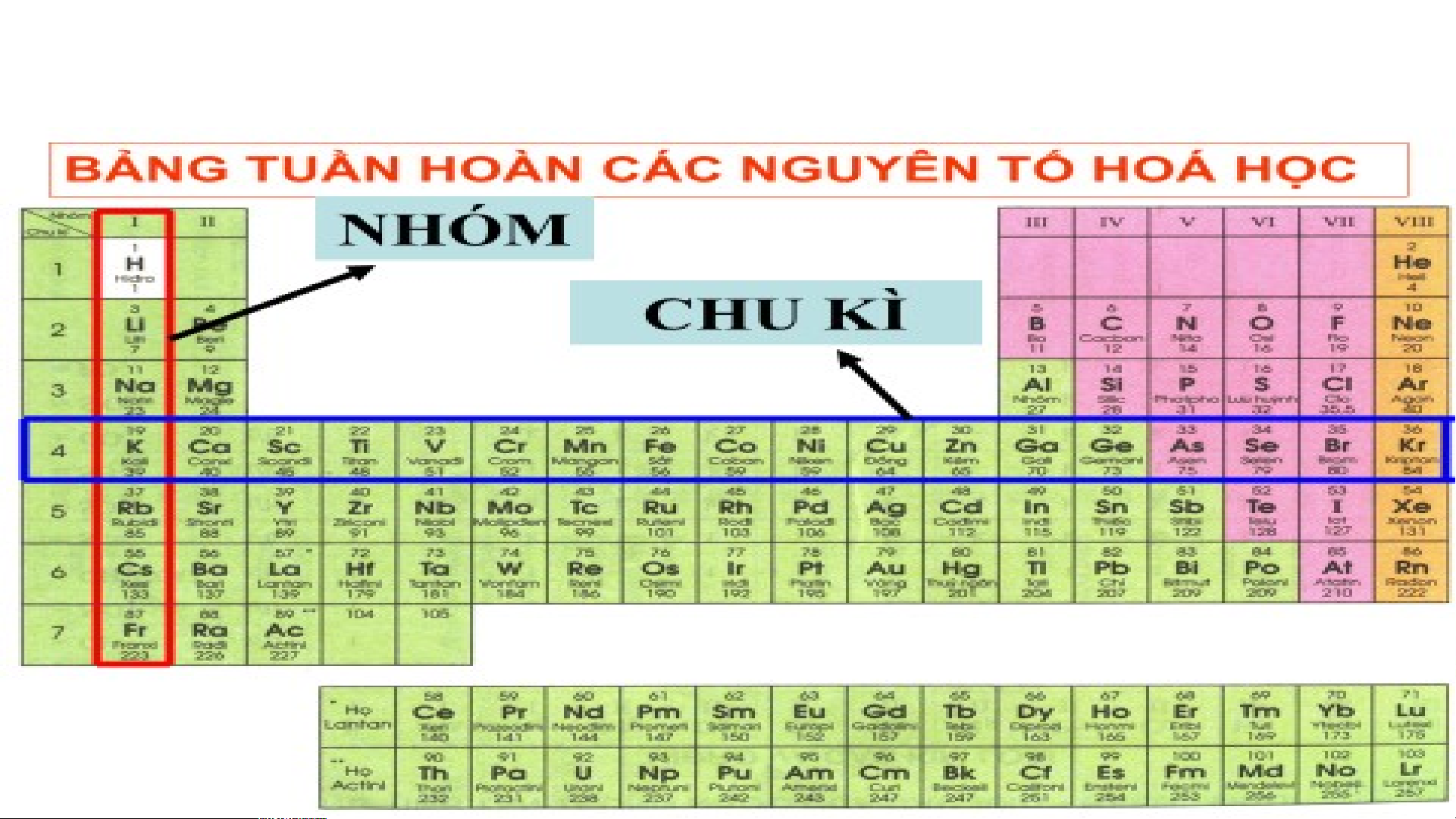
2. Cấu tạo bảng tuần hoàn các nguyên tố hóa học
a. Mô tả cấu tạo của bảng tuần hoàn các nguyên tố hóa học
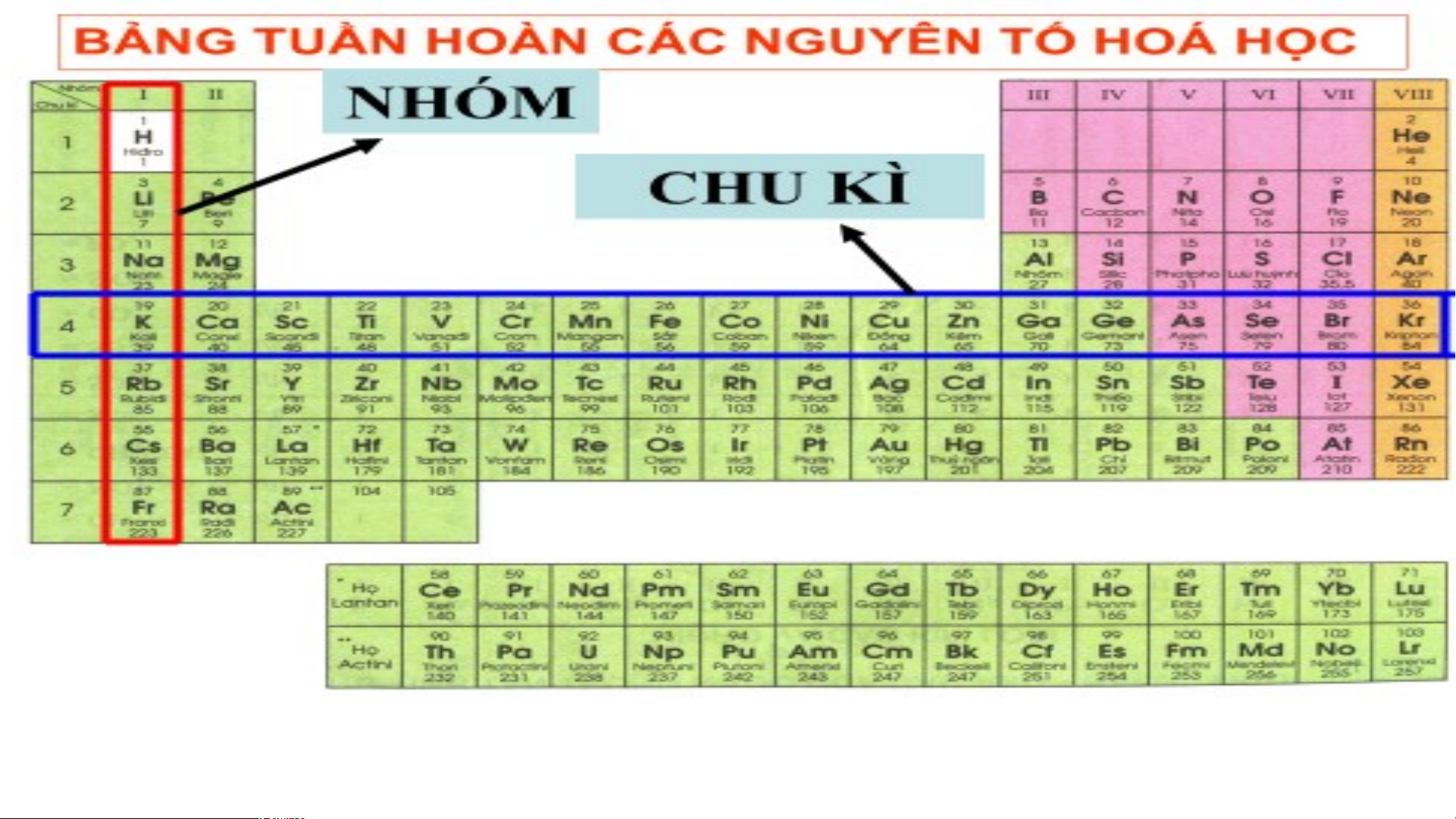
Quan sát bảng tuần hoàn các nguyên tố hóa học cho biết
cấu tạo của bảng như thế nào?
1. Nguyên tắc xây dựng bảng tuần hoàn các nguyên tố hóa học
2. Cấu tạo bảng tuần hoàn các nguyên tố hóa học a. + M B ô tả c ảng t ấ u u tạ ần h o o c à ủ n a g bản ồm g cátu c ần ng h u o y à ê n n các tố h ng óa uy họ ê c n tố mà h vịóa h trí ọc được đặc
trưng bởi ô nguyên tố, chu kì và nhóm
+ Các nguyên tố họ lanthnide và họ actinide được xếp riêng
thành 2 hàng ở cuối bảng tuần hoàn
b.Tìm hiểu ô nguyên tố trrong bảng tuần hoàn các nguyên tố hóa học
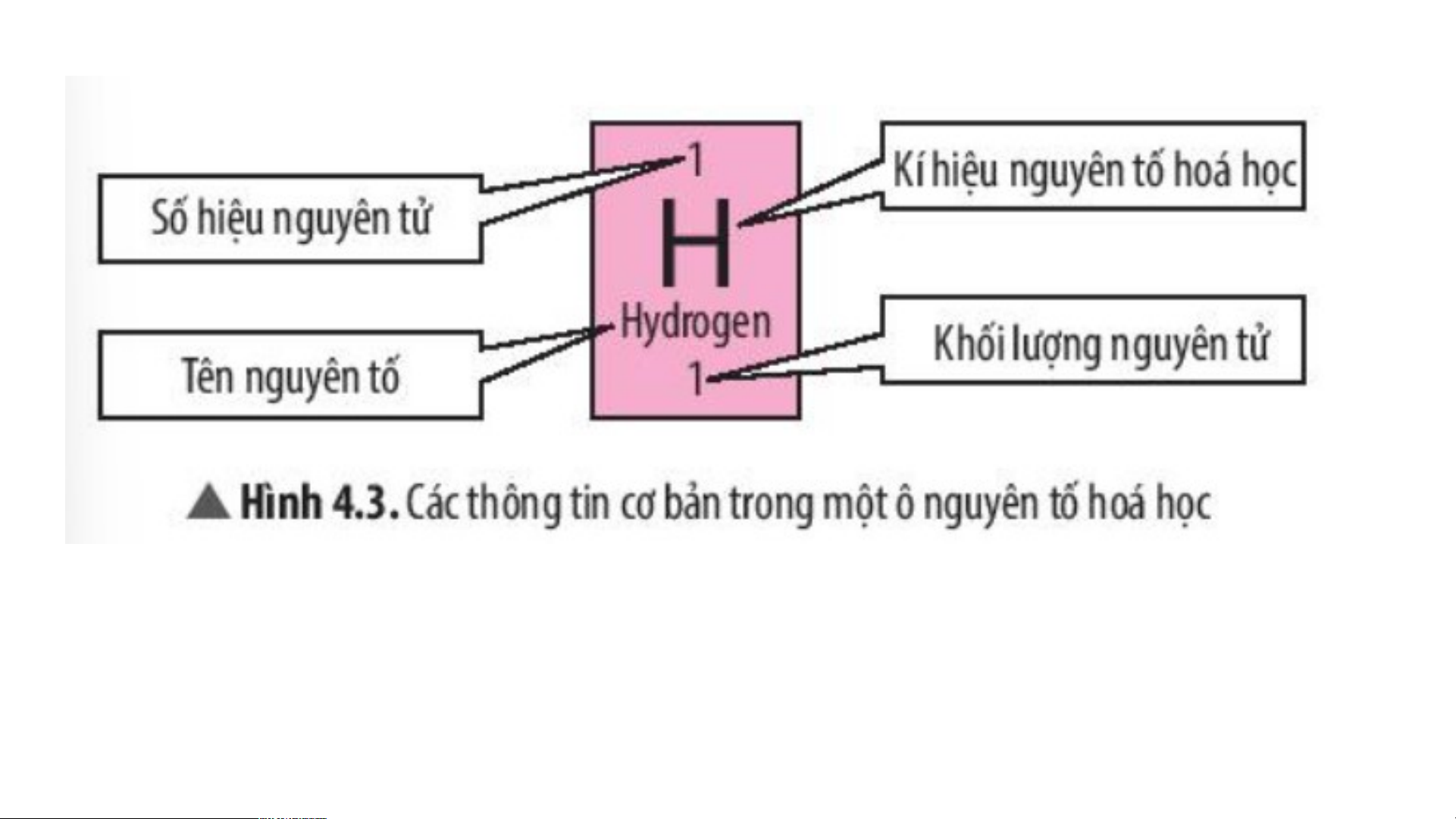
Quan sát hình 4.3 trả lời câu hỏi
?1 Có những thông tin cơ bản nào trong một ô nguyên tố hóa học?
?2 Số hiệu nguyên tử của một nguyên tố hóa học cho
biết những thông tin gì về nguyên tố đó?
1. Nguyên tắc xây dựng bảng tuần hoàn các nguyên tố hóa học
2. Cấu tạo bảng tuần hoàn các nguyên tố hóa học a. b. M Tì ô tả c m hi ấu tạo ểu ô ng của uyênb tảng ố tr rtuần ong h b o ả àn ng cá tu c ầ nguy n hoà ê n n tố các hóa h ng ọc uyên tố hóa
- Các thông tin trong một ô ng h u ọ y c ên tố hóa học gồm: + Số hiệu nguyên tử
+ Kí hiệu nguyên tố hóa học + Tên nguyên tố + Khối lượng nguyên tử
BÀI TẬP LUYỆN TẬP
? Cho biết những thông tin cơ bản về nguyên
tố hóa học đã cho dưới đây? Giải:
Những thông tin cơ bản về nguyên tố Oxygen:
+ Số hiệu nguyên tử: …… 8 …..
+ Kí hiệu nguyên tố hóa học: … O … + Tên nguyên tố: ……. Oxygen
+ Khối lượng nguyên tử: …… 16 …
1. Nguyên tắc xây dựng bảng tuần hoàn các nguyên tố hóa học
2. Cấu tạo bảng tuần hoàn các nguyên tố hóa học a. b. M Tì ô tả c m hi ấu tạo ểu ô ng của uyênb tảng ố tr rtuần ong h b o ả àn ng cá tu c ầ nguy n hoà ê n n tố các hóa h ng ọc uyên tố hóa
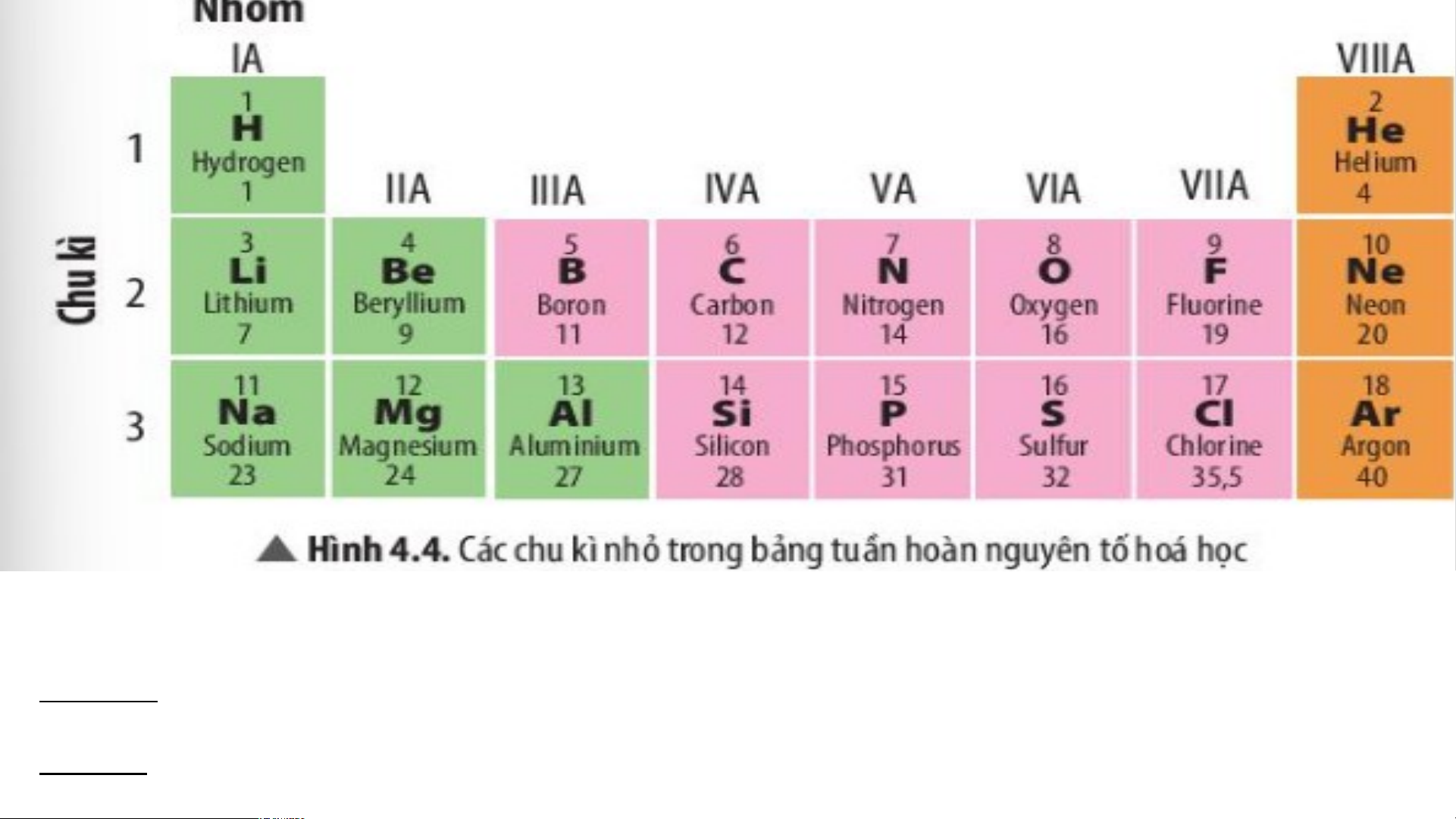
c. Tìm hiểu về chu kì trong bản học
g tuần hoàn các nguyên tố hóa học Quan sát hình 4.4 trả lời chu kỳ là gì?
1. Nguyên tắc xây dựng bảng tuần hoàn các nguyên tố hóa học
2. Cấu tạo bảng tuần hoàn các nguyên tố hóa học a. b. M Tì ô tả c m hi ấu tạo ểu ô ng của uyênb tảng ố tr rtuần ong h b o ả àn ng cá tu c ầ nguy n hoà ê n n tố các hóa h ng ọc uyên tố hóa
c. Tìm hiểu về chu kì trong bản học
g tuần hoàn các nguyên tố hóa học
- Chu kì là tập hợp các nguyên tố hóa học có cùng số lớp electron
trong nguyên tử theo hàng ngang.
Bảng tuần hoàn nguyên tố hóa học có mấy chu kì? Bao nhiêu chu
kì lớn, bao nhiêu chu kì nhỏ?
1. Nguyên tắc xây dựng bảng tuần hoàn các nguyên tố hóa học
2. Cấu tạo bảng tuần hoàn các nguyên tố hóa học a. b. M Tì ô tả c m hi ấu tạo ểu ô ng của uyênb tảng ố tr rtuần ong h b o ả àn ng cá tu c ầ nguy n hoà ê n n tố các hóa h ng ọc uyên tố hóa
c. Tìm hiểu về chu kì trong bản học
g tuần hoàn các nguyên tố hóa học
- Chu kì là tập hợp các nguyên tố hóa học có cùng số lớp electron
trong nguyên tử theo hàng ngang.
- Bảng tuần hoàn có 7 chu kì, gồm 3 chu kì nhỏ và 4 chu kì lớn.
Phiếu học tập: HOẠT ĐỘNG NHÓM
Câu 1. Mỗi chu kì bắt đầu từ nhóm nào và kết thúc ở nhóm nào?
Câu 2. Em hãy chỉ sự tuần hoàn ở mỗi chu kì trong bảng tuần hoàn các nguyên tố hóa học?
2. Cấu tạo bảng tuần hoàn các nguyên tố hóa học
c. Tìm hiểu về chu kì trong bảng tuần hoàn các nguyên tố hóa học
- Chu kì là tập hợp các nguyên tố hóa học có cùng số lớp electron
trong nguyên tử theo hàng ngang.
- Bảng tuần hoàn có 7 chu kì, gồm 3 chu kì nhỏ và 4 chu kì lớn.
+ Mỗi chu kì bắt đầu từ nhóm IA và kết thúc ở nhóm VIIIA
+ Trong mỗi chu kì các nguyên tố được xếp thành hàng tăng dần điện tích hạt nhân.
- Mỗi chu kì bắt đầu bằng nguyên tố có 1 electron lớp ngoài cùng,
tiếp theo là nguyên tố có 2 electron lớp ngoài cùng và cứ thế kết
thúc chu kì bằng 1 nguyên tố có 8 electron lớp ngoài cùng và tiếp tục một chu kì mới.
2. Cấu tạo bảng tuần hoàn các nguyên tố hóa học
c. Tìm hiểu về chu kì trong bảng tuần hoàn các nguyên tố hóa học
d. Tìm hiểu về nhóm trong bảng tuần hoàn hoàn các nguyên tố hóa học
- Các thông tin trong một ô nguyên tố hóa học gồm: Quan sát hình 4.5 , cho biết những nguyên tố nào có tính chất tương tự nhau? nhóm là gì?
2. Cấu tạo bảng tuần hoàn các nguyên tố hóa học
d. Tìm hiểu về nhóm trong bảng tuần hoàn hoàn các nguyên tố hóa học
Quan sát hình 4.5 , cho biết những nguyên tố nào có tính chất tương tự .
- Các thông tin trong một ô nguyên tố hóa học gồm: nhau?
Những nguyên tố có tính chất tương tự nhau là: • H, Li, Na, K, Rb, Cs, Fr • F, Cl, Br, I, At, Ts • He, Ne, Ar, Kr, Xe, Rn, Og
1. Nguyên tắc xây dựng bảng tuần hoàn các nguyên tố 2. Cấu tạo bảng tuần h hoàó na h cáọ c c nguyên tố hóa học
a. Mô tả cấu tạo của bảng tuần hoàn các nguyên tố hóa học
b.Tìm hiểu ô nguyên tố trrong bảng tuần hoàn các nguyên tố hóa học
- Các thông tin trong một ô nguyên tố hóa học gồm:
c. Tìm hiểu về chu kì trong bảng tuần hoàn các nguyên tố hóa học
d. Tìm hiểu về nhóm trong bảng tuần hoàn hoàn các nguyên tố hóa học.
- Nhóm là tập hợp các ngu
yên tố có tính chất hóa học tương tự nhau và
được xếp thành cột, theo chiều tăng dần về điện tích hạt nhân.
2. Cấu tạo bảng tuần hoàn các nguyên tố hóa học
d. Tìm hiểu về nhóm trong bảng tuần hoàn hoàn các nguyên tố hóa học
• Dựa vào hình 4.2, hãy hoàn thành các thông .
- Các thông tin trong một ô nguyên tố hóa học gồm:
tin còn thiếu trong bảng sau: Nguyên tố KHHH Nhóm Chu kỳ Calcium ? ? ? ? P ? ? Xenon ? ? ?
2. Cấu tạo bảng tuần hoàn các nguyên tố hóa học
d. Tìm hiểu về nhóm trong bảng tuần hoàn hoàn các nguyên tố hóa học
• Dựa vào hình 4.2, hãy hoàn thành các thông tin còn thiếu trong bảng .
- Các thông tin trong một ô nguyên tố hóa học gồm: sau: Nguyên tố KHHH Nhóm Chu kỳ Calcium II A Ca 4 phosphorus P VA 2 Xenon Xe VIIA 5
Qua đây các con cho biết nhóm các nguyên tố hóa học là gì? BÀI TẬP VẬN DỤNG
Câu 1. Hiện nay, có bao nhiêu chu kì trong bảng tuần hoàn các nguyên tố hoá học. A. 5. C.8 B. 7. D. 9.
Câu 2. Trong bảng tuần hoàn các nguyên tố hoá học, các
nguyên tố hoá học được sắp xếp theo thứ tự tăng dần của. A. Khối lượng. C. Số proton B. Tỉ trọng. D. Số neutron.
Câu 3. Tên gọi của các cột trong bảng tuần hoàn các
nguyên tố hoá học là gì?. A. Chu kì. C. Họ B. Loại. D. Nhóm.
Câu 4. Những nguyên tố nào sau đây thuộc nhóm VIIA (Halogen)?. A. Chlorine, bromine, Iorine.. C. Beryllium, carbon, oxygen B. Fluorine, carbon, bromine. D. Neon, helium, argon.. KIỂM TRA 15 PHÚT
BẢNG SO SÁNH CÁC LOẠI HỢP CHẤT VÔ CƠ
Câu 1. Xác định vị trí ( ô nguyên tố, nhóm, chu kì) của các nguyên tố: Vị trí Tên nguyên tố Ô thứ nhóm Chu kì Potassium OXIT AXIT BAZƠ MUỐI Sodium Copper KHÁI N M IaỆM gnesium Aluminium -Công thức tổng quát:
- Công thức tổng quát: - Công thức tổng quát: - Công thức tổng quát:
Câu 2. Nêu các nguyên tố kim loại thuộc nhóm IA và các nguyên tố thuộc A O H A M(OH) M A x y n n x y nhóm IIA. - A là kí hiệu hóa - A là gốc axit. - M là kim loại. - M là kim loại. C Câ ÔNG u 3. TH C ỨC ho các học. nguyên tố hóa học s - a n l u: à c H hỉ số , M , là g, h B óa , Na, - S n là , O ,ch Pỉ , số N , elà h , Hóea , Al - . A là gốc axit ; x,y là - x, y là chỉ số trị của A trị của M chỉ số.
a) Những nguyên tố nào thuộc cùng một nhóm?
b) Những nguyên tố nào thuộc cùng một chu kì?
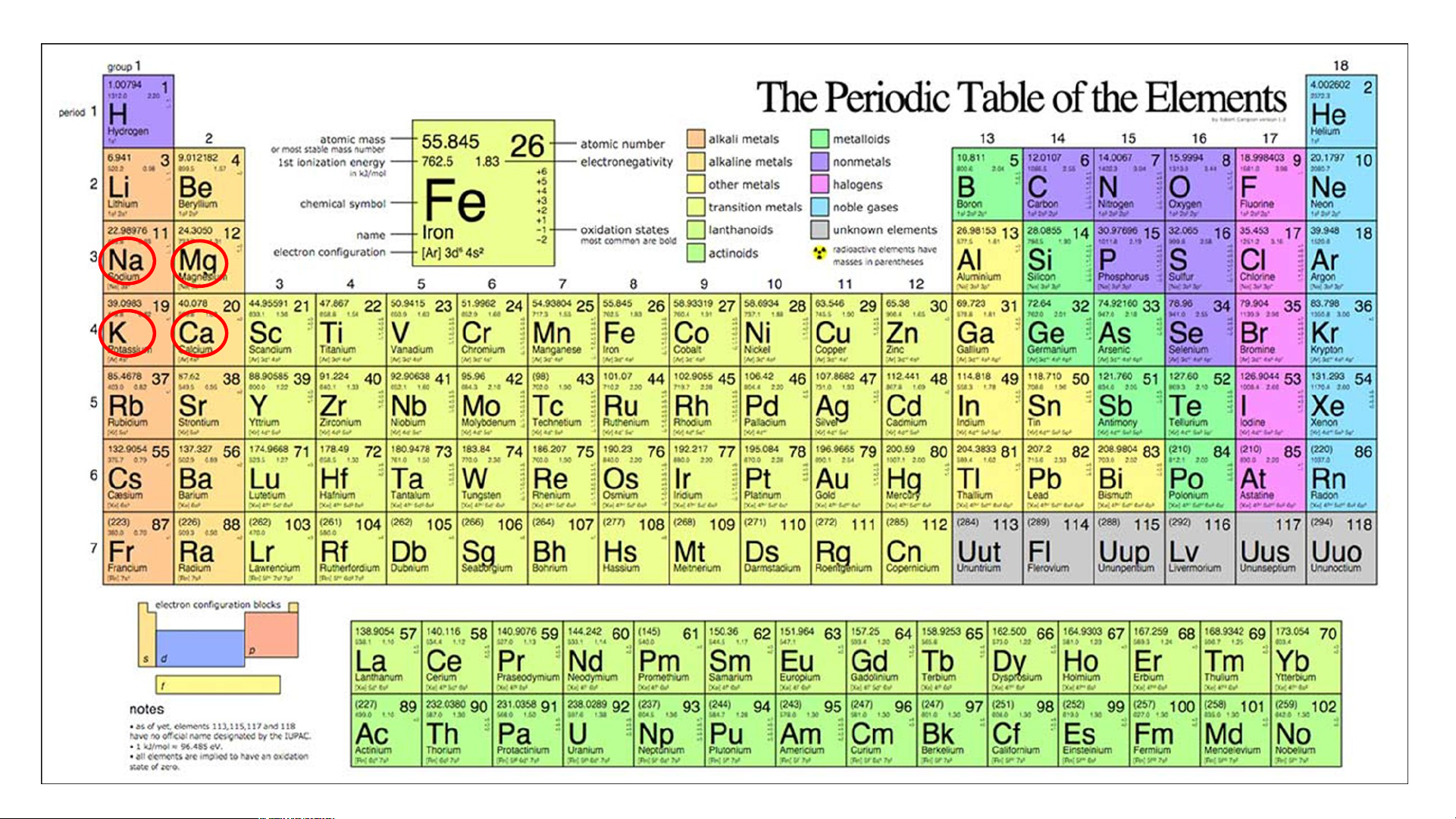
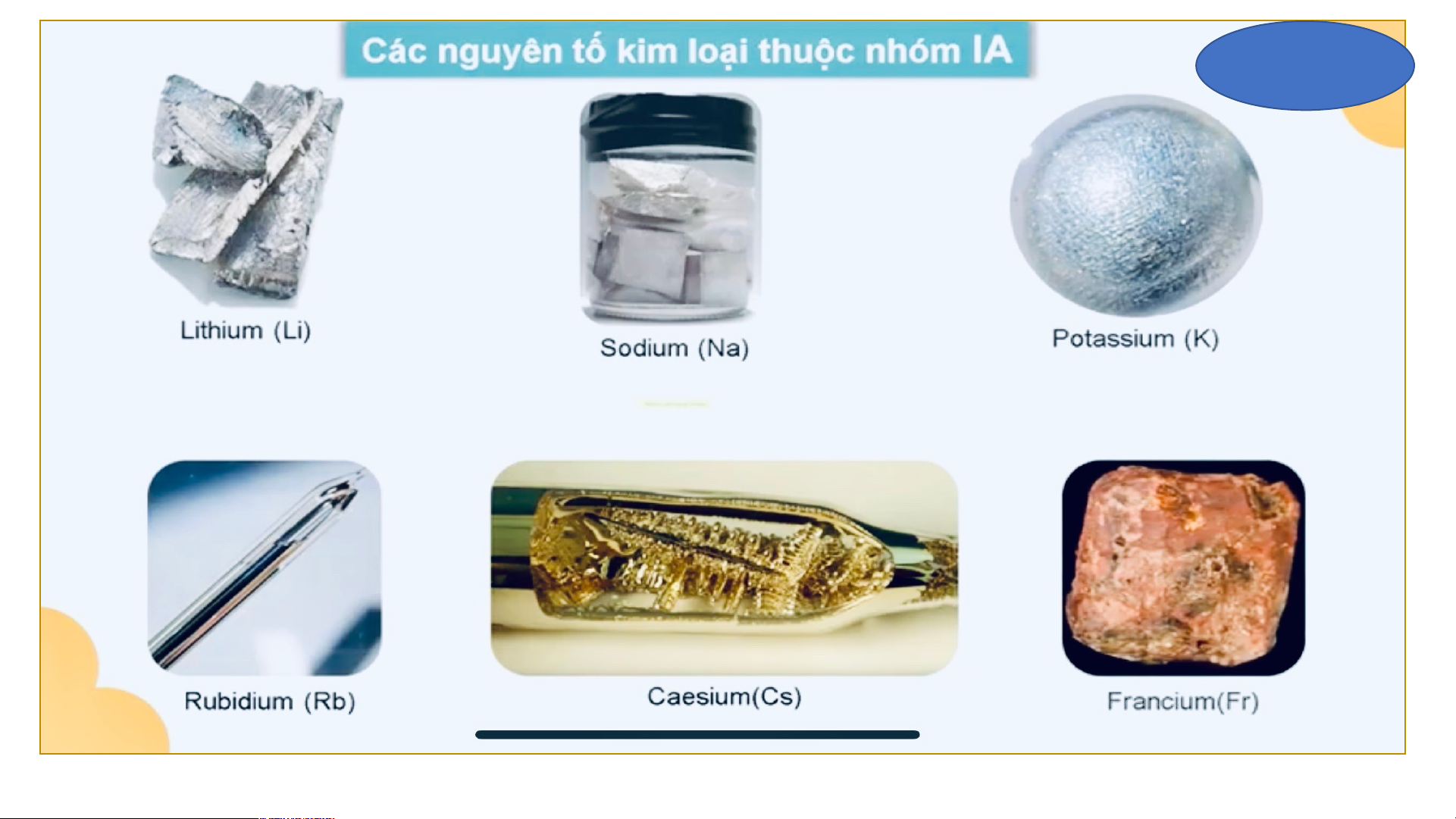
c) Những nguyên tố nào là kim loại, phi kim, khí hiếm? Nhóm kim loại kiềm Kim loại kiềm Nhóm kim loại kiềm thổ
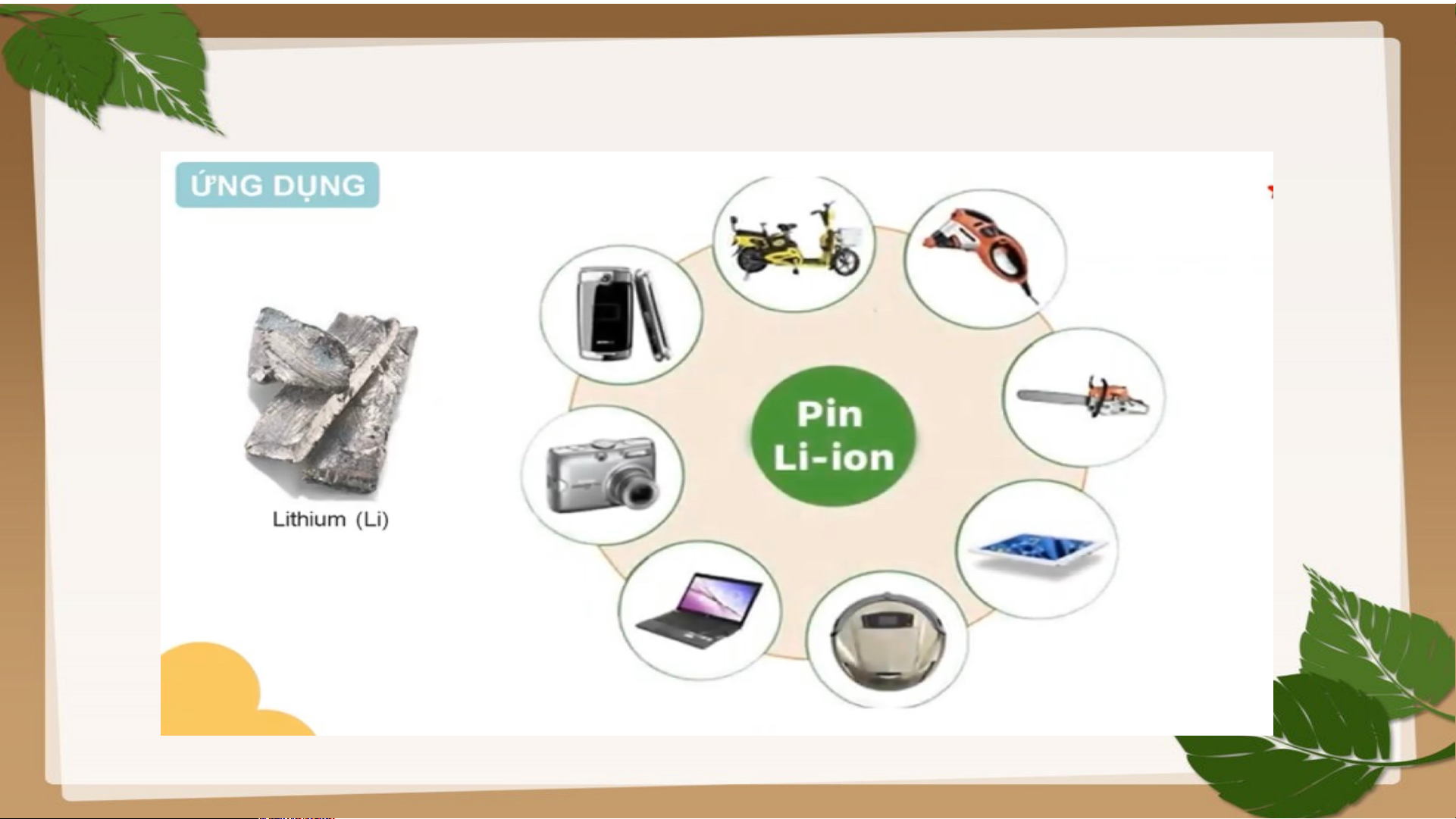
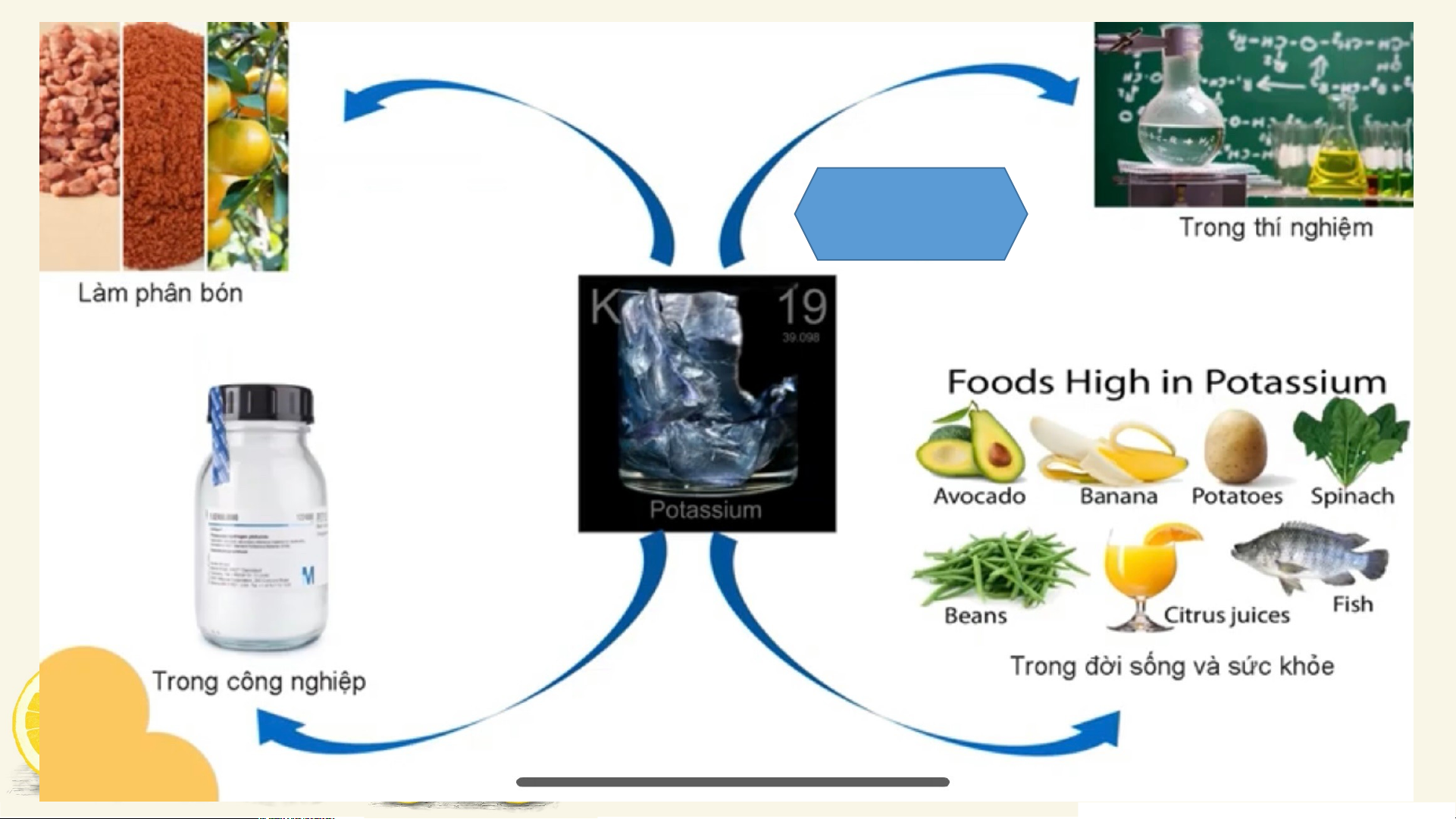
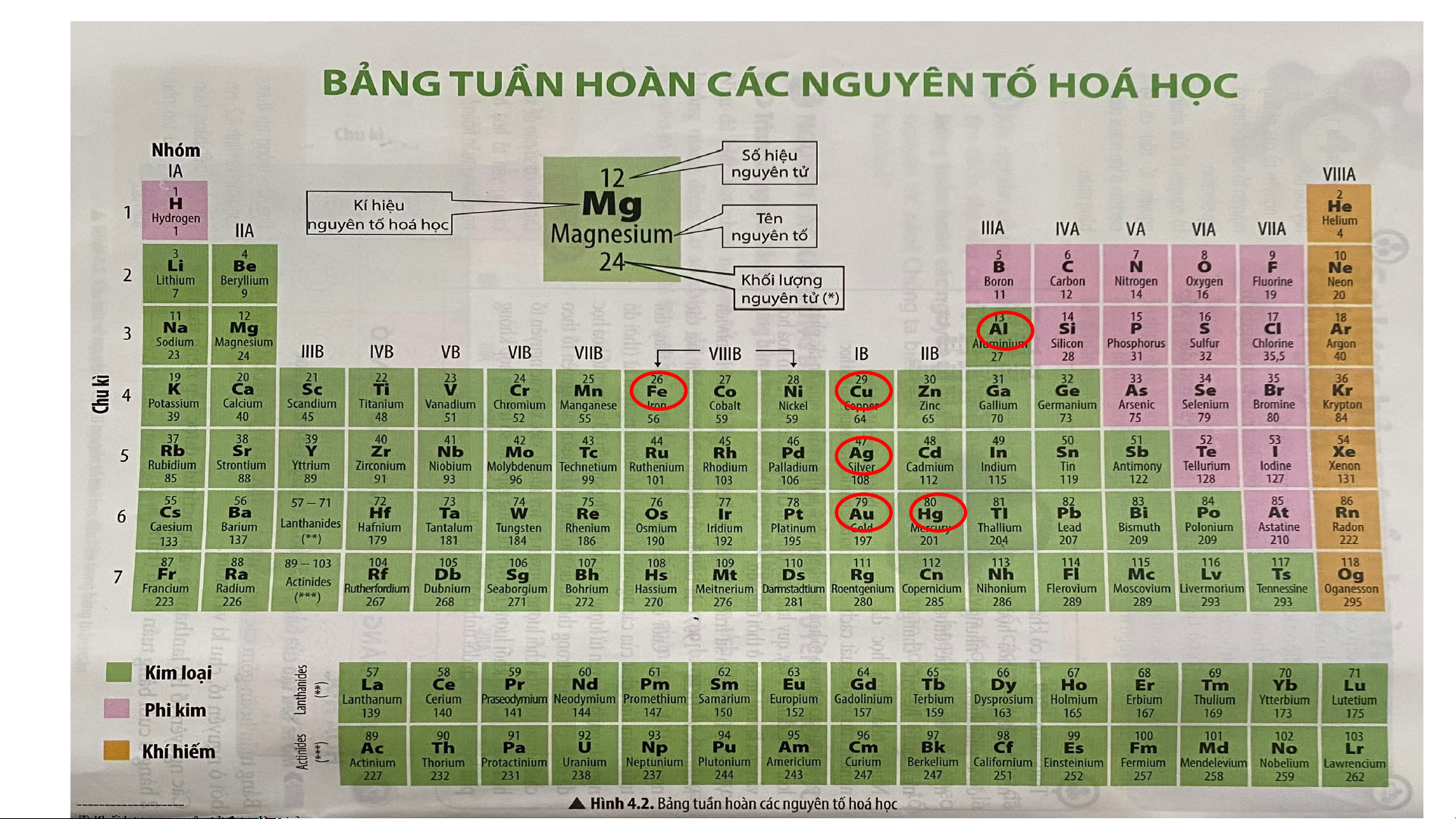
Ứng dụng của một số nguên tố kim loại nhóm A. potassium HOẠT ĐỘNG NHÓM
(Thời gian hoàn thành 5 phút)
Câu 1. Một kim loại ở thể lỏng trong điều kiện thường được ứng dụng để chế tạo
nhiệt kế. Đó là kim loại nào? Cho biết vị trí (ô, nhóm, chu kì) của nguyên tố đó.
Câu 2. Hãy cho biết những kim loại nào được sử dụng làm đồ trang sức, làm dây
dẫn điện, làm vật liệu trong xây dựng, hãy cho biết vị trí (ô, nhóm, chu kì) của
nguyên tố đó trong bảng tuần hoàn.
Hg là chất độc hại gây nguy hiểm tới sức khỏe con người. Theo WHO (tổ chức y tế
thế giới) thì chất này là một trong mười nhóm hóa chất độc nhất. Ở dạng kim loại, các
hợp chất và muối của Hg rất độc. Khi cơ thể tiếp xúc, hít thở hay nuốt phải các chất
trên sẽ gây tổn thương não và gan.
Kim loại Hg: Tiếp xúc qua con đường không khí và được hít vào phổi. Thể hơi của Hg là
nguy hiểm nhất. Chất này được sinh ra từ hoạt động của các nhà máy nhiệt điện, lò đốt
rác hoặc cháy rừng, vỡ nhiệt kế.
ỨNG DỤNG CỦA MỘT SỐ KIM LOẠI NHÓM B 47 HOẠT ĐỘNG NHÓM
( Thời gian hoàn thành 6 phút)
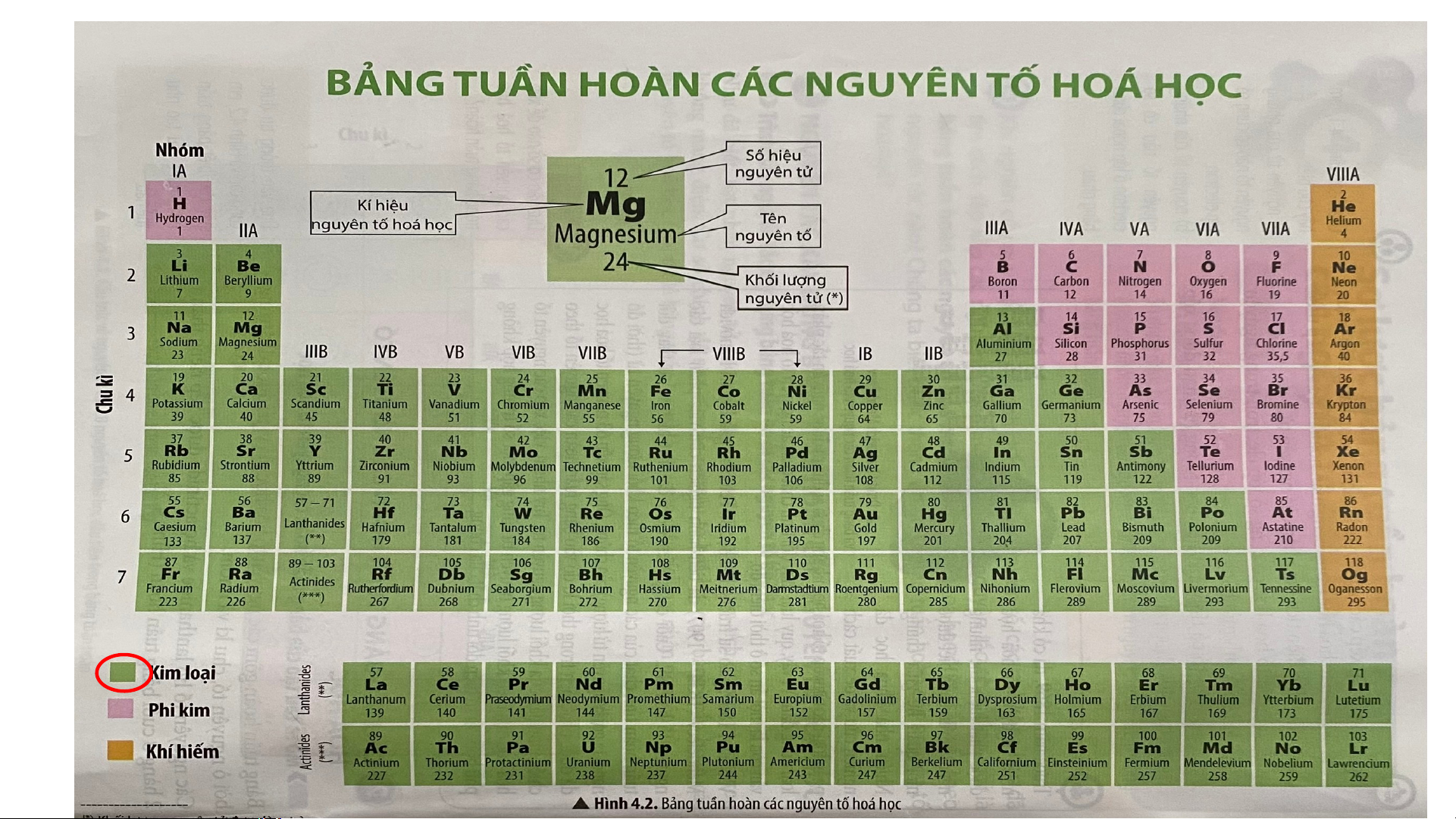
Câu 1. Nêu vị trí các nguyên tố phi kim . Cho biết ở điều kiện thường các nguyên tố
phi kim tồn tại ở những trạng thái nào?
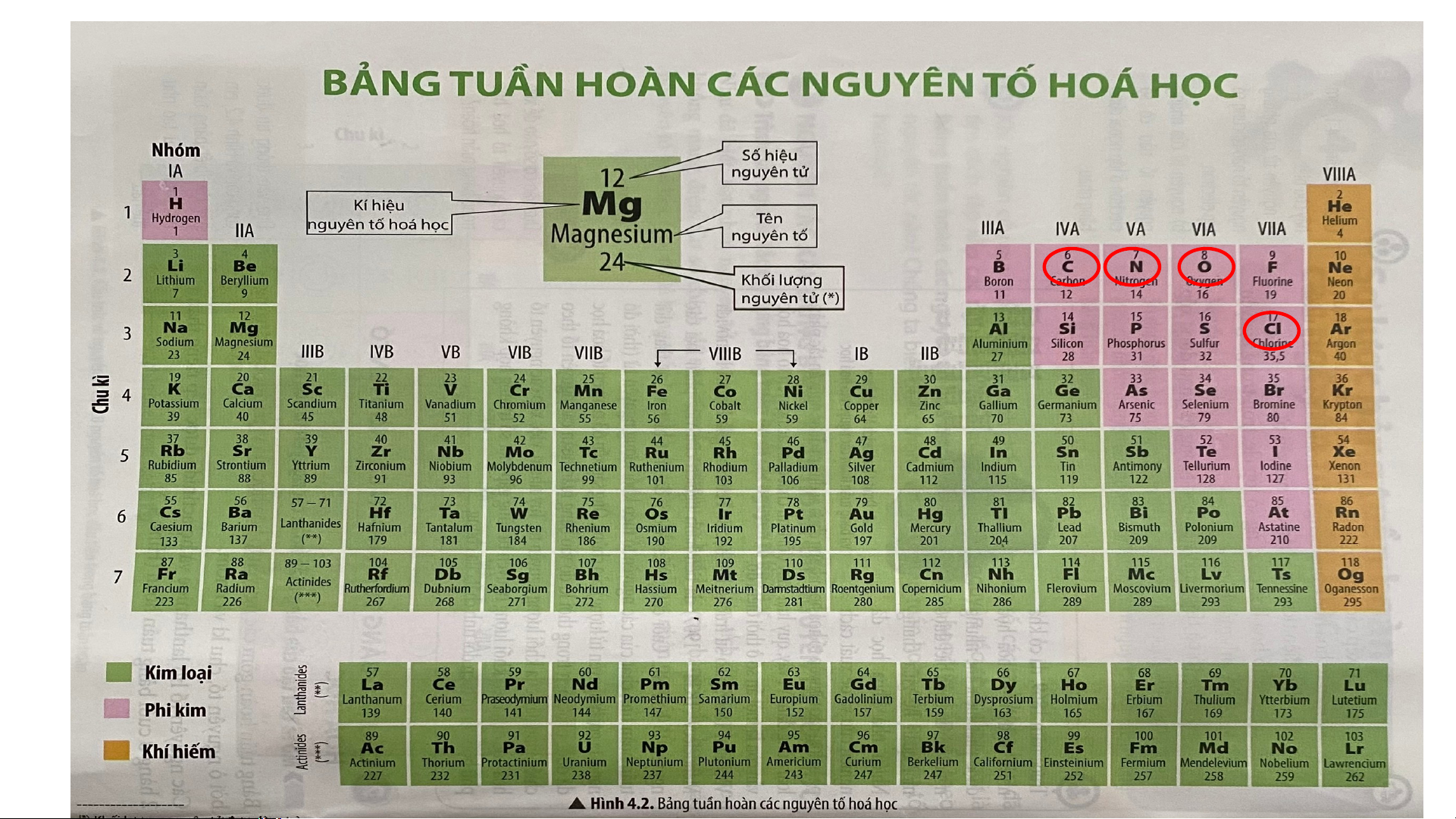
Câu 2. Cacbon, nitrogen, oxygen và cholorine là những nguyên tố phi kim phổ biến và
gần gũi trong đời sống. Em hãy cho biết vị trí (nhóm, chu kì) của chúng trong bảng tuần hoàn.
Câu 3. Tìm hiểu qua thực tế, hãy cho biết nguyên tố phi kim nào có trong thành phần
của kem đánh răng. Nguyên tố phi kim nào có trong thành phần muối ăn, chúng thuộc
chu kì và nhóm nào trong bảng tuần hoàn.
F- Fluorine dưới nhiều hình thức là thành phần hoạt chất phổ biến
nhất trong kem đánh răng để ngăn ngừa sâu răng. Fluoride có số
lượng nhỏ trong thực vật, động vật và một số nguồn nước tự nhiên.
Chất fluoride bổ sung trong kem đánh răng có tác dụng tốt đối với
quá trình hình thành men răng và xương. HOẠT ĐỘNG NHÓM
(Thời gian hoàn thành 6 phút)
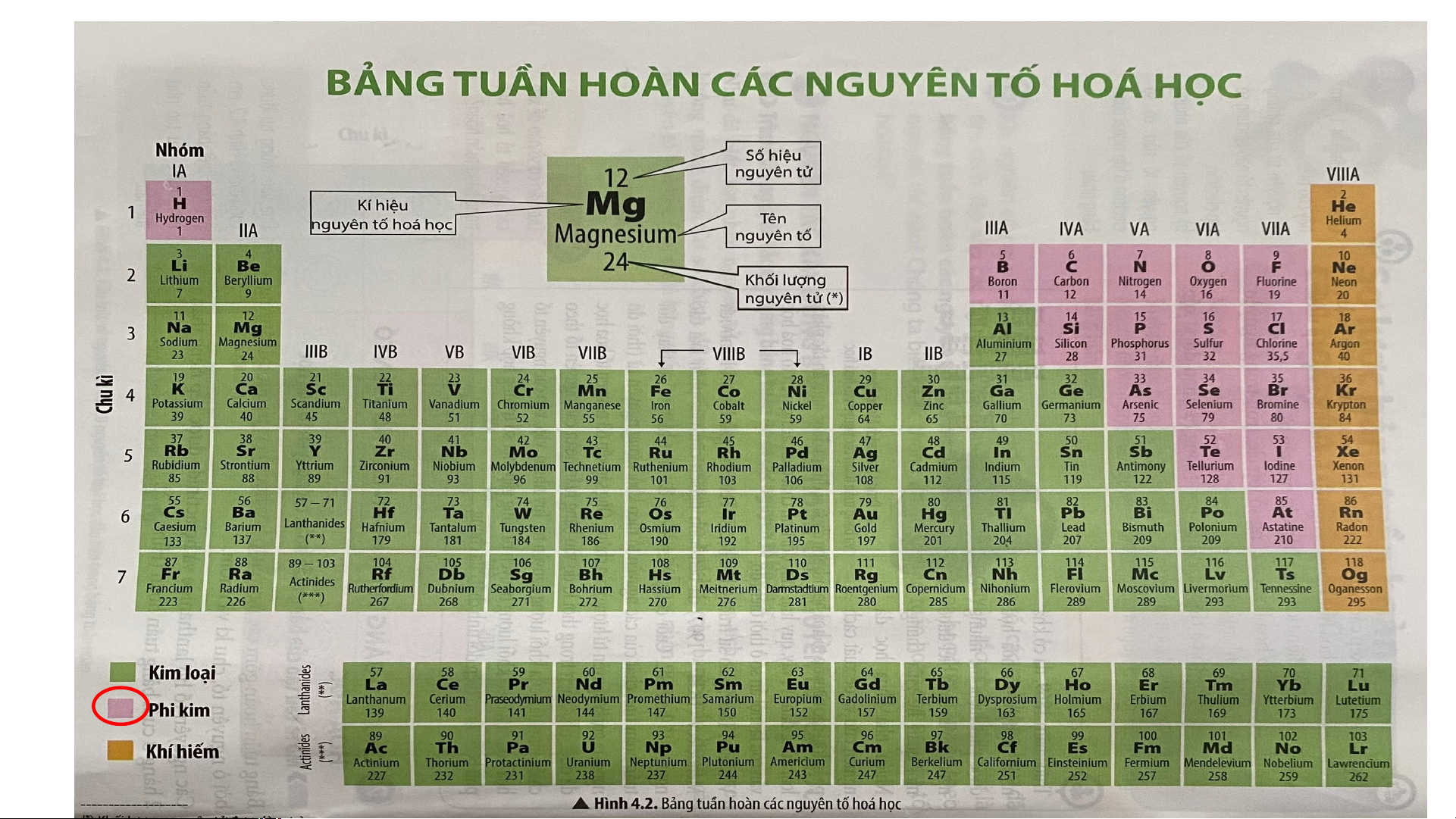
Câu 1. Cho biết vị trí của các nguyên tố khí hiếm
Câu 2. Sử dụng hình 4.1 em hãy nhận xét về số electron lớp ngoài
cùng trong nguyên tử của các nguyên tố khí hiếm.
Câu 3. Vào những dịp tết hay lễ hội, ở một số thành phố hoặc khu vui
chơi giải trí công cộng chúng ta thường thấy những khinh khí cầu đủ
màu sắc bay trên bầu trời. Theo em người ta đã bơm khí nào trong các
khí: oxygen, helium, hydrogen vào khinh khí cầu? Giải thích sự lựa chọn đó. 54 Các nguyên tố khí hiếm khi nghiên cứu các
nguyên tố khí hiếm, các
nhà hóa học phát hiện ra rằng các nguyên tố này
đều có số electron lớp ngoài cùng của nguyên tử bão hòa (2 hoặc 8 electron). Với cấu tạo
bền vững như vậy, chúng
hoạt động hóa học cực kì
yếu. Ở điều kiện thường, các nguyên tố này rất khó phản ứng hóa học
với các vật chất khác, để
hình thành các hợp chất.
ĐIỀU BẠN CẦN BIẾT
Khinh khí cầu, bóng bay có thể
bơm bằng khí helium hoặc hydrogen
vì chúng là các khí nhẹ nhất trong các chất khí.
Khi bạn ra đường mua bóng bay
được bơm hơi ở các điểm vui chơi
giải trí, hầu như tất cả những quả
bóng bay đó đều chỉ được bơm
bằng khí Hidro vì khí Heli rất đắt.
Nếu bán cho bạn 20.000 quả bóng
bay đó người ta cũng chỉ hòa hoặc
không đủ tiền mua khí Heli
Tuy nhiên, khi bơm bằng hydrogen
có thể nguy hiểm vì nó dễ phản ứng
với oxygen gây nổ, còn với helium là
khí ở điều kiện thường khó có thể
phản ứng với các vật chất khác nên an toàn hơn. Neon là loại đèn sử dụng ống thủy tinh với nhiều đường kính khác nhau. Chúng có thể phát sáng. Nhờ bên trong có chứa khí hiếm như Neon hoặc Argon, trong áp suất thấp. Neon sẽ cho ra ánh sáng màu đỏ. Còn Argon sẽ cho ra ánh sáng màu yếu hơn như vàng, xanh dương, xanh lá cây, trắng BÀI TẬP VỀ NHÀ
- Làm bài tập 4,5,6 sách giáo khoa, bài tập 2.10; 2.11; 2.12 sách bài tập.
- Đọc trước bài 5: Phân tử, đơn chất, hợp chất. 60
Cô cảm ơn các con đã tham gia
tiết học ngày hôm nay Bài 4
SƠ LƯỢC BẢNG TUẦN HOÀN
CÁC NGUYÊN TỐ HOÁ HỌC (tiết 2) : : : GV thực hiện:
Tổ Khoa Học Tự Nhiên
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62




