










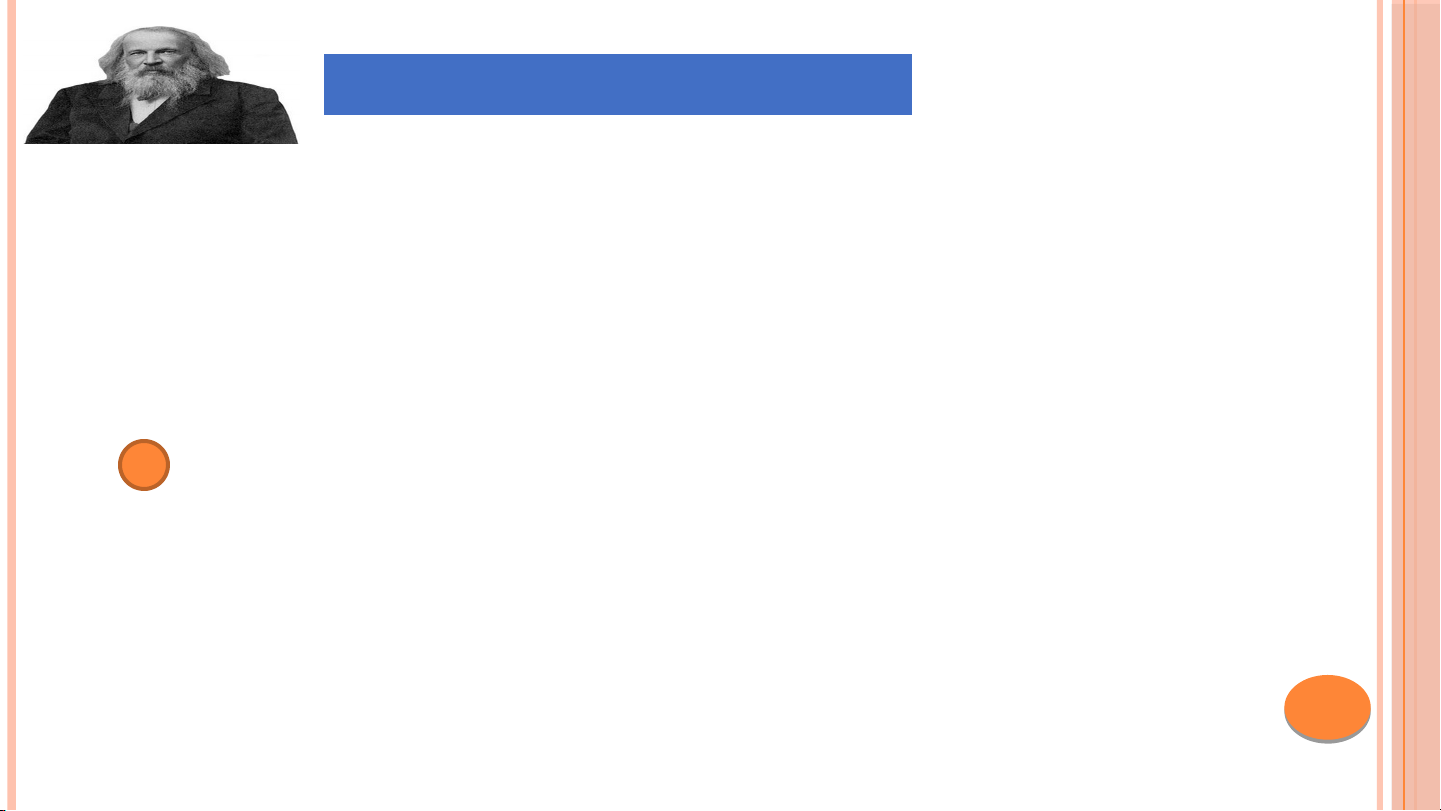
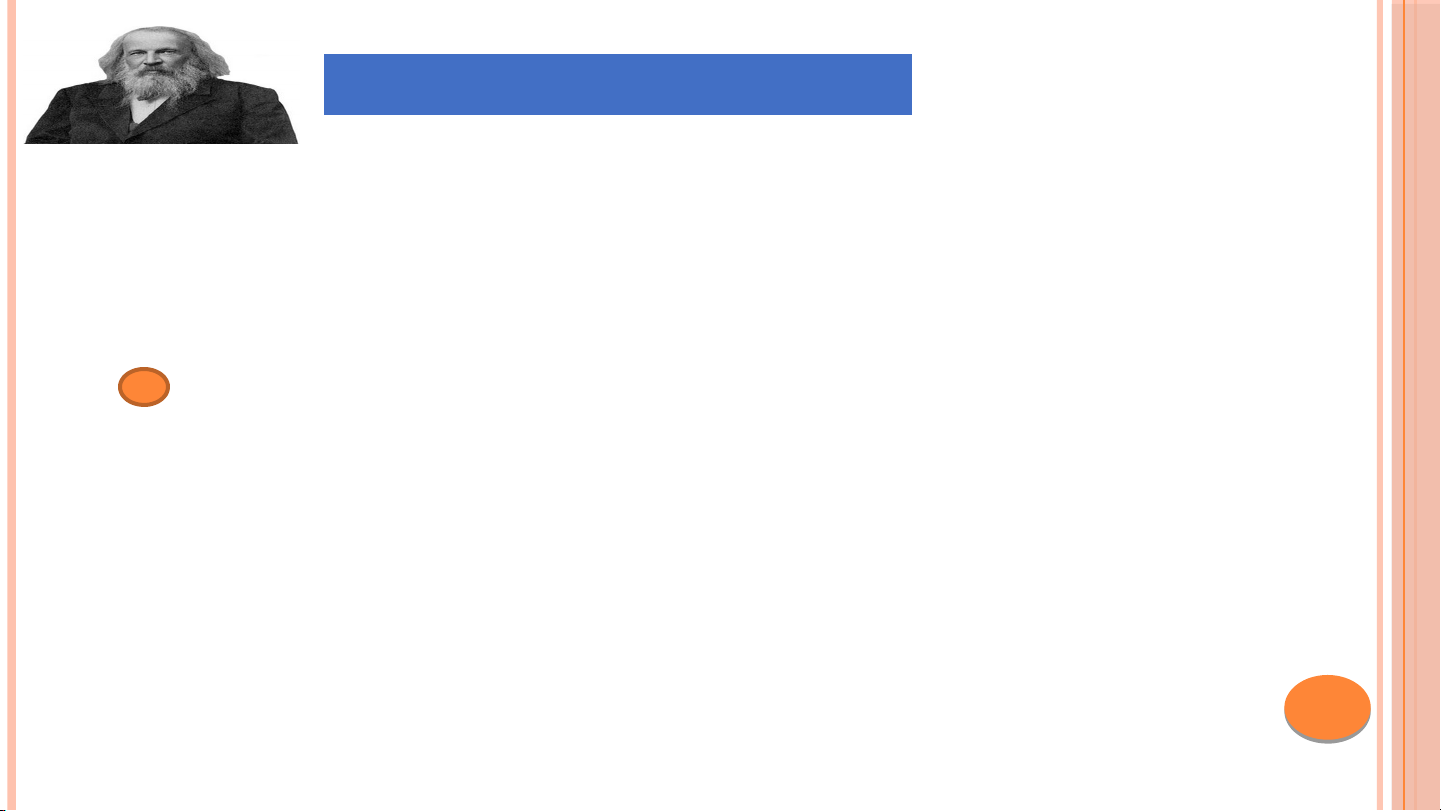
Preview text:
CHỦ ĐỀ 2: BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC BÀI 6:
CẤU TẠO CỦA BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC NỘI DUNG BÀI HỌC LỊCH SỬ PHÁT MINH
NGUYÊN TẮC SẮP XẾP CỦA BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC
CẤU TẠO CỦA BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC
LIÊN HỆ GIỮA CẤU HÌNH ELECTRON NGUYÊN TỬ VỚI VỊ
TRÍ CỦA NGUYÊN TỐ TRONG BẢNG TUẦN HOÀN PHÂ P N HÂ LOẠI LOẠ CÁC CÁ NGUY NG Ê UY N N T Ố Ố HÓA H ÓA HỌC H I. LỊCH SỬ PHÁT MINH
Được coi là cha đẻ của bảng tuần hoàn các nguyên tố hóa học
Công trình nghiên cứu có tính hệ thống, có thể
dự đoán được tính chất của các nguyên tố chưa tìm thấy.
Vd: Tính chất vật lí, khối lượng nguyên tử,…
Mendeleev (1834 – 1907)
Năm 1871, Mendeleev đưa ra định luật tuần hoàn: Tính
chất của các đơn chất, cấu tạo và tính chất các hợp chất
của chúng có tính tuần hoàn theo khối lượng nguyên tử
của các nguyên tố.
Dự đoán có 10 nguyên tố mới
Bảng tuần hoàn hóa học hiện nay dựa trên cơ sở “ số
hiệu nguyên tử - tính chất’’
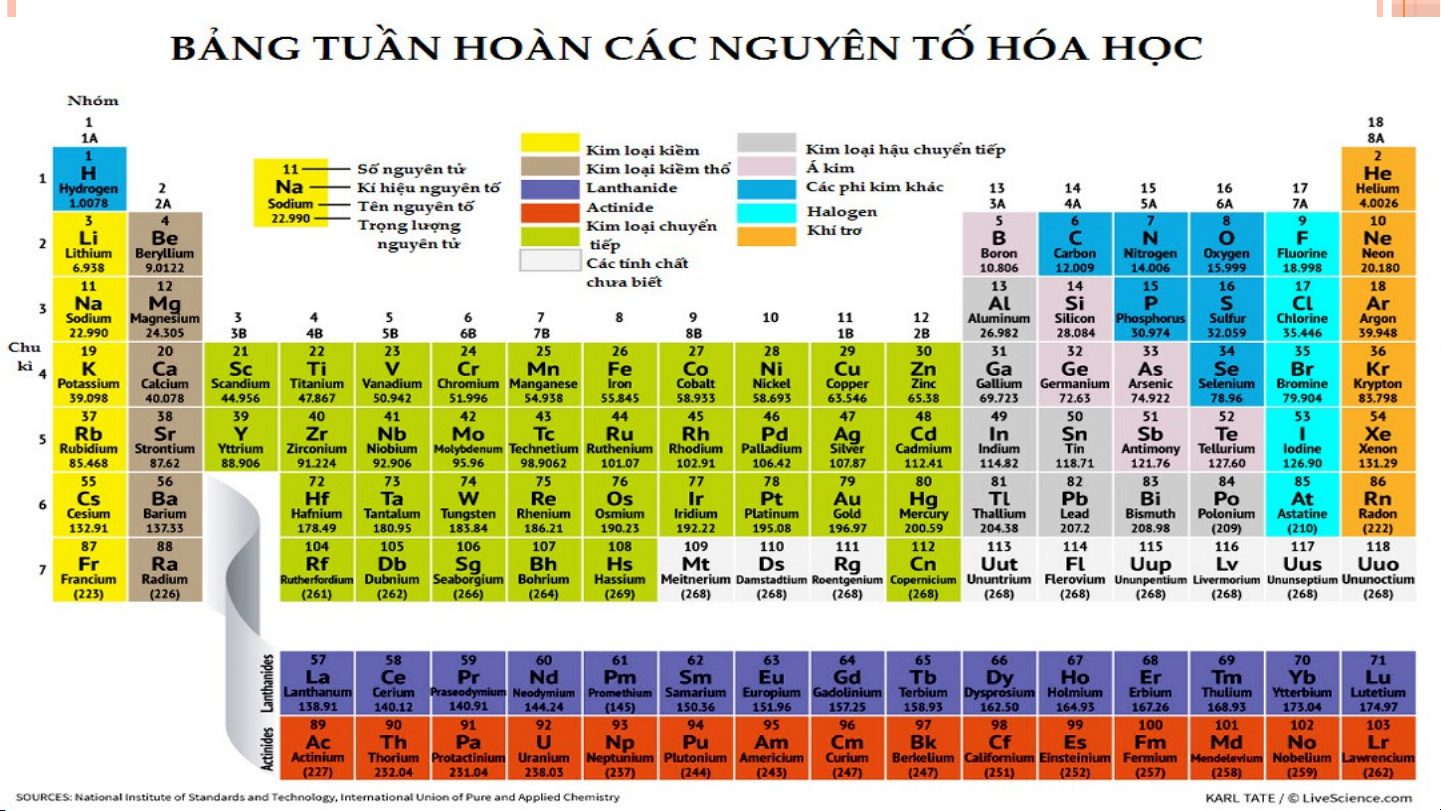
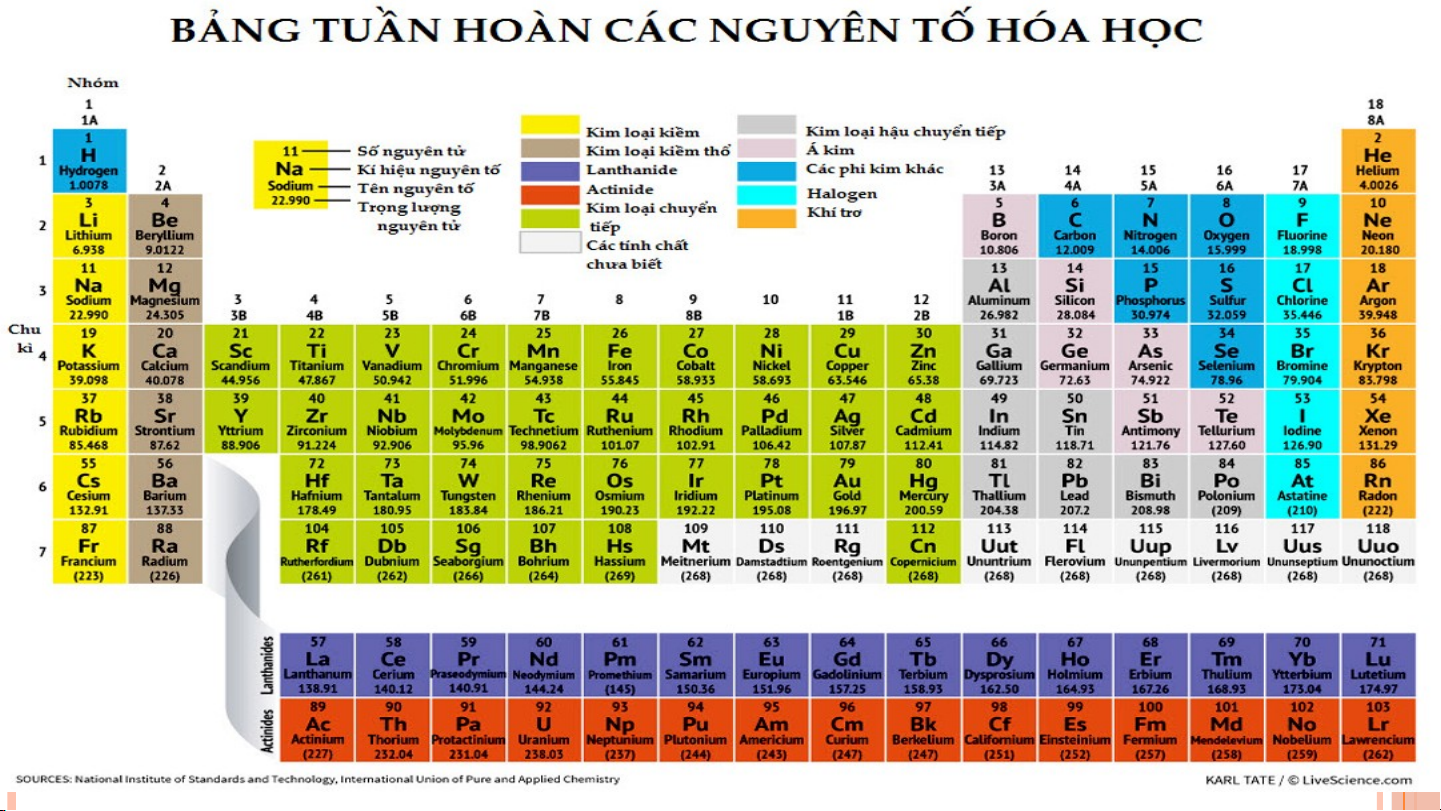
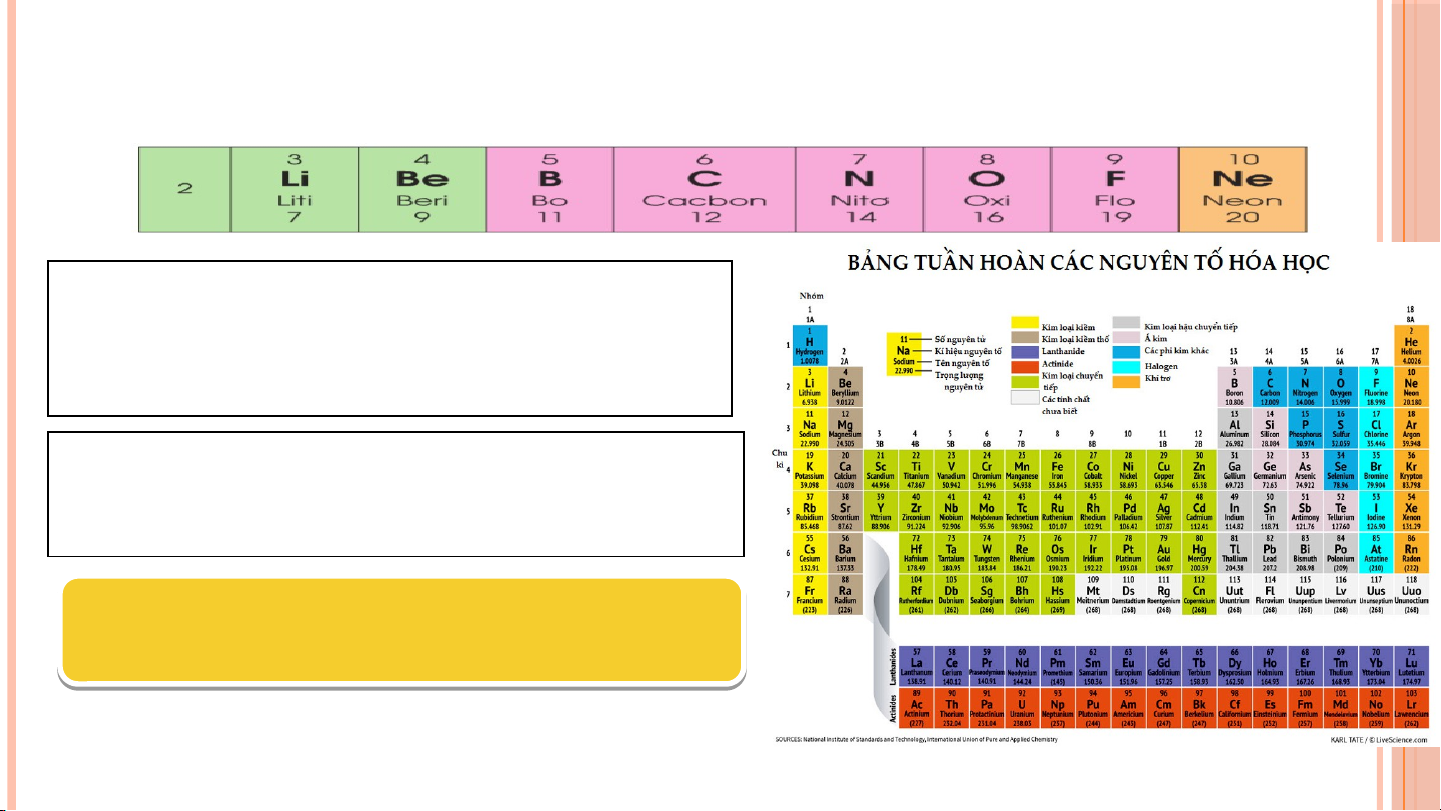
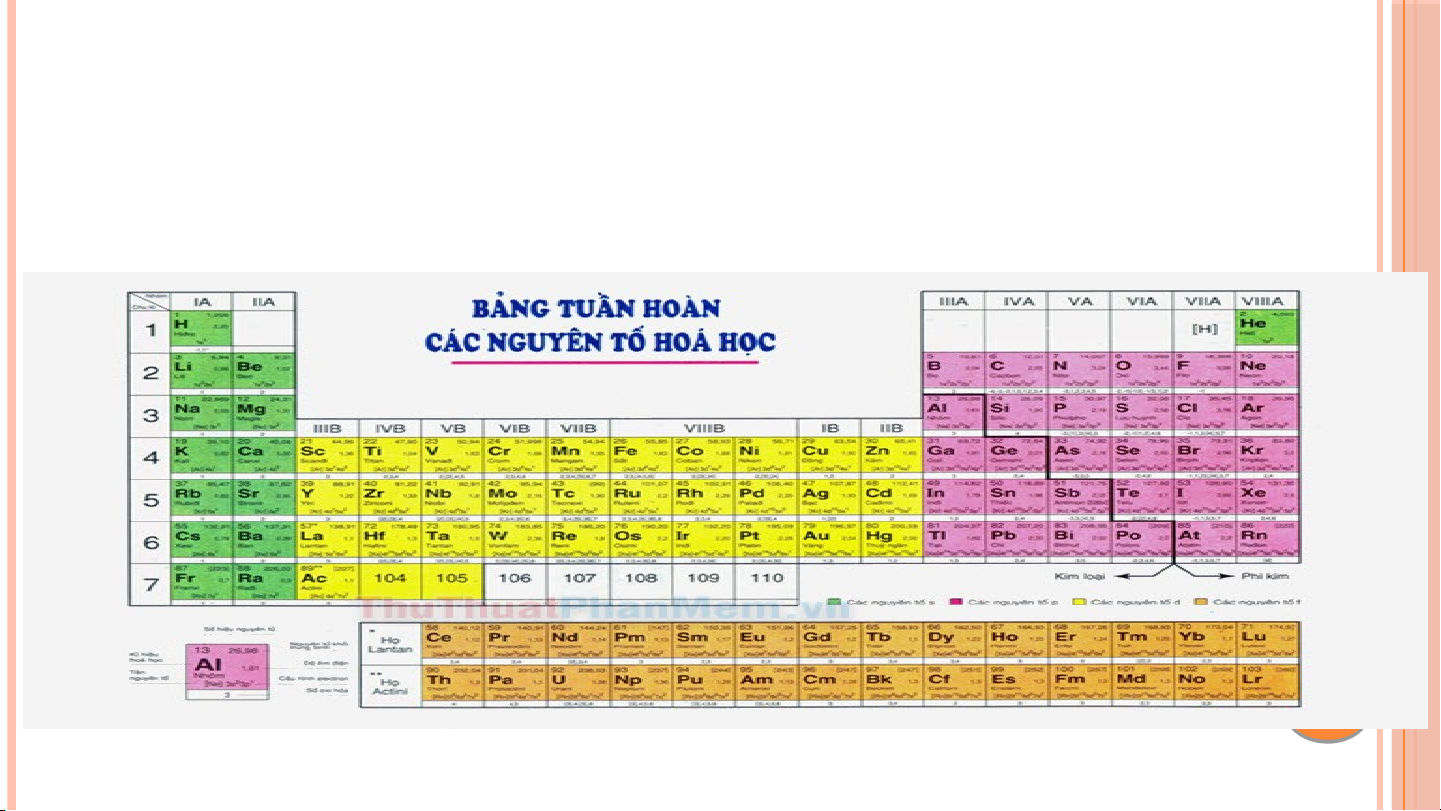
II. NGUYÊN TỐ SẮP XẾP CỦA BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC Các nguyên t ố hóa h c ọ đ c ượ s p ắ x p ế t ừ trái qua ph i ả và t ừ trên xu n ố g d i ướ theo chi u ề tăng d n ầ đi n ệ tích 1 hạt nhân Các nguyên t ố mà cùng s ố l p ớ electron đ c ượ x p ế vào 2 cùng m t ộ hàng.
Các nguyên tố mà nguyên t ử có s ố electron hóa tr ị 3 nh n ư hau đ c ượ x p ế vào cùng m t ộ c t ộ
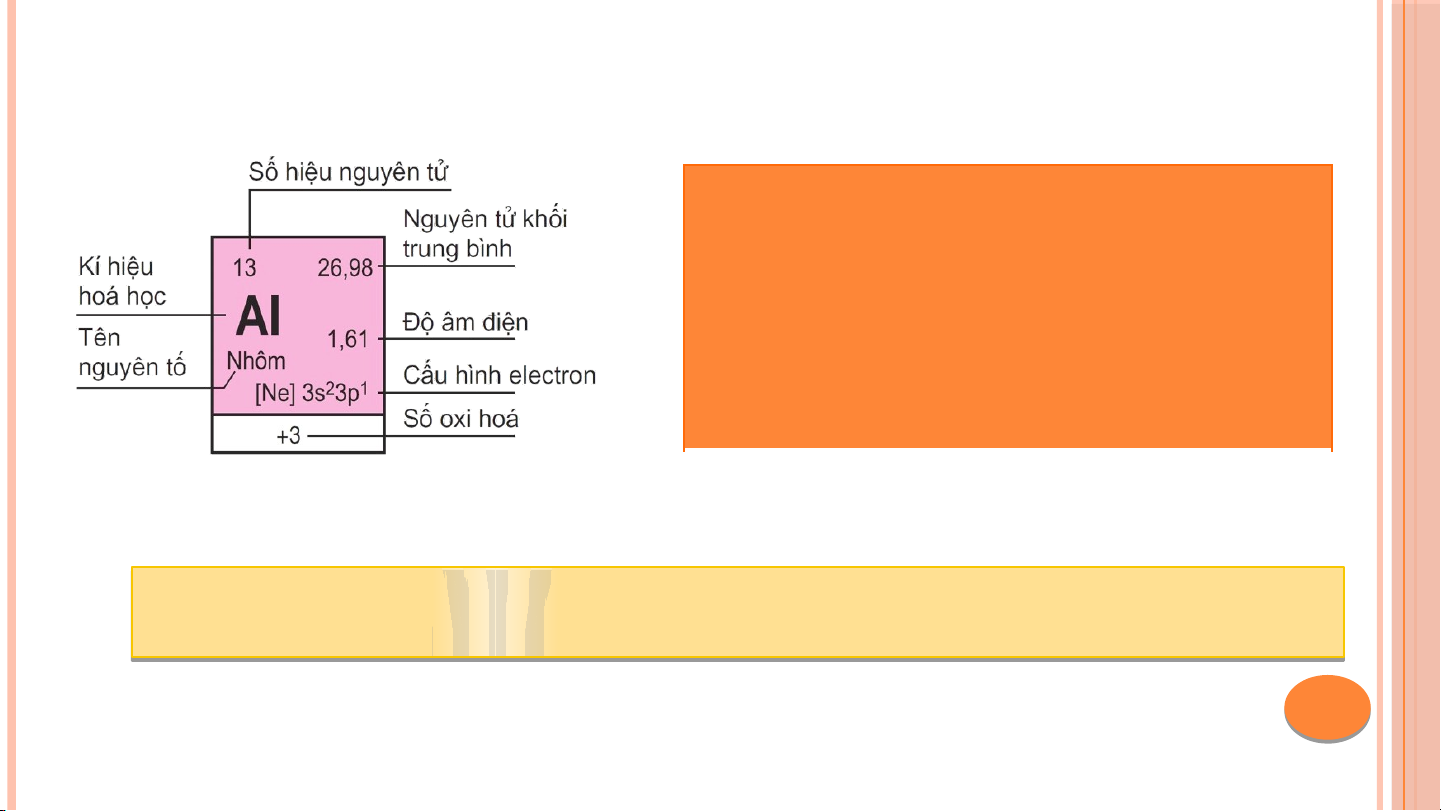
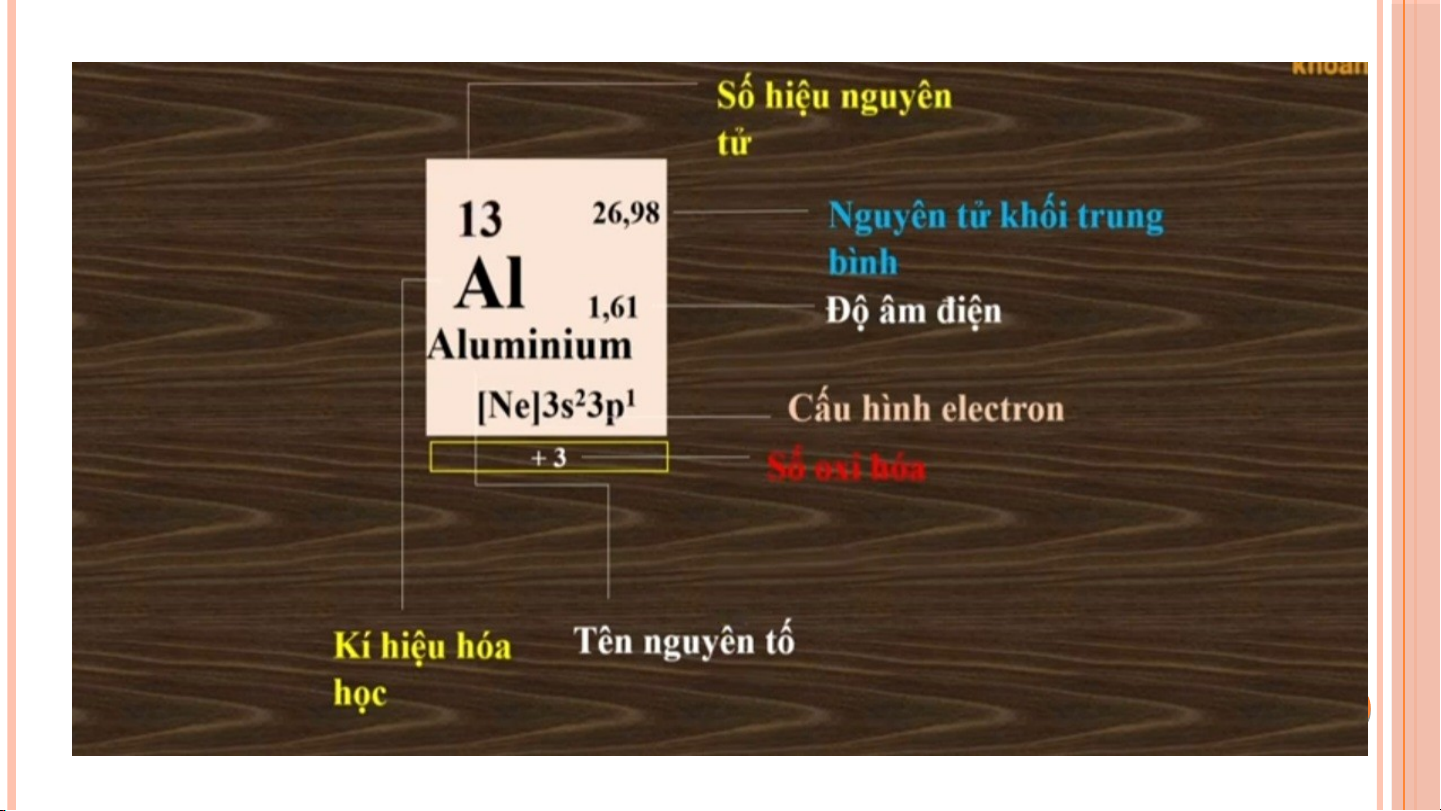
III. CẤU TẠO CỦA BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC Ô N Ô G N U G Y U Ê Y N N TỐ T BẢ B N Ả G N G TU T Ầ U N Ầ N CHU CH U KÌ K HO H À O N À N HÓ H A Ó A HỌ H C Ọ NHÓM 1. Ô NGUYÊN TỐ Cho bi t ế : • Kí hi u ệ hóa h c ọ • Tên nguyên tố • Số hi u ệ nguyên tử • Nguyên tử kh i ố trung bình
• ………………………………… Số t S hứ tự ô nguyên ự ô nguyê t ố = s ố = ố hiệu nguyên tử 2. CHU KÌ Là t p ậ h p ợ các nguyên t ố mà nguyên t ử có cùng s ố l p ớ eletron trong nguyên t ử đư c ợ x p ế thành m t ộ hàng theo chi u ề tăng d n ầ c a ủ đi n ệ tích h t ạ nhân.
Bảng tuần hoàn gồm 7 chu kì., được đánh STT từ 1 đến 7.
1, 2, 3 là chu kì nhỏ. 4, 5, 6, 7 là chu kì lớn Số S thứ tự ự chu c kì = s = ố lớp ele e c le tr c on 3. NHÓM
Nhóm nguyên tố là tập hợp các nguyên tố hóa học mà nguyên
tử có cấu hình electron tương tự nhau, được xếp thành một cột
theo chiều tăng dần điện tích hạt nhân từ trên xuống dưới. Nhóm A 8 nhóm
Các nguyên tử trong cùng 1 nhóm
A có cấu hình tương tự nhau =>
Tính chất hóa học tương tự nhau IA → VIII A 8 nhóm Nhóm B IB → VIII B Nhóm VIII B có ba cột
STT ô nguyên tố = Số hiệu nguyên tử nguyên tố
STT chu kì = số lớp electron trong nguyên tử
STT nhóm A = Số electron lớp ngoài cùng của nguyên tử nguyên tố đó (Trừ He)
Ví dụ: Nguyên tử C (Z = 6). Cấu hình e: 1s2 2s22p2
• Số hiệu nguyên tử là 6 => ô số 6
• Nguyên tử có 2 lớp e => thuộc chu kì 2
• Nguyên tử có 4e lớp ngoài cùng => Thuộc nhóm IVA C C th
t uộc ô số 6, chu kì ì2, nhóm IVA V
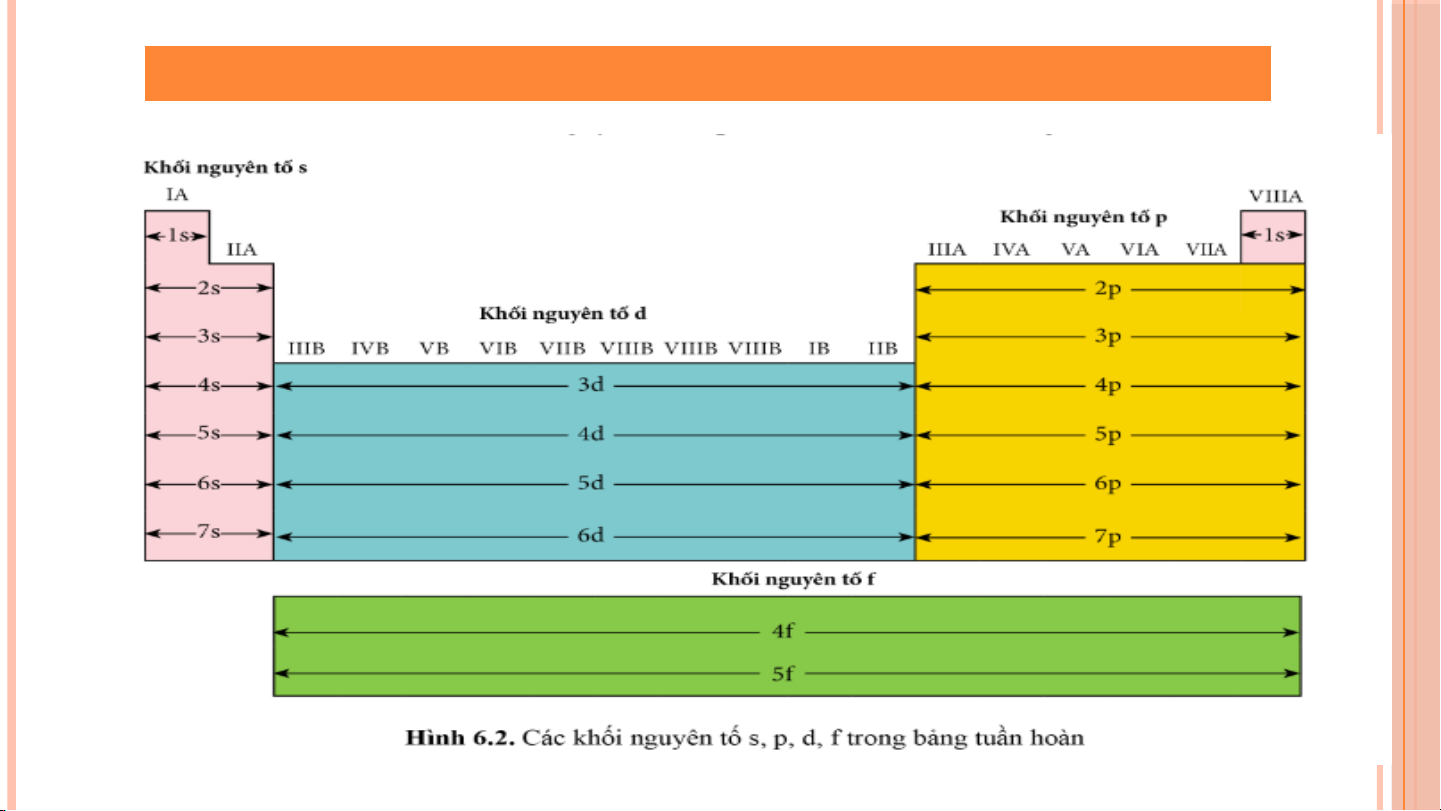
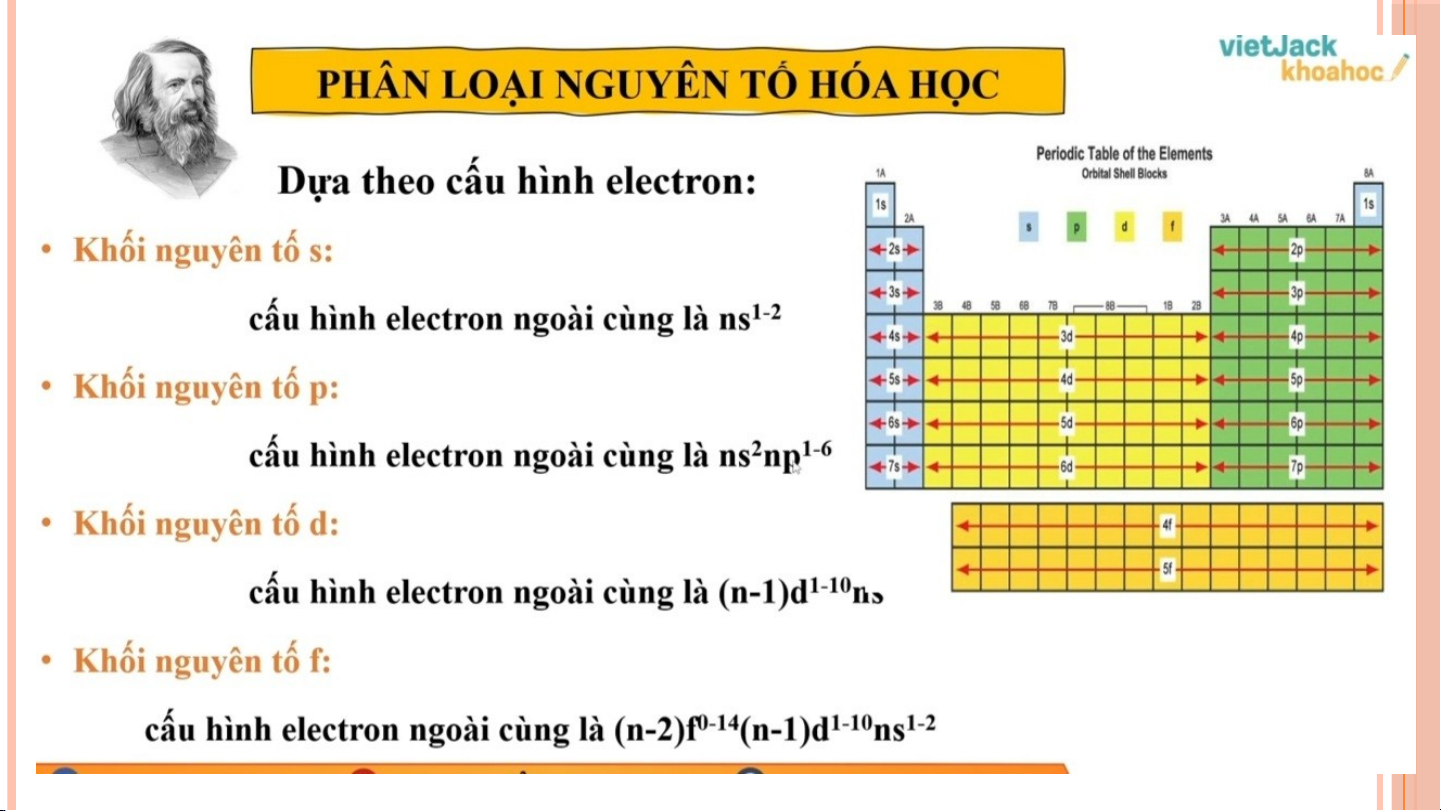
1. DỰA THEO CẤU HÌNH ELECTRON
2. DỰA THEO TÍNH CHẤT HÓA HỌC
Dựa theo tính chất hóa học: cơ bản có thể phân loại nguyên tố
thành kim loại, phi kim, khí hiếm. CỦNG CỐ
Câu 1: Trong bảng tuần hoàn, số thứ tự của ô nguyên tố có giá trị bằng? A. Số khối
B. Khối lượng nguyên tử C. Số hiệu nguyên tử C D. Tất cả đều đúng CỦNG CỐ
Câu 2: Các nguyên tố trong một chu kì có cùng?
A. Số electron lớp ngoài cùng
B. Khối lượng nguyên tử C. Điện tích hạt nhân D. D Số lớp electron CỦNG CỐ
Câu 3: Trong bảng tuần hòa các nguyên tố hóa học, số chu kì nhỏ và chu kì lớn là A. 3 và 3 B. 3 B và 4 C. 4 và 3 D. 4 và 4
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- I. LỊCH SỬ PHÁT MINH
- Slide 6
- Slide 7
- Slide 8
- II. NGUYÊN TỐ SẮP XẾP CỦA BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC
- Slide 10
- III. CẤU TẠO CỦA BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC
- 1. Ô NGUYÊN TỐ
- Slide 13
- 2. CHU KÌ
- Slide 15
- 3. NHÓM
- Slide 17
- Slide 18
- Slide 19
- 1. Dựa theo cấu hình electron
- Slide 21
- 2. Dựa theo tính chất hóa học
- Slide 23
- Slide 24
- Slide 25




