

Preview text:
Bài 2: Một số oxit quan trọng (tiết 2)
B. Lưu huỳnh đioxit ( SO ) 2
I. TÍNH CHẤT CỦA LƯU HUỲNH ĐIOXIT
1. Tính chất vật lí ?) •Nhắ Tín c lại tính chất hó h chất hóa h a ọc của h ọc của oxit a xit o:xit axit.
- Lưu huỳnh đioxit là chất khí - Tác dụng với nước
không màu, mùi hắc, độc
- Tác dụng với dung dịch bazơ 64
- Nặng hơn không khí (d )
- Tác dụng với oxit bazơ. 29
2. Tính chất hóa học
a) Tác dụng với nước
?) Viết phương trình phản ứng.
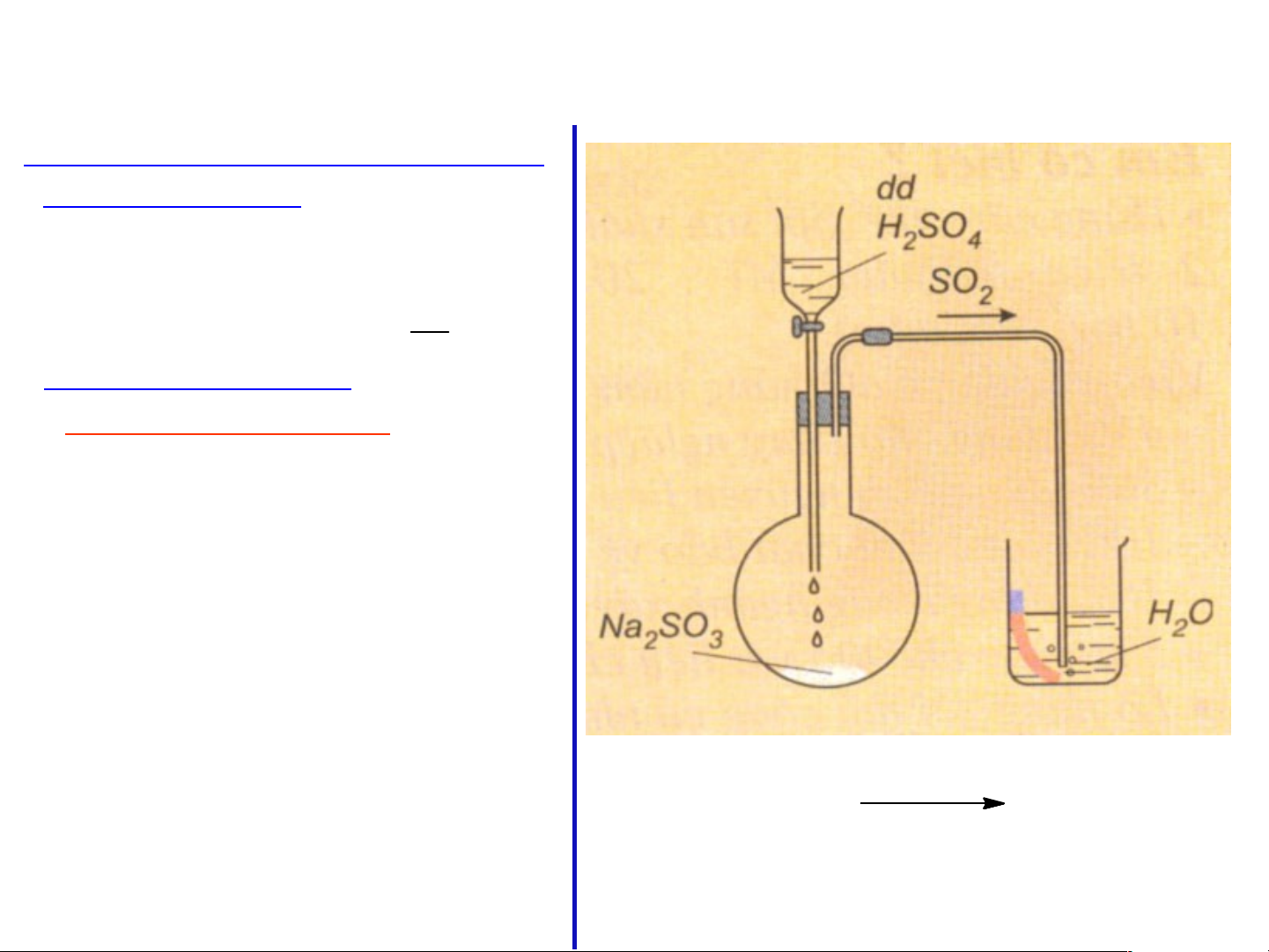
?) Dựa vào hình vẽ, hãy mô tả cách tiến h S àn O2( h t k) h í ngh + H iệ 2 m O(l) và n êu h iện tư H2 ợn SOg xảy ra. 3(dd)
I. TÍNH CHẤT CỦA LƯU HUỲNH ĐIOXIT:
•Tính chất hóa học của oxit axit :
1. Tính chất vật lí
- Lưu huỳnh đioxit là chất khí - Tác dụng với nước
không màu, mùi hắc, độc
- Tác dụng với dung dịch bazơ 64
- Nặng hơn không khí (d )
- Tác dụng với oxit bazơ. 29
2. Tính chất hóa học
a) Tác dụng với nước SO2(k) + H2O(l) H2SO3(dd)
b) Tác dụng với bazơ
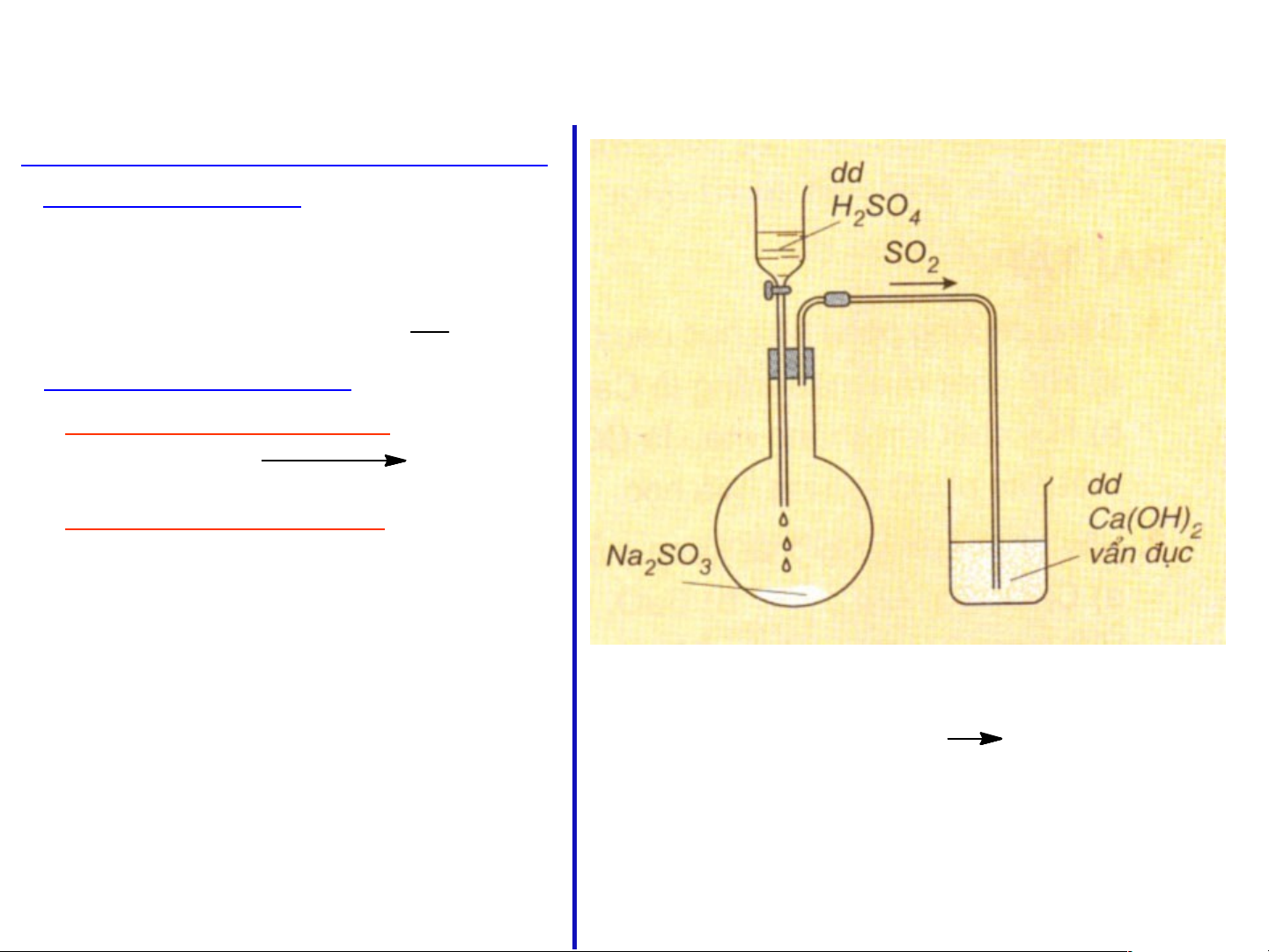
Dựa vào hình vẽ, hãy mô tả cách tiến hành
?) Viết phương trình phản ứng.
thí nghiệm và nêu hiện tượng xảy ra.
SO2(k) + Ca(OH)2(dd) CaSO3(r) + H2O
I. TÍNH CHẤT CỦA LƯU HUỲNH ĐIOXIT
•Tính chất hóa học của oxit axit :
1. Tính chất vật lí
- Lưu huỳnh đioxit là chất khí - Tác dụng với nước
không màu, mùi hắc, độc
- Tác dụng với dung dịch bazơ 64
- Nặng hơn không khí (d )
- Tác dụng với oxit bazơ. 29
2. Tính chất hóa học
a) Tác dụng với nước
Lưu huỳnh đioxit tác dụng với oxit bazơ SO2(k) + H2O(l) H2SO3(dd)
như Na O, CaO… tạo muối sunfit. Hãy
b) Tác dụng với bazơ 2
viết phương trình phản ứng?
SO2(k) + Ca(OH)2(dd) CaSO3(r) + H2O SO
c) Tác dụng với oxit bazơ 2(k) + CaO(r) CaSO3(r)
KL: Lưu huỳnh đioxit là oxit axit.
I. TÍNH CHẤT CỦA LƯU HUỲNH ĐIOXIT
Cho muối sunfit tác dụng với axit (dung dịch HCl,
1. Tính chất vật lí
H SO ), thu khí SO vào lọ bằng cách đẩy 2 4 2
- Lưu huỳnh đioxit là chất khí không khí.
không màu, mùi hắc, độc Na SO + H SO Na SO + Th H uốc O + SO 2 3 2 4 2 4 2 2 diệt 64 2. Trong công nghiệp - Nặng hơn không khí nấm (d ) Mốc 29
- Đốt lưu huỳnh trong không khí.
2. Tính chất hóa học o S + O t SO
a) Tác dụng với nước Axit 2 2 H SO
- Đốt quặng pirit sắt (FeS ) thu được SO . 2 4 SO o 2 2 SO2(k) + H2O(l) H2SO3(dd) t
b) Tác dụng với bazơ 4FeS + 11O 2Fe O + 8SO 2 2 2 3 2
SO2(k) + Ca(OH)2(dd) CaSO3(r) + H2O
c) Tác dụng với oxit bazơ SO2(k) + CaO(r) CaSO3(r)
KL: Lưu huỳnh đioxit là oxit axit.
Tẩy trắng bột gỗ
II. ỨNG DỤNG CỦA LƯU HUỲNH ĐIOXIT
III. ĐIỀU CHẾ LƯU HUỲNH ĐIOXIT
1. Trong phòng thí nghiệm
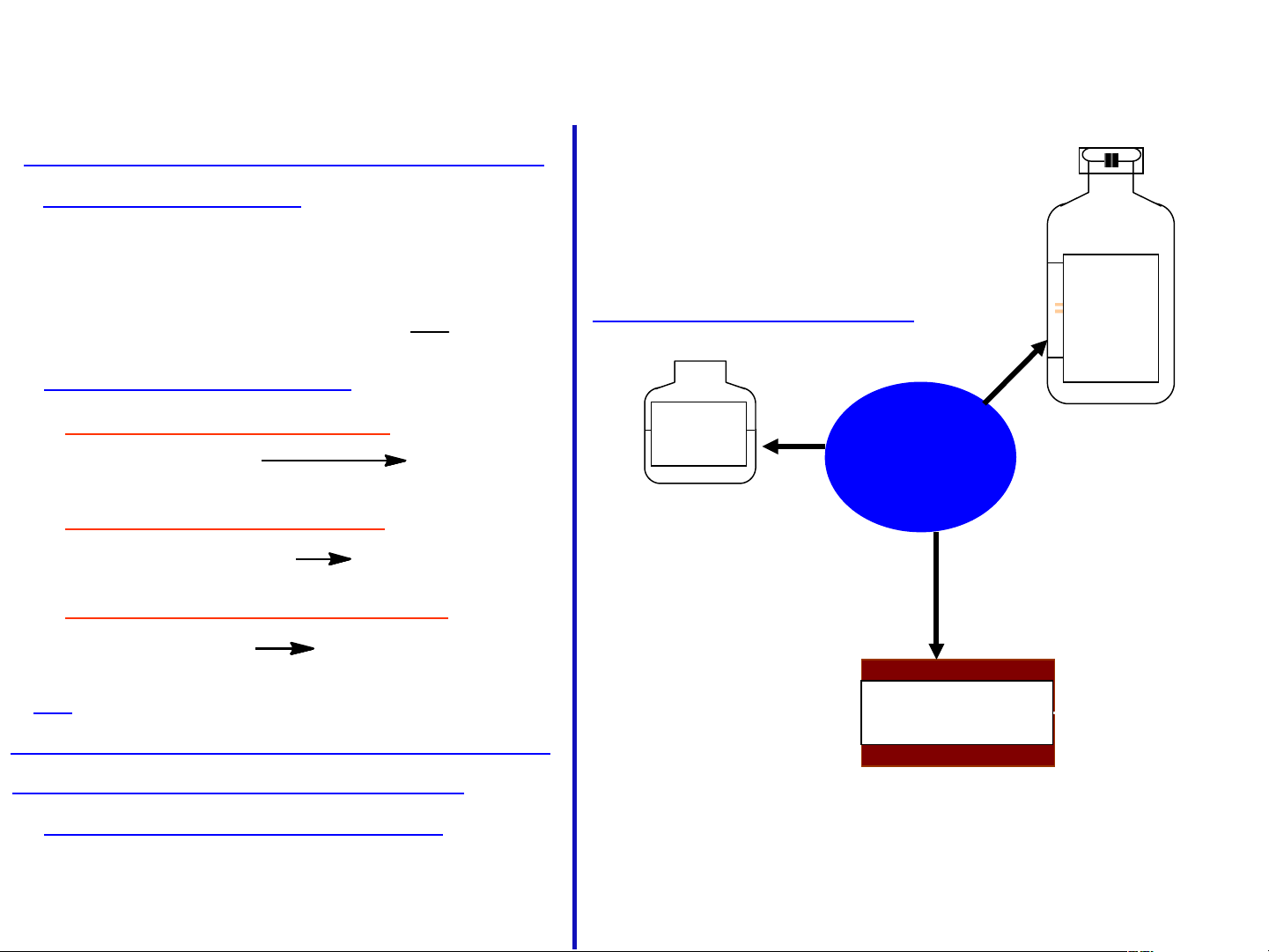
?) Dựa vào sơ đồ trên cho biết ứng
dụng của lưu huỳnh đioxit.
I. TÍNH CHẤT CỦA LƯU HUỲNH ĐIOXIT
Cho muối sunfit tác dụng với axit (dung dịch HCl,
H SO ), thu khí SO vào lọ bằng cách đẩy 2 4 2
1. Tính chất vật lí không khí.
- Lưu huỳnh đioxit là chất khí Na SO + H SO Na SO + H O + SO 2 3 2 4 2 4 2 2
không màu, mùi hắc, độc 64 2. Trong công nghiệp
- Nặng hơn không khí (d ) 29
- Đốt lưu huỳnh trong không khí.
2. Tính chất hóa học o S + O t SO
a) Tác dụng với nước 2 2
- Đốt quặng pirit sắt (FeS ) thu được SO . 2 2 SO2(k) + H2O(l) H2SO3(dd) o t
b) Tác dụng với bazơ 4FeS + 11O 2Fe O + 8SO 2 2 2 3 2
SO2(k) + Ca(OH)2(dd) CaSO3(r) + H2O * Bài Bà tập 1 tập 2: : Có nh Cho ữ 1 ng chất kh 5,8 gam kalí sau:CO i sunfit tá , c H d , ụnN g ,
c) Tác dụng với oxit bazơ 2 2 2
vừa đủ với 200 ml dung dịch axit H SO . SO
SO , O . Hãy cho biết chất nào có tính chấ 2 t4 sau: 2(k) + CaO(r) CaSO3(r) 2 2
a/ Viết phương trình phản ứng.
KL: Lưu huỳnh đioxit là oxit axit.
a/ Cháy được trong không khí. ( H ) 2
II. ỨNG DỤNG CỦA LƯU HUỲNH ĐIOXIT
b/ Tính thể tích khí SO thoát ra ở (đktc).
b/ Tác dụng được với nư 2 ớc tạo thành dung dịch
III. ĐIỀU CHẾ LƯU HUỲNH ĐIOXIT c/ axi T t ính. ( n CO ồn , SO ) 2 2
g độ mol của dung dịch axit đã dùng.
1. Trong phòng thí nghiệm c/ Đ ổi màu g ( B iấ i y qu ết: ỳ K = tím 39, ẩm S = thà 3 nh đỏ 2, O . ( C = 16) O , SO ) 2 2
d/ Làm đục nước vôi trong. ( CO , SO ) 2 2
- Làm bài tập 1, 2, 3, 5, 6 / sgk trang 11.
Bài 6: + Tính số mol hai chất SO và Ca(OH) . 2 2
+ Lập tỉ lệ số mol để xác định chất nào còn dư, chất
nào phản ứng hết. Tính theo số mol chất phản ứng hết.
- Nghiên cứu, chuẩn bị trước bài 3: Tính chất hóa học của axit.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7




