




















Preview text:
CHỦ ĐỀ 2: PHÂN Bài 6: Giới thiệu TỬ về liên kết hóa học NỘI DUNG BÀI HỌC
I. Vỏ nguyên tử khí hiếm II. Liên kết ion
III. Liên kết cộng hóa trị
IV. Chất ion, chất cộng HT
V. Một số t/c của chất ion và chất cộng HT I. Vỏ nguyên tử khí hiếm
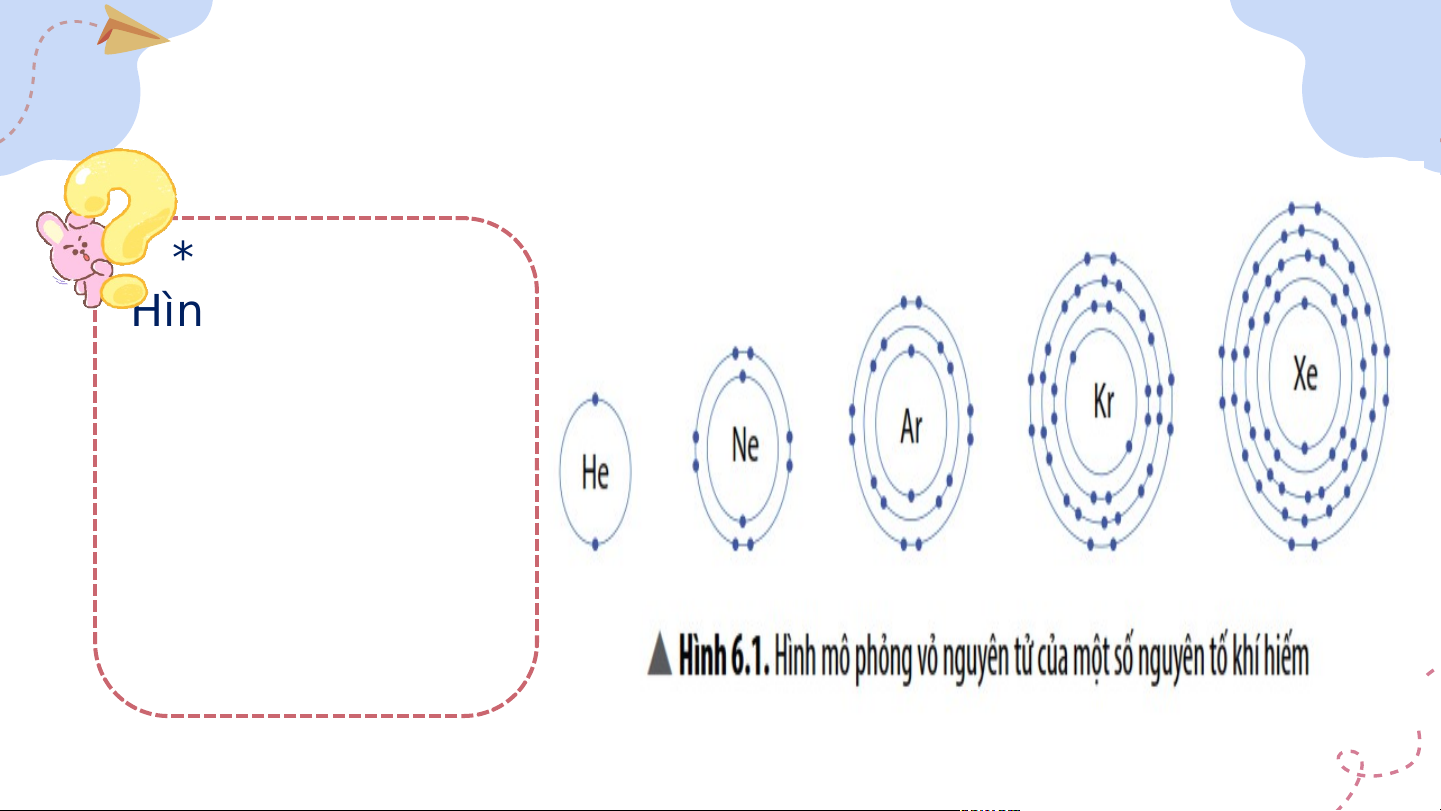
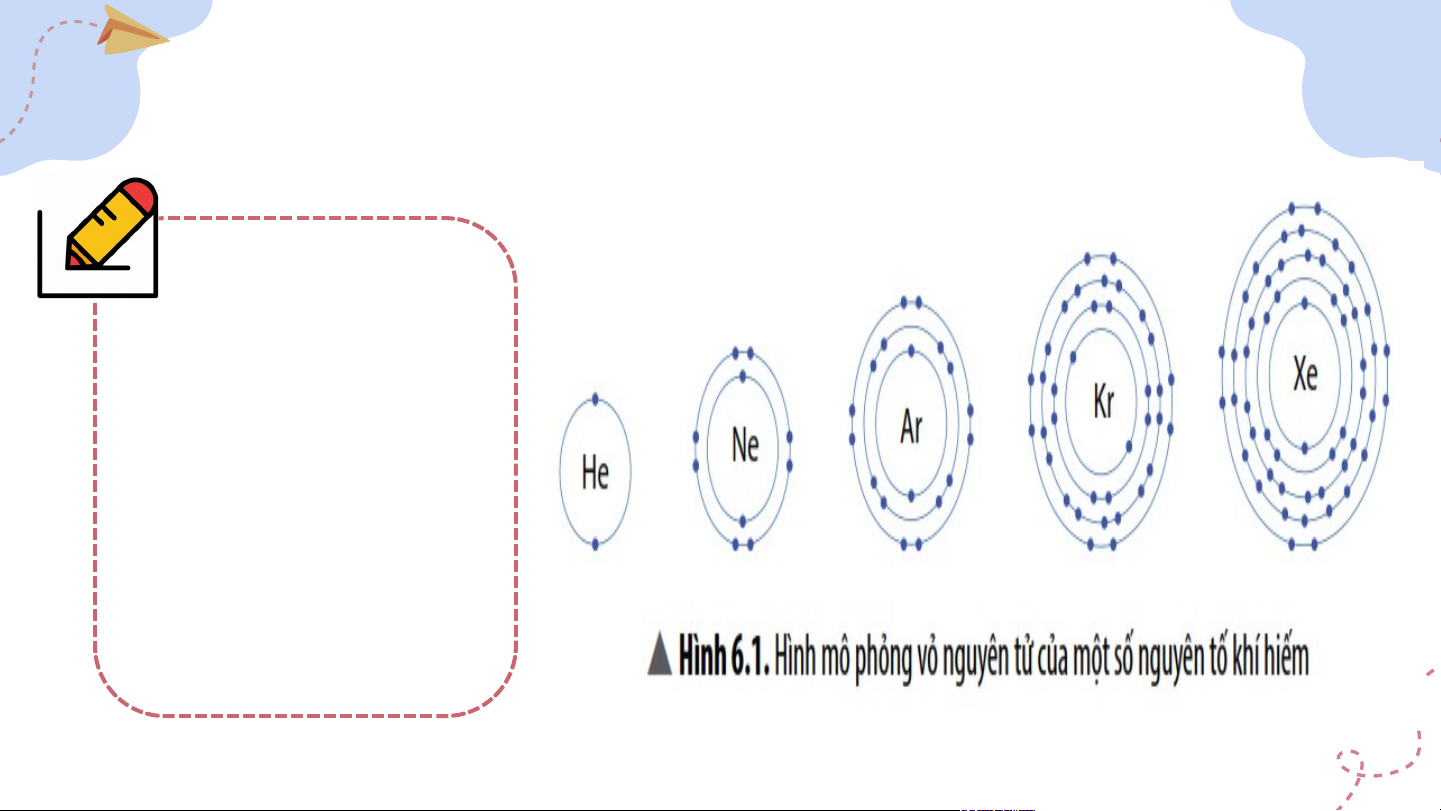
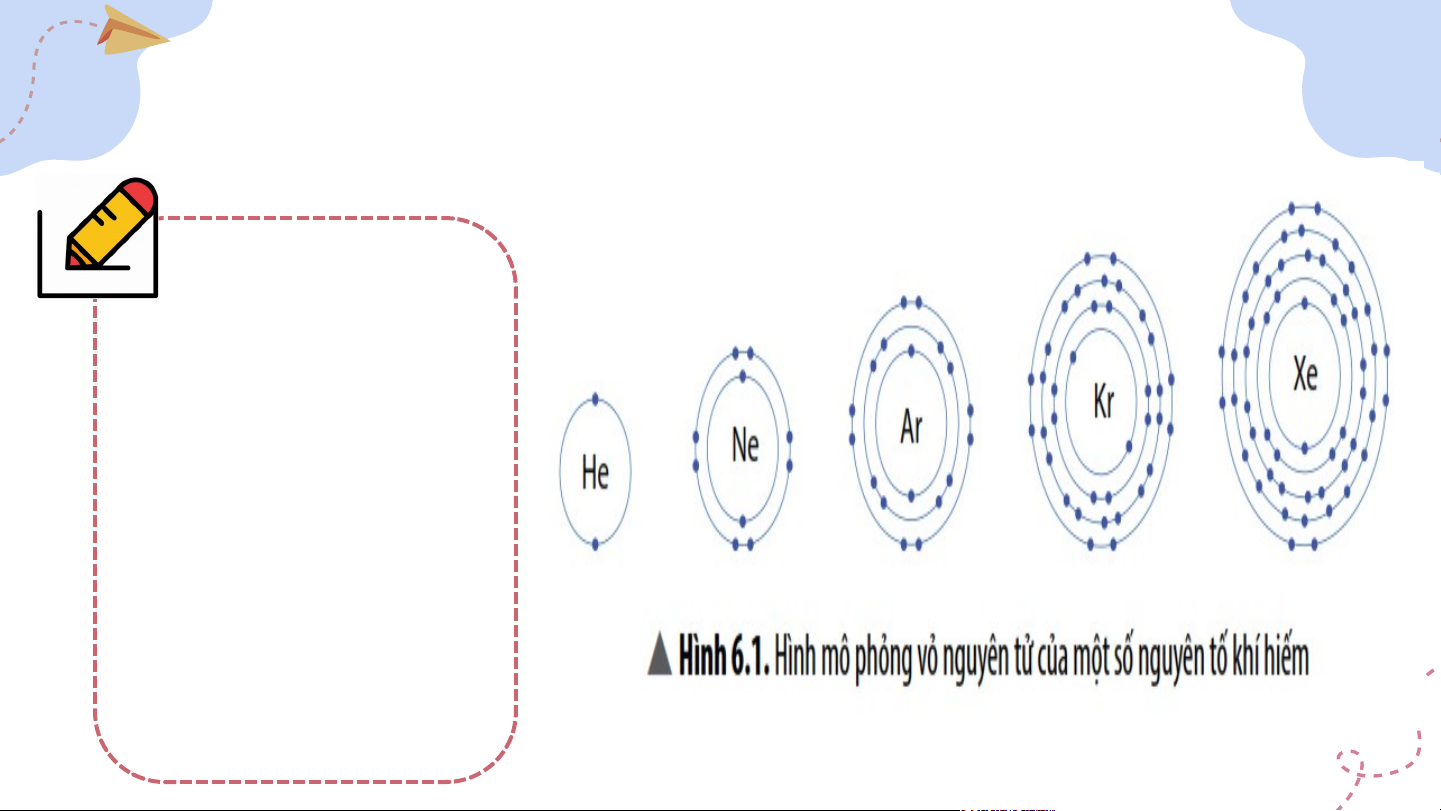
I. Vỏ nguyên tử khí hiếm * Quan sát Hình 6.1 và cho biết: Trừ Helium, vỏ nguyên tử của các nguyên tố còn lại có điểm gì giống và khác nhau?
I. Vỏ nguyên tử khí hiếm - Helium có 2 e lớp ngoài cùng. - Các nguyên tố khí hiếm còn lại đều có 8 e lớp ngoài cùng.
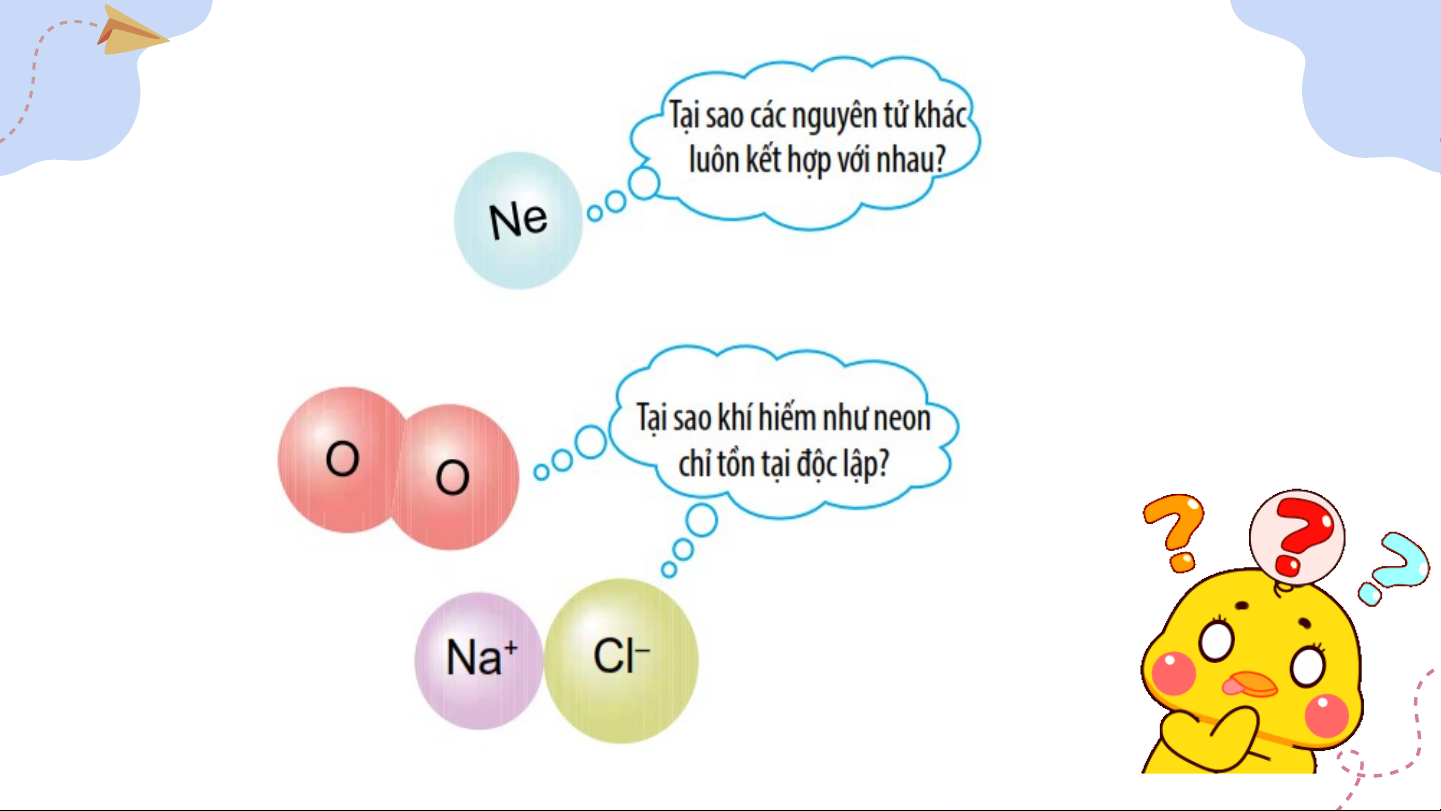
I. Vỏ nguyên tử khí hiếm Số e ở lớp ngoài cùng vừa đủ → Ở điều kiện thường, các nguyên tử khí hiếm thường trơ, bền và chỉ tồn tại độc lập. Em có biết II. Liên kết ion II. Liên kết ion
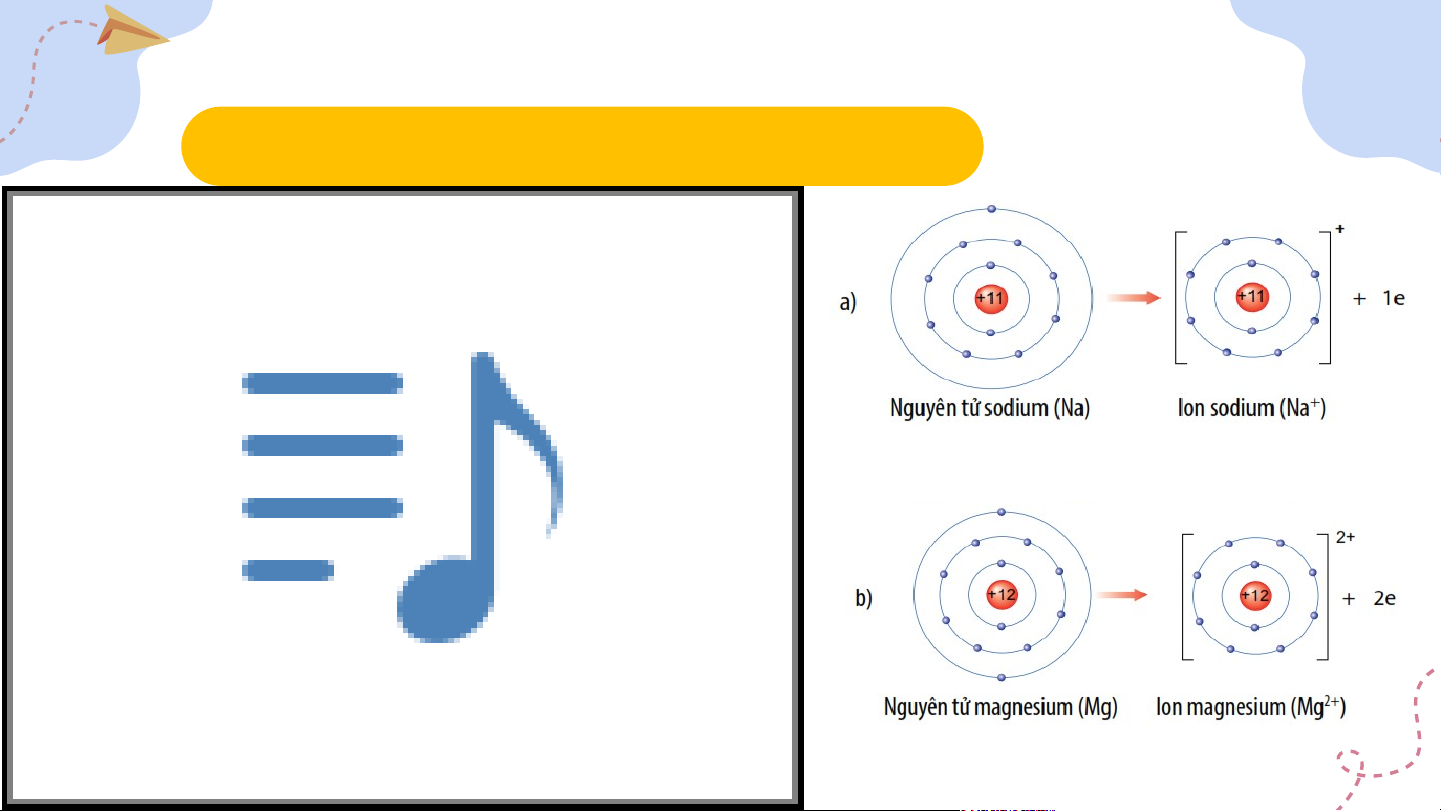
1. Mô tả sự tạo thành ion dương II. Liên kết ion
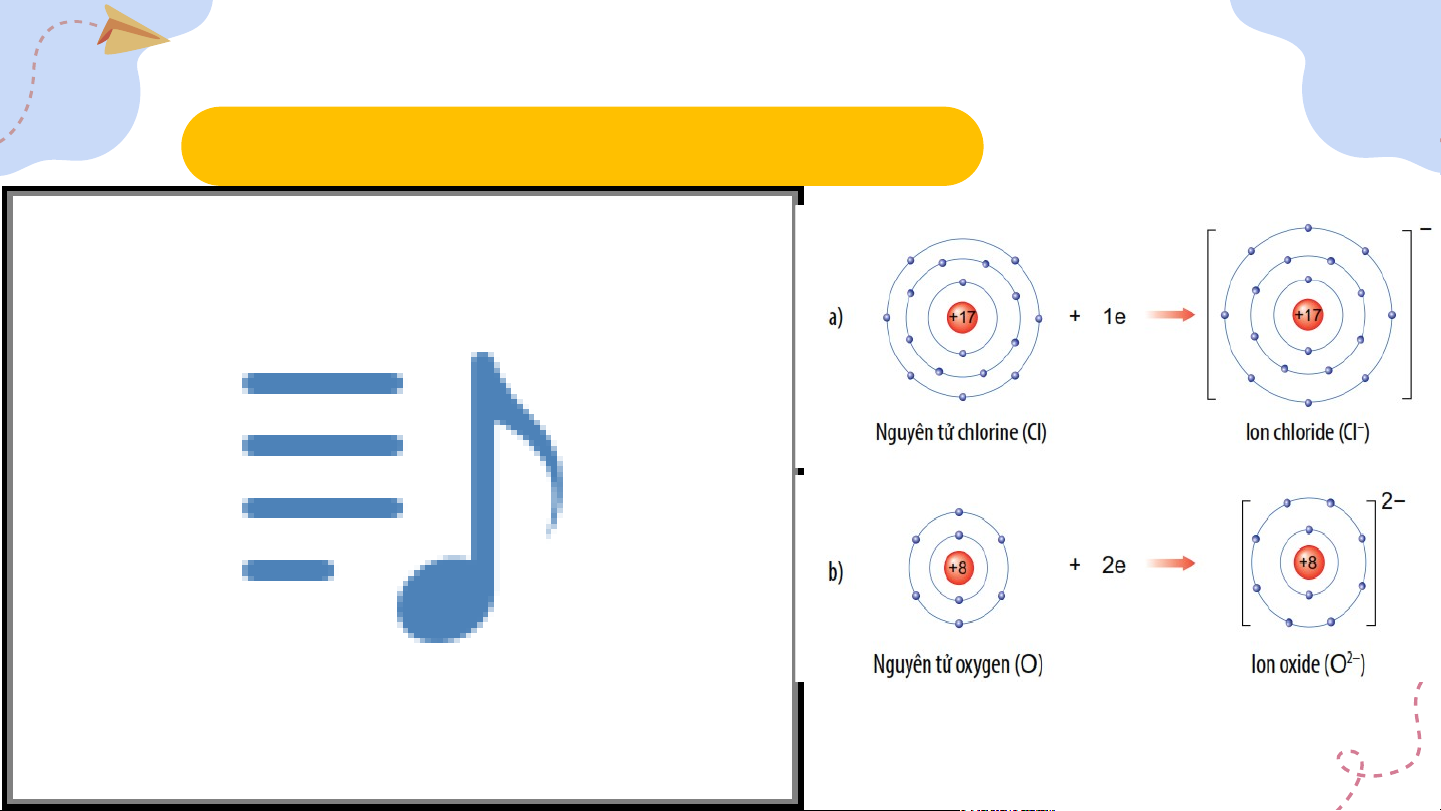
2. Mô tả sự tạo thành ion âm II. Liên kết ion
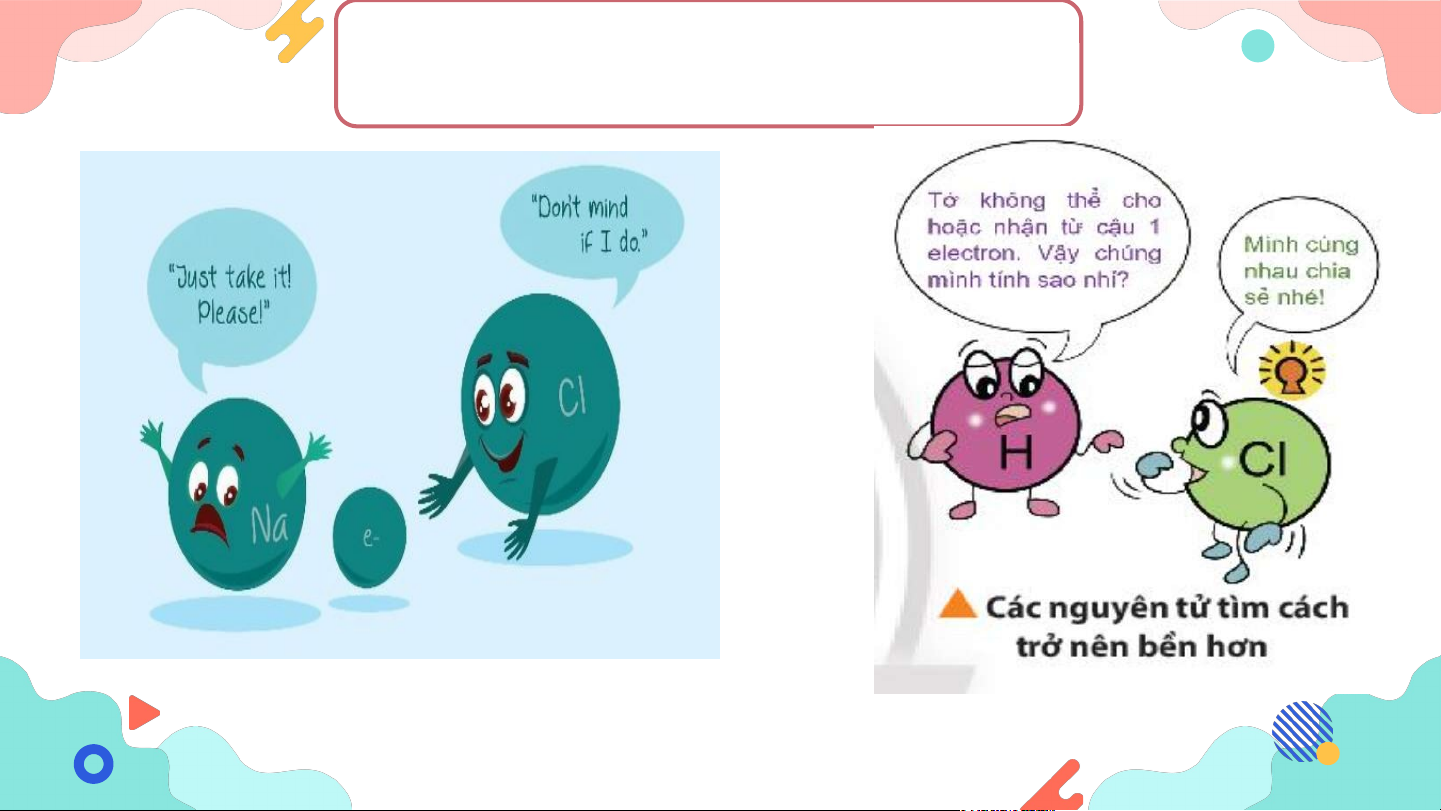
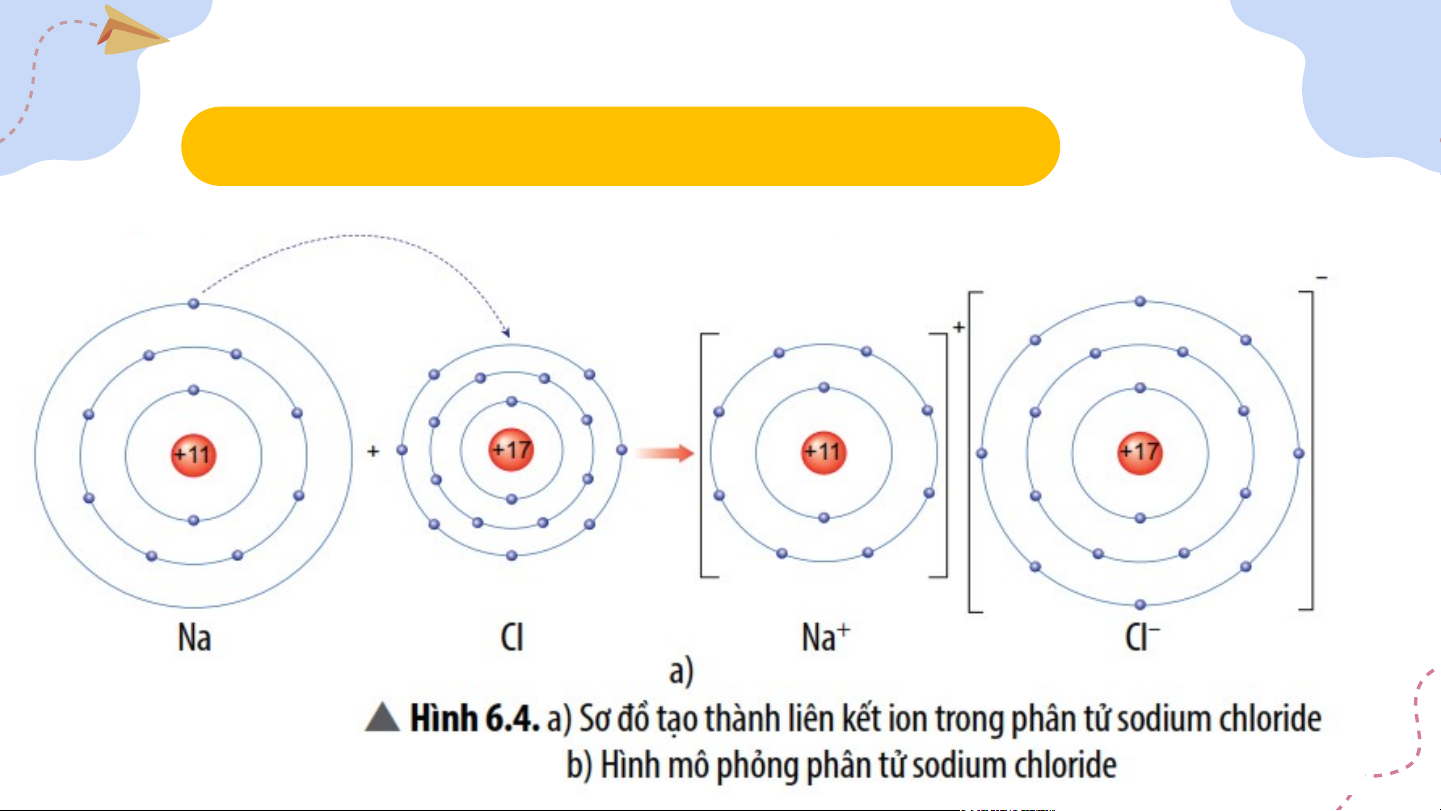
3. Tìm hiểu sự tạo thành liên kết ion II. Liên kết ion
3. Tìm hiểu sự tạo thành liên kết ion II. Liên kết ion
3. Tìm hiểu sự tạo thành liên kết ion
+ Liên kiết ion là liên kết giữa ion dương và ion âm.
+ Các ion dương và ion âm đơn nguyên tử có lớp
electron ngoài cùng giống với nguyên tử của nguyên tố khí hiếm. III. Liên kết cộng hóa trị
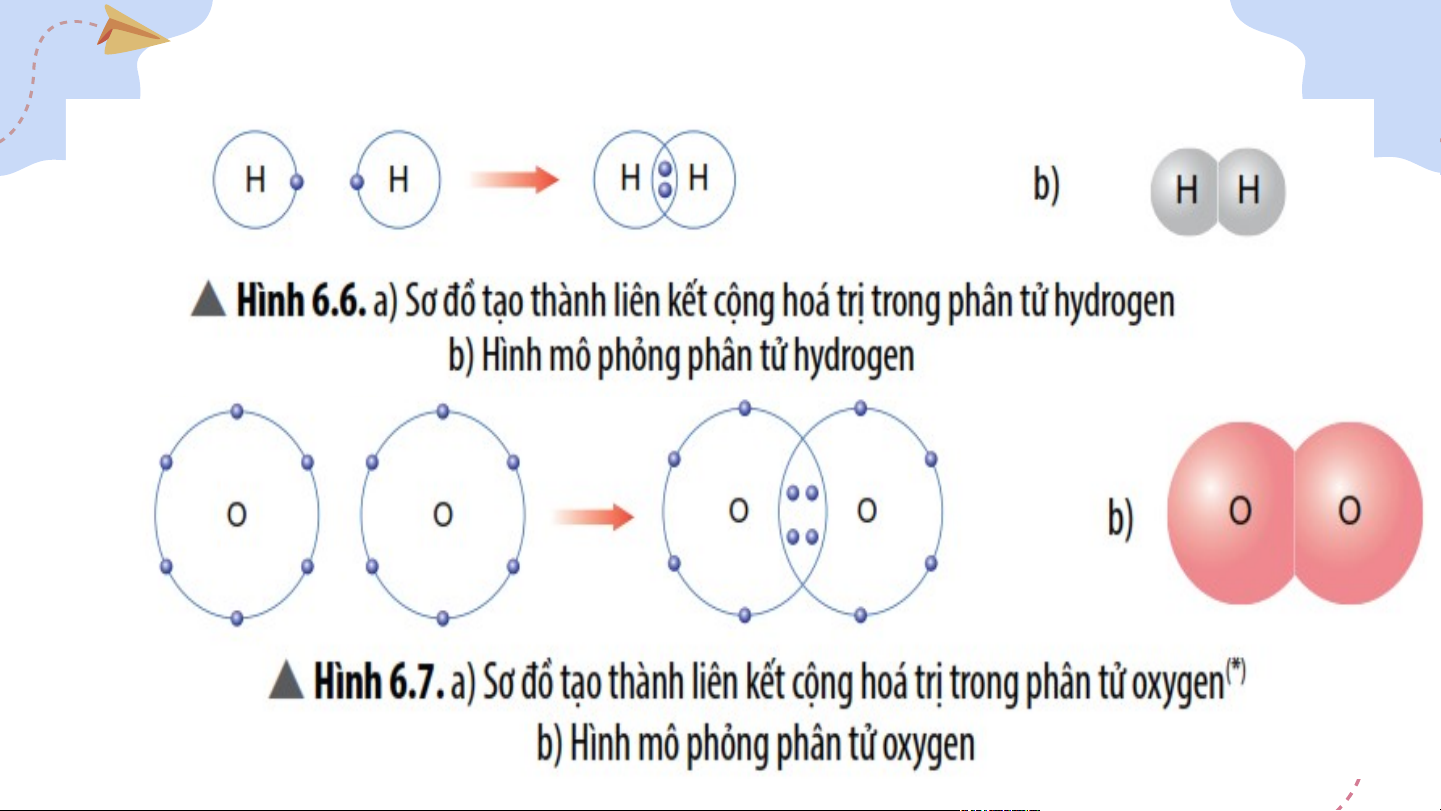
III. Liên kết cộng hóa trị
III. Liên kết cộng hóa trị
III. Liên kết cộng hóa trị
+ Liên kiết cộng hóa trị là liên kết được hình thành
bởi sự dùng chung electron giữa hai nguyên tử.
+ Liên kiết cộng hóa trị thường là liên kết giữa hai
nguyên tử của nguyên tố phi kim với phi kim. IV. Chất ion, chất cộng hóa trị
IV. Chất ion, chất cộng hóa trị 1. Tìm hiểu về chất ion
- Chất ion là chất được tạo bởi ion dương và ion âm. - Thường ở thể rắn.
- Khó bay hơi, khó nóng chảy, khi tan trong nước tạo thành dung dịch dẫn điện được.
IV. Chất ion, chất cộng hóa trị
2. Tìm hiểu về chất cộng hóa trị
- Chất cộng hóa trị là chất được tạo thành do liên kết cộng hóa trị.
- Thường ở thể rắn, thể lỏng, thể khí.
- Thường dễ bay hơi, kém bền với nhiệt.
- Khi tan trong nước có thể dẫn điện hoặc không dẫn điện
TRÒ CHƠI: ONG VỀ TỔ
Câu 1: Chất được phân chia thành hai loại lớn là (1) và (2).
Đơn chất được tạo nên từ một nguyên tố hóa học,
còn (3) được tạo nên từ hai nguyên tố hóa học trở lên. (1),
(2), (3) lần lượt là: 3
B. Đơn chất, hợp chất, hợp
A. Phân tử, đơn chất, hợp chất chất
D. Đơn chất, hợp chất, đơn 0
C. Phân tử, hợp chất, hợp chất chất
Câu 2: Để phân biệt phân tử của đơn chất và phân tử của
hợp chất, ta dựa vào
A. Hình dạng phân tử.
B. Số lượng nguyên tử trong phân tử. 30
C. Số lượng nguyên tố hoá học tạo nên chất.
D. Khối lượng phân tử.
Câu 3: Cho các chất sau: oxygen, ammonia, carbon
dioxide, hydrogen, nước, neon, nitrogen. Có bao
nhiêu chất là đơn chất? 30 A. 3 B. 4. C. 5 D. 6
Câu 4: Khối lượng phân tử của sulfur dioxide
(gồm 2 nguyên tử oxygen và 1 nguyên tử sulfur) là 3 A. 32 amu. B. 44 amu. 0 C. 48 amu. D. 64 amu.
Câu 5: Phân tử glucose được cấu tạo từ carbon,
hydrogen, oxygen. Glucose là 30 A. kim loại. B. phi kim. C. đơn chất. D. hợp chất.
Câu 6: Cho các phát biểu sau:
(1) Các kim loại đều là đơn chất.
(2) Các đơn chất đều là kim loại.
(3) Mỗi nguyên tố thường chỉ tạo ra một dạng đơn chất.
(4) Số lượng hợp chất lớn hơn rất nhiều so với đơn chất 30 A. 4. B. 3. C. 2. D. 1. 4. Luyện tập
1. Hãy liệt kê 5 phân tử đơn chất và 5 phân tử
hợp chất chứa 2 nguyên tố hoá học. Lời g 5 i pải: hâ n tử hợp chất là: 5 phân tử đơn chất là:
- Sulfur dioxide tạo bởi 2 nguyên tố S và O.
- Khí hydrogen tạo bởi nguyên tố - Nước tạo bởi 2 nguyên tố H và O. H.
- Methane tạo bởi 2 nguyên tố C và H.
- Khí oxygen tạo bởi nguyên tố O. - Hydrogen chloride tạo bởi 2 nguyên tố H
- Khí nitrogen tạo bởi nguyên tố N.và Cl.
- Sodium tạo bởi nguyên tố Na.
- Sodium oxide tạo bởi 2 nguyên tố Na và
- Helium tạo bởi nguyên tố He. O. 4. Luyện tập 2. Hoàn thành bảng sau: PHÂN TỬ PHÂN TỬ KHỐI LƯỢNG CHẤT ĐƠN CHẤT HỢP CHẤT PHÂN TỬ
Phân tử carbon monoxide gồm 1 nguyên tử
carbon và 1 nguyên tử oxygen ? ? ? 28 amu
Phân tử calcium oxide gồm 1 nguyên tử
calcium và 1 nguyên tử oxygen ? ? ? 56 amu
Phân tử ozone gồm 3 nguyên tử oxygen 48 amu
Phân tử nitrogen dioxide gồm 1 nguyên tử ? ? ?
nitrogen và 2 nguyên tử oxygen ? ? ? 46 amu
Phân tử acetic acid (có trong giấm ăn) gồm 2
nguyên tử carbon, 4 nguyên tử hydrogen và 2 nguyên tử oxygen ? ? ? 60 amu 4. Luyện tập
3. Baking soda là một loại muối được ứng
dụng rộng rãi trong nhiều ngành như:
thực phẩm, dược phẩm, công nghiệp hoá O O H chất. X C
a) Baking soda là phân tử đơn chất hay O phân tử hợp chất?
b) Baking soda có khối lượng phân tử
bằng 84 amu. Quan sát hình mô phỏng
phân tử baking soda (hình bên), cho biết
phân tử baking soda có mấy nguyên tử X. Bột baking soda
Hãy xác định khối lượng nguyên tử X và
và hình mô phỏng phân tử baking
cho biết X là nguyên tố nào? soda Lời giải:
a) Baking soda được tạo từ 4 nguyên tố: C, H, O, X Baking soda là phân tử hợp chất.
b) Khối lượng phân tử baking soda là: X + 12 + 16 x 3 + 1 = 84 (amu) X = 23 (amu)
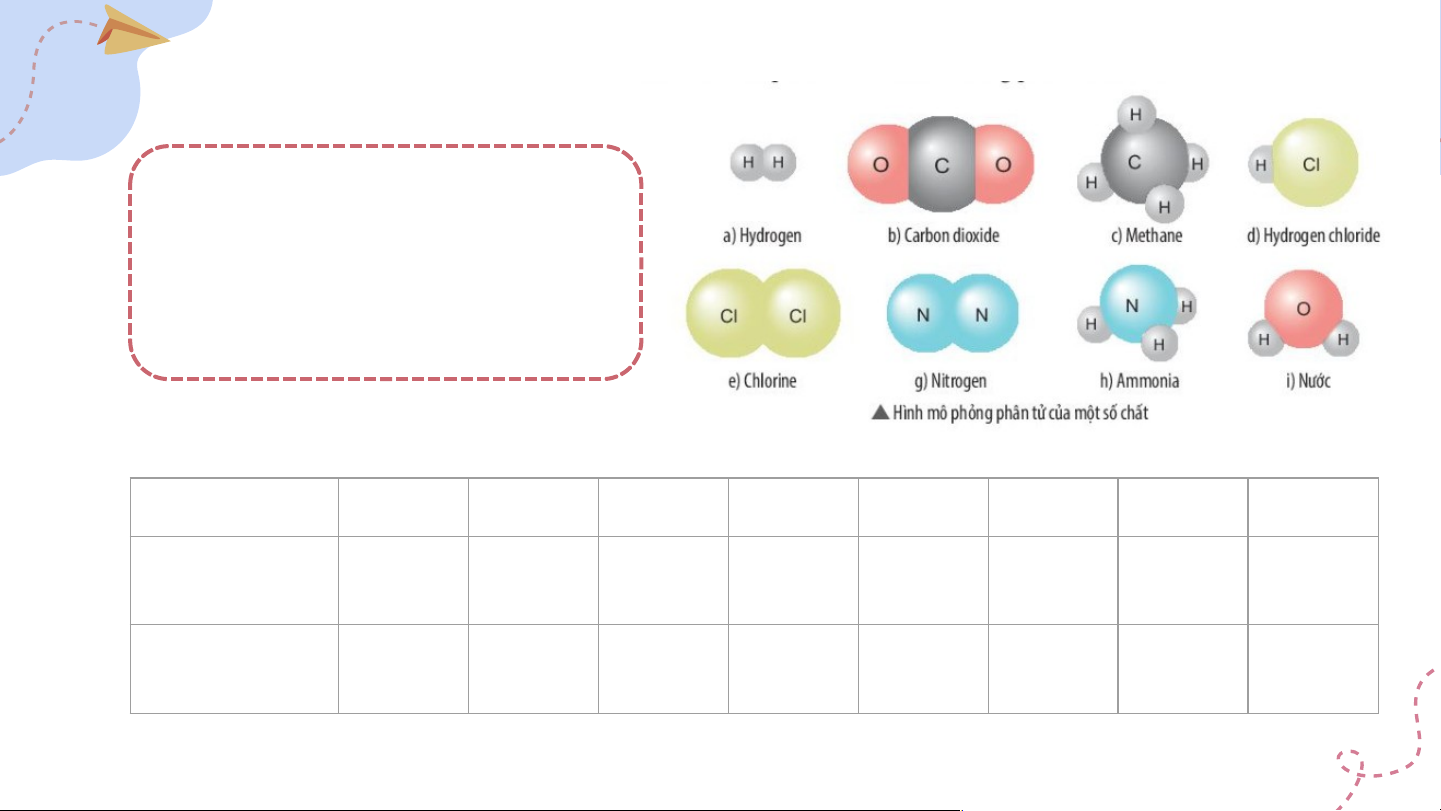
X là nguyên tố sodium (Na) 4. Luyện tập 4. Quan sát hình mô phỏng các phân tử sau,
cho biết chất nào là đơn chất, chất nào là hợp chất. Tính khối lượng phân tử của các chất. Lời giải: Chất a) b) c) d) e) g) h) i) Phân loại Đơn Hợp Hợp Hợp Đơn Đơn Hợp Hợp chất chất chất chất chất chất chất chất KLPT 2 (amu) 44 16 36,5 71 28 17 18
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32




