






Preview text:
BÀI 6-P1 (tiết 1,2,3) GIỚI THIỆU VỀ LIÊN KẾT HOÁ HỌC Mở đầu
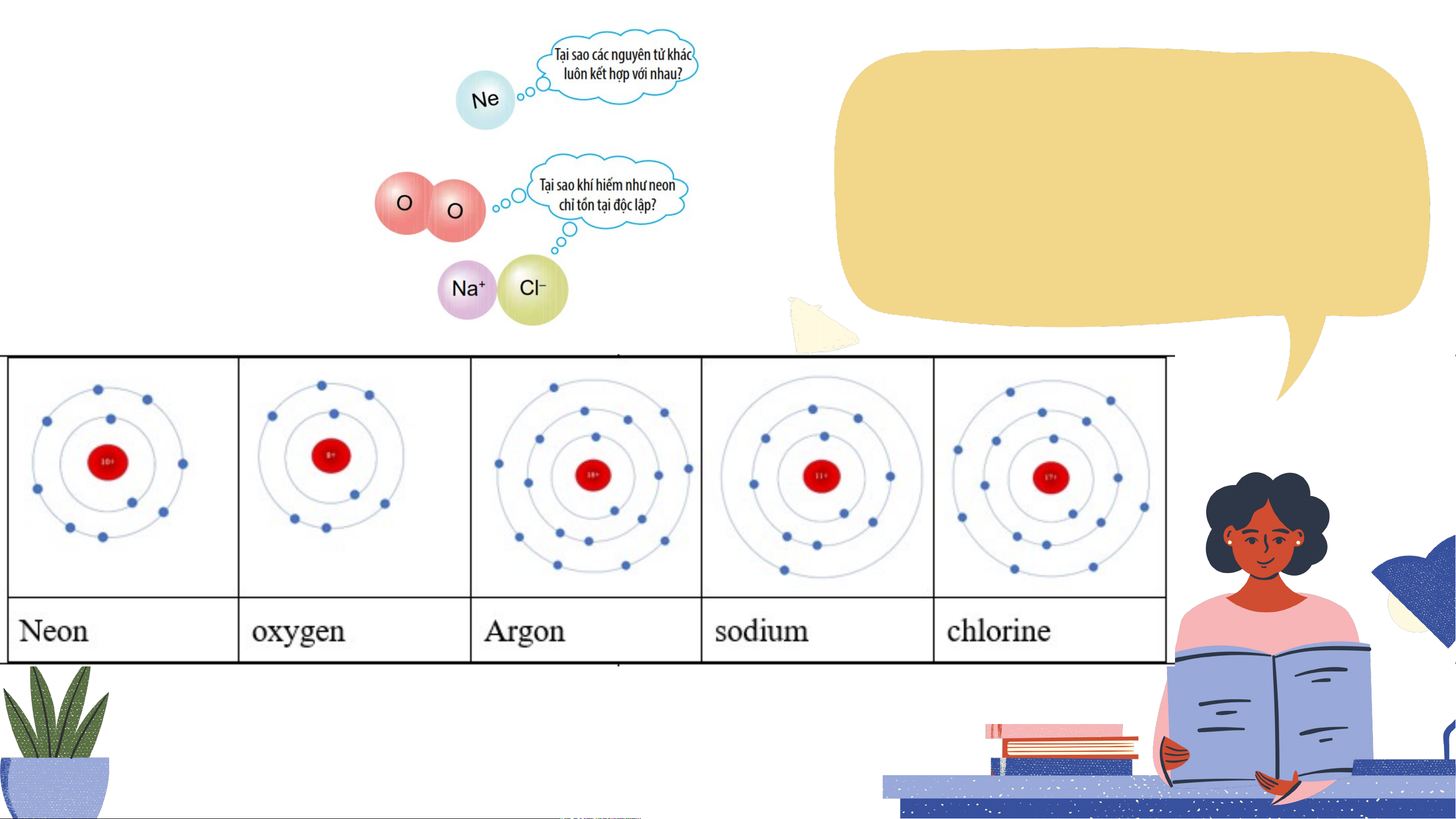
Quan sát e lớp ngoài cùng, dự đoán nguyên nhân vì sao:
+ Neon, Argon không liên kết với các chất khác được?
+ oxygen tự liên kết với nhau để tạo ra phân tử khí?
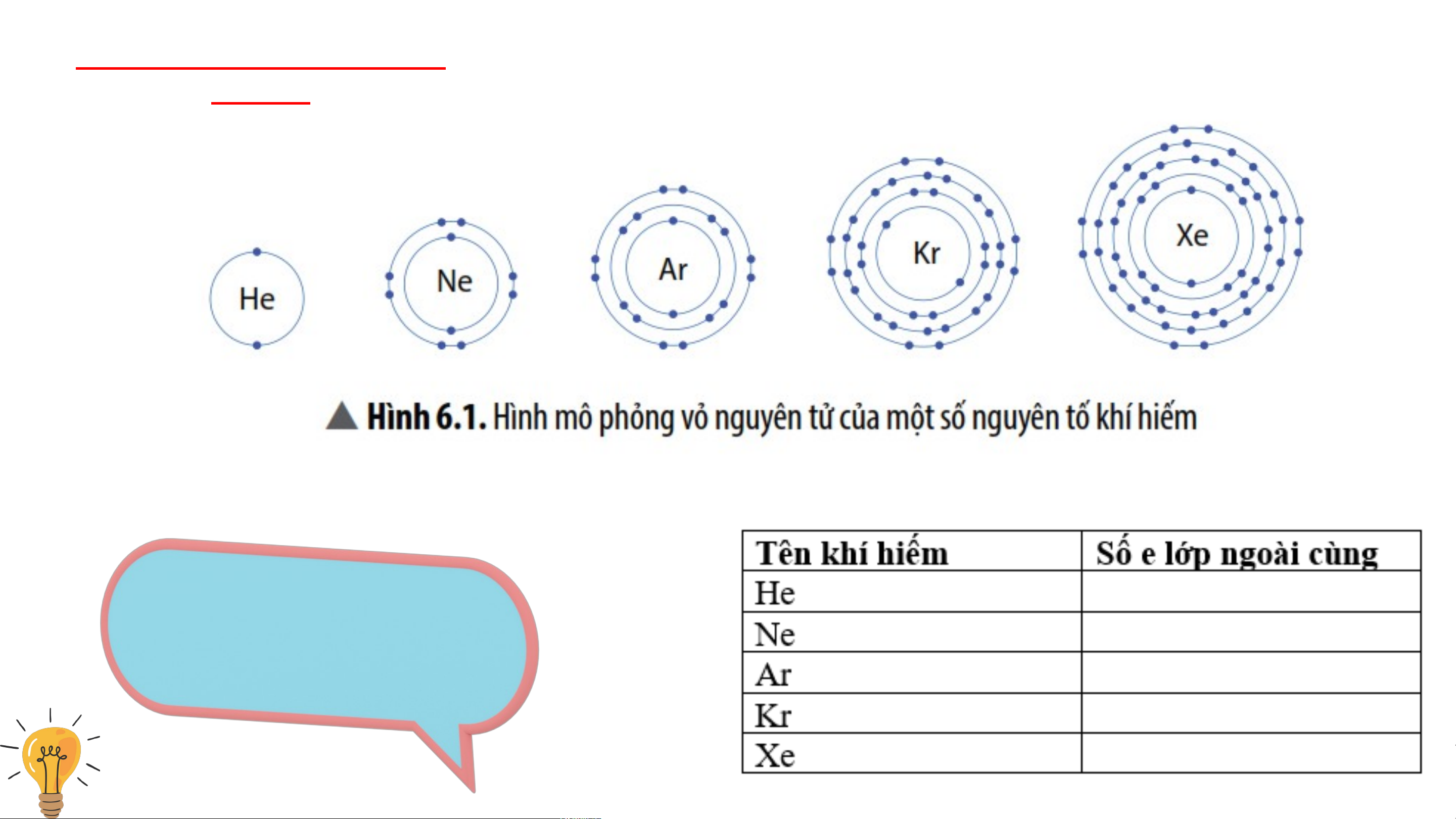
+ Trong khi đó sodium liên kết với chlorine I. Vỏ nguyên tử khí hiếm Ghi lại số e ngoài cùng của các nguyên tử khí
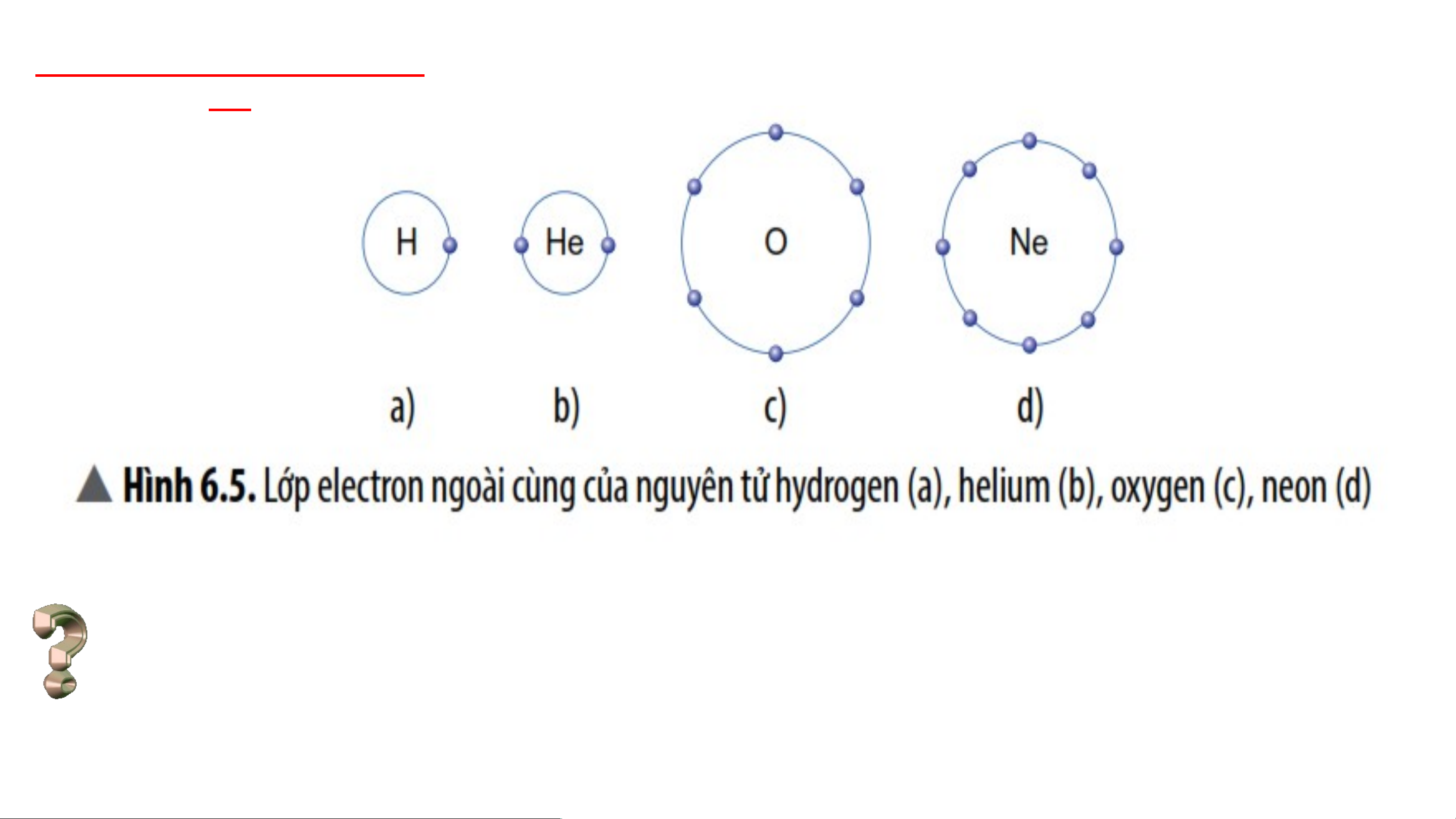
hiếm ở hình 6.1 vào bảng I. Vỏ nguyên tử khí hiếm Vỏ nguyên tử khí hiếm
đều có 8 e ở lớp ngoài
cùng, riêng helium ở lớp ngoài cùng có 2 e
I. Vỏ nguyên tử khí hiếm
1- VỎ NGUYÊN TỬ KHÍ HIẾM
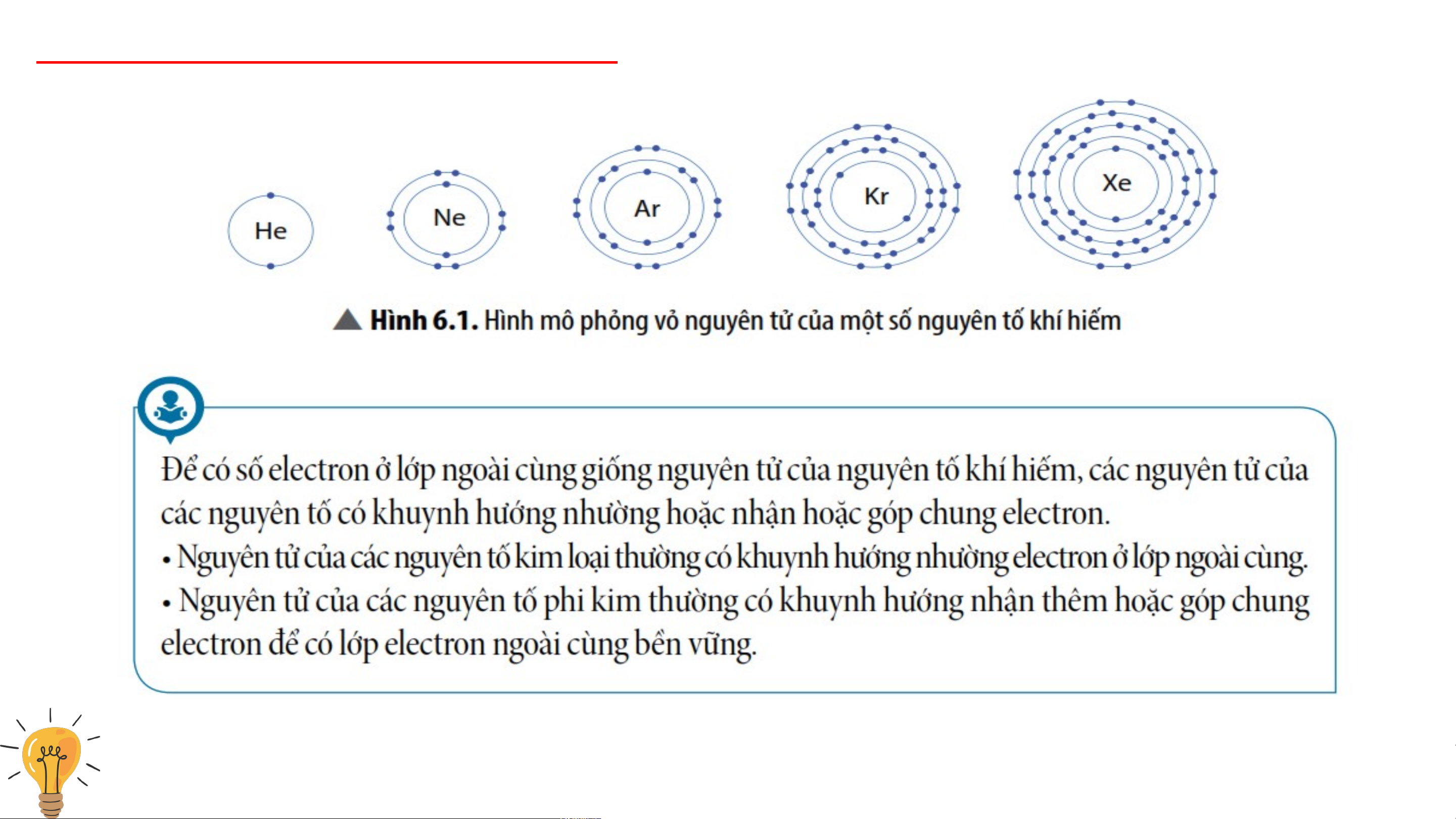
- Nhóm khí hiếm là nhóm các nguyên tố hoạt động hóa học kém.
Nhóm khí hiếm gồm: helium (He); neon (Ne); argon (Ar); krypton (Kr); xenon (Xe), …
- Vỏ nguyên tử của các nguyên tố khí hiếm đều có 8 electron ở lớp ngoài cùng,
riêng helium ở lớp ngoài cùng có 2 electron. 2. Tìm hiểu liên kết ion 3 phút Nhóm 1, 2,3,4: Quan Nhóm 5,6,7,8: Quan sát hình 6.2 mô tả sự sát hình 6.3 mô tả sự hình thành liên kết hình thành liên kết ion ion dương âm
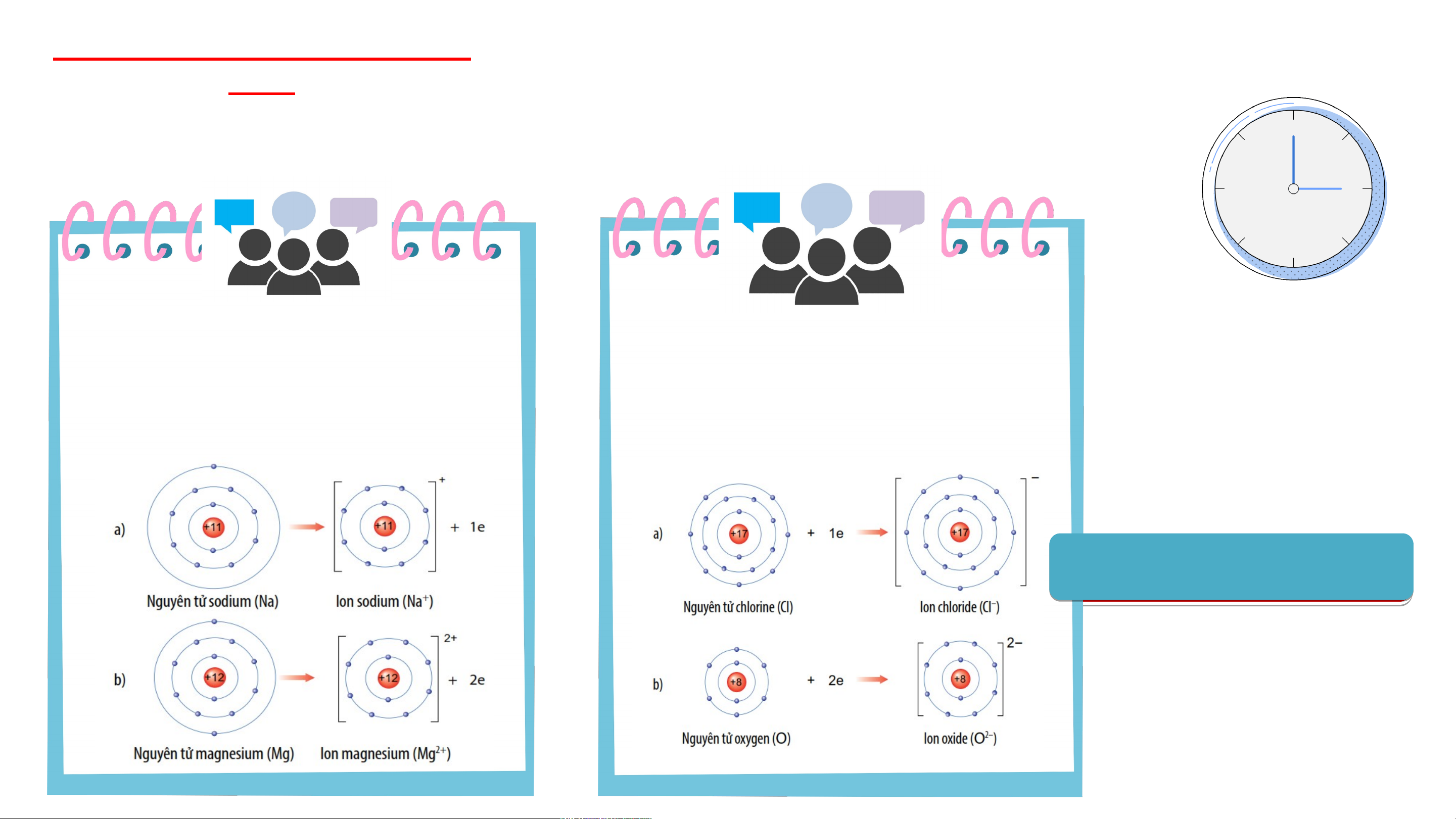
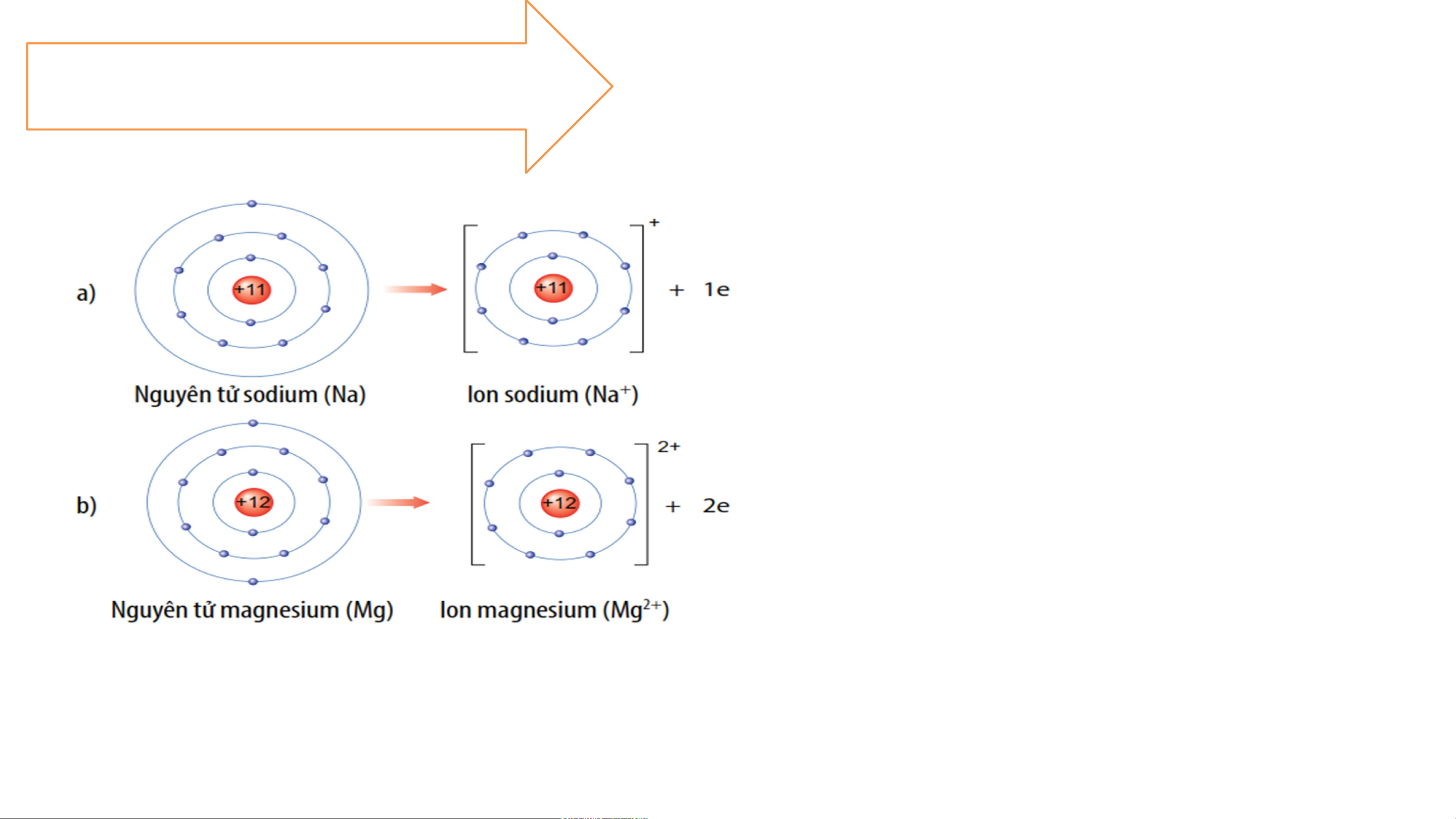
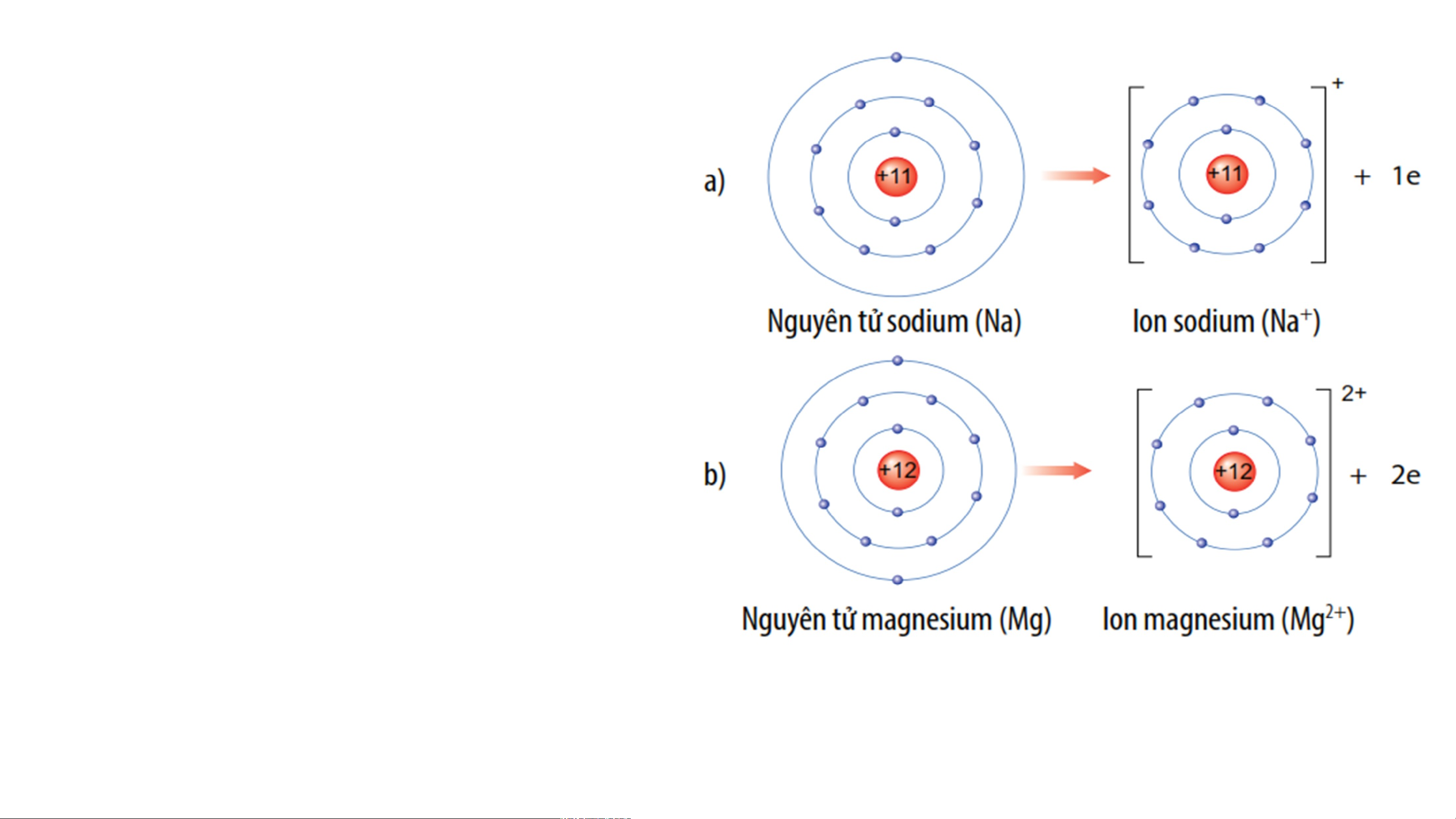
2.1-SỰ TẠO THÀNH ION DƯƠNG
Các nguyên tử của nguyên tố
kim loại có xu hướng nhường e
ở lớp ngoài cùng giống nguyên
tử của khí hiếm gần nhất trong
bảng tuần hoàn. Nguyên tử kim
loại khi nhường e sẽ tạo thành ion dương tương ứng. Ví dụ: a/ Nguyên tử sodium nhường 1 electron lớp ngoài cùng tạo thành ion dương, kí hiệu Na+ b/ Nguyên tử magnesium nhường 2 electron lớp ngoài cùng tạo thành ion dương, kí hiệu Mg2+
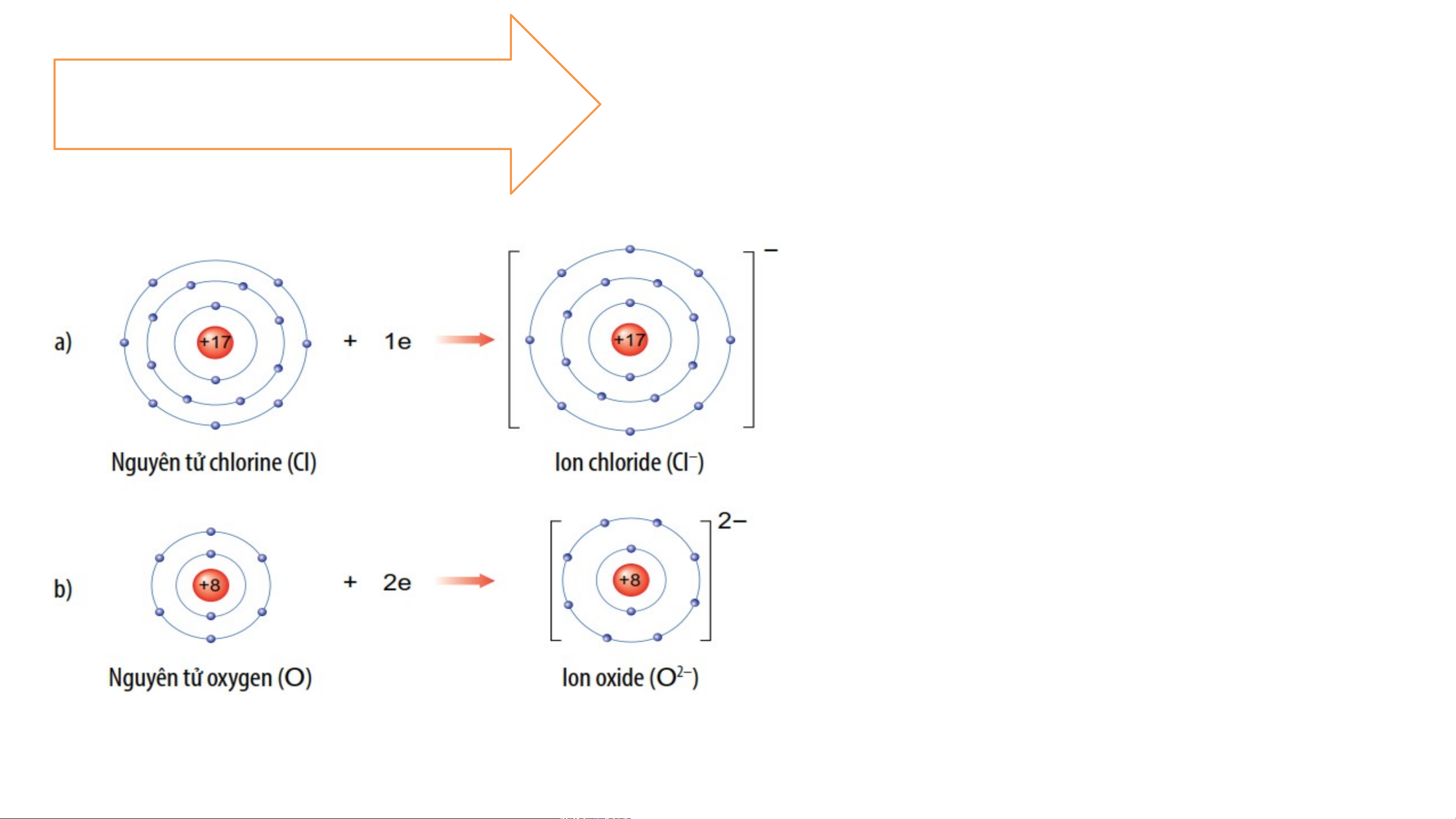
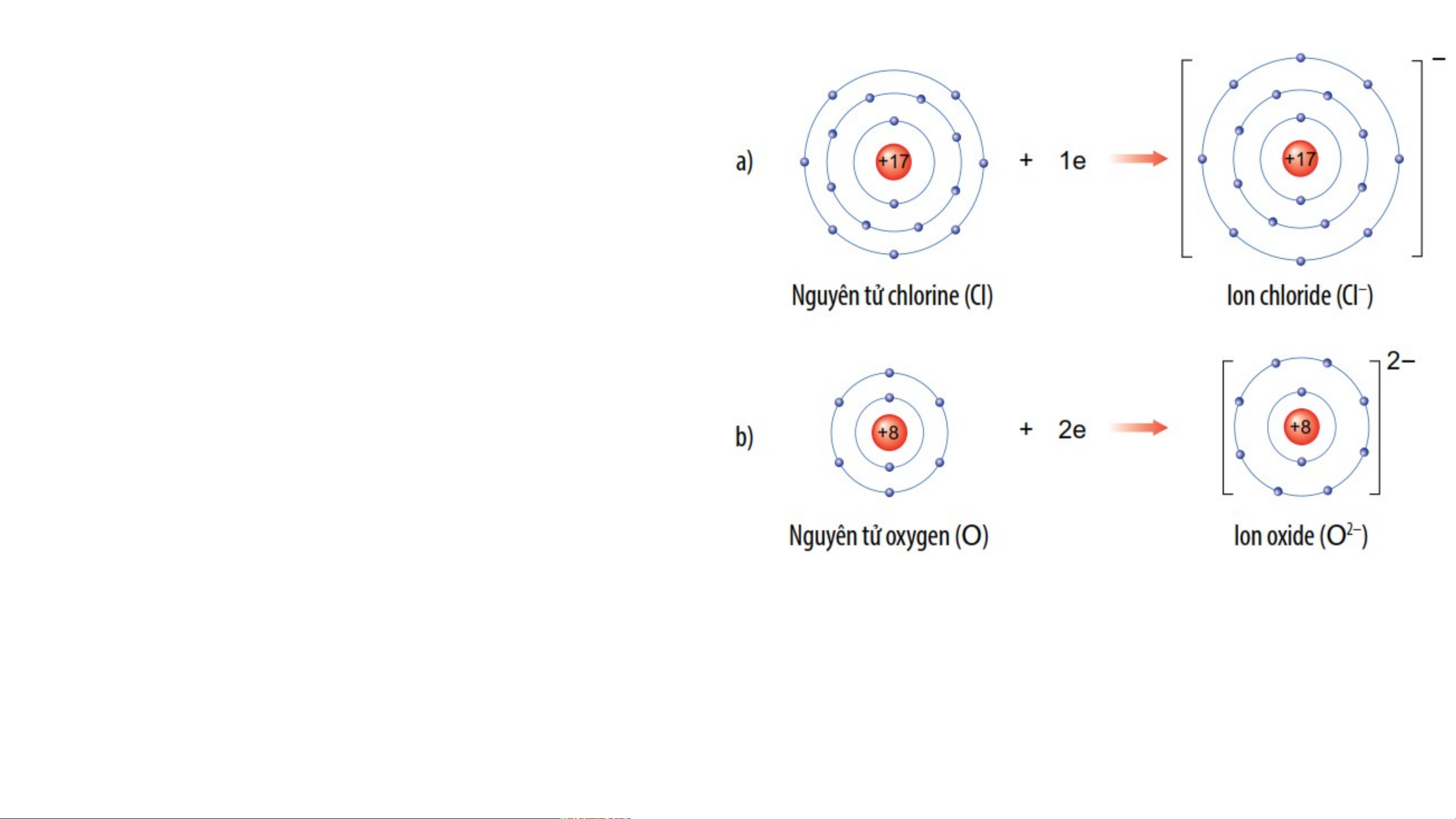
2.1- SỰ TẠO THÀNH ION ÂM
-Các nguyên tử của nguyên tố phi
kim (CL , O, N,…) có số e lớp 2
ngoài cùng là 7,6,5,… nên khi kết
hợp với các nguyên tố kim loại,
nguyên tử phi kim có xu hướng
nhận e từ nguyên tử kim loại để
có lớp e lớp ngoài cùng giống
nguyên tử của nguyên tố khí
hiếm gần nhất trong bảng tuần hoàn.
-Nguyên tử phi kim khi nhận e sẽ
tạo thành ion âm tương ứng. Ví dụ: a/ Nguyên tử chlorine nhận thêm 1 electron vào lớp ngoài cùng tạo
thành ion âm, kí hiệu Cl- b/ Nguyên tử Oxygen nhận thêm 2 electron vào lớp ngoài cùng tạo
thành ion âm, kí hiệu O2-
Cùng xem video hình thành liên kết ion trong phân tử NaCl
3- Tìm hiểu liên kết • Liên kết ion là gì? ion
• e lớp ngoài cùng của các nguyên tử trong liên kết ion giống nguyên tử nguyên tố nào?
II. Tìm hiểu liên kết ion
3. Sự tạo thành liên kết ion
- Khi nguyên tử kim loại kết hợp với nguyên tử phi kim, nguyên
tử kim loại nhường electron tạo thành ion dương, đồng thời
nguyên tử phi kim nhận electron tạo thành ion âm.
- Ion âm và ion dương mang điện tích trái dấu, hút nhau, tạo thành liên kết ion.
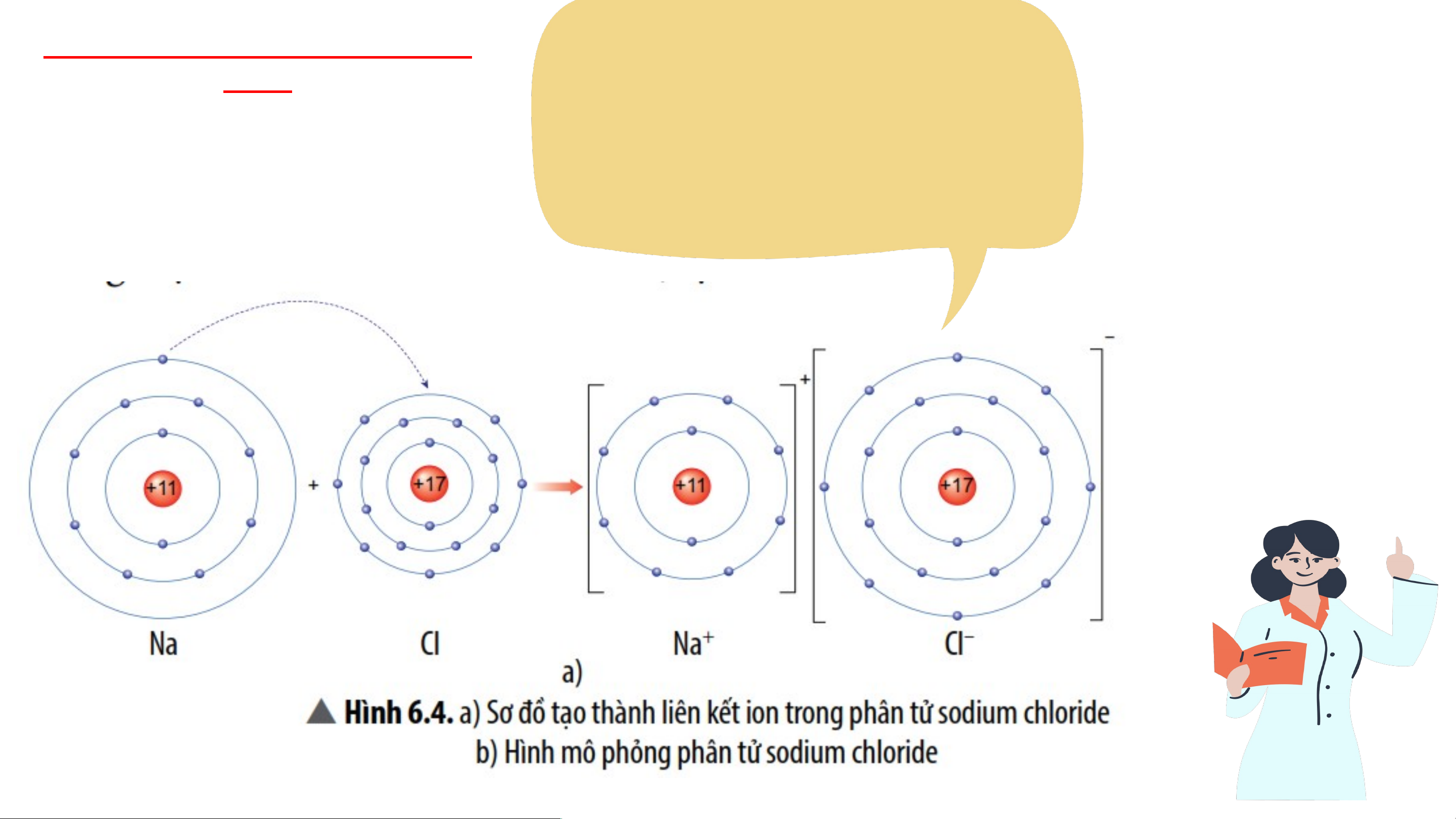
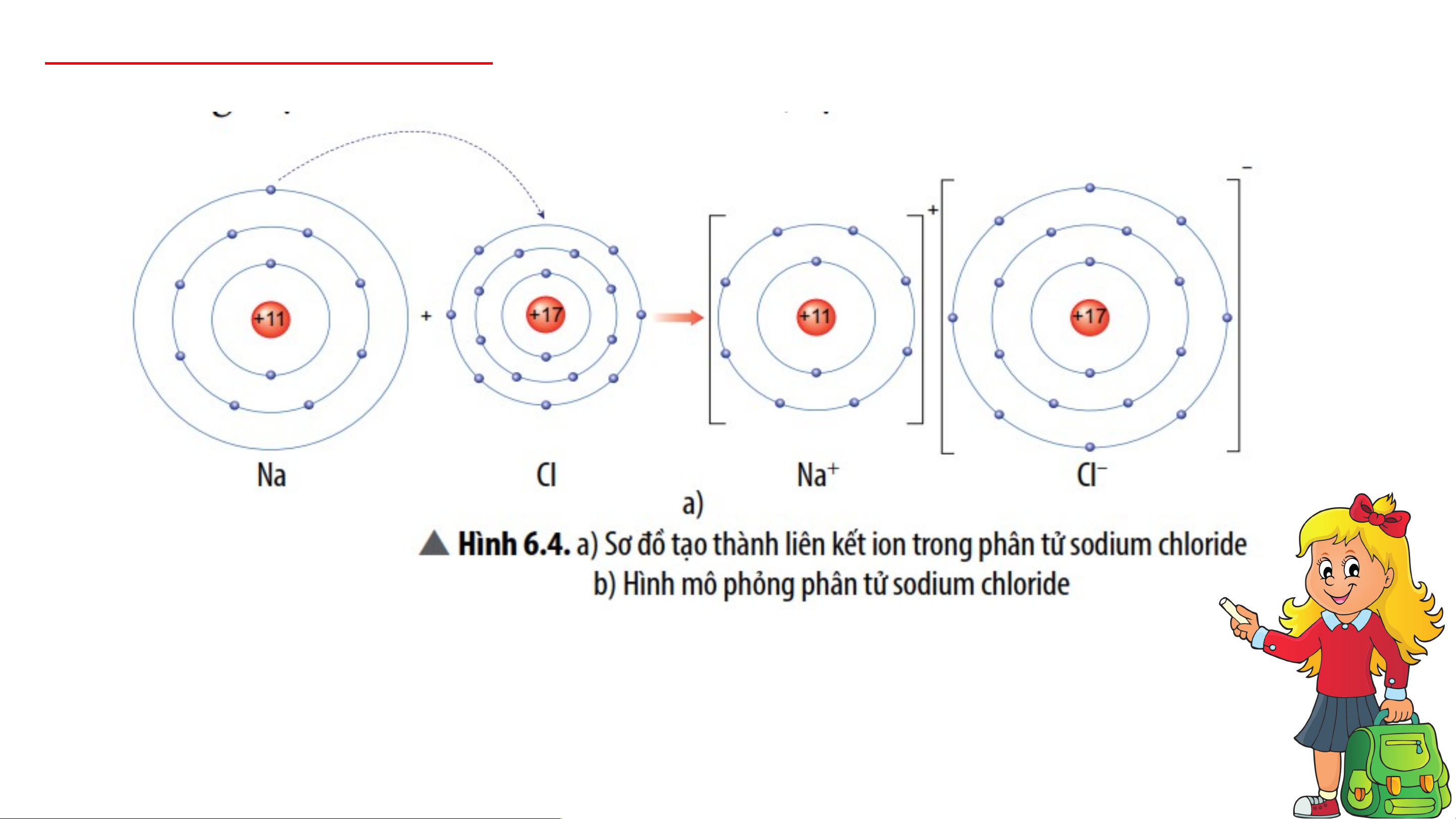
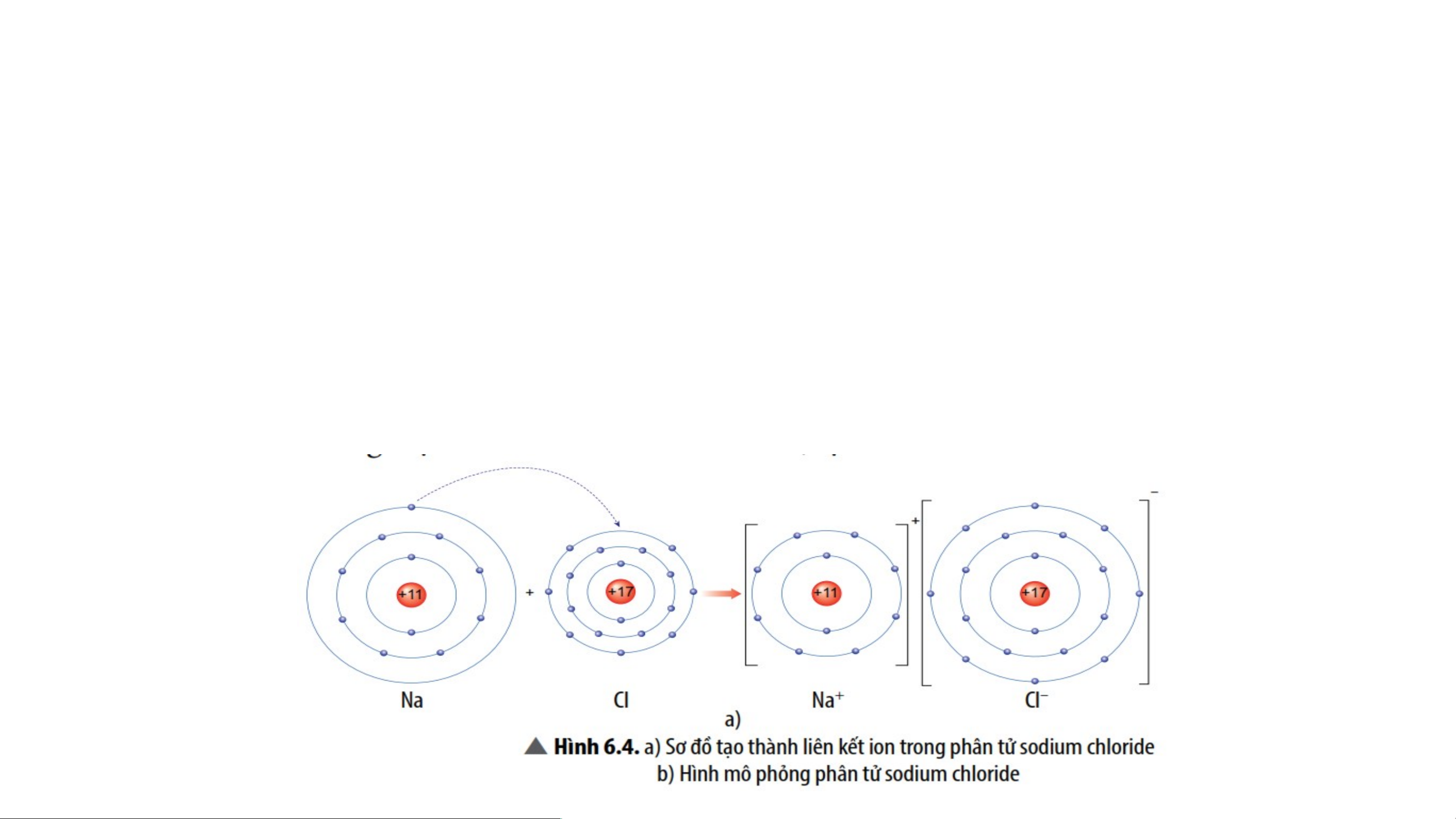
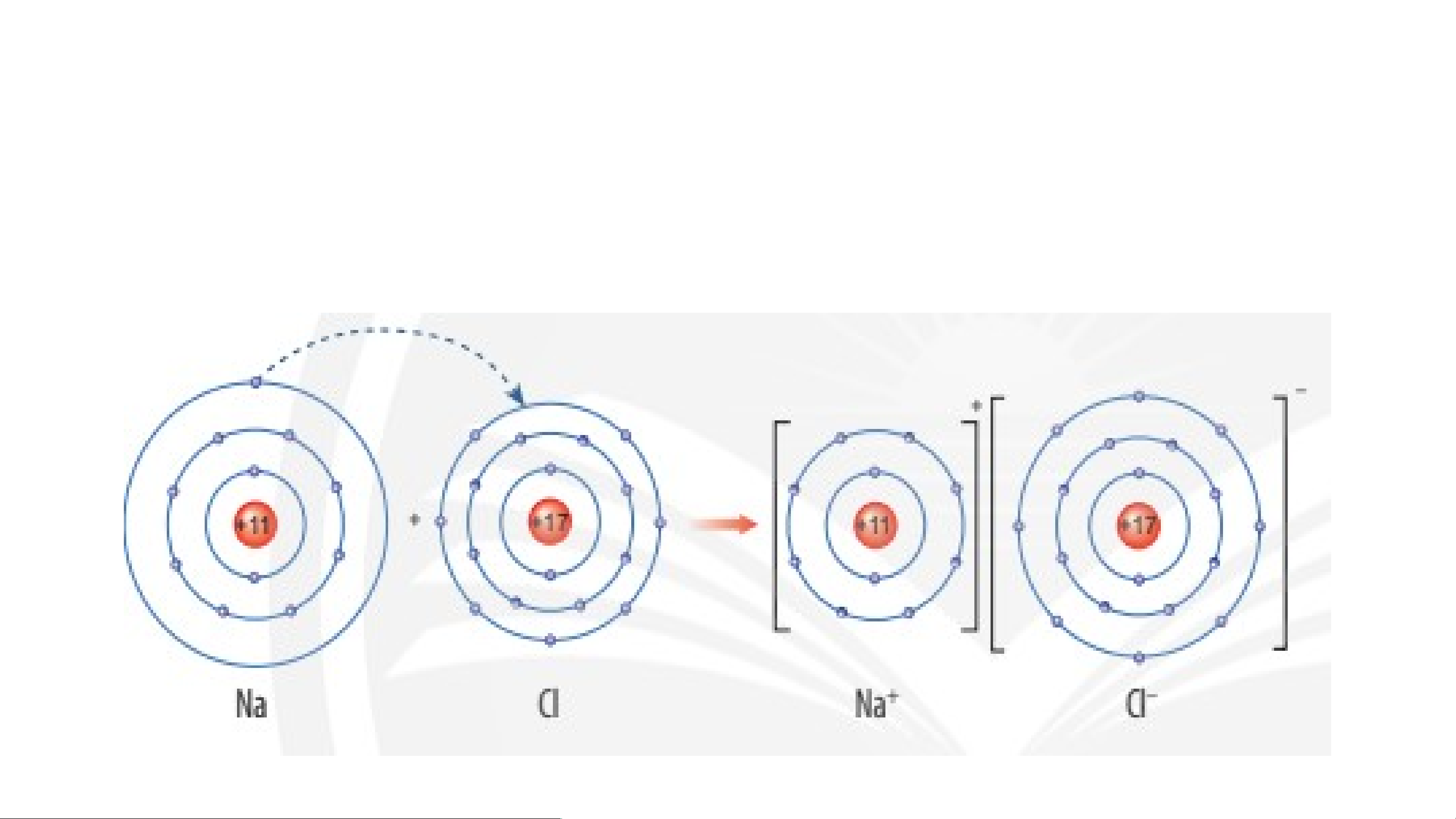
*VD 1: Sơ đồ tạo thành liên kết ion trong phân tử NaCl (sodium chloride).
- Nguyên tử sodium nhường 1 electron tạo thành ion dương, kí hiệu Na+;
- Nguyên tử chlorine nhận 1 electron tạo thành ion âm, kí hiệu Cl-;
Hai ion trên trái dấu nên hút nhau tạo thành phân tử sodium chlorine.
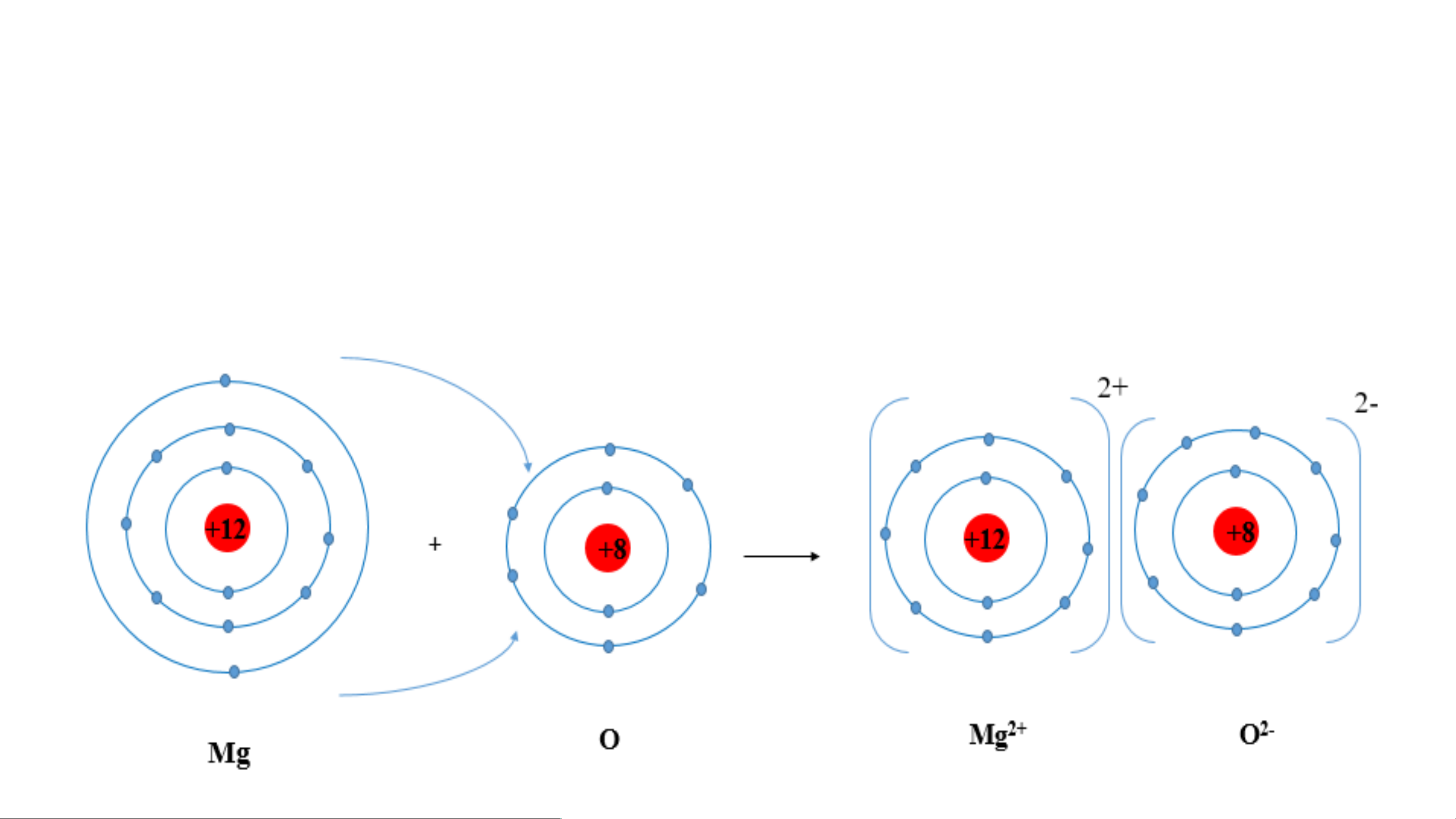
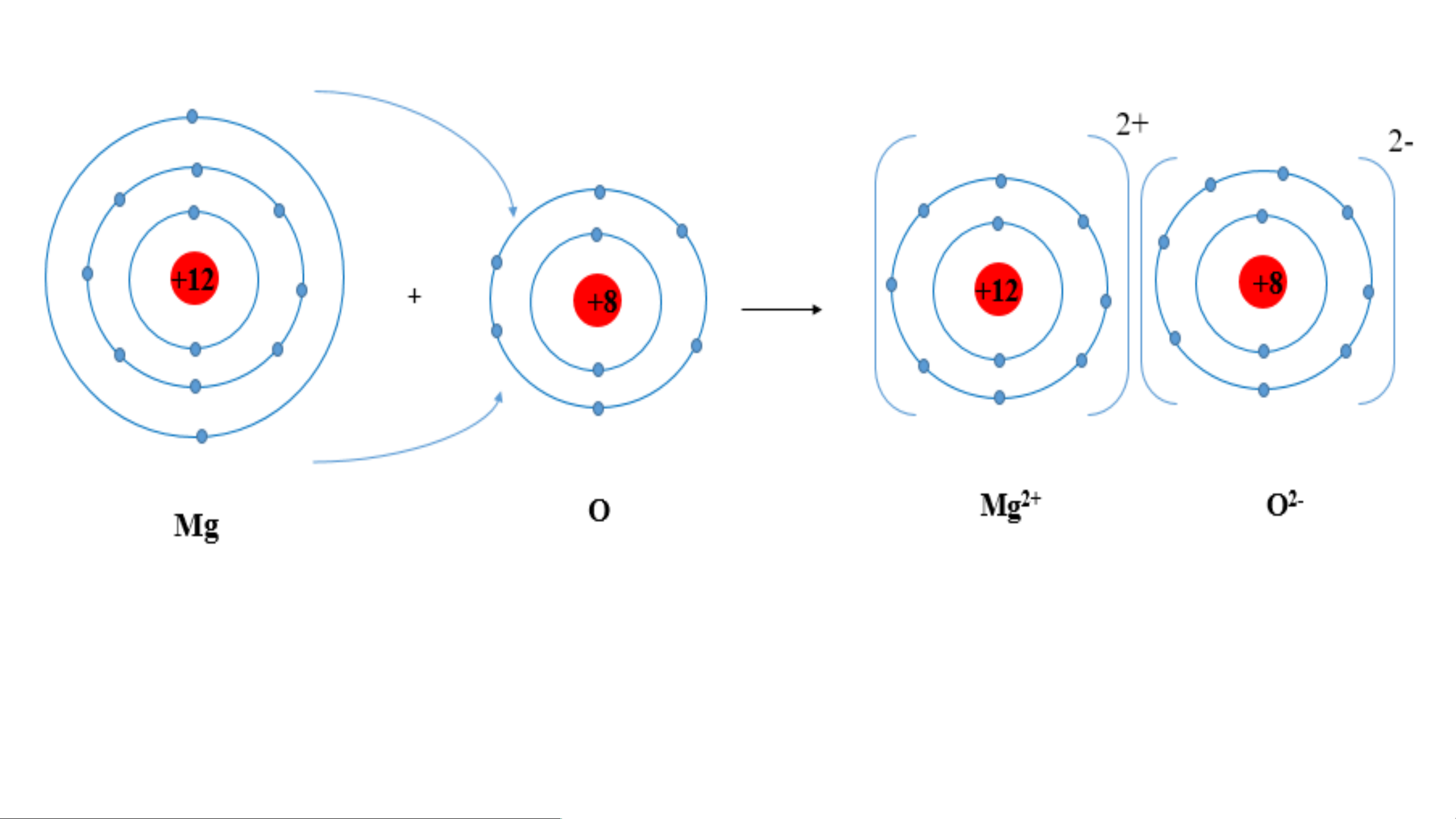
Ví dụ 2: Sơ đồ tạo thành liên kết ion trong phân tử MgO (magnesium oxide).
- Nguyên tử magnesium nhường 2 electron tạo thành ion dương, kí hiệu Mg2+;
- Nguyên tử oxygen nhận 2 electron tạo thành ion âm, kí hiệu O2-;
Hai ion trên trái dấu nên hút nhau tạo thành phân tử magnesium oxide 2- Liên kết ion
- Liên kết ion là liên kết giữa ion dương và ion âm.
- Các ion dương và ion âm đơn nguyên tử có lớp electron
ngoài cùng giống với nguyên tử của nguyên tố khí hiếm. 3-Liên kết cộng hoá trị
? Dựa vào bảng tuần hoàn, hãy chỉ ra nguyên tố khí hiếm gần nhất của
hydrogen và oxygen. Để có lớp e lớp ngoài cùng giống nguyên tố khí
hiếm gần nhất, nguyên tử hydrogen và oxygen có xu hướng gì? Nhóm Nhóm Nhóm Nhóm 1,2 vẽ 3,4 vẽ 5,6 vẽ sơ 7,8 vẽ sơ sơ đồ sơ đồ đồ hình đồ hình hình hình thành thành thành thành phân tử phân tử carbon phân phân tử amonia dioxide tử nước
Thời gian: 3 phút cho mỗi nhóm nitroge n
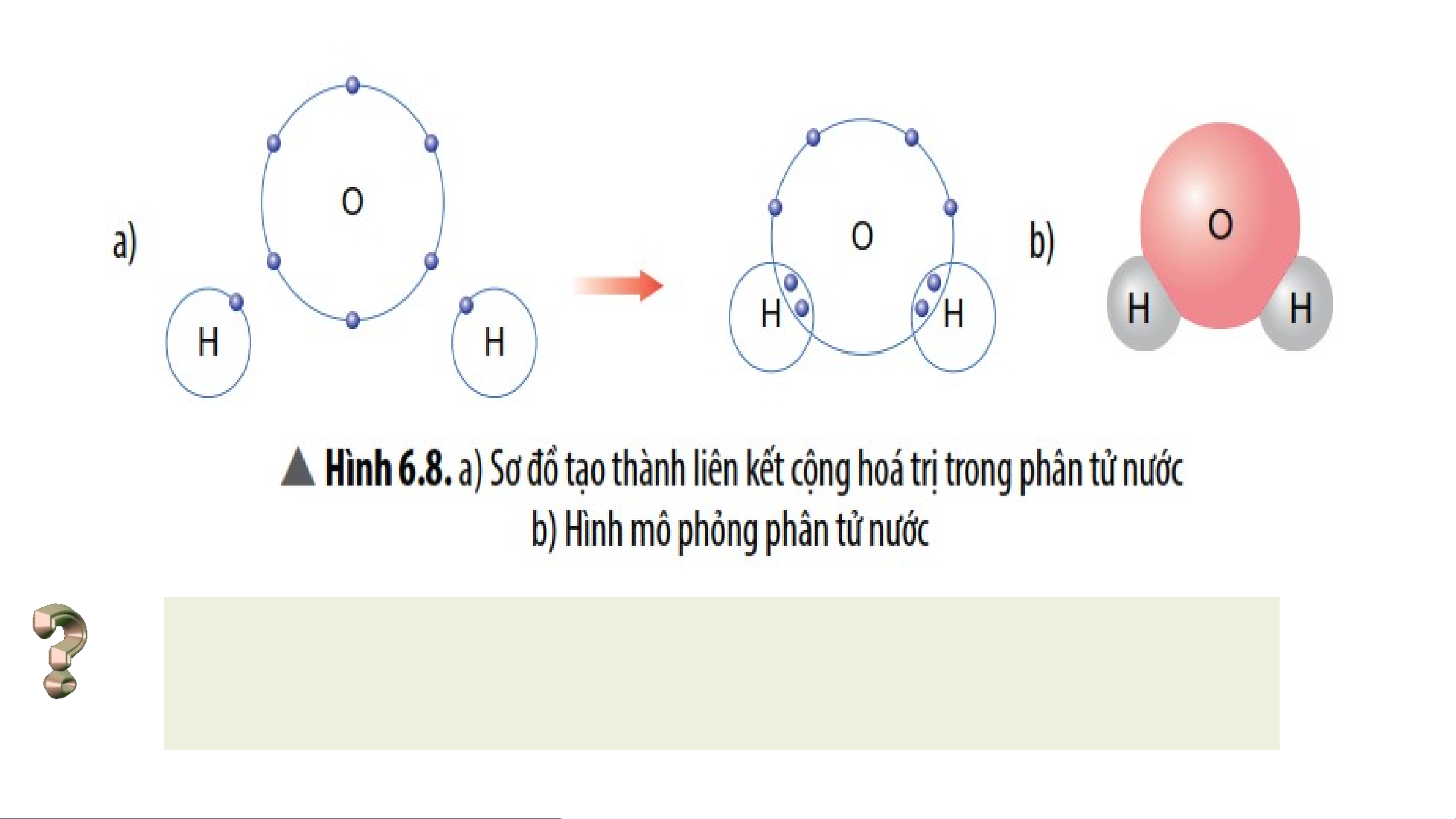
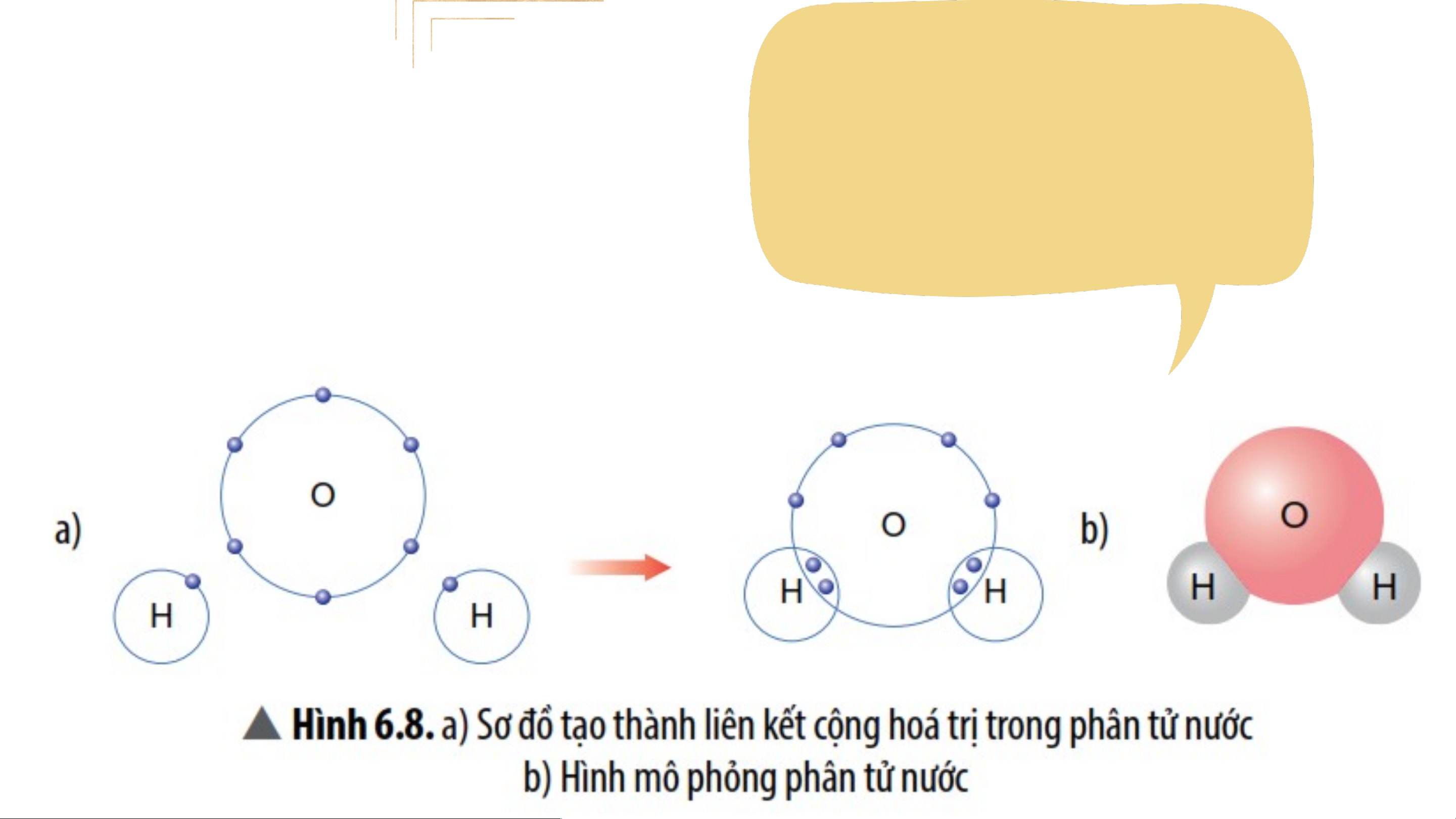
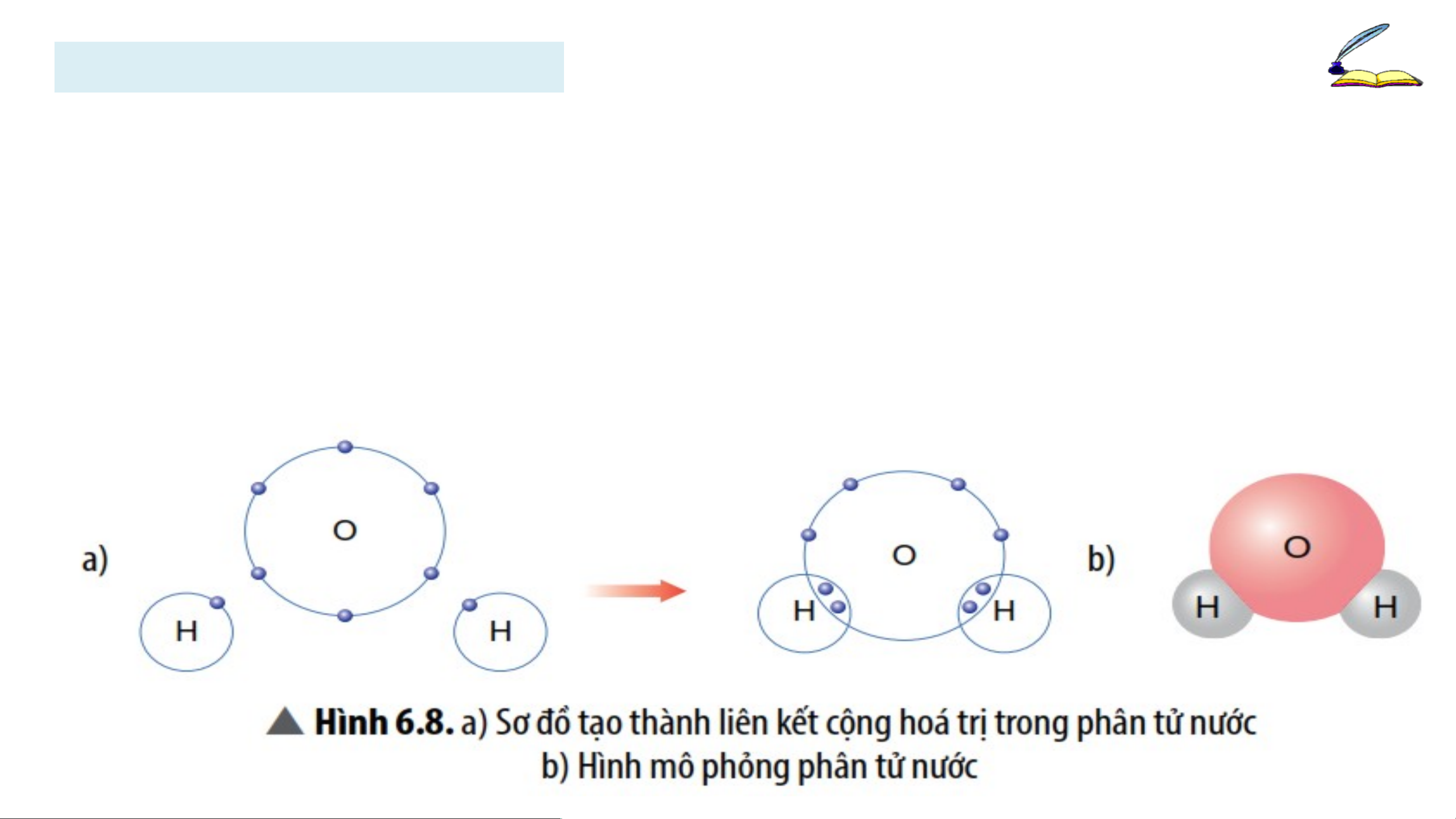
Quan sát Hình 6.8, em hãy cho biết số e dung chung của nguyên
tử H và nguyên O. Trong phân tử nước, số e ở lớp ngoài cùng
của O và H là bao nhiêu và giống với khí hiếm nào?
Cùng xem video hình thành liên kết cộng hoá trị trong phân tử Chlorine
• Liên kết cộng hoá trị là gì?
• e lớp ngoài cùng của các nguyên tử trong liên
kết cộng hoá trị giống nguyên tử nguyên tố nào?
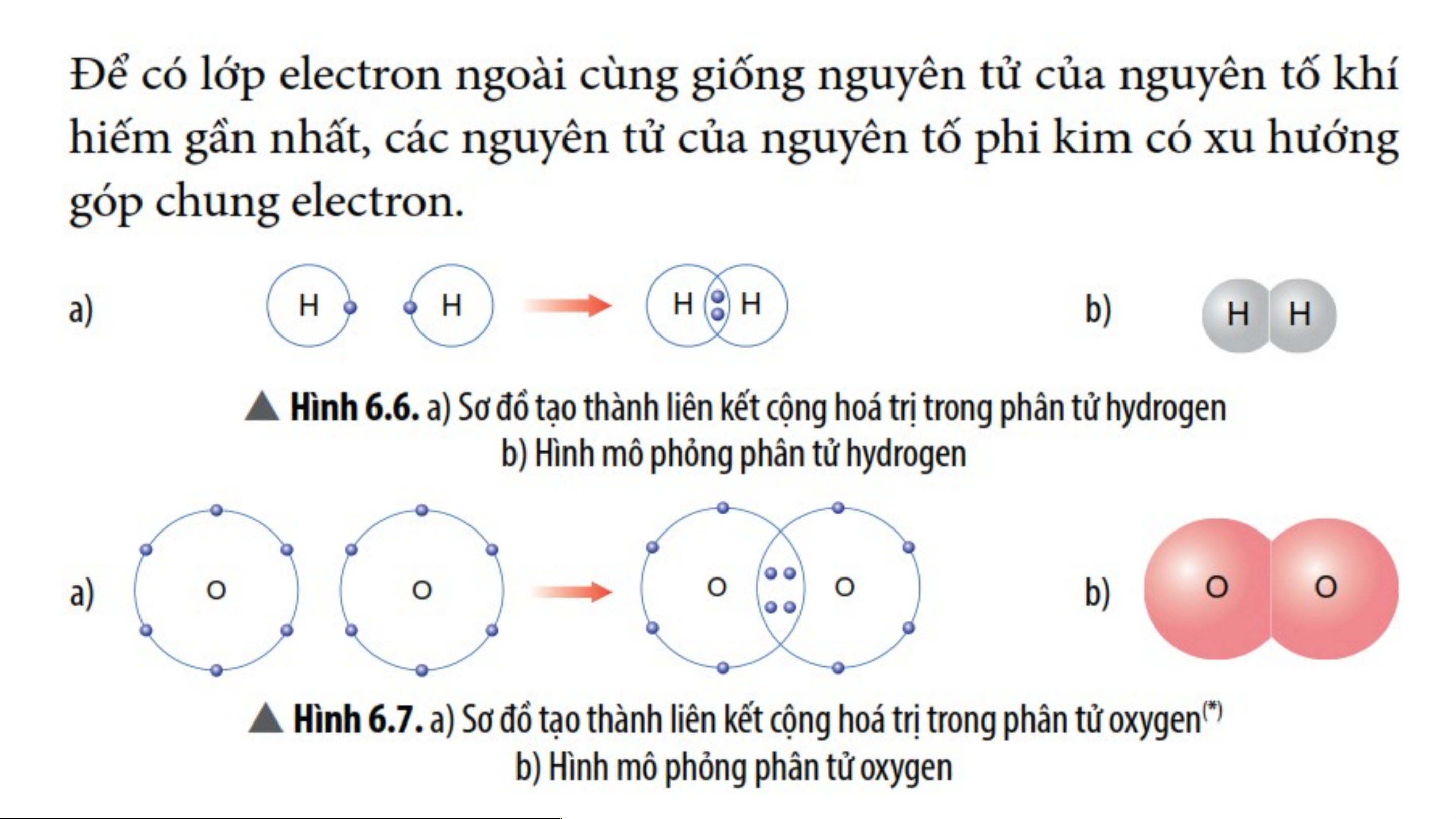
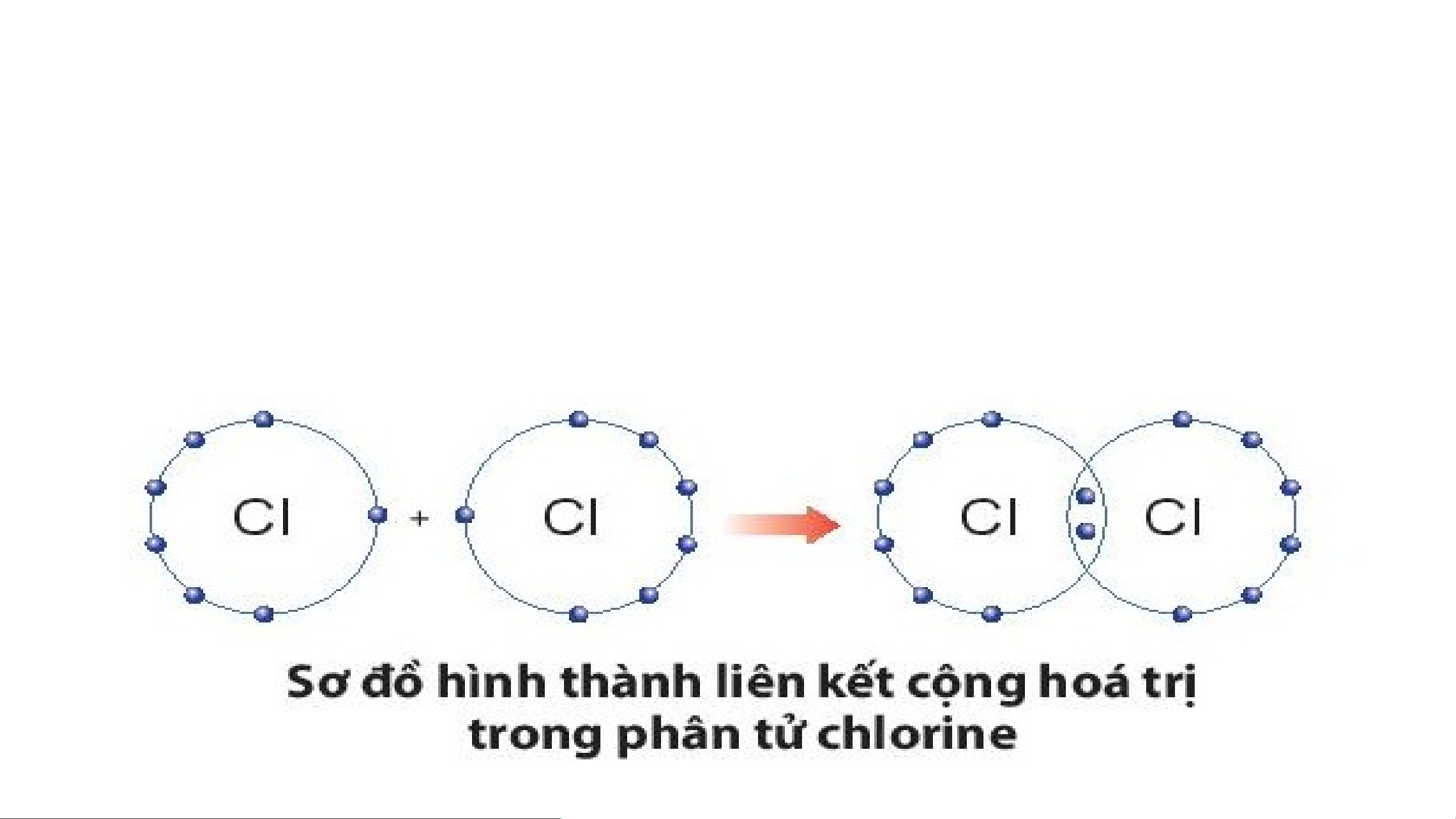
3- LIÊN KẾT CỘNG HÓA TRỊ:
- Liên kết cộng hóa trị là liên kết được hình thành bởi sự dung chung
electron giữa hai nguyên tử.
- Liên kết cộng hóa trị thường là liên kết giữa hai nguyên tử của nguyên
tố phi kim với phi kim.
Ví dụ 1: Quá trình tạo thành liên kết cộng hóa trị trong phân tử chlorine:
+ Nguyên tử Cl có 7 electron lớp ngoài cùng và cần thêm 1
electron để có lớp vỏ bền vững tương tự khí hiếm.
+ Khi hai nguyên tử Cl liên kết với nhau, mỗi nguyên tử góp 1
electron để tạo ra đôi electron dùng chung.
+ Hạt nhân của hai nguyên tử Cl cùng hút đôi electron dùng
chung và liên kết với nhau tạo thành phân tử chlorine.
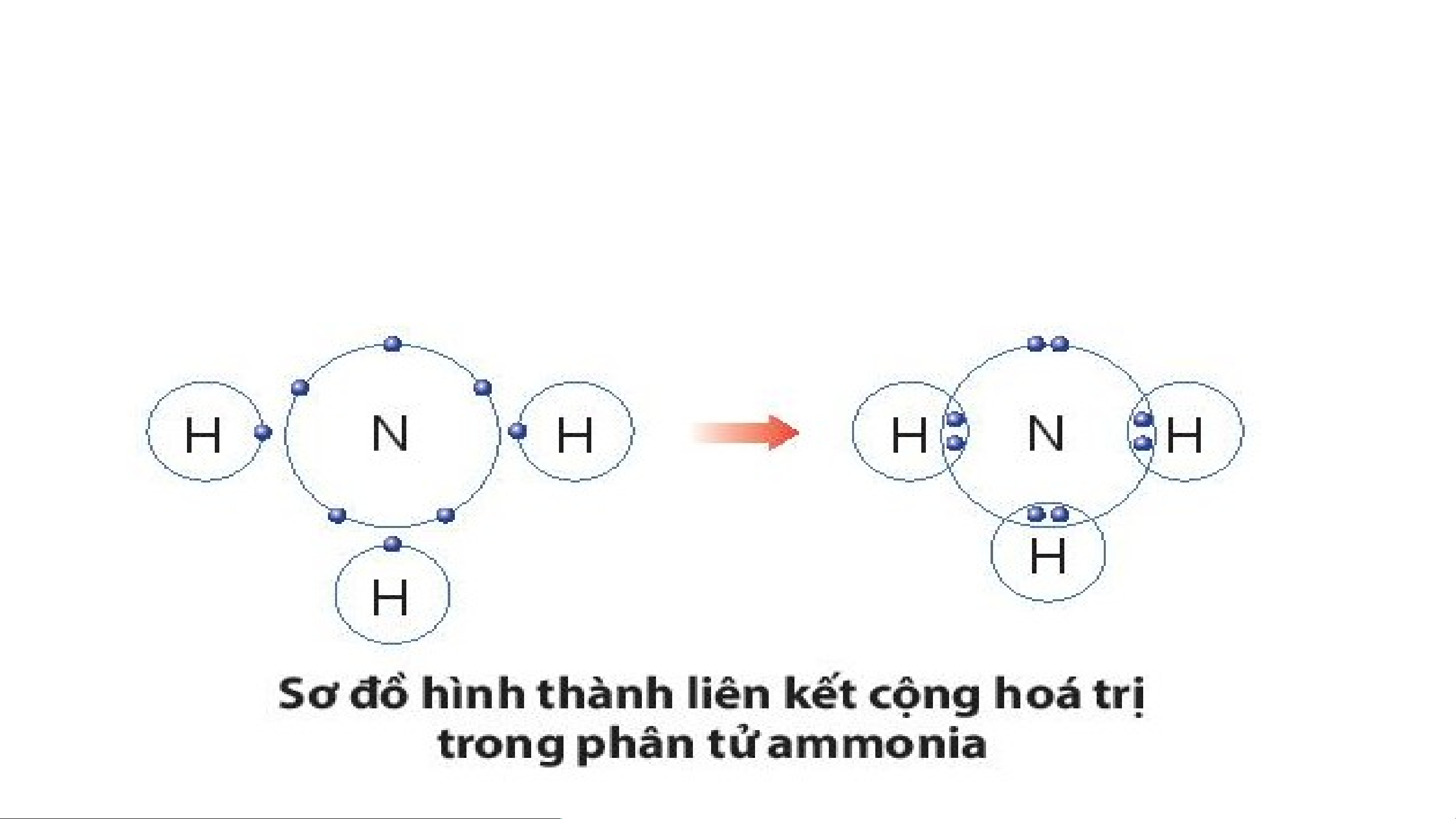
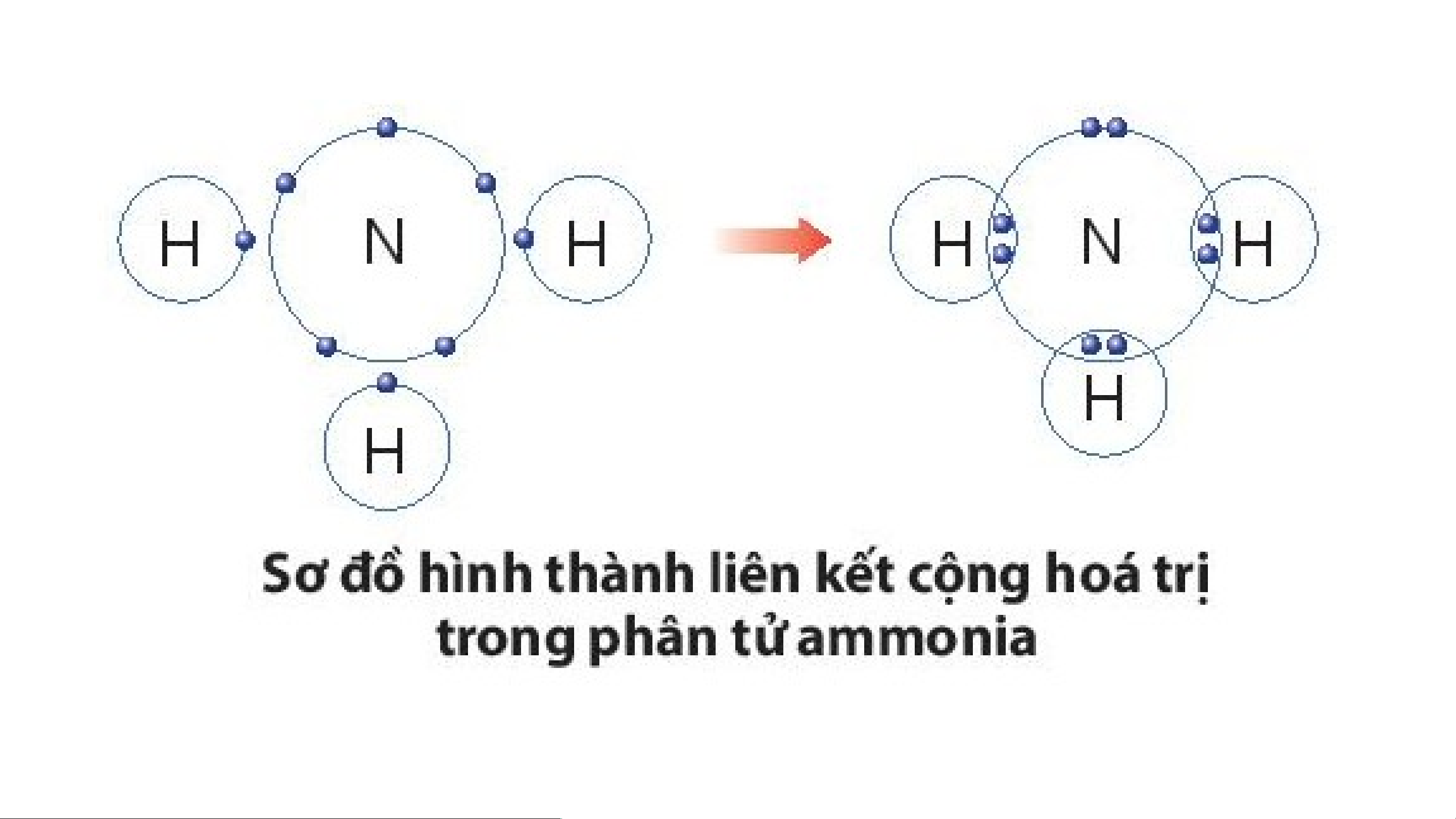
Ví dụ 2: Quá trình tạo thành liên kết cộng hóa trị trong phân tử ammonia:
+ Nitrogen thuộc nhóm VA, có 5 electron lớp ngoài cùng, nguyên
tử nitrogen sẽ góp chung 3 electron.
+ Hydrogen thuộc nhóm IA, có 1 electron lớp ngoài cùng, mỗi
nguyên tử hydrogen sẽ góp chung 1 electron, theo sơ đồ sau:
SƠ ĐỒ TẠO THÀNH LIÊN KẾT ION
TRONG PHÂN TỬ Magnesium Oxide DẶN DÒ:
- VẼ MÔ HÌNH VÀ MÔ TẢ QUÁ TRÌNH TẠO THÀNH
LIÊN KẾT ION TRONG PHÂN TỬ:
Magnesium oxide; Sodium chloride
- ÔN BÀI 1 ĐẾN BÀI 6 ĐỂ KTCK1 (TUẦN 8)
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31




