














Preview text:
Quan sát sơ đồ nguyên tử các nguyên tố, đọc đoạn thông tin
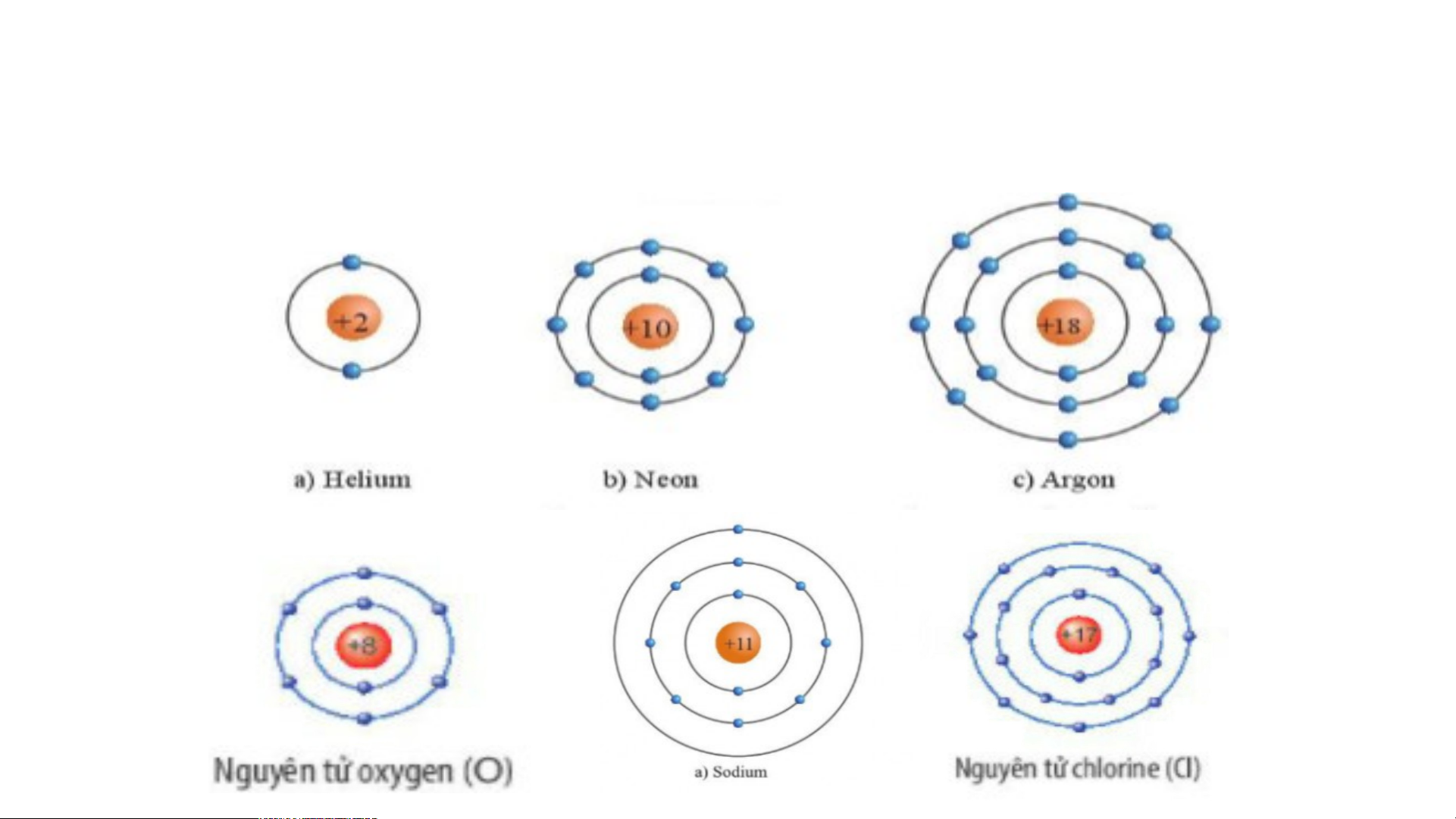
sách giáo khoa hoàn thiện PHT số 1 và câu hỏi phần khởi động. Nguyên Số p Số e Số lớp e Số e Chu kì Nhóm Thuộc loại tử LNC nguyên tố KL/PK/KH He Ne Ar Na Cl O
Đáp án Phiếu học tập số 1 Nguyên Số Số Số lớp e Số e lớp Thuộc loại nguyên tố tử proton eletron ngoài cùng KL/PK/KH He 2 2 1 2 Khí hiếm Ne 10 10 2 8 Khí hiếm Ar 18 18 3 8 Khí hiếm Na 11 11 3 1 Kim loại Cl 17 17 3 7 Phi kim O 8 8 2 6 Phi kim
Tại sao ở điều kiện thường các nguyên tử khác (như
Na, Cl,...) luôn có xu hướng
kết hợp với nhau, còn các nguyên tử khí hiếm (Ne,
He,...) thường trơ, bền và
Các nguyên tử của nguyên
chỉ tồn tại độc lập?
tố kết hợp với nhau theo quy tắc nào?
BÀI 6: GIỚI THIỆU VỀ LIÊN KẾT HÓA HỌC 1. Vỏ nguyên tử
Trừ helium, vỏ nguyên tử khí hiếm
của các nguyên tố còn lại ở
hình 6.1 có những điểm
Vỏ nguyên tử của các nguyên tố khí hiếm đều
giống và khác nhau nào?
có 8 electron ở lớp ngoài cùng, riêng helium
lớp ngoài cùng chỉ có 2 electron.
Các nguyên tố khí hiếm:
+ Giống nhau: Đều có 8 electron ở lớp ngoài cùng.
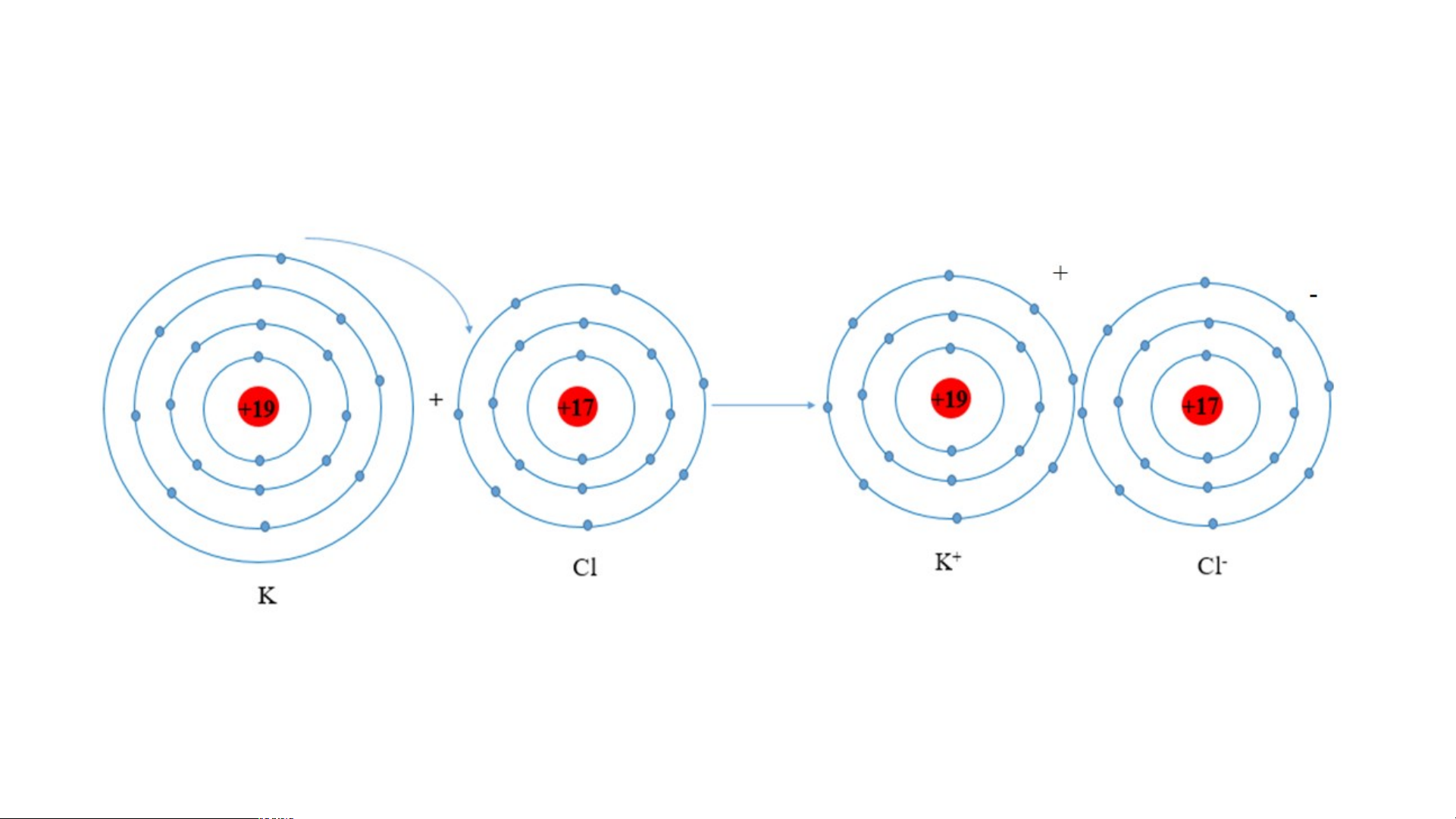
+ Khác nhau: Số lớp electron khác nhau (tăng dần: 1 lớp, 2 lớp, ...). 2. Liên kết ion - Quan sát hình 6.2 em hãy mô tả sự hình thành +11 ion Sodium, ion +11 +1 e magnesium
- Nhận xét về số Nguyên tử sodium (Na) Ion sodium (Na+) electron lớp ngoài cùng của các ion +1 +1 này và cho biết + 2 2 2e sự phân bố electron của 2 ion
Nguyên tử magnesium (Mg) Ion magnesium (Mg2+) này giống sự Hình 6.2 phân bố electron của nguyên tử khí hiếm nào. 2. Liên kết ion
- Nguyên tử Na nhường 1
electron ở lớp electron ngoài
cùng tạo thành ion Na; +11 +11 +
nguyên tử Mg nhường 2 1e
electron ở lớp electron ngoài Nguyên tử sodium (Na) Ion sodium (Na+)
cùng tạo thành ion Mg.
- Số electron lớp ngoài cùng
của các ion này đều bằng 8; +1 +1 + 2e 2 2
sự phân bố electron của 2
ion này giống sự phân bố
Nguyên tử magnesium (Mg) Ion magnesium (Mg2+)
electron của nguyên tử khí Hình 6.2 hiếm Ne. 2. Liên kết ion
a. Sự tạo thành ion dương
- Nguyên tử kim loại khi nhường electron sẽ tạo
thành ion dương tương ứng. Luyện tập
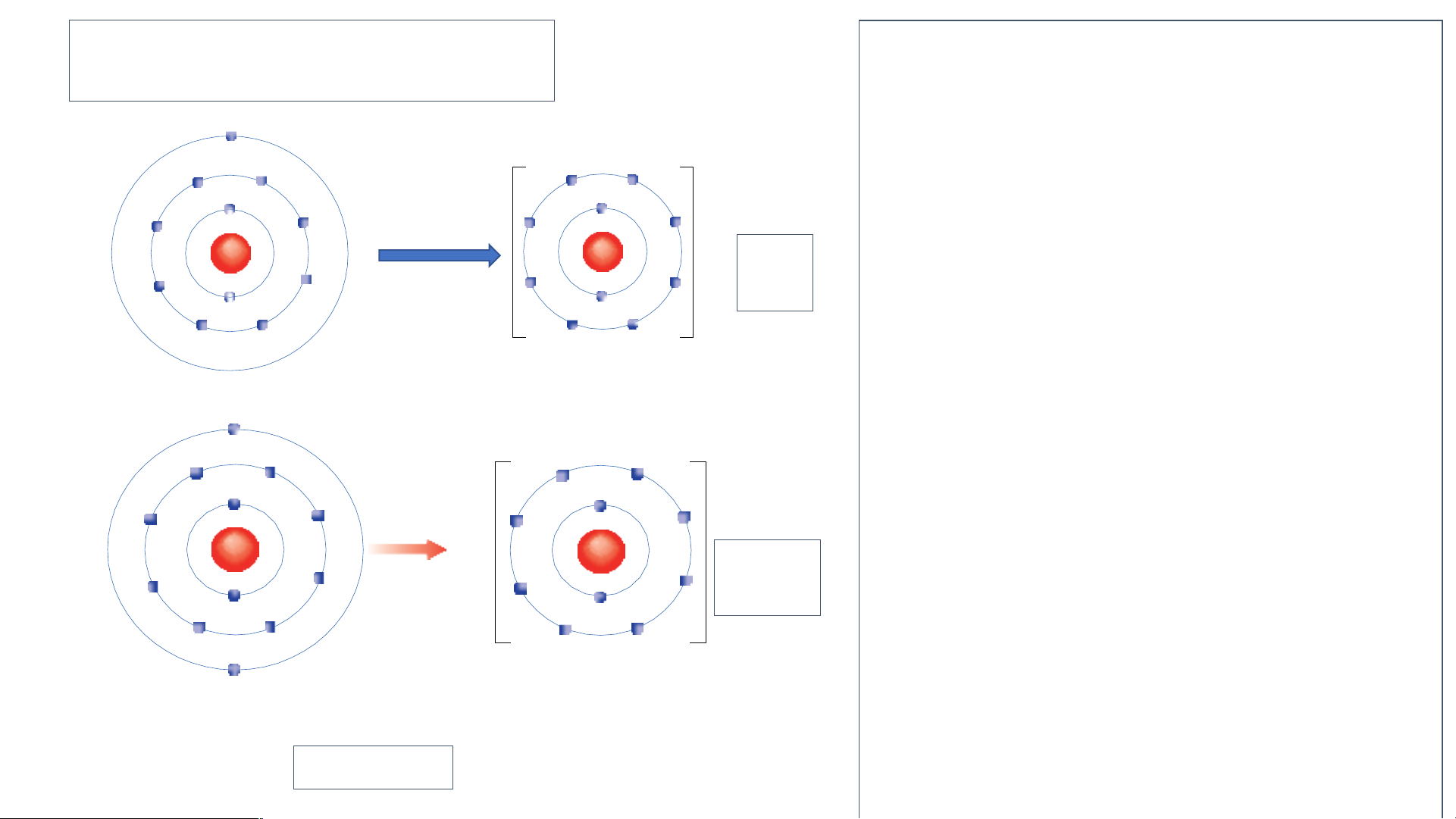
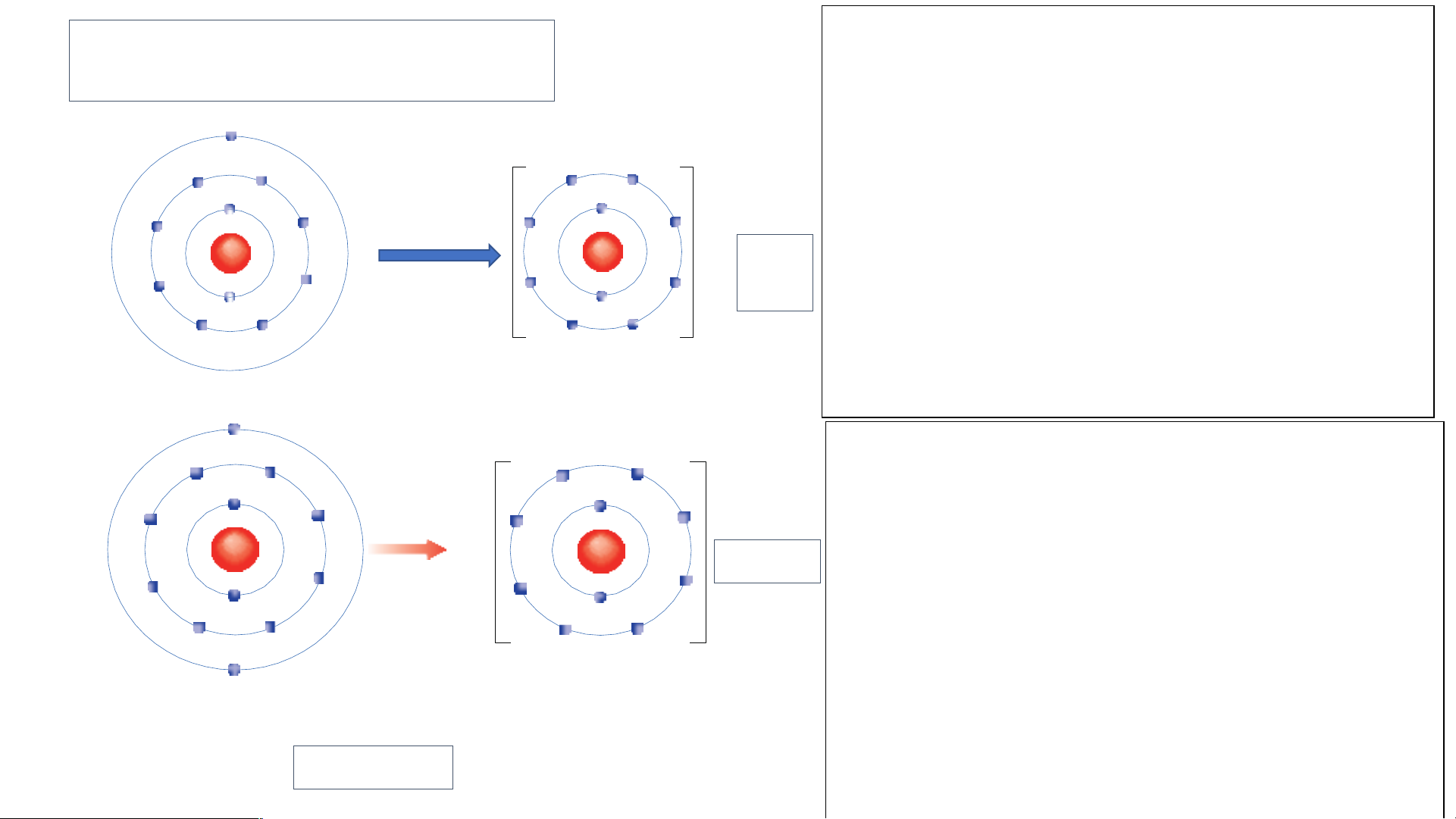
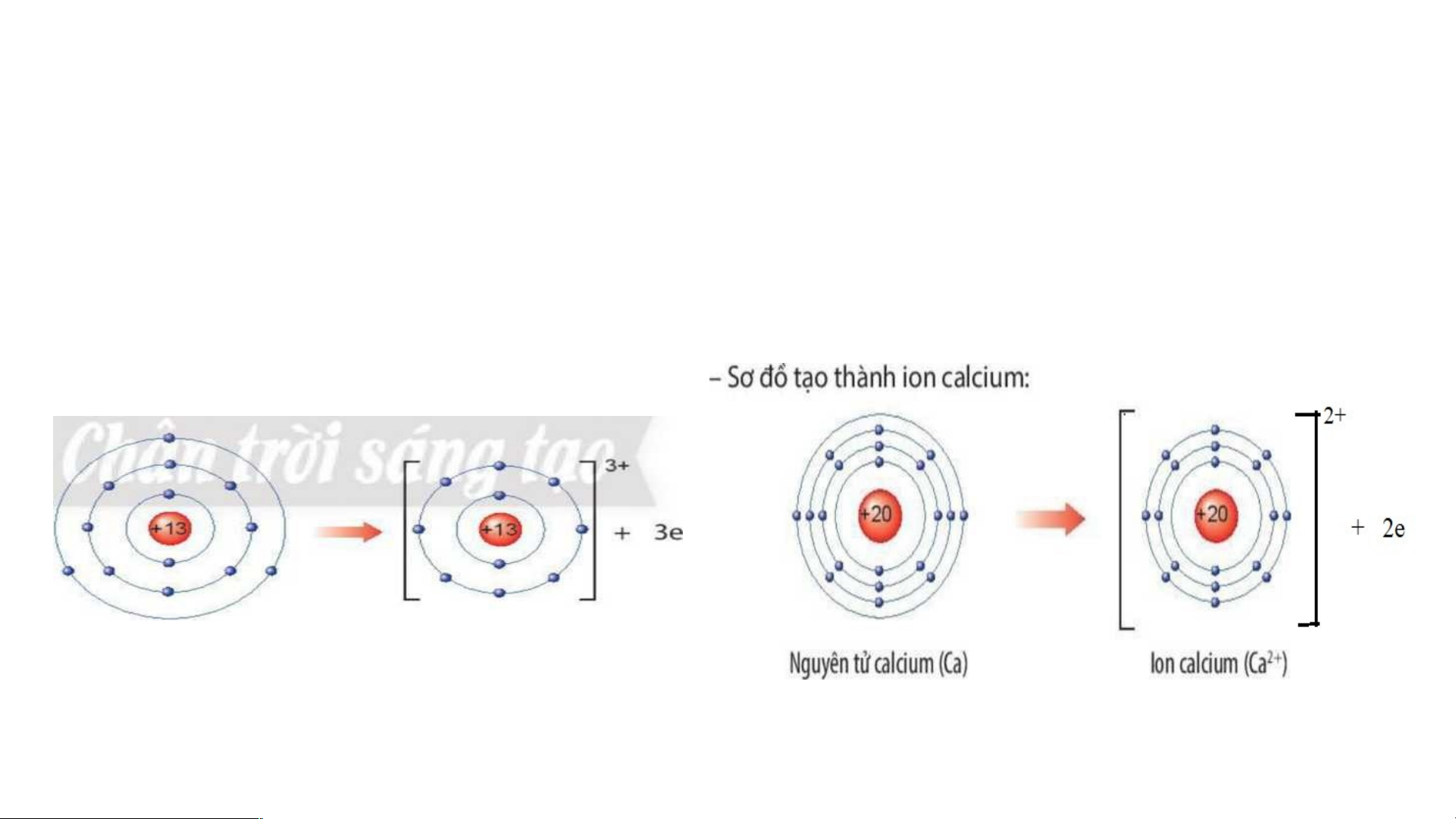
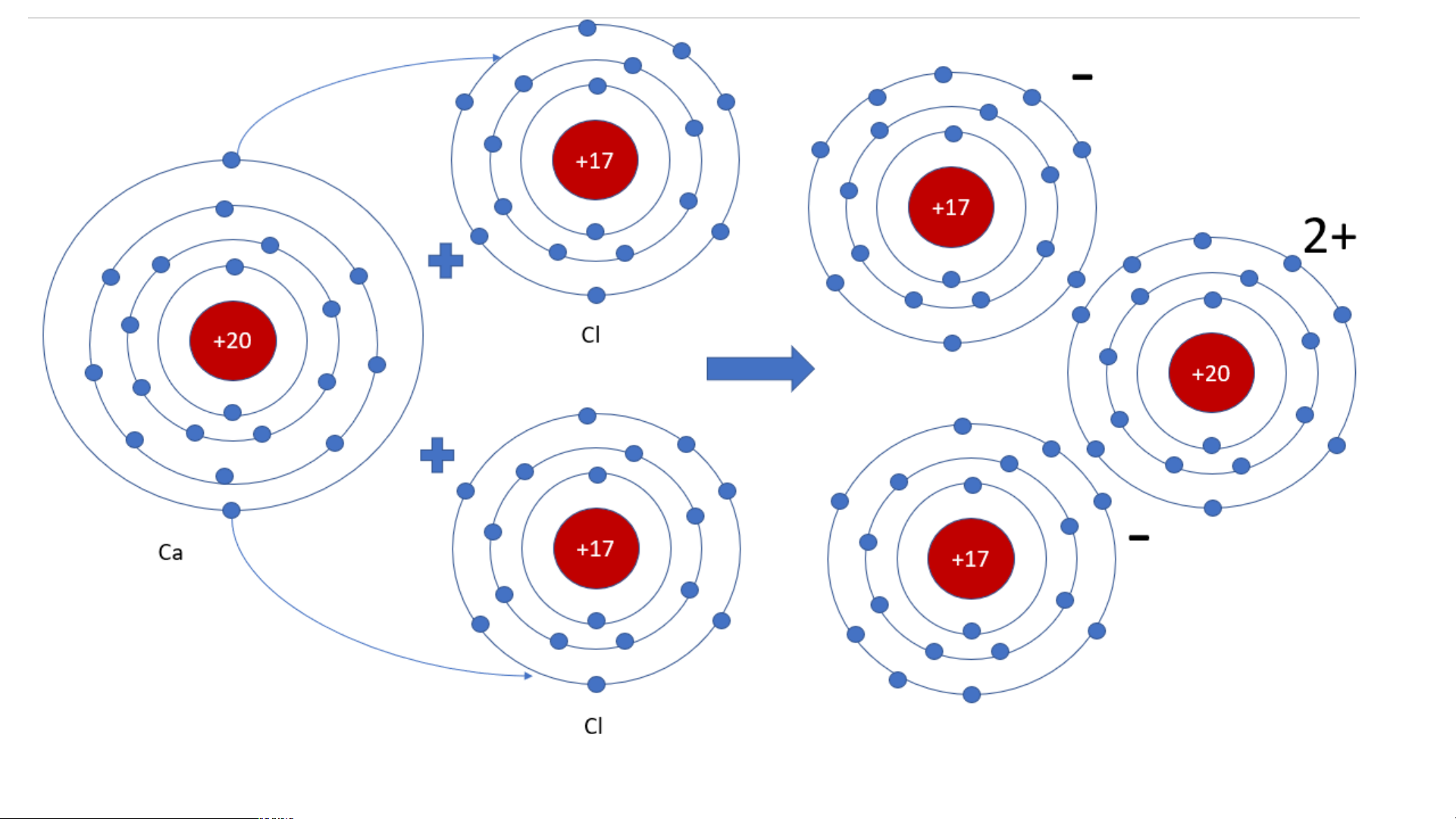
Em hãy xác định vị trí của Ca, Al trên bảng tuần hoàn và
vẽ sơ đồ tạo thành ion Ca2+ , Al3+ từ nguyên tử Ca, Al.
Al thuộc nhóm IIIA, chu kì 3
- Calcium thuộc nhóm
- Sơ đồ tạo thành ion Al: IIA, chu kì 4
Nguyên tử aluminium (Al) lon aluminium(Al3+) 2. Liên kết ion -- Quan
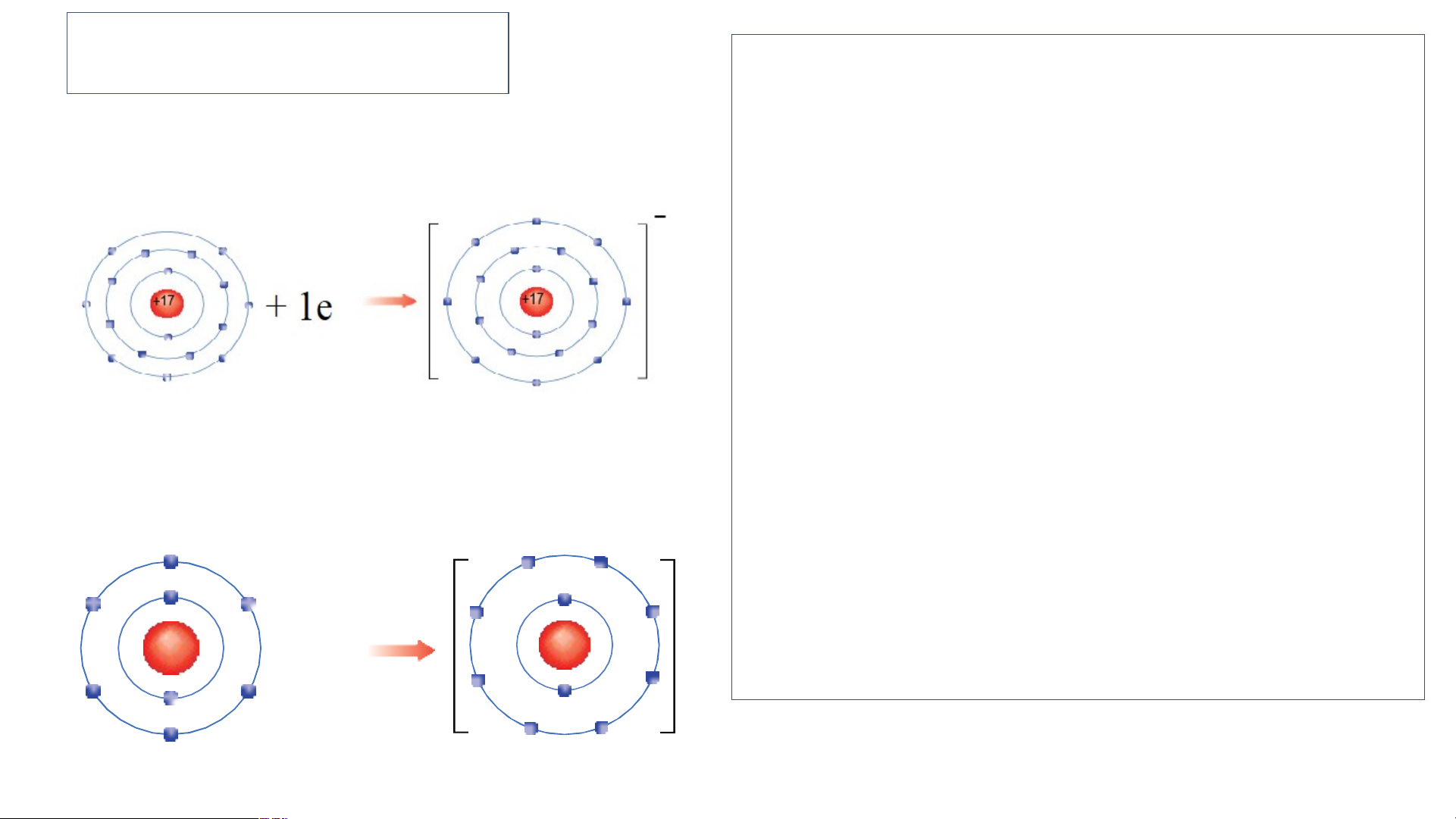
Nguy sát Hình 6.3, em hãy
ên tử Cl nhận thêm 1
b. Sự tạo thành ion âm m el ô ec tả tr sự tạo thàn on vào lớp ele h ct ion ron ngoài c c h ù lori ng d tạ e o , ion oxide. thành ion Cl- -- Nhận Nguy xét về số ên tử oxyge el n ectr nhậ on n t l hêớp m 2 ngoài electr cù on ng c vào ủa các lớp elect ion này ron ngoài và c cù h ng o bi tạo t ết s hà ự phân nh ion ox bố ide.
Nguyên tử chlorine (Cl) Ion chloride(Cl-) - electr Số e on lect c r ủ o a 2 i n lớ on p ng này oài cùng của +8 gi c ống ác io sự ph n này đân b ề ố u bằn e g le 8 ctr ; s on ự phân c bủ ố a nguyên tử k
electron của io hí hiế n oxid m e và ion +8 + 2e +8 nào?
chloride giống sự phân bố
electron của nguyên tử khí hiếm
Nguyên tử oxygen (O) Ion Oxide (O2-) Ne và Ar. 2. Liên kết ion
a. Sự tạo thành ion dương
- Nguyên tử kim loại khi nhường
electron sẽ tạo thành ion dương tương ứng.
b. Sự tạo thành ion âm
- Nguyên tử phi kim khi nhận
electron sẽ tạo thành ion âm tương ứng. Luyện tập
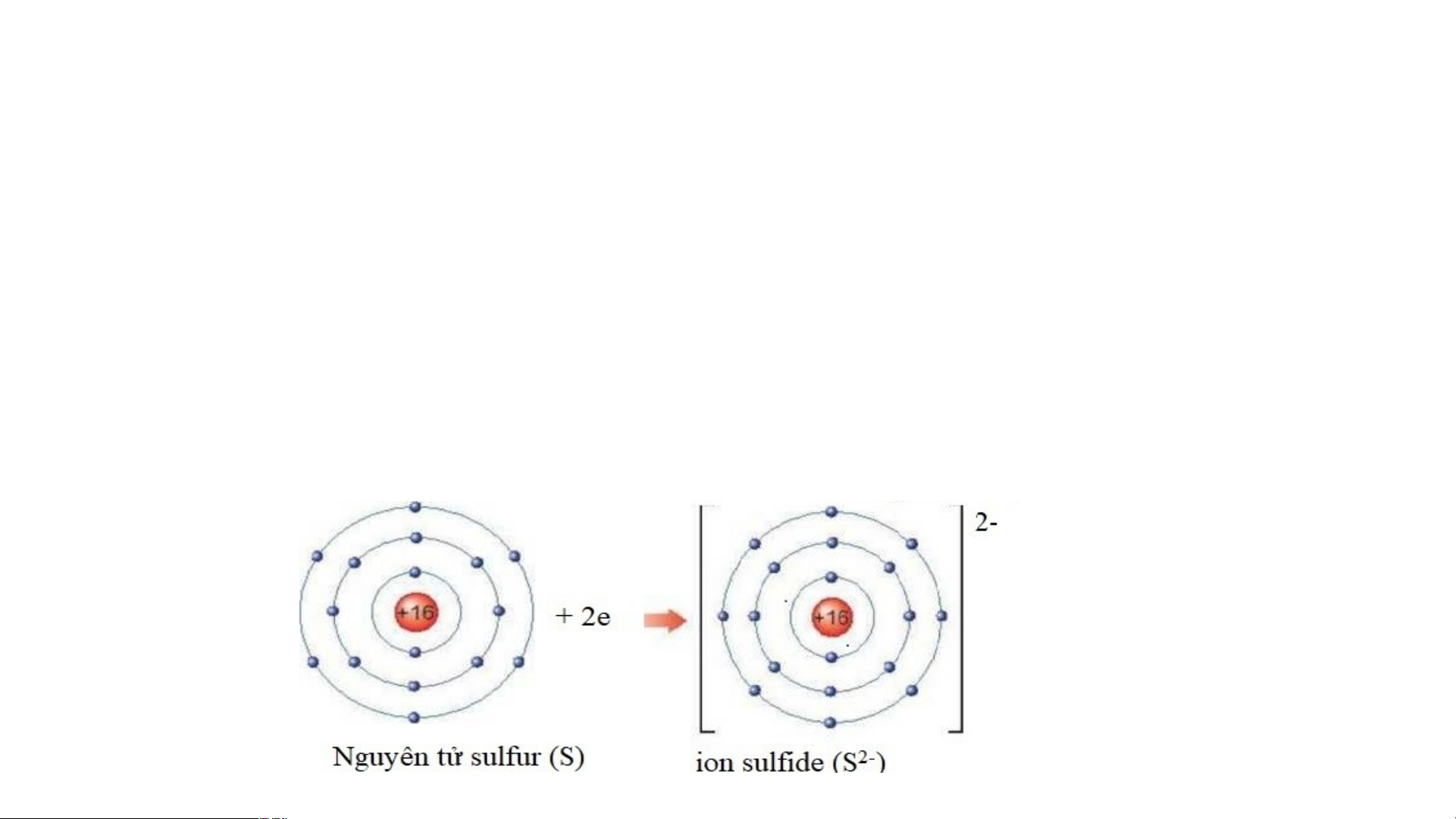
- Em hãy xác định vị trí của S trên bảng tuần hoàn
- Vẽ sơ đồ tạo thành ion sulfide từ nguyên tử S. Trả lời:
- Sulfur thuộc chu kì 3, nhóm VIA.
- Sơ đồ tạo thành ion sulfide: 2. Liên kết ion
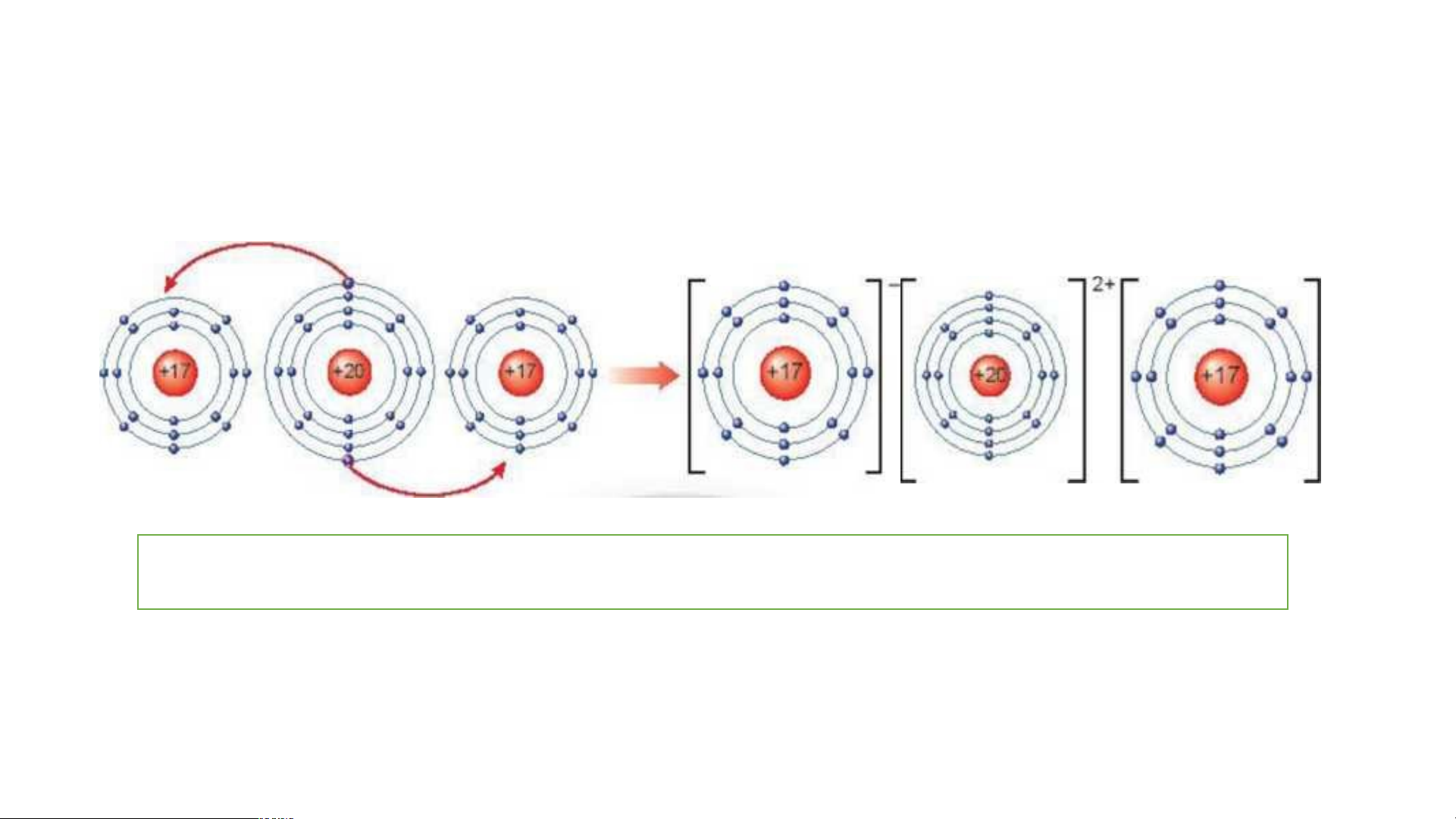
c. Sự tạo thành liên kết ion
+ Nguyên tử Na nhường 1 electron tạo ion Na+ (điện tích
- Quan sát Hình 6.4.a, em hãy mô tả quá trìn dươ h tạo ng), ngu th yê à n nh tử c li hl ên k orine ết n io hận n 1 etro le n ctr g on phân tạo ion tử sodium chlor chlorine (điệ ide n tí (NaCl) ch âm), h .
ai ion trên trái dấu nên hút - Nê nh u một au, tạo th số ứ ành png d hân ụ tử ng củ sodium a sodium c chloride. hloride
(NaCl) trong đời sống.
Video sự hình thành liên kết ion NaCl
Sodium chloride có rất nhiều ứng dụng thiết yếu:
- Trong công nghiệp: Dùng sản xuất giấy, thuốc nhuộm. Sử dụng trong
công nghiệp dệt may và sản xuất vải, sản xuất xà phòng, chất tẩy rửa.
Nguyên liệu ban đầu để sản xuất xút. Trong sản xuất cao su, nó dùng để
làm trắng các loại cao su. Trong dầu khí, nó là thành phần quan trọng
trong dung dịch khoan giếng. Chế tạo sản xuất nhôm, đồng, thép, điều chế nước Javen….
- Trong nông nghiệp và đời sống: Giúp cân bằng sinh lý trong cơ thể
người, gia súc, gia cầm. Cung cấp thêm vi lượng khi trộn với các loại
phân hữu cơ để tăng hiệu quả của phân bón. Sử dụng để bảo quản thực
phẩm. Dùng để ướp thực phẩm tươi sống như cá, tôm … để không bị
ươn, ôi trước khi thực phẩm được nấu, vận chuyển đi xa…
- Trong y tế: Sát trùng vết thương, pha huyết thanh, thuốc tiêu độc và
một số loại thuốc khác để chữa bệnh, cung cấp muối khoáng cho cơ thể,
khử độc, thanh lọc cơ thể, làm đẹp da, chữa viêm họng, chữa hôi miệng…. 2. Liên kết ion
c. Sự tạo thành liên kết ion Liên kết ion là
- Liên kết ion là liên kết giữa ion dương và ion âm. gì?
- Các ion dương và ion âm đơn nguyên tử có lớp
electron ngoài cùng giống với nguyên tử của nguyên tố khí hiếm.
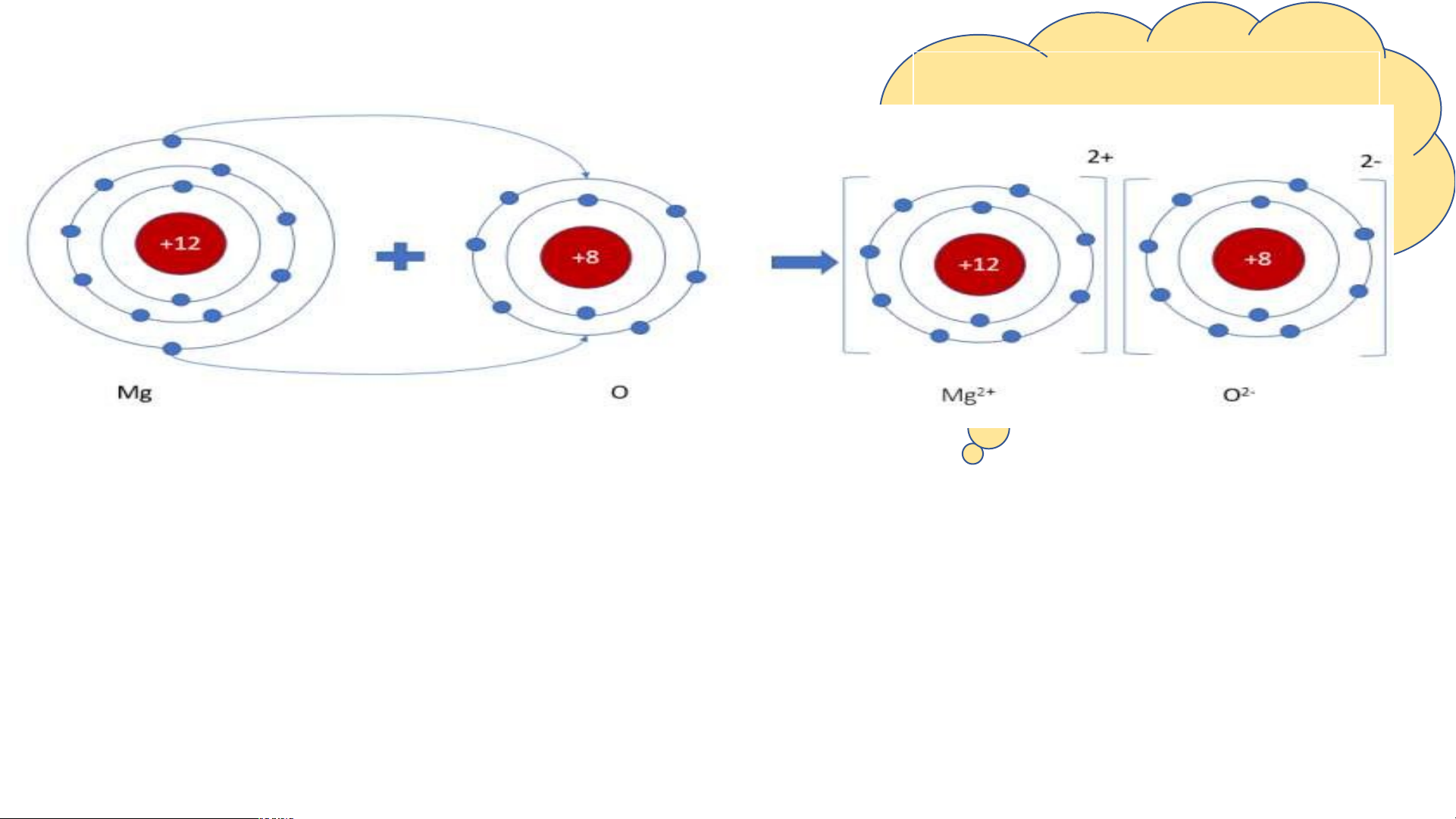
Sơ đồ tạo thành liên kết ion trong phân tử H m ã a y g v n ẽ es sơ đồ và m ium oxi ô de tả
quá trình tạo thành liên
kết ion trong phân tử hợp chất magnesium oxide.
Hình mô phỏng phân tử magnesium oxide
- Nguyên tử magnesium nhường 2 electron tạo ion magnesium
(điện tích dương). Nguyên tử oxygen nhận 2 electron tạo ion oxide
(điện tích âm). Hai ion trên trái dấu nên hút nhau, tạo thành phân tử magnesium oxide.
Ứng dụng của calcium chloride :
Calcium chloride có nhiều ứng dụng trong đời sống. Tìm
- Dùng để làm khô trong quy trình chế biến thực phẩm đóng hiểu q ộp vàua s các ách loạ báo và i
i tinh bột. nternet, em hãy cho biết một số ứn - g dụn Làm ch g của c ất chốn h g ất này đóng b . ă Vẽ sơ ng tr đồ tạo thàn
ên mặt đường h li ở n ên k hững ế qt tr uố ong c gia phân ôn đớ it ử hocalc ặc ium chlor làm chất ch id ố e
ng . bụi, diệt nấm mốc.
- Trong xây dựng, calcium chloride làm tăng thời gian đông của bê tông.
- Trong công nghệ luyện kim và sản xuất giấy, chất này đóng vai
trò là chất phụ gia quan trọng để tải nhiệt và làm khô.
- Ứng dụng trong hệ thống tiêu nước và xử lý nước thải công nghiệp.
- Là chất hỗ trợ giúp hút oxygen trong không khí, được ứng
dụng làm thiết bị cứu hoả.
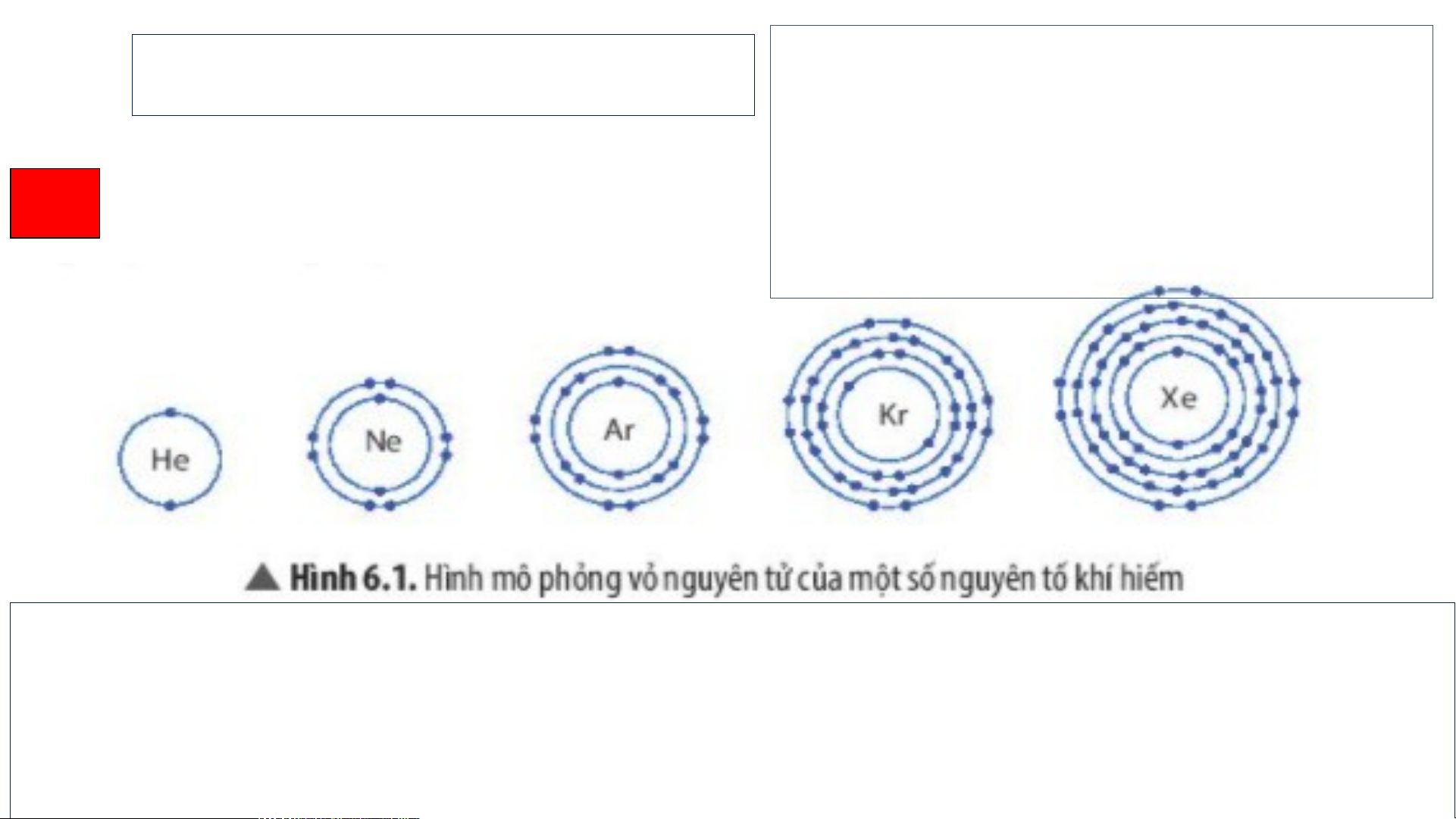
3. Liên kết cộng hoá - Q N uan s guyê á n t H tố ìknh 6 hí hi.5 ế trả m g lờ ần i trị
nhất của hydrogen là He; câu hỏi:
- Nguyên tố khí hiếm gần - D nhấ ựa t c và ủa o ox bảng ygen tuần ho là Ne àn, hãy ch (tương ỉ ra ng ứng uy Hình ê n 6. tố 5). khí
- Để có lớp electron ngoài H He
hiếm gần nhất của
cùng giống nguyên tố khí O Ne hydrogen và oxygen.
hiếm gần nhất, thì: I) a) b) c) d)
Hình 6.5. Lớp electron ngoài cùng của nguyên tử - Đ + Ngể c uyó lớp e ên tử le hy ctr dr o o n ng gen coà ó i xu
hydrogen (a), helium (b), oxygen (c), neon (d) cùng hướng giố th n ê g n m 1 geuy le ên tố ctron kh để í hiếm g lớp ngo ần ài nhất, ng cùng có 2 u eylê e n tử ctron. hy + d Ng ro uy gen v ên tử à o ox x y y g g e en c n có ó xu xu
hướng thêm 2 electron để vỏ hướng gì?
ngoài cùng có 8 electron.
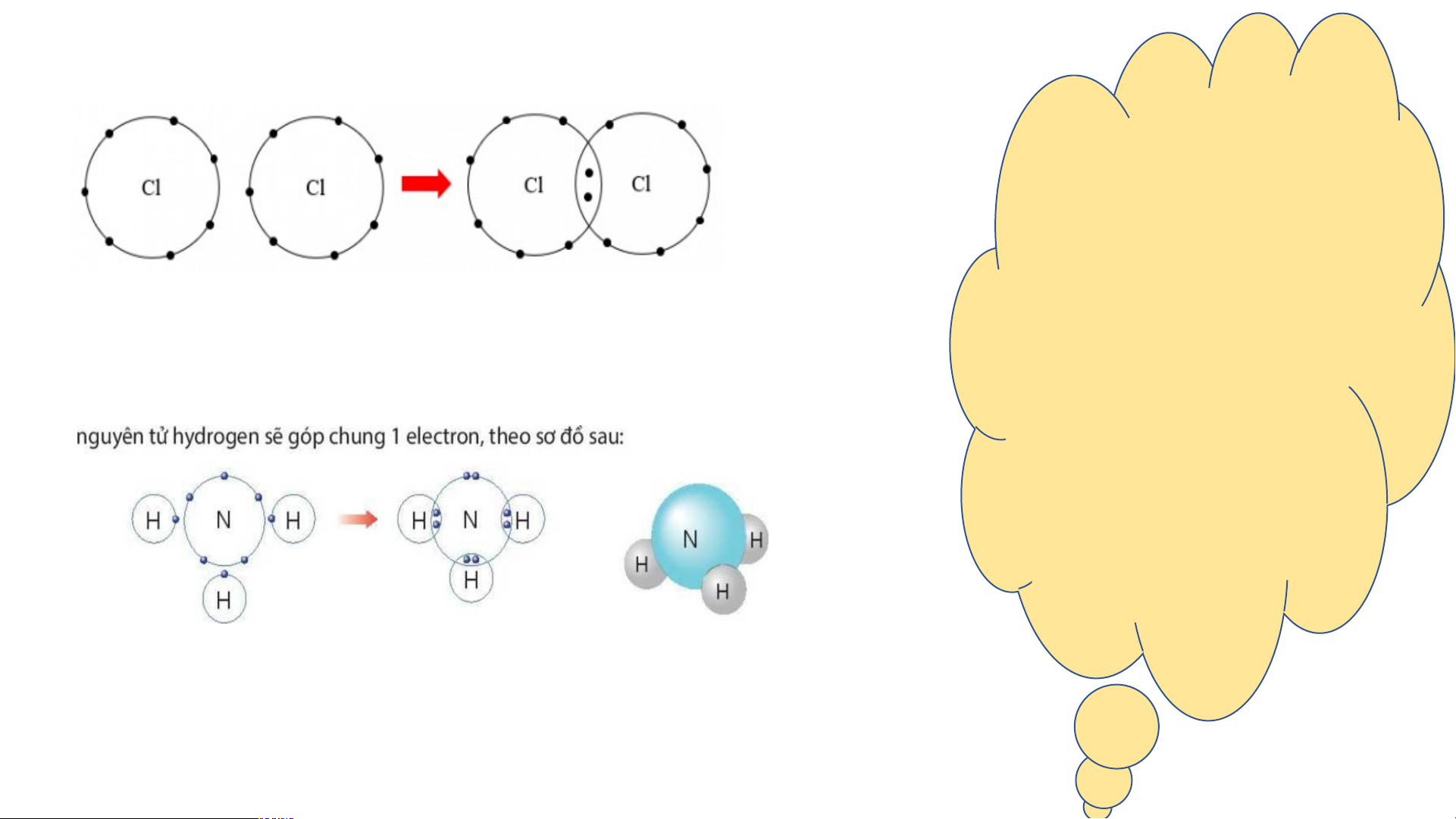
3. Liên kết cộng hoá trị Câu 6:
HS thảo luận nhóm quan sát
- Số electron lớp ngoài cùng của mỗi nguyên tử H
hình 6.6; 6.7; 6.8; 6.9 trả lời câu
trong phân tử hydrogen là 2, giống khí hiếm He hỏi 5,6,7,8,9
- Số electron lớp ngoài cùng của mỗi nguyên tử O
trong phân tử oxygen là 8, giống khí hiếm Ne. 3. Liên kết cộng hoá trị Câu C 7: âu 8: âu 9: - Mỗi ngu Mô tả qu yên á tr tử H - Mỗi nguyên tử ình góp chu H góp chu tạo thành ng 1 liên kel ế ectr ectron ,tạo thành t cộng quá trị tr nguyên tử O ong phân góp phân tử tử hyd chung n 2 r ogen ele ước: ctr (gồ on m 2 ngu
với mỗi yên tử H). nguyên tử H. - - M T ỗi ngu rong p Hai n yên tử O hân tử n guyên tử h góp ước, ydr ogech số e n ung 2 lectr ele on góp chunctron lớp n g 1 e tạo thàn goài lec cùn tr h g củ on của a phân tử mỗi ngu oxyge yên n (g tử H ồ
tử với m 2 nguyên là 2 n electron tử O (giốn ). g vỏ
guyên tử oxygen để nguyên tử hình thành he liê lium), n kết nguyê cộng n tử o l
hoá trị. à 8 electron (giống vỏ nguyên tử n - eon C ).
ùng lúc, nguyên tử oxygen cũng góp 2 electron cho
mỗi nguyên tử hydrogen để hình thành liên kết cộng hoá trị. 3. Liên kết cộng hoá trị Vậy liê - Liên kết n kết
cộng cộng hóa trị
hóa trị là l là gì iên ?
kết được hình thành bởi sự dù Phân tử h ng chun ì g enh th
lectr ành nên liên kết cộng hóa trị
on giữa hai nguyên tử. thườ - Li ng là ên kết nguyên tố k
cộng hóa trị thim loại hay ph ường là l i kim?
iên kết giữa hai nguyên
tử của nguyên tố phi kim với phi kim. a. Chlorine Luyện tập: Vẽ sơ đồ hình thành liên kết cộng b. Ammonia hoá trị trong các phân tử: Chlorine, Ammonia.
Em hãy phân loại các chất sau ? Sodium chloride - NaCl
carbon dioxide- CO 2 Đường tinh luyện - C H O 12 22 11 Calcium chloride- CaCl Nước – H O 2 Magnesium oxide- MgO 2
4. Chất ion, chất cộng hóa trị
Sodium chloride - NaCl Calcium chloride- CaCl Magnesium oxide - MgO 2
1. Cho biết mỗi phân tử của chất trong Hình 6.9 được tạo bởi các ion nào?
Ở điều kiện thường, các chất này ở thể gì?
2. Chất ion là gì? Chúng có đặc điểm gì?
- Chất được tạo bởi các ion dương và ion âm được gọi là chất ion.
- Ở điều kiện thường, chất ion thường ở thể rắn.
4. Chất ion, chất cộng hóa trị
Đường tinh luyện - C H O Ethanol carbon dioxide- CO 12 22 11 2
11.Quan sát và cho biết thể của các chất có trong Hình 6.10.
12.Nêu một số ví dụ về chất cộng hoá trị và cho biết thể của chúng ở điều kiện thường.
Chất cộng hóa trị là gì? Chúng có đặc điểm gì?
Chất được tạo thành nhờ liên kết cộng hoá trị được gọi là chất cộng hoá trị.
Ở điều kiện thường chất cộng hoá trị có thể ở thể rắn, thể lỏng hoặc thể khí.
Khói của núi lửa ngầm phun trào từ dưới
biển có chứa một số chất như: hơi nước,
sodium chloride, potassium chloride,
carbon dioxide, sulfur dioxide.
a. Hãy cho biết chất nào là hợp chất ion,
chất nào là hợp chất cộng hoá trị.
b. Nguyên tử của nguyên tố nào trong các
chất trên có số electron ở lớp ngoài cùng nhiều nhất? Đáp án
a. Chất ion là sodium chloride, potassium chloride;
Chất cộng hoá trị là hơi nước, carbon dioxide, sulfur dioxide.
b. Nguyên tử của nguyên tố Cl có số electron ở lớp ngoài cùng nhiều nhất (7 e)
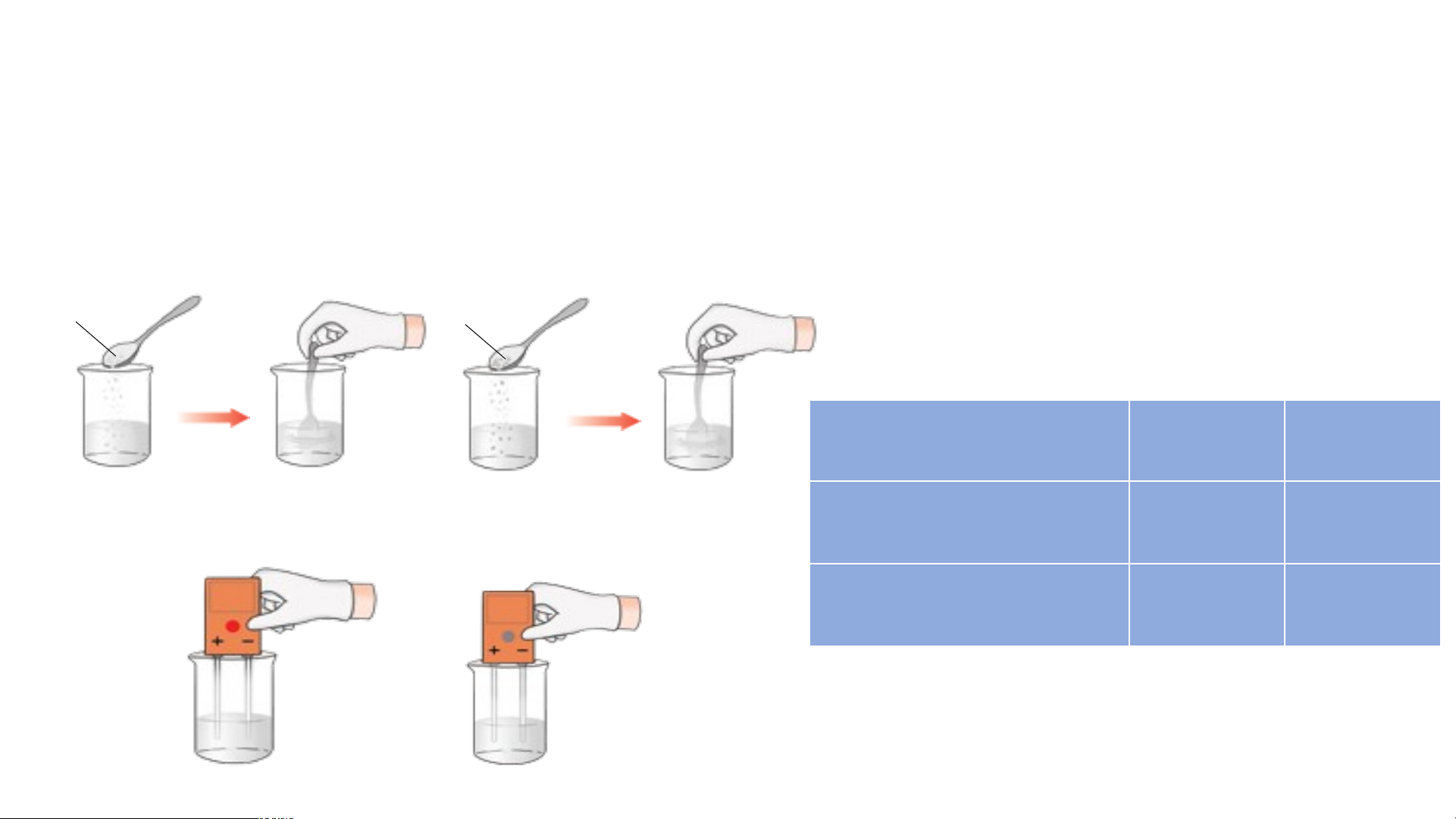
Tiến hành thí nghiệm STT Tên thí Dụng cụ và hóa chất Tiến hành Kết quả nghiệm 1 Khả năng
*Dụng cụ: cốc thuỷ tinh Bước 1: Cho nước vào 2 cốc hoà tan
250 ml, 2 cốc thuỷ tinh Cốc 1: Thêm 1 thìa muối
trong nước 100 ml đánh số 1 và 2, và khả năng
Cốc 2: thêm 1 thìa đường dụng cụ thử khả năng dẫn điện
Bước 2: Khuấy nhẹ, quan sát dẫn điện của dung của muối hiện tượng
dịch, thìa lấy hoá chất. ăn, đường
Bước 3: Đặt dụng cụ thử khả tinh luyện * Hóa chất: muối ăn,
năng dẫn điện vào từng cốc,
(saccharose đường tinh luyện, nước
quan sát khả năng dẫn điện ) cất của từng dung dịch. 2
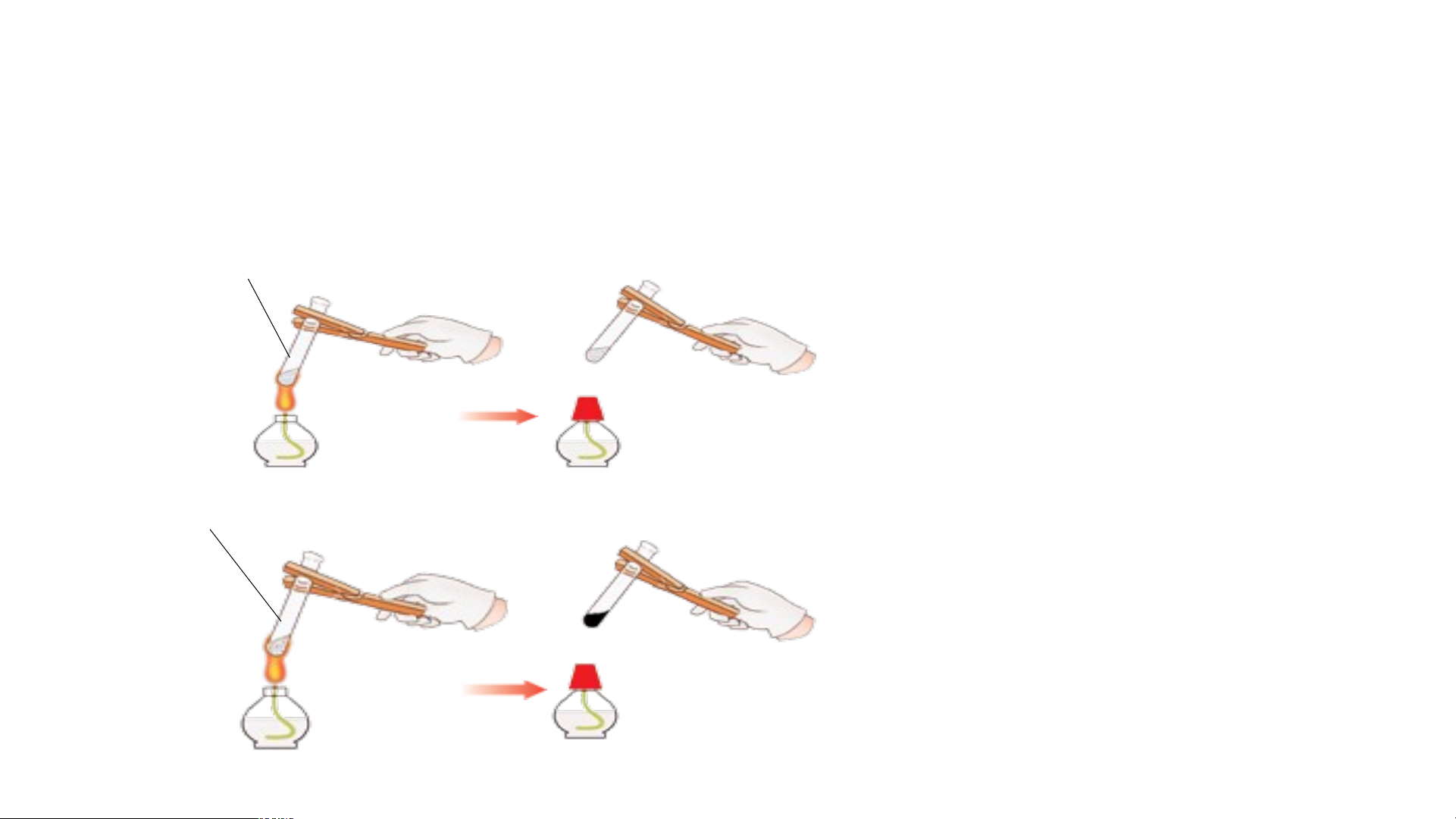
So sánh khả * Dụng cụ: 2 ống Bước 1: năng bền
nghiệm đánh số 1 và 2, ống nghiệm (1): thêm 1 thìa muối nhiệt của kẹp ống nghiệm, đèn
ống nghiệm (2): thêm vào 1 thìa muối và
cồn, thìa lấy hoá chất. đường
đường tinh *Hóa chất: muối ăn,
Bước 2: Đun nóng 2 ống nghiệm luyện đường tinh luyện. bằng đèn cồn, quan sát (saccharose
Bước 3: Sau 2 phút, tắt đèn )
cồn và ghi nhận hiện tượng
5. Một số tính chất của chất ion và chất cộng hóa trị
Thí nghiệm 1: Khả năng hoà tan trong nước và khả năng dẫn điện của
muối ăn, đường tinh luyện (saccharose) Kết quả thí nghiệm Tính chất Muối Đường Tan trong nước X X Dẫn điện được X Dung dịch nước muối
Dung dịch nước đường
5. Một số tính chất của chất ion và chất cộng hóa trị
Thí nghiệm 2: So sánh khả năng bền nhiệt của muối và đường tinh luyện (saccharose) Muối ăn Kết quả thí nghiệm
Muối bền nhiệt hơn đường,
ống nghiệm 2 có sự tạo Đường tinh luyện thành chất mới.
Tiến hành thí nghiệm STT Tên thí Dụng cụ và hóa chất Tiến hành Kết quả nghiệm 1 Khả năng
*Dụng cụ: cốc thuỷ tinh Bước 1: Cho nước vào 2 cốc hoà tan
250 ml, 2 cốc thuỷ tinh Cốc 1: Thêm 1 thìa muối
trong nước 100 ml đánh số 1 và 2, và khả năng
Cốc 2: thêm 1 thìa đường dụng cụ thử khả năng dẫn điện
Bước 2: Khuấy nhẹ, quan sát dẫn điện của dung của muối hiện tượng
dịch, thìa lấy hoá chất. ăn, đường
Bước 3: Đặt dụng cụ thử khả tinh luyện * Hóa chất: muối ăn,
năng dẫn điện vào từng cốc,
(saccharose đường tinh luyện, nước
quan sát khả năng dẫn điện ) cất của từng dung dịch. Muối bền nhiệt hơn 2
So sánh khả * Dụng cụ: 2 ống Bước 1: đường, ống nghiệm năng bền
nghiệm đánh số 1 và 2, ống nghiệm (1): thêm 1 thìa muối 2 có sự tạo thành nhiệt của kẹp ống nghiệm, đèn
ống nghiệm (2): thêm vào 1 thìa muối và
cồn, thìa lấy hoá chất. đường chất mới.
đường tinh *Hóa chất: muối ăn,
Bước 2: Đun nóng 2 ống nghiệm luyện đường tinh luyện. bằng đèn cồn, quan sát (saccharose
Bước 3: Sau 2 phút, tắt đèn )
cồn và ghi nhận hiện tượng
5. Một số tính chất của chất ion và chất cộng hóa trị
- Chất ion khó bay hơi, khó nóng chảy, khi tan trong
nước tạo dung dịch dẫn được điện.
- Chất cộng hóa trị thường dễ bị bay hơi, kém bền với
nhiệt, một số chất tan được trong nước thành dung
dịch. Tùy thuộc vào chất cộng hóa trị khi tan trong
nước mà dung dịch thu được có thể dẫn điện hoặc không dẫn điện. CỦNG CỐ
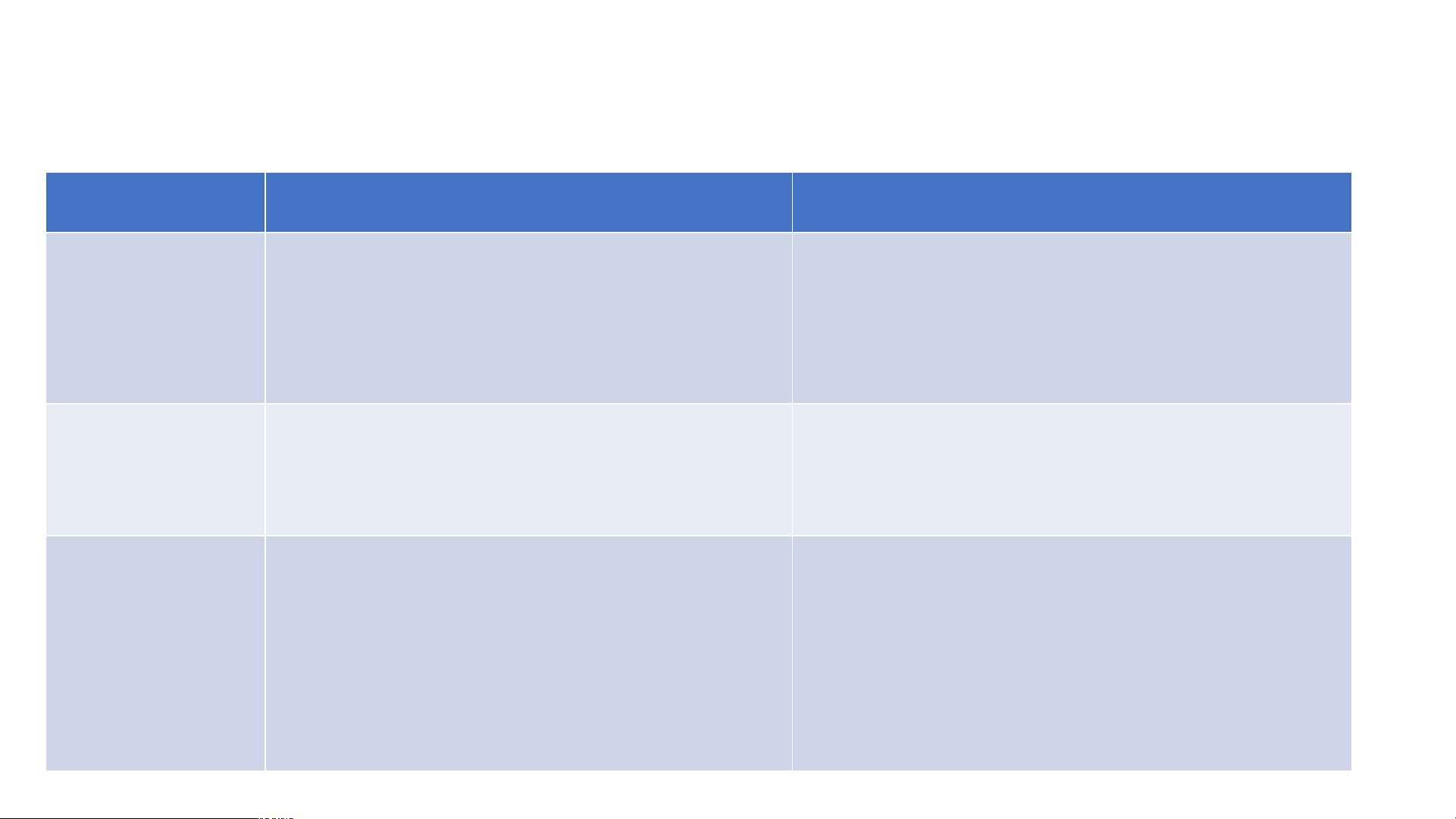
Hoàn thành nội dung bảng sau Nội dung Liên kết ion Liên kết cộng hóa trị Khái niệm Thành phần cấu tạo phân tử Tính chất của chất CỦNG CỐ Nội dung Liên kết ion Liên kết cộng hóa trị Khái niệm
Là liên kết giữa ion dương và ion Liên kết được hình thành bởi sự âm
dung chung electron giữa 2 nguyên tử
Thành phần Thường là liên kết giữa kim loại
Thường là liên kết giữa các nguyên cấu tạo và phi kim tử phi kim phân tử Tính chất - Khó bay hơi - Dễ bay hơi của chất - Khó nóng chảy - Kém bền với nhiệt
- Tan trong nước tạo dd dẫn được - Tùy thuộc và chất cộng hóa trị mà điện
tan trong nước tạo dung dịch có
thể dẫn điện hoặc không Luyện tập Tính chất Chất A Chất B - Kết quả thử nghiệm tính chất Thể (25 oC) Rắn Lỏng của 2 chất A và B Nhiệt độ sôi (oC) 1500 64,7 được trình bày ở
Nhiệt độ nóng chảy (oC) 770 −97,6 bảng bên. Em hãy
Khả năng dẫn điện của Có Không cho biết chất nào dung dịch là chất cộng hoá trị, chất nào là
Chất A là hợp chất ion. Chất A có thể là pot ch assiu ất m i c on hl . oride.
Chất B là chất cộng hoá trị. Chất B có thể là methanol.
Đại diện các nhóm bốc thăm chọn câu hỏi:
Vẽ sơ đồ hình thành liên kết trong phân tử
1. Potassium chloride (KCl)
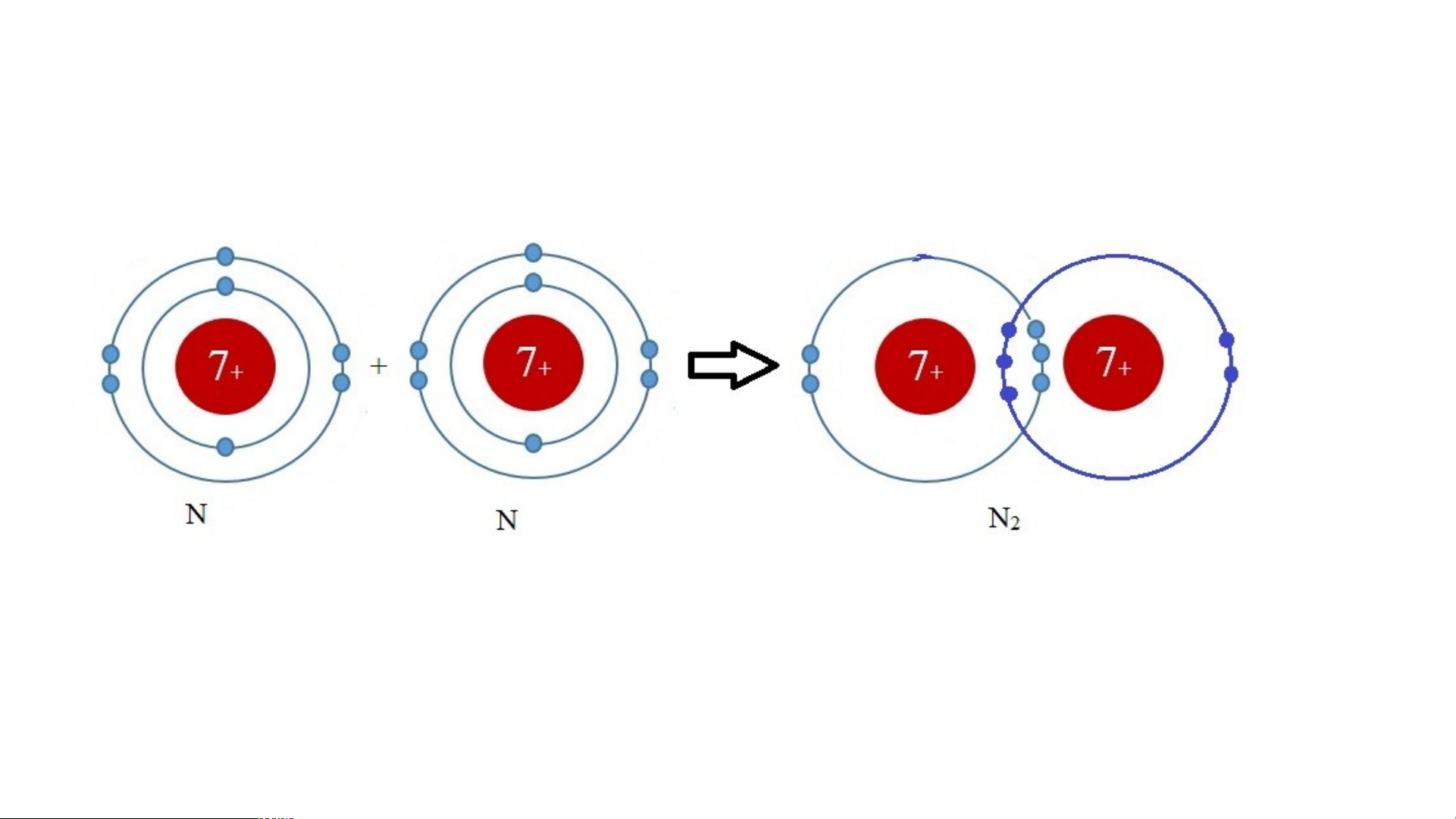
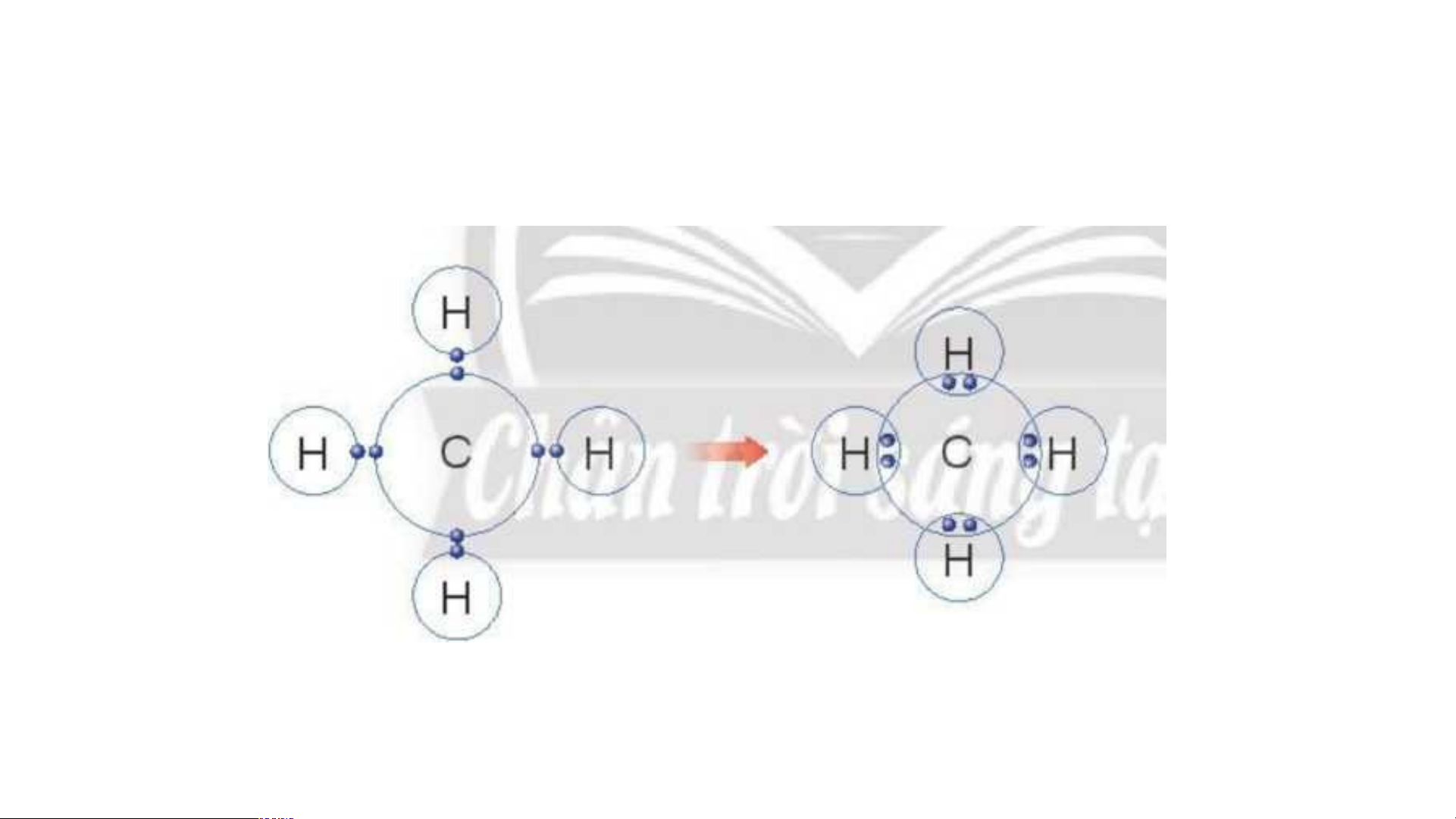
2. Calcium chloride (CaCl ) 2 3. Nitrogen (N ) 2 4. Metan (CH ) 4
Potassium chloride (KCl)
Calcium chloride (CaCl ) 2 _ Cl Ca Cl Cl- Ca2+ Cl- Nitrogen (N ) 2 Metan (CH ) 4
Document Outline
- Slide 1
- Slide 2
- Đáp án Phiếu học tập số 1
- Slide 4
- BÀI 6: GIỚI THIỆU VỀ LIÊN KẾT HÓA HỌC
- 1. Vỏ nguyên tử khí hiếm
- 2. Liên kết ion
- 2. Liên kết ion
- 2. Liên kết ion
- Slide 10
- Slide 11
- 2. Liên kết ion
- Slide 13
- 2. Liên kết ion
- Slide 15
- Slide 16
- 2. Liên kết ion
- Slide 18
- Slide 19
- 3. Liên kết cộng hoá trị
- 3. Liên kết cộng hoá trị
- 3. Liên kết cộng hoá trị
- 3. Liên kết cộng hoá trị
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- 5. Một số tính chất của chất ion và chất cộng hóa trị
- 5. Một số tính chất của chất ion và chất cộng hóa trị
- Slide 32
- Slide 33
- CỦNG CỐ
- CỦNG CỐ
- Slide 36
- Slide 37
- Potassium chloride (KCl)
- Calcium chloride (CaCl2)
- Nitrogen (N2)
- Metan (CH4)




