





































Preview text:
MÔN: KHOA HỌC TỰ NHIÊN 8
Giáo viên: Nguyễn Thuỵ Tường Vân Khởi động Trả lời:
- Học sinh quan sát các mẫu sau: (1) Bí -Làm cho các loại bánh mức
đao ngâm trong nước vôi trong làm mứt, dẻo, dai và trong.Nhất là đối
(2) cà chua ngâm trong nước vôi trong
với các loại bánh mức có vị
làm mứt.Tìm hiểu vai trò của nước vôi đắng hăng thì nước vôi trong trong?
có công dụng làm giảm vị đắng và vị hăng đó NỘI I. KHÁI NIỆM DUNG
II. TÍNH CHẤT HÓA HỌC BÀI HỌC III. THANG PH I. HOẠT ĐỘNG KHÁI TÌM HIỂU NIỆM KHÁI NIỆM BASE
Bảng 9.1. Tên một số base thông dụng, công thức
hoá học và dạng tồn tại của base trong dung dịch Tên base Công thức
Dạng tồn tại của base Dạng tồn tại của hoá học trong dung dịch base trong dung Cation kim loại dịch Anion Sodium NaOH Na+ OH− hydroxide Barium Ba(OH) hydroxide 2 Ba2+ OH−
Quan sát bảng trên và thực hiện các yêu cầu 1. 2. 3. 4. Công thức Các dung Thảo luận Em hãy hoá học dịch base nhóm và đề nhận xét về của các có đặc xuất khái cách gọi tên base có điểm gì niệm về base và đọc đặc điểm chung? base. tên base gì giống Ca(OH) . nhau? 2 BÀI 9 : BASE-THANG PH
I.KHÁI NIỆM VÀ PHÂN LOẠI:
Quan sát Bảng 9.1 và thực hiện Trả lời: các yêu cầu:
1. Công thức hoá học của các base đều có chứa
1. Công thức hoá học của các nhóm hydroxide (−OH).
base có đặc điểm gì giống nhau? 2. Các dung dịch base đều có chứa anion OH−.
2. Các dung dịch base có đặc
3. Khái niệm: Base là những hợp chất trong điểm gì chung?
phân tử có nguyên tử kim loại liên kết với nhóm
3. Thảo luận nhóm và đề xuất
hydroxide. Khi tan trong nước, base tạo ra ion khái niệm về base. OH−.
4. Em hãy nhận xét về cách gọi 4. Quy tắc gọi tên các base: Tên kim loại (kèm
tên base và đọc tên base Ca(OH)
hoá trị đối với kim loại có nhiều hoá trị) + 2. hydroxide.
Tên base Ca(OH) : Calcium hydroxide. 2 I.KHÁI NIỆM
– Khái niệm: Base là những * Công thức hóa học của base :
hợp chất trong phân tử có
- Gồm một nguyên tử kim loại
nguyên tử kim loại liên kết liên kết với một hay nhiều với nhóm hydroxide. Khi nhóm hydroxide (-OH).
tan trong nước, base tạo ra ion OH–.
- Công thức tổng quát: M(OH)n. Ví dụ: KOH, Ba(OH)2 , Fe(OH)
+ n là hóa trị của kim loại M. 3,…
Base tạo ra Cation kim loại + và Anion - theo sơ đồ sau:
Base → M+ (Cation kim loại) + OH− (Anion)
Ví dụ: NaOH → Na+ + OH− Sodium hydroxide Ba(OH) → Ba2+ + OH− 2 Barium hydroxide I.KHÁI NIỆM
– Khái niệm: Base là những hợp chất trong phân tử có nguyên tử kim loại liên kết
với nhóm hydroxide. Khi tan trong nước, base tạo ra ion OH–.
Ví dụ: KOH, Ba(OH)2 , Fe(OH)3,…
– Gọi tên base: Tên base = Tên kim loại (kèm hóa trị đối với kim loại nhiều hóa trị) + hydroxide
Ví dụ: NaOH: sodium hydroxide , Fe(OH)2: iron(II) hydroxide I.KHÁI NIỆM :
KOH: potasium hydroxyde – base kiềm
NaOH: sodium hydorxyde – base
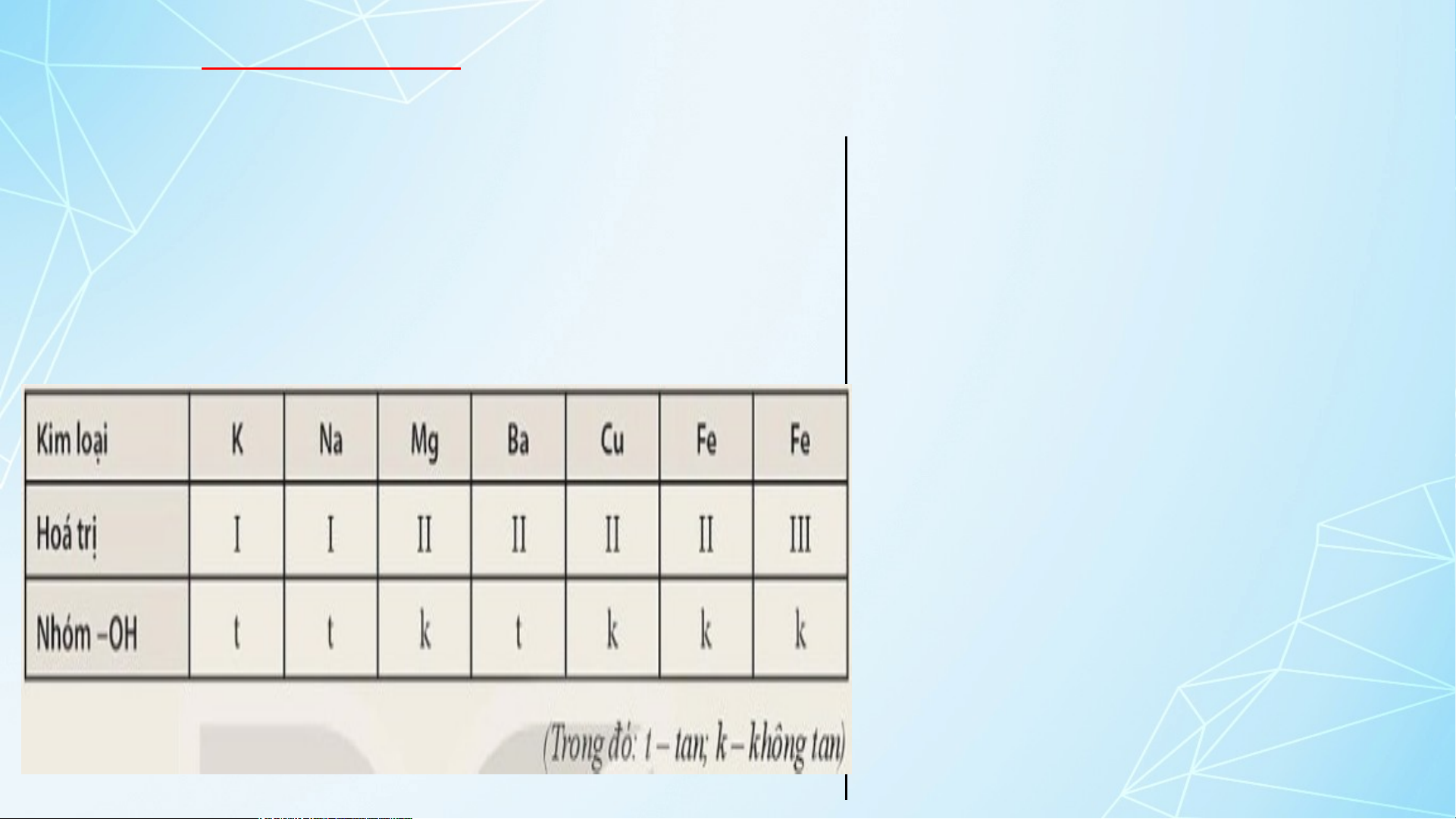
Dựa vào bảng tính tan dưới đây, hãy cho biết những kiềm
base nào là base không tan và base nào là base kiềm?
Viết công thức hóa học và đọc tên các base có trong
Mg(OH) : magnesium hydroxide – 2 bảng. base không tan
Ba(OH) : barrium hydroxide – 2 base kiềm Cu(OH) : copper(II) 2 hydroxide– base không tan
Fe(OH) : iron(II) hydroxide – base 2 không tan
Fe(OH) : iron(III) hydroxide– base 2 không tan I.KHÁI NIỆM
– Khái niệm: Base là những hợp chất trong phân tử có nguyên tử kim loại liên kết
với nhóm hydroxide. Khi tan trong nước, base tạo ra ion OH–.
Ví dụ: KOH, Ba(OH)2 , Fe(OH)3,…
– Gọi tên base: Tên base = Tên kim loại (kèm hóa trị đối với kim loại nhiều hóa trị) + hydroxide
Ví dụ: NaOH: sodium hydroxide , Fe(OH)2: iron(II) hydroxide - Phân loại:
- Các base được chia làm hai loại tùy vào tính tan của chúng:
+ Base tan được trong nước gọi là kiềm: LiOH, KOH, NaOH, Ba(OH)2, Ca(OH2 (tan ít).
+ Base không tan trong nước: Cu(OH)2, Zn(OH)2, Fe(OH)3, Mg(OH)2, Al(OH)3.
I.KHÁI NIỆM VÀ PHÂN LOẠI:
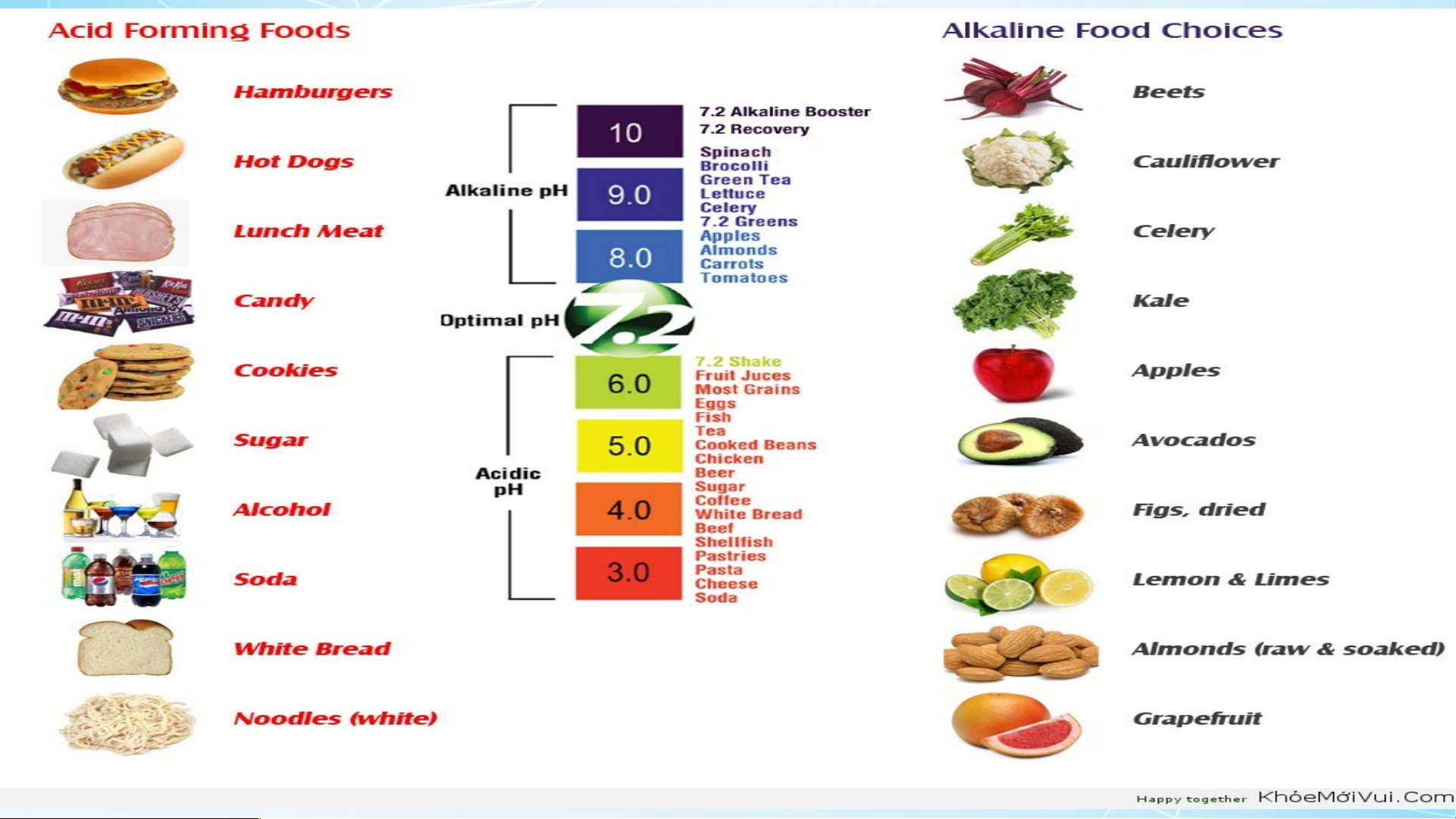
- Các loại thực phẩm chứa hàm lượng base cao. I.KHÁI NIỆM: Luyện tập
- Chia lớp thành 6 nhóm hoàn thành phiếu học tập số 1( 3 phút ) + Nhóm 1,3 câu 1 + Nhóm 2,5 câu 2 + Nhóm 4,6 câu 3 LUYỆN TẬP
PHIẾU HỌC TẬP SỐ 1
Câu 1: Trong các chất sau đây, những chất nào là base: P O , HCl, Mg(OH) , Ca(OH) , Na O, 2 5 2 2 2
Zn(OH) , KOH, NaOH, CO , H SO , Fe(OH) . 2 2 2 4 2
Câu 2: Hoàn thành bảng sau:
Công thức hóa học Tên base
Công thức hóa học Tên base NaOH Mg(OH) 2 Potassium hydroxide Iron (III) hydroxide Ba(OH) Al(OH) 2 3 Copper (II) hydroxide Calcium hydroxide
Câu 3: Sử dụng bảng tính tan, em hãy cho biết base nào tan được trong nước, base nào không tan
được trong nước: LiOH, KOH, NaOH, Cu(OH) , Zn(OH) , Fe(OH) , Mg(OH) , Ca(OH) , 2 2 3 2 2 Ba(OH) , Al(OH) 2 3.
………………………………………………………………………………………………… LUYỆN TẬP
PHIẾU HỌC TẬP SỐ 1
Câu 1: Những chất là base: Mg(OH) , Ca(OH) , Zn(OH) , KOH, NaOH, Fe(OH) . 2 2 2 2
Câu 2: Hoàn thành bảng sau:
Công thức hóa học Tên base
Công thức hóa học Tên base NaOH Sodium hydroxide Mg(OH) Magnesium hydroxide 2 KOH Potassium hydroxide Fe(OH) Iron (III) hydroxide 3 Ba(OH) Barium hydroxide Al(OH) Aluminium hydroxide 2 3 Cu(OH) Copper (II) hydroxide Ca(OH) Calcium hydroxide 2 2 Câu 3:
+ Base tan được trong nước gọi là kiềm: LiOH, KOH, NaOH, Ba(OH) , Ca(OH) (tan ít). 2 2
+ Base không tan trong nước: Cu(OH) , Zn(OH) , Fe(OH) , Mg(OH) , Al(OH) 2 2 3 2 3.
MỨC ĐỘ 1: BIẾT (4 câu biết)
Câu 1. Chất nào sau đây là base? A. K
A OH. B. HCl. C. NaCl. D. H SO 2 4.
Trong số các base sau đây, base nào là base tan trong nước? Câu 2. A. Fe(OH) B. K
B OH C. Cu(OH) D. Fe(OH) 2 2 3
Calcium hydroxide được sử dụng rộng rãi trong nhiều ngành công nghiệp. Công thức của Câu 3. calcium hydroxide?B
A. CaO. B. Ca(OH) . C. CaSO . D. CaCO . 2 4 3
Câu 4. Dung dịch chất nào sau đây làm quỳ tím hóa xanh? C
A. NaCl. B. Na SO . C. NaOH D. HCl. 2 4 II. HOẠT ĐỘNG TÍNH TÌM HIỂU CHẤT
1. Làm đổi màu chất chỉ thị? HÓA
2. Tác dụng với dung dịch acid? HỌC I.KHÁI NIỆM :
II. TÍNH CHẤT HÓA HỌC CỦA BASE.
- GV hướng dẫn cách tiến hành thí nghiệm, cách quan sát và ghi nhận kết quả vào bảng sau.
- GV gọi HS nhận xét, nêu hiện tượng.
- GV gọi HS lên bảng viết phương trình hóa học. STT Thí nghiệm Hiện tượng Phương trình phản ứng 1
Làm đổi màu chất chỉ thị 2
Dung dịch NaOH tác dụng với dung dịch HCl loãng 3
Mg(OH) tác dụng với dung dịch HCl 2 loãng
1. Làm đổi màu chất chỉ thị
Chuẩn bị: Dung dịch NaOH loãng,
dung dịch HCl loãng, giấy quỳ tím,
dung dịch phenolphthalein; ống
nghiệm, ống hút nhỏ giọt. Tiến hành:
Thí nghiệm 1: Nhúng quì tím vào dung dịch NaOH.
Quì tím chuyển sang màu gì? Quì tím hóa xanh
2. Tác dụng với dung dịch acid
Thí nghiệm 2: Cho vào ống nghiệm
khoảng 1 mL dung dịch NaOH loãng,
sau đó nhỏ vào ống nghiệm 2 – 3 giọt
dung dịch phenolphthalein. Dùng ống
hút nhỏ giọt nhỏ từ từ dung dịch HCl
vào hỗn hợp, vừa nhỏ vừa lắc (Hình 9.1).
Dung dịch phenolphthalein chuyển sang màu gì ?
Base + acid tạo thành gì?
Dung dịch phenolphthalein màu hồng
Base + Acid tạo thành Muối + Nước
Dung dịch phenolphthalein màu hồng STT Thí nghiệm Hiện tượng
Phương trình phản ứng 1
Làm đổi màu chất chỉ + Quỳ tím thành xanh. thị + Dung dịch phenolphthalein không màu thành màu hồng. 2 Dung dịch NaOH tác Dung dịch màu hồng NaOH + HCl → NaCl + H O 2 dụng với dung dịch
chuyển sang không màu Sodium hydroxide Sodium chloride HCl loãng 3
Mg(OH) tác dụng với Chất rắn Mg(OH) tan Mg(OH) +2HCl →MgCl + H O 2 2 2 2 2 dung dịch HCl loãng dần, dung dịch không Magnesium hydroxide Magnesium màu chloride
I.KHÁI NIỆM VÀ PHÂN LOẠI:
II. TÍNH CHẤT HÓA HỌC CỦA BASE.
1. Làm đổi màu chất chỉ thị
- Làm đổi màu chất chỉ thị: Dung dịch base làm giấy quỳ tím chuyển sang màu
xanh, dung dịch phenolphtalein không màu chuyển sang màu hồng.
2. Tác dụng với dung dịch acid
- Phản ứng trung hòa (Tác dụng với dung dịch acid):
BASE + DUNG DỊCH ACID → MUỐI + NƯỚC. BÀI 9 : BASE-THANG PH
II.TÍNH CHẤT HÓA HỌC CỦA BASE.
Quan sát hình 9.2 nêu ứng
dụng của Base trong đời Trả lời: sống và sản xuất ?
có nhiều ứng dụng trong sản
xuất và đời sống như sản xuất
nhôm, xà phòng, tơ nhân tạo,
giấy, dược phẩm, xử lý nước, … LUYỆN TẬP
PHIẾU HỌC TẬP SỐ 2
- Chia lớp thành 6 nhóm hoàn thành phiếu học tập số 1( 5 phút ) + Nhóm 1,3 câu 1 + Nhóm 2,5 câu 2 + Nhóm 4,6 câu 3
Câu 1: Viết phương trình hóa học xảy ra khi cho các base sau: KOH, Cu(OH) , Ca(OH) lần 2 2 lượt tác dụng với:
a. dung dịch hydrochloric acid HCl. b. dung dịch sulfuric acid H SO . 2 4
Câu 2: Hoàn thành các phương trình theo sơ đồ sau:
a. ….. KOH + ? → K SO + H O 2 4 2 b. Mg(OH) + ? → MgSO + H O 2 4 2 c. Al(OH) + H SO → 3 2 4
Câu 3: Có hai dung dịch acetic acid (giấm ăn) CH COOH và calcium hydroxide (nước vôi 3
trong) Ca(OH) . Nêu cách phân biệt hai dung dịch trên bằng: a. Giấy quỳ tím. b. Dung dịch 2 phenolphthalein. LUYỆN TẬP
Phiếu học tập số 2
Câu 1: Viết phương trình hóa học xảy ra khi cho các base sau: KOH, Cu(OH) , Ca(OH) lần 2 2 lượt tác dụng với:
a. dung dịch hydrochloric acid HCl.
b. dung dịch sulfuric acid H SO . 2 4 a. KOH + HCl → KCl + H O 2
Cu(OH) + 2HCl → CuCl + 2H O 2 2 2
Ca(OH) + 2HCl → CaCl + 2H O 2 2 2 b. 2KOH + H SO → K SO + H O 2 4 2 4 2
Cu(OH) + H SO → CuSO + 2H O 2 2 4 4 2
Ca(OH) + H SO → Ca SO + 2H O 2 2 4 4 2
Câu 2: Hoàn thành các phương trình theo sơ đồ sau: a. 2KOH + H SO → K SO + H O 2 4 2 4 2
b. Mg(OH) + H SO → MgSO + H O 2 2 4 4 2
c. 2Al(OH) + 3H SO → Al (SO ) + 6H O 3 2 4 2 4 3 2 LUYỆN TẬP
Phiếu học tập số 2
Câu 3: Có hai dung dịch acetic acid (giấm ăn) CH COOH và calcium hydroxide 3
(nước vôi trong) Ca(OH) . Nêu cách phân biệt hai dung dịch trên bằng: 2 CH COOH 3 a. Giấy quỳ tím.
b. Dung dịch phenolphthalein.
a. Giấy quỳ tím hóa đỏ là CH COOH, giấy quỳ tím hóa xanh là Ca(OH) . 3 2
b. Dung dịch phenolphthalein không màu chuyển sang màu hồng là Ca(OH) , 2
không có hiện tượng gì là CH COOH. 3
I.KHÁI NIỆM VÀ PHÂN LOẠI:
II. TÍNH CHẤT HÓA HỌC CỦA BASE. III. THANG pH III. HOẠT ĐỘNG THANG PH TÌM HIỂU
Hãy tìm hiểu và cho biết giá trị
pH chuẩn trong các hình sau? III. THANG pH
+ Dung dịch có pH < 7: môi trường acid
+ Dung dịch có pH > 7: môi trường base
+ Dung dịch có pH = 7: môi trường trung tính LUYỆN TẬP
PHIẾU HỌC TẬP SỐ 3.
- Tiến hành thí nghiệm xác định pH của một số dung dịch bằng giấy pH. Hoàn thành phiếu học tập.
1. Đọc giá trị pH của từng dung dịch và cho biết dung dịch nào có tính acid, dung dịch nào có tính base? Dung dịch Mẫu giấy quỳ Giá trị pH Nước lọc Giấm ăn Nước chanh Nước ngọt có gas Nước rửa bát Baking sođa
2. Tính chất chung của dung dịch các chất có giá trị pH < 7 và của dung dịch các chất có giá trị
pH > 7 là gì? ………………………………………………………………………………………………….
- Phiếu học tập đã hoàn thành.
PHIẾU HỌC TẬP SỐ 3.
- Tiến hành thí nghiệm xác định pH của một số dung dịch bằng giấy pH. Hoàn thành phiếu học tập. Dung dịch Mẫu giấy quỳ Giá trị pH Nước lọc Không đổi màu 7 Giấm ăn Đỏ 2,8 Nước chanh Đỏ 2 - 3
Nước ngọt có gas Đỏ tía 3 - 4 Nước rửa bát Tím 5,5 - 7 Baking sođa Xanh dương 9,5
1. Đọc giá trị pH của từng dung dịch và cho biết dung dịch nào có tính acid, dung dịch nào có
tính base? + Dung dịch có tính acid là: Giấm ăn, nước chanh, nước ngọt có gas + Dung dịch
có tính base là: baking soda
2. Tính chất chung của dung dịch các chất có giá trị pH < 7 và của dung dịch các chất có giá
trị pH > 7 là gì? + Dung dịch có tính acid là: pH < 7. + Dung dịch có tính base là: pH > 7.
- Sữa (pH = 6,2), nước cam (pH = 3,5), cà phê (pH = 5,5 ).
I.KHÁI NIỆM VÀ PHÂN LOẠI:
II. TÍNH CHẤT HÓA HỌC CỦA BASE. III. THANG pH Luyện tập :
TL:Nước sông thường độc, nhất là về
Bài tập 1: Khi làm trong nước sông người ta thường dùng mùa mưa vì có nhiều cặn, đất, cát và
phèn chua cho thêm một ít vôi tôi (Ca(OH) )? Tại sao? Biết các sinh vật phù sinh như tảo, rêu, 2
nguyên sinh động vật,…Những hạt
phèn chua tan trong nước tạo các hạt keo Al(OH) kéo theo 3
cặn to, nặng bị lắng nhanh, những hạt
những hạt cặn lơ lửng xuống làm nước trong.
keo nhỏ bị lắng chậm hơn. Người ta
thường dùng phèn chua để giúp cặn
lắng nhanh hơn, tuy nhiên với những
nguồn nước có tính acid (pH<7) thì
chỉ dùng phèn không đủ để kéo các hạt
lơ lửng xuống. Nước sẽ kém trong
hoặc lâu trong. Để làm trong nước
nhanh và tiết kiệm phèn, người ta
thường cho vào nước một nước nhỏ
vôi tôi Ca(OH)2 làm tăng lượng các hạt keo Al(OH)3.
MỨC ĐỘ 1: BIẾT (3 câu biết)
Câu 1. Nhóm các dung dịch có pH < 7
A. HCl, NaOH. B. Ba(OH ), H SO C. NaCl, HCl. D. D H SO , HNO . 2 2 4 2 4 3
Câu 2. Sodium hydroxide (hay xút ăn da) là chất rắn, không màu, dễ nóng chảy,
hút ẩm mạnh, tan nhiều trong nước và tỏa ra một lượng nhiệt lớn. Công thức của sodium hydroxide A. Ca(OH) . B.
B NaOH. C. NaHCO . D. Na CO . 2 3 2 3
Câu 3. Dung dịch nào sau đây có pH < 7
A. NaOH. B. Ba(OH) C. NaCl. D. D H SO . 2 2 4
MỨC ĐỘ 3: VẬN DỤNG (GIẢI CHI TIẾT)
Câu 1. Một base được dùng phổ biến để sản xuất các phụ gia cho dầu thô, xử lý
nước để sản xuất các loại đồ uống như rượu hay đồ uống không cồn có công thức
X(OH) , trong đó X chiếm 54,054% (khối lượng). Công thức hóa học của base đó 2 là: A. Ba(OH) B. Ca(OH) C. Zn(OH) D. Mg(OH) 2 2 2 2 Hướng dẫn giải:
% X=XX + 17.2.100 = 54,054 X ⇒ = 40amu%
X=XX + 17.2.100 = 54,054 X
⇒ = 40amu. Vậy X là Ca
nên công thức base là Ca(OH)2
Hướng dẫn tự học ở nhà (….. phút)
Học bài và làm bài tập về nhà
Xem và chuẩn bị bài mới “BÀI 10 : OXIDE”
Nhiệm vụ 1: Trả lời câu hỏi dựa vào bảng trong sách giáo khoa
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Quan sát bảng trên và thực hiện các yêu cầu
- BÀI 9 : BASE-THANG PH
- Slide 8
- Base tạo ra Cation kim loại + và Anion - theo sơ đồ sau:
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- 1. Làm đổi màu chất chỉ thị
- 2. Tác dụng với dung dịch acid
- Slide 23
- Slide 24
- BÀI 9 : BASE-THANG PH
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- - Phiếu học tập đã hoàn thành.
- Slide 37
- Slide 38
- MỨC ĐỘ 1: BIẾT (3 câu biết)
- Slide 40
- Slide 41




