








Preview text:
proton neutron neutron electron electron electron neutron proton và neutron 17 10 10 7 amu Tên nguyên tố
Kí hiệu hoá học của nguyên tố hydrogen H helium He carbon C nitrogen N oxygen O sodium Na Trả lời
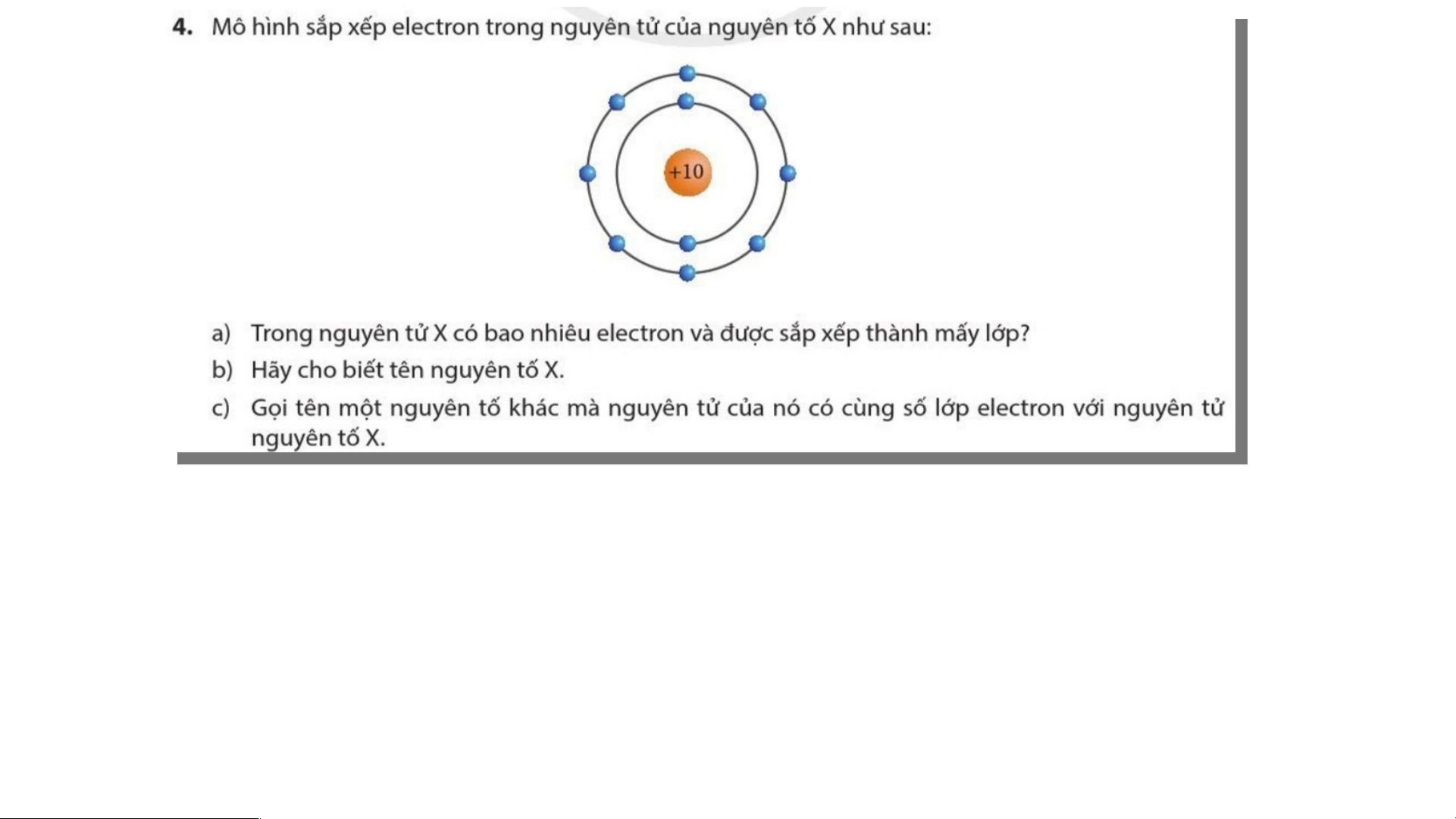
a) Trong nguyên tử X có 10 electron và được sắp xếp thành 2 lớp.
b) Nguyên tố X có tên là neon (kí hiệu hóa học là Ne)
c) Số lớp electron =số thứ tự chu kì => Nguyên tử Ne có 2 lớp electron ⇒ thuộc chu kì 2.
⇒ Các nguyên tử của nguyên tố: Lithium (Li), beryllium (Be), boron (B), carbon (C),
nitrogen (N), oxygen (O), fluorine (F) đều thuộc chu kì 2
⇒ đều có 2 lớp electron giống
như nguyên tử nguyên tố neon (Ne) Fluorine F 9 19 S 16 16 Magnesium Mg 12 12 Hydrogen H 1 1 Sodium Na 11 12
Số proton = số electron
Khối lượng nguyên tử = Số proton + số neutron Trả lời
a) Khối lượng nguyên tử X = 6.1 + 6.1 = 12 amu Lưu ý:
Khối lượng nguyên tử Y = 6.1 + 8.1 = 14 amu
- Khối lượng 1 proton xấp xỉ bằng khối lượng 1 neutron và xấp xỉ bằng 1 amu. - V b) ì kh Ng ố u i l yêư n ợ t n ử g Xc ủ v a à e n le g ct uy rêonn t rấ ử t Y n hỏ có tso hu vớ ộc i kh cùn ố g i lượ một nngg củ u a yê np tro ố to h n ó avà h ọne c u vì t ro c n ó n cùênng: số Kh pr ố
o it loượn n t g
ro nngg u h yê ạt n n htử â n=
. khối lượng proton + khối lượng neutron (amu) Trả lời
a) Các nguyên tố trên được sắp xếp chiều tăng dần điện tích hạt nhân như sau:
F (Z = 9), Ne (Z = 10), Na (Z = 11), Mg (Z = 12), S (Z = 16), Ca (Z = 20)
b) Các nguyên tố kim loại: Na, Mg, Ca.
Các nguyên tố phi kim: F, S. Nguyên tố khí hiếm: Ne. Magnesium Mg 24 3 IIA Kim loại Phosphorus P 31 3 VA Phi kim Argon Ar 40 3 VIIIA Khí hiếm Trả lời
- Nguyên tử của nguyên tố M có 2 electron ở lớp ngoài cùng ⇒ thuộc nhóm IIA. - Có 3 lớp electron ⇒ thuộc chu kì 3.
+ Lớp thứ nhất có 2 electron.
+ Lớp thứ hai có 8 electron.
+ Lớp thứ ba (lớp ngoài cùng) có 2 electron.
⇒ Nguyên tử của nguyên tố M có 12 electron
⇒ Thuộc ô số 12 trong bảng tuần hoàn. M là kim loại.
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10




