












































































































































Preview text:
HƯ H Ớ Ư N Ớ G N G DẪ D N Ẫ N S Ử S D Ử ỤN Ụ G N G 12 Mg
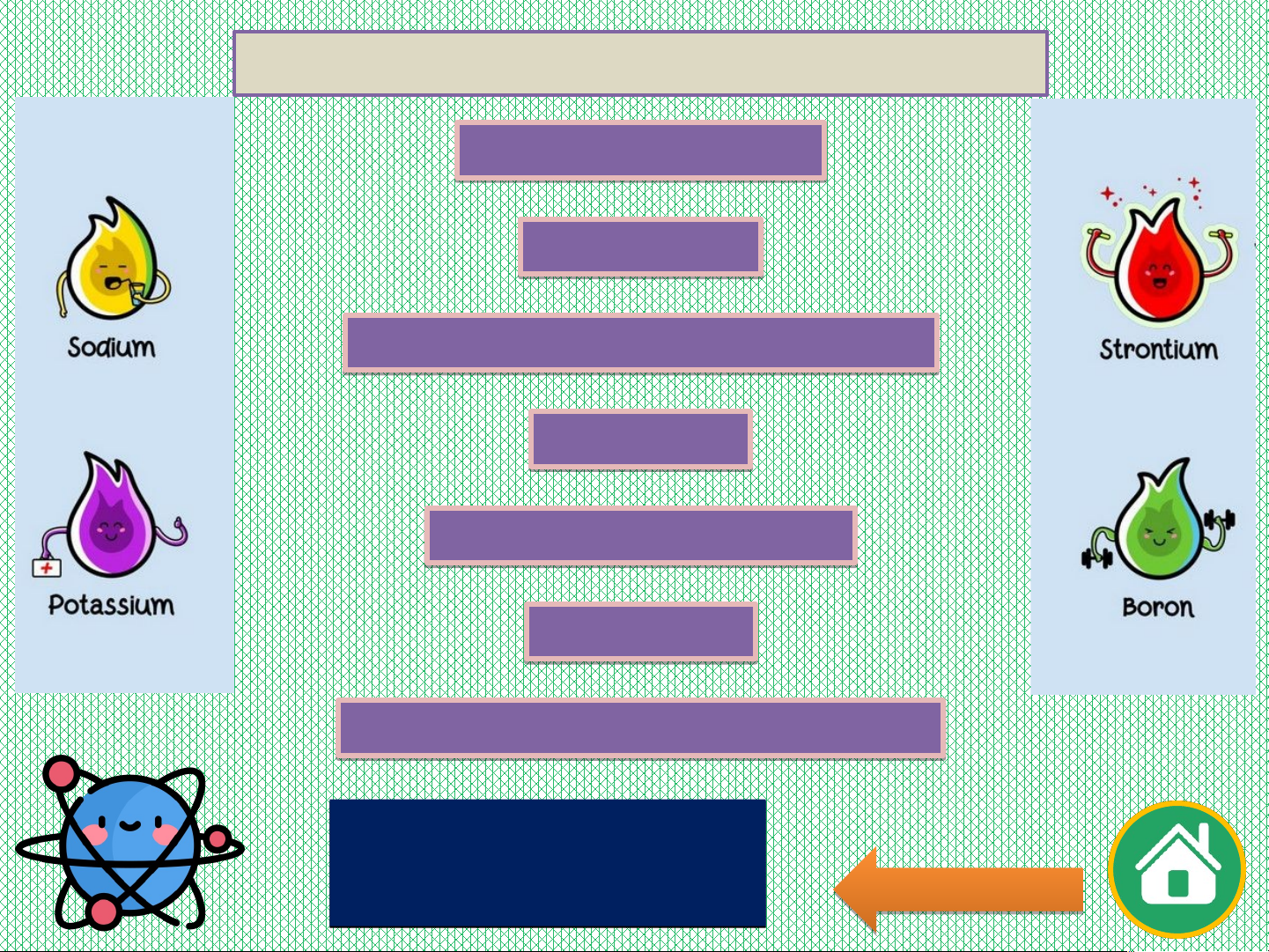
Nháy chuột trái vào ô nguyên tố để hiện ra thông tin về nguyên tố đó. 24 Tiếp ế theo e
Nháy chuột trái biểu tượng mũi tên để di chuyển trang thông tin. Quay a lại lạ Tính KL nh
Nháy chuột trái vào các "thẻ nội dung" để có thông tin cần thiết. Xó X a ó hế t hế Tí T nh P nh K P
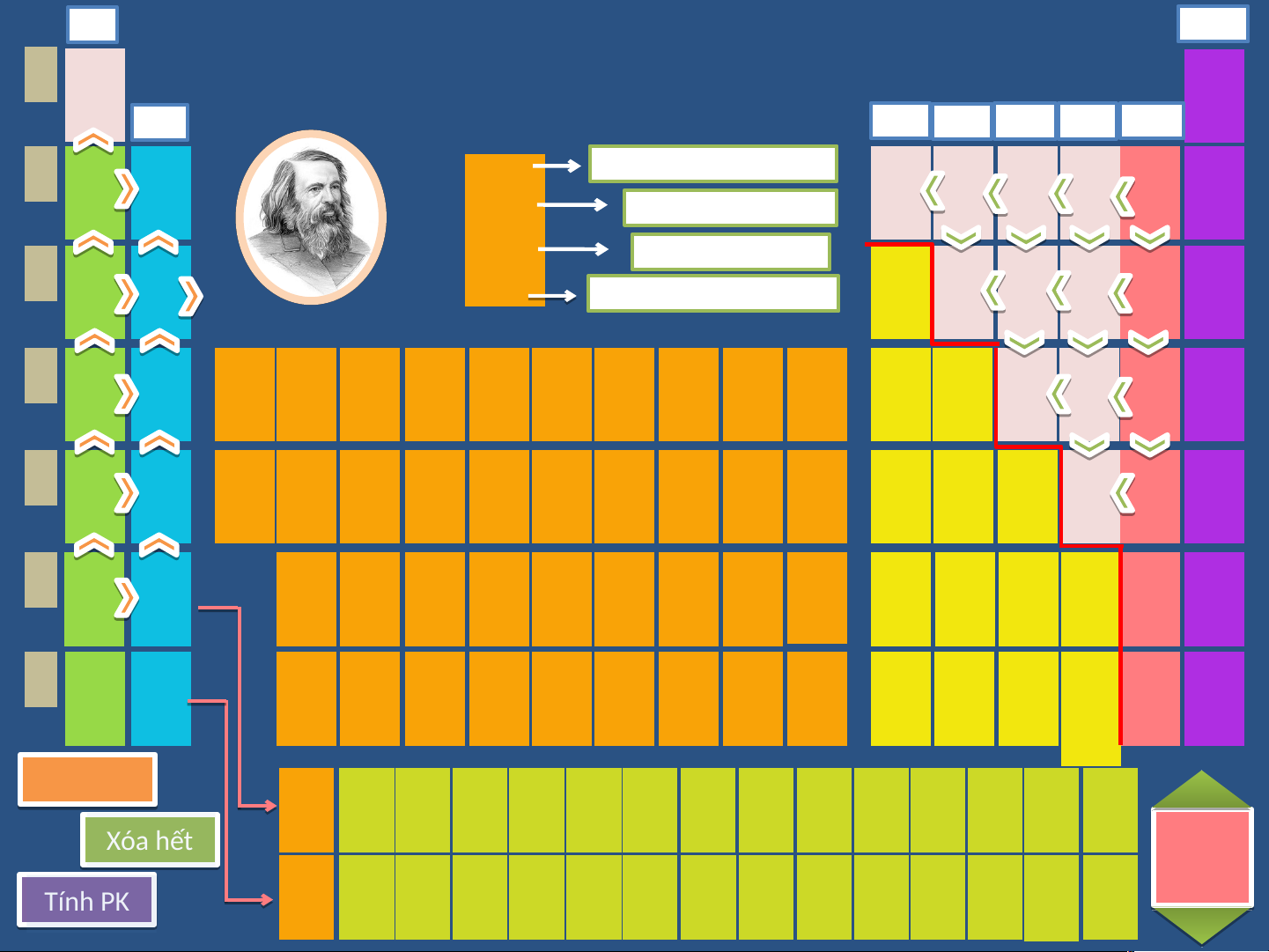
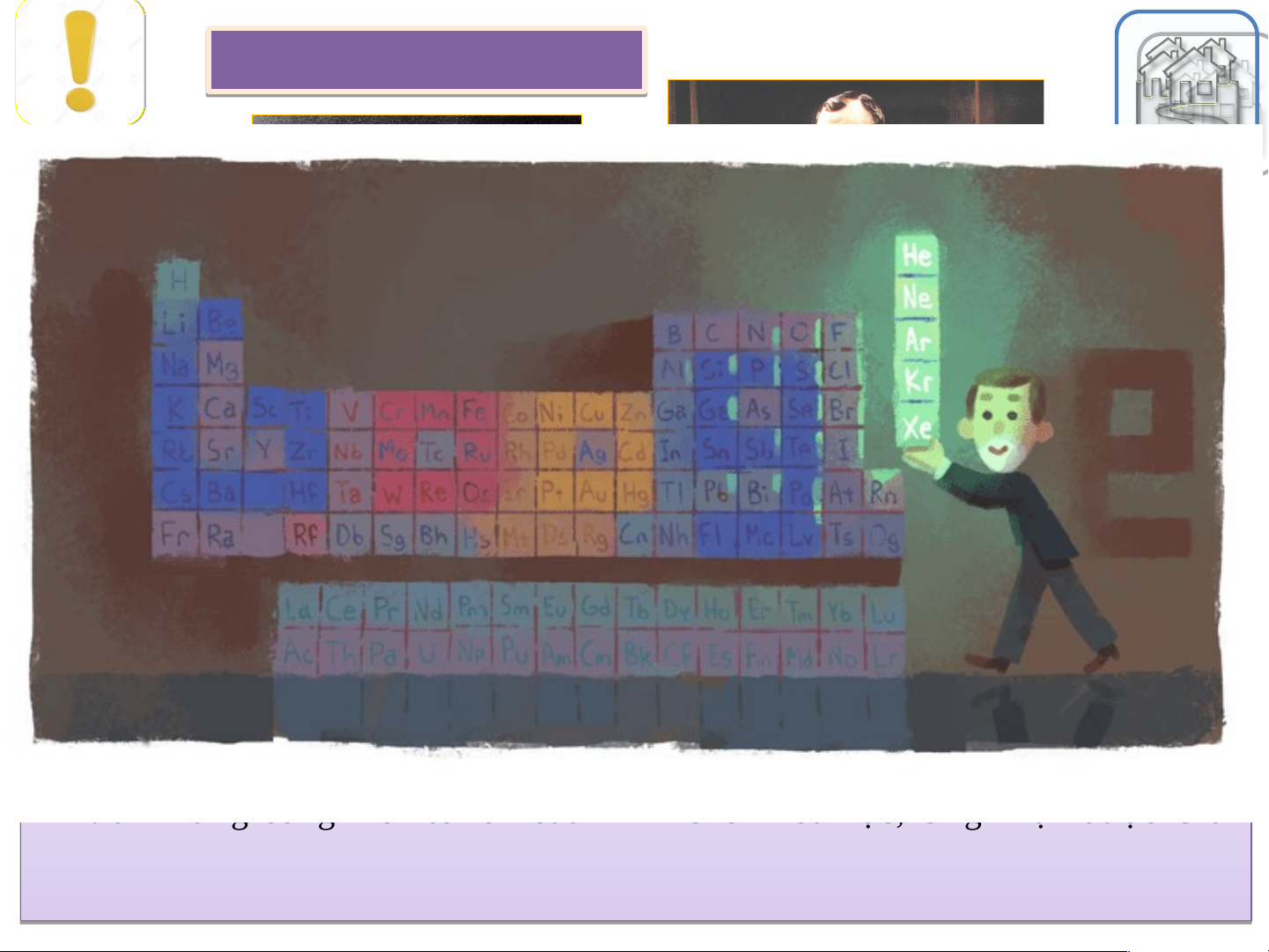
Nháy chuột trái vào biểu tượng ngôi nhà để quay về màn hình chính. I A VIII A Bảng tuần hoàn 1 2 1 H He Hydrogen Helium
các nguyên tố hóa học 1 II A III A IV A V A VI A VII A 4 3 4 5 6 7 8 9 10 2 Số hiệu nguyên tử Li Be 79 B C N O F Ne Lithium Beryllium Kí hiệu hóa học Boron Carbon Nitrogen Oxygen Fluorine Neon Au 7 9 11 12 14 16 19 20 Gold 11 12 Tên nguyên tố 13 14 15 16 17 18 3 Na Mg 197 Al Si P S Cl Ar Nguyên tử khối TB Sodium Magnesium Aluminium Silicon Phosphorus Sulfur Chlorine Argon 23 24 III B IV B V B VI B
VII B VIII B VIII B VIII B I B II B 27 28 31 32 35,5 40 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 4 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr Potassium Calcium
Scandium Titanium Vanadium Chromium Manganese Iron Cobalt Nickel Cupper Zinc Gallium Germanium Arsenic Selenium Bromite Krypton 39 40 45 48 51 52 55 56 59 59 64 65 70 73 75 79 80 84 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 5 Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe Rubidium Strontium
Yttrium Zirconium Niobium Molybdenum Technetium Ruthenium Rhodium Palladium Silver Cadmium Indium Tin Antimony Tellurium Iodine Xenon 85 88 89 91 93 96 [98] 101 103 106 108 112 115 119 122 128 127 131 55 56 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 6 Cs Ba Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn Cesium Barium Hafnium Tantalum Tungsten Rhenium Osmium Iridium Platinum Gold Mercury Thallium Lead Bismuth Polonium Astatine Radon 133 137 179 181 184 186 190 192 195 197 201 204 207 209 [209] [210] [222] 87 88 104 105 106 107 108 109 110 111 112 113 114 115 116 117 118 7 Fr Ra Rf Db Sg Bh Hs Mt Ds Rg Cn Nh Fl Mc Lv Ts Og Francium Radium Rutherfordium
Dubnium Seaborgium Bohrium
Hassium Meitnerium Darmstadtium Roentgenium Copernicium
Nihonium Flerovium Moscovium Livermoriu Tennessine Oganeson [223] [226] [267] [268] [269] [270] [269] [278] [281] [280] [285] [286] [289] [289] m [294] [294] [293] 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 Tính K h L K La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Lanthanum
Cerium Praseodymium Neodymium Promethium Samarium Europium Gadolinium Terbium Dysprosium Holmium Erbium Thulium Ytterbium Lutetium 139 140 141 144 [145] 150 152 157 159 163 165 167 169 173 175 Xó X a ó a hế t hế Gi G ới 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Th T iệu ệ Tính P nh K
Actinium Thorium Protactinium Uranium Neptunium Plutonium Americium Curium Berkelium Californium Einsteinium Fermium Mendelevium Nobelium Lawrencium [227] 232 231 238 [237] [244] [243]
[247] [247] [251] [252] [257] [258] [259] [262]
Bảng tuần hoàn các nguyên tố hóa học, hay bảng tuần
hoàn Mendeleev là một phương pháp liệt kê các nguyên tố hóa học
thành bảng, dựa trên số hiệu nguyên tử (số proton trong hạt nhân),
cấu hình electron và các tính chất hóa học tuần hoàn của chúng. D.I. Mendeleev
Các nguyên tố được biểu diễn theo trật tự số hiệu nguyên tử tăng dần, (1834 - 1907)
thường liệt kê cùng với ký hiệu hóa học trong mỗi ô. Hư H ớ ư n ớ g n g dẫ d n ẫ 3 13 Li Al 7 Kim loại Kiềm 27 Kim loại phân nhóm p Dã D y ã y điệ i n h óa óa học 4 26 Be Fe 9 Kim loại Kiềm thổ 56 Kim loại chuyển tiếp Bảng n độ đ âm â điệ i n 9 101 F Md 258 Bảng R R ng n uy u ê y n n tử t 19 Phi kim halogen Kim loại phân nhóm f 2 8 He O Bản Bả g tính t a t n a 4 Khí hiếm 16 Phi kim thông thường Hỗ trợ phát âm danh pháp quốc tế Lí Lí thu t y hu ế y t ế t cơ c bả b n n về v ề hó h a họ c họ Lí Lí thuy h ế uy t ế c ơ c bản ơ v bản ề v ề hó h a họ a c họ 1. .Nguyê y n tử - -phân t ử Tà T i ililệ i u Ki K m i lo l ạ o i tha h m khảo & & T á T c giả i Đơn ch c ất ấ Ph P i iki k m i Kh K í íhiế i m 2. C hất ấ Oxi O d xi e
Chọn các thẻ thông tin cần tìm hiểu Acid Aci Quay a lại lạ Hợp H ch c ất ấ Bas Ba e Muối 3. C ông thức c huyể y n ể đ ổi ổ Hy H d y ro r xi o d xi e lư l ỡ ư ng tín tí h Lí Lí thu h y u ế y t ế c ơ c ơ bả b n n về v hó a hó họ c họ 1. N guyê uy n tử - -phân tử
Nguyên tử là đơn vị cơ bản của chất chứa một hạt nhân ở trung
tâm bao quanh bởi đám mây điện tích âm các electron(vỏ).
- Hạt nhân nguyên tử là dạng gắn kết hỗn hợp giữa các proton (p)
mang điện tích dương (1+) và các neutron (n) không mang điện
(ngoại trừ trường hợp của nguyên tử hydro).
- Vỏ electron là tập hợp các electron (e) mang điện tích âm (1-)
chuyển động rất nhanh trong khu vực xung quanh hạt nhân nguyên
tử không theo những quỹ đaọ xác định.
Nguyên tử được phân loại tuân theo số proton và neutron trong
hạt nhân của nó: số proton xác định lên nguyên tố hóa học và số
neutron xác định đồng vị của nguyên tố đó.
Phân tử là hạt đại diện cho chất, gồm một số
nguyên tử liên kết với nhau và thể hiện đầy đủ
tính chất hóa học của chất. Quay a lại lạ CH4 Lí Lí thu h y u ế y t ế c ơ c ơ bả b n n về v hó a hó họ c họ 2. Ch 2. C ất h Đơn ơ chấ h t là l chất đ t ược ợ tạ t o từ t 1 hay nhiề i u nguyên tử t của cùng 1 nguyên tố t hóa học. Ví Ví dụ: - Alu l min i iu i m: :Al - Car a bon: :C - Khí O í xygen: n: O2 - Ozone: : O3 Hợp chấ h t là l 1 ch c ất được ợ cấu tạo ạ bởi t i ừ 2 nguyên tố t khác lo l ại t i r t ở ở lê l n, với t i ỷ t lệ ệ th t ành phần cố địn ị h và trật ậ tự t nhất ấ địn ị h. Ví d í ụ: - Nước ớ : :H O 2O 2 - Cát á : S : iO i 2 - Muối ă i n: :NaC a l - Đườn ờ g mía: a C H O 12H22 12 2 11 1 Quay a lại lạ CH4 Lí Lí thu h y u ế y t ế c ơ c ơ bả b n n về v hó a hó họ c họ Kim m lo l ại là l nguyên ê tố t có th t ể nhường ele l ct c ron tạ t o ra các io i n dương (catito i n) v à có c các liê i n kết ế kim i loại.
Tính chất vật lí chung:
Tính dẻo, tính dẫn điện, tính dẫn nhiệt, tính ánh kim.
Tính chất hóa học chung:
1. Kim loại + Phi kim Oxide / Muối
4Al + 3O → 2Al O 2Al + 3Cl → 2AlCl 2 2 3 2 3
2. Kim loại (trước H+) + Acid thông thường muối + H ↑ 2
2Al + 6HCl → 2AlCl + 3H ↑ 3 2
3. Kim loại + dd muối muối + kim loại
2Al + 3Cu(NO ) → 2Al(NO ) + 3Cu↓ 3 2 3 3
4. Kim loại (Li, K, Ba, Ca, Na) + H O dd Base + H ↑ 2 2
2Na + 2H O → NaOH + H ↑ 2 2 5. Kim loại + H SO /HNO
muối + sản phẩm khử + H O Quay lại 2 4 đặc nóng 3 2 Quay lạ 2Al + 6H SO
→ Al (SO ) + 3SO ↑ + 6H O 2 4 đặc nóng 2 4 3 2 2 Al + 4HNO
→ Al(NO ) + NO↑ + 2H O 3 loãng 3 3 2
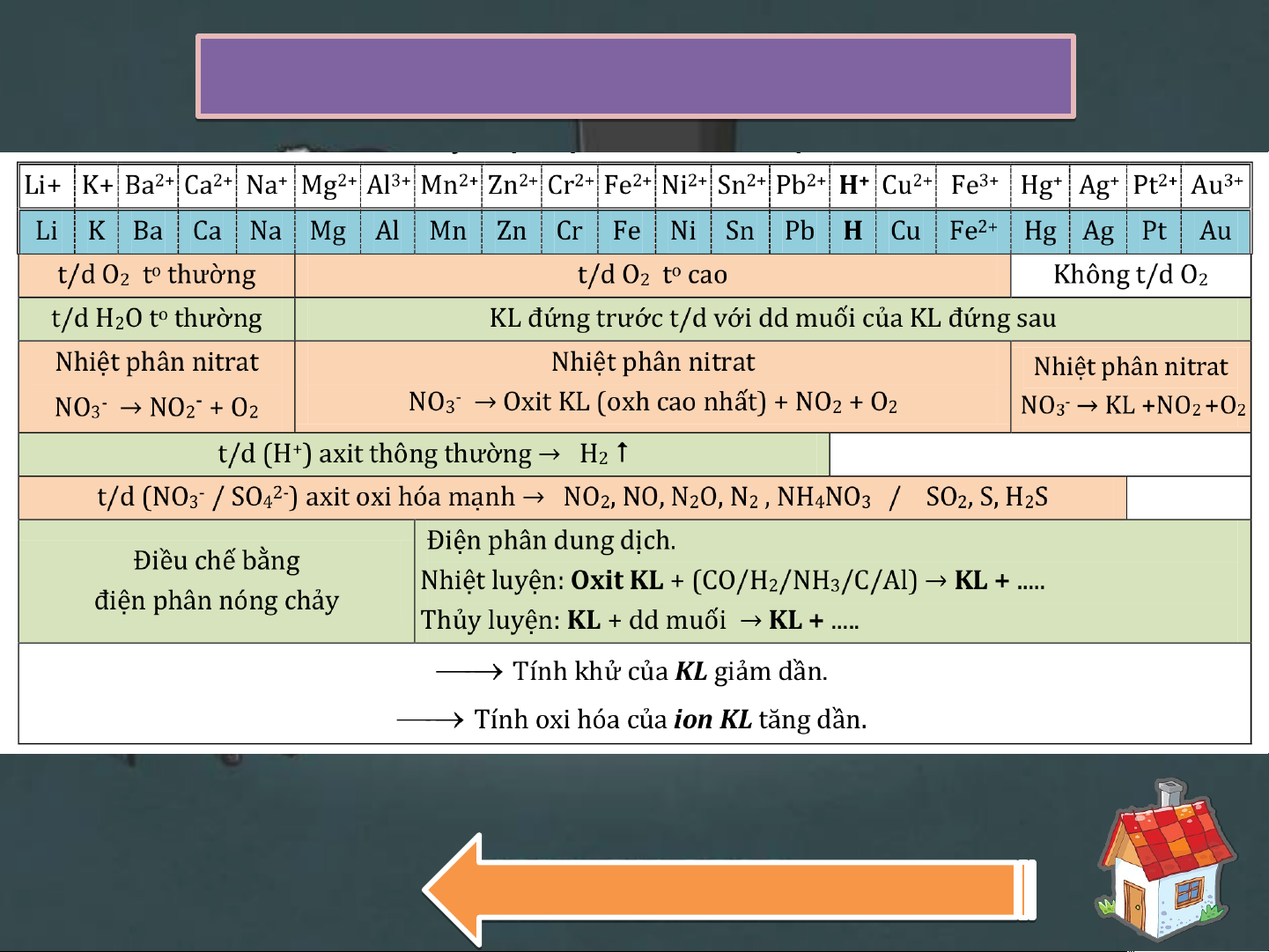
Dãy hoạt động hóa học của kim i lo l ại Li K i K Ba B Ca C Na Mg A Mg l lZn Fe Ni Sn Pb P [H] Cu Hg Ag Pt P Au Lí Lí thuy h ế uy t ế c ơ c bản ơ v bản ề v ề hó h a họ a c họ Phi k i im i là l nguyên ê tố t có th t ể nhận ele l ct c ron tạ t o ra cá c c io i n âm (anio i n)
Tính chất vật lí chung: Tồn tại ở nhiều trạng thái, không có ánh kim,
hầu hết không dẫn điện, dẫn nhiệt kém (trừ C-than chì, Silicon, ...)
Tính chất hóa học chung:
1. Phi kim + Kim loại Oxide / Muối
O + 2Mg → 2MgO Cl + Mg → MgCl 2 2 2 2. Phi kim + H
Hợp chất khí / hơi 2 Cl + H → 2HCl N + 3H 3NH 2 2 2 2 3 3. Phi kim + O
Oxide (F , Cl , Br , I không phản ứng) 2 2 2 2 2 C + O → CO 4P + 5O → 2P O 2 2 2 2 5 4. Phi kim + H SO / HNO 2 4 đặc nóng 3 C + 2H SO
→ CO ↑ + 2SO ↑ + 2H O↑ Sulfur 2 4 đặc nóng 2 2 2 P + 5HNO
→ H PO + 5NO ↑ + H O 3 đặc nóng 3 4 2 2
5. Một số phản ứng đặc biệt của nhóm halogen (F ,Cl , Br , I ) Quay a lại lạ 2 2 2 2 Cl + 2NaBr → 2NaCl + Br 2 2 Cl + 2NaOH → NaCl + NaClO + H O 2 loãng 2 3Cl + 6KOH → 5KCl + KClO + 3H O 2 đặc nóng 3 2
Cl + Ca(OH) → CaOCl + H O (chloride vôi) 2 2 2 2
6. Các phi kim mạnh: F , Cl , Br , O , O . 2 2 2 3 2 Lí t Lí huy h ế uy t ế c ơ c bản ơ v bản ề v ề hó h a họ h c ọ Khí h hiế i m m hoặc khí h trơ, là l nhóm các á nguyên tố t hóa học c tr t ong nhóm nguyên tố
t số 18, (VIII A) trong bảng tu t ần hoàn. Ba B o gồm 7 nguyên ê tố t : : Helilu i m, Neon, Arg r on, Krypto t n, Xenon, Ra R don và à Oganesson
Tính chất vật lí chung: Đều là chất khí, không màu, tồn tại ở dạng đơn nguyên tử.
Tính chất hóa học chung: Hầu như không tham gia các phản ứng hóa học.
(Trước đây, khái niệm khí trơ được công nhận rất rộng. Nhưng hiện tại nhiều nhà
khoa học đã bác bỏ tên gọi khí trơ của chúng. Bởi họ cho rằng thuật ngữ đó không
có tính chính xác chặt chẽ. Bởi vì những loại khí trơ chúng ta đã biết đến đều có
những phản ứng hóa học nhất định nếu gặp điều kiện phù hợp.) Ánh Á sang màu của khí hiếm
trong ống phóng điện chân không Quay a lạ i Lí L thu t y hu ế y t ế t cơ c bả b n n về v ề hó h a học họ
Oxide là hợp chất gồ
g m 2 nguyên tố hoá học, trong đó có một nguyên tố là Oxygen. R O x y
- Basic oxide tác dụng với dung dịch Acid tạo thành muối và nước, thường là Oxide của kim
loại và tương ứng với một Base.
- Acidic oxide tác dụng với dung dịch Base tạo thành muối và nước, thường là Oxide của phi
kim và tương ứng với một Acid.
- Oxide lưỡng tính tác dụng với dung dịch Base hoặc dung dịch Acid tạo thành muối và
nước. thường là Oxide của kim loại và tương ứng với một Hydroxide lưỡng tính. (Al O , 2 3 Cr O , ZnO, PbO, BeO, …) 2 3
- Oxide trung tính (Oxide không tạo muối) không tác dụng với dung dịch Base hoặc dung
dịch Acid. (CO, NO, N O, …) 2
Tính chất hóa học chung: I. Basic oxide
1. Basic oxide + nước → dd Base (Li O, K O, BaO, CaO, Na O) 2 2 2 Na O + H O → 2NaOH CaO + H O → Ca(OH) 2 2 2 2
2. Basic oxide + dd Acid → muối + nước
Fe O + 6HCl → 2FeCl + 3H O FeO + 2HCl → 2FeCl + H O 2 3 3 2 2 2
3. Basic oxide + Acidic oxide→ muối (Li O, K O, BaO, CaO, Na O) 2 2 2 Na O + SO → Na SO CaO + CO → CaCO 2 2 2 3 2 3 Quay a lại lạ Tiếp th t eo Lí thuy t ế huy t ế c ơ c bả ơ n n về v hó a hó họ a c họ II. Acidic oxide
1. Acidic oxide + nước → dd Acid (trừ SiO ) 2 SO + H O → H SO SO + H O → H SO 2 2 2 3 3 2 2 4
2. Acidic oxide + dd Base → muối + [nước]
CO + Ca(OH) → CaCO ↓ + H O 2CO + Ca(OH) → Ca(HCO ) 2 2 3 2 2 2 3 2
3. Acidic oxide + Basic oxide → muối (Li O, K O, BaO, CaO, Na O) 2 2 2 CO + Na O → Na SO P O + 3K O → 2K PO 2 2 2 3 2 5 2 3 4
III. Oxide lưỡng tính
1. Oxide lưỡng tính + dd Acid → muối + H O 2 Al O + 6HCl → 2AlCl + 3H O ZnO + H SO → ZnSO + H O 2 3 3 2 2 4 4 2
2. Oxide lưỡng tính + dd Base → muối + H O 2
Al O + 2NaOH → 2NaAlO + H O ZnO + 2KOH → K ZnO + H O 2 3 2 2 2 2 2
IV. Một số phản ứng đặc biệt của Oxide
SO + Br + 2H O → H SO + 2HBr (mất màu dd Br → nhận biết SO ) 2 2 2 2 4 2 2
5SO + 2KMnO + 2H O → K SO + 2MnSO + 2H SO (→ nhận biết SO ) 2 4 2 2 4 4 2 4 2 CO + CuO → Cu + CO
(CO khử được Oxide từ ZnO trở về sau) 2 3CO + Fe O → 2Fe + 3CO 2 3 2 Quay a lạ i Lí L thuyế u t cơ bả c n về hóa học Acid i là l hợp chất ấ 1 hay nhiề i u nguyên tử t H lilê i n kết v t ới g i ốc Acid i . H A x
- Acid mạnh: HCl, HBr, HI, H SO , HNO , HClO , HClO ,… 2 4 3 3 4
- Acid trung bình-yếu: HF, H S, HClO, HClO , H PO , H PO , HNO , H SiO , [H CO ], 2 2 3 4 3 3 2 2 3 2 3
[H SO ], các Acid hữu cơ HCOOH, CH COOH, … 2 3 3
- Acid có tính oxi hóa mạnh ( tác nhân oxi hóa không phải H+): HNO , H SO đặc. 3 2 4 CTHH Tên Acid CTHH Tên gốc Acid CTHH Tên gốc Acid HCl Hydrochloric Acid -Cl Chloride ≡PO Phosphate 4 HF Hydrofluoric Acid -F Fluoride -HCO Hydrogencarbonate 3 HNO Nitric Acid =S Sulfide 3 -HSO Hydrogensulfite 3 H SO Sulfurous Acid -NO Nitrate 2 3 3 -HSO Hydrogensulfate 4 H SO Sulfuric Acid =SO Sulfite 2 4 3 =HPO Hydrogenphosphate 4 H CO Carbonic Acid =SO Sulfate 2 3 4 -H PO Dihydrogenphosphate 2 4 H PO Phosphoric Acid =CO Carbonate 3 4 3 -AlO Aluminate 2
Tính chất vật lí chung: Acid khi hòa tan trong nước tạo ra dung dịch Acid có vị chua và có
khả năng dẫn điện (chất điện li) Quay lại l Ti T ế i p theo Lí thuy t ế huy t ế c ơ c bả ơ n n về v hó a hó họ a c họ
Tính chất hóa học chung:
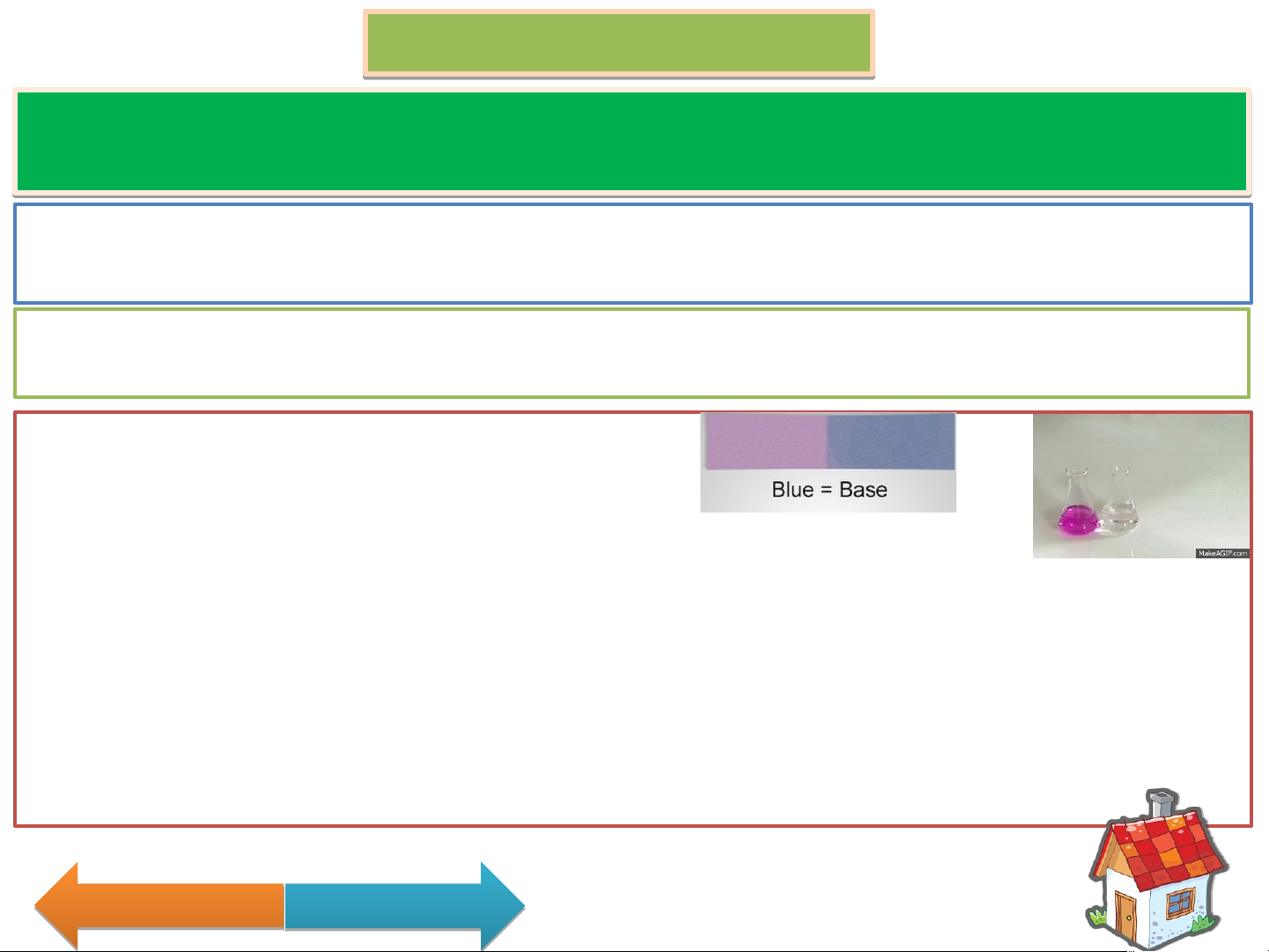
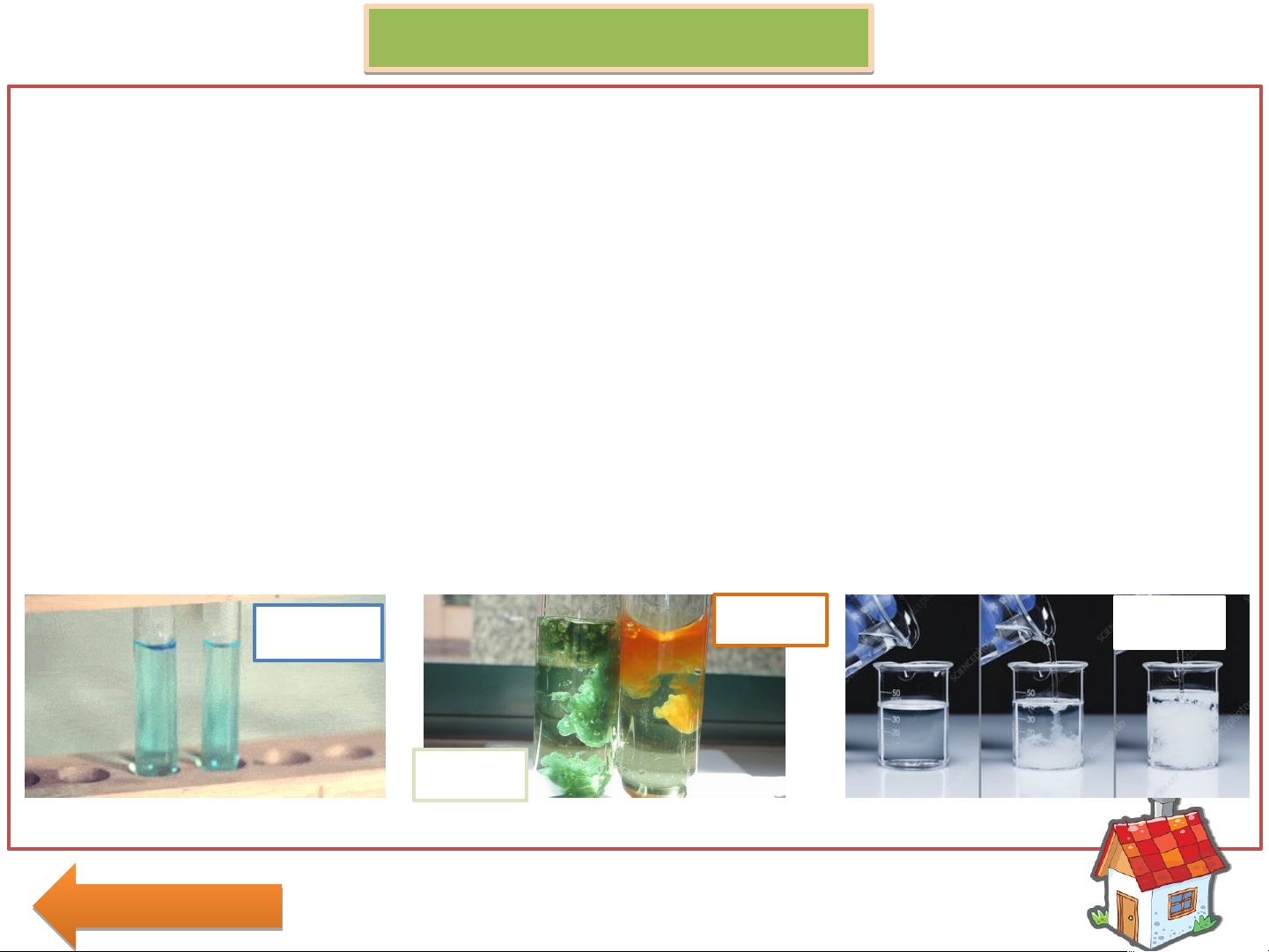
1. Acid làm quỳ tím chuyển màu đỏ (màu hồng với Acid yếu)
2. Acid + kim loại(trước H+)
muối(hóa trị thấp) + H ↑ 2 2HCl + Fe
FeCl + H ↑ (hóa trị thấp) HCl + Cu không phản ứng. 2 2 H SO + Mg MgSO + H ↑ H SO + Ag không phản ứng. 2 4 loãng 4 2 2 4 loãng
3. Acid + Basic oxide
muối(cùng hóa trị) + nước H SO + MgO MgSO + H O 3H SO + Fe O Fe (SO ) + 3H O 2 4 loãng 4 2 2 4 2 3 2 4 3 2 4. Acid + Base Muối + nước HCl + NaOH NaCl + H O 3HNO + Fe(OH) Fe(NO ) + 3H O 2 3 3 3 3 2 5. Acid + muối
muối mới + Acid mới (↓,↑, điện li yếu) 2HCl + CaCO
CaCl + H O + CO ↑ H SO + BaCl BaSO ↓ + 2HCl 3 2 2 2 2 4 2 4
6. Một số tính chất của H SO đặc và HNO 2 4 3
a. dd HNO , dd H SO đặc nguội KHÔNG phản ứng với Al, Fe, Cr (thụ động hóa học). 3 2 4 𝐻 𝑆 𝑂
b. Tính háo nước của H SO đặc 2 4 2 4 →
- Phân hủy các hợp chất hữu cơ: C H O 12C + 11H O 12 22 11 2
- Làm khô các chất không phản ứng với nó: H , O , N , Cl , SO , CO , .... 2 2 2 2 2 2
c. Tác dụng với KL(trước Ag) → muối (hóa trị cao) + sản phẩm khử + H O 2 Cu + 2H SO → CuSO + SO ↑ + H O 2 4 đặc nóng 4 2 2
Fe + 4HNO → Fe(NO ) + NO↑ + 2H O 3 3 3 2 3FeCO Q u+ a 1 y 0H
lại NO → 3Fe(NO ) + NO↑ + 3CO ↑ + 5H O 3 3 3 3 2 2 Lí L thuyế u t cơ bả c n về hóa học Ba B se là à hợp chất m t à phân tử t của
a nó bao gồm có một nguyên tử t kim i loại ililê i n kết v t ới i 1 hay nhiề
i u nhóm Hydroxide(-OH) . R(OH)x
- Base mạnh (Base tan hay còn goi là kiềm): LiOH, KOH, Ba(OH) , Ca(OH) , NaOH, … 2 2
- Base yếu (Base không tan): Mg(OH) , Fe(OH) , Fe(OH) , Cu(OH) , … 2 2 3 2
Tính chất vật lí chung: một số Base khi hòa tan trong nước tạo ra dung dịch Base có vị đắng,
tạo ra cảm giác nhờn và có khả năng dẫn điện (chất điện li)
Tính chất hóa học chung:
1. Dung dịch Base làm quỳ tím chuyển màu xanh.
Dung dịch Base làm dung dịch phenolphtalein không màu chuyển hồng. 2. Base + Acid muối + nước Ba(OH) + 2HCl BaCl + 2H O Fe(OH) + 3HCl FeCl + 3H O 2 2 2 3 3 2
3. dd Base + Acidic oxide muối + [nước] 2NaOH + CO Na CO + H O NaOH + CO NaHCO 2 2 3 2 2 3 6KOH + P O 2K PO + 3H O 2KOH + P O + H O 2KH PO 2 5 3 4 2 2 5 2 2 4
4. dd Base + dd muối
Base + Muối (↓,↑, điện li yếu) 2NaOH + CuSO Cu(OH) ↓ + Na SO Ca(OH) + Na CO NaOH + CaCO ↓ 4 2 2 4 2 2 3 3 Quay lại l Ti T ế i p theo Lí thuy t ế huy t ế c ơ c bả ơ n n về v hó a hó họ a c họ
5. Base không tan bị nhiệt phân Oxide + nước 2Fe(OH) Fe O + 3H O Cu(OH) CuO + H O 3 2 3 2 2 2 Fe(OH) FeO + H O (không có O ) 4Fe(OH) + O 2Fe O + 4H O (có O ) 2 2 2 2 2 2 3 2 2
6. Một số phản ứng đặc biệt của Base 2NaOH + 2Al + 2H O
2NaAlO + 3H ↑ Ca(OH) + 2Al + 2H O Ca(AlO ) + 3H ↑ 2 2 2 2 2 2 2 2 2NaOH + Zn Na ZnO + H ↑ Ba(OH) + Zn BaZnO + H ↑ 2 2 2 2 2 2 2NaOH + Si + H O Na SiO + 2H ↑ đặc 2 2 3 2 Ca(OH) + Al O Ca(AlO ) + H O 2 2 3 2 2 2 NaOH + NaHCO
Na CO + H O Ca(OH) + Ca(HCO ) CaCO ↓ + H O 3 2 3 2 2 3 2 3 2
1NaOH + 1Ca(HCO ) CaCO ↓ + NaHCO + H O 3 2 3 3 2
2NaOH + 1Ca(HCO ) CaCO ↓ + Na CO + 2H O 3 2 3 2 3 2
7. Màu của một số kết tủa Base Cu(OH) Fe(OH)3 Al(OH)3 2 Fe(OH)2 Quay a lạ i Lí L thuyế u t cơ bả c n về hóa học Muố u i ilà l hợp chất tgồm cat a io i n kim i lo l ại( i hoặc NH +
H ) liên kết với anion gốc Acid.
4 ) liên kết với anion gốc Acid 4 R A x y
- Muối trung hòa là muối có gốc Acid không có nguyên tử H phân li ra ion H+:
NaCl, Na CO , AgNO , K PO , K HPO ... 2 3 3 3 4 2 3
- Muối Acid là muối có gốc Acid có nguyên tử H phân li ra ion H+: NaHCO , KH PO , ... 3 2 4
Tính chất hóa học chung:
1. dd muối + Kim loại
Muối + [kim loại] (KL mạnh tác dụng với muối của KL yếu) CuSO + Fe FeSO + Cu↓ 2AgNO + Mg Mg(NO ) + 2Ag↓ 4 4 3 3 2 2FeCl + 6Na + 6H O 6NaCl + 2Fe(OH) ↓ + 3H ↑ 3 2 3 2 CuSO + Ba + 2H O BaSO ↓ + Cu(OH) ↓ + H ↑ 4 2 4 2 2 2. Muối + Acid
muối + Acid (↓,↑, điện li yếu) AgNO + HCl AgCl↓ + HNO CaCO + 2HCl CaCl + CO ↑ + H O 3 3 3 2 2 2
3. dd muối + dd Kiềm
muối + Base (↓,↑, điện li yếu) MgCl + Ca(OH)
CaCl + Mg(OH) ↓ Na SO + Ba(OH) BaSO ↓ + 2NaOH 2 2 2 2 2 4 2 4
4. dd muối + dd muối
muối mới + muối mới (↓,↑, điện li yếu) Na SO + BaCl
BaSO ↓ + 2NaCl KCl + AgNO AgCl↓ + KNO 2 4 2 4 3 3 Quay lại l Ti T ế i p theo Lí thuy t ế huy t ế c ơ c bả ơ n n về v hó a hó họ a c họ
5. Một số muối bị nhiệt phân hủy 2KMnO K MnO + MnO + O ↑ 2KClO 2KCl + 3O ↑ 4 2 4 2 2 3 2 NH Cl HCl↑ + NH ↑ NH HCO H O↑ + NH ↑ + CO ↑ 4 3 4 3 2 3 2 NH NO 2H O↑ + N O↑ NH NO 2H O↑ + N ↑ 4 3 2 2 4 2 2 2 2NaHCO Na CO + H O + CO ↑ Ca(HCO ) CaCO ↓ + H O + CO ↑ 3 2 3 2 2 3 2 3 2 2 Na CO
(không bị nhiệt phân hủy) CaCO CaO + CO ↑ 2 3 3 2 2KNO 2KNO + O ↑ 2Cu(NO ) 2CuO + 4NO ↑ + O ↑ 3 2 2 3 2 2 2 4Fe(NO ) 2Fe O + 8NO ↑ + O ↑ 2AgNO Ag + 2NO ↑ + O ↑ 3 2 2 3 2 2 3 2 2 4Fe(NO ) .nH O
2Fe O + 12NO ↑ + 3O ↑ + 4nH O ↑ 3 3 2 2 3 2 2 2
6. Một số phản ứng đặc biệt của muối FeCl + Cl FeCl 2FeCl + Fe 3FeCl 2 2 3 3 2 2FeCl + Mg MgCl + 2FeCl FeCl + Mg MgCl + Fe↓ 3 2 2 2 2 2FeCl + Cu 2FeCl + CuCl Fe (SO ) + Cu 2FeSO + CuSO 3 2 2 2 4 3 4 4 10FeSO + 2KMnO + 8H SO
5Fe (SO ) + K SO + 2MnSO + 8H O 4 4 2 4 2 4 3 2 4 4 2 Fe(NO ) + AgNO Fe(NO ) + Ag↓ 3 2 3 3 3 FeCl + 3AgNO Fe(NO ) + Ag↓ + 2AgCl ↓ 2 3 3 3 2KHSO + 2NaHCO K SO + Na SO + CO ↑ + H O 4 3 2 4 2 4 2 2 KHSO + BaCl BaSO ↓ + KCl + HCl 4 2 4 Quay a lạ i Lí L thuyế u t cơ bả c n về hóa học Hydr d o r xid i e lưỡ l ng n tín í h n là l hợp ợ chất tmà phân â tử của nó vừa có th t ể điệ i n li t i h t eo kiể i u Ba B se, vừa có c th t ể ể điệ i n lil ith t eo e kiểu ể Acid i . → Hydr → oxi Hydr
de lưỡng tính vừa vừ tác á dụ d ng n với Base
as , vừa tác dụng với A
ới cid tạo ra muối và nước nư Ví ídụ d : Al(
l OH) , Cr(OH) , Zn(OH) , Pb(OH) , Be(OH) , …
3 Cr(OH)3, Zn(OH)2, Pb(OH)2, Be(OH)2, 3 3 2 2 2 Al(OH) HAlO .H O 3 2 2
Aluminium Hydroxide Acid aluminic Al(OH) Al3+ + 3OH- HAlO H+ + AlO - 3 2 2
Al(OH) + 3HCl → AlCl + 3H O
Al(OH) + NaOH → NaAlO + 2H O 3 3 2 3 2 2
Cr(OH) + 3HCl → CrCl + 3H O
Cr(OH) + KOH → KCrO + 2H O 3 3 2 3 2 2
Zn(OH) + H SO → ZnSO + 2H O Zn(OH) + KOH → K ZnO + 2H O 2 2 4 4 2 2 2 2 2 Chú ý: C Al A , Zn, Fe F (NO
(N ) không phải là chất lưỡng tính.
3)2 không phải là chất lưỡng t 3 2 Quay lại l Lí L thuyế u t cơ bả c n về hóa học Công g th t ức chuyể y n đổi Quay lạ l i
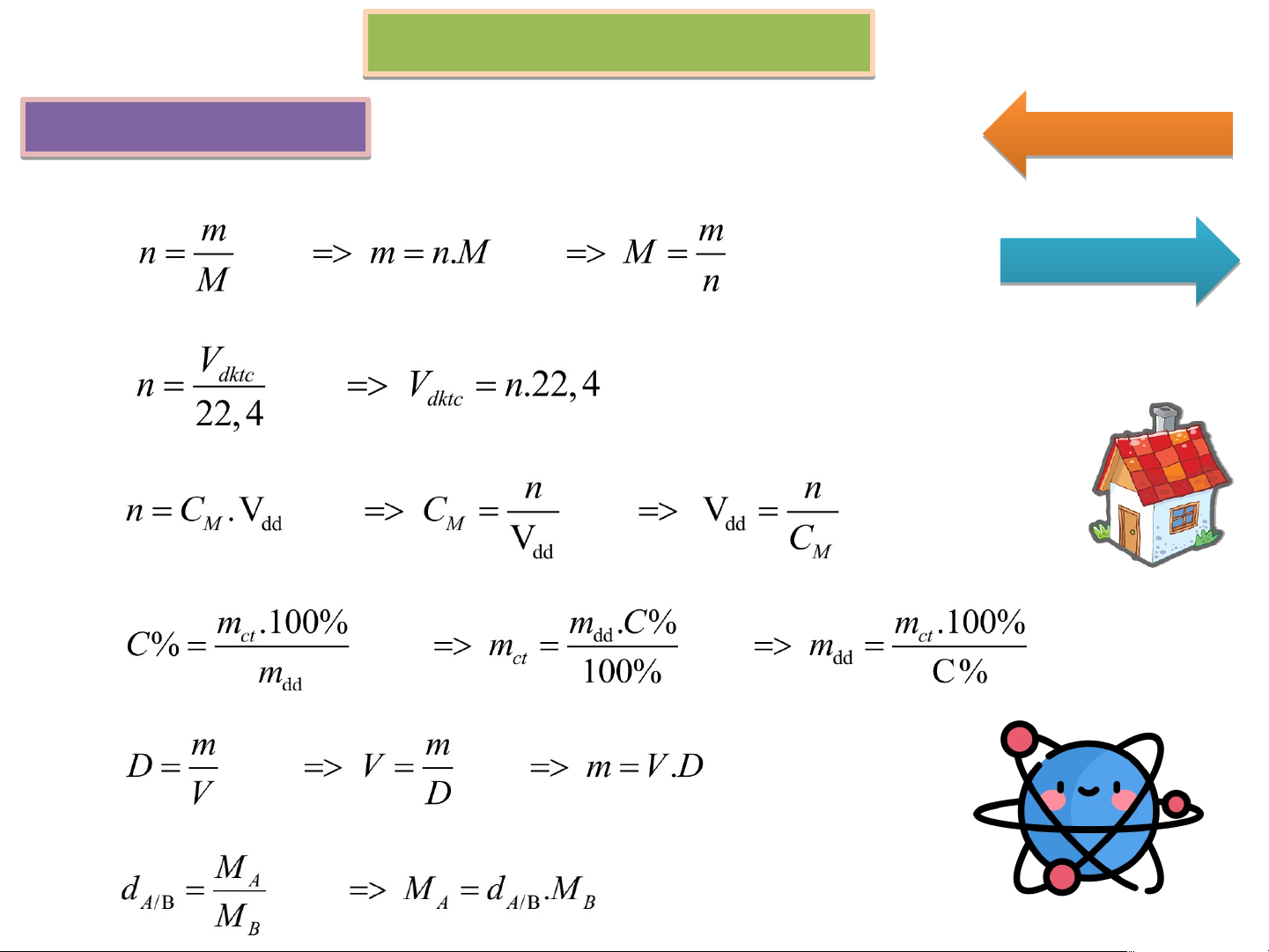
1. Theo khối lượng: (m ↔ n ↔ M) Ti T ế i p p the h o
2. Theo thể tích (đktc): (n ↔ V ) đktc
3. Theo nồng độ mol (C ↔ n ↔ V ) M dd
4. Theo nồng độ phần trăm (C% ↔ m ↔ m ) ct dd
5. Theo khối lượng riêng (D ↔ m ↔ V ) dd
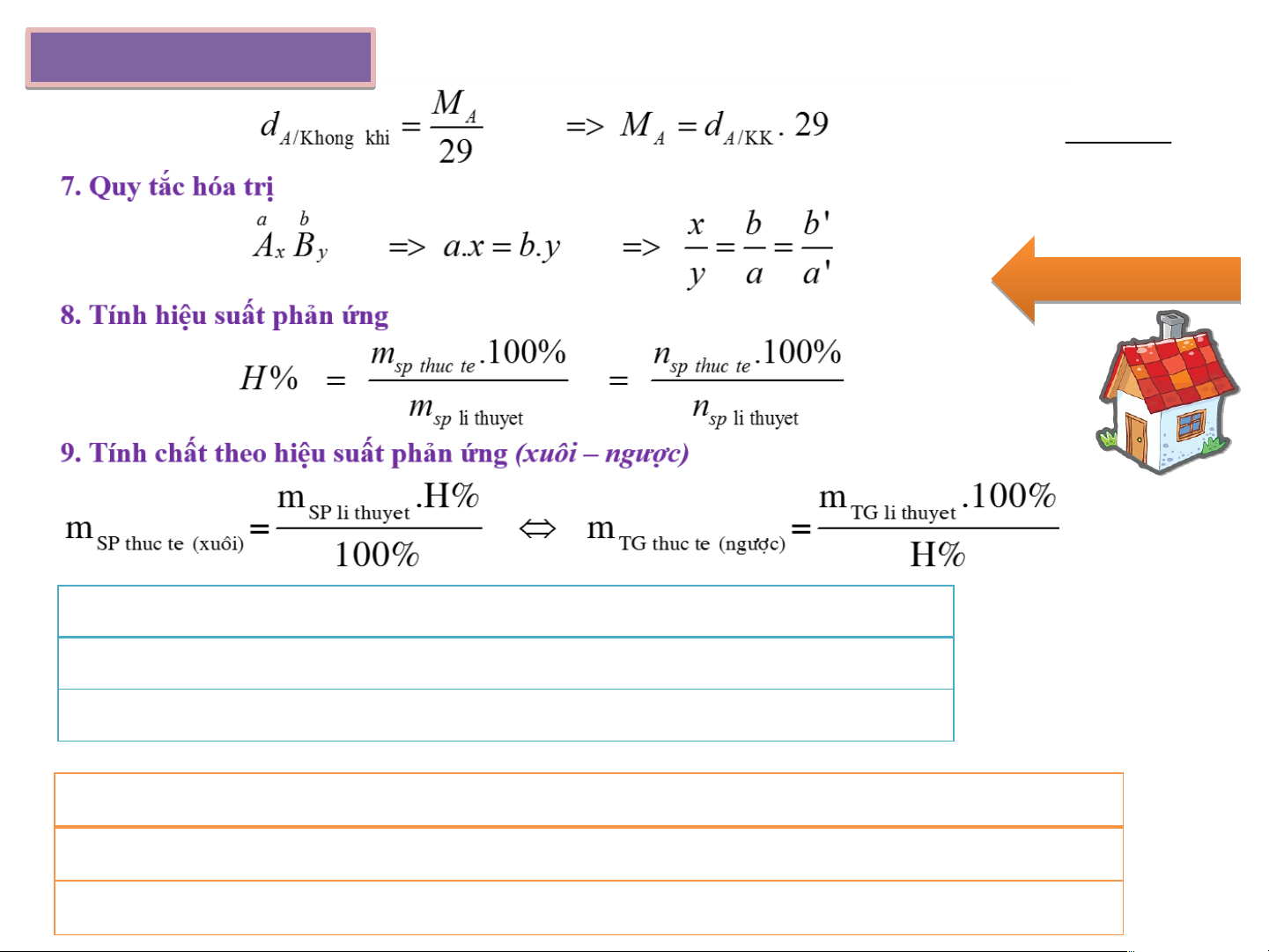
6. Theo tỉ khối khí (d) Công t g hức c huyể y n ể đổi 10. Độ tan bão hòa mChat tan S = .100 mH2O Qu Q ay lạ l i m = m + Σm – Σm (↓,↑) dd sau dd trước cho vào thoát ra m = m + Σm – Σm (↑) bình sau bình trước cho vào thoát ra m = m + Σm – Σm rắn sau rắn trước kết tủa
bị hòa tan (phản ứng)
Sự thay đổi khối lượng dd: Δm = Σm – Σm (↓,↑) dd sau cho vào thoát ra
Sự thay đổi khối lượng bình: Δm = Σm – Σm (↑) bình sau cho vào thoát ra
Sự thay đổi khối lượng chất rắn: Δm = Σm – Σm rắn sau kết tủa bị hòa tan Tà T i l i iệ i u u tham kh k ảo & T á T c c giả i
1. Sách giáo khoa Hóa học 8, 9, 10, 11, 12.
2. The Royal Society of Chemistry: https://www.rsc.org/periodic-table/
3. National Center for Biotechnology Information (NCBI):
https://pubchem.ncbi.nlm.nih.gov/periodic-table/ 4. Kênh Youtube:
“KIẾN THỨC THÚ VỊ Official”, “Người Nổi Tiếng”.
5. Oxford Learner's Dictionaries: Qu Q ay lạ l i
https://www.oxfordlearnersdictionaries.com/
Tác giả: Hà Duy Trường
Trường THCS Phan Chu Trinh – Krông Buk – Đăk Lăk.
Trong “Bảng tuần hoàn nguyên tố hóa học thông minh” mình có sử dụng một số hình ảnh và video
trên internet khi chưa xin phép mong quý chủ sở hữu thông cảm và tạo điều kiện. Nếu có vi phạm xin
vui lòng liên hệ để cùng giải quyết.
Hi vọng “Bảng tuần hoàn nguyên tố hóa học thông minh” sẽ giúp ích cho các bạn học sinh, quý thầy
cô trong quá trình nghiên cứu Hóa học.
Tải phiên bản mới (tiếng Việt / Quốc tế ) tại : hoặc
Fanpage: Hóa Học Không Chỉ Là Một Môn Học:
Nếu bạn thấy có ích hãy bình chọn cho tác giả nhé ^^!
Cuộc thi: “Tri thức trẻ vì giáo dục 2021”
Mọi ủng hộ giúp cho tác giả có thêm động lực để tạo ra những ứng dụng
mới vui lòng gửi về ngân hàng BIDV: 63110000394933. DÃY Y ĐIỆN HÓA H A ỌC KIM LOẠI Qua u y a lạ i lạ
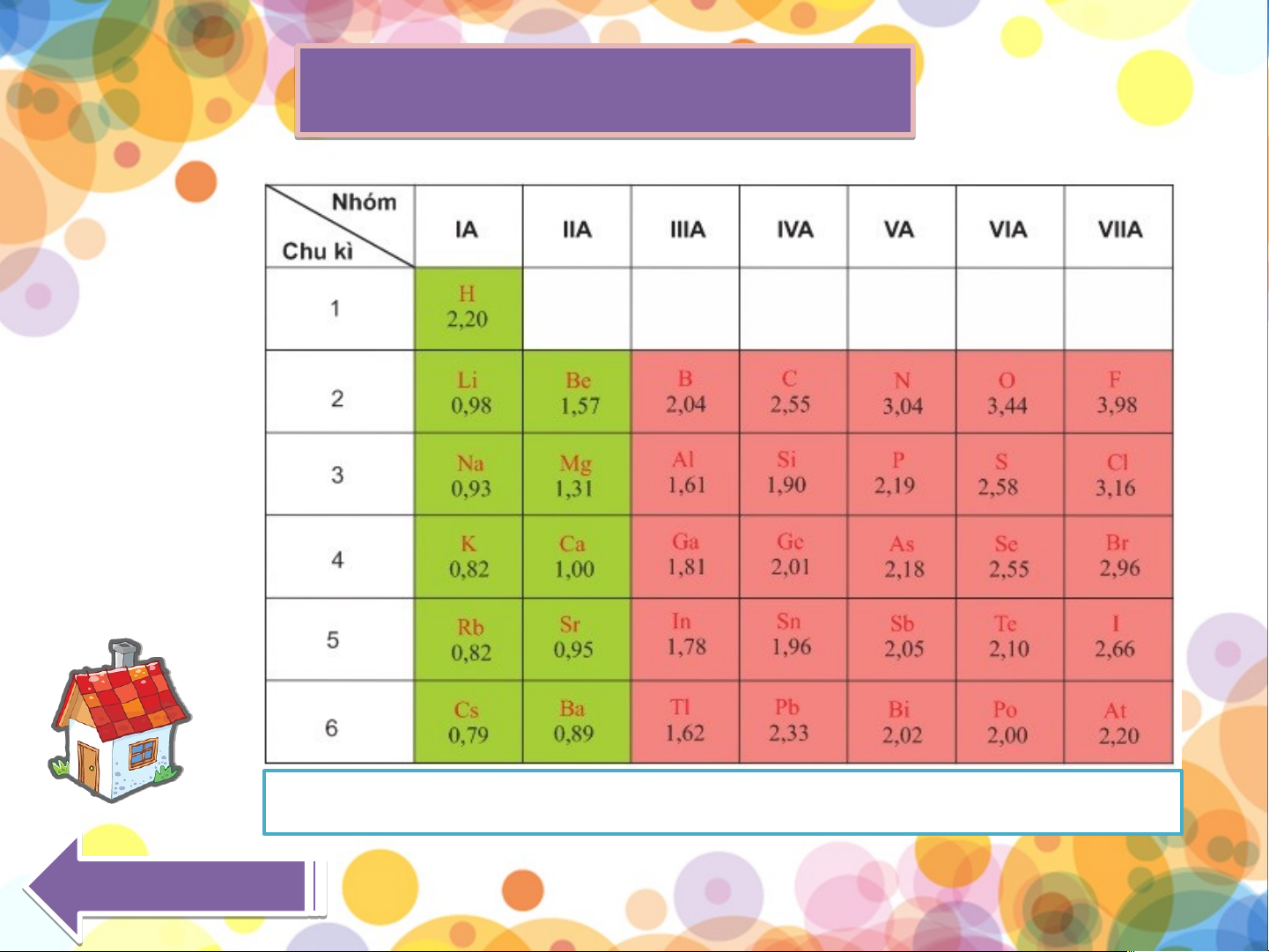
BẢNG ĐỘ ÂM ĐIỆN
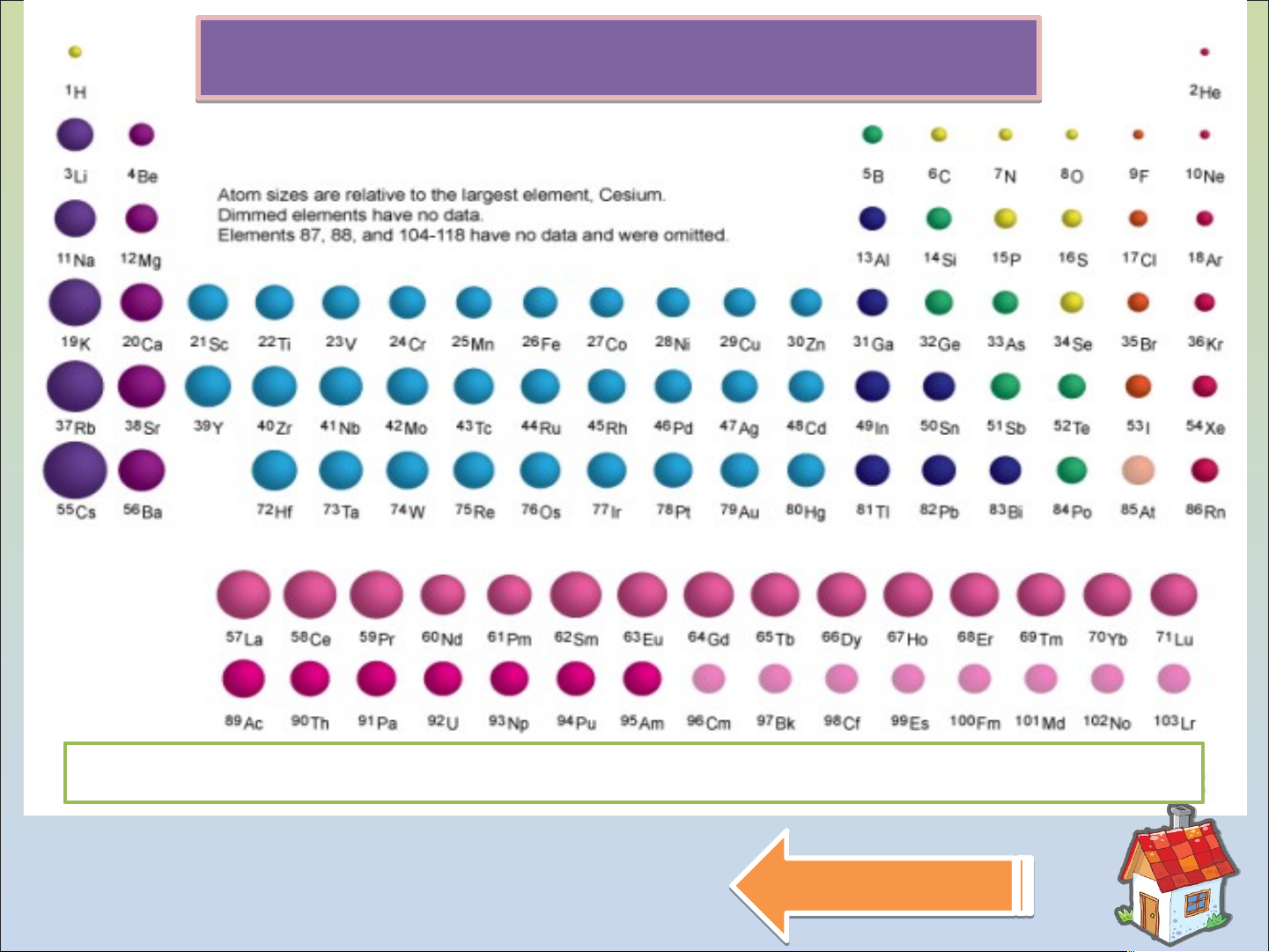
Có thể coi độ âm điện tỉ lệ thuận với tính phi kim Qua u y a lạ i lạ BẢNG BÁN KÍN Í H NGUYÊN TỬ N
Có thể coi bán kính nguyên tử (nhóm A) tỉ lệ thuận với tính kim loại Qu Q a u y a lạ i BẢ B NG T G Í T NH N TA T N Qua u y a lạ i
Hỗ trợ phát âm danh pháp Quốc tế 1. El E e l ment (nguy u ên n tố) 2. Oxid xi e (oxit i ) 3. Base / H / ydrox r ide d (Ba B zo / / Hi H dr d o r xit i ) 4. A . cid i (axit i ) 5. T . ê T n n nhó h m nguy u ên n tố/i/o i n 6. Salt l (muố u i) i 7. T . ê T n n một số chất / / qu q ặng n thườ h ng n gặp Nế N u bị lỗi âm tha h nh.
Hãy lùi về một trang và quay lại Hoặc thoát ra và vô lại Quay lại l Hoặc thoát ra và vô lại
Hỗ trợ đọc danh pháp Quốc tế 1. E lement n (T ( ê T n ê nguyê y n tố t ) 1. Hydrogen 11. .Sodium 21. Scan a diu i m 31. .Gall l ilu i m 2. Heli l um 12. Ma M gnesi e um 22. Ti T ta t niu ni m 32. Germaniu i m 3. Lit i h t iu i m 13. Alu l min i iu i m 23. .Va V nadium i 33. Arsenic i 4. Ber e yllilu i m 14. Si S liic i on 24. .Ch C romiu i m 34. Sele l niu ni m 5. Boron 15. Ph P osphorus 25. .Man Ma ganese e 35. Br B omine 6. Car a bon 16. Su S lf l ur 26. .Iron 36. Krypto t n 7. Nitr t ogen e 17. Ch C lo l rin i e 27. .Co C baltl 37. Ru R bid i iu i m 8. Oxygen 18. Argo r n 28. .Nic i kel e 38. Str t ontitu i m 9. Flu l orin i e 19. Po P ta t ssiu ssi m 29. .Co C pper e 39. Yttr t iu i m 10. .Neon 20. Ca C lc l iu i m 30. Zin i c 40. Zir i conium Hãy click vào Quay lạ l i Ti T ế i p theo ô nguyên tố
Hỗ trợ đọc danh pháp Quốc tế 1. E lement n (T ( ê T n ê nguyê y n tố t ) 41. .Nio i biu i m 51. .Antim i ony 61. .Prometh t iu i m 71. .Lutet e iu i m 42. Moly l bdenum 52. .Te T lllurium 62. .S amariu i m 72. .Hafnium 43. .T e T chnet e iu i m 53. .Iodin i e 63. .Europiu i m 73. .Ta T nta t lu l m 44. Ru R th t eniu i m 54. .Xenon 64. Gadoli l n i iu i m 74. .Tu T ngste st n 45. Rh R odiu i m 55. .Cesi e um 65. .Te T rbiu i m 75. .Rhen e iu i m 46. .Pa P llla l diu i m 56. .Bar a iu i m 66. Dysprosiu si m 76. .Osm s iu i m 47. .Si S liver 57. .Lanth nt anum 67. Holm l iu i m 77. .Irid i iu i m 48. .C ad a miu i m 58. .Cer e iu i m 68. Erbiu i m 78. .Pla l titn i um 49. .Indium 59. Prase s odymiu i m 69. T huliu i m 79. .Gold 50. .Ti T n 60. Neodymiu i m 70. Yttte t rbium 80. .Mercury Hãy click vào Quay lạ l i Ti T ế i p theo ô nguyên tố
Hỗ trợ đọc danh pháp Quốc tế 1. E lement n (T ( ê T n ê nguyê y n tố t ) 81. T hal a lilu i m 91. Prota t ct c in i iu i m 101. Me M ndele l viu vi m 11 1 1 1 . Roentg t eniu i m 82. Lead 92. Uraniu i m 102. Nobelilu i m 11 1 2. Co C per e nici c um 83. Bi B sm i uth t 93. Neptu t niu i m 103. Lawrenci c um 11 1 3. Nih i oniu i m 84. Po P lo l niu i m 94. Plu l to t nium 104. Rutherfordium 11 1 4. Fl F er e oviu i m 85. Astat a in i e 95. Americ i iu i m 105. Dubniu ni m 11 1 5. Mo M scoviu i m 86. Ra R don 96. Cu C riu i m 106. Sea e borg r iu i m 11 1 6. Liv Li ermoriu i m 87. Fr F an a ciu i m 97. Be B rkelilu i m 107. Bo B hriu i m 11 1 7. T . e T nnessi e ne 88. Ra R diu i m 98. Ca C lilf i ornium 108. Hassiu ssi m 11 1 8. Oganesson 89. Actitnium 99. Ein Ei stei e nium 109. Me M itineriu i m 90. Th . oriu i m 100. Fe F rmium 11 1 0. Darmst s ad a titum Nế N u bị lỗi âm thanh. Hãy click vào Quay lạ l i Hãy lùi về một trang n và quay lại ô nguyên tố Hoặ H c thoát ra và vô ô lại
Hỗ trợ phát âm danh pháp Quốc tế 2. Oxid i e
Cách 1: Tên nguyên tố + (hóa trị nếu nguyên tố có nhiều hóa trị) + oxide
Cách 2: Số lượng nguyên tử + Tên nguyên tố + Số lượng nguyên tử oxygen + oxide SO S : Sulfur (IV) oxide P O : Phosphorus (V) oxide Cu O: Cupper (I) oxide 2 : Sulfur (IV) oxide P O 2 5 : Phosphorus (V) oxide Cu2O: Cupper (I) 2 2 5 2 SO : Sulfur dioxide P O : Diphosphorus pentoxide 2 : Sulfur dioxide P2O5 : Diphosphorus pentoxi Cu O: Cuprous oxide 2 2 5 Cu2O: Cuprous oxi 2 SO S : Sulfur (VI) oxide 3 : Sulfur (VI) CuO: Cupper (II) oxide 3 Na N O: Sodium oxide 2O: Sodium CuO: Cupper (II) oxi 2 SO : Sulfur trioxide 3 : Sulfur trioxide CuO: Cupric oxide 3 Al A O : Aluminium oxide CuO: Cupric 2O3: Aluminium oxide 2 3 CO CO : Carbon (II) I ox o ide Fe F O: O Iron (II) oxide Cr O : chromium (III) oxide 2O3: chromium (III) 2 3 CO : Ca C rbon monoxide Fe F O: O Ferrous oxide Cr O : chromic oxide 2O3: chromic oxi 2 3 CO : Carbon (IV) oxide Fe O : Iron (III) oxide CrO : Chromium trioxide 3 Chromium trioxide 2 : Carbon (IV) oxide Fe2O3: Iron (III) oxide 2 2 3 3 CO : Carbon dioxide Fe O : Ferric oxide Fe F O : Ferumoxides 3O4: Ferumoxid 2 : Carbon dioxide Fe2O3: Ferric oxide 2 2 3 3 4 Hãy click vào Quay lạ l i ô tên chất
Hỗ trợ phát âm danh pháp Quốc tế 3. Ba B se Hydro r xid i e NaOH NaOH : Sodium hydroxide Fe F (OH) (O : Iron (II) hydroxide 2 : Iron (II) hydroxi 2 KOH KOH : Pot Po assium hydroxide Fe(OH) O : Ferrous hydroxide 2 : Ferrous hydroxi 2 Ca(OH) : Calcium hydroxide Fe(OH) : Iron (III) hydroxide 2 : Calcium hydroxide Fe(OH)3 : Iron (III) hydroxi 2 3 Ba(OH) (O : Barium hydroxide Fe(OH) Fe(OH : Ferric hydroxide 3 : Ferric hydroxid 2 : Barium hydroxide 2 3 Al A (OH) (O : Aluminium hydroxide
Cu(OH) : Cupper (II) hydroxide 3 : Aluminium hydroxide Cu(OH) 2: Cupper (II) 3 2 Mg(OH) Mg(OH : Magnesium hydroxide Cu(OH) Cu(OH : Cupric hydroxide 2 : Cupric hydroxide 2 : Magnesium hydroxide 2 2 Hãy click vào Quay lạ l i ô tên chất
Hỗ trợ phát âm danh pháp Quốc tế 4. A . cid i H SO : Sulfuric acid 2 4 : Sulfuric a HX : H Hydrohalic acid 2 4 HCl H O O : Hypochlorous orous acid H SO : Sulfurous acid 2SO3 : Sulfurous a HCl : Hydroc H hloric acid 2 3 HClO : Chlorous acid 2 : Chlorous acid 2 HNO : Nitric acid HF : H Hydrofluoric acid HNO3 : Nitric ac 3 HClO : Chloric acid 3 : Chloric ac 3 HNO HN : Nitrous acid 2 : Nitrous aci H S : Hydrosulfuric Acid 2 HClO : Perchloric acid 2S : Hydrosulfuric Acid HClO4 : Perchloric ac 2 4 H PO : Phosphoric acid 3PO4 : Phosphoric ac 3 4 H PO : Phosphorous acid 3 3: Phosphorous a 3 3 H CO : Carbonic acid 2CO 3 : Carbonic aci 2 3 Hãy click vào Quay lạ l i ô tên chất
Hỗ trợ phát âm danh pháp Quốc tế 5. T . ê T n n nh n óm ng n uyên ê tố/io i n ‒F : ‒ Fluor o ide =SO S : Sulfate ‒HSO : Hydrogen sulfate 4 : Hydrogen sulfa 4 : Sulfate 4 4 ‒Cl ‒ : Chloride =SO S : Sulfite ‒H ‒ SO H : Bisulfate 4 : Bisulfa 3 : Sulfite 3 4 ‒Br : Bromide ‒NO N : Nitrate ‒HC H O : Hydrogen carbonate 3 : Hydrogen carbonat 3 : Nitrate 3 3 ‒I ‒ : Iodide ‒NO N : Nitrite ‒HCO ‒ : Bicarbonate 3 : Bicarbona 2 : Nitrite 2 3 =S : Sulfi S de ≡PO : Phosphate =HPO H : Hydrogen phosphate 4 : Hydrogen phosphat 4 : Phosphate 4 4 =C : Carbide =CO : Carbonate ‒H PO : Dihydrogen phosphate 3 : Carbonate ‒H2PO 4: Dihydrogen phosph 3 2 4 ≡N : Nitride ‒ClO : Chlorate 3 : Chlora ‒NH : Ammonium 3 ‒NH4 : Ammoni 4 ≡P P : Ph P osphide o ≡CN : Cyanide ‒Al A O : Aluminate 2 : Alumi 2 Hãy click vào Quay lạ l i ô tên chất
Hỗ trợ phát âm danh pháp Quốc tế 6. Salt a ( Muối) Na N F: F Sodi S um fl f uoride Al C : Aluminium carbide 4 3: Aluminium carbide 4 3 CuCl : Copper (II) chloride Ca C C : Calcium carbide 2: Calcium carbide 2: Copper (II) chloride 2 2 CuCl : Cupric chloride 2: Cupric chloride 2 Zn P : Zinc phosphide 3P2: Zinc phosphide 3 2 Fe F Br : Iron (III) bromide KCN C : P : ota t ssiu ssi m cyan a id i e 3: Iron (III) bromide 3 FeBr : Ferric bromide 3: Ferric bromide 3 Na SO : Sodium sulfate 2SO4: Sodium sulfate 2 4 AgI: A Silver iodide KHSO
S : Potassium hydrogen sulfate 4: Potassium hydrogen sulfate 4 PbS: P Lead sul su fide KHSO : Potassium bisulfate 4: Potassium bisulfate 4 Li N: Lithium nitride CaSO : Calcium sulfite 3N: Lithium nitride CaSO3: Calcium sulfite 3 3 Hãy click vào Quay lạ l i Ti T ế i p theo ô nguyên tố
Hỗ trợ phát âm danh pháp Quốc tế 6. Salt a ( Muối) AgNO A : Silver nitrate Ag A PO : Silver phosphate 3PO4: Silver phosphat 3: Silver nitrate 3 3 4 Ca (PO ) : Calcium phosphate KNO K : Potassium nitrite Ca3(PO 4)2: Calcium phosphat 3 4 2 2: Potassium nitrite 2 (NH
(N ) HPO : Ammonium hydrogen phosphate
4 2HPO4: Ammonium hydrogen phospha KMnO : Potassium permanganate 4 2 4 4: Potassium permanganate 4
Ca(H PO ) : Calcium dihydrogen phosphate
2PO 4)2: Calcium dihydrogen phospha 2 4 2 KClO : Potassium chlorate 3: Potassium chlor 3 Na N Al A O : Sodium aluminate 2: Sodium alumina 2 MgCO M : Magnesium carbonate 3 Magnesium carbonat 3 NaCl: Sodi S um u chloride NaHCO : Sodium bicarbonate 3: Sodium bicarbonate 3 NaClO: O Sodium hypochlorite
Ba(HCO ) : Barium hydrogen carbonate 3)2: Barium hydrogen carbona 3 2 K CrO : Potassium chlorate 2CrO4: Potassium chlorat 2 4 Ba(HCO ) : Barium bicarbonate 3)2: Barium bicarbonate 3 2 K CrO : Potassium dichlorate 2CrO4: Potassium dichlor 2 4 Nế N u bị lỗi âm thanh. Hãy click vào Quay lạ l i Hãy lùi về một trang n và quay lại ô nguyên tố Hoặ H c thoát ra và vô ô lại
Hỗ trợ phát âm danh pháp Quốc tế 7. Một số ch c ất thườ h ng n gặp Ore r e (quặ u ng) Hematite : Fe O Hydrogen fluoride (gas): HF Solid (rắn) 2O Hydrogen fluoride (gas): HF Solid (rắn 2 3 Magnetite : Fe O 3 Sulfur hexafluoride : SF Liqid (lỏng) 3 4 Sulfur hexafluoride : SF Liqid 6 Si S derite : FeCO3 Hydroge H n chloride (gas): s HCl Ga G s s (khí) Pyrite : Fe F S2 Carbon tetrachloride: CCl Solut u ion (dung dịch) 4 Thermite: Fe O và Al 2O3 và 2 3 Chloroform: CHCl Mixture (hỗn hợp) 3 Mixture (hỗn Bauxite : Al A O 2 3 Am A monia: NH N Powder (bột) 3 Powder (bột Cryolite : NaAlF6 Phe P nolphthalein Reacts (phản n ứng) ứ Calcite : CaCO Purpl P e litmus paper (quỳ tím) 3 Magn g esi es te : MgCO Dolomite: CaCO .MgCO 3.M 3 Dolomite: CaCO3 3 Hãy click vào Quay lạ l i ô tên chất 1
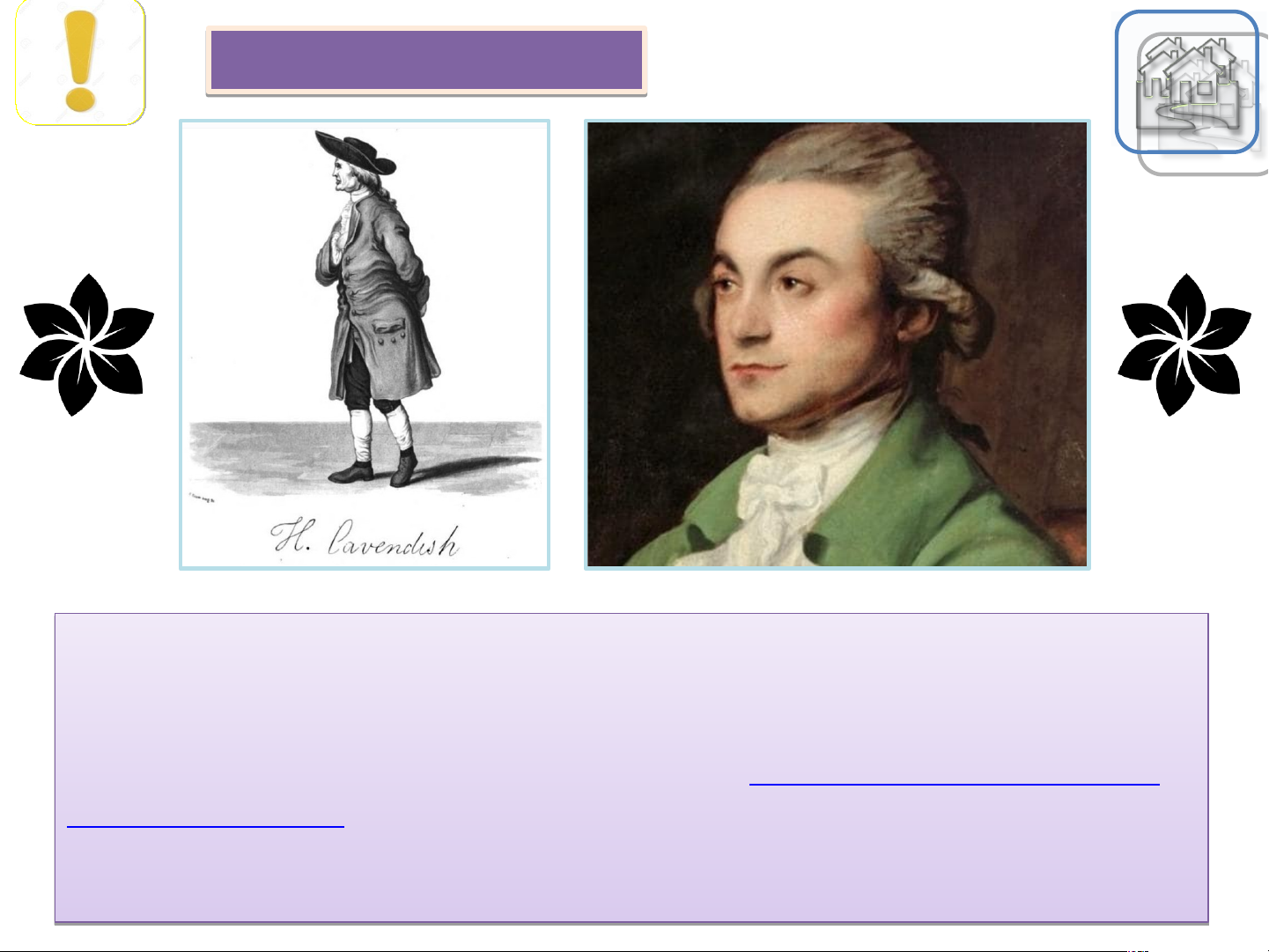
- Hydrogen(khinh khí) được nhà vật lý người Anh Henry Cavendish phát hiện vào H
năm 1766. Hydrogen là nguyên tố phổ biến nhất trong vũ trụ, tạo nên khoảng 75%
Hydrogen tổng khối lượng vũ trụ và chiếm trên 90% tổng số nguyên tử, có trong mặt trời và hầu 1
hết các ngôi sao, hành tinh. Sao Mộc có thành phần chủ yếu là Hydrogen.
- Hóa trị: I NTK: H = 1đvC PTK: H = 2đvC 2
I. TCVL: Chất khí, không màu, không mùi, ít tan trong nước. Hãy Click vào t = -259oC, t = Hì -253o nh ả C nh dựa trên mô hình biểu tượng nc s II. TCHH
nguyên tử mang tính biểu Nguyên tố
1. H tác dụntg với O → H ượng do Ni O el s 2 Bohr đề H + xuấ tO 2Ho t O 2 2 2 2 2 2 để biết ý nghĩa
2. H tác dụng với phi kim(khác O ) → hợp chất khí 2 lần đầu t , , o xt p t as iên và 2 o năm 1913. H + Cl 2H Cl 3H + N 2NH 2 2 2 (Theo Hiệp hội H 2 óa học 3
3. H tác dụng với Oxide kim lootại(sau Al) → Kim loại + H O 2 2 Hoàng gia – R SC) H + CuO Cu + H O 2 2 III. Ứng dụng: - Nhiên liệu sạch.
- Nguyên liệu sản xuất: HCl, NH .... 3
- Điều chế một số kim loại.
- Bơm vào bóng thám không... Tiếp th t eo Mộc tinh IV. Điều chế
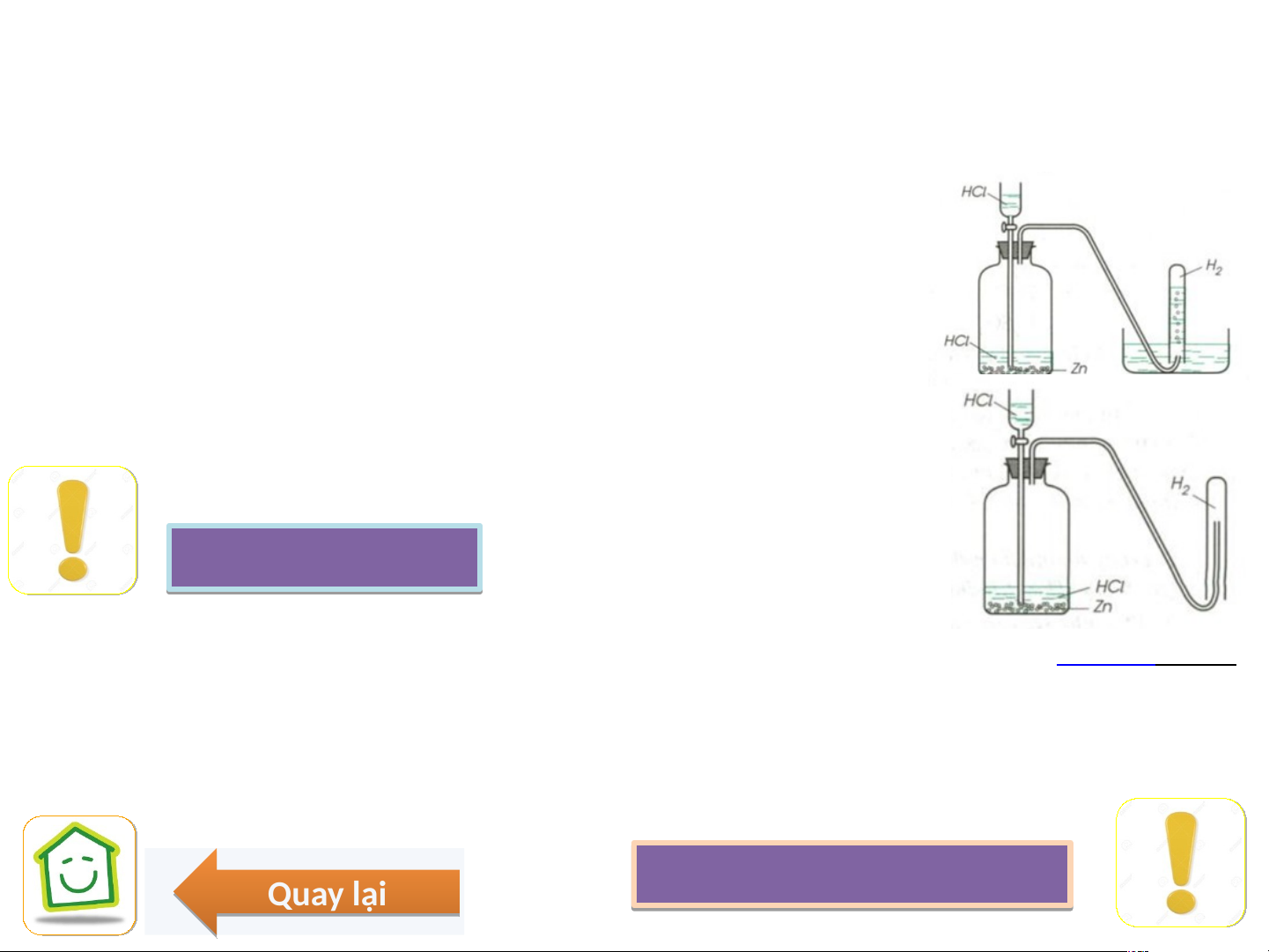
1. Trong PTN: Kim loại(trước H+) + dd Acid → Muối + H ↑ 2
Zn + 2HCl → ZnCl + H ↑ 2 2
(thu khí H phương pháp đẩy nước hoặc đẩy không khí bình đứng) 2 2. Trong CN ñieän phaân
Điện phân nước: 2H O H SO 2 4 2H ↑ + O ↑ 2 2 2
Khí than ướt: (H , CO, CO ...) 2 2 1050o C C + H O CO + H 2 2
Phân hủy khí thiên nh,iê,n o p xt t : CH C + 2H 4 2 Khí Kh th í iên th iên nh n iên h ?
- Khí thiên nhiên hỗn hợp chất khí cháy được, bao gồm phần lớn là các hydrocarbon
có thể chứa đến 70-95% methane(CH ) còn lại là các alkane và tạp chất khác. 4
- Khí thiên nhiên được sử dụng làm nhiên liệu và nguyên liệu đầu vào cho ngành chế biến hóa chất. Henr n y Cave y C nd n i d sh? h Quay a lạ i Henr n y Cave y C nd n i d sh? h Henr n y Cavend n ish i (10 tháng 10 năm ă 1731 - 24 th t án á g 3 năm 1810) là l mộ m t tnhà vật t lý
l , hóa học người iAnh người i đã ã phát á hiệ i n ra Hydrogen, tính í ra được ợ một t hằng số hấp dẫn và à títn í h được khối lư l ợng T r T ái á Đất.t Tên của Ca C ven e dish i được ợ đặt t ch c o Phòng thí t nghiệ i m Ca C vendish i ở Đại h i ọc Ca C mbrid i ge, chín hí h là l Khoa Vật ậ lý và à Thiên ê văn củ c a Đại ạ học c Cam a bridge - một ttr t ong những trung tâ t m nghiê i n cứu và đào tạ t o hàng đầu ầ nước c Anh cũng như thế giới ớ ivề ề lĩln ĩ h vực vật tlý l . 2
- Helium được nhà hóa học Scotland William Ramsay tìm thấy vào năm He
1895 và độc lập bởi các nhà hóa học Thụy Điển Per Teodor Cleve và Nils
Helium Abraham Langlet. Tên của Helium bắt nguồn từ "Heliumos", tên của thần 4
Mặt Trời trong thần thoại Hi Lạp, nguyên tố này được
tìm thấy trong quang phổ trên Mặt Trời. Hãy Click vào
- Hóa trị: - NTK: He = 4đvC PTK: - biểu tượng
I. TCVL: Chất khí, kh H ôn ì g m nh ả à n u, h lkhô à n m g ặ m t t ùi, rời rất vì í t tan trong nước, Nguyên tố t = -272oC, t = -268oC. để biết ý nghĩa nc s Helium lấy tên từ II. TCHH 'Heliumos', từ Hy Lạp có
- Helium thuộc nhóm VIIIA: khí hiếm, khí trơ thường tồn tại ở dạng đơn nguyên tử.
nghĩa là mặt trời. Helium đã
- Trong thực tế Helium nói riêng và các nguyên tố nhóm VIIIA nói chung rất khó tham gia các phản ứng đượchóa h phá ọtc n hi ê ệ n c n t húng kh
rong máặ ttrơ t về rời mặt hóa học.
III. Ứng dụng: bằng các vạch quang phổ của - Helium được dùng để b nó nhi ơ ề m và u nă o mbón tr g ư t ớ h c ám k khi hô n n
ó g và khí cầu nhỏ và hóa lỏng để
làm lạnh cho nam châm siêu dẫn.
được tìm thấy trên Trái đất. -
Làm giọng nói trở nên thay đổi (trở nên cao hơn) -
Sử dụng rộng rãi trong y học: Nó có tác dụng rất tốt với những người mắc bệnh
hen suyễn. Ngoài ra những người thợ lặn và những người làm việc dưới các độ
sâu lớn thường dùng một chất hỗn hợp bao gồm Helium và Oxygen IV. Điều chế: -
Khai thác từ khí thiên nhiên. Trong khí này có chứa 1-2% Helium. Hệ H mặt trời -
Tách ra trong quá trình phóng xạ 3
- Lithium được phát hiện bởi nhà khoáng vật học người Thụy Điển Johan Li
August Arfwedson vào năm 1818. Tên Lithium bắt nguồn từ tiếng
Latin lithos có nghĩa là "đá“. Lithium 7
- Hóa trị: I NTK: Li = 7đvC
I. TCVL: Chất rắn, màu trắng bạc, mềm, tan(pư) trong nước,
là nguyên tố kim loại nhẹ nhất. t = 180oC, t = 1330oC, d = 0,53 g/cm3, Lithium nc được phát s hiện từ một II. TCHH
khoáng chất, trong khi các kim
1. Li tác dụng với O → Oxide 4Li + O → 2Li O 2
loại kiềm thông thường khác2 được 2
2. Li tác dụng với phi k ph iám( t hkh iệ á n c O ) từ ng → uy M ê u n l ố iệi 2L u i + thực C vậl t. → 2LiCl 2 2
(Li là kim loại duy nhất Đi tác ề dụng u nà với y đượN c ở c đk ho thư là ờng.) để giả 6Li i th + íc N h → 2Li N 2 2 3
3. Li tác dụng với nước → ngu d ồn d B gố as c ce ủ+ H a tê ↑ n ng 2L uyê i n + 2 tố; H
từ O → 2LiOH + H ↑ 2 2 2
'lithos' (tiếng Hy Lạp có nghĩa là
4. Li tác dụng với dd Acid → Muối + H ↑
2Li + 2HCl → 2LiCl + H ↑ 2 2
'đá'). Hình ảnh dựa trên một biểu
5. Li tác dụng với dd Muối → Base + Muối + H ↑ 2 tượng giả kim cho đá.
2Li + CuSO + 2H O → Cu(OH) ↓ + Li SO + H ↑
III. Ứng dụng: Vì n 4hiệt du2ng riêng lớn củ2a nó (l 2ớn n4hất tr2ong số các chất rắn),
Lithium được sử dụng trong các ứng dụng truyền nhiệt. Nó cũng là vật liệu quan
trọng trong chế tạo cực dương của pin vì khả năng điện hóa học cao của nó.
IV. Điều chế: Điện phân nóng chảy hợp chất của Lithium. 2LiCl 2Li + d C pn lc ↑ 2 4
- Beryllium được phát hiện bởi nhà hóa học và dược sĩ người Pháp Be
Nicholas-Louis Vauquelin trong beryl và ngọc lục bảo vào năm 1797.
Beryllium - Hóa trị: II NTK: Be = 9đvC 9
I. TCVL: Chất rắn, màu trắng xám, cứng, giòn, nhẹ, có độc tính,
không tan trong nước, t = -1287oC, t = -2469oC, d = 1,85 g/cm3. nc s
Beryllium được sử dụng II. TCHH trong bánh răng và bánh
1. Be tác dụng với O → Oxide 2Be + O 2BeO ot 2 2
răng, đặc biệt là trong o t
2. Be tác dụng với phi kim(khác O )
2 → Muối Be + Cl BeCl 2 2 ngành hàng không.
4. Be tác dụng với dd Acid → Muối + H ↑ Be + 2HCl → BeCl + H ↑ 2 2 2
5. Be tác dụng với dd Muối(sau Be) → Muối + Kim loại ↓ 2Be + CuSO → BeSO + Cu↓ 4 4
Chú ý: Be không tác dụng với nước ở bất kì điều kiện nào. III. Ứng dụng:
- Chế tạo hợp kim Beryllium-Cupper, được sử dụng rộng rãi trong nhiều lĩnh vực.
- Sử dụng trong các vũ khí hạt nhân.
- Sử dụng trong công nghiệp hàng không, vũ trụ, ...
IV. Điều chế: Khử Beryllium Fluoride bằng Magnesium kim loại. o BeF + Mg MgF + tB e 2 2 5
- Boron được cô lập bởi các nhà hóa học người Pháp Louis-Joseph Gay- B
Lussac và Louis-Jacques Thenard năm 1808. Các hợp chất của Boron Boron
(buraq) đã được biết đến từ hàng nghìn năm trước. 11 - Hóa trị: III NTK: B = 11đvC
I. TCVL: Chất rắn, màu đen nâu, là nguyên tố có sức
kéo dãn cao nhất. t = 2076oC, t = 3927oC. nc
Một hình ả snh phản ánh tầm quan
II. TCHH (Boron có thể coi là một á kim)
trọng của boron như một khoáng o
1. B tác dụng với O → Oxide 4B + 3O 2B O t 2 2 2 3
chất cần thiết cho cây trồng. Cái o t
2. B tác dụng với H → hợp chất khí 2B + 3H 2 B H 2 2 o 3
cây và những tán lá kim loại kỳ t
3. B tác dụng với phi kim(khác O ) → Muối 2B + 3Cl 2oB Cl 2 2 t 3
lạ của nó 'phát triển' từ một hình
(Boron nitride (BN) có độ cứng như kim cương) 2B + N o t 2BN 2
nón bột tối 'nguyên chất' của
4. B tác dụng với kim loại→ Muối B + 3Na Na B 3 III. Ứng dụng: nguyên tố.
- Dùng làm lớp vỏ cách nhiệt cho cáp quang, Sodium octaborat là chất chống cháy.
- Boron được sử dụng làm chất đốt cháy nhiên liệu tên lửa và tạo màu lục cho pháo hoa.
- Hợp chất của Boron( Acid boric, borax và Oxide boric) được sử dụng làm phân bón
trong nông nghiệp, thuốc sát trùng nhẹ, bột giặt và men gạch, ...
IV. Điều chế: Boron tinh khiết không dễ điều chế.
- Boron nguyên chất có thể được điều chế bằng việc khử các hợp
chất của Boron halogenua dễ bay hơi bằng Hydrogen ở nhiệt độ cao. 6
- Carbon là nguyên tố phổ biến thứ 4 trong vũ trụ về khối lượng. Các hợp C
chất của Carbon tạo ra nền tảng cho mọi loại hình sự sống trên Trái Đất, là
Carbon nền tảng của hóa hữu cơ. Carbon có nhiều dạng thù hình, phổ biến nhất là 3 12
dạng thù hình gồm Carbon vô định hình, graphite(than chì) và kim cương.
- Hóa trị: II & IV NTK: C = 12đvC
I. TCVL: Chất rắn, trong suốt hoặc đen, t = 3642oC. thăng hoa
+ Thù hình graphite rất mềm, có thể dẫn điện.
+ Thù hình kim cương rất cứng(10moh), có thể dẫn điện.
Ba vương miện đại diện cho
+ Thù hình vô định hình(than hoạt tính) có khả năng hấp phụ chất khí
ba dạng chính của nguyên tố
và chất tan trong dung dịch. Ngoài ra, còn diệt khuẩn và khử mùi ...
trong tự nhiên và trạng thái II. TCHH (C là nguyên c tố ủa đán Carg chú bon lýà v ' ì n V hiề ua u c lý ủa do c ) ác o
1. C tác dụng với O → Oxide 2C + O 2CO t 2 2 2
nguyên tố' trong bảng tuần , o xt t
2. C tác dụng với H → hợp chất khí C + 2H C H 2 2 o 4 hoàn. t
3. C tác dụng với kim loại → Muối
3C + 4Al Al C 4 3 o t
4. C tác dụng với Oxide(sau Al)→ Kim loại + CO C + ZnO o t Zn + CO
5. C tác dụng với hợp chất → ..... C + CO 2CO o 2 t C + SiO 2CO + Si o 2 t
(Đất đèn (CaC ) với rất nhiều ứng dụng) 3C + CaO CaC + CO 2 2 Tiếp t heo Vid i eo: Địn
ị h tuổi ibằng đồng vị C ị ac a bon-14 III. Ứng dụng:
- Carbon là các thành phần thiết yếu cho mọi sự sống và không có nó thì sự sống
mà chúng ta đã biết không thể tồn tại.
- Đồng vị Carbon-14 sử dụng trong phương pháp định tuổi cho mẫu vật, khảo cổ.
- Graphit kết hợp với đất sét để tạo ra 'chì' sử dụng trong các loại bút chì.
- Kim cương được sử dụng vào mục đích trang sức hay trong các mũi khoan.
- Than hoạt tính được sử dụng trong y tế.
- Carbon nano có ứng dụng đầy hứa hẹn trong các lĩnh vực mới. IV. Điều chế:
Chủ yếu được khai thác từ các mỏ than/ mỏ kim cương tự nhiên trên thế giới. V. Chu trình Carbon
Trong các điều kiện trên Trái Đất, sự chuyển
biến từ một nguyên tố này thành một nguyên tố
khác là rất hiếm. Dù vậy, hàm lượng Carbon trên
Trái Đất là không đổi. Do đó, các quá trình sử
dụng Carbon phải tiêu thụ nó ở một nơi và thải
ra ở một nơi khác. Những cách mà Carbon di
chuyển trong môi trường tạo thành một chu
trình gọi là chu trình Carbon. Vi V d i e d o: Sợ S i c i arbon Quay a lạ i 7
- Nitrogen(đạm khí) được phát hiện bởi bác sĩ và nhà hóa học người Scotland
Daniel Rutherford vào năm 1772. Nitrogen là nguyên tố chiếm khoảng 78% khí N
quyển Trái Đất và là thành phần của mọi cơ thể sống tạo nên các Amino acid
Nitrogen và Nucleic acid . Nitrogen là chất đạm cần thiết cho thực vật. 14
- Hóa trị: I, II, III, IV, V. NTK: N = 14đvC PTK: N = 28đvC 2
Biểu tượng lá lúa mì và tia chớp
I. TCVL: Chất khí, không phả m n á àu n , kh h tầ ôn m g mùi, quan ítt tan tro rọng c ng ủa nước,
không duy trì sự cháy, không độc. t = -210oC, t = -196oC Nitrogen đốinc với si s nh vật.
II. TCHH (N khó th N aitm gia roge các p
n rấ htản ứn qua g h n t óa h
rọn ọgc v đ ì c ốió liên với kết
sự b a N≡N bền vững.) 2 3000o
1. N tác dụng với O phát t → riểOxid n c e ủa thực vật N và c + ó tO hể 2NO 2 2 2 2 o t ,xt , p 2. N tác dụng v đ ới H ược '→ c hợ
ố địpn chh' ất
b ằkhí
ng s é t hoặc N t hê + m 3 H 2 o NH 2 2 2 2 3 t
3. N tác dụng với kim vàloại → o đất Mu t ối rong phâ N + n bón. 3Mg Mg N 2 2 3 2
(Li là kim loại duy nhất tác dụng với N ở đk thường) N + 6Li 2Li N 2 2 3 III. Ứng dụng:
- N là nguyên liệu tổng hợp NH từ đó sản xuất HNO , phân đạm, thuốc nổ, .... 2 3 3
- N tạo môi trường trơ trong bảo quản thực phẩm hoặc sản xuất bóng bán dẫn, điôt, 2 … - N IV. l Đ ỏn iề g u d c ù h n ế:g
làm chất làm lạnh nhanh để bảo quản máu và các mẫu vật sinh học. 2
- Trong CN: Chưng cất phân đoạn không khí lỏng o - Trong PTN: NH NO t N + 2H O 4 2 2 2 o t NH Cl + NaNO NaCl + N + 2H O 4 2 2 2
“Lúa chiêm lấp ló đầu bờ,
Hễ nghe tiếng sấm phất cờ mà lên”
- Do trong không khí có ~ 80% khí N và ~ 20% khí O , khi có sấm sét (tia lửa điện) 2 2
N và O trong không khí sẽ phản ứng với nhau. 2 2 3000o Phương trình hóa học: N + O 2N O 2 2
- Khí NO vừa sinh ra sẽ ngay lập tức phản ứng với O trong không khí. 2 Phương trình hóa học: NO + O → NO 2 2
- Khí NO tác dụng với nước mưa tạo ra HNO (nồng độ rất nhỏ) rơi xuống đất tác 2 3
dụng với các chất có trong đất tạo ra muối Nitrate.
Phương trình hóa học: 4NO + 2H O + O → 4HNO 2 2 2 3 nHNO + Rn+ → R(NO ) + nH+. 3 3 n
- Muối Nitrate cung cấp nguyên tố N(đạm) làm cho lúa(cây) phát triển nhanh hơn. Quay a lại lạ 8
- Oxygen được phát hiện độc lập bởi dược sĩ và nhà hóa học người Thụy O
Điển Carl-Wilhelm Scheele vào năm 1771, và giáo sĩ và nhà hóa học người
Oxygen Anh Joseph Priestley vào năm 1774. Oxygen là nguyên tố phổ biến nhất theo 16
khối lượng trong vỏ Trái Đất. O chiếm khoảng 21% về thể tích không khí. 2
- O thường được gọi là dưỡng khí vì nó duy trì sự sống của cơ thể con người. Hãy Click vào 2
Hình ảnh thể hiện tầm quan
- Oxygen có 2 thù hình chính: O -khí Oxygen và O -Ozone biểu tượng 2 3
trọng cơ bản của nguyên tố
- Hóa trị: II. NTK: O = 16đvC PTK: O = 32đvC Nguyên tố
I. TCVL: Chất khí, không m O àu, k xygehô n ng t m ronùi, ít t g kh an t ô r ng o n k gh nư 2 í ớ và c , duy trì sự cháy, để biết ý nghĩa
cần thiết cho hô hấp của đ khi liộêng thự n kết c vật với . t = -2 hydro19o ge C, n t tạ = o -183oC nc s
II. TCHH (O là chất đáng chú ý vì nhiều tính chất đặc biệt) 2 ra nước. o t
1. O tác dụng với phi kim → Oxide O + S S O 2 2 o 2 t
2. O tác dụng với kim loại → Oxide O + Fe Fe O 2 2 3 4
3. O tác dụng vớoi hợp chất → 2 xt, t o t O + 2SO o 2SO O + 4CO CO 2 2 t 3 2 2 11O + 4FeS o t 2Fe O + 8SO O + 4Fe(OH) + o 2H O → 4Fe(OH) 2 2 2 3 2 2 2t 2 3 3O + 2H S o t 2SO + 2H O 2O + CH COot + 2H O 2 2 2 2 2 4 2 2 3O + C H OH m
en 2CO + 3H O 6nO + (C H O ) 6nCO + 5nH O 2 2 5 2 2 2 6 10 5 n 2 2 O + C H OH CH COOH + H O 2 2 5 3 2 Tiếp t heo III. Ứng dụng:
- Khí Oxygen(O ) cần thiết cho sự hô hấp của người và động vật. Quá trình này tạo 2
ra năng lượng để duy trì sự sống. Tính trung bình, ta có thể nhịn thở tối đa 3 phút.
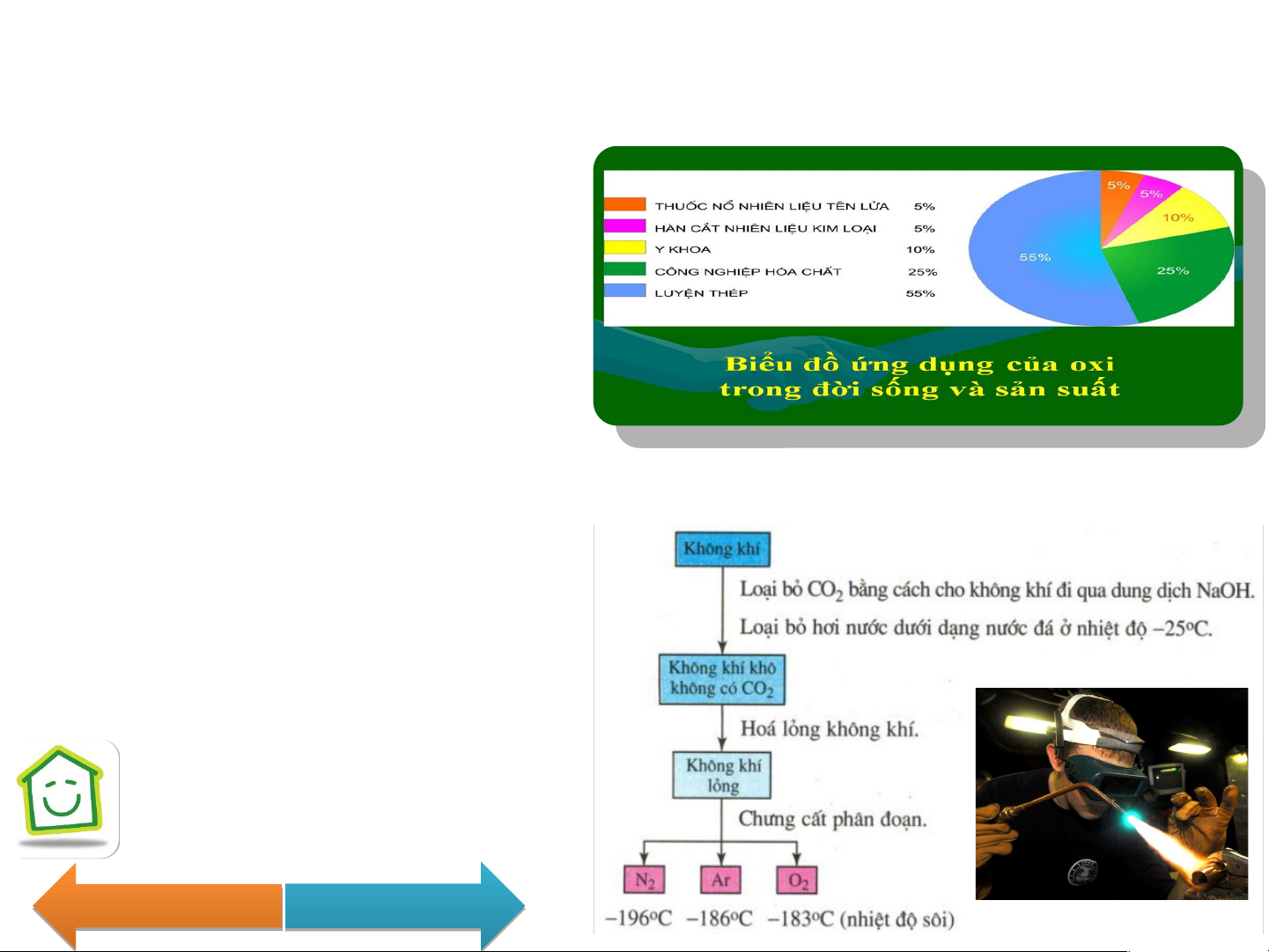
- Sử dụng làm chất oxi hóa các
loại nhiên liệu để tạo ra năng lượng.
- Sử dụng trong sản xuất thép và các hóa chất - Sử dụng trong y khoa. IV. Điều chế:
- Trong PTN: đun nóng những hợp chất giàu Oxygen và dễ bị phân hủy. o o
2KMnO t K MnO + MnO + O 2H O M 22 nO H , t O + O 4 2 4 2 2 2 2 2 2 o t 2KClO 2 K Cl + 3O 3 2 - Trong CN: + điện phân nước. ñieänphaân 2H O 2 H + O 2 2 2
+ chưng cất phân đoạn không khí lỏng (sơ đồ) Quay a lạ i Tiếp th t eo V. Ozone (O ) 3
- Ozone(O ) là một dạng thù hình của oxy, trong phân tử của nó chứa ba nguyên 3
tử oxy thay vì hai như thông thường.
- Trong điều kiện nhiệt độ và áp suất tiêu chuẩn, O là một chất khí có màu xanh 3
nhạt. O hóa lỏng màu xanh thẫm ở -112 °C, và hóa rắn có màu xanh thẫm ở -193 °C. 3
- Ozone có tính oxy hóa mạnh hơn oxy, do nó không bền, dễ dàng bị phân hủy thành
ôxy phân tử và ôxy nguyên tử. O → O + O* 3 2 O + 2Ag → O + Ag O
O + 2KI + H O → I + O + 2 KOH 3 2 2 3 2 2 2
(O làm giấy tẩm dung dịch KI và hồ tinh bột chuyển xanh ) 3 VI. Tầng Ozone
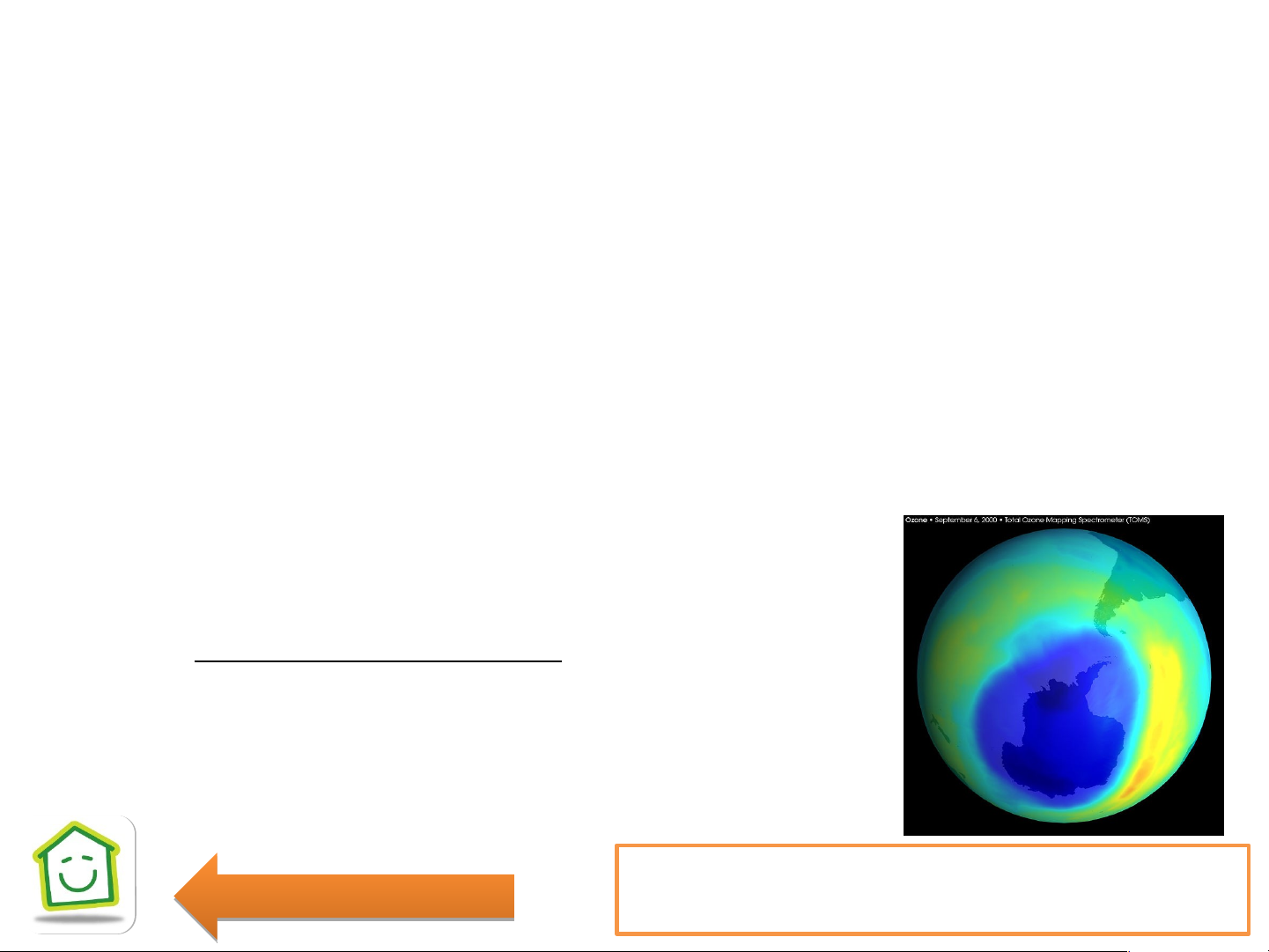
- Tầng(lớp) Ozone là một lớp khí quyển trên bề mặt Trái Đất có tập trung hàm
lượng Ozone cao nằm ở tầng bình lưu.
- Ozone được hình thành do hấp thụ bức xạ UV-B(tia cực tím), nhờ đó mà ngăn c U h V ặn
tia UV-B có hại chiếu xuống mặt đất. 3O 2O 2 3 -
Sự suy giảm tầng Ozone là hiện tượng giảm
lượng Ozone trong tầng bình lưu do tác hại của
các khí thải như: CFC(freon), CCl .... 4
Hình chụp lỗ thủng Ozone lớn nhất ở Nam Cực Quay a lạ i
từ trước đến nay vào tháng 9 năm 2000. 9
- Fluorine(có nghĩa là "Sự hủy diệt") dược sĩ kiêm nhà hóa học người Pháp F
Henri Moissan mới được cô lập năm 1886. Fluorine là một halogen và là Fluorine
nguyên tố phi kim có tính oxi hóa mạnh nhất. 19 - Hóa trị: I.
NTK: F= 19đvC PTK: F = 38đvC 2
I. TCVL: Chất khí, màu lục nhạt, rất độc, phản ứng mãnh liệt với nước,
gây bỏng nặng khi tiếp xúc trực tiếp. t = -220oC, t = -188oC. nc s
II. TCHH (F có tính oxi hóa và hoạt động hóa học mạnh nhất trong tất cả các nguyên tố) 2 Hình ảnh phản ánh bản
F tác dụng được với tất cả kim loại và hầu hết các phi kim(trừ O và N ) 2 2 2
chất phản ứng mãnh liệt
1. F tác dụng với H → HF F + H 2HF (nổ mạn h) 2 2 2 2 của nguyên tố
2. F tác dụng với H O → ...... 2F + 2H O 4HF + O 2 2 2 2 2 o t
3. F tác dụng với kim loại → Muối 4F + 2Au 2AuF o 2 2 3t
2F + 2NaOH 2NaF + H O + OF 4F + 2Fe 2FeF 2 2 2 2 3 III. Ứng dụng:
- Fluorine được sử dụng trong sản xuất các chất dẻo ma sát thấp như Teflon.
- Hydrofluoric acid(HF) được sử dụng để khắc kính, thủy tinh vô cơ.
- NaF làm thuốc chữa sâu răng. video
- F dùng để làm giàu 235U trong sản xuất nhiên liệu hạt nhân. 2
- Hợp chất Freon-CFC (CF Cl ) là nguyên nhân chính phá hủy tầng Ozone của Trái đất. 2 2
IV. Điều chế: Trong CN: điện phân hỗn hợp KF + 2HF (nóng chảy ở 70°C) 2KF 2K
ñi e+än p hFaân 2 10
- Neon được nhà hóa học người Scotland William Ramsay và nhà hóa học Ne
người Anh Morris William Travers phát hiện vào năm 1898. Tên của Ne
Neon bắt nguồn từ neos, có nghĩa là ‘mới’. 20
- Hóa trị: - NTK: Ne = 20đvC PTK: -
I. TCVL: Chất khí, không màu, không mùi, không tan trong nước, t = -249oC, t = -246oC nc s II. TCHH
Hình ảnh của Las Vegas và
- Neon thuộc nhóm VIIIA: khí hiếm, khí trơ thường tồn tại ở dạng đơn nguyên tử.
biểu tượng 'đô la' bằng đèn
- Trong thực tế Neon nói riêng và các nguyên tố nhóm VIIIA nói chung rất khó tham gia các phản ứng n h e óa học on phả nên n á chúng nh vi k ệc há s trơ về m ử dụng ặt hóa học. III. Ứng dụng
khí đốt trong ánh sáng đèn
- Neon được dùng trong đè n n e khí, đ on để èn c quảhỉ thị ng c áđiệ
o. n thế cao, thiết bị chống
sét. (Chất khí neon đựng trong một lọ borosilicate. Dây đồng mạ bạc quấn bên
ngoài cho dòng điện đi qua chất khí, làm cho nó phát sáng – đây là nguyên lí làm
việc của bóng đèn neon)
- Neon lỏng được sử dụng trong công nghiệp như một chất làm lạnh nhiệt
độ cực thấp có tính kinh tế.
- Neon và Helium được sử dụng để tạo ra các loại laser khí. IV. Điều chế
- Neon được sản xuất từ không khí siêu lạnh trong chưng cất từng phần từ không khí lỏng. 11
- Sodium (Natri) được nhà hóa học, vật lí học người Anh Humphry Davy cô lập
Na lần đầu tiên năm 1807. Hợp chất phổ biến nhất là Sodium chloride - NaCl là
Sodium nguyên nhân chính tạo nên vị mặn của nước biển. 23 - Hóa trị: I
NTK: Na = 23đvC PTK: - Hãy Click vào
I. TCVL: Chất rắn, màu trắng bạc, mềm, tan(pư) trong nước, biểu tượng
t = 98oC, t = 883oC, d = 0,97 g/cm3. Nguyên tố nc s I I. T C H H (Đốt Hai cháy hợp chất
đường tr của Sodi ong một um cho vòng tngọn lửa ròn đạimàu v àng) để biết ý nghĩa 1. Na tác dụng v di ớ ệ i O n c → O ho S xid odi e um, và là 4 m Na ột t + O rong → 2Na O 2 2 2 2. Na tác dụng vớ nhữ i phi kim ng biể (k u t hác O ) ượng nguyên tố được
2 → Muối 2Na + Cl → 2NaCl 2 3. Na tác dụn J g với n ohn D ư
al ớtc → dd on phá B t a
t srieể +n Hv ↑ à 2 o t Na hế + 2H O
kỷ 19. → 2NaOH + H ↑ 2 2 2
Ánh sáng màu cam giống như màu
4. Na tác dụng với dd Acid → Muối + H ↑ 2Na + 2HCl → 2NaCl + H ↑ 2 2
của ánh sáng đường phố Sodium và
5. Na tác dụng với dd Muối → Base + Muối + H ↑ 2
biểu tượng 'đèn flash' có gai phản
2Na + CuSO + 2H O → Cu(OH) ↓ + Na SO + H ↑ 4 2 2 2 4 2 III. Ứng dụng: Sod á ium là t nh khả hành nă phần qua ng phản n ứ trọng ng c t a ron o cg tổn
ủa g hợp hữu cơ, vô cơ.
- Đèn đường thường sử dụng là đèn hơ nguyê i S n todi
ố. um, phát ra ánh sáng đặc trưng màu vàng.
- Sodium chloride được sử dụng rộng rãi để chống, khử đóng băng và làm chất bảo quản.
- Sodium và Potassium làm chất trao đổi nhiệt trong lò phản ứng hạt nhân.
IV. Điều chế: Điện phân nóng chảy hợp chất của Na. 2NaCl
d p n c 2 Na + Cl ↑ video 2 12
- Magnesium được nhà hóa học người Scotland Joseph Black tìm thấy vào
Mg năm 1755. Mg là nguyên tố quan trọng cho cả thực vật và động vật. Tên
Magnesium nguyên tố có nguồn gốc từ Magnesia, một Quận ở Hy Lạp. 24
- Hóa trị: II NTK: Mg = 24đvC PTK: -
I. TCVL: Chất rắn, màu trắng xám, cứng, giòn, nhẹ,
không tan trong nước, t = 650oC, t = 1091oC, d = 1,74 g/cm3. nc s II. TCHH
Hình ảnh được lấy cảm hứng
1. Mg tác dụng với O từ → O chất xide diệp lục, phân t ử 2 có Mg + O o t 2MgO 2 2 trong cây xanh giúp chúng o t
2. Mg tác dụng với phi kim(khác O ) → Muối Mg + Cl MgCl 2 2 2 quang o t
hợp. Chất diệp lục chứa o t Mg + N Mg N Mg + CO MgO + C 2 3 2 2 o
một nguyên tử Magnesium ở t
3. Mg tác dụng với nước → dd Base + H ↑ Mg + 2H O Mg(OH) + H ↑ 2 2 2 2 trung tâm của nó.
4. Mg tác dụng với dd Acid → Muối + H ↑ Mg + 2HCl MgCl + H ↑ 2 2 2
5. Mg tác dụng với dd Muối(sau Mg) → Muối + Kim loại ↓ 2Mg + CuSO → MgSO + Cu↓ 4 4
III. Ứng dụng: Thành phần chính của chất diệp lục(chlorophyll)
- Chế tạo hợp kim cứng, nhẹ, bền... được sử dụng rộng rãi trong nhiều lĩnh vực.
- Sử dụng trong tổng hợp hữu cơ (cơ Magnesium).
- Sử dụng trong đèn flash trong nhiếp ảnh, pháo hoa, bom cháy.
IV. Điều chế: Điện phân nóng chảy muối Magnesium chloride. MgCl Mg +d C pn lc ↑ 2 2 13
- Aluminium(Nhôm) đã được biết đến trong thời tiền sử. Năm 1825, nhà vật lý, Al
hóa học Đan Mạch, Hans Christian Oersted đã cô lập được Aluminium không
Aluminium tinh khiết. Al là nguyên tố phổ biến thứ 3(sau O và Si) và là kim loại phổ biến 27
nhất trong vỏ Trái Đất.
- Hóa trị: III NTK: Al = 27đvC PTK: -
I. TCVL: Chất rắn, màu trắng bạc, mềm, nhẹ, dẫn điện,
dẫn nhiệt tốt. Aluminium thường được bao phủ bởi lớp Oxide bền vững với
môi trường, không tan trong nước. t = Th 6 â 6 n0o C m, t á = 25 y ba 19oC y và, d = lá 2,7 g/cm3. nc s
II. TCHH (Al là kim loại có Oxide và Hydroxide lưỡng tính) Aluminium chỉ là hai trong
1. Al tác dụng với O → Oxide 4Al + 3O o 2 t A l O
2 số rất nhiều cách s 2 ử dụng đa 2 3 o
2. Al tác dụng với phi kim(kh dạ ác O ng c )
ủa → ng M uy u ê ố ni t ố 2 n A à l y + 3Cl t 2AlCl 2 2 3
3. Al tác dụng với Acid → Muối + H ↑ 2Al + 6HCl 2AlCl + 3H ↑ 2 3 2
4. Al tác dụng với dd kiềm → Muối(Aluminate) + H ↑ 2
2Al + 2H O + 2NaOH 2NaAlO + H ↑ 2 2 2
5. Al tác dụng với dd Muối(sau Al) → Muối + Kim loại ↓ 2Al + 3CuSO Al (SO ) + 3Cu↓ 4 2 4 3
6. Al tác dụng với Oxide kim loạo t
i(sau Al) → Al O + Kim loại ↓ (pư nhiệt nhôm) 2 3 2Al + Fe O Al O + 2Fe↓ 2 3 2 3 Tiếp t h t eo
III. Ứng dụng: Tính theo cả số lượng lẫn giá trị, việc sử dụng Aluminium vượt tất cả các
kim loại khác(trừ Iron) và đóng vai trò quan trọng trong nền kinh tế thế giới.
- Aluminium và hợp kim Aluminium cứng, nhẹ, bền. .được sử dụng rộng rãi trong nhiều lĩnh vực. -
Sử dụng trong đóng gói thực phẩm(giấy bạc), dụng cụ nhà bếp. -
Sử dụng làm dây tải điện. -
Xử lí nước(phèn chua K SO .Al (SO ) .24H O). 2 4 2 4 3 2 -
Hỗn hợp Thermite(bột Al và Fe O ) được dùng để hàn đường ray. 2 3 -
Điều chế một số kim loại khó nóng chảy như: Cr, Ni, Mo...
IV. Điều chế: Điện phân nóng chảy Al O (từ quặng bauxite Al O .2H O). 2 3 2 3 2 2Al O 2A d lp + nc 3 O ↑ 2 3 2
V. Một số hợp kim của Aluminium -
Hợp kim Đuyra: Al – Cu – Mg ..... dùng để chế tạo máy bay, ôtô... -
Hợp kim Silumin: Al – Si dùng để đúc các bộ phận máy móc... -
Hợp kim Amelec: Al – Mg – Fe ... dùng để chế tạo dây dẫn đi n ệ cao thế. -
Hợp kim Electron: Mg – Al – Mn . .. dùng làm vỏ tên lửa, tàu vũ trụ, v ệ tinh nhân tạo,.. -
Khoáng vật của Aluminium: Ruby, sapphire, coridon, phèn chua ... video Quay a lạ i 14
- Silicon‘đá lửa’ được nhà hóa học Thụy Điển Jöns Jacob Berzelius phát Si
hiện vào năm 1824, là nguyên tố phổ biến thứ 2 trong vỏ Trái Đất. Khu Silicon
vực công nghệ cao ở California được đặt tên là Silicon Valley (Thung 28
lũng Silicon) được đặt tên theo nguyên tố Si.
- Hóa trị: IV NTK: Si = 28đvC PTK: -
I. TCVL: Chất rắn, màu xám sẫm ánh kim, không tan trong nước,
là chất bán dẫn. t = 1414oC, t = 3265oC, d = 2,57 g/cm3. nc s II. TCHH
Hình ảnh dựa trên một loại
1. Si tác dụng với O → O tảxid
o ceát. Tảo cá t 2 l S à i l + oạiO t ả → o 2SiO 2 2 2 o t
2. Si tác dụng với phi kim(
quaknhác O ) → h g hợp. Ch ợp ún c g h đ ấặt c biSệi t + ở 2F o S iF 2 2 t 4
3. Si tác dụng với kim loạ c i→ M hỗ t u hà ối nh tế bà Si o c + ủa c 2Mg húng Mg S i 2
4. Si tác dụng với dd kiềm → M được u lốài + m H bằng S ilicon 2 Si + NaOH + H( O Si l→ ic Na S on di iO oxi + H de 2 2 3 2
III. Ứng dụng: Silicon cực kỳ cần thiết trong nhi ngậều m ngành nước c ).ông nghiệp
- Sản xuất vật liệu bán dẫn sử dụng trong vô tuyến, điện tử, pin mặt trời, ...
- Công nghiệp Silicate(hợp chất Silicon) bao gồm: Thủy tinh, Đồ gốm và Xi măng.
- Hợp kim Al-Si hoặc Fe-Si (Ferrosilicon) được sử dụng để chế tạo máy phát điện và
tấm biến áp, khối động cơ, đầu xi lanh và máy công cụ
IV. Điều chế: (nguyên liệu chính o
là cát mịn thạch anh SiO ) t 2
- Trong PTN: SiO + Mg ot MgO + Si 2
- Trong CN: SiO + C CO + Si 2 15
- Phosphorus‘ánh sáng’ được cô lập bởi một bác sĩ và nhà giả kim người P
Đức Hennig Brand vào năm 1669, được mệnh danh là ‘nguyên tố của sự
Phosphorus sống và tư duy’. Phosphorus có hai dạng thù hình chính quan trọng là 31
Phosphorus đỏ và Phosphorus trắng.
- Hóa trị: III, V NTK: P = 31đvC
I. TCVL: Chất rắn, ‘trắng sáp, ngả vàng, đỏ tươi, đen...’’,
Hình ảnh là mô hình phân tử P
không tan trong nước, độc, gây bỏng khi tiếp xúc. P hút ẩm mạnh, trắng đỏ hình cầu và que của dễ chảy rữa. d = 1,82 g/cm3, d = 2,34 g/cm3. trắng đỏ II. TCHH Phosphorus trắng. Nó có o
1. P tác dụng với O → Oxide 4P + 5O 2P O t 2 2 2 5
một hình tứ diện và có công o t
2. P tác dụng với phi kim(khác O ) → hợp chất 2P + 5Cl P C l 2 2 o 5 thức P . t
3. P tác dụng với kim loại→ Muối 2P + 4 3Ca Ca P 3 2
4. P tác dụng với hợ o t
p chất(oxh mạnh) → .... o t
3P + 5KClO 3P O + 5KCl 2P + 5H SO 2H PO + 5SO + H O 3 2 5 2 4(đặc) 3 4 2 2 III. Ứng dụng:
- Sản xuất H PO , diêm, bom, đạn cháy, đạn khói.... 3 4
- Quặng chứa P được sản xuất thành phân bón(phân lân) cho nông nghiệp.
- P đóng một vai trò quan trọng trong các phân tử sinh học như ADN và ARN.
IV. Điều chế: (nung quặng Phosphorite, cát và than cốc trong lò điện) o
- Trong CN: Ca (PO ) + 3SiO + 5C t 3CaSiO + 2P + 5CO 3 4 2 2 3 15
- Sulfur(lưu huỳnh) được biết đến từ thời tiền sử. Năm 1809, các nhà hóa S
học người Pháp Louis-Joseph Gay-Lussac và Louis-Jacques Thenard đã Sulfur
chứng minh tính chất nguyên tố của Sulfur. 31
- Hóa trị: II, IV, VI NTK: S = 32đvC
I. TCVL: Chất rắn, vàng chanh, không mùi, không tan trong
nước. t = 115oC, t = 445oC, d = 2,07 g/cm3. nc s II. TCHH Biểu tượng giả kim cho o t
1. S tác dụng với O → S O ul xid f e
ur được hi ể S n t+ hị O t rê n 2SO 2 2 2 o t
2. S tác dụng với phi kim nề (kh n 'lác ửaO ) và → dihêợp m c s h i ất nh'. S + 3F o SF 2 2 6 t
3. S tác dụng với kim loại → Muối 3S + 2Al Al S 2 3
(S tác dụng với Hg ở điều kiện thường→ xử lí Hg) S + Hg o t HgS
4. S tác dụng với H → H S(có mùi trứng thối) S + H H S 2 2 2 2
5. S tác dụng với o
t hợp chất(oxh mạnh) → .... o t
S + 6HNO H SO + 6NO + 2H O S + 2H SO 3SO + 2H O 3 2 4 2 2 2 4(đặc) 2 2
III. Ứng dụng: Sulfur có nhiều ứng dụng công nghiệp.
- 10% lượng S sản xuất được dùng để lưu hóa cao su, chế tạo diêm, tẩy trắng bột
giấy, chất dẻo, dược phẩm, thuốc bảo vệ thực vật....
- 90% lượng S sản xuất được dùng để điều chế H SO . 2 4
IV. Điều chế: (từ mỏ Sulfur hoặc từ các hợp chất chứa Sulfur)
H S + O → S + H O H S + SO → S + H O (thu hồi 90% khí thải độc) 2 2 2 2 2 2 17
- Chlorine được phát hiện bởi dược sĩ và nhà hóa học người Thụy Điển Cl
Carl-Wilhelm Scheele vào năm 1774. Tên nguyên tố có nguồn gốc từ tiếng
Chlorine Hy Lạp 'chloros' có nghĩa là màu vàng lục.
35,5 - Hóa trị: I,... NTK: Cl= 35,5đvC PTK: Cl = 71đvC 2
I. TCVL: Chất khí, màu vàng lục, phản ứng và tan vừa phải trong nước,
rất độc, nó phá hoại niêm mạc đường hô hấp. t = -105oC, t = -34oC. nc s
II. TCHH (Cl là phi kim Bi c ể ó tí u t nh ượ oxi hóa ng ch và o t ho hấạt y đ ộ mng ột hóa mặhọc t mạnh) 2
1. Cl tác dụng với H
nạ → HCl (1:1 phòng độc nổ . Đ m iề ạnh) u nà y lC à l + do H as 2HCl 2 2 2 2
2. Cl tác dụng với H C O hl → ori .... ne .. là một l oại Cl khí+ H O độc H C l + HClO 2 2 2 2 (nước Chlorine có m và à và đã ng đưnh ợ ạ c t s là ử h d ỗn ụn h g ợ lp: à H m Cl, H vũ ClO, Cl , oH O) 2 t 2
3. Cl tác dụng với kim khí loại hóa → M học. uối Chl ori ne3C c ló + m 2 àuF e 2FeCl 2 2 3
4. Cl tác dụng với hợp c vàhnất g → l ... ục .. , như hì n h ảnh. 2
Cl + Ca(OH) CaOCl + H O (CaOCl là Calcium oxychloride) 2 2 2 2 2 Cl + 2NaOH o t N aCl + NaClO + H O
(Hỗn hợp NaCl, NaClO, H O là nước Ja-ven) 2 2 2 3Cl + 6NaOH 5NaCl + NaClO + 3H O 2 3 2 Cl + 2NaBr 2 NaCl + Br Cl + 2NaI 2NaC l + I 2 2 2 2 3Cl + 2FeCl 2FeCl 3Cl + 2CrCl 2CrCl 2 2 3 2 2 3 video Tiếp T Th eo Th
♪ Hữu cơ Cl + CH as CH Cl + HCl 2 4 3 Cl + CH =CH CH Cl-CH Cl 2 2 2 2 2 o Cl + CH =CH 5 0 0 C CH =CHCl + HCl 2 2 2 2
Cl + CH≡CH CHCl -CHCl (CH =CHCl dùng để sản xuất P.V.C) 2 2 2 o 2 450 C
Cl + CH =CHCH CH =CHCH Cl + HCl 2 2 3 2 2
III. Ứng dụng: Nguyên liệu sản xuất nhiều hợp chất vô cơ và hữu cơ với nhiều ứng dụng.
- Chlorine là một hóa chất quan trọng làm tinh khiết nước, trong việc khử trùng hay tẩy trắng.
- Sản xuất các muối Chlorate, Chloroform, Carbon tetrachloride, chất dẻo, chất màu...
- Sử dụng trong sản xuất Bromite(Br ) và Iodine(I ). 2 2
IV. Điều chế: Trong PTN: HCl đặc tác dụng với chất oxi hóa mạnh(KMnO , KClO , MnO ) 4 3 2 o t 4HCl + MnO MnCl + C l + 2H O 2 2 2 2 o t 16HCl + 2KMnO 2KCl + 2 Mn Cl + 5Cl + 8H O 4 o 2 2 2 t
14HCl + K Cr O 2KCl + 2CrCl + 3Cl + 8H O 2 2 7 ñieänphaân 3 2 2
- Trong CN: 2NaCl + 2H O c o ù m a øn g n g a2 ên NaOH + H + Cl 2 2 2 Qua u y a lạ i 18
- Argon"lười" được nhà hóa học người Scotland William Ramsay và nhà Ar
vật lý người Anh John William Strutt (Baron Rayleigh) phát hiện năm
Argon 1894. Tên bắt nguồn từ argos (Hy Lạp) có nghĩa là "lười biếng"Click vào 39,9
- Hóa trị: - NTK: Ar = 39,9đvC biểu tượng
I. TCVL: Chất khí, không màu, không mùi, không Nguyên tố
tan trong nước, t = -189oC, t = -186oC nc s để biết ý nghĩa II. TCHH
Hình ảnh phản ánh việc sử
- Argon thuộc nhóm VIIIA: khí hiếm, kh dụng nguyê í tr n t ơ ố t trhường tồ ong ngàn tại
nh ở dạng đơn nguyên tử. - Trong thực tế Argon nó hà i n.r iên Arg và các gon c nguy ung c ê ấ n tố p m ộnthó mm ôi V IIIA nói chung rất khó
tham gia các phản ứng hóa học nên chúng khá trơ về mặt hóa học.
trường không khí trơ trong đó III. Ứng dụng
các kim loại hàn sẽ không bị
- Sử dụng trong các loại đèn điện, đèn plasma do nó không phản ứng với dây tóc trong oxy hóa.
bóng đèn ngay cả ở nhiệt độ cao.
- Các thiết bị phẫu thuật lạnh chẳng hạn như sự cắt bỏ lạnh sử dụng argon lỏng để tiêu diệt các tế bào ung thư.
- Argon được sử dụng như là môi trường khí trơ trong nhiều công nghệ hàn kim loại hoặc
nuôi cấy các tinh thể Silicon và Germanium trong công nghiệp sản xuất chất bán dẫn.
IV. Điều chế: Argon được sản xuất từ chưng cất phân đoạn không khí lỏng. John h n W i W lliam S trutt u ? John Joh n W i W lliam Str S ut u t? John h Wi W lillila i m Strut u t, Nam tước ớ Rayle l ig i h h đệ tam (12/1 / 1 1 /1 / 982 - 30/0 / 6/1919) là à một n t hà vật t lý l người ờ Anh cùng với iWi W lillilam a Ra R m a say sa đã phát t hiệ i n ra nguyên ê tố Arg r on. Ông cũng là l người ờ đã phát thiệ i n ra a hiện ệ tư t ợn ợ g gọi ilà l Tán á xạ Ray a lei e gh và dự đoán sự tồ t n tạ t i icủ c a sóng bề mặt tđược ợ biế bi t tđến là l Sóng Ray a lei e gh. Với i những cống hiế i n to t lớ l n của mìn ì h cho nhân lo l ại, i Ông nhận ậ được Huy chương Mattte t ucci c (1894); ;Giả i i iNobel e vật ậ lý (1904) và nhiề hi u giả i i ith t ưởn ở g cao a quý khác. 19
- Potassium ‘Ka li’ được nhà hóa học người Anh Humphry Davy cô lập lần đầu K
tiên vào năm 1807. Tên có nguồn gốc từ tiếng Anh ‘potash’ nghĩa là tro bếp.
Potassium Hóa trị: I NTK: K = 39đvC 39
I. TCVL: Chất rắn, màu trắng bạc, mềm, tan(pư) trong
nước, t = 63oC, t = 759oC, d = 0,86 g/cm3. nc s
Hình ảnh có biểu tượng
(Đốt cháy hợp chất của Potassium cho ngọn lửa màu tím) giả kim thuật cho
II. TCHH (K là nguyên tố kim loại hoạt động hóa học mạnh ) Potassium, từ đó
1. K tác dụng với O → Oxide 4K + O → 2K O 2 2 2
nguyên tố này lần đầu
2. K tác dụng với phi kim(khác O ) → Muối 2K + Cl → 2KCl 2 2 tiên được phân lập.
3. K tác dụng với nước → dd Base + H ↑
2K + 2H O → 2KOH + H ↑ 2 2 2
4. K tác dụng với dd Acid → Muối + H ↑
2K + 2HCl → 2KCl + H ↑ 2 2
5. K tác dụng với dd Muối → Base + Muối + H ↑ 2
6K + 2FeCl + 6H O → 2Fe(OH) ↓ + 6KCl + 3H ↑ 3 2 3 2
III. Ứng dụng: (Hợp chất của Potassium là thành phần thiết yếu trong dinh dưỡng động, thực vật.)
- Khoảng 95% lượng Potassium được dùng làm phân bón: KCl, KNO , K SO ... 3 2 4
IV. Điều chế: Điện phân nóng chảy hợp chất của K. 2KCl 2 dpK nc + C l ↑ 2 Hum u ph p r h y Davy y D ? Hum u ph p r h y Davy y D ? Hum u phr
h y Davy (Đệ nh
n ất t Nam tướ
ư c) (17/12/1778 - 29/05/1 / 929) là l một n t hà hóa a học và à nhà phát á min
i h người iAnh, người iđã phát tmin
i h ra đèn Davy và một tdạng rất tsớm
sớ của đèn hồ quang . Ông là à người iđầu titên ê bằng các á h sử dụng dòng điệ đi n (điệ i n phân) cô lập ậ được ợ các á nguyên ê tố t : Potassi a u ssi m, Sodium i , Cal a ci c um, Str t ontitu i m, Ba B rium, Magnesiu si m, Bo B ron. Ông trở ở nên nổi ititế i ng nhờ ờ các th t ực nghiệ i m của ông về các c phản ứng sin si h lý l của một s t ố ch c ất tkhí, trong đó có c cả “k “ hí ícư c ời” Ni N tir t o r us oxid i e – N O. 2O 2 Ông nhận được ợ Huân â chươn ơ g Co C ple l y (1805), Giải ả Vol V t ol a( a 1807), Huân chươn ơ g Ru
R mford (1816), Huân chương Hoàn à g gia i (1827). 20
- Calcium được nhà hóa học người Anh Humphry Davy cô lập lần đầu tiên Ca
Calcium vào năm 1808. Tên nguyên tố có nguồn gốc Latinh 'calx' có nghĩa là vôi. 40
- Hóa trị: II NTK: Ca = 40đvC Click vào
I. TCVL: Chất rắn, màu xám bạc, mềm, tan(pư) biểu tượng
trong nước, t = 842oC, t = 1484oC, d = 1,55 g/cm3. Nguyên tố nc s để biết ý nghĩa
II. TCHH (Ca là nguyên tố kim loại hoạt động hóa học mạnh ) Vỏ và xương xoắn ốc
1. Ca tác dụng với O → Oxide 2Ca + O → 2CaO 2 2
phản ánh sự hiện diện
2. Ca tác dụng với phi kim(khác O ) → Muối Ca + Cl → CaCl 2 2 2 thiết yếu của Calcium
3. Ca tác dụng với nước → dd Base + H ↑ Ca + 2H O → Ca(OH) + H ↑ 2 2 2 2 trong mọi sinh vật.
4. Ca tác dụng với dd Acid → Muối + H ↑ Ca + 2HCl → CaCl + H ↑ 2 2 2
5. Ca tác dụng với dd Muối → Base + Muối + H ↑ 2
3Ca + 2FeCl + 6H O → 2Fe(OH) ↓ + 3CaCl + 3H ↑ 3 2 3 2 2
III. Ứng dụng: (Calcium là một thành phần quan trọng của khẩu phần dinh dưỡng.
Vitamin D là cần thiết để cơ thể hấp thụ Calcium tốt hơn)
- Hợp chất của Ca được sử dụng trong sản xuất xi măng hay vữa xây sử dụng rộng rãi
trong xây dựng và trong nông nghiệp,... Thạch cao nung CaSO .H O thường được 4 2
dùng để bó bột xương gãy, đúc tượng, …
IV. Điều chế: Điện phân nóng chảy hợp chất của Ca. CaCl C dp a nc + C l ↑ 2 2 21
- Scandium được phát hiện bởi nhà hóa học Thụy Điển Lars-Fredrik Sc
Nilson vào năm 1879. Tên bắt nguồn từ 'Scandia', tên tiếng Latinh của Scandium
Scandinavia nơi tìm thấy khoáng sản. 45 - Hóa trị: III,...
NTK: Sc = 45đvC
I. TCVL: Chất rắn, màu trắng bạc, khi phơi trong không khí chuyển
sang màu vàng hoặc hồng nhạt, không tan trong nước.
Tên của nguyên tố có nguồn
t =1541oC, t = 2836oC, d = 2,99 g/cm3. nc s gốc từ tên Latinh của II. TCHH
Scandinavia. Hình ảnh phản
- Sc là một kim loại hoạt động TB- yếu, tương đối trơ về mặt hóa học.
ánh điều này với một bức
- Sc có thể tác dụng với Oxygen, các phi kim và dung dịch Acid. III. Ứng dụng tượng nhỏ của người
- Ứng dụng chính theo k Sc haối lư ndi ợn na g l vi à a c c ác hợ ổ đạ p i ki vàm Al- nhữ Sc ng
cho công nghiệp tàu vũ trụ vi v ê à các n đá thiế khắt cbị c th h ể thao ữ Runic.
(xe đạp, gậy bóng chày v.v.)
- Scandium Iotua được thêm vào các đèn hơi Mercury để tạo ra nguồn ánh sáng
nhân tạo hiệu suất cao tương tự như ánh sáng mặt trời.
- Đồng vị Sc-46 được sử dụng như một chất đánh dấu trong quá trình dò dấu vết.
IV. Điều chế: Scandium tinh khiết được sản xuất thương mại bằng
cách khử Scandium Fluoride bởi Calcium kim loại. o 3Ca + 2ScCl 3 tCaC l + 2Sc 3 2 22
- Titanium được phát hiện bởi giáo sĩ người Anh William Gregor trong Ti
khoáng vật (FeTiO ) vào năm 1791. Tên có nguồn gốc từ các Titan, con 3 Titanium
trai của nữ thần Gaia trong thần thoại Hy Lạp. 48
- Hóa trị: III, IV.... NTK: Ti = 48đvC
I. TCVL: Chất rắn, màu bạc xám-trắng bạc, cứng, bề mặt láng bóng
và chống ăn mòn tốt(như Platinum).
Biểu tượng là đại diện cho
t =1668oC, t = 3287oC, d = 4,11 g/cm3. nc s các Titanium trong thần II. TCHH
- Titanium là một kim loạit hoạ hoạ ti độn H g y Ltrạung p, s baìn u h - khiy ếu, có lớp
màng oxide bền vững nên tươn nguyê g đ n t ối trơ v ố đượcề m đặặtt h têóa học n. N . ó III. Ứng dụng
dựa trên những bức tượng
- Khoảng 95% lượng Titanium được nhỏ t dùng r ở dạ ong đề ng n t Tit hờ an
. ium dioxide (TiO ) như: 2
Sơn, nhựa, giấy, kem chống nắng, xi măng, đá quý, ....
- Hợp kim Titanium được dùng chủ yếu trong hàng không, xe bọc thép, tàu hải
quân, tàu vũ trụ và tên lửa, áo chống đạn, laptop, đồ trang sức....
- Dùng để sản xuất các loại đá quý nhân tạo. video id
- Sử dụng làm các khớp giả, các dụng cụ y tế và các dụng cụ chế biến thực phẩm.
IV. Điều chế: Titanium được sản xuất thương mại bằng cách khử TiCl với Mg. 4 o 2Mg + TiCl t2M gCl + Ti 4 2 23
- Vanadium được phát hiện bởi bác sĩ và nhà hóa học người Thụy Điển V
Nils-Gabriel Sefström vào năm 1830. Nguyên tố được đặt theo tên “ nữ
Vanadium thần sắc đẹp Freyja(Vanadís)" trong thần thoại Bắc Âu. 51
- Hóa trị: III, V .... NTK: V = 51đvC PTK: -
I. TCVL: Chất rắn, màu bạc-xám bạc, mềm, chống ăn mòn tốt (như
Platinum), bền với dung dịch kiềm và Acid thông thường. t =1910oC, t = 3689o Bi C ể , u td = 6,0 g/cm3
ượng được . dựa trên một bức nc s II. TCHH
tượng nhỏ của nữ thần Scandinavia - Vanadium là một k Fim re l y ojạ a i ho và ạt đ o t ộ h n ế g TB kỷ t - yếu, tương đố hứ 8, người i m tr à ơ về mặt hóa học.
III. Ứng dụng sau đó nguyên tố được đặt tên. Nó
- Khoảng 80% Vanadium được sản xuất được sử dụng làm phụ gia thép.
được thiết lập dựa trên một văn
Thép Vanadium làm giảm trọng lượng và tăng độ bền kéo.
bản từ một câu chuyện của Iceland
- Hợp chất thương mại quan trọng nhất là V O được dùng làm chất 2 5
được viết vào thế kỷ 13.
xúc tác trong sản xuất Sulfuric Acid (H SO ), tạo màu cho gốm, thủy tính 2 4
và sản xuất nam châm siêu dẫn. Muối của Vanadium +2 (màu tím), +3 (lục), +4 (lam), +5 (vàng). IV. Điều chế:
Vanadium nguyên chất được tạo ra bằng cách khử V O , VCl với Ca, Mg... 2 5 3 5Ca + V O 5o t C a O + 5V 2 5 24
- Chromium được phát hiện vào năm 1797 bởi nhà hóa học và dược sĩ
Cr người Pháp Nicolas-Louis Vauquelin và cô lập vào năm 1798. Tên bắt
nguồn từ tiếng Hy Lạp chroma có nghĩa là "màu sắc" Chromium 52
- Hóa trị: II, III, VI NTK: Cr = 52đvC
I. TCVL: Chất rắn, ánh bạc, cứng(KL cứng nhất), có lớp Oxide bảo vệ,
chống ăn mòn tốt. t =1907oC, t = 2671oC, d = 7,19 g/cm3. nc s
II. TCHH (Cr là kim loại có Oxide Hì(InII) và h ả Hydro nh phảxide n á (III) lư nh bảỡng n tính) ot
1. Cr tác dụng với O → Oxide ch ất đ ộc 4 hại Cr c + ủa 3O ki m l o ạ i 2Cr O 2 2 2 3 o t
2. Cr tác dụng với phi kim(khác và O
‘á ) → Muối nh kim' c 2 ủa Cr + 3C nó khi l 2C rCl 2 2 3
3. Cr tác dụng với Acid → Muối + H ↑ được đ á Cr + nh bóng.2HCl C rC l + H ↑ 2 2 2
III. Ứng dụng (Chromium có nhiều ứng dụng thiết thực trong đời sống và sản xuất)
- Trong ngành luyện kim: Chế tạo thép không gỉ(inox), siêu cứng, mạ Chromium...
- Sản xuất thuốc nhuộm và sơn.
- Sử dụng trong sản xuất hồng ngọc(ruby) tổng hợp.
- Là chất xúc tác cho nhiều phản ứng. IV. Điều chế:
Sử dụng phản ứng nhiệt Aluminium với Cr O để điều chế Chromium 97-99% 2 3 o 2Al + Cr O Al O t + 2Cr 2 3 2 3 25
- Manganese được nhà hóa học người Thụy Điển Johan Gottlieb Gahn Mn
lần đầu tiên cô lập năm 1774. Tên gọi này bắt nguồn từ các magnes trong Manganese
tiếng Latinh có nghĩa là "nam châm“. 55
- Hóa trị: II, IV, VII... NTK: Mn = 55đvC Hãy Click vào
I. TCVL: Chất rắn, trắng xám, cứng, giòn, có từ tính khi xử lí biểu tượng
đặc biệt. t =1246oC, t = 2061oC, d = 7,21 g/cm3. nc s Nguyên tố
II. TCHH (Mn hoạt động tương đối mạnh, dễ bị oxi hóa)
Hình ảnh là một nam châm điện cổ để biết ý nghĩa o
1. Mn tác dụng với O → Oxide 2Mn + O 2M t nO v 2
à một con bò. Nam châm đi 2 ện là o t
2. Mn tác dụng với phi k do Mim a (khác ngane O se ) c→ Muối ó thể c M ó tê n + n t C ừ tli ế ng M nCl 2 2 2
3. Mn tác dụng với Acid L → ati M nhuối c + H ↑ ó nghĩ a l à na mM cn + hâ 2 mH. Cl M nCl + H ↑
III. Ứng dụng (Manganese có nhiều 2ứng dụng thiết thực trong đời sống v
2 à sả2n xuất)
Con bò phản ánh tầm quan trọng
- Mn có vai trò quan trọng trong sản xuất Iron thép vì có tác dụng khử S, khử O ,..., 2
của nguyên tố này như một thức ăn
hợp kim thép của Mn có độ bền cao, cứng và khả năng chống mài mòn sử dụng cho
đường ray xe lửa, két Iron, thù bổ s ng sú ung c ng trường và ho động vậ so t ă ng I n c ro ỏ. n nhà tù.
- Các hợp chất của Mn: KMnO , K MnO , MnO , Mn2+.... có nhiều ứng dụng. 4 2 4 2
- Hợp chất Mn được sử dụng để làm chất tạo màu và nhuộm màu cho gốm, thủy tinh và làm phân bón. IV. Điều chế:
- Manganese tinh khiết thu được bằng cách khử Oxide
Manganese với Na, Mg, Al hoặc bằng cách điện phân. 26
- Iron (sắt) đã được biết đến từ thời tiền sử. Ký hiệu Fe có nguồn gốc từ
Fe tiếng Latinh ferrum có nghĩa là "độ cứng". Iron
- Hóa trị: II, III. NTK: Fe = 56đvC 56
I. TCVL: Chất rắn, trắng xám, dẻo, có tính nhiễm từ.
t =1538oC, t = 2862oC, d = 7,9 g/cm3. nc s
Hình ảnh là biểu tượng giả
II. TCHH (Fe là kim loại hoạt động trung bình có nhiều hóa trị) kim cho Iron. Biểu tượng
1. Fe tác dụng với O → Oxide 3Fe + 2O 2o tF e O (FeO.Fe O ) 2 2 3 4 3 4
được hiển thị trên một tấm o
2. Fe tác dụng với phi kim(khác O ) → Muối 2Fe + 3Cl t 2FeCl 2 2 3 o t thép nhẹ bị gỉ. o t Fe + I Fe I Fe + S FeS 2 2
3. Fe tác dụng với Acid → Muối + H ↑ Fe + 2HCl FeCl + H ↑ 2 2 2 Fe + 2H SO FeSO + H ↑ 2 4(loãng) 4 2
4. Fe tác dụng với Acid H SOot
/ HNO → Muối + H O + ..... 2 4 đặc nóng 3 2 2Fe + 6H SO
Fe (SO ) + 3SO ↑ + 6H O 2 4(đặ c) 2 4 3 2 2
Fe + 4HNO Fe(N o O
t ) + NO ↑ + 2H O 3 3 3 2 Fe + 6HNO
Fe(NO ) + 3NO ↑ + 3H O Tiếp Tiếp th t eo 3 (đặc) 3 3 2 2
Al, Fe, Cr ... Không phản ứng với dd H SO , HNO đặc nguội. 2 4 3 5. Fe tác dụng với
dd muối → Muối *+ KL* Fe + CuSO FeCl + Cu↓ 4 2 Fe + 2FeCl 3FeCl Fe + 3AgNO Fe(NO ) + 3Ag↓ 3 2 3 (dư) 3 3
III. Ứng dụng: Iron là kim loại quan trọng nhất, được sử dụng nhiều nhất, chiếm
khoảng 90% tổng khối lượng kim loại sản xuất trên toàn thế giới. Sự kết hợp của giá
thành thấp và các đặc tính tốt về chịu lực, độ dẻo, độ cứng làm cho nó trở thành không
thể thay thế được. Thép là hợp kim nổi tiếng nhất của Iron.
- Gang: hợp kim của Fe – C : Chứa 2% đến 5% khối lượng là Carbon.
- Thép: hợp kim của Fe – C : Chứa < 2% khối lượng là Carbon.
- Iron là nguyên tố vi lượng tham gia vào cấu tạo Hemoglobin của hồng cầu IV. Điều chế:
*Sản xuất Gang: Dùng CO(chất khử) khử Oxide Iron: 3CO + Fe O 2Fe +o t 3 CO 2 3 2
*Sản xuất Thép: Dùng O oxi hóa tạp chất trong gang trắng. o 2 t o t o t O + C CO
O + S SO O + Si SiO 2 2 2 2 2 2
V. Một số hợp kim và quặng của Iron. -
Hợp kim ferrosilicon: Fe – Si ..... Thép chịu Acid. -
Hợp kim inox: Fe – Ni – Cr .... Thép chống gỉ. -
Quặng hematite đỏ: Fe O (khan) - Quặng hematite nâu: Fe O .nH O 2 3 2 3 2 -
Quặng magnetite: Fe O (giàu Fe nhất) 3 4 -
Quặng pyrite: FeS . - Cementit: Fe C 2 3 - Quặng siderite: FeCO video Qua u y a lạ i 3 video 27
- Cobalt được phát hiện bởi nhà hóa học người Thụy Điển Georg Brandt Co
vào năm 1735. Tên có nguồn gốc từ tiếng Đức 'kobald', có nghĩa là yêu tinh.
Cobalt - Hóa trị: II, III. NTK: Co = 59đvC 59
I. TCVL: Chất rắn, trắng bạc, cứng, có từ tính.
t =1495oC, t = 2927oC, d = 8,9 g/cm3. nc s
II. TCHH (Có hoạt độ H ng ì tru nh ả ng bì nh c nh – ho t yế hấ u y có m nhiề ột c u hóa on yê tr u ị)
tinh hoặc 'kobold' (thường bị buộc III. Ứng dụng - Cobalt là thành p t h ộiần q khiua ế n t n crọ á n c gt tạo nê hợ m n ỏ ccác ủa lo Đ ại ứchợp đi kim, siêu hợp kim đặc biệt. Hợp kilm ạ ccủa Cobal đường t t được sử rong quá d tụrnìg tro nh tìng m tu k a i b ế in m phản lực và máy phát tuabin khí, nơ T i độ b n c ề ủan nhi họ) ệt đ . Ở ộ c p ao hí r a ấ s t a qua u l n à tr mọng ột . s ố
- Hợp kim Co-Al-Ni để tạo ra những nam châm đặc biệt mạnh mẽ.
đồ sứ Trung Quốc thời kỳ đầu, sử
- Chất xúc tác cho công nghiệp dầu khí và hóa chất.
dụng nguyên tố Cobalt để tạo cho
- Muối Co đã được sử dụng trong nhiều thế kỷ để tạo ra màu xanh lam rực nó lớp men màu xanh lam.
rỡ trong sơn, đồ sứ, thủy tinh, đồ gốm và đồ tráng men.
- Co-60 phóng xạ được sử dụng để điều trị ung thư và ở một số quốc gia.
Nó còn được dung để chiếu xạ bảo quản thực phẩm.
IV. Điều chế: Hầu hết Cobalt được hình thành như một sản phẩm phụ của
quá trình tinh chế Nickel. Phương pháp sản xuất tùy thuộc vào thành phần
các loại quặng. 2CoSO + 2H O ñi eän ph aân 2Co + O + 2H SO 4 2 2 2 4 28
- Nickel (kền) được phát hiện bởi nhà luyện kim người Thụy Điển Axel-
Ni Frederik Cronstedt vào năm 1751. Tên này bắt nguồn từ tiếng Đức Nickel Nickel
có nghĩa là "tinh thần nhỏ bé lừa dối”. 59
- Hóa trị: II, III. NTK: Ni = 59đvC
I. TCVL: Chất rắn, trắng bạc ánh vàng, cứng, dễ dát mỏng, dễ
kéo sợi, có từ tính. t =1455oC, t = 2913oC, d = 8,9 g/cm3. nc s II. TCHH
1. Ni tác dụng với O → Oxide 2Ni + O o t 2 NiO 2 2
Hình ảnh là những hạt đậu o
2. Ni tác dụng với phi kim(khác O ) → Muối Ni + Cl t NiCl 2
nướng, có chứa một lượng 2 2
3. Ni tác dụng với Acid → Muối + H ↑ Ni + 2HCl NiCl + H ↑ Nickel 2 đáng kinh ngạc. o 2 2 t
(Nickel dễ dàng pư với dd HNO
) Ni + 4HNO Ni(NO ) + NO + 2H O
III. Ứng dụng (phần lớn Ni đượ3c đặdùng
c, nóng để chế tạo hợp ki3 m đ chống ăn mòn 3 2 , chịu nhi 2 ệt... ) 2
- Trong ngành luyện kim: Thép không gỉ và các hợp kim chống ăn mòn... Ni có thể được
mạ điện (mạ kền) lên các kim loại khác để tạo thành một lớp phủ bảo vệ.
- Hợp kim Inva: Ni – Fe không giãn nở theo nhiệt độ, dùng trong kĩ thuật vô tuyến.
- Nickel được sử dụng trong pin, bao gồm pin Ni-Cd có thể sạc lại và pin Nickel Metal
Hydride (NiMH) được sử dụng trong xe hybrid. -
Nickel được phân chia mịn được sử dụng làm chất xúc tác để hydro hóa các
chất hữu cơ. Thêm Nickel vào thủy tinh làm cho nó có màu xanh lục.
IV. Điều chế: Nickel được sản xuất từ quặng chứa oxide, hydroxide,
sulfide của Ni bằng phương pháp nhiệt luyện hoặc thủy luyện. 29
- Cuper (Đồng) đã được biết đến từ thời tiền sử. Tên gọi này bắt nguồn từ tiếng
Cu Latin cuprum của Cyprus, hòn đảo nơi người La Mã đầu tiên lấy được cupper.
Cupper - Hóa trị: I, II. NTK: Cu = 64đvC 64
I. TCVL: Chất rắn, đỏ cam, dẻo, dẫn điện và nhiệt
tốt(sau Ag) t =1083oC, t = 2562oC, d = 8,98 g/cm3. nc s
II. TCHH (Cu là kim loại hoạt động yếu)
Hình ảnh là một trong nhiều biểu
1. Cu tác dụng với O → Oxide 2Cu + O 2CuOo t 2 2
tượng giả kim thuật từng được sử o
2. Cu tác dụng với phi kim(khác O ) → Muối Cu + Cl t CuCl 2 2 2
dụng để đại diện cho nguyên tố
3. Cu không tác dụng với Acid thông thường(HCl, H SO ...)
đồng. Nó được hiển thị trên bả 2 n đồ 4 loãng
4. Cu tác dụng với Acid (HNO , H SO ,
) → Muối + Sản phẩm khử + H O thế kỷ 17 c o t ủa S3i 2 p, t 4 đặc ừ đó n n ón g guyên tố 2 Cu + 2H SO CuS đư O ợc + S đặtO t ê ↑ n.+ 2H O 2 4(đặc) 4 2 2
3Cu + 8HNO 3otCu(NO ) + 2NO ↑ + 4H O 3 3 2 2 Cu + 4HNO
Cu(NO ) + 2NO ↑ + 2H O 3 (đặc) 3 3 2 2
5. Cu tác dụng với dd m uối
→ Muối + KL* Cu + 2FeCl 2F eC l + CuCl 3 2 2
Cu + 2AgNO Cu(NO ) + 2Ag↓ 3 3 2 Tiếp Tiếp th eo
III. Ứng dụng: Cupper là vật liệu dễ dát mỏng, dễ uốn, có khả năng dẫn điện và dẫn
nhiệt tốt(chỉ sau Silver)
- Dây điện, động cơ điện, nam châm điện ... - Đúc tượng -
Đồ dùng, dụng cụ trong gia đình... -
Sản xuất gốm kim loại và thủy tinh màu. -
Sản xuất các loại nhạc khí, đặc biệt là các loại nhạc khí. -
Các hợp chất có ứng dụng trong phân tích hóa học (dung dịch Fehling) . -
Dung dịch thuốc Boóc-đô (Bordaux): CuSO -Ca(OH) sử dụng cho nông nghiệp. 4 2
IV. Điều chế: Hầu hết Cupper được sản xuất từ Cupper sulfide (Cu S; CuFeS ...), 2 2
phần khác được tái chế từ đồng phế liệu.
*Phương pháp sản xuất: tinh chế điện (electrorefining) để tạo ra cupper tinh khiết. Cu2+ Cu
V. Một số hợp kim và quặng của Đồng.
- Hợp kim Vàng tây: Cu – Au ứng dụng làm đồ trang sức.
- Hợp kim Đồng thanh: Cu – Sn ứng dụng trong công nghiệp hóa chất.
- Hợp kim Đồng thau: Cu – Zn ứng dụng nhiều vào các lĩnh vực.
- Hợp kim Đồng bạch/Constantan: Cu – Ni... ứng dụng chế tạo tiền xu. Qua u y a lạ i 30
Zinc(Kẽm) được nhà hóa học người Đức Andreas Marggraf phát hiện vào Zn năm 1746. Zinc
- Hóa trị: II NTK: Zn = 65đvC 65
I. TCVL: Chất rắn, màu bạc xám, cứng, giòn. Zn thường được bao phủ
bởi lớp Oxide bền vững với môi trường, không tan trong nước.
t = 420oC, t = 970oC, d = 7,14 g/cm3. nc s
Một biểu tượng giả kim cho
II. TCHH (Zn là kim l Z o i ại nc có t O rê xide n nề và n t H r y ừ dro u t xide lưỡ ượng l ng ấy tính) o 1. Zn tác dụng vớ cải O m → hứ Oxid ng t e ừ vật liệ u l ợ 2 p ZiZn nc .+ O 2 Z t n O 2 2 o t
2. Zn tác dụng với phi kim(khác O ) → Muối Zn + Cl Z n Cl 2 2 2
3. Zn tác dụng với Acid → Muối + H ↑ Zn + 2HCl Z nCl +H ↑ 2 2 2
4. Zn tác dụng với dd kiềm → Muối(zincat) + H ↑ 2
Zn + 2NaOH Na ZnO + H ↑ 2 2 2
Zn + Ca(OH) CaZnO + H ↑ 2 2 2
5. Zn tác dụng với dd Muối(sau Zn ) →
Muối + Kim loại ↓ Zn + CuSO ZnSO + Cu↓ 4 4
Bảo vệ bề mặt kim loại Tiếp Tiếp th t eo bằng mạ Zinc
III. Ứng dụng: Zinc là kim loại được sử dụng phổ biến hàng thứ tư sau Iron,
Aluminium, và Cupper tính theo lượng sản xuất hàng năm. -
Kim loại Zinc chủ yếu được dùng làm chất chống ăn mòn ở dạng mạ. - Pin Zinc - Carbon. -
Hợp kim của Zinc được sử dụng rộng rãi. -
Zinc có trong hầu hết các khẩu phần ăn cung cấp
dưỡng chất và vitamin hàng ngày. -
Có nhiều hợp chất Zinc hữu cơ quan trọng. -
Zinc là nguyên tố cần thiết để duy trì sự sống của con người, động vật, thực vật và vi sinh vật. -
Sử dụng làm phân bón vi lượng cho nông nghiệp.
IV. Điều chế: Khoảng 70% lượng Zinc trên thế giới có nguồn gốc từ khai thác mỏ,
lượng còn lại từ hoạt động tái sử dụng.
*phương pháp nhiệt luyện: 2ZnO + o C t 2Zn + CO 2
*phương pháp điện phân: 2ZnSO + 2H O ñi eän ph a ân 2Zn + 2H SO + O 4 2 2 4 2 Quay a lạ i 31
- Gallium Nó được nhà hóa học người Pháp Paul-Emile Lecoq de
Ga Boisbaudran phát hiện vào năm 1875. Tên có nguồn gốc từ tên Latinh
Gallium của Pháp, 'Gallia'. Trước khi phát hiện ra nó thì phần lớn các tính chất của
nó đã được D. I. Mendeleev dự đoán và miêu tả(gọi là "eka-Aluminium"). 70
- Hóa trị: II, III. NTK: Ga = 70đvC PTK: - Hãy Click vào
I. TCVL: Chất rắn, bạc trắng, cứng và giòn. Dễ nóng chảy nếu biểu tượng
để trong lòng bàn tay. t = 30oC, t = 2204oC, d = 5,9 g/cm3. Nguyên tố nc s để biết ý nghĩa
II. TCHH (Ga hoạt Hì động nh ả rất yếu, nh phả hầu n án hết h c kh ác ó t h cham hơi gia c p hữ hản liê ứ n ng hóa học) Gallium cũng phá quahủy k n đếết cấu n ng u phần ồn g lớ ốcn c c ác ủa kim tê loại khác n nguyê bằn n t g ố. cách khuếch tán vào L etr c ong lư oq de ới B tin oi h s thể kim baudr lo an ại đãcủa đặtch t ún ê g. n nguyên
tố này theo tên của Pháp ('Gaul' trong
III. Ứng dụng (Trong công nghiệp bán dẫn và điện tử) - Gallium và hợp t icếhất củ ng L aa tnió là ch nh) và ấ ct ảthay bảnt htế S hâ il n ico ônng ,c óv ình iều hữu ích cho ngành công nghiệp điện Letử c . Nó oq, c là ó m n ột gh ĩthà a lnàh ' p c hầ onn gqu à a t n r trọn ống' g c dị ủ c a
h nhiều chất bán dẫn, sử dụng trong đènt LED hà , nh ' pi Gna lm l ặ u ts 'tr t ờ r i, có ong t nh iế ững ứ ng Lantg i dụng nh. M tro ột ng công nghệ Blu-ray,
điện thoại di động, … và tạo các hợp kim nóng chảy thấp.
con gà trống bằng kim loại màu bạc được
- Hợp kim lỏng của Ga được sử dụng rộng rãi trong một số nhiệt kế y học để thay
thể hiện trên nền bản đồ cổ của Pháp.
thế cho nhiệt kế Mercury.
IV. Điều chế: Gallium có thể thu được bằng cách
điện phân dung dịch Ga(OH) trong KOH. 3 32
- Germanium được nhà hóa học người Đức Clemens-Alexander Winkler
Ge phát hiện và cô lập vào năm 1886. Tên này có nguồn gốc từ tên Latinh của
Đức, 'Germaniuma'. Mendeleev đã tiên đoán sự tồn tại của Germanium vào
Germanium năm 1871 dưới dạng ekaSilicon. 73
- Hóa trị: II, IV. NTK: Ge = 73đvC
I. TCVL: Chất rắn, bạc trắng, cứng, bóng và là chất bán dẫn.
t = 938oC, t = 2833oC, d = 5,3 g/cm3. nc s
Germanium đã được sử dụng
II. TCHH (Ge hoạt động rất yếu, hầu hết khó tham gia phản ứng hóa học)
trong các bóng bán dẫn ban
Về mặt hóa học, Germanium có nhiều tính chất giống Tin.
III. Ứng dụng (Chủ yếu t đầron u t g công n ương t ghiệp ự như bán bó d n ẫn v g báà điệ n dẫn t n ử)
- Germanium Oxide có chỉ số khú ở c bixạ ể và u t phân ượng. tán cao. Điều
này làm cho nó phù hợp để sử dụng trong ống kính máy ảnh
góc rộng và vật kính cho kính hiển vi.
- Hợp kim Si-Ge từng là vật liệu bán dẫn quan trọng. Tuy nhiên
ngày nay, các chất bán dẫn khác đã thay thế nó.
- Germanium cũng được sử dụng làm chất tạo hợp kim (thêm
1% Ge vào bạc sẽ giúp bạc không bị xỉn màu), trong đèn huỳnh
quang và làm chất xúc tác.
IV. Điều chế: Germanium thu được từ quặng Zinc nhờ xử lý bụi quặng
nóng chảy cũng như từ các phụ phẩm sau cháy của một vài dạng than đá.
- Chưng cất phân đoạn cho phép sản xuất Ge cực kỳ tinh khiết. 33
- Arsenic được biết đến từ thời tiền sử với các chất độc sulfide. Nhà khoa As
học và triết học người Đức Albertus Magnus được cho là đã thu được As
Arsenic tinh khiết vào khoảng năm 1250. 73
- "Thạch tín" là tên gọi chung của As và As O . 2 3
- Hóa trị: III, V. NTK: As = 75đvC
I. TCVL: Chất rắn, ánh kim xám, As vô cơ rất độc, As hữu cơ không độc. t = 615oC, d = 5,7 g/cm3. thăng hoa
Tôm chứa hàm lượng Arsenic
II. TCHH (As hoạt động rất yếu, hầu hết khó tham gia phản ứng hóa học)
khá cao. Tuy nhiên, ở dạng
Về mặt hóa học, Arsenic có nhiều tính chất giống Phosphorus.
Arsenic hữu cơ nên không gây
III. Ứng dụng hại cho sức khỏe.
- Arsenic là một chất độc được nhiều người biết đến. Các hợp chất
Arsenic đôi khi được sử dụng làm thuốc diệt chuột và thuốc diệt côn
trùng nhưng việc sử dụng chúng được kiểm soát chặt chẽ.
- Sử dụng trong kỹ thuật mạ đồng và pháo hoa màu"ngọc lục bảo".
- Các hợp chất Arsenic có thể được sử dụng để làm thủy tinh đặc biệt
và bảo quản gỗ Chromated copper arsenate (CCA)
- As và nhiều hợp chất của nó là những chất độc cực kỳ độc. Cần phải cẩn thận khi sử dụng.
IV. Điều chế: Arsenic thu được từ quá trình xử lý bụi quặng cupper, gold
trong quá trình sản xuất các kim loại trên. 34
- Selenium được phát hiện bởi nhà hóa học Thụy Điển Jöns Jacob Se
Berzelius vào năm 1817. Tên này có nguồn gốc từ 'Selene', tên tiếng Hy Lạp
của nữ thần Mặt trăng. Selenium 79
- Hóa trị: III. NTK: Se = 79đvC
I. TCVL: Chất rắn, đen-xám-đỏ và là chất bán dẫn.
t = 221oC, t = 685oC, d = 4,8 g/cm3. nc s
Nguyên tố này được đặt theo tên
II. TCHH (Se hoạt động rất yếu, hầu hết khó tham gia phản ứng hóa học)
của Selene, nữ thần mặt trăng
Về mặt hóa học, Selenium có nhiều tính chất giống S.
III. Ứng dụng (Se có n c hi ủaều Hứng y Ldụ ạ ng p. tr H on ìn g si h ả nh học nh c v ủa à c mông ột nghiệp)
- Ứng dụng lớn nhất củ m aặ S t e t l răà sản ng l xuấ ưỡi t l tihềủy m ttinh rê và v n bề ật l m iặệtu gốm.
- Selenium vừa có tác dụng quang c điệ hain, s n ầ ó
n. rất hữu ích trong tế bào
quang điện, pin mặt trời và máy photocopy. Nó cũng có thể chuyển
đổi điện xoay chiều thành điện một chiều, do đó được sử dụng rộng
rãi trong các bộ chỉnh lưu.
- Selenium là chất độc đối với nấm da đầu gây ra gàu vì vậy nó
được sử dụng trong một số loại dầu gội trị gàu.
- Selenium là một trong những khoáng chất vi lượng thiết yếu có thể. Có IV .kh Đ ả i ề nă u n c g h k ế: hSửe đ le ộ n c i , c umh ố đ n ư g ợ u c ng sả t n h x ư v uất àt l ừ à m ph c ụ h pậhm ẩ q m u t á r tr on ìgnh ti l n ão h hóa.
luyện cupper hay trong sản xuất Sulfuric Acid . 35
- Bromite được tìm thấy độc lập bởi nhà hóa học người Đức Carl Löwig và Br
nhà hóa học và dược sĩ người Pháp Antoine-Jérôme Balard năm 1826. Tên
Bromite này xuất phát từ tiếng Hy Lạp 'Bromos' có nghĩa là mùi hôi thối. 80
- Hóa trị: I,... NTK: Br= 80 đvC PTK: Br = 160đvC 2
I. TCVL: Chất lỏng, màu đỏ nâu, khi pha loãng có màu cam hoặc vàng.
Có mùi đặc trưng, rất độc. t = -7oC, t = 59oC. d = 3,1 g/cm3. nc s
II. TCHH (Br là phi kim có tính oxi hóa và hoạt động hóa học mạnh) 2
Hình ảnh có ý định phản ánh ot
1. Br tác dụng với H → HBr Br + H 2HBr 2 2 2 2
màu sắc phong phú, tính bay
2. Br tác dụng với H O → ...... Br + H O HBr + H B r O 2 2 hơi và mùi 2 hôi t 2hối của o t
3. Br tác dụng với kim loại → Muối 3B nguyêr + n t ố.2Fe 2FeBr 2 2 3
4. Một số phản ứng đặc biệt: ♪ Vô cơ Br + 2NaI 2NaBr + I
(halogen mạnh đẩy halogen yếu hơn ra khỏi dung dịch muối) 2 2 Br + 2NaOH N o t aBr + NaBrO + H O 2 2 video
3Br + 6NaOH 5NaBr + NaBrO + 3H O 2 3 2 3Br + 2FeBr 2Fe B r
Br + 5Cl + 6H O 10HCl + 2HBrO 2 2 3 2 2 2 3 Br + SO + 2H O 2HBr + H
SO (khí SO làm mất màu dd Bromite. Phân biệt SO / CO ) 2 2 2 2 4 2 2 2 3Br + 2CrBr + 16NaOH 2N a CrO + 12NaBr + 8H O 2 3 2 4 2 Tiếp Tiếp th eo th
3Br + 2NaCrO + 8NaOH 2Na CrO + 6NaBr + 4H O 2 2 2 4 2
♪ Hữu cơ Br + CH =CH
CH Br-CH Br (alkene(nối C=C, mạch hở) làm mất màu dd Bromite) 2 2 2 2 2 Br + CH≡CH
CHBr -CHBr (alkyne(nối C≡C, mạch hở) làm mất màu dd Bromite) 2 2 2 , o Fe t Br + C H
C H Br + HBr (Benzene thế Br nguyên chất khi đun nóng có mặt Fe) 2 6 6 6 5 2 Br + CH CHO + H O 2HBr + CH COOH
(aldehyde làm mất màu dd Bromite) 2 3 2 3 Br + C H O
+ 2H O 2HBr + C H O (glucose làm mất màu dd Bromite) 2 6 12 6 (glucose) 2 6 12 7 Br + HCOOH 2HBr + CO
(Formic acid làm mất màu dd Bromite và có khí bay lên) 2 2 3Br + C H OH C
H Br OH↓ + 3HBr (phenols làm mất màu dd Bromite và có kết tủa trắng) 2 6 5 6 2 3
3Br + C H NH C H Br NH ↓ + 3HBr (anilin làm mất màu dd Bromite và có kết tủa trắng) 2 6 5 2 6 2 3 2
III. Ứng dụng: Bromite được sử dụng trong nhiều lĩnh vực như hóa chất nông
nghiệp, thuốc nhuộm, thuốc trừ sâu, dược phẩm và các chất trung gian hóa học.
- OrganoBromides được sử dụng trong bình chữa cháy halon. AgBr là một hóa chất
được sử dụng trong chụp ảnh phim.
IV. Điều chế: Nguồn chính điều chế Br là từ nước biển sau khi đã loại 2 bỏ NaCl. 2NaBr + Cl 2NaC l + Br 2 2 Quay a lại lạ 36
- Krypton được phát hiện trong không khí hóa lỏng bởi nhà hóa học người Kr
Scotland William Ramsay và nhà hóa học người Anh Morris William
Krypton Travers vào năm 1898. 84
- Hóa trị: - NTK: Kr = 84 đvC
I. TCVL: Chất khí, không màu, không mùi, không
tan trong nước. t = -157,4oC, t = -153,4oC nc s Ống phóng điện krypton II. TCHH phát sáng màu trắng
Có nhiều đồng vị khác nhau
- Krypton thuộc nhóm khí hiếm(khí trơ) thường tồn tại ở dạng đơn nguyên tử.
của krypton. Biểu tượng này
- Trong thực tế Kr nói riêng và các nguyên tố nhóm VIIIA nói chung rất khó tham
đại diện cho đồng vị
gia các phản ứng hóa học. krypton-86. III. Ứng dụng
Krypton được sử dụng thương mại làm khí nạp cho đèn huỳnh quang tiết kiệm năng
lượng. Nó cũng được sử dụng trong một số đèn flash dùng để chụp ảnh tốc độ cao.
- Krypton Fluoride được sử dụng trong một số loại laser.
- SpaceX Starlink sử dụng krypton làm chất đẩy cho hệ thống đẩy điện của mình.
IV. Điều chế: Krypton được sản xuất từ không khí
siêu lạnh trong chưng cất phân đoạn không khí lỏng. Wi W lliam Ram am R say s ? Wi W lliam Rams R ay ams ? Wi W lilila i m m Ramsa m y (1852 - 1916) là
à nhà hóa học người iScotl ot an a d. Ông là à người iđã ã khám phá ra cá c c khí íhiế i m và chín í h ông cũng là l người iđưa a chúng vào bảng tu t ần hoàn các nguyên ê tố
t hóa học. Nhờ có đóng góp này, y ông trở ở th t ành nhà hóa a học Scotlta l nd cũng như Vươn ơ g quốc c Anh đầu ti t ê i n nhận Giả i i iNobel e Hóa học.
Với những cống hiến to lớn của mình cho khoa học, Ông nhận được Giải
Nobel Hóa học (1904); Huy chương Matteucci (1907) và Huy chương Elliott Cresson (1913). 37
- Rubidium được phát hiện bởi nhà hóa học người Đức Robert Wilhelm
Rb Bunsen và nhà vật lý người Đức Gustav-Robert Kirchoff vào năm 1861.
Tên có nguồn gốc từ tiếng Latinh 'Rubidius', có nghĩa là màu đỏ đậm nhất. Rubidium 85
- Hóa trị: I NTK: Rb = 85đvC
I. TCVL: Chất rắn, màu trắng bạc, mềm, dẻo, tan(pư)
trong nước, t = 39oC, t = 688oC, d = 1,53 g/cm3. nc s
II. TCHH (Rb là kim loại h H oạ ì t độn nh ả g(t nh cính ủa khử m ) ột rấ ' t m m ắt ạnh đi ) ện'
1. Rb tác dụng với O → O đượcxi l d ấ e y cảm 4Rb hứng t + O ừ việ → c s 2 ử Rb O 2 2 2
2. Rb tác dụng với phi kim(khác O dụng Rubi ) di → M um t uối rong tế2Rb bà + o Cl → 2RbCl 2 2
3. Rb tác dụng với nước → quadd Ba ng đi se ệ + n ( H cả ↑m bi2R ế b +
n phá 2t H O → 2RbOH + H ↑ 2 2 2
4. Rb tác dụng với dd Acid → M
hi uệốni + H á ↑ nh sá 2R
ng). b + 2HCl → 2RbCl + H ↑ 2 2
5. Rb tác dụng với dd Muối → Base + Muối + H ↑ 2
2Rb + CuSO + 2H O → Cu(OH) ↓ + Rb SO + H ↑
III. Ứng dụng: Rubi 4 dium ít 2 được sử dụng tr 2 ong nghi 2ên c 4ứu bê 2n
ngoài. Nó đã được sử dụng như một thành phần của tế bào quang điện,
để loại bỏ dấu vết của oxy từ các ống chân không và để chế tạo các loại thủy tinh đặc biệt.
- Rubidium và Cesium có khả năng tăng hiệu suất pin mặt trời Perovskite.
IV. Điều chế: Điện phân nóng chảy hợp chất của Rb(theo lí thuyết). 2RbCl 2Rb + dp nCc l ↑ 2 38
- Strontium được phát hiện bởi hóa học người Ireland Adair Crawford vào Sr
năm 1790. Strontium được đặt theo tên của Strontian, một thị trấn nhỏ ở Strontium Scotland. 88
- Hóa trị: II NTK: Sr = 88đvC PTK: -
I. TCVL: Chất rắn, màu vàng xám, mềm, tan(pư) trong
nước, t = 777oC, t = 1382oC, d = 2,64 g/cm3. nc s
II. TCHH (Sr là nguyên tố kim loại hoạt động hóa học mạnh )
Hình ảnh là một 'đám mây
1. Sr tác dụng với O → Oxide 2Sr + O → 2SrO 2 2
hình nấm' bằng kim loại rất
2. Sr tác dụng với phi kim(khác O ) → Muối Sr + Cl → SrCl 2 2 2
trừu tượng. Nó ám chỉ sự hiện
3. Sr tác dụng với nước → dd Base + H ↑ Sr + 2H O → Sr(OH) + H ↑ diện của St 2 rontium tr 2 ong bụi 2 2
4. Sr tác dụng với dd Acid → Mu ph ối ón+g H x ↑ ạ Sr hạt + 2 nhâ HC n. l → SrCl + H ↑ 2 2 2
5. Sr tác dụng với dd Muối → Base + Muối + H ↑ 2
Sr + CuSO + 2H O → Cu(OH) ↓ + SrSO ↓ + H ↑ 4 2 2 4 2
III. Ứng dụng: Strontium được biết đến nhiều nhất với màu đỏ rực rỡ mà muối của nó tạo
ra cho pháo hoa và pháo sáng. Nó cũng được sử dụng để sản xuất nam châm ferrite và tinh
chế Zinc. SrCl là một thành phần trong kem đánh răng dành cho răng nhạy cảm. 2
- Sơn và nhựa 'phát sáng trong bóng tối' hiện đại có chứa Sr(AlO ) . Chúng hấp thụ ánh 2 2
sáng vào ban ngày và nhả ra từ từ trong nhiều giờ sau đó.
IV. Điều chế: Điện phân nóng chảy hợp chất của Sr. SrCl Sr dp n+ c C l ↑ 2 2 39
- Yttrium được nhà hóa học người Đức, Friedrich Wöhler cô lập lần đầu Y
tiên vào năm 1828. Tên được đặt theo tên của làng Ytterby, Thụy
Yttrium Điển. Yttrium thường được phân loại là “nguyên tố đất hiếm”. 89
- Hóa trị: III NTK: Y = 89 đvC
I. TCVL: Chất rắn, màu trắng bạc, mềm.
t =1526oC, t = 2930oC, d = 4,47 g/cm3. nc s
Radar phản ánh việc sử dụng II. TCHH
Yttrium trong công nghệ radar.
- Yttrium là một kim loại hoạt động trung bình.
Nguyên tố này cũng được sử dụng III. Ứng dụng
để cung cấp màu đỏ cho các màn - Yttrium thường được hì sử dụ nh ti ng vi là m m à chấ u t t phụ hời gi kỳ a đ tầrong h u, và ợp đâkim y l . à N
ó làm tăng độ bền của
hợp kim Aluminium và Magnesium. Nó cũng được sử dụng trong việc chế tạo bộ lọc vi
lý do cho phần nền lặp lại câu hát
sóng cho radar và được sử dụng làm chất xúc tác trong phản ứng polymer hóa ethylene.
'Đó là tất cả những gì Folks!' Của
- Hợp chất của Yttrium cũng được sử dụng trong sản xuất đèn LED trắng, điện cực, chất
điện phân, bộ lọc điệ Wn a tử, rne laser, chấ r Bros t s . m iàêu d n hìẫn, các nh gi ậ ứ t ng gâ dụng y
n hoạt tế khác nhau và đang
nghiên cứu các vật liệu khác nhau để nâng hì cao nh. tính chất của chúng.
- Đồng vị phóng xạ Y-90 được sử dụng trong y tế. Nó có thể được sử dụng để điều trị
một số bệnh ung thư, chẳng hạn như ung thư gan.
IV. Điều chế: Yttrium tinh khiết được sản xuất thương mại bằng cách
khử YF bởi Calcium kim loại. 3 o t Nguy gu ê y n n t ố t đ ất ấ h t iếm h ? 3Ca + 2YF 3CaF + 2Y 3 2 Các C ngu n yê gu n n tố đất đ hi h ếm và và c ác ki k m loại đất hi h ếm ế , theo IUP U A P C A l C à một hợp chất
hấ gồm 17 nguyên tố hóa học ọ thuộ hu c bả c ng tuần hoàn của Me M ndeleev e . Z Kí hiệu Tên Z Kí hiệu Tên 21 Sc Scandium 64 Gd Gadolinium 39 Y Yttrium 65 Tb Terbium 57 La Lanthanum 66 Dy Dysprosium 58 Ce Cerium 67 Ho Holmium 59 Pr Praseodymium 68 Er Erbium 60 Nd Neodymium 69 Tm Thulium 61 Pm Promethium 70 Yb Ytterbium 62 Sm Samarium 71 Lu Lutetium 63 Eu Europium
Ứng dụng: Dùng để chế tạo các nam châm vĩnh cửu cho các máy phát
điện, đưa vào các chế phẩm phân bón vi lượng, làm vật liệu siêu dẫn, vật
liệu phát quang trong các ứng dụng quang điện, công nghệ laser. 40
- Zirconium được nhà hóa học người Đức Martin-Heinrich Klaproth vào
Zr năm 1789. Tên có nguồn gốc từ tiếng Ả Rập, 'zargun', có nghĩa là màu
Zirconium vàng. 91
- Hóa trị: IV… NTK: Zr = 91 đvC
I. TCVL: Chất rắn, mềm, dẻo và dễ uốn, màu bạc trắng.
t = 1855oC, t = 4409oC, d = 6,52 g/cm3. nc
s Người Ai Cập cổ đại sử dụng đá II. TCHH - Zirconium là một ki quý z m i l rc oại h on t orạt động t ong đồ trun ra g bì ng snh ứ .c. Đối - Ở dạng bột thì Zr với rất dễ ngư c ờih áy Ai n h C ưậng ở p c dạng ổ đại khối rắn th
, bọ hung ì nó khó bắt lửa hơn. Zr có khả năng ( ch đạốing d iăện mòn n ở đâ byở)i lcàác bicểhất u t kiềm, A ượng c cid
ủa , nước muối và các tác nhân khác rất cao. s T ựuy t ái n shiiên, n nh và ó s á sẽ n g h t ò ạ a o , ttan t ruyề rong
n đạt các Acid như Hydrochloric Acid và Sulfuric A nh c ữ id , đặc ng ý t biệt là kh ưởng về i s có ự m bi ặ ế t Fluo n đổirine. , đổi
III. Ứng dụng: Zirconium không hấp thụ neutron, khiến nó trở thành vật liệu lý mới và phục sinh.
tưởng để sử dụng trong các nhà máy điện hạt nhân. Hơn 90% Zr được sử dụng theo
cách này. Với Nb, Zr siêu dẫn ở nhiệt độ thấp và được dùng để chế tạo nam châm
siêu dẫn. - Đá Zirconiuma/ đá CZ (Zirconium dioxide – ZrO ) được cắt thành đá quý 2
để sử dụng trong đồ trang sức hoặc vật liệu mài như: đá mài, giấy nhám …
IV. Điều chế: Hầu hết kim loại Zr được tạo ra bằng cách
khử Zirconium (IV) chloride với kim loại Mg trong quá trình Kroll. 2Mg + ZrCl o 2M t gCl + Zr 4 2 41
- Niobium hay Columbi được nhà hóa học và nhà sản xuất người Anh
Nb Charles Hatchett phát hiện trong một khoáng chất màu đen từ Châu Mỹ
Niobium vào năm 1801 và ông gọi nguyên tố là columbium. 93
- Hóa trị: III,V… NTK: Nb = 93 đvC
I. TCVL: Chất rắn, mềm, màu xám có ánh lam khi
phơi ngoài không khí. t = 2477oC, t = 4744oC, d = 8,57 g/cm3. nc s II. TCHH
Các cánh quạt trong biểu
- Niobium là một kim loại hoạt động t hóa học ượng phả yếu n á (tươn nh vi g ệ tcự sTa ử ntalum).
- Ở nhiệt độ thấp Nb hầu như không dụngph ả N n i ứng obi hóa um học và c vớ áci chất nà hợp o.
III. Ứng dụng: Niobium được sử ki d m ụn c g t ủa rong nó t các hợp ki rong ngàm b nh ao gồm cả thép không
gỉ. Nó cải thiện độ bền của hợp kim, đặc hà biệt là ở nhi
ng không. ệt độ thấp. Hợp kim chứa
Niobium được sử dụng trong động cơ phản lực và tên lửa, dầm và dầm cho các tòa nhà
và giàn khoan dầu, và đường ống dẫn dầu và khí đốt.
- Nguyên tố này cũng có đặc tính siêu dẫn. Nó được sử dụng trong nam châm siêu dẫn
cho máy gia tốc hạt, máy quét MRI và thiết bị NMR.
- Các hợp chất Oxide Nb được thêm vào thủy tinh để tăng chỉ số khúc xạ, cho phép chế
tạo kính hiệu chỉnh với thấu kính mỏng hơn.
IV. Điều chế: Hầu hết kim loại Nb được tạo ra
bằng cách khử Niobium(V) oxide với kim loại Al. o t 3Nb O + 10Al 5Al O + 6Nb 2 5 2 3 42
- Molybdenum được nhà hóa học người Thụy Điển Carl Wilhelm Scheele
Mo phát hiện năm 1778 và nhà hóa học Thụy Điển Peter-Jacob Hjelm cô lập
Molybdenum lần đầu tiên vào năm 1781. 96
- Hóa trị: I,III,IV… NTK: Mo = 96 đvC
I. TCVL: Chất rắn, màu xám bạc, có hệ số giãn nở
nhiệt thấp. t = 2623oC, t = 4639oC, d = 10,28 g/cm3. nc s
Hình ảnh là một van vặn II. TCHH
hình bánh xe, phản ánh việc
- Molybdenum là một kim loại hoạt động hóa học trung bình. sử dụng hợp kim
- Ở nhiệt độ thường Mo không phản ứng hóa học với nước hoặc Oxygen. Molybdenum trong van và III. Ứng dụng nồi hơi.
- Molybdenum chủ yếu được sử dụng làm chất tạo hợp kim trong thép đặc biệt có độ
cứng cao, chịu nhiệt tốt, chống ăn mòn.
- Molybdenum disulfide (MoS ) được sử dụng làm chất bôi trơn ở nhiệt độ cao. 2
- Các ứng dụng khác của Mo như: chất xúc tác cho ngành công nghiệp dầu khí, mực
in cho bảng mạch, chất màu, điện cực và làm phân bón vi lượng trong nông nghiệp.
IV. Điều chế: Molybdenum kim loại được tạo ra
bằng cách khử oxide với hydrogen: o MoO + 3H Mo t + 3H O 3 2 2
- Technetium là nguyên tố đầu tiên được sản xuất nhân tạo. Nó được Carlo 43
Tc Perrier và Emilio Segrè cô lập vào năm 1937. Tên có nguồn gốc từ tiếng
Technetium Hy Lạp 'tekhnetos' có nghĩa là nhân tạo. [98]
- Hóa trị: IV, VI,VII. NTK: Tc = [98] đvC
I. TCVL: Chất rắn, màu xám bạc, nguyên tố phóng xạ.
t = 2157oC, t = 4265oC, d = 11 g/cm3. nc s II. TCHH
Biểu tượng bàn tay con người
- Technetium là một kim loại phả hoạ n át nđộng h s hóa ự t hậhtọc rằyếu. ng nguyên
- Technetium hòa tan trontg Nitric a ố được c t id, ạ nướ o ra c c m ườ ột ng cá tcoan và h nhâ Su n lfuric
Acid đậm đặc, nhưng không tạ hòa o và ta t n ê tro n cng ủaHydroc nó c h ó lor ngic A hĩaci l dà III. Ứng dụng 'nhân tạo'.
- Technetium-99 phát ra tia gamma (có thể di căn) được sử dụng rộng rãi cho các nghiên
cứu chẩn đoán y tế. Một số dạng hóa học được sử dụng để hình ảnh các bộ phận khác nhau của cơ thể.
- Một lượng nhỏ Technetium có thể làm chậm sự ăn mòn của thép.
- Tc cũng đã được đề xuất cho các thiết bị quang điện tử và pin hạt nhân, chất xúc tác cho
một số phản ứng hóa học.
IV. Điều chế: Số lượng lớn Technetium-99 được sản xuất mỗi năm từ các
thanh nhiên liệu hạt nhân đã qua sử dụng. Sự phân hạch của 1000 mg U-235
trong lò phản ứng hạt nhân tạo ra 27 mg Tc-99. 44
- Ruthenium được nhà hóa học người Nga Gottfried Wilhelm Osann phát
Ru hiện vào năm 1828. Tên có nguồn gốc từ 'Ruthenia', tên Latinh của Nga.
Ruthenium - Hóa trị: III,… NTK: Ru = 101 đvC 101
I. TCVL: Chất rắn, màu trắng bạc.
t = 2334oC, t = 4150oC, d = 12,45 g/cm3. nc s II. TCHH
Tên của nguyên tố có nguồn
- Ruthenium là một kim loại hoạt động hóa học yếu.
gốc từ tên Latinh của Nga.
- Ru không phản ứng với Acid nhưng tác dụng được với kiềm
đặc hoặc halogen ở nhiệt độ cao.
Chữ Cyrillic cách điệu dựa
trên lá cờ Nga của Liên Xô từ
III. Ứng dụng: Một lượng nhỏ Ruthenium cũng được sử dụng trong một số các siêu
hợp kim đơn tinh thể chịu nhiệt độ cao khoả . n Hợp g nă ki m m 1 c9ủa
21R.u để chế tạo các tiếp điểm điện
chống mài mòn hoặc trong điện trở chip màng dày.
- Các hợp chất Ruthenium có thể được sử dụng trong pin mặt trời, biến năng lượng
ánh sáng thành năng lượng điện.
- Ruthenium(VIII) oxide – RO được sử dụng để làm hiện ra dấu vân tay tiềm ẩn bằng 4
cách chuyển sang dạng RO nâu/đen khi tiếp xúc với dầu mỡ hoặc chất béo. 2
IV. Điều chế: Ruthenium được cô lập thương mại bằng một quá trình hóa
học phức tạp sau quá trình tinh chế Nickel. Nhóm b ạ b ch h kim (P ( la P ti la n ti u n m)? NH N ÓM Pl P atinu n m u (Bạch (Bạc k im) Các C ki k m loại nh n óm Platinum u là nhóm à c ác nguyên tố kim loạ o i
quý hiếm nằm gần nhau trong bảng tuần hoàn. Các
Cá nguyên tố này đều là các ki c m loại chuyển t huyể iếp trong phân nhóm ó d. Z 44 45 46 76 77 78 Kí hiệu Ru Rh Pd Os Ir Pt Tên Ruthenium Rhodium Palladium Osmium Iridium Platinum 45
- Rhodium được nhà hóa học người Anh William Hyde Wollaston phát hiện
Rh vào năm 1803. Tên có nguồn gốc từ tiếng Hy Lạp 'rhodon‘ nghĩa là hoa Rhodium hồng. 103
- Hóa trị: III, … NTK: Rh = 103 đvC
I. TCVL: Chất rắn, màu trắng bạc, có độ phản xạ cao,
cứng và bền. t = 1964oC, t = 3695oC, d = 12,41 g/cm3. nc s II. TCHH - Rhodium là một k B iim ể ul otạưi h ợ o n ạ g t đ n ộ à ng y c hó ủaa học hoa yếu. hồng - Rh không bị ph t ần lớn các hường đư A ợ c c itdì ă mn tmò hấ n: nó y vớih o c àân toàn u nói không hòa tan trong Nitric aci'd v Daàt ch R ỉ hò osa a ta M n e m l ột A c pi hút t bus' ron (Hg n oa ước cườ hồng ng toan.
III. Ứng dụng cho ong mật). Nó được sử dụng
- Việc sử dụng chính của Rhodium là trong các bộ chuyển đổi xúc tác cho ô tô
bởi Rosicrucians, một hội kín thế
(80%). Nó làm giảm các Oxide Nitrogen trong khí thải. kỷ 17.
- Rhodium là một trong những loại hiếm nhất và có giá trị nhất trong kim loại
quý, được sử dụng để làm tiếp điểm điện, làm đồ trang sức và xúc tác…
IV. Điều chế: Quá trình khai thác Rhodium trong công Nướ ư c c cư c ờ ư ng n t g o t an? n
nghiệp rất phức tạp vì quặng được trộn với các kim loại
khác. Nó được tìm thấy trong quặng Platinum và được
chiết xuất như một kim loại trơ màu trắng khó nung chảy. Nướ N c c c ường g toan hay C y ườn C g t ườn oa o n th n ủ
th y (nước hoàng gia) là ch c ất ấ ăn
mòn mạnh, ở dạng lỏng, màu vàng, dễ b ay hơi a . Nó được N tạo thành bằng cá
ng c ch trộn lẫn dung dịch Ni N tric acid đậm đặc và dung dịch Hydroc H hloric Ac A id d đậ đ m đặc, tối ưu l à ở tỉ lệ mol 1:3. Nước c cườn ườ g toan n là l một t t rong số ítí thóa ch c ất c t ó khả năng hòa ta t n Gold và à Pl P a l titnum. Ví dụ: :
Au + HNO + 3HCl → AuCl + NO + 2H O 3 + 3HCl → AuCl3 + NO + 2H 3 3 2 3Pt P +
+ 4HNO + 12HCl → 3PtCl + 4NO + 8H O
3 + 12HCl → 3PtCl4 + 4NO + 8H2 3 4 46
- Palladium được phát hiện bởi nhà hóa học người Anh William Hyde Pd
Wollaston vào năm 1803. Tên gọi bắt nguồn từ tiểu hành tinh lớn thứ hai Palladium
trong hệ mặt trời Pallas. 106
- Hóa trị: II, IV … NTK: Pd = 106 đvC
I. TCVL: Chất rắn, màu trắng bạc, mềm và dễ uốn.
t = 1554oC, t = 2963oC, d = 12,023 g/cm3. nc s II. TCHH
Hình ảnh đại diện cho tiểu
- Palladium là một kim loại hoạt động hóa học yếu.
hành tinh Pallas, sau đó nguyên
- Pd hòa tan chậm trong dung dịch Acid và cũng
tố được đặt tên. Trên nền là các
không phản ứng với oxygen ở nhiệt độ bình thường. III. Ứng dụng
biểu đồ sao của thế kỷ 20.
- Palladium chủ yếu được dùng cho các bộ chuyển đổi xúc tác ô tô. Ngoài ra, Pd được
sử dụng để làm lò xo cho đồng hồ, dụng cụ phẫu thuật, nhạc cụ Flute, tiếp điểm điện,
chất hàn răng và mão răng, chất xúc tác tốt cho các phản ứng của H .2
- Palladium chloride (PdCl ), có thể hấp thụ một lượng lớn khí Carbon Oxide (CO) và 2
được sử dụng trong máy dò CO …
IV. Điều chế: Palladium có thể được tìm thấy như
một kim loại tự do hợp kim với Gold và các kim loại
nhóm Platinum khác trong các mỏ sa khoáng. 47
- Silver (Bạc) đã được biết đến trong thời tiền sử. Tên có nguồn gốc
Ag từ tên Anglo-Saxon, 'siolfur'. Silver
- Hóa trị: I. NTK: Ag = 108đvC 108
I. TCVL: Chất rắn, trắng bóng, dẻo, là kim loại dẫn điện và
nhiệt tốt nhất. t = 962oC, t = 2162oC, d = 10,5 g/cm3. nc s
II. TCHH (Ag hoạt động Bi ể rất u t yếu)
ượng dựa trên ký hiệu giả o
1. Ag không tác dụng v ki ới m phi kim được (trừ s F ) ử dụng r 2A ộng rãig c + F ho 2A g t F 2 2
2. Ag không tác dụng v Sil ới ve Ac r id
. P hthông thườ ía sau là ng m (H ột C cl, H hi tSiO
ết từ ...) 2 4 loãng
3. Ag tác dụng với Ac 'Gid (HNO undest , H SO rup Cau , l ) → Muối dron', ví + dụ S l p khử + ớn H O 3 2 4 đặc nóng 2 o t 2Ag + 2H SO nhấ t Ag SO được o + bi SO ết ↑ đến + v 2 ề H táOc phẩm 2 4(đặc) 2 t 4 2 2 Ag + 2HNO S i l ve A r g c NO ủa + N Châ O u ↑ Â + u t H hờOi kỳ đồ 3 (đặc) 3 2 2
III. Ứng dụng (Silver là một kim loại quý) Iron.
- Silver và hợp kim dung làm các sản phẩm điện và điện tử cao cấp, pin, đồ
trang sức, tiền xu, gương, ... AgBr và AgI sử dụng làm film của máy ảnh cơ.
- Silver có đặc tính kháng khuẩn và các hạt nano bạc được sử dụng trong
quần áo để ngăn vi khuẩn tiêu hóa mồ hôi và hình thành mùi khó chịu. Sợi
bạc được đan vào các đầu ngón tay của găng tay để có thể sử dụng với điện
thoại màn hình cảm ứng.
IV. Điều chế: Hiện nay, Silver được sản xuất bằng phương pháp điện phân. 48
- Cadmium được Friedrich Strohmeyer, một nhà hóa học người Đức, Cd phát hiện vào năm 1817.
Cadmium - Hóa trị: I, II, … NTK: Cd = 112 đvC 112
I. TCVL: Chất rắn, màu trắng ánh xanh, mềm và
dễ uốn. Cd có độc tính cao.
t = 321oC, t = 767oC, d = 8,65 g/cm3. nc s II. TCHH
Cadmium có tự nhiên trong vỏ -
Cadmium là một kim loại hoạt động hóa học yếu.
Trái đất. Hình ảnh bao gồm một -
Cd tác dụng với dung dịch Acid, phi kim hoặc cháy trong không khí tạo thành biể cá u t cư hợợp chấ ng gi tả củ ki a C m a t dmium c ừng đư ó ợ h c ó s a t ử rị II.
dụng để đại diện cho các nguyên III. Ứng dụng
tố 'đất', dựa trên hình chiếu nền - Khoảng 3/4 Cadmium sản xu c ất ủa ra T đ ráưiợc đấsử t. dụng trong các loại
pin (đặc biệt là pin Ni-Cd) và phần lớn trong 1/4 còn lại sử
dụng chủ yếu trong các chất màu, lớp sơn phủ, các tấm mạ kim
và làm chất ổn định cho plastic.
IV. Điều chế: Cadmium là một tạp chất phổ biến trong quặng Zinc và
nó thường được cô lập trong quá trình sản xuất Zinc. Cd được cô lập từ
kim loại Zinc bằng cách chưng cất chân không nếu Zinc được nấu chảy,
hoặc CdSO được kết tủa từ dung dịch điện phân. 4 49
- Indium được hai nhà khoa học người Đức là Ferdinand Reich In
và Hieronymous Theodor Richter phát hiện năm 1863.
Indium - Hóa trị: III, … NTK: In = 115 đvC 115
I. TCVL: Chất rắn, màu trắng hoặc xám bạc, rất mềm.
t = 156,6 oC, t = 2072oC, d = 7,31 g/cm3. nc s II. TCHH - Indium không ph Biảển ứ u tng ư ợvới nướ ng đư c, ợc n shư ử ng nó phả dụng ở n đ âứng y là các c ký thấ ự t oxi hóa mạnh hơn như ka ha njilo t gie ế n, cá ng Nc A hậtc 'id h để on' . t ạo N ór ac hợp ch ó nghĩ ấ a t l Iàn dium III. (II Ứ
I). ng dụng' nguồn gốc'. Indium được đặt tên theo vạch - Hầu hết Indium mđư à ợc u c sử hà dụ m n s g á để t ng t ạro ra Oxide ong qua Tin Indi ng phổ cum ủa (ITO nó. ),
là một phần quan trọng của màn hình cảm ứng, TV màn hình
Người Nhật phát hiện ra rằng bông là một
phẳng và tấm pin mặt trời.
loại vải khó nhuộm, ngoại trừ màu chàm.
- Indium dần dần tăng lên các ứng dụng mới được tìm thấy trong
Vì vậy, thuốc nhuộm chàm đã được sử
các hợp kim dễ nóng chảy, Tin hàn và trong ngành điện tử.
- Indium được sử dụng để phủ dụng rộng rãciá cđ ổ ể ttrạục của o mà độ u c ng cơ tốc độ ho bông tr cao ong vì
nó cho phép phân phốis đều uốt d t ầu b hời ôi trơ kỳ End.o (1603–1867).
IV. Điều chế: Indium được sản xuất riêng như một sản phẩm phụ trong
quá trình chế biến quặng của các kim loại khác như quặng Zinc, Iron, Lead và Cupper ... 50
- Tin (Thiếc) đã được biết đến trong thời tiền sử. Tin-α (Tin xám) không có
Sn tính kim loại, bền ở nhiệt độ dưới 14 °C. Tin-β (Tin trắng) có tính kim loại, Tin
ổn định ở mức nhiệt độ trên 14 °C. 119
- Hóa trị: II, IV NTK: Sn = 119đvC
I. TCVL: Chất rắn, màu trắng bạc hoặc xám. t = 232oC, t = 2602oC. nc s
- Tin trắng: mềm, dẻo, dễ uốn, d = 7,4 g/cm3.
- Tin xám: cứng, giòn, d = 5,8 g/cm3.
Một biểu tượng giả kim thuật
* Sự phân rã Sn: Sn trắng ↔ Sn xám
phổ biến cho Tin được thể hiện ở
II. TCHH (Sn là kim loại có oxide và hydroxide lưỡng tính)
đây được in nổi trên lon 'Tin'. o
1. Sn tác dụng với O → Oxide Sn + O Sn tO 2 2 2
Lon Tin theo truyền thống được o t
2. Sn tác dụng với Acid → Muối + H ↑ Sn + 2HCl Sn Cl + H ↑ 2 2 2
làm từ thép tráng thiếc.
3. Sn tác dụng với dd kiềm → Muối + H ↑ 2
Sn + 2NaOH + H O Na SnO + 2H ↑ 2 2 3 2
4. Sn tác dụng với dd Muối(sau Sn) → Muối + Kim loại ↓ III. Ứng d
S ụnn g+ : S 2 n Agđượ NO Sn(NO ) + 2Ag↓ 3c dùng để tráng 3 l
2 ên bề mặt các vật bằng thép(sắt tây), vỏ hộp
thực phẩm, nước giải khát, có tác dụng chống ăn mòn, tạo vẻ đẹp không độc hại.
Sn dùng chế tạo hợp kim có to thấp, chống ăn mòn... nc
IV. Điều chế: Sn được sản xuất từ quặng Tin (IV) Oxide. SnO + C So t n
+ CO (hoặc điện phân) 2 2 51
- Antimony đã được biết đến từ thời cổ đại. Nicolas Lémery, nhà hóa học
Sb người Pháp, là người đầu tiên nghiên cứu khoa học về Antimony và các
Antimony hợp chất của nó. Ông công bố phát hiện của mình vào năm 1707. 122
- Hóa trị: III, V … NTK: Sb = 122 đvC
I. TCVL: Chất rắn, màu trắng bạc, dẫn điện, nhiệt kém.
t = 630,6oC, t = 1587oC, d = 6,697 g/cm3. nc s II. TCHH
- Antimony bền trong không khí ở nhiệt độ phòng, nhưng phản
Biểu tượng là Con mắt của Horus,
ứng với oxygen nếu đun nóng để tạo ra Sb O . 2 3
một biểu tượng của Ai Cập cổ đại
- Sb cũng phản ứng với các Acid và các halogen theo phản ứng
về sự bảo vệ, quyền lực hoàng gia oxi hóa-khử
và sức khỏe tốt. Người Ai Cập cổ III. Ứng dụng - Antimony được sử d đạ ụn i sg ngày cà ử dụng ng A n nt hiiề m u tron ony g s c ul ôfing d n e ghiệp như bán dẫn để
sản xuất các Diode, các thiết mbị ột p l há oạt i hiệ m n as b c ằ a ng
ra . tia hồng ngoại và các
thiết bị dùng hiệu ứng Hall.
- Hợp kim Sb làm tăng đáng kể độ cứng và độ bền cơ học của Lead để
làm các loại ắc quy, vật liệu chống cháy, sơn, men, thủy tinh và đồ gốm.
- Thời cổ đại, hợp chất của Sb được sử dụng để vẽ lông mày và lông mi
IV. Điều chế: Antimony đôi khi được tìm thấy ở dạng tự nhiên nhưng
chủ yếu được khai thác từ khoáng vật sulfide stibnit (Sb S ). 2 3 52
- Tellurium được phát hiện bởi Franz Joseph Müller von Reichenstein Te
vào năm 1783. Tên có nguồn gốc từ tiếng Latin 'Telluriums', có nghĩa là
Tellurium Trái đất. 128
- Hóa trị: II, IV, VI … NTK: Te = 128 đvC
I. TCVL: Chất rắn, màu trắng bạc với ánh kim loại,
độ dẫn điện tăng nhẹ khi tiếp xúc với ánh sáng.
t = 449,5oC, t = 988oC, d = 6,24 g/cm3. nc s
Hình cầu giống Trái đất II. TCHH
trong ảnh phản ánh nguồn - Tellurium là nguyên tố phi g k ố icm t yế ê u n c (á ủa kim) có nguyê tín n t h ch ố, s ấ a t u hóa
học tương tự với Oxygen, Sulfur và Selenium.
'Tellus', từ tiếng Latinh có III. Ứng dụng nghĩa là Trái đất. -
Tellurium chủ yếu được sử dụng là luyện kim trong các
hợp kim Iron, thép không gỉ, đồng và chì. Ngoài ra, Te còn
được sử dụng để tạo màu cho thủy tinh và gốm sứ … -
Hợp kim (Cd-Te) để sản xuất pin mặt trời có hiệu suất sinh điện cao.
IV. Điều chế: Nguồn thu Tellurium chủ yếu từ bùn dính tại các điện
cực anot trong lúc điện phân tinh lọc các xốp đồng. Xử lý 500 tấn
quặng đồng thu hồi được 0,45 kg Tellurium. 53
- Iodine(có nghĩa là "tím") được phát hiện trong rong biển bởi nhà hóa học I
người Pháp Bernard Courtois vào năm 1811. Tên có nguồn gốc từ tiếng Hy
Iodine Lạp 'iodes' có nghĩa là màu tím. 127
- Hóa trị: I,... NTK: Br= 127u PTK: I = 254u 2
I. TCVL: Chất rắn, màu tím xám, thăng hoa ở nhiệt độ
thường tạo ra khí có màu tím hồng, rất độc.
t = 114oC, t = 184oC. d = 4,9 g/cm3. nc s
II. TCHH (I là phi kim có tính Hì oxi hóa, nh ả k nh l hử à c và ủa hoạt động h rong biể ó n a. học trung bình) 2 o t
1. I tác dụng với H → HI Nhiều l oài r I + ong biH ể n có 2HI 2 2 2 2 o t
2. Br tác dụng với kim loại → Mu c ối hứa I odi I ne . + Fe F e I 2 o 2 2 t 3I + 2Al 2A l I 2 3
3. Một số phản ứng đặc biệt: Iot kết hợp với hồ tinh bột cho hợp
chất màu xanh. Vì vậy, dùng I để nhận biết hồ tinh bột và ngược lại. 2
III. Ứng dụng: Ngày nay, Iodine có nhiều công dụng thương mại. Muối Iodine được sử
dụng trong dược phẩm và chất khử trùng, mực in và thuốc nhuộm, chất xúc tác, chất bổ
sung thức ăn chăn nuôi và hóa chất nhiếp ảnh. Iodine cũng được sử dụng để làm bộ lọc
phân cực cho màn hình LCD.
- Muối ăn I ốt có chứa một lượng nhỏ Iodine dưới dạng KI/KIO .3
IV. Điều chế: Nguồn chính điều chế I là NaI từ rong biển. 2 2NaI + Cl 2NaCl + I 2 2 video 54
Xenon được phát hiện bởi nhà hóa học người Scotland, William Ramsay Xe
và nhà hóa học người Anh, Morris William Travers vào năm 1898. Tên Xenon
có nguồn gốc từ tiếng Hy Lạp 'xenos' có nghĩa là người lạ. 131
- Hóa trị: - NTK: Xe = 131đvC
I. TCVL: Chất khí, không màu, không mùi, không tan trong nước. t = -111,8oC, t = -108,1oC nc s II. TCHH
Biểu tượng 'đèn flash điện tử'
- Xenon thuộc nhóm khí hiếm(khí trơ) thường tồn tại ở dạng đơn nguyên tử.
phản ánh việc sử dụng khí Xenon
- Trong thực tế xenon nói riêng và các nguyên tố nhóm VIIIA nói chung rất khó tham gia các phản ứng h t óa học.
rong công nghệ đèn flash máy
ảnh. Đây thường là một ống chứa III. Ứng dụng
đầy khí xenon với các điện cực ở
- Xenon được dùng rộng rãi nhất và nổi tiếng nhất trong các thiết bị phát ra ánh
mỗi đầu và một tấm kích hoạt kim
sáng gọi là các đèn chớp xenon, được sử dụng trong các đèn chớp của máy
ảnh. Ánh sáng phát ra từ đèn xe l no oạni cũng ở giữđaược sử
ống. dụng để diệt vi khuẩn và cung
cấp năng lượng cho tia laze ruby.
- Trong y tế được sử dụng như là chất gây mê toàn phần. Cho phép Chụp cộng hưởng từ MRI. IV. Điều chế
- Xenon được sản xuất từ không khí siêu lạnh trong
chưng cất phân đoạn không khí lỏng. 55
- Cesium được phát hiện bởi hai nhà khoa học người Đức Robert Wilhelm Cs
Bunsen và Gustav Robert Kirchhoff vào năm 1860. Tên bắt nguồn từ tiếng
Cesium Latinh caesius có nghĩa là "màu xanh da trời". 133
- Hóa trị: I NTK: Cs = 133đvC
I. TCVL: Chất rắn, màu vàng ngà, là kim loại mềm nhất,
tan(pư) trong nước. t = 29oC, t = 690oC, d = 1,90 g/cm3. nc s
II. TCHH (Cs là kim loại hoạt đ Bi ộ ể ng
u t / có tính kh
ượng phả ử m n á ạ n n
h hv n i h ệ ấ c t)
1. Cs tác dụng với O → Oxid s e 4 ử dụng nguyê Cs n t + ố t O r → ong 2Cs O 2 2 2
2. Cs tác dụng với phi kim(khác O ) → Muố
đồng hồ nguyê in t 2Cs ử c + C ó độ l → 2CsCl 2 2 chính xác cao.
3. Cs tác dụng với nước → dd Base + H ↑ 2Cs + 2H O → 2CsOH + H ↑ 2 2 2
4. Cs tác dụng với dd Acid → Muối + H ↑ 2Cs + 2HCl → 2CsCl + H ↑ 2 2
5. Cs tác dụng với dd Muối → Base + Muối + H ↑ 2 III. Ứng dụng:
- Việc sử dụng phổ biến nhất cho các hợp chất Cs là làm dung dịch khoan.
- Một trong những ứng dụng quan trọng nhất của Cs là đồng hồ nguyên tử. Đây là
một phần quan trọng của mạng internet và điện thoại di động, cũng như các vệ tinh
của Hệ thống Định vị Toàn cầu (GPS). Một số đồng hồ Cs có độ chính xác đến 1 giây trong 15 triệu năm.
IV. Điều chế: Điện phân nóng chảy hợp chất của Cs(theo lí thuyết). 2CsCl 2Cs + dp C nc l ↑ 2 56
- Barium được cô lập bởi nhà hóa học người Anh Sir Humphry Davy vào Ba
năm 1808. Cái tên này xuất phát từ tiếng Hy Lạp 'barys', có nghĩa là nặng. Barium 137
- Hóa trị: II NTK: Ba = 137đvC PTK: -
I. TCVL: Chất rắn, màu bạc xám, mềm, tan(pư) trong nước,
là nguyên tố có độc tính, t = 727oC, t = 1897oC, d = 3,51 g/cm3. nc s
II. TCHH (Ba là nguyên tố kim l H o ì ại ho nh ả ạt động nh dựa hó t a rê học m n phi ạnh m )
1. Ba tác dụng với O → Oxi c d h e ụp X-quang2 B d a ạ + dà O → y và 2BaO 2 2
2. Ba tác dụng với phi kim(
rkuhá ột c O củ ) a → bệ Muối nh nhâ Ba + n đư C ợ lc → BaCl 2 2 2
3. Ba tác dụng với nước → c dd Base + ho dùng ' H ↑ bữa B ă a n + 2 Ba H ri O um '→ . Ba(OH) + H ↑ 2 2 2 2
4. Ba tác dụng với dd Acid → Muối + H ↑ Ba + 2HCl → BaCl + H ↑ 2 2 2
5. Ba tác dụng với dd Muối → Base + Muối + H ↑ 2 III. Ba Ứn+g C d u ụ SO
ng: + 2H O → Cu(OH) ↓ + BaSO ↓ + H ↑ 4 2 2 4 2
- Hầu hết Barium được sử dụng trong dung dịch khoan cho các giếng dầu khí.
- BaSO được sử dụng trong sản xuất sơn, thủy tinh và chẩn đoán bằng tia X. 4
- Ba(NO ) được sử dụng để tạo màu xanh lá cây trong sản xuất pháo hoa. 3 2
- BaCl còn được sử dụng để trừ sâu bệnh trong nông nghiệp vì độc tính cao của nó. 2
IV. Điều chế: Điện phân nóng chảy hợp chất của Ba. BaCl B dp a nc + C l ↑ 2 2 57
- Lanthanum được nhà hóa học người Thụy Điển Carl Gustav
La Mosander phát hiện năm 1839. Tên có nguồn gốc từ tiếng Hy
Lanthanum Lạp 'Lanthanein', có nghĩa là nằm ẩn nấp. 139
- Hóa trị: III, ... NTK: La = 139 đvC
I. TCVL: Chất rắn, trắng bạc, dễ uốn, dẻo và đủ mềm để
cắt bằng dao. t = 920oC, t = 3464oC, d = 6,16 g/cm3. nc s II. TCHH
Hình ảnh của một ống kính
- Lanthanum là kim loại phản ứng mạnh nhất trong số các kim loại
máy ảnh. Lanthanum được
đất hiếm. Nó bị oxy hóa nhanh chóng khi tiếp xúc với không khí.
La phản ứng trực tiếp vớ t i hêngu m yê vàn tố o t phi hủ ki y t m i khác, nh đư n ợ ưcớ c s v ử à Acid.
dụng trong một số ống kính III. Ứng dụng
máy ảnh để cải thiện độ rõ nét
- Lanthanum được sử dụng với số lượng lớn trong pin sạc Nickel metal hydride (NiMH) cho ô tô hybr c id ủa hoặ hì c đèn nh ả hồ qua nh màng Ca nó crbon ó t sử hể t dụn ạo g trong điện ảnh. - La O được dùng chế ra . tạo C ácá c c loại kí ngọn l nh ửa qu t ang học rong nề đặ
n c biệt, như: Kính hấp thụ 2 3
tia hồng ngoại; Các thấu phả kính n á cho nh m ca ứ m c era và độ dễ kính dà thiên ng m v
à ăn, do có chiết suất cao và độ tán sắc thấp
nguyên tố cháy khi bắt lửa.
- Hợp kim Mischmetal được sử dụng làm đá lửa chứa khoảng 25% La.
IV. Điều chế: Lanthanum có thể được tạo ra bằng cách khử muối Lanthanum
Fluoride/chloride khan bằng kim loại mạnh hoặc điện phân nóng chảy. LaCl + 3Li 3LiCl o t + La 3 58
- Cerium được phát hiện bởi hai nhà hóa học Thụy Điển Jöns Jakob
Ce Berzelius và Wilhelm Hisinger năm 1803. Cerium được đặt tên cho tiểu
Cerium hành tinh, Ceres (tên của nữ thần nông nghiệp La Mã). 140
- Hóa trị: III, IV ... NTK: Ce = 140 đvC
I. TCVL: Chất rắn, trắng bạc, dễ uốn, dẻo.
t = 795oC, t = 3443oC, d = 6,77 g/cm3. nc s II. TCHH
- Cerium bị oxy hóa nhanh c Hìhóng nh ảkhi tiếp xúc nh dựa t vớ rê i n t không iể khí u hà , nh phản
ứng trực tiếp với nguyên ttố i phi kim nh Cer k e há s c , s, anướ u đc,ó A ncid gu và y ê kiề n t m. ố III. Ứng dụng
được đặt tên. Bối cảnh dựa
- Cerium được sử dụng với t số rê lượ n bảng lớn n đồ ttro hi n ê g côn n vă g n n đ g ầ hi u ệp luyện kim
để tạo ra các hợp kim đặc biệt. thế kỷ 17.
- Hợp kim Mischmetal được sử dụng làm đá lửa chứa khoảng 55% Ce.
- Cerium (Ill) Oxide được sử dụng như một chất xúc tác. Nó được sử dụng bên
trong của lò nướng tự làm sạch để ngăn chặn sự tích tụ của cặn nấu ăn.
- Các phụ gia Cerium(IV) vào nhiên liệu diesel làm cho chúng cháy hoàn toàn
hơn, giảm gây ô nhiễm môi trường
IV. Điều chế: Cerium kim loại được điều chế bằng các kỹ thuật khử nhiệt
kim loại, chẳng hạn như khử Cerium Fluoride bằng Calcium, hoặc sử
dụng điện phân Cerium chloride nóng chảy, … CeF + 2Ca 2Ca o F t + Ce 4 2
- Praseodymium được phát hiện bởi nhà hóa học người Áo Carl Auer 59
vào năm 1885. Tên có nguồn gốc từ tiếng Hy Lạp 'prasios didymos' có
Pr nghĩa là cặp song sinh màu xanh lá cây.
Praseodymium - Hóa trị: III, IV ... NTK: Pr = 141 đvC 140
I. TCVL: Chất rắn, trắng bạc, mềm, dễ uốn..
t = 935oC, t = 3520oC, d = 6,77 g/cm3. nc s II. TCHH - Praseodymium Bi b ể ị o u txy hóa nha ượng nà nh y t chóng khi tiếp hường được x s úc với k ử dụng hông khí, phản ứng trự c c tiếp v ho dấ ới n u hi gu ệu y ê sin tố nh tphi kim rong c khá hiê c, m n t ư i ớc, nh Acid.
III. Ứng dụng của Gemini ('cặp song sinh'). Màu
- Công dụng chính của Praseodymium là tạo hợp kim với Magnesium
xanh lá cây, cùng với biểu tượng này,
có độ bền cao được sử dụng trong động cơ máy bay.
phản ánh nguồn gốc tên của nguyên
- Praseodymium là một thành phần của Didymium kính (kính an toàn), được sử
tố, từ 'prasinos' trong tiếng Hy Lạp, có
dụng để làm cho một số loại thợ hàn, rèn và thợ thổi thủy tinh. - Muối Praseodymi nghĩum a l đượ à ' c xa sử dụn nh lá g câđể y' ,t ạo và m ' à d u i cho dym kính, os' , cme ó n và đồ tráng men có màu vàng đậm nghĩa là 'sinh đôi'.
IV. Điều chế: Praseodymium kim loại được điều chế bằng các kỹ thuật
khử nhiệt kim loại, chẳng hạn như khử Cerium Fluoride bằng Calcium
hoặc khử Oxide của Pr, … PrF + 2Ca 2CaFo t + Pr 4 2 60
- Neodymium được phát hiện bởi nhà hóa học Thụy Điển
Nd Carl Gustav Mosander vào năm 1841 và nguồn gốc từ
Neodymium tiếng Hy Lạp 'neos didymos' có nghĩa là cặp song sinh mới. 144
- Hóa trị: III, IV ... NTK: Nd = 144 đvC
I. TCVL: Chất rắn, trắng bạc.
t = 1024oC, t = 3074oC, d = 7,01 g/cm3. nc s II. TCHH
- Neodymium bị oxy hóa nhanh chóng khi tiếp xúc với không khí,
Hình ảnh và biểu tượng được
phản ứng trực tiếp với nguyên tố phi kim khác, nước, Acid.
sử dụng ở đây phản ánh việc III. Ứng dụng sử dụng Neodymium trong
- Ứng dụng quan trọng nhất của Neodymium là trong một hợp kim với Iron và boron
sản xuất thủy tinh màu tím.
để làm nam châm vĩnh cửu rất mạnh.
- Neodymium là một thành phần, cùng với Praseodymium, của thủy tinh didymium..
- Thủy tinh Neodymium được sử dụng để chế tạo tia laser. Chúng được sử dụng như
con trỏ laser, cũng như trong phẫu thuật mắt, phẫu thuật thẩm mỹ và điều trị ung thư
da... Muối Neodymium cũng được dùng làm chất tạo màu cho men.
IV. Điều chế: Neodymium kim loại được bằng cách tách muối Neodymium
khỏi các đất hiếm khác bằng kỹ thuật trao đổi ion hoặc chiết xuất bằng dung
môi và bằng cách khử halogenua khan như NdF với Calcium kim loại. 3 2NdF + 3Ca 3Co t a F + 2Nd 3 2 61
- Promethium lần đầu tiên được sản xuất tại Phòng thí
Pm nghiệm Quốc gia Oak Ridge, Mỹ vào năm 1945 và đặt theo
Promethium tên của Prometheus trong thần thoại Hy Lạp, người đã đánh [145]
cắp lửa từ các vị thần và ban nó cho con người.
- Hóa trị: II, III, ... NTK: Pm = [147] đvC
Chỉ một lượng nhỏ Promethium được sản xuất hoặc
tách ra, do đó có rất ít thông tin về tính chất của nó. PmCl được sử dụng 3 làm nguồn sáng cho các I. TCVL
Hình ảnh dựa trên một cảnh trong m tín
ột hiệu trong nút nhiệt. - Chất rắn. t = 104 c 2o hiC ế , c t = bì 3 nh0 00o H C, y Lạ d = p c 7,26 ổ đạ ig/ . cm3 N . nc s ó mô tả thần II. TCHH
Atlas chứng kiến sự trừng phạt của Zeus
- Promethium có tính chất hóa học tương tự các nguyên tố họ Lanthanum.
đối với Prometheus. Prometheus bị xích
III. Ứng dụng vào một tảng đá trên đỉnh núi. Mỗi ngày - Hầu hết Prome mthi ộtum c chỉ on đạ đ i ượ bàc sử dụ ng xé ng xá c c aho m nh taục vàđí ăch n n gaghi n ên cứu. Một ít
Promethium được sử dụng trong pin nguyên tử chuyên dụng. Chúng có kích thước
anh ta, và mỗi đêm gan lại mọc trở lại. Vì
gần bằng một chiếc ghim vẽ và được sử dụng cho máy điều hòa nhịp tim, tên lửa
Prometheus là bất tử nên anh ta không thể
dẫn đường, Radiumo và "đồng hồ vũ trụ" để đo thời gian tồn tại của tia vũ trụ.
chết, nhưng anh ta đau khổ không ngừng.
IV. Điều chế: Promethium được sản xuất với
số lượng nhỏ bằng cách bắn phá các hạt nhân
nguyên tử nhẹ hơn bằng neutron trong các lò Prometheus?
phản ứng hạt nhân hoặc máy gia tốc hạt nhân. Prometheus Prome r the th us? Tr
T ong thần thoại iHy Lạp, Pro Pr metheus u có nghĩa ĩ là à "n " gười ibiế i t ttr t ước ớ tư t ơng la l i" i " là
l một tvị ịthần khổng lồ. Ông nổi titế i ng với ớ trí íth t ông minh và chín í h ông đã tạ t o ra lo
l ài ingười i(ban đầu là l những hìn ì h nhân â đất ấ sét tsau đó ông đã ã lé l n Zeus thổ
t i lilnh hồn vào những hìn ì h nhân đó) và chính í ông là l người igiú i p đỡ ỡ rất tnhiề i u ch c o con người ờ ,i là l người iđã ăn cắp ắ ngọn lử l a từ t th t ần Apolllo l và tr t ao a nó ch c o nhân loạ l i.i Zeus đã tr t ừng phạt ạ ông bằn
ằ g cách buộc ông vào một ttả t ng đá á để một tcon
đại ibàng ăn gan của ông hàng ngày, y nhưng lá
á gan cứ ban ngày bị ăn thì ìban đêm lạ l i t i á t i isin si h. Cuối icùng Prometh t eus đã ã được ợ Herac a le l s giả i i t i h t oát. Tr T ong tất ấ cả c các nhân vật ậ tr t ong th t ần ầ th t oại iHy Lạp, Promet e heus phải ilà l một t tr t ong những nhân vật q t uan tr t ọng nhất đ t ối v i ới k i hoa học. c Nguyên ê tố t hóa a học 61-Pr P ometh t iu i m được ợ đặt tthe t o tê t n của ông. 62
- Samarium được phát hiện vào năm 1879 bởi nhà hóa học Paul-Émile
Sm Lecoq de Boisbaudran người Pháp và được đặt tên theo khoáng chất Samarium
samarskite (đặt theo tên Đại tá Vassili Samarsky-Bykhovets người Nga, do 150
đó Sm là nguyên tố hóa học đầu tiên đặt theo tên một người).
- Hóa trị: II, III ... NTK: Sm = 150 đvC
I. TCVL: Chất rắn, trắng bạc, cứng.
t = 1072oC, t = 1900oC, d = 7,52 g/cm3. nc s II. TCHH
Khoáng chất samarskite, nơi mà
- Samarium bị oxy hóa S n a ha m n a h ri chó um n lgầ khi t n đầiếp u t x i úc ê với kh n được ông k phâ h n í,
phản ứng trực tiếp với nguyên tố phi kim khác, nước, Acid.
lập, được đặt theo tên của Đại tá III. Ứng dụng
Samarsky, một quan chức mỏ
- Các nam châm Samarium-Cobalt (SmCo and Sm Co ) được sử dụng làm vật liệu 5 2 17
người Nga. Búa, liềm và ngôi sao
chế tạo nam châm vĩnh cửu do có độ kháng khử từ cao. Các nam châm này sử dụng
của Liên Xô nằm trên nền phản
cho đầu đọc từ chất lượng cao cho các tai nghe, ghi-ta, các nhạc cụ khác và ứng dụng
trong các động cơ điện c á ủa má nh vi y ệ cba s yử Solar Challeng dụng nguyê er. n tố này
- Oxide Samarium cũng được sửt d r ụn on g g ttrion a lg
a tzheủ.y tinh quang học để hấp thụ bức xạ
hồng ngoại cũng như để pha tạp tinh thể Calcium Fluoride trong laser quang học.
IV. Điều chế: Samarium kim loại được sản xuất bằng cách tách muối
Samarium khỏi các đất hiếm khác bằng kỹ thuật trao đổi ion hoặc chiết xuất
bằng dung môi. Sau đó, điện phân nóng chảy hoặc khử Oxide với Ba. 63
- Europium được phát hiện bởi nhà hóa học Pháp vào năm 1896 Eugène- Eu
Antole Demarçay vào năm 1901. Europium được đặt tên theo Châu Âu.
Europium - Hóa trị: II, III ... NTK: Eu= 152 đvC 152
I. TCVL: Chất rắn, trắng bạc, mềm.
t = 826oC, t = 1529oC, d = 5,24 g/cm3. nc s II. TCHH
- Europium là kim loại hoạt động Thi h ế óa t học kế d mạ ựa nh, tr ê bị n o l xy á c hóa ờ nhanh
chóng khi tiếp xúc với không khí, phản ứng trực tiếp với nguyên tố
và biểu tượng tiền tệ của
phi kim khác, tác dụng mạnh với nước(như Ca), Acid. Liên minh Châu Âu. III. Ứng dụng
- Các ứng dụng thương mại cho Europium rất ít và khá chuyên biệt. Nó từng được sử
dụng làm chất kích thích cho một số loại thủy tinh, nhựa để làm laser.
- Europium được sử dụng trong việc in tiền giấy Euro. Nó phát sáng màu đỏ dưới ánh
sáng UV và có thể được phát hiện khi thiếu ánh sáng đỏ này.
- Europium rất tốt trong việc hấp thụ neutron, làm cho nó có giá trị trong các thanh
điều khiển cho các lò phản ứng hạt nhân.
IV. Điều chế: Europium kim loại được sản xuất bằng cách tách muối
Europium khỏi các đất hiếm khác. Sau đó, điện phân nóng chảy hoặc
Ảnh chìm phát sáng dưới tia UV khử Oxide với Lanthan Ảnum h tron chìg ch m ân p kh h ô á n t g . sáng dưới tia UV 64
- Gadolinium được phát hiện bởi nhà hóa học người Thụy Sĩ Jean-Charles
Gd Galliumssard de Marignac vào năm 1886 và được đặt tên theo nhà hóa học
Gadolinium Johan Gadolin. 157
- Hóa trị: III, ... NTK: Gd = 157 đvC
I. TCVL: Chất rắn, trắng bạc, mềm, dễ uốn.
t = 1312oC, t = 3000oC, d = 7,90 g/cm3. nc s II. TCHH
- Gadolinium bị oxy hóa nhan Hìh chó nh ả ng khi t nh phảiếp n á xúc vớ nh vi iệ k c hsông ử
khí, phản ứng trực tiếp với nguyên tố phi dụng nguyê ki n m t k ố thác, ron tgá c d m ụ à n n g với nước, Acid. hình tivi trong quá khứ. III. Ứng dụng
- Chỉ cần 1% Gadolinium có thể cải thiện tính chất cơ học, hóa học của hợp kim Iron
và Chromium. Nó cũng được sử dụng trong hợp kim để chế tạo nam châm, linh kiện
điện tử và đĩa lưu trữ dữ liệu.
- Các hợp chất của nó rất hữu ích trong chụp cộng hưởng từ (MRI), đặc biệt là chẩn đoán các khối u ung thư.
- Gadolinium rất tốt trong việc hấp thụ neutron, và do đó MR M I R ?
nó được sử dụng trong lõi của các lò phản ứng hạt nhân.
IV. Điều chế: Gadolinium kim loại được sản xuất
bằng cách trao đổi ion và chiết xuất dung môi từ các
khoáng chất. Hoặc khử muối GdF khan với Ca. 3 MRI R ? I Cộn C g ộn hưởng ở từ hạt hạ nhân nhâ MR M I R (c ( òn ò gọi là à ch c ụ h p em e - m rai r theo he viế vi t ế tắt ắ tiế i ng ế Anh A nh của c ủa Magn M e agn t e ic c Re R s e on s an on ce c e Im I agi a ng) là à một ột kỹ thuật huậ ttạo ạ hình n cắ c t ắ lớp p sử s dụng dụng sóng só từ trườ r ng và và sóng só Ra R d a i d umo. Khi K cá c c á c nguyê n n guyê n tử hydroge hydr n oge trong ong cơ c thể h ể người ngườ dưới itác á c động độn của c ủa từ trường ng và và sóng s óng Ra R di a umo, um hấp hấ thụ và và phóng phón thíc hí h c năn nă g n lượng RF R . F Quá Q uá trình ì phóng phó thíc hí h c này nà được c má m y á thu hu nhận, nhậ xử lý ý và và chuyể c n huyể n đổi cá c c á c tín í hiệu ệ thà t nh hà hình hì ảnh. ả Hì H nh n ảnh ả cộn c g ộn hưởng từ t MR M I R Icó c độ tư t ơng n phản phả n ca c o, a sắ s c ắ c nét né và và rõ õ ràng à , ng chi c tiết ế ,t giải ả phẫu phẫ t u ốt và và có c ó khả khả năng nă t ng ái á tạo ạ 3D 3 D mang a ng lại ạ hiệu ệ u quả quả chẩ c n hẩ đoá đ n oá cho c bá b c á c sĩ sĩ đối với vớ bệnh bệ lý củ c a ủ a bệnh bệ nhâ nh n. n T r T ong o rất ấ nhiều ề u trường ng hợp, hiệ hi u ệ quả quả chẩ c n hẩ n đoá đ n oá của c ủa MR M I R Itốt hơn hơ rất ấ t nhiề nhi u ề so s với si s êu ê u âm â , chụp c hụp X- X qua qu ng a hay ha ch c ụp h cắ c t ắ lớp ớ CT C , T ... Bê B n ê cạ c nh ạ nh đó cộng c ộng hưở h ng từ MR M I R Ikhông sử s dụng dụ tia a xạ x , r ất ấ an a toà o n, à nên nê được đượ c á c c c bác bá c sĩ s chuy c ê huy n ê môn ôn đánh đá giá gi á ca c o a trong o chỉ c đị đ nh chụ c p hụ và và chẩ c n hẩ đoá đ n oá bệnh bệ . nh 65
- nguyên tố được nhà hóa học người Thụy Điển là Carl Gustaf Mosander Te
phát hiện năm 1843 và được đặt theo tên của làng Ytterby, Thụy Điển.
Terbium - Hóa trị: III, ... NTK: Tb = 159 đvC 159
I. TCVL: Chất rắn, xám bạc, mềm, dễ uốn.
t = 1356oC, t = 3123oC, d = 8,23 g/cm3. nc s II. TCHH
Ký hiệu đĩa compact được trừu
- Terbium bị oxy hóa khti tiếp xúc v ượng hóaới kh phảôn n g á khí, p nh vi hả ệc n ứ sửn g trực
tiếp với nguyên tố phi kim khác, tác dụng nguyê dụ n t ng vớ ố nà i nư y tr ớc, Ac ong viid ệ .c III. Ứng dụng
sản xuất những chiếc đĩa - Terbium được sử dụn c g đ om ể p pa h c a t tạ đầp m u tiộêt số n c lo ó tại t hể hiết ghi b lị ạở
i trạng thái rắn và cùng với
(ZrO ), làm chất ổn định tinh thể trong pin n
được. hiên liệu hoạt động ở nhiệt độ cao. 2
- Tb được sử dụng trong thiết bị truyền động, trong hệ thống sonar hải quân, cảm
biến , trong thiết bị SoundBug.
- Terbium(III) Oxide được sử dụng trong các chất phát quang màu xanh lục trong
các đèn huỳnh quang và màn hình thiết bị điện tử. - Muố Son S i T ar e : rb l ià đ ư mợc ột sử d kỹ ụtng t huậ rto n s g ử cá d c t ụnhi g ếts b ự ị lla a ze n .truyền uyề â m thanh (thườ hư ng n là dưới IV n . Đi ước ề)u đch ể
ể ết:ì T me rbium đư đường ợc di ccô lập huyểbằ n n , gl ik ê ỹ n th l u ạ ậ c t thra o o ặ cđ ổi io phá nt để hi t ệ ác n hc ác c đối tượ ư ng ng cá k c h áng c u ởy ê t n r ê tố n đ mất ặ thi , tếrm. H ong olặc đi òng ện ph nướcâ n nó hoặ n c g chả dướiy ha đá y y k n hử b ước ằ , ng C như a các c cá, tàu bè, , cá v c ậ m t t uố hể i tTbF rôi , T nổibCl . vật thể trôi 3 nổi 3 hoặc
hoặ chìm trong bùn cát đáy đá , v y .v , v . .v 66
- Dysprosium được nhà hóa học người Pháp Paul-Emile
Dy Lecoq de Boisbaudran phát hiện lại trong một mẫu
Dysprosium Holmium vào năm 1886 và cô lập vào năm 1906. 163
- Hóa trị: III, ... NTK: Dy = 163 đvC
I. TCVL: Chất rắn, xám bạc, đủ mềm để cắt bằng dao.
t = 1407oC, t = 2562oC, d = 8,54 g/cm3. nc s II. TCHH
Hình ảnh là một mô tả cách
- Dysprosium dễ bị oxy hóa khi tiếp xúc với không khí ẩm,
điệu của một lò phản ứng hạt
phản ứng trực tiếp với nguyên tố phi kim khác, tác dụng với nước, Acid.
nhân, phản ánh việc sử dụng III. Ứng dụng
nguyên tố trong các thanh điều
- Gốm kim loại Dysprosium-Oxide-Nickel được sử dụng trong các thanh điều khiển hấp khiển lò phản ứng.
thụ neutron trong lò phản ứng hạt nhân.
- Nam châm Nd–Fe–B có thể có tới 6% Nd được thay thế bằng Dy để nâng cao lực kháng
từ cho các ứng dụng đòi hỏi cao, chẳng hạn như động cơ truyền động cho xe điện và máy phát điện cho tuabin gió.
- Dy được sử dụng, kết hợp với Vanadium và các nguyên tố khác để chế tạo vật liệu laser.
IV. Điều chế: Dysprosium được cô lập bằng kỹ thuật trao đổi ion để tách
các nguyên tố đất hiếm. Hoặc khử bằng Ca/Li các muối DyF , DyCl . 3 3 2DyF + 3Ca o t 3CaF + 2Dy 3 2 67
- Holmium được phát hiện bởi nhà hóa học người Thụy Điển Per Theodor
Ho Cleve vào năm 1879 và độc lập bởi Marc Delafontaine và Louis Soret ở Holmium
Thụy Sĩ. Tên nguyên tố có nguồn gốc từ tên Latinh của thành phố Stockholm, 165
'Holmia‘. - Hóa trị: III NTK: Ho = 165 đvC
I. TCVL: Chất rắn, màu trắng bạc, mềm dễ uốn và
là nguyên tố có độ từ tính cao nhất.
t = 1461oC, t = 2600oC, d = 8,80 g/cm3. nc s II. TCHH
- Holmium dễ bị oxy hóa khi tiếp xúc với không khí, phản ứng H v ì ới n nh ả hiề nh u n d gu ựa yê tr n ê t n ố qphi uố c huy kim khác, nước (to ca c o) ủa , A Stciod. ckholm, thành phố III. Ứng dụng
đặt tên cho nguyên tố này.
- Holmium có thể hấp thụ neutron, vì vậy nó được sử dụng trong
các lò phản ứng hạt nhân để kiểm soát phản ứng dây chuyền.
- Hợp kim Ho của nó được sử dụng trong một số nam châm hoặc sử dụng trong các ứng
dụng y tế, nha khoa, cáp quang và tiêu chuẩn hiệu chuẩn cho máy đo quang phổ.
- Việc mã hóa dữ liệu trên một nguyên tử Holmium bằng cách thay đổi trạng thái từ tính
của chúng là tiềm năng để chế tạo máy tính lượng tử.
IV. Điều chế: Holmium được cô lập bằng kỹ thuật trao đổi ion để tách
các nguyên tố đất hiếm. Hoặc khử bằng Ca các muối HoF , HoCl . 3 3 2HoF + 3Cao t 3CaF + 2Ho 3 2 68
- Erbium được phát hiện bởi bác sĩ phẫu thuật và nhà hóa học Thụy Điển Er
Carl-Gustav Mosander vào năm 1843 trong một mẫu Yttrium. Tên Erbium
nguyên tố bắt nguồn từ thị trấn Ytterby của Thụy Điển. 167 - Hóa trị: III NTK: Er = 167 đvC
I. TCVL: Chất rắn, màu trắng bạc, mềm, dễ uốn.
t = 1529oC, t = 2868oC, d = 9,07 g/cm3. nc s II. TCHH
Hình ảnh phản ánh việc
- Erbium dễ bị oxy hóa khi tiếp xúc với không
khí, phản ứng với nhiều n s gửuyên tố phi kim dụng nguyê n tố trong
khác, nước (to cao), Acid. sản xuất men hồng III. Ứng dụng trong gốm sứ.
- Các ứng dụng của Erbi rất đa dạng. Nó thường được
dùng làm bộ lọc ảnh và dùng làm phụ gia luyện kim.
- Sợi quang học hai tạp chất Er và Yb được dùng trong laser Er/Yb năng lượng cao có
khả năng như một bộ khuếch đại tín hiệu.
- Erbium được sử dụng để tạo màu hồng cho thủy tinh và đá quý giả. Oxide Erbium đôi
khi được sử dụng trong thủy tinh hấp thụ tia hồng ngoại như kính bảo hộ cho thợ hàn và
công nhân kim loại. Phẫu thuật laser Er dùng để loại bỏ vôi răng trong nha khoa.
IV. Điều chế: Erbium được cô lập bằng kỹ thuật trao đổi ion để tách
các nguyên tố đất hiếm. Hoặc khử bằng Ca các muối và Oxide. 2ErF + 3Ca o t 3CaF + 2Er 3 2 69
- Thulium được phát hiện vào năm 1879 bởi nhà hóa học người Thụy
Tm Điển Per Theodor Cleve trong một mẫu khoáng chất Erbium và được cô Thulium
lập bởi nhà hóa học người Mỹ Charles James vào năm 1911. 169 - Hóa trị: III NTK: Tm = 169 đvC
I. TCVL: Chất rắn, màu trắng bạc, mềm, dễ uốn.
t = 1545oC, t = 1950oC, d = 9,32 g/cm3. nc s II. TCHH Hình ảnh phản ánh
- Thulium dễ bị oxy hóa khi t niế g p x uồ ú nc v g ới ốc k chông ủa t ên
khí, phản ứng với nhiều nguyên tố phi kim
nguyên tố và gợi ý một
khác, nước (to cao), Acid.vùng xa xôi ở cực bắc III. Ứng dụng (Ultima Thule).
- Do giá kim loại tương đối cao, Thulium vẫn chưa có
nhiều ứng dụng thực tế.
- Đồng vị Thulium-170 được sử dụng để tạo ra một máy chụp X quang di động, nhẹ
dùng trong y tế. Thulium còn được sử dụng trong laser với các ứng dụng phẫu thuật.
- Bởi vì Thulium phát quang với màu xanh lam khi tiếp xúc với ánh sáng cực tím,
Thulium được đưa vào tiền giấy euro như một biện pháp chống hàng giả.
IV. Điều chế: Thulium được cô lập bằng kỹ thuật trao đổi ion để tách
các nguyên tố đất hiếm. Hoặc khử Oxide bằng Ca của . Tm O + 3Cao t 3CaO + 2Tm 2 3 70
- Ytterbium được phát hiện bởi nhà hóa học người Thụy Sĩ Jean-
Yb Charles Galissard de Marignac vào năm 1878 và được được đặt theo Ytterbium
tên của làng Ytterby, Thụy Điển. 173
- Hóa trị: II, III NTK: Yb = 173 đvC
I. TCVL: Chất rắn, màu trắng bạc lấp lánh, mềm,
dễ uốn. t = 824oC, t = 1196oC, d = 6,90 g/cm3. nc s II. TCHH Hình ảnh dựa trên
- Ytterbium dễ bị oxy hóa khi tiếp xúc với
không khí, phản ứng với nhiều nguyên những bức tố c ph hạ i m
kim khác, nước (to cao), Acid
khắ .c trên đá cổ của III. Ứng dụng Thụy Điển.
- Ytterbium đang bắt đầu tìm thấy nhiều cách sử dụng khác nhau như: trong các thiết
bị bộ nhớ, laser có thể điều chỉnh, tạo ra hợp kim cải thiện độ bền và các tính chất cơ
học khác của thép không gỉ. Nó cũng có thể được sử dụng như một chất xúc tác công
nghiệp thay thế các chất xúc tác khác được coi là quá độc hại và gây ô nhiễm.
IV. Điều chế: Ytterbium được cô lập bằng kỹ thuật trao đổi ion để tách các nguyên
tố đất hiếm. Hoặc khử oxide bằng Al của . Yb O + 2Ao t l Al O + 2Yb 2 3 2 3 Jean C an harles G s alissar G d alissar de d M arigna ign c ? Jean n Charles G s ali G ssar s d sar de d Marignac ? Jea e n Charl r es e Gali al ssard r de Marig i na n c (1817 – – 1894) là l một t nhà hóa học người
ờ Thụy Sĩ với i công tr t ình nghiê i n cứu về ề tr t ọng lư l ợng nguyên ê tử t và à các á nguyên tố t đất th iế i m đã dẫn ẫ đến việ i c c ông phát t hiện ệ ra Yttte t rbium vào năm 1878 và đồng phát thiệ i n ra Gadoliln i iu i m vào năm 1880. Ông được ợ co c i ilà l "m " ột ttr
t ong những nhà hóa học vĩ ĩđại icủa th t ế kỷ XIX", đặc biệ i t t tr t ong lĩ l n ĩ h vực hóa học vô cơ ơ và à được ợ tr
t ao Huân chương Davy năm 1888. Địa ị điể i m phòng th t í ínghiệ i m của ông tạ t i iĐại ihọc Gen e eva được c chỉ định là l một t địa ị dan a h hóa học lị l c ị h sử của a T hụy Sĩ.ĩ 71
- Lutetium được phát hiện bởi hai công trình nghiên cứu độc lập vào năm Lu
1907 của nhà khoa học người Pháp Georges Urbain và nhà hóa học Lutetium
người Mỹ Charles James. Tên nguyên tố bắt nguồn từ Lutetia, tên cổ của 175 thành phố Paris. - Hóa trị: III NTK: Lu = 175 đvC
I. TCVL: Chất rắn, màu trắng bạc, cứng.
t = 1652oC, t = 3042oC, d = 9,84 g/cm3. nc s II. TCHH
Hình ảnh dựa trên quốc
- Lutetium dễ bị oxy hóa khi tiếp xúc với không
khí, phản ứng với nhiều n huy c gu ủa yê t n hà tố phi kim nh phố P aris khác, nước (to cao), (tA ê cid. n Latinh 'Lutetia') đặt III. Ứng dụng tên cho nguyên tố này.
- Vì khó khăn trong sản xuất và giá thành cao, Lutetium có rất ít
ứng dụng thương mại, đặc biệt là vì nó hiếm hơn hầu hết các loại Lanthanum khác.
- Một trong số ít ứng dụng thương mại của Lu là chất xúc tác cracking Hydrocarbon
trong các nhà máy lọc dầu, xúc tác trong alkyl hóa, hydro hóa, và polime hóa.
- Lutetium-176 (176Lu) đã được dùng để định tuổi thiên thạch.
IV. Điều chế: Lutetium được cô lập bằng kỹ thuật trao đổi ion để tách các
nguyên tố đất hiếm. Hoặc khử bằng Ca các muối chloride hoặc Fluoride. 2LuCl + 3Cao t 3CaCl + 2Lu 3 2 72
- Hafnium được nhà hóa học Đan Mạch, Dirk Coster và nhà hóa học
Hf Hungary, Georg von Hevesy phát hiện năm 1923. Tên có nguồn gốc từ tên
Hafnium Latinh của Copenhagen, 'Hafnia' 179
- Hóa trị: II, VI... NTK: Hf = 179 đvC
I. TCVL: Chất rắn, xám bạc, bóng, dễ uốn, kháng ăn mòn.
t = 2233oC, t = 4603oC, d = 13,31 g/cm3. nc s II. TCHH
- Hf có tính chất hóa học thì tương tự như Zirconium.
Hình ảnh dựa trên quốc
- Hafnium không dễ phản ứng với Acid nhưng có thể bị oxy hóa bằng các halogen hoặc
có thể bị cháy trong Oxyge hu n. y công dân của thành III. Ứng dụng phố Copenhagen, đặt tên
- Hafnium được dùng làm c c ác thanh kiể ho nguyê m n tố này.
soát cho các lò phản ứng hạt nhân do khả năng hấp thụ neutron cao.
- Hafnium tạo siêu hợp kim với Fe, Ti.
Niobium, Tantalumi và các kim loại khác.
Hafnium Oxide được sử dụng làm chất
cách điện trong vi mạch, chip, …
IV. Điều chế: Khoảng một nửa tổng lượng Hafnium kim loại được sản xuất
được sản xuất như một sản phẩm phụ của quá trình tinh chế Zirconium. HfCl + 2Mg 2MgCo t l + Hf 4 2 73
- Tantalum được phát hiện bởi nhà hóa học và khoáng vật Ta
học người Thụy Điển Anders-Gustav Ekeberg vào năm Tantalum
1802. Tên này có nguồn gốc từ hình tượng huyền thoại Vua 181 Tantalus của Hy Lạp.
- Hóa trị: II, V... NTK: Ta = 181 đvC
I. TCVL: Chất rắn, màu xám, nặng và rất cứng.
t = 3017oC, t = 5458oC, d = 16,69 g/cm3. nc s II. TCHH
Hình ảnh hộp sọ người được trừu tượng
- Tantalum gần như trơ về mặt hóa học. Tantalum không phản ứng
hóa, có dải hoặc 'đĩa'. Điều này phản
hóa học với chất nào, ngay cả với nước cường toan và chỉ bị ăn mòn bởi Hydrofluoric acid.
ánh việc sử dụng nguyên tốnày trong
III. Ứng dụng các bộ phận giả trong y tế. Thiết kế nền
- Tantalum được sử dụng trong sản xuất các linh kiện điện tử, chủ yếu
dựa trên một cảnh trong một chiếc bình
là tụ điện và một số điện trở công suất cao được dùng nhiều trong
các điện thoại di động, H l y Lapt ạ op p c và đi ổ đạ ệin t mử c ô tủa ả ô tô… nhân vật thần
- Ta cũng đượct sử dụn hoại g Ta để nt s alản xu um ất us ,nhi li ề ê u loại n qua hợ n p đ k ế inm ncó gu đi ồ ểm n nóng
chảy, độ bền và độ dẻo cao. gốc tên của nguyên tố.
- Vì không phản ứng với các dung dịch trong cơ thể và không gây dị
ứng nên Tantalum được dùng nhiều để chế tạo dụng cụ phẫu thuật.
IV. Điều chế: Tantalum được sản xuất từ quặng Tantalite qua nhiều giai đoạn phức tạp. 74
- Tungsten còn gọi là wolfram lần đầu tiên được cô lập bởi
W các nhà hóa học Tây Ban Nha Fausto Elhuyar và Juan José Tungsten vào năm 1783. 184
- Hóa trị: II, VI... NTK: W = 184 đvC
I. TCVL: Chất rắn, màu xám bạc, giòn và cứng.
Là kim loại có nhiệt độ nóng chảy cao nhất. t = 3422oC, t = 5555oC, d = 19,25 g/cm3. nc s
II. TCHH (W hoạt động rất yếu, hầu hết không tham gia phản ứng hóa học)
Biểu tượng được sử dụng
Tungsten nguyên tố có khả năng chống ôxy hóa, Acid và kiềm.
phản ánh việc sử dụng phổ
III. Ứng dụng (W là một kim loại hiếm, quý có nhiều ứng dụng đa dạng.)
biến của nguyên tố trong
- Khoảng 60% lượng Tungsten của thế bóng đèn.
giới được sử dụng để sản xuất hợp kim cứng..
- Tungsten cũng được dùng trong làm điện cực.
- Hợp kim của Tungsten được dùng trong các
ứng dụng nhiệt độ cao: dây tóc bóng đèn sợi đốt,
thiết bị sưởi ấm, thiết bị nấu nướng, ....
- Một số phần xấu đã dùng W để làm vàng giả.
IV. Điều chế: Tungsten cũng có thể được tách ra bằng cách khử o Hydrogen của WF : WF + 3 H W t + 6 HF 6 6 2 75
- Rhenium được phát hiện bởi các nhà hóa học người Đức Ida Tacke,
Re Walter Noddack và Otto Carl Berg vào năm 1925. Tên này
Rhodium có nguồn gốc từ tên Latinh của sông Rhine, 'Rhenus'. 186
- Hóa trị: II, IV, VII … NTK: Re = 186 đvC
I. TCVL: Chất rắn, màu trắng bạc, có nhiệt độ nóng
chảy cao. t = 3186oC, t = 5596oC, d = 21,02 g/cm3. nc s II. TCHH
- Rhenium là một kim loại ho B ạitể độ u tng ư hóa học ợng dựa y tếu rê.n quốc
- Ở điều kiện thường, Re tương đối huy c trơ ủa về M m ai ặt nz hóa , t học, hủ phủ
khó phản ứng với các dung dịch c A ủacid. bang Rhineland- Palatinate của Đức. III. Ứng dụng
- Rhenium được bổ sung vào các siêu hợp kim chịu nhiệt độ cao sử dụng trong chế
tạo các bộ phận của động cơ phản lực.
- Ứng dụng lớn khác là trong các chất xúc tác Pt-Re, được sử dụng chủ yếu trong sản
xuất xăng có chỉ số octan cao và không chứa Lead.
IV. Điều chế: Rhenium thương mại được tách ra từ khí ống khói lò
nung Molybdenum thu được từ các quặng copper sulfide. Một số
quặng Molybdenum chứa 0,001% tới 0,2% Rhenium. 76
- Osmium được nhà hóa học người Anh Smithson Tennant phát hiện đồng
Os thời trong một quặng Platinum thô vào năm 1803.
Osmium - Hóa trị: II, IV, VIII … NTK: Os = 190 đvC 190
I. TCVL: Chất rắn, màu bạc ánh xanh, có nhiệt độ nóng
chảy cao, cứng, giòn và là kim loại có khối lượng riêng lớn nhất. t = II. 3 T 03 C 3o H C
H , t = 5012oC, d = 22,59 g/cm3. nc s
Hình ảnh gợi ý việc sử
- Osmium là một kim loại hoạt động hóa học yếu.
dụng nguyên tố này trong
- Ở điều kiện thường, Os tương đối trơ về mặt hóa học, khó phản
việc chế tạo ngòi bút chất
ứng với tất cả các Acid, bao gồm cả nước cường toan. lượng cao.
- Ở nhiệt độ cao, Os tác dụng được với các chất kiềm nung chảy. III. Ứng dụng
- Do tính dễ bay hơi và cực độc của Oxide của nó, Osmium hiếm khi được sử dụng ở trạng
thái nguyên chất, mà thay vào đó thường được hợp kim hóa với các kim loại khác cho các
ứng dụng có độ mài mòn cao.
- Hợp kim Osmium rất cứng được sử dụng trong các đầu bút máy, trụ bản lề dụng cụ và
các điểm tiếp xúc điện, vì chúng có thể chống mài mòn do hoạt động thường xuyên.
IV. Điều chế: Osmium thu được thương mại như một sản phẩm phụ
từ khai thác và chế biến Nickel và Cupper.
- Iridium được nhà hóa học người Anh, Smithson Tennant phát hiện đồng 77
Ir thời trong một quặng Platinum thô vào năm 1803. Tên có nguồn gốc từ nữ
Iridium thần cầu vồng của Hy Lạp, Iris. 192
- Hóa trị: III, IV, … NTK: Ir = 192 đvC
I. TCVL: Chất rắn, màu trắng ánh vàng, có nhiệt độ nóng
chảy cao, cứng, giòn và có khối lượng riêng lớn thứ 2(sau Os).
t = 2446oC, t = 4130oC, d = 22,56 g/cm3. nc s II. TCHH
Các muối Iridium có màu rất rực - Iridium là một kim lo r ạ ỡi ho . Đạt đ ôi ộ c ng á hóa học nh óng á yếu. nh của chuồn - Ir là kim loại có k chả năng huồn đạcihốn di g ệ ăn n c mò ho cn ả lớ n n g nh uồ ấ n t, g khô
ốc ng phản ứng với hầu
hết Acid, nước cường toan. Tuy nhiên, nó có thể phản ứng với một số muối nóng
tên gọi của nguyên tố và các loại
chảy như NaCN và KCN cũng như O và các halogen ở nhiệt độ cao. 2
muối có màu rực rỡ của nó. III. Ứng dụng
- Iridium có nhiều ứng dụng trong công nghiệp đặc thù và trong khoa học.
- Iridium được dùng với chức năng chống ăn mòn cao ở nhiệt độ cao như nồi nung,
các điện cực trong sản xuất Chlorine và máy phát nhiệt điện đồng vị phóng xạ. Các
hợp chất Ir cũng được dùng làm các chất xúc tác trong sản xuất Acetic acid. Trong
công nghiệp ôtô, Iridium được dùng làm bugi, la bàn, …
IV. Điều chế: Iridium thu được thương mại như một sản phẩm phụ
từ khai thác và chế biến Nickel và Cupper. 78
- Platinum "Bạch kim" được sử dụng bởi những người da đỏ trước
Pt Columbus ở Nam Mỹ cho đến khí các nhà khoa học chú ý vào năm 1735. Platinum
- Hóa trị: II, IV. NTK: Pt = 195đvC 195
I. TCVL: Chất rắn, trắng bạc sáng bóng, dẻo và dễ uốn.
t = 1768oC, t = 3825oC, d = 21,45 g/cm3. nc s
II. TCHH (Pt hoạt động rất yếu, hầu hết không tham gia phản ứng hóa học) Hình ảnh dựa trên chữ 1. Tác dụng với F
Pt + 2F PtF o t 2 2 4 viết của người Maya.
2. Tác dụng với nước cường toan, nước hoàng gia (HNO -HCl) 3 Người Maya s ử dụng bạ ch
Pt + 4HNO + 4HCl PtCl + 4NO↑ + 8H O 3 4 2 kim trong đồ trang sức.
III. Ứng dụng (Platinum là một kim loại quý)
- Platinum được sử dụng rộng rãi cho đồ trang sức. Tuy nhiên, ứng dụng chính của nó
là trong các bộ chuyển đổi xúc tác cho ô tô, xe tải và xe buýt, trang thiết bị phòng thí nghiệm, điện cực, …
- Các hợp chất bạch kim là loại thuốc hóa trị quan trọng được sử dụng để điều trị bệnh ung thư.
IV. Điều chế: Hiện nay, Pt được sản xuất
bằng phương pháp điện phân. 79
- Gold(Vàng) "Aurum" đã được biết đến và có giá trị cao trong thời tiền Au
sử, Au là nguyên tố kim loại quý được sử dụng làm bản vị cho nhiều tiền Gold
tệ trong lịch sử. Vàng như một biểu tượng cho sự thanh khiết, giá trị, sự
vương giả. (King, Queen, Lord, .....) 197
- Hóa trị: I, III. NTK: Au = 197đvC
I. TCVL: Chất rắn, ánh kim vàng, là kim loại dẻo nhất, dẫn điện, dẫn nh Tiệ r t o tố ng t. t hìn = 1 h ả 064o nh n C à , y , t = m ộ 2 t 85 bi 6o ểuC, t ư d ợ = 1 ng 9,3 giả g/cm3. nc s
kim thuật truyền thống của Gold. Nó
II. TCHH (Au hoạt động rất yếu, hầu hết không tham gia phản ứng hóa học)
cũng được sử dụng như một biểu tượ o ng 1. Tác dụng với F
2Au + 3F 2AuF t 2 2 3
mặt trời, và phần lớn thần thoại xung
2. Tác dụng với nước cường toan, nước hoàng gia (HNO -HCl)
quanh vàng liên quan đến mặt trời. Các 3 Au + HNO + nh 3 à H g Cl iả k im A t uC hu l ậ + t b aNO n đ↑ ầ + u b2H ị á O m ảnh bởi 3 3 2
III. Ứng dụng (G vàonld là g v m à ộ th te kim o đ lo uổ ại q i m uý o ) ng muốn biến đổi - Sử dụng làm phư ki ơ m n lg t oạiệi n c c ơ hu bảyể n n ( đ th ổi ư t ờ iền ng tệ là .Lead) thành - Gold và hợp kim củ Gold a G . Hìold d nh ả ùn nh g l tr àom đ ng ồ t nề rnang sứ dựa t cr.ên hình - Tiêm vàng giúp ả lnàm gi h tượ ảm ng đtrau v ưngà csưn ủa g 'p do hò th ngấp k thí hớp v ngh à iệ la m' o .
- Gold có thể được sản xuất m c ỏn ủa g tớ nhà i mứ giả c nó
kim.dường như trong suốt.
- Gold có thể được sử dụng trong thực phẩm và có số hiệu E 175.
IV. Điều chế: Hiện nay, Glod được sản xuất bằng phương pháp điện phân. 80
Hg - Mercury(Thủy ngân) "hydragyrum – nước bạc" được biết đến từ 3500TC
là nguyên tố kim loại duy nhất có dạng lỏng ở nhiệt độ thường. Tên được đặt
Mercury tên theo hành tinh Mercury (Thủy tinh). 207
- Hóa trị: I,II. NTK: Hg = 207đvC
I. TCVL: Chất lỏng ở điều kiện thường, ánh bạc.
Mercury rất độc, có thể gây chết người khi bị nhiễm độc qua
đường hô hấp. t = -38,8oC, t = 629,8oC, d = 13,5 g/cm3. nc s II. TCHH (Hg ho Hì ạt độ nh ả ng nh lrất à y m ếu, ột kh bi ó
ể ut ham tư gia ợn p g gihản ả kiứng
m hóa học nhưng lại dễ tạo hợp kim(hỗn hống H t g) vớ
huật i cnhiều ổ xư nguy a c ê ủa n t
Mốe: rAcu, u A ryg, C . Đ u â , A y l, Zn.... ) Hg có thể c tác dụ ũng l ng à v m ới ột S b ở i ểđuiề t u ư ki ợ ệ n n th g c ư hiờêng m , tniên khi nh vô ý làm vỡ nhiệt kế Mercury có th c ể rắc m ho hà ột í nh t ti bột S nh M lê e n rc hạt ury Hg, . R đợi một ồng hoặthờ
c i gian có thể dễ dàng thu gom
phần rắn lại để xử lí. Hg + S HgS (rắn)
rắn trong nền xuất phát từ các bản
III. Ứng dụng (Hg được sử dụng chủ yếu trong sản xuất các hóa chất,trong kỹ thuật
vẽ giả kim thời kỳ đầu và thường
điện và điện tử. Nó cũng được sử dụng trong một số nhiệt kế kiểu cũ)
được liên kết với nguyên tố.
- Hg được sử dụng trong cao áp "đèn hơi Thủy ngân" và một số đèn kiểu "đèn huỳnh quang". - Mercury dễ dàng B tạo thà óng đènh hợ n hơip k T im, được hủy ngâ g n ọi là hỗn hống, vớ Bóng đè i các n hơi k S im o diloại um khác
như Gold, bạc và Tin khiến Hg trở nên hữu ích trong việc thu hồi Gold từ quặng. - IH V. ỗ n Đi h ề ốn u c g h Me ế: Hrc g ury thu c ũ đ ng ượ c đư ợc bằn sử g c d ác ụn h đg t ốt r o n ng ón c g h c ất hu hà s n a ( ră H n g g S) . trong luồng
không khí và làm lạnh hơi thoát ra. HgS + O o t H g + SO 2 2 81
- Thallium được phát hiện bởi nhà vật lý và hóa học người Anh William
Tl Crookes vào năm 1861. Thallium có nguồn gốc từ tiếng Hy Lạp 'thallos', có
Thallium nghĩa là một cành cây xanh. 204
- Hóa trị: I, III NTK: Tl = 204 đvC
I. TCVL: Chất rắn, màu bạc trắng, rất mềm, dễ dát mỏng, có
thể cắt bằng dao, rất độc. t = 304oC, t = 1473oC, d = 11,85 nc s g/cm3 II. TCHH - Thallium là một H k ì im nh lảoại hoạt nh phả độn n á g hóa học khá m nh nguồn gốc ạ c nh ủa. - Thallium có thể tdễ ê dàng tác n nguyê d n ụtng v ố (t ới O ừ tiếxygen ng H tron y L g ạ k p hông khí hoặc với các phi k'i t m, ha d ll un os g ', d cịch Acid
ó nghĩ .a là 'chồi hoặc - Tl có thể được b c ả à o quả nh c n â bằn y xag cá nh' ch ), t ng í âm tro nh độc ng h ạdầ i u c lử ủa a hay dầu khoáng.
III. Ứng dụng: nó và việc sử dụng nó trong sản
- Hợp chất Thallium sulfat t xuấ ừ t ng kí được d nh phảùng n c là hi m ế t
u.huốc diệt chuột và côn trùng do rất
độc và không mùi, không vị. Tuy nhiên nó có thể ảnh hưởng đến sức khỏe con người
và đã bị cấm ở một số nước.
- Thallium được dùng trong chế tạo vật liệu siêu dẫn nhiệt độ cao cho các ứng dụng
như chụp cộng hưởng từ, sản xuất điện năng và truyền điện …
IV. Điều chế: Việc khai thác hơi phức tạp và phụ thuộc vào nguồn Thallium.
Tl có mặt trong quặng pyrite và được thu hồi từ quá sản xuất Sulfuric acid.
Tl cũng thu được từ quá trình nấu chảy quặng Lead và Zinc. 82
- Lead(Chì) (có nghĩa là "kim loại mềm") là nguyên tố từng được sử dụng Pb
phổ biến từ thời tiền sử. Lead
- Hóa trị: II, IV. NTK: Pb = 207đvC 207
I. TCVL: Chất rắn, trắng xanh, mềm, dễ uốn và nặng, có độc.
t =327oC, t = 1749oC, d = 11,3 g/cm3. nc s
Lead đã được con người biết đến
II. TCHH (Pb là kim loại hoạt động tương đối yếu)
và sử dụng trong nhiều thế kỷ.
1. Pb tác dụng với O → Oxide 2Pb + O o t 2PbO 2 2
Lịch sử lâu đời này được phản
2. Pb không tác dụng với Acid HCl và H SO
vì tạo kết tủa không tan bao bọc. 2 4 loãng
ánh trong hình ảnh bằng việc sử
3. Một số phản ứng đặc biệt. Pb + 2NaOH Na PbO + H 2 2 2
dụng một biểu tượng giả kim ban
3Pb + 8HNO 3Pb(NO ) + 2NO + 4H O 3 o 3 2 2 đầu cho c t hì
và chạm khắc các ký Pb + 2H SO PbSO + SO + 2H O 2 4 đặc 4 2 2 tự La Mã Cổ đại.
III. Ứng dụng: Hiện nay, Lead vẫn được sử dụng rộng rãi cho pin xe hơi, bột màu, đạn
dược, vỏ bọc cáp, tạ nâng, đai cân để lặn, thủy tinh pha lê chì, bảo vệ bức xạ và trong
một số chất hàn. Hợp kim Thiếc hàn: Sn-Pb.
- Lead là thành phần màu trong tráng men(son) màu đỏ và vàng. Tuy nhiên đã bị cấm, bị
thay thế hoặc không được khuyến khích vì Lead được biết là có hại cho sức khỏe.
IV. Điều chế: Pb thường được tìm thấy ở dạng quặng cùng
với Zinc, Silver, Cupper và được sản xuất cùng với các kim loại này. 83
- Bismuth được phát hiện bởi một nhà giả kim vô danh vào khoảng năm 1400
Bi sau công nguyên. Tuy nhiên, Bismuth thường bị nhầm lẫn với Lead, cho đến
Bismuth khi nhà hóa học người Pháp Claude-Francois Geoffroy đã chỉ ra rằng Bismuth 209
khác với Lead vào năm 1753.
- Hóa trị: III, V, … NTK: Bi = 209 đvC
I. TCVL: Chất rắn, màu trắng ánh hồng bạc, giòn và các
vết xỉn óng ánh nhiều màu. t = 271,5oC, t = 1564oC, d = 9,78 g/cm3 nc s II. TCHH
Hình ảnh bao gồm một ký
- Bismuth là một kim loại hoạt động hóa học trung bình.
hiệu giả kim được sử dụng
- Bi có thể tác dụng với F tạo ra hợp chất hóa trị V. Khi tác dụng 2
để đại diện cho nguyên tố.
với O , Cl , Br , H SO , HNO , … chỉ tạo ra hợp chất hóa trị III. 2 2 2 2 4 3
Phía sau là những bức vẽ về III. Ứng dụng:
nguồn gốc hóa học cổ đại.
- Hợp chất của Bismuth được sử dụng nhiều trong mỹ phẩm và y học:
Pepto-Bismol® được dùng làm thuốc chống bệnh tiêu chảy.
- Bismuth thường được trộn với các kim loại khác, chẳng hạn như
Lead, Tin, Iron hoặc Cadmium để tạo thành các hợp kim nóng chảy
thấp hoặc tạo thành Nam châm vĩnh cửu.
IV. Điều chế: Hầu hết Bismuth được sản xuất như một sản phẩm phụ
của các quá trình khai thác kim loại khác bao gồm nấu chảy Lead, cũng như Tungsten và Cupper. 84
- Polonium được phát hiện bởi nhà hóa học người Ba Lan Marie Sklodowska
Po Curie vào năm 1898. Nguyên tố được đặt tên là Polonium để ghi nhớ tổ quốc
Polonium của bà Marie (polinia trong tiếng Latinh). [209]
- Hóa trị: II, V, … NTK: Po = [209] đvC
I. TCVL: Chất rắn, màu xám, nguyên tố phóng xạ cực độc.
t = 254oC, t = 962oC, d = 9,12 g/cm3 nc s II. TCHH
Một hình ảnh dựa trên Luna E-1, tàu
- Polonium là một kim loại có tính chất tương tự Tellurium và
vũ trụ đầu tiên của chương trình Bismuth.
'Luna' của Liên Xô. Sau đó, tàu vũ
- Polonium tan dễ dàng trong Acid loãng nhưng chỉ tan
rất ít trong kiềmt.rụ Luna đã mang theo những chiếc
III. Ứng dụng:tàu lượn 'Lunokhod' lên mặt trăng.
- Đồng vị Po210 được dùng để làm nguồn hạt alpha.
Đây là những chiếc tàu lượn đầu tiên
- Polonium có thể được sử dụng để loại bỏ tĩnh điện trong máy móc gây ra bởi các quá trình như cuộn giấy khá , d m ây h pháoặc k bề im mặ lto ại m tặấtm t và ră sử d ng vàụng
đư trợocn g bàn chải để loại bỏ bụi
khỏi phim ảnh.cung cấp năng lượng bởi Polonium.
- Một gam Polonium sẽ đạt đến nhiệt độ 500°C do bức xạ alpha phát ra. Điều này làm
cho nó hữu ích như một nguồn năng lượng cho các thiết bị không gian.
IV. Điều chế: Polonium là một nguyên tố tự nhiên rất hiếm.
Có thể điều chế Po trong lò phản ứng nguyên tử (với lượng mg hoặc g)
khi bắn chùm neutron vào Bismuth. 85
- Astatine được tổng hợp lần đầu tiên là vào năm 1940 do Dale R. At
Corson, Kenneth Ross MacKenzie và Emilio G. Segrè thực hiện Astatine
tại Đại học California, Berkeley. [210] - Hóa trị: I, …
NTK: At = [210] đvC
I. Tính chất vật lí: (ước tính)
- Chất rắn, màu tối hoặc bóng
Hình ảnh dựa trên biểu
II. Tính chất hóa học: (ước tính)
tượng nguy hiểm bức xạ
- Astatine có tính chất hóa học giống các halogen khác, đặc biệt là Iodine.
quen thuộc và phản ánh bản III. Ứng dụng:
- Do một lượng nhỏ đượ c c sả hất n xuất và thời không ổn đị gia nh n v bá à n hủ phả y
n ngắn của nó, hiện tại
không có công dụng nào cho A ứ statin ng c e n ủa goài ngh nguyê iê n t n c
ố. ứu khoa học cơ bản.
IV. Điều chế: Astatine được tạo ra bằng cách bắn phá Bismuth bởi các hạt
anpha mạnh tạo ra các đồng vị có thời gian sống tương đối lâu 209At đến 211At, các
đồng vị này có thể được tách ra bằng cách nung nóng trong không khí. Emilio Gino S n e o S grè? Emilio Gino Se o S g e rè r ? Emi m lilo i Gin i o Segrè
r (01.2.1905 – 22.4.1989) là l nhà à vật ậ lý l học người ờ Mỹ đã cùng với icá
c c cộng sự khám phá ra Te T chnet e iu i m và Asta t titn i e. e Giá i o sư Em E iliilo Gin i o Se
S grè và Owen Chamberlai l n cù c ng dẫn đầu nhóm nghiê i n cứu ở ở Ph P òng th t í n í ghiệ i m bức xạ Lawrence c đề xuất v t iệc ệ thí t nghiệ i m để khám á phá ra hạt tphản proto t n và đây là
l nguyên nhân chủ yếu để ể xây â dựng máy á gia a tố t c hạt t tên ê Be B vatr t on ở ở Ph P òng th t í n í ghiệ i m bức xạ Lawrence c . Th àn à h công của a nghiên ê cứu này à giú i p hai n i gười icù c ng đoạt ạ giả i i iNobel lV ật tlý l năm 1959 cho cô c ng tr t ìn ì h của họ. 86
- Radon được nhà hóa học người Đức Friedrich Ernst Dorn phát hiện Rn
vào năm 1900 khi đang nghiên cứu chuỗi phân rã của Radium. Radon
- Hóa trị: - NTK: Rn = [222] đvC [222]
I. TCVL: Chất khí, không màu, không mùi, có khả năng
gây hại cho sức khỏe. t = -71,15oC, t = -61,85oC. nc s II. TCHH - Radon thuộc nhóm M kh ột í h hìiếm(k nh ả hí trơ) t nh dựa h tườ rê ng tồ n bi n ể tạ u t i ở dạn ượng g đơn nguyên tử.
quen thuộc của nguy hiểm bức xạ.
- Trong thực tế Radon nói riêng và các nguyên tố nhóm VIIIA nói
Hình ảnh nền phản ánh thực tế rằng
chung rất khó tham gia các phản ứng hóa học.
lượng Radon là một loại khí phóng xạ
III. Ứng dụng tự nhiên có thể được tìm thấy ở nồng
- Một lượng nhỏ Radon đôi khi được các bệnh viện sử dụng để điều trị một số dạng
độ cao trong môi trường bình thường,
ung thư, viêm khớp và bệnh hô hấp. Radon đã được sử dụng trong hạt cấy ghép,
chẳng hạn như nhà và nơi làm việc.
làm bằng vàng hoặc thủy tinh, chủ yếu được sử dụng để điều trị bệnh ung thư, được
gọi là liệu pháp điều trị não. IV. Điều chế -
Radon thu được dưới dạng sản phẩm phụ của quá trình chế biến quặng Uranium. 87
- Francium được nhà hóa học người Pháp Marguerite Catherine Perey phát Fr
hiện vào năm 1939. Francium được đặt theo tên của nước Pháp.
Francium - Hóa trị: I NTK: Fr = [223]đvC [223]
I. TCVL: Nghiên cứu một khối lượng lớn Francium chưa bao giờ được thực hiện
nên chưa có thông tin về TCVL chính xác cho nguyên tố này. II. TCHH
(Xét một cách tương đối, Fr có các tính chất hóa học tương tự như Cs).
Hình ảnh phản ánh biểu
III. Ứng dụng: Hiện tại không có ứng dụng thương mại nào của Francium do tính
tượng văn hóa cổ 'Gallic' của
không ổn định(có thời gian bán hủy chỉ 22 phút) và độ khan hiếm của nó. Vì thế
Pháp, là nguyên tố đặt theo
chỉ có ứng dụng trong các nghiên cứu, trong cả các lĩnh vực của sinh học lẫn cấu tên quốc gia này. trúc nguyên tử.
IV. Điều chế: Trong tự nhiên : 233Fr là kết quả của phân rã alpha của 227Actinium và
có thể tìm thấy ở dạng dấu vết trong các khoáng vật của Uranium và Thorium. 227Ac → 233Fr + α (alpha)
- Nhân tạo: Francium có thể được tổng hợp trong phản ứng hạt nhân. 18O + 197Au → 210Fr + 5n (neutron) 88
- Radium được phát hiện bởi vợ nhà hóa học Marie Sklodowska Curie (Ba Ra
Radium Lan) và Pierre Curie (Pháp) vào năm 1898. Tên có nguồn gốc từ 'bán kính'
[226] trong tiếng Latinh, có nghĩa là tia.
- Hóa trị: II NTK: Ra = [226]đvC
I. TCVL: Chất rắn, màu bạc(hoặc màu vàng nhạt) dễ bay hơi.
là nguyên tố có độc tính, t = 727oC, t = 1897oC, d = 3,51 g/cm3. nc s II. TCHH:
Hình ảnh đại diện cho việc
- Radium giống như Barium là nguyên tố kim loại kiềm thổ hoạt động hóa học mạnh.
ứng dụng trước đây của III. Ứng dụng
- Radium đang được sử dụng Ra ng di ày um c tàng ro nh ng iề s u trong ơn dạ lĩnh qua vực
ng vật lý nguyên tử, phân tử và
quang học. Khi trộn với Beryll đượciu sm ử nó là nguồn dụng c neutron dùng
ho đồng hồ vàt rong các thí nghiệm vật lý.
- Đồng vị 223 Ra (dưới tên thương mại Xofigo) đã được Cục Quản lý Thực phẩm và Dược mặt số đồng hồ.
phẩm Hoa Kỳ cho phép sử dụng trong y học như một phương pháp điều trị ung thư di căn xương.
- Radium từng được sử dụng trong sơn dạ quang, ví dụ như trong đồng hồ và mặt số đồng
hồ. Mặc dù các tia alpha không thể đi qua kính hoặc kim loại của vỏ đồng hồ, nhưng hiện
nay nó được coi là quá nguy hiểm để sử dụng theo cách này.
IV. Điều chế: Ngày nay Ra chỉ được chiết xuất từ nhiên liệu hạt nhân đã qua sử dụng. Ma M rie r Cu C rie r ? ie Ma M rie r Cur Cu ie r ? ie video id
Marie và Pierre Curie(chồng) trong phòng thí nghiệm ở Paris Marie i Cur u ie
i , nhũ danh Maria i Salo l me m a Sk S ło ł do
d wska(1867 - 1934), nhà vật ậ lý l người P i háp á gốc Ba a Lan, nổi ổi titế i ng với c i ông tr t ìn ì h phóng xạ, phát h t iệ i n ra a hai inguyên tố t Po P lo l niu i m và Ra R diu i m và hai ilầ l n đoạt tgiả i i N i obel. Bà B là à người ờ iphụ nữ đầu ầ titê i n đoạt ạ giả i i ivà là l người p i hụ nữ duy nhất ấ đoạt ạ giả i i Nobel ltr t ong hai l i ĩ l nh vực khác nhau a . Cù C ng với iHenri Bec e quere
r l và chồng, bà đã được trao a giải ả Nobel lV ật ậ lý l năm 1903 và bà là l người d i uy nhất đ t oạt g t iả i i iNobel e Hóa học năm ă 1911. Ngoài à ra, Ma M rie e Cu C rie ri còn nhận được ợ Huy chương Davi( i 1903); ;Huy chương Ma M ttteu e cci( i 1904); ;Huy chương Alber e t(1910) và nhiề i u giả i i ith t ưởn ở g cao quý khác á . 89
- Actinium được phát hiện bởi nhà hóa học người Pháp
Ac Andre Debierne vào năm 1899. Tên có nguồn gốc từ tiếng Actinium
Hy Lạp 'actinos', có nghĩa là một tia. [227]
- Hóa trị: III, ... NTK: Ac = [227] đvC
I. TCVL: Chất rắn, màu trắng bạc, mềm, phát sáng trong bóng
tối với ánh sáng xanh nhạt.
t = 1227oC, t = 3200oC, d = ~10 g/cm3. nc s
Biểu tượng 'alpha' trong tiếng II. TCHH
Hy Lạp và 'tia' kim loại là đại
- Actinium có tính chất di hó ệ a h n c ọc tương t ho nguyêự n n thư Lant ố như ha m nu ột m , Ac có thể phản ứng
nhanh chóng với Oxygen, các phi nguồn bức ki xạ m a k l hác pha và d và u c ng ũn dị g c l h à Acid trong điều kiện thích hợp.
nguồn gốc của tên gọi của nó. III. Ứng dụng
- Do khan hiếm, giá cao và tính phóng xạ, Actinium không
có ứng dụng thương mại đáng kể, chủ yếu phục cho nghiên cứu và y học hạt nhân.
IV. Điều chế: Actinium chỉ được tìm thấy ở dạng vết
trong quặng Uranium và quặng Thorium. 90
- Thorium được phát hiện trong khoáng vật Thorite bởi nhà hóa học Thụy
Th Điển Jöns Jacob Berzelius vào năm 1828. Thorium được đặt tên theo thần
Thor, vị thần chiến tranh của vùng Scandiumnavia. Thorium
- Hóa trị: IV, ... NTK: Th = 232 đvC 232
I. TCVL: Chất rắn, màu bạc và ngả đen khi tiếp xúc với không
khí, mềm, dễ uốn. t = 1750oC, t = 4788oC, d = 11,7 g/cm3. nc s II. TCHH
Hình ảnh được sử dụng ở đây
- Khi đun nóng Thorium cháy trong không khí với ánh sáng trắng.
có liên quan đến Thor, vị thần
- Thorium khó phản ứng với nước và các Acid.
Bắc Âu kết nối với sấm sét. Nó
III. Ứng dụng Thorium có thể được sử dụng như một nguồn năng
bao gồm cả cây búa của Thor
lượng hạt nhân trong tương lai.
- Thorium và hợp kim của Thorium có (Mj nhi ol ều nir tí
).nh chất đặc biệt như độ
bền và chống lại biến dạng trườn ở nhiệt độ cao dùng trong các động
cơ máy bay, điện cực,…
- Thorium được dùng làm lớp áo trong các đèn măng-sông cầm tay.
IV. Điều chế: Một số phương pháp được sử dụng để sản xuất Thorium như:
khử Oxide Thorium bằng Calcium hoặc điện phân Fluoride, .… Jöns Jac s ob Be ob rz r elius ? Jöns Jön J acob ac Be B rzel e ius u ? Jöns Jaco c b Be B rzelilu i s (20/8 / /1 / 779 – 07/8 / /1848) là à một n t hà hóa a học người iTh ụy Điể i n. Ông là l người ờ iđã ã đặt r
t a danh pháp hóa học, bao gồm các ký hiệ i u hóa học c được ợ sử dụng tr t ong công thứ t c hóa a học cho tớ t i ingày nay. C y ù . C ng với Jo i hn Daltlo t n, Anto t in i e Lavoisi oi er e ,r và Ro R bert B t oyle e được ợ coi ilà l cha đẻ ẻ của hóa học hiệ i n đại.i Tr T ong số nhiề i u khoáng chất ấ và nguyên tố t mà à ông đã nghiê i n cứu, ông được ợ ghi i nhận là l người đ i ã khám phá ra Cer e iu i m và Sel e en e iu i m, và à là l người đ i ầu ti t ê i n cô c lậ l p được Siliilc i on và Thoriu i m Ông được biế i t đ t ến ở Th ụy Điể i n với b i iệ i t tdanh "Ch C a
a đẻ của ngành Hóa học T hụy Điể i n“ và được ợ tr t ao Huy chươn ơ g Cople l y vào năm m 1836. 91
- Protactinium được phát hiện hai nhà khoa học người Đức, Otto Hahn
Pa và Lise Meitner vào năm 1918.
Protactinium - Hóa trị: V, ... NTK: Pa = 231 đvC 231 I. TCVL: Pa dưới ánh đèn màu
- Chất rắn, màu xám bạc ánh kim, cứng, phóng xạ,
Biểu tượng dựa trên chữ độc.
lồng tiếng Nhật có nghĩa là - t II. = T 1 C56 H 8o
H C, t = 4027oC, d = 12,34 g/cm3. nc s
'ichi' - số một. Điều này phản
- Protactinium dễ dàng phản ứng với oxy, hơi nước và Acid, nhưng ánh nguồn gốc của tên
không phản ứng với kiềm.nguyên tố từ 'protos' trong
III. Ứng dụng
tiếng Hy Lạp, có nghĩa là
- Do tính chất khan hiếm, độ phóng xạ cao và độc tính, Protactinium
hiện không được sử dụng ngoài mục đíc đầ h n u t gih ê iê n. n cứu khoa học cơ bản.
IV. Điều chế: Protactinium là một trong những nguyên tố hiếm nhất và đắt nhất trong
tự nhiên. Vào năm 1961, Cơ quan Năng lượng Nguyên tử Anh Quốc đã có thể sản
xuất 125 gam Pa nguyên chất 99,9%, mặc dù họ phải xử lý khoảng 55.000 kg quặng
Uraniumnit và tiêu tốn khoảng 500.000 USD để có được nó. Otto o Hah a n ? Otto Hahn ah n ? Ot O to t Hah H n n ( (08/ 8 3/ 3 1879 / – 28/7 / /1968) 1 968) là à một ột nhà n hà hóa h óa học học và và nhà n hà khoa khoa học học người Đức Đ , ức người đi đ tiê i n ê phong ph trong on lĩnh vực vực phóng p hóng xạ xạ và và hóa hóa học học phóng phóng xạ. xạ Ông Ô ng được c coi c là l "c " ha c ha đẻ đẻ của c ủa hóa h óa học học hạt hạ nhâ n" nhâ n" và và " ngườ " i sá s ng á l ng ập ậ thời iđại đạ nguyê ngu n yê tử". ử" Ott t o Hahn ah và v à Li L se s e Me M it i ner e r đã đ phát phá hiện ệ ra r a cá c c á c đồng đồ vị phóng ph xạ x ạ của c ủa Ra R d a i d um, Thori Thor um, um Pr P otac a t c inium um và và Ur U ani a um ni . Nă N m ă m 1938, 19 Hah H n, ah Li L se s e Mei e tne t r ne r và và Fri r tiz St S rass ra m ss ann m đã đã phát phá hiện ệ n ra r a sự s phân phâ hạc hạ h c hạt hạ tnhâ nh n là à cơ c sở s cho c cá c c á c lò phả ph n ả ứng hạt hạ nhâ n n hâ và và vũ khí vũ hạt hạ nhâ n nhâ . Vớ V i ớ những cốn c g ốn hiến ế to lớ l n củ c a ủ a mình n cho c nhâ n n hâ loạ o i ạ , Ôn Ô g n nhận nhậ được c Gi G ải ả Nob N e ob l lhóa hóa học h ọc (1944) 4 ; ;Huy H chươ c ng n Ma M x a Pla l nc n k c (1949) 1 ; ;Légi é on o d'H d' onne H ur onne ur (1959) 1 ; Gi G ả i i ả Enrico c o Fe F r e mi m (1966) 19 và v à nhiều ề gi g ải ả thưởng n ca c o a quý quý khác khá . c 92
- Uranium được nhà hóa học người Đức Martin-Heinrich Klaproth phát U
hiện vào năm 1789. Tên được đặt theo tên của hành tinh Uranus.
Uranium - Hóa trị: ... NTK: U = 238đvC 238
I. TCVL: Chất rắn, màu xám bạc bị ăn mòn trong không khí tạo
lớp vỏ Oxide màu đen, không tan trong nước. t =1132oC, t = 4131oC nc s Hình ảnh dựa trên II. Ứng dụng biểu tượng chiêm tinh
- Ứng dụng chủ yếu của Uranium trong lĩnh vực dân dụng là làm cho hành tinh Uranus.
nhiên liệu cho các nhà máy điện hạt nhân. 1kg U có thể tạo ra
mức năng lượng tương đương 3000 tấn than.
- Cho tới cuối năm 2006, toàn thế giới đã có 34 nước với 560 trạm phát điện nguyên
tử, tạo ra 5780 tỷ kWh chiếm ¼ tổng lượng điện toàn thế giới làm ra.
- Ứng dụng của Uranium trong lĩnh vực quân sự: vũ khí hạt nhân, đầu đạn đặc biệt, ...
- Phải cân nhắc khi sử dụng U, nó là nguyên tố tiềm năng vô hạn nhưng cũng là
nguyên tố của sự hủy diệt. Phón Ph g x g ạ x ạ ?
IV. Điều chế: Quặng Uranium được khai thác theo nhiều cách
như đào mỏ lộ thiên, tách từ đất đá và khoan mỏ. Uranium
cấp thương mại có thể được tạo ra bằng cách khử các muối
Uranium với các kim loại kiềm hoặc kim loại kiềm thổ. cial ffi Ị O V Ú TH C Ứ TH IẾN : K e b tu u Yo Ph P óng x g ạ x ?
Phóng xạ hay ph p óng n xạ hạt nhân là à hiệ i n tư t ợn ợ g một t số hạt ạ nhân nguyên tử t không bền tự biế i n đổi ivà phát
á ra các bức xạ hạt tnhân â (th t ườn ờ g được ợ gọi ilà l các ti t a i phóng xạ). Cá C c c nguyên tử t có c títn í h phóng xạ gọi ilà
l các đồng vị ịphóng xạ, còn cá c c nguyên tử t không phóng xạ gọi ilà l các á đồng vị ịbền. Cá C c á nguyên tố t hóa học
c chỉ ỉgồm các đồng vị vị phóng xạ (không có c đồng vị bền ề ) gọi i là l nguyên tố t phóng xạ. Một vật c t hất c t hứa các hạt n t hân không bền được c coi là l chất phó h ng xạ. 93
- Neptunium được nhà vật lý người Mỹ Edwin M. McMillan và nhà hóa
Np học Philip H. Abelson lần đầu tiên tìm thấy vào năm 1940. Nguyên tố này
được đặt tên theo hành tinh Neptune( sao Hải Vương). Neptunium
[237] - Hóa trị: IV, V, ... NTK: Np = [237] đvC I. TCVL:
- Chất rắn, màu bạc, dễ uốn, phóng xạ, độc. - t = 639oC, t = 4174oC, d = 1 H9ì,38 g nh ả /cm3. nh dựa trên nc s II. TCHH biểu tượng chiêm tinh
- Neptunium rất dễ tham gia c c ác phả ho hà n ứn nh t g i hóa nh Uranus. học. III. Ứng dụng
- Neptunium phần lớn chỉ được sử dụng trong nghiên
cứu khoa học cơ bản. Đồng vị Neptunium-237 đã được
sử dụng trong máy dò neutron năng lượng cao.
Các ion Neptunium trong dung dịch
IV. Điều chế: Phần lớn Neptunium hiện đang tồn tại trên Trái đất được sản
xuất nhân tạo trong các phản ứng hạt nhân. Neptunium thu được như một
sản phẩm phụ từ các lò phản ứng hạt nhân. Edw Ed i w n M . McMillan? Ed E w d i w n M cMillan ? n Ed E w d in i n Mattiso i n n McMililla l n (18/9 / /1 / 907 – 17/9 / /1991) là l nhà vật lý l người Mỹ và là l người i đầu ầ titê i n đã ã tạo ạ ra nguyên ê tố t sau Uraniu ni m. Năm 1940 ông và Philiilp i A belso l n khi isử dụng Cy C clo l tr t on (máy gia i tố
t c cộng hưởng từ t ) ở đây â là l m một t th t í í nghiệm ệ phân hạt t nhân â của Uraniu i m-239 cùng với ớ neu e tron tạ t o ra Neptuniu i m. Với n i hững cống hiế hi n to t lớ l n của mìn ì h cho nhân lo l ại,i Ông nhận được ợ Giả i i iNobel l Hóa học(1951) ch c ung với ớ iGle l nn Seaborg r và Giải ả Nguyên tử vì ìHòa a bìn ì h(1963). 94
- Plutonium được nhà vật lý hạt nhân người Mỹ Glenn Seaborg và cộng
Pu sự phát hiện vào năm 1940. Tên được đặt theo tên của hành tinh lúc đó là Pluto. Plutonium
[244] - Hóa trị: VI, V, ... NTK: Pu = [244] đvC I. TCVL
- Chất rắn, màu sáng bạc bị oxi hóa trong không khí chuyển thành màu Hì xám nh ả tối, giòn, c nh được lứấng, y c pảhó m ng x hứ ạ, độ ng t c ừ . câu nói - t = 639oC, tc = 3 ủa 228oC, Robe r d t = O 16,6 ppen3 g he /icm3 me . nc s r, sau vụ thử bom II. TCHH
Các ion Plutonium trong dung dịch
nguyên tử đầu tiên ở sa mạc Nevada:
- Plutonium rất dễ tham gia các phản ứng hóa học,
'Chúng tôi biết thế giới sẽ không giống
có thể tự bốc cháy trong không khí ẩm.
nhau. Một vài người đã cười, một vài III. Ứng dụng - Plutonium-238 được người sử đãdụng tr khóc ong . H m ầ á u y hphá ết t nhi mọi ệt điệ ngư n đồn ời g đều im vị phóng xạ để cung lặ cấ ng. p đi … ện cho "Bâ các y gi tàu ờ t t ôihăm đã dò tr kh ở t ông hà gi nh an Thần
hoạt động quá xa không thể sử dụng mặt trời (tàu thăm dò
chết, kẻ hủy diệt thế giới." Tôi cho rằng
Cassini và Galliumleo). Pu-239 được sử dụng làm lõi của vũ khí
tất cả chúng ta đều nghĩ như vậy, bằng
hạt nhân ngày nay và trong một số lò phản ứng hạt nhân.
1 kg Pu tạo ra một vụ nổ tươ cá ng ch đnươ à ng vớ y ha i h y c ơán c 10. h 0 k 00 há t c ấn . ' thuốc nổ hóa học.
IV. Điều chế: Phần lớn Plutonium hiện đang tồn tại trên Trái
đất được sản xuất nhân tạo trong các phản ứng hạt nhân. “Lõi quỷ“ 95
- Americium được nhà khoa học người Mỹ Glenn T. Seaborg, Ralph A.
Am James, Leon O. Morgan và Albert Ghiorso phát hiện vào năm 1944. Tên
được đặt theo nước Mỹ, nơi nó được tạo ra lần đầu tiên. Americium
[243] - Hóa trị: III, ... NTK: Am = [243] đvC I. TCVL
- Chất rắn, màu sáng bạc nhưng sau đó bị xỉn màu từ
từ trong không khí, mềm, phóng xạ, độc.
- t = 1176oC, t = 2607oC, d = 12 g/cm3. nc s II. TCHH
- Americium rất dễ tham gia c Hìác ph nh ảản ứ nh n p g h h ả óa h n á ọc, nh nguồn
dễ dàng phản ứng với Oxygen, p gốc h ci ki ủa m t ,ê Acid, nướ n nguyê c n , tố và ...
III. Ứng dụng
sự hiện diện của nó trong
- Americium có thể được sử d cáụcng t tr hi o ế n t g m bị áy bá dò o động phát
khói và có thể được sử dụng như một nguồn tia hiện khói. gamma di động.
IV. Điều chế: Americium đã được sản xuất với số lượng
nhỏ trong các lò phản ứng hạt nhân trong nhiều thập kỷ. Al A be b rt Ghiorso ? s Al A be b r e t Ghi h orso ? Alb l er e t Ghi h orso (15/7 / /1915 – 26/1 / 2/2 / 010) là l một tnhà khoa học c hạt n t hân người ờ i Mỹ M và là l người ờ lậ l p kỷ lụ l c đồng phát thiện
ệ ra 12 nguyên tố hóa học tr t ong bảng tu t ần hoàn: :Americ ri iu i m, Cu C riu ri m, Berk e elilu i m, Ca C lilfo f rn r iu i m, Ein i ste st in i iu i m, Fermiu i m, Me M ndele l vi v umum, No
N bel,l Lawr w e r n e ciu i m, Ruth t erfo rf rd r iu
i m, Dubnium, Sea e borg r ium, Ghi h orso đã phát á minh ra nhiều ề kỹ thuật tvà à máy móc để cô lập ậ và xác á định các á
nguyên tố nặng từng nguyên tử t . Ông th
t ường được ghi inhận là à người iđã ã triể i n khai i máy phân títc í h đa kênh và à kỹ th t uật ậ độ giậ i t tđể cô lậ
l p các sản phẩm phản ứng, mặc dù cả c hai iđiề i u này đều ề là à sự mở r ở ộng đáng kể của a các c khái iniệm ệ đã ã hiể i u tr t ước đây. y
Với inhững cống hiế i n to t lớ l n của mìn ì h, Ông nhận được c Giải ả th t ưởn ở g Thàn à h tự t u tr t ọn đời ờ năm 2004 (Hiệ i p hội H
i óa học phóng xạ) và nhiề i u giả i i t i h t ưởng khác á . 96
- Curium được nhà vật lý hạt nhân người Mỹ Glenn Seaborg và cộng sự
Cm phát hiện vào năm 1944 và Curium được đặt tên để vinh danh vợ chồng
nhà khoa học Pierre và Marie Curie. Curium
[247] - Hóa trị: III, IV ... NTK: Cm = [247] đvC I. TCVL
- Chất rắn, màu sáng bạc dễ bị mờ xỉn khi tiếp xúc
không khí, giòn, cứng, phóng xạ, độc.
Hình ảnh cho thấy một vệ
- t = 1340oC, t = 3110oC, d = 13,51 g/cm3. nc s tinh trên quỹ đạo quanh II. TCHH
Trái đất, phản ánh việc sử
- Curium rất dễ tham gia các phản ứng hóa học, có
dụng nguyên tố trong công
thể tác dụng với Oxygen, phi kim khác, Acid. nghệ vệ tinh.
Một mẫu Curium trong ống thạch anh III. Ứng dụng
- Vì chỉ một lượng miligam Curium từng được sản xuất nên hiện tại không có ứng
dụng thương mại nào cho nó, mặc dù nó có thể được sử dụng trong các máy phát
nhiệt điện đồng vị phóng xạ trong tương lai. Curium chủ yếu được sử dụng cho
nghiên cứu khoa học cơ bản.
IV. Điều chế: Curium được sản xuất nhân tạo bằng các phản
ứng hạt nhân với số lượng nhỏ cho mục đích nghiên cứu. Ma M rie r Cur Cu ie r ? ie 97
- Berkelium được sản xuất bởi Stanley G. Thompson, Glenn T. Seaborg
Bk và Albert Ghiorso làm việc tại Đại học California - Berkeley, vào tháng
12 năm 1949 và được đặt tên theo Đại học này. Berkelium
[247] - Hóa trị: III, IV ... NTK: Bk = [247] đvC I. TCVL
- Chất rắn, màu trắng bạc, mềm, phóng xạ, độc. - t = 1340oC, t = 3110oC, M d ột = bi 1 ể 3, u 5t1 ư g/ ợ c n m3. g kim loại nc s
trừu tượng trên nền màu sắc II. TCHH
rực rỡ đại diện cho việc tạo
- Berkelium rất dễ tham gia các phản ứng hóa học, có
ra nguyên tố trong lò phản
thể tác dụng với Oxygen, phi kim khác, Acid, nước …
Mẫu Berkelium được cô lập đầu tiên ứng hạt nhân. III. Ứng dụng
- Hiện tại không được sử dụng cho bất kỳ đồng vị nào của
Berkelium ngoài nghiên cứu khoa học cơ bản.
IV. Điều chế: Berkelium được sản xuất nhân tạo bằng các phản
ứng hạt nhân với số lượng nhỏ cho mục đích nghiên cứu.
Berkelium được sản xuất bằng cách bắn phá các Actinides
bằng neutron trong lò phản ứng hạt nhân. 98
- Californium được sản xuất bởi Stanley G. Thompson, Glenn T.
Cf Seaborg, Kenneth Street Jr. và Albert Ghiorso làm việc tại Đại học
California, Berkeley, vào năm 1950 và được đặt tên theo tiểu bang và
Californium trường đại học California. 251
I. TCVL - Hóa trị: III, ... NTK: Cf = 251 đvC
- Chất rắn, màu trắng bạc bị ngả màu chậm trong không khí, phóng xạ, độc.
Hình ảnh dựa trên lá cờ của
- t = 900oC, t = 1470oC, d = 15,1 g/cm3. nc s
tiểu bang California và có hình II. TCHH
một con gấu xám (biểu tượng
- Californium dễ tham gia các phản ứng hóa học khi đun
của sức mạnh vĩ đại) và một
nóng, có thể tác dụng với Oxygen, phi kim khác, Acid, nước, … ngôi sao đơn độc.
III. Ứng dụng
Mẫu Californium được cô lập đầu tiên
- Với giá khoảng 25 triệu USD/gram, Californium-252 chắc chắn là kim loại đắt
nhất thế giới. Cf được sử dụng trong vật lý hạt nhân, y học và cả trong việc khám
phá các lĩnh vực vàng bạc hay dầu mỏ.
IV. Điều chế: Californium được sản xuất trong lò phản ứng
hạt nhân và máy gia tốc hạt. Hàng năm chỉ có 30 - 40 microgam được tạo ra.
Máy dò neutron có thời gian,
một thiết bị phát hiện bom mìn. 99
- Einsteinium được phát hiện bởi một nhóm các nhà khoa học do Albert
Es Ghiorso dẫn đầu vào năm 1952 khi đang nghiên cứu các mảnh vỡ phóng
xạ được tạo ra từ vụ nổ quả bom khinh khí đầu tiên và được theo tên nhà
Einsteinium khoa học Albert Einstein.
[252] - Hóa trị: III, ... NTK: Es = [252] đvC I. TCVL
- Chất rắn, màu bạc, mềm, phóng xạ, độc.
- t = 860oC, t = 996oC, d = 8,84 g/cm3. nc
sThiết kế được lấy cảm hứng từ công trình II. TCHH
của Albert Einstein và những hình ảnh - Einsteinium dễ tha th m u tgia hậ các phả p đư n ợc ứ t ng ừ chóa ác họ m c á khi y giđu a n tốnóng c , hạ t ban
có thể tác dụng với Oxygen, phi kim khác, Acid, nước, …
đầu, chẳng hạn như ở Cern và Fermilab.
III. Ứng dụng
Es phát sáng màu xanh lam trong bóng tối.
Các mũi tên là từ một trong những hình - Vì chỉ có một lượn ả g nhỏ nh đ Ein ược ste c inium hú t hítừng c đượ h nà c y c sản xuấ ho biết tnên nó hi
hướng ện không được sử
dụng ngoài mục đích nghiên cứu khoa học cơ bản.
va chạm. Một mẫu 'máy gia tốc hạt' trừu
IV. Điều chế: Einsteinium tư đượ ợ c sản ng đượxcuất hi vớ ể i số n th ịlượ t ng nhỏ bằ rong nề ng
n. cách bắn phá các Actinide
nhẹ hơn bằng neutron trong các lò phản ứng hạt nhân thông lượng cao chuyên dụng. Al A ber be t Einst ns ein? Al A bert Einst ns ein? video id
Albert Einstein và vợ (Elsa) Alb l ert r Ei E nst n ei e n(14/0 / 3/1879–18/04/1 / 955) là l một tnhà à vật tlý l người ờ Đức, được ợ công nhận ậ là l một ttr t ong những nhà à vật ậ lý l vĩ đại inhất tmọi th t ời iđại, i người ờ iđã phát t triể i n th t uyết ế tư
t ơng đối itổng quát,t một ttr t ong hai itr t ụ cột tcủa a vật tlý l hiệ i n đại i(tr t ụ cột t còn lại ạ là l cơ ơ học lư l ợn ợ g tử t ). Ông được ợ biế i t t đến nhiề i u nhất t qua phương trìn ì h về sự tươn ơ g đươn ơ g khối lư l ợn ợ g-năng lư l ợn ợ g được xem là l "phương trìn ì h nổi i tiế i ng nhất ấ th t ế giớ i i“ i . Cô C ng tr t ìn ì h về hiệ i u ứng quang điện
ệ của ông mang títnh bước ớ ngoặt k t hai si i nh ra a lý l thuyết l t ư l ợn ợ g tử t . Với n i hững cống hiến ế to t lớ l n của mìn ì h cho nhân â lo l ại ạ , Ông nhận được c Giả i i i Nobel lVật l t ý l (1921); ;Huy chươn ơ g Mattte t ucc c i i(1921) và nhiề i u giả i i t i h t ưởng khác á . 100
- Fermium được phát hiện bởi một nhóm các nhà khoa học do Albert
Fm Ghiorso dẫn đầu vào năm 1952 khi đang nghiên cứu các mảnh vỡ phóng xạ
được tạo ra từ vụ nổ quả bom khinh khí đầu tiên và được theo tên nhà khoa
Fermium học Enrico Fermi.
[257] - Hóa trị: III, ... NTK: Fm = [257] đvC
Chỉ một lượng nhỏ Fermium được sản xuất hoặc tách ra, do
đó có rất ít thông tin về tính chất hóa học của nó. I. TCVL
Hình ảnh nhằm mục đích gợi ý
- Chất rắn(dự đoán) phóng xạ, độc.
một chuỗi phản ứng hạt nhân II. TCHH
tự lan truyền, chẳng hạn như
- Fermium có tính chất hóa học tương tự các
nguyên tố nhóm Actinium.xảy ra trong lò phản ứng hạt
III. Ứng dụng
nhân và bom nguyên tử. Hợp kim Fermi - Ytterbium
- Do sản xuất một lượng nhỏ và thời gian bán hủy ngắn của nó, hiện tại không có
công dụng nào đối với Fermium ngoài nghiên cứu khoa học cơ bản.
IV. Điều chế: Fermium được sản xuất với số lượng nhỏ bằng cách bắn phá các Actinide
nhẹ hơn bằng neutron trong các lò phản ứng hạt nhân thông lượng cao chuyên dụng. Enr n ic r o ic F o er F m er i? Enr n ic r o ic F o er F m er i? vid v eo En E r n i r co c Fe F r e mi m (1 ( 901–1954) ) là à nhà v hà ật ậ lý lý thuyết v ế à th à ực ự nghiệm ệ người Ý, với vớ nghiên ê cứu c về về lò Chi C ca c go a Pi P le- le 1 - , lò phản hả ứn ứ g hạt hạ nhân d â o con người ườ xây xâ dựng đầu đầ tiên trê r n ê thế giới, và à nổi tiếng ế với những côn c g trìn r h đóng góp ch c o cơ c ơ học ọc lượn lượ g tử, vật vậ lý hạt hạ nhân, vật ậ lý hạt và và cơ c ơ học ọc thống kê. kê Cùng với vớ Ro R ber be t r Oppen e hei he me m r e ,r ông được c co c i là là một m tron r g những "ch g "c a đ a ẻ c ẻ ủ c a bo a m n m guyên yê tử". tử". Ông Ô có mộ m t số bằng ằ sá s ng chế c liên liê quan ua đến năng ă lượn lượ g hạt hạ nhân â và và nhận hậ Gi G ải ả Nobel e Vậ V t ậ lý năm nă
1938 cho lý thuyết phóng xạ ạ cả c m ả ứng và và phát há hiện ra n r cá c c á nguyên yê tố siê s u Ura Ur niu a m. m 101
- Mendelevium được phát hiện bởi nhà khoa học hạt nhân người Mỹ
Md Albert Ghiorso và cộng sự làm việc tại Đại học California, Berkeley, vào
Mendelevium năm 1955 và được theo tên nhà khoa học Dimitri Ivanovich Mendeleev.
[258] - Hóa trị: II, III, ... NTK: Md = [258] đvC
Chỉ một lượng nhỏ Mendelevium được sản xuất hoặc tách
ra, do đó có rất ít thông tin về tính chất hóa học của nó. I. TCVL
Hình ảnh được lấy cảm
- Chất rắn(dự đoán) phóng xạ, độc.
hứng từ và dựa trên bức II. TCHH ảnh của Dimitri Mendeleev
- Mendelevium có tính chất hóa học tương tự
các nguyên tố nhóm Actiniu và m.
phiên bản đầu tiên của
III. Ứng dụng bảng tuần hoàn.
- Do sản xuất một lượng nhỏ và thời gian bán hủy ngắn của nó, hiện tại không có
công dụng nào đối với Mendelevium ngoài nghiên cứu khoa học cơ bản.
IV. Điều chế: Mendelevium được sản xuất với số lượng nhỏ bằng cách bắn phá các
hạt nhân nguyên tử nhẹ hơn bằng neutron trong các lò phản ứng hạt nhân hoặc máy gia tốc hạt nhân. Di D mitri Ivanovich Me h M ndeleev? Di D mitri Ivan va ovi o ch M c endeleev? e Dm it Dm r it i Iv i I ano an vich M h en e de d le e e le v (1934–1 4 907) là ) mộ m t nhà h à oá h oá ọc và và nhà hà phát há minh người ườ Nga. Ông đượ ư c c co c i là là người ườ tạo ra r a phiên ê bản bả đầu đầ tiên iê của ủa bảng ả tuần hoàn oà c á c c ng c uyên tố hoá h á ọc, một bướ ư c c ngoặt oặ lớn ớ tron r g lịch lịc sử ử nghiên cứu c hoá học. ọc Sử ử dụng bảng ả tuần uầ hoàn oà này, y ông đã đã dự đoán á các á c tính chấ c t củ c a a cá c c á nguyên tố cò c n chưa hưa đượ ư c c phát há hiện. Ông cũng là là ngườ ư i phát h á iện iệ nhiệt đ iệ ộ sô ộ s i tớ t i hạn ạ . Miệng iệ núi lửa M lửa end e ele e e le v e trê tr n ê Mặt ặ tră tr ng, cũng c như nguyên yê tố số s 101, chất hấ phóng xạ xạ Me M n e del de eviu e m, m được đượ c đặt đặ theo the tên tê ông. Sự ự v ĩ ĩđạ đ i c i ủa ủ Men d Men eleev elee ( v ( ideo) eo ) 102
- Nobelium được nhà khoa học Georgy Flerov và các cộng sự tại Dubna, gần
No Moscow, Nga, và độc lập bởi Albert Ghiorso và các cộng sự tại Berkeley,
California, Hoa Kỳ và được theo tên nhà khoa học Alfred Nobel.
Nobelium - Hóa trị: II, III, ... NTK: No = [259] đvC [259]
Chỉ một lượng nhỏ Nobelium được sản xuất hoặc tách ra,
do đó có rất ít thông tin về tính chất hóa học của nó. I. TCVL
Hình ảnh mô tả một chữ của tiếng Nhật
- Chất rắn(dự đoán) phóng xạ, độc.
với nhiều ý nghĩa khác nhau bao gồm II. TCHH
- Nobelium có tính 'chấ bậ tc h tóa hầ họ y' c tư và ơ'n c g a tự các o quý' - một cách chơi nguyên tố nhóm Actini c um
hữ t .ừ nguồn gốc tên của nguyên tố.
III. Ứng dụng Nền có hình ảnh gợi ý về các “dấu vết” - Do sản xuất một lượ gi ng nhỏ và t ống như c h á ờ c i g ti ia a ns b á án h ng ủy ng được ắtn ạ c o ủ a n ra ó, h khi iện tại không có
công dụng nào đối với Nobelium ngoài nghiên cứu khoa học cơ bản. ánh sáng đi qua đám mây.
IV. Điều chế: Nobelium được sản xuất với số lượng nhỏ bằng cách bắn phá các hạt
nhân nguyên tử nhẹ hơn bằng neutron trong các lò phản ứng hạt nhân hoặc máy gia tốc hạt nhân. Al A fre fr d N d ob N e ob l ? Al A fred Nobe d N l? video id Alfr Alf e r d e Ber e n r h n ard ar Nobe
Nob l (1933–1896) )là là mộ m t nhà hà hóa a học, một nhà hà kỹ nghệ, hệ nhà s hà ản ả xuất ấ vũ khí, người gườ phát min m h ra h r thuốc ốc nổ và à một triệ tr u iệ phú người T gườ hụy Điển y Điể . Ông dùng toàn oà bộ tài tà sả s n ả củ c a a mìn m h nhằm ằ m sáng á lập lậ ra r a Giả G i thưở ư ng Nob N el e . Ng N uyên ê tố hóa a học ọc Nob N eliu e m được đượ c đặt đặ theo e tên tê củ c a a ông.
Giải thưởng Nobel, hay Giải Nobel là một tập các giải thưởng quốc tế được tổ
chức trao thưởng hằng năm kể từ năm 1901 cho những cá nhân đạt thành tựu
trong lĩnh vực: vật lý, hoá học, y học, văn học, kinh tế và hòa bình.
Vào năm 1968, Ngân hàng Thụy Điển đưa thêm vào một giải về lĩnh vực
khoa học kinh tế, theo di chúc của Alfred Nobel năm 1895. 103
- Lawrencium được các nhóm nghiên cứu vật lý hạt nhân tại Dubna - Nga
Lr và Berkeley – Mỹ đồng phát hiện ra và được theo tên nhà khoa học Ernest
Lawrence, người phát minh ra Cyclotron. Lawrencium
[262] - Hóa trị: III, ... NTK: Lr = [262] đvC
Chỉ một lượng nhỏ Lawrencium được sản xuất hoặc tách
ra, do đó có rất ít thông tin về tính chất hóa học của nó. I. TCVL
Hình ảnh này dựa trên các vệt hạt trừu
- Chất rắn(dự đoán) phón t gư x ợ ạ, độc.
ng được tạo ra trong một II. TCHH
Cyclotron. Thiết kế để tăng tốc các - Lawrencium có tính c “ h s ất h ub- ó a at họ omci t c ư ” ơng ( tự cá p, n, e c ) xung quanh nguyên tố nhóm Actinium.
một vòng tròn cho đến khi chúng có
III. Ứng dụng đủ năng lượng để đập vào một nguyên
- Do sản xuất một lượng nhỏ và thời gian bán hủy ngắn của nó, hiện tại không có
công dụng nào đối với tLawr ử vàenc tạ ium o ra ngo m à ộti nghiên nguyê cứ n tu kho ử m a ới h.ọc cơ bản.
IV. Điều chế: Lawrencium được sản xuất với số lượng nhỏ bằng cách bắn phá các
hạt nhân nguyên tử nhẹ hơn bằng neutron trong các lò phản ứng hạt nhân hoặc máy gia tốc hạt nhân. Er E nest s Lawr w ence nc ? Máy Má g y ia t i ốc a t ốc hạt hạ lớn lớ Er E nes e t Lawr t Law e r nc n e c ? Er E ne n st Orla l nd n o Lawre r n e ce (1901-1958) là l nhà vật tlý l người iMỹ M . Ông là l người ờ đã đưa ra ý tư t ởn ở g chế tạ t o một tmáy gia a tốc t trong đó hạt tma m ng điệ i n được tă t ng tố t c nhờ ờ sự phối i hợp ợ của điệ i n tr t ường và à từ t tr t ườn ờ g. Đó ch c ín í h là l máy Cyclo l tr t on, lo l ại ạ máy được th t ử nghiệ i m lầ l n đầu ầ titê
i n vào năm 1931 và được thực c tế t ch c ứng tỏ t rằn ằ g là l một m t áy gia i tố t c c rất h t ữu íc í h. Nguyên tố t hóa học Lawrenciu i m được ợ đặt tth t eo e tê t n của a ông. Với i những cố c ng hiế hi n to t lớ l n của mìn ì h, Ông nhận được ợ Giả i i i Nobel l năm(1939); Huân ch c ươn ơ g Thành títc í h (1946); Huân â chương Farad a ay (1952); Giả i i i thưởng Enrico c Fe F rmi i(1957) và nhiề hi u giả gi i ith t ưởng khác. 104
- Rutherfordium được các nhà khoa học làm việc tại Viện nghiên cứu hạt Rf
nhân chung ở Dubna, Nga phát hiện năm 1964 và được theo tên nhà khoa
Rutherfordium học Ernest Rutherford. [267]
- Hóa trị: IV, ... NTK: Rf = [267] đvC
Chỉ một lượng nhỏ Rutherfordium được sản xuất hoặc tách
ra, do đó có rất ít thông tin về tính chất hóa học của nó. I. TCVL
Biểu tượng kim loại trừu tượng
- Chất rắn(dự đoán) phóng xạ, độc.
và nền được lấy cảm hứng từ II. TCHH
hình ảnh từ các máy gia tốc hạt
- Rutherfordium có tính chất hóa học tương tự các
thời kỳ đầu và hiện đại.
nguyên tố nhóm IV B (Ti, Zr, Hf).
III. Ứng dụng Do sản xuất một lượng nhỏ và thời gian
bán hủy ngắn của nó, hiện tại không có công dụng nào đối
với Rutherfordium ngoài nghiên cứu khoa học cơ bản.
IV. Điều chế: Rutherfordium được sản xuất với số lượng nhỏ bằng cách bắn phá các
hạt nhân nguyên tử nhẹ hơn bằng neutron trong các lò phản ứng hạt nhân hoặc máy gia tốc hạt nhân. Er E nest s Rutherford? Erne n st s Ru R th u e th rford r ? d video id Er E ne n st Rutherf r ord (1871 - 1937) là
l một nhà vật tlý người N i ew e Zeala l nd hoạt t động trong lĩln
ĩ h vực phóng xạ và cấu tạ t o nguyên tử t . Ông được ợ coi i là l "ch c a đẻ" " của a vật ậ lý hạt t nhân â ; sau a khi i đưa a ra a mô hìn ì h hành titn i h nguyên tử t để giả i i i th t íc í h th t í ínghiệ i m trên lá l vàng. Nguyên ê tố t hóa a học Ru R th t er e fordiu i m m được ợ đặt ặ th t eo tê t n của a ông. Với inhững cống hiến ế to t lớ l n ớ của mìn
ì h, Ông nhận được Giả i i iNobel Hóa a học
năm(1908); ; Huân chương Far
a aday (1920); ; Huân chương Co C ple l y (1922); ; Huy chương W i W lihelm l Exner (1936) và nhiề i u giả i i t i h t ưởng khác á . 105
- Dubnium được các nhà khoa học làm việc tại Viện nghiên cứu hạt nhân
Db chung ở Dubna, Nga phát hiện năm 1967 và được đặt tên theo địa điểm
Dubnium của Viện Nghiên cứu Hạt nhân chung (JINR) ở Dubna, Nga. [268]
- Hóa trị: V, ... NTK: Db = [268] đvC
Chỉ một lượng nhỏ Dubnium được sản xuất hoặc tách
Hình ảnh có phiên bản ký tự
ra, do đó có rất ít thông tin về tính chất hóa học của nó. I. TCVL
Cyrillic cách điệu của 'Dubna', - Chất rắn(dự đoátn) hị ph tr óấng x n c ạ ủ ,a độ N c. ga mà sau đó II. TCHH
nguyên tố được đặt tên. Nó - Dubnium có tính chấ được t hó đặ a t h t ọ rêc tươ n nềng n t ' ự c hạt ác fr actal'
nguyên tố nhóm V B (V, Nb, Ta). trừu tượng. III. Ứng dụng
- Do sản xuất một lượng nhỏ và thời gian bán hủy ngắn của nó, hiện tại không có
công dụng nào đối với Dubnium ngoài nghiên cứu khoa học cơ bản.
IV. Điều chế: Dubnium được sản xuất với số lượng nhỏ bằng cách bắn phá các hạt
nhân nguyên tử nhẹ hơn bằng neutron trong các lò phản ứng hạt nhân hoặc máy gia tốc hạt nhân. JI NR N ? R J INR? IN Việ V n iệ n ph p ần ần Ng N hiê h n n cứu c ứu Hạt H nhân h JINR N (V ( iệ V n iệ Liê L n iê hiệp iệ nghiên iê cứu c hạt nhân Dub D na) )là mộ m t cơ ơ quan ua nghiên cứu c trong lĩnh vực ự hạt hạ nhân, h â ạt ạ cơ b ơ ản đ ả ượ ư c t c hành hà lập ậ năm ă 1 m 956 tại Du D bna, Nga a . , Nga JIN I R N là là một m trun tr g tâm â m nghiên iê cứu c quốc c tế tế cho c khoa oa học ọc hạt hạ nhân, â với ớ 5500 nhân hâ viên, ê 1200 các á c nhà hà nghiên iê cứu b c ao a gồm 1000 Ti T ến ế sĩ, ... hầu hầ hết ế cá c c á nhà à khoa oa học ọc đều đề là là những nhà à khoa học ọc lỗi lạc lạ của ủa Nga. Nga 106
- Seaborgium được sản xuất các nhà khoa học do Albert Ghiorso và
Sg cộng sự làm việc tại Phòng thí nghiệm Lawrence Berkeley, California vào
Seaborgium năm 1974 và được đặt theo tên của nhà khoa học Glenn Seaborg. [269]
- Hóa trị: VI, ... NTK: Sg = [269] đvC
Chỉ một lượng nhỏ Seaborgium được sản xuất hoặc tách
ra, do đó có rất ít thông tin về tính chất hóa học của nó.
Biểu tượng là một biểu tượng I. TCVL
nguyên tử được trừu tượng hóa.
- Chất rắn(dự đoán) phóng xạ, độc. II. TCHH
Nền được lấy cảm hứng từ hình - Seaborgium có tính ch ả ất hó nh t a h ừ c ọácc tươ m n á g y tự gi caá tc ốc hạt thời
nguyên tố nhóm VI B (Cr, Mo, V kỳ ). đầu và hiện đại. III. Ứng dụng
- Do sản xuất một lượng nhỏ và thời gian bán hủy ngắn của nó, hiện tại không có
công dụng nào đối với Seaborgium ngoài nghiên cứu khoa học cơ bản.
IV. Điều chế: Seaborgium được sản xuất với số lượng nhỏ bằng cách bắn phá các
hạt nhân nguyên tử nhẹ hơn bằng neutron trong các lò phản ứng hạt nhân hoặc máy gia tốc hạt nhân. Glenn n T h T eod e ore or S eab e org or ? G lenn n n Th e Th odor od e or Se S abor ab g ? Glen e n Th T e h odo d re r Se S aborg (1912-1999) là
l nhà hóa học, vật t lý hạt ạ
nhân người iMỹ, ,những đóng góp của a ông trong việ i c tổ t ng hợp ợ , khám phá và nghiê i n cứu mười inguyên ê tố t TransUranium.
Với những cống hiến to lớn của mình cho khoa học, Ông
nhận được Giải Nobel Hóa học(1951); Giải thưởng Enrico
Fermi(1959); Huân chương Franklin(1963); Huân chương Khoa
học Quốc gia(1991) và nhiề i u dan a h hiệ i u cao quý khác á . Nguyên tố t hóa học Sea e borgi r um được ợ đặt tth t eo e tê t n của ông.
- Bohrium được sản xuất lần đầu tiên vào năm 1976 bởi các nhà khoa học làm 107
Bh việc tại Viện Nghiên cứu Hạt nhân ở Dubna, Nga, và sau đó được xác nhận vào
Bohrium năm 1981 bởi Peter Armbruster, Gottfried Münzenber cùng nhóm của họ làm [270]
việc tại Gesellschaft für Schwerionenforschung ở Darmstadt, Đức. Bohrium
được đặt theo tên của nhà khoa học Niels Bohr.
- Hóa trị: VII, ... NTK: Bh = [270] đvC
Chỉ một lượng nhỏ Bohrium được sản xuất hoặc tách
ra, do đó có rất ít thông tin về tính chất hóa học của Biể n u tó.
ượng và các mẫu được I. TCVL
trừu tượng hóa dựa trên mô - C II. h Tất C rắ H n
H( dự đoán) phó hì ng xạ, độc
nh nguyê . n tử, hiện mang - Bohrium có tính chất h tí óa h nh ọ b c i ểtươ u t n ưg ợ tự ngc,ác ng do u N y i ê e n
l st ố nhóm VII B (Mn, Tc, Re).
III. Ứng dụng
Bohr đề xuất vào năm 1913.
- Do sản xuất một lượng nhỏ và thời gian bán hủy ngắn của nó, hiện tại không có
công dụng nào đối với Bohrium ngoài nghiên cứu khoa học cơ bản. IV. Điều chế
- Bohrium được sản xuất với số lượng nhỏ bằng cách bắn phá các hạt nhân nguyên
tử nhẹ hơn bằng neutron trong các lò phản ứng hạt nhân hoặc máy gia tốc hạt nhân. N i N els Boh r Boh ? r Ni N el e s Boh s r Boh ? r video id B o h r và vợ Nie i ls l Henr n ik i David i Bo B hr (1885-1962) là l nhà vật tlý l học người Đ i an Mạ M ch với i những đóng góp nền tả t ng về lý thuyết tcấ c u tr t úc nguyên tử t và cơ ơ học lư l ợng tử t sơ khai a . Ông phát ttr t iể i n mô hìn ì h nguyên tử t Bo B hr cho cấu tr t úc nguyên tử t .
Với những cống hiến to lớn của mình cho khoa học, Ông nhận được
Giải Nobel Vật lý(1922); Huy chương Matteucci(1923);Huy chương
Franklin (1926); Huy chương Copley (1938); Giải Nguyên tử vì Hòa bình (1957) và nhiề i u danh hiệ i u cao a quý khác. Nguyên ê tố t hóa a học Bo B hriu i m được đặt ặ th t eo tê t n của ông. Aage Nie i ls l Bohr, hr con tr t ai icủa ông cũ c ng là l một tnhà
à vật tlý và đoạt tGiả i i iNobel lV ật ậ lý l năm 1975.
- Hassium được sản xuất bởi Peter Armbruster, Gottfried Münzenber 107
Hs và cộng sự làm việc tại Gesellschaft für Schwerionenforschung(Trung tâm
nghiên cứu ion nặng GSI Helmholtz) ở Darmstadt, Đức vào năm 1984 và
Hassium được đặt tên theo tên một bang (Hesse) của Đức. [269]
- Hóa trị: VIII, ... NTK: Hs = [269] đvC
Chỉ một lượng nhỏ Hassium được sản xuất hoặc tách
ra, do đó có rất ít thông tin về tính chất hóa học của nó.
Hình ảnh được lấy cảm I. TCVL hứng từ quốc huy của - C II. h Tất C rắ H n
H( dự đoán) phóng xạ ba , đ ng ộ c H. esse của Đức, nơi
- Hassium có tính chất hóa h đặọtc t têươ n n c g tự các ng ho nguyê uyê n t n tố n
ố nàyh.óm VIII B (Os, …). III. Ứng dụng
- Do sản xuất một lượng nhỏ và thời gian bán hủy ngắn của nó, hiện tại không có
công dụng nào đối với Hassium ngoài nghiên cứu khoa học cơ bản. IV. Điều chế
- Hassium được sản xuất với số lượng nhỏ bằng cách bắn phá các hạt nhân nguyên
tử nhẹ hơn bằng neutron trong các lò phản ứng hạt nhân hoặc máy gia tốc hạt nhân. GS G I S H I el e mhol h tz ? Máy M áy gi g a a tốc ố hạ c t hạ t uyến uy t ến ính í U nh N U I N L I AC A C của c ủa GSI G , ,nơi phá t phá hi ện ệ r n a r Has H s as i s um G S G I S H elmhol h tz ? Tr T u r n u g tâ t m m nghiên iê n cứu ứu ion n nặng GSI GS I Helm He h lm oltz( z vi v ết
ế tắt là GSI) )tại vùng ngoại ô của c Da D rm r s m tadt, Đức được ợ c thành lập và v o năm m 1969, để để tiến iế hành nghiên iê cứu v c à vớ à v i các máy ác
máy gia tốc ion nặng. Phòng thí nghiệm iệ thực hực hiện cá c c á c nghiên ê cứu c cơ c bản ả và và ứn ứ g dụng tro tr ng vật ậ lý và và cá c c á ngàn ngà h khoa a học ọc tự ự nhiên hiê liên liê quan. Các á c lĩnh vực vực nghiên iê cứu ứ ch c ín í h bao a gồm vật vậ lý l plas a ma s , ma vật vậ lý nguyên ê tử, ử nghiên iê cứu c cấ c u ấ trúc úc và p à hản hả ứng hạt hạ nhân , nghiên iê cứu l c ý si ý s nh và n và ghiên iê cứu y c học. c Tr T ong nhữn ữ g năm ă m tới, ớ GSI GS Isẽ s ẽ phát á triển iể thành à mộ m t cấ c u trú tr c c quốc ốc tế ế có c tên l ê à à FA F I A R I cho c Cơ C sở s Ng N hiên hiê cứu c A ứu n A tipro tipr ton và à Ion I .
- Meitnerium được sản xuất bởi Peter Armbruster, Gottfried Münzenber và 108
cộng sự làm việc tại Gesellschaft für Schwerionenforschung(Trung tâm nghiên
Mt cứu ion nặng GSI Helmholtz) ở Darmstadt, Đức vào năm 1982 và được đặt tên
Meitnerium theo tên nhà khoa học Lise Meitner. [278]
- Hóa trị: II, IV, VI, ... NTK: Mt = [278] đvC
Chỉ một lượng nhỏ Meitnerium được sản xuất hoặc tách
ra, do đó có rất ít thông tin về tính chất hóa học của nó. I. TCVL
Hình ảnh trừu tượng này
- Chất rắn(dự đoán) phóng xạ, độ được c l . ấy cảm hứng từ II. TCHH
hình ảnh phóng đại của
- Meitnerium có tính chất hóa họ c c á t c ươ h ng ạt tự n cá gu c y ng ê uyê
n tử.n tố nhóm VIII B (Co, Rh, Ir, …). III. Ứng dụng
- Do sản xuất một lượng nhỏ và thời gian bán hủy ngắn của nó, hiện tại không có công
dụng nào đối với Meitnerium ngoài nghiên cứu khoa học cơ bản. IV. Điều chế
- Meitnerium được sản xuất với số lượng nhỏ bằng cách bắn phá các hạt nhân nguyên tử
nhẹ hơn bằng neutron trong các lò phản ứng hạt nhân hoặc máy gia tốc hạt nhân. Li se M e eitne n r? r Lise Me M itne n r? ahn tto H video id eitner và O ise M L Li L se i Meit i ner e (1878-1968) là l một tnhà vật tlý
l người iÁo - Thụy Điể i n, Bà B đã là l m nghiê
i n cứu về phóng xạ và vật tlý l hạt n t hân. Meit i ner r đã nhận ậ được nhiề i u giải ả thư t ởn ở g và dan a h hiệ i u, nhưng bà à không được ợ đồng nhận Giả i i iNobel lHóa
a học năm 1944 "vì ìtạ t o ra nguyên ê tố
t mới inhờ phản ứng
phân hạch", mà giả i i ithưởn ở g này à được c trao riên ê g cho người icộng tá t c lâ l u năm của bà là l Otto t Hahn. Mộ
M t tsố nhà khoa học và nhà báo á đã ã gọi iviệc ệ lo l ại itr t ừ bà là à "bất t công“ vì sự tr t ọng nam a khinh i nữ. Theo e kho lưu tr t ữ giả i i iNobel,l bà đã được ợ đề cử 19 lầ l n cho giả i i i Nobel l Hóa học từ t năm ă 1924 đến ế năm ă 1948, và 29 lần ầ ch c o giả i i i Nobel lVật ậ lý l từ t năm ă 1937 đến năm ă 1965. Tuy T nhiê i n, Meitin t er đã nhận ậ được ợ nhiều ề giả i i ith t ưởn ở g vin i h dự khác. Nguyên ê tố t hóa a học Me M itin t eriu i m được ợ đặt ttheo tê t n của a bà.
- Darmstadtium được sản xuất bởi Peter Armbruster, Gottfried Münzenber 107
và cộng sự làm việc tại Gesellschaft für Schwerionenforschung(Trung tâm Ds
nghiên cứu ion nặng GSI Helmholtz) ở Darmstadt, Đức vào năm 1994 và được
Darmstadtium đặt tên theo tên thành phố (Darmstadt) của Đức. [281]
- Hóa trị: VIII, VI, ... NTK: Ds = [281] đvC
Chỉ một lượng nhỏ Darmstadtium được sản xuất hoặc
tách ra, do đó có rất ít thông tin về tính chất hóa học của nó. I. TCVL Darmstadtium có tính phóng
- Chất rắn(dự đoán) phóng xạ, độc. II. TCHH
xạ cao, vì vậy hình ảnh dựa - Darmstadtium có títnrh ê chất n m hó ột a học m tươ ô hì ng tự các nh nguyênguyê
n tử n tố nhóm VIII B (Ni, Pd, Pt, …).
III. Ứng dụng trừu tượng và các dấu vết của
- Do sản xuất một lượng nhỏ và thời gian bán hủy ngắn của nó, hiện tại không có
các hạt “sub – atomic”.
công dụng nào đối với Darmstadtium ngoài nghiên cứu khoa học cơ bản. IV. Điều chế
- Darmstadtium được sản xuất với số lượng nhỏ bằng cách bắn phá các hạt nhân
nguyên tử nhẹ hơn bằng neutron trong các lò phản ứng hạt nhân hoặc máy gia tốc hạt nhân. Pe P ter A r A m r br b us u ter ? P e P ter Ar A mbr mb ust s er e ? Peter r Armb m rust u er e (25/7/1 / 931) là à một nhà à vật tlý người ờ iĐức và được ợ ghi inhận là l
người i đồng phát t hiện ệ ra các nguyên tố t 107 (Bo B hriu i m), 108 (Hassiu ssi m), 109 (Me M itin t erium), 110 1 ( Darmsta st dtitum), 11 1 1 1 (Ro R en e tgeniu i m) và 11 1 2 (Co C pernic ni iu i m) với i đối itá t c nghiê hi n cứ c u Gotttftri f ed e Mü M nzenberg r và cộng sự. Lãnh vực nghiê i n cứ c u chín í h của a ông là l phân hạch c , tá t c c động qua a lạ l i i của cá c c io i n nặng tr t ong vật tch c ất tvà vật tlý l nguyên tử. Ông đã nhận ậ được ợ nhiề i u giải ả th t ưởng ch c o công việ i c c củ c a mìn ì h, bao gồm Huy ch c ương Max Bo B rn (1988); Huy chương Ste t rn-Ger e lac a h (1997); ; Giả i i i Hóa học hạt t nhân của Hội iHóa a học Hoa a Kỳ (1997). 111
- Roentgenium được sản xuất bởi Peter Armbruster, Gottfried Münzenber
và cộng sự làm việc tại Gesellschaft für Schwerionenforschung(Trung tâm Rg
nghiên cứu ion nặng GSI Helmholtz) ở Darmstadt, Đức vào năm 1994 và được
Roentgenium đặt tên theo tên nhà khoa học Wilhelm Conrad Röntgen. [280]
- Hóa trị: I, III, V, ... NTK: Rg = [280] đvC
Chỉ một lượng nhỏ Roentgenium được sản xuất hoặc tách
ra, do đó có rất ít thông tin về tính chất hóa học của nó. I. TCVL
- Chất rắn(dự đoán) phóng xạ, độc.
Hình ảnh dựa trên ống tia II. TCHH - Roentgenium có X t. ín Th h cihấ ết t hóa kế nhọc ền tươ đư ng ợc tự lấ cá
y c nguyên tố nhóm I B (Cu, Ag, Au, …). III. Ứng dụng
c ảm hứng từ thiên văn học - Do sản xuất một ti al ượ X ng v nhỏ à m v á à thờ y gi ia g t ian ốc bán
hạt.hủy ngắn của nó, hiện tại không có công
dụng nào đối với Roentgenium ngoài nghiên cứu khoa học cơ bản. IV. Điều chế
- Roentgenium được sản xuất với số lượng nhỏ bằng cách bắn phá các hạt nhân nguyên
tử nhẹ hơn bằng neutron trong các lò phản ứng hạt nhân hoặc máy gia tốc hạt nhân. Wi W lhelm Conr C ad Rönt a gen ? W i
W lhelm Conrad Röntgen ? video id Wi W lih l elm l Conr n ad d Röntgen e (1845-1923) là l một tnhà vật tlý l người iĐức, là l giá i m đốc c Vi V ệ i n vật tlý l ở Đại ihọc Würzb z urg. r Ông đã ã khám phá ra a sự bức xạ điện ệ từ t , lo l ại i bức xạ không nhìn ì th t ấy ấ có bước c sóng ngắn (10 pm < lam a da < 10 nm) mà ngày nay chúng ta t được ợ biế i t tđến ế với icá c i itê t n tita i x-quang hay ti t a a Rö R ntgen.
Với những cống hiến to lớn của mình cho khoa học, Ông nhận được
Huy chương Matteucci(1896); Huy chương Rumford(1896); Huy chương Elliott Cresson(1897); Giải ả Nobel lV ật l t ý đầu ầ titê i n(1901). Nguyên ê tố t hóa a học 11 1 1- 1 Ro R en e tgeniu i m được đặt ặ th t eo tê t n của ông.
- Meitnerium được sản xuất bởi Peter Armbruster, Gottfried Münzenber và 112
nhóm của họ làm việc tại Gesellschaft für Schwerionenforschung(Trung tâm
Cn nghiên cứu ion nặng GSI Helmholtz) ở Darmstadt, Đức vào năm 1996 và được
Copernicium đặt tên theo tên nhà khoa học Nicolaus Copernicus. [285]
- Hóa trị: I, II, ... NTK: Cn = [285] đvC
Chỉ một lượng nhỏ Copernicium được sản xuất hoặc tách
ra, do đó có rất ít thông tin về tính chất hóa học của nó. I. TCVL
- Chất rắn(dự đoán) H ph ì óng nh ả xạ, độc nh nà .
y tập hợp một biểu đồ
sao thế kỷ 17, các vòng đồng tâm II. TCHH
lấy cảm hứng từ hệ mặt trời, một
- Copernicium có tính chất hóa học tương tự các nguyên tố nhóm II B (Zn, Cd, Hg, …).
dạng kim loại màu bạc và sơ đồ III. Ứng dụng
- Do sản xuất một lượ mặ ng t nhỏ bằ và ng c thờ ủa i g m ia á n bá y gi n a h t ủy ốc ngắ i n của on nặ nó,
ng hiện tại không có công dụng nào đối với Cope nơi rnicium nguyê ngoà n t i ng ố nà hiên cứu y được kh tạ oa học o ra l c ầ ơ n bản. IV. Điều chế đầu tiên.
- Copernicium được sản xuất với số lượng nhỏ bằng cách bắn phá các hạt nhân nguyên
tử nhẹ hơn bằng neutron trong các lò phản ứng hạt nhân hoặc máy gia tốc hạt nhân. H ì H nh n ả h nh n từ k t ên ê h n You Y tu t b u e: e :Người Ngườ Nổi N T iế T n iế g (m ( ột m ột kê k n ê h t h r t i th i t ức r ức ấ r t b t ổ b ích íc ) ) Ni N co c laus au s Cop C er e ni n cus? s Ni N co c laus au s Co C p o ern r i n cus? s video id Nic i ola l us s Cope p rnic i us u / Cô-péc- c níc í h (1473 - 1543) là l một n t hà thiê i n văn học người iBa B Lan đã nêu ra hìn hì h th t ức hiệ i n đại iđầu titê i n của th t uyết nhật ttâm â (Mặ M t tTr T ời ở i tr t ung tâ t m) tr t ong cuốn sách mang títn
í h mở đầu một tkỷ nguyên ê củ
c a ông, cuốn Về sự sự ch
c uyển động quay của các th t iê i n th t ể . Co C pernik i là à một ttr t ong những học giả ả có c hiểu ể biết ế về nhiề i u phươn ơ g diệ i n ở th t ời iđại i ông sống. Ông là l một nhà à to t án học, thiê hi n văn học, l , uật tgia i , học giả ả kinh điể i n, nhà cai t i rị, viê i n chức hành ch c ính, nhà à ngoại igiao a , nhà à kin i h tế t , và à người ilíln í h. Tr T o r ng o số s nhữ nh ng ữ khả k hả nă n ng ă ng củ c a ủ a mì m nh ì , nh ông đã đã lự l a ự a chọ c n họ thi t ê hi n ê văn vă học học là l m à m nghề ngh ề nghi n ệ ghi p ệ chí c n hí h, n h, sự s ự phá p t há t tr t i r ể i n ể n th t uyế h t uyế t nhậ n t hậ t tâ t m â m củ c a ủ a ông ông đượ đư c ợ c co c i o i là l g à i g ả i ả th t uyế h t uyế t khoa khoa học h qu ọc a qu n a t n r t ọn r g ọn nhấ g t nhấ t t r t ong o l ng ịlc ị h c s h ử s , ử đá , nh đá dấ nh u dấ bư u ớ bư c ớ c c hu c yể hu n yể s n a s ng a t ng h t i h ê i n ê vă n n h vă ọc n h h ọc i h ệ i n ệ đạ n i đạ .i 113
- Nihonium được các nhà khoa học làm việc tại Trung tâm Khoa học Máy
Nh gia tốc RIKEN Nishina ở Wako, Nhật Bản tổng hợp vào năm 2004 và Nihonium
được đặt tên nước Nhật (Nihon - Đất nước Mặt trời mọc). [286]
- Hóa trị: I, III, ... NTK: Nh = [286] đvC
Chỉ một lượng nhỏ Nihonium được sản xuất hoặc tách
ra, do đó có rất ít thông tin về tính chất hóa học của nó.
Hình ảnh phản ánh cách đặt tên của I. TCVL
nguyên tố và sử dụng các ký tự kanji
- Chất rắn(dự đoán) phóng xạ, độc.
truyền thống của Nhật Bản là 'ni' và 'hon'
II. TCHH tạo nên tên của Nhật Bản có nghĩa là 'nơi
- Nihonium có tính chất hóa học chưa được xác định một cách rõ r
mặàtn tg.rời mọc'. Hình ảnh cũng có biểu III. Ứng dụng
t ượng mặt trời từ quốc kỳ Nhật Bản và - Do sản xuất m cộát l c ư sợng nhỏ và ơ đồ khá t c hời g nha ian b u đạiá nd h i ủ ệ y n n c gắn c ho c ủ ấ a n u ó, hiện tại không có
công dụng nào đối với Nithon rúcium m á ngoà y gi ia n t ghi ốc ên hạctứ . u khoa học cơ bản. IV. Điều chế
- Nihonium được sản xuất với số lượng nhỏ bằng cách bắn phá các hạt nhân nguyên
tử nhẹ hơn bằng neutron trong các lò phản ứng hạt nhân hoặc máy gia tốc hạt nhân. Vi V ện ệ R I R KEN ? EN Vi V ện R n I R KEN E ? N Việ V n n ng n hiê h n iê cứu c ứu vật vật lý và hó h a học h RIK RI E K N N (vi v ết
ế tắt là RIK RI E K N) N )là một viện iệ nghiên iê cứu ứ kh k oa học c lớn ở ở Nh N ật Bản, được ượ thành lập vào v năm ăm 1917. Rik R en e là Việ V n nghiên iê cứu c và v phát triể
tr n quốc gia được c ch c ỉ định và v trướ r c ướ đây là y Cơ C quan hành chí c nh độc ộc lập . Rik R en e thực hực hiện nghiên iê cứu ứ trong nhiều lĩnh vực vực khoa a học, bao a gồm m vật l ậ ý , hóa óa học , s , in s h học ọc , gen , khoa h a ọc ọc y tế , kỹ , thuật uậ , máy má tính hiệu s ệ uất uấ ca c o a và và k hoa h a ọc t ọc ính toán toá , từ nghiên c ê ứu ứ cơ bả ơ n đến ế ứng dụng thực ự tế với 4 ớ 85 đối tác tr c ê tr n toàn t à hế g hế iới iớ . 114
- Flerovium được sản xuất bởi các nhà khoa học làm việc tại Viện Nghiên Fl
cứu Hạt nhân chung ở Dubna, Nga vào năm 1998 và được đặt tên nhà khoa Flerovium học Georgy Flyorov. [289]
- Hóa trị: II, IV, ... NTK: Fl = [289] đvC
Chỉ một lượng nhỏ Flerovium được sản xuất hoặc tách
ra, do đó có rất ít thông tin về tính chất hóa học của nó.
Hình ảnh có dạng trừu tượng lấy cảm I. TCVL
hứng từ hàng rào của Viện nghiên cứu
- Chất rắn(dự đoán) phóng xạ, độc.
hạt nhân chung (JINR), nơi phát hiện ra
II. TCHH nguyên tố này. Hai màu chính đại diện
- Flerovium có tính chất hóa học chưa được xác định một cách rõ ràng.
cho việc tạo ra nguyên tố từ Calcium và
III. Ứng dụng
Plutonium. Hình nền có các đường và
- Do sản xuất một lượng nhỏ và thời gian bán hủy ngắn của nó, hiện tại không có công dụng nào đ m ốặit v cớắi tFle hạrtovium được n tgoài óm ng tắ hti tên ừ c s ứu khoa ơ đồ m h ặt ọ c cơ bản. IV. Điều chế
bằng của máy gia tốc tại JINR.
- Flerovium được sản xuất với số lượng nhỏ bằng cách bắn phá các hạt nhân nguyên
tử nhẹ hơn bằng neutron trong các lò phản ứng hạt nhân hoặc máy gia tốc hạt nhân. Georgy F or lyorov ? yor G eorg or y y Fl F yorov ? yor Ge G o e rgy r Ni N kol k ayevich vic Flyoro r v (1 ( 913 - -1990) 0) là à mộ m t nhà à vật lý hạt ạ nhân hâ người Xô X V iế V t iế , người ngườ được đượ c biết iế đến với khám á m phá á ra a phân hâ hạc ạ h c tự phát há và đóng góp của ủa ông đối với ớ vật vậ lý củ c a a phản ả ứng nhiệt. iệ Ng N oài oà ra r , a ông cò c n được c biết iế đến ế với vớ lá lá thư gửi ử cho c Jos J eph e Stali a n, giữa iữa Th T ế ế chi c ến ế II, I để để bắt ắ đầu ầ dự án á bom nguyên tử tron tr g Li L ên ê Xô. Ôn Ô g nhận ậ được ượ c danh hiệu iệ Anh A hùng lao la động xã xã hội chủ c nghĩa (19 ( 49).) Nguy ên ê tố hóa óa học 114 1 -F - le F rov r ium được đượ đặt đặ theo tên củ n c a ô a ng. 115
- Moscovium được các nhà khoa học làm việc tại Viện Nghiên cứu Hạt
Mc nhân ở Dubna, Nga cùng với các nhà khoa học từ Phòng thí nghiệm Quốc Moscovium
gia Lawrence Livermore và Phòng thí nghiệm Quốc gia Oak Ridge, Hoa Kỳ [289]
đã công bố việc tạo ra vào năm 2004 và được đặt tên theo vùng Moscow
của Nga, là nơi có nhiều nghiên cứu về nguyên tố siêu nặng của Nga.
- Hóa trị: III, V, ... NTK: Mc = [289] đvC
Chỉ một lượng nhỏ Moscovium được sản xuất hoặc tách
ra, do đó có rất ít thông tin về tính chất hóa học của nó. I. TCVL
- Chất rắn(dự đoán) phóng xạ, độc. II. TCHH
Hình ảnh phản ánh cách đặt tên của - Moscovium có tính nguyênch t ất ố thóa học tương t rong đó nó s ự các ngu ử dụng cyáên c t c ố n hi hóm V A (Bi, …).
III. Ứng dụng
tiết trừu tượng của kiến trúc truyền
- Do sản xuất một lượng nhỏ và thời gian bán hủy ngắn của nó, hiện tại không có
thống từ vùng Moscow với cả dạng
công dụng nào đối với Moscovium ngoài nghiên cứu khoa học cơ bản.
mái vòm củ hành và các đặc điểm kiến
IV. Điều chế: Moscovium được sản xuất với số lượng nhỏ bằng cách bắn phá các hạt nhân nguyên t trử n úc hẹ hơ khá n c bằ . Hnìg neu nh ả tron nh c trong ũng ccá ó c clò á p
c hản ứng hạt nhân hoặc máy gia tốc hạt nhân.
đường mòn hạt được trừu tượng hóa. Phả Ph n n ứ n ứ g n t ổ t ng n h g ợ h p p h ạt ạ n t h n ân â ? Ph P ả h n ứ n ứ g t g ổ t ng n h g ợ h p p hạ h t ạ n t h n ân n ? video Phả h n n ứng tổn t g ổn hợ h p p hạt ạt nh n â h n hay a phả h n n ứng nhiệ h t thạ h ch c , p , h p ản ứn ứ g hợp ợ p hạch
ạc , trong vật lý học, là quá á trìn r h giữa iữa 2 hạt nhân â trở tr lên lê hợp ợ lại lạ với ớ nhau ha để ể tạo tạ nên ê một hạt nhân mớ m i ớ nặn ặ g hơn hơ (n ( guyên ê tố mới) mớ . Cù C ng với ớ quá á trìn tr h này nà là là sự phóng th t ích íc năng lượ ư ng hay ha hấp hấ thụ năn nă g lượng tùy vào và khối lượ ư ng của c hạt hạ nhân th t am gia a . Phản hả ứng tổng hợp hợ hạt hạ nhân hâ là l một m tro tr ng hai loại ạ phản hả ứng hạt hạ nhân â . Loại ikia a là là phản ứng ph ân â hạc hạ h c .
- Livermorium được các nhà khoa học làm việc tại Viện Nghiên cứu Hạt 116
nhân ở Dubna, Nga cùng với các nhà khoa học từ Phòng thí nghiệm Quốc
Lv gia Lawrence Livermore, Hoa Kỳ đã công bố việc tạo ra vào năm 2000 và Livermorium
được đặt tên theo thành phố Livermore, California, Hoa Kỳ. [293]
- Hóa trị: II, IV, ... NTK: Lv = [293] đvC
Chỉ một lượng nhỏ Livermorium được sản xuất hoặc tách
ra, do đó có rất ít thông tin về tính chất hóa học của nó. I. TCVL
Hình ảnh có dạng trừu tượng lấy - Chất rắn(dự c đảoá m n) p hứ hón ng tg x ừ ạ, hì độc. nh ả nh từ Phòng Mục
II. TCHH tiêu NIF tại Phòng thí nghiệm Quốc - Livermorium c gi ó a tí Lnah c w h r ấ e tn h c ó e a h Liọc ve trươ m ng t ore ự cá . H c a ingu m y à ê u n tố nhóm VI A (Po, …).
III. Ứng dụng trong hình ảnh đại diện cho hai - Do sản xuất một lư nguyê ợn n tg nhỏ ố va v c àh tạhờ mi gia vớin bán nha hủy n u để tgạắn
o của nó, hiện tại không có
công dụng nào đối với Livermorium ngoài nghiên cứu khoa học cơ bản.
thành Livermorium: Calcium và
IV. Điều chế: Livermorium được sản xuất với số lượng nhỏ bằng cách bắn phá các Curium.
hạt nhân nguyên tử nhẹ hơn bằng neutron trong các lò phản ứng hạt nhân hoặc máy gia tốc hạt nhân. Phòng Phò t ng hí t nghiệ hí m Q uốc uố gia Law La r w e r nce Liv e Liv rmor o e r ? Phòng Phò ng thí t nghiệ hí m Q uốc uố gia La L w a r w e r nce Liv e Liv rmo m re r ? Phòn h g th t í h ngh n iệm iệ m Qu Q ốc ốc gia La L wr w e r n e c n e c Liv L er e m r o m re r ( ( L LNL L ) ) là là mộ m t cơ c sở s ở nghiên hiê cứu c liên ban ba g ở ở Liv L er e m r o m re r , e Ca C li a for f n or ia , Hoa H Kỳ K , được ượ c thành à lập ậ bởi Đạ Đ i học c Ca C lifo lif rnia r , B e B rke r ley le vào và năm ă m 1952. Ph P òng thí nghiệm iệ La L wr w e r n e ce c e Li L ver ve mor r e mor e trở tr thành hà cơ c sở s độc lập lậ vào à năm nă m 1971 và à đượ ư c c ch c ỉ định là là phòng thí nghiệm q hiệ uốc uốc gia gia vào và năm 19 m 81. LL L NL L NL tự ự mô tả ả là là "cơ ơ sở s nghiên cứu c và và phát há triể tr n hàng đầu đầ về ề khoa oa học ọc và và công nghệ ệ áp á dụng cho c an a ninh quốc ốc gia." T ia r ." T ác á h c nhiệm hiệ chín c h của c nó là là đảm đả bảo ả sự s an a toàn, à an a ninh và và độ tin cậ c y ậ củ c a a vũ khí hạt n ạ hân hâ của c quốc g c ia thông qua v ua iệc iệ c áp d á ụng khoa học, kỹ thuật uậ và và côn c g nghệ hệ tiên tiê tiến. 117
- Tennessine được các nhà khoa học làm việc tại Viện Nghiên cứu Hạt nhân Ts
ở Dubna, Nga cùng với các nhà khoa học từ Phòng thí nghiệm Quốc gia
Tennessine Lawrence Livermore và Phòng thí nghiệm Quốc gia Oak Ridge, Hoa Kỳ đã [294]
công bố việc tạo ra vào năm 2010 và được đặt tên theo vùng Tennessee của
Hoa Kỳ là nơi có Phòng thí nghiệm Quốc gia Oak Ridge.
- Hóa trị: I, III, V, ... NTK: Ts = [294] đvC
Chỉ một lượng nhỏ Tennessine được sản xuất hoặc tách
ra, do đó có rất ít thông tin về tính chất hóa học của nó. I. TCVL
Hình ảnh phản ánh cách đặt tên của - Chất rắn(dự đoán) nguyêphó n t ng ố. x T ạ, độc. rong đó sử dụng phiên II. TCHH
bản trừu tượng của cờ tiểu bang
- Tennessine có tính chất hóa học tương tự các nguyên tố nhóm VII A (At, …).
Tennessee có ba ngôi sao trắng trên III. Ứng dụng - Do sản xuất nề m n ộxt l a ư n ợhn lga nh m ỏ v và à t đ hỏờ. i g H iìan b nh á ả n hủ nh cy ngắn ũng c củ
ó a nó, hiện tại không có công dụng nà coá đ c ố i đ với Tenne ường mòssi n ne hạ n t goài n được g thriê ừ n c u t ứ ưu kho ợng a học cơ bản. IV. Điều chế: T hóaenne và ssi cá n c e được sả đồ họa n xuấ kháct v n ớ h i số au l đưạợing di n ệ h n ỏ
bằng cách bắn phá các hạt
nhân nguyên tử nhẹ hơn bằng neutron trong các lò phản ứng hạt nhân hoặc máy gia
cho cấu trúc máy gia tốc hạt. tốc hạt nhân. Phò Ph ng n th g í th n í gh g iệm Q iệm uố u c g ia i Oak R ak i R dge d ? Ph P òng t g h t í n í gh n iệm gh Q u Q ốc gia Oak R ak i R dge g ? Ph P òng thí h ng n hiệ h m m quố u c c gia Oak Oak Rid R ge ge (viết ttắt t là ORNL OR NL ) ) là là một m phòng thí nghiệm ệ m quốc c gia ia về ề khoa học ọc và công nghệ đa a chươ c n hươ g trình ở thành hà phố Oa O k a Ridge, e Te T nn e es e s s ee e , Hoa e , Hoa Kỳ K , được đượ thành à lập vào năm nă 194 9 2. Các á c chươ c n hươ g trình tr khoa học c củ c a a ORNL OR NL tập trung vào à vật vậ liệu liệ , neutro utr n khoa học, năn nă g lượng, máy má tính hiệu iệ năn nă g ca c o, hệ t hệ hống si g s nh học và c an a ninh quốc gia.
- Oganesson được các nhà khoa học làm việc tại Viện Nghiên cứu Hạt 118 Og
nhân ở Dubna, Nga cùng với các nhà khoa học từ Phòng thí nghiệm Quốc
gia Lawrence Livermore, Hoa Kỳ đã công bố việc tạo ra vào năm 2006 Oganesson
và được đặt tên nhà khoa học Yuri Oganessian. [294]
- Hóa trị: - NTK: Og = [294] đvC
Chỉ một lượng nhỏ Oganesson được sản xuất hoặc tách ra,
do đó có rất ít thông tin về tính chất hóa học của nó. I. TCVL
- Chất rắn(dự đoán) phóng xạ, độc.
Hình ảnh phản ánh việc đặt tên cho II. TCHH
nguyên tố theo tên nhà khoa học Yuri
- Oganesson có tính chất hóa học chưa được xác định một cách rõ ràng.
Oganessian, người được coi là nhà nghiên
III. Ứng dụng
cứu hàng đầu thế giới về các “Superheavy
- Do sản xuất một lượng nhỏ và thời gian bán hủy ngắn của nó, hiện tại không có công dụng nào đối vớ eli eOg m a e ne nt sson ”và ng “Isolàai nghiên nd of s ctứ a u bi klihtoa y” họ . c cơ bản.
IV. Điều chế Hình ảnh mô tả bằng đồ họa về ““Island
- Oganesson được s of s ảtn a x biulấ itt vớ y” i ” số l dựaượ t n rêg nhỏ bằng n đồ họa các 3D h bắ về n c p ấ há u các hạt nhân nguyên
tử nhẹ hơn bằng neutron trong các lò phản ứng hạt nhân hoặc máy gia tốc hạt nhân. trúc vỏ hạt nhân. Yu Y ri r Ogane gan ssi s an an ? Yu Y ri Ogane gan ssi s an? an Yu Y ri iT so T la l kovic i h Oganessia ssi n
n (sinh ngày 14 tháng 4 năm 1933) là l một ột nhà vật tlý l hạt tnhân â người iNga- a Armenia i , người ờ iđược coi là l nhà à nghiê i n cứ c u hàng đầu th t ế giớ gi i i về các á nguyên tố t hóa học c siê si u nặng (tr t an a sactitn i oid i ). Ông đã dẫn đầu việ i c c phát thiệ i n ra các nguyên tố t hóa học này tr t ong bảng tu t ần hoàn à . Nguyên tố t hóa học 118 1 -Ogan a esson được ợ đặt tth t eo tê t n của a ông. Ông đã nhận ậ được nhiề i u giải ả th t ưởng ch c o công việ i c củ c a mìn ì h, bao gồm Huy
chương vàng Lomonosov (2017); Giải ả th t ưởng Demid i ov (2019); ;…
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- “Lúa chiêm lấp ló đầu bờ, Hễ nghe tiếng sấm phất cờ mà lên”
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62
- Slide 63
- Slide 64
- Slide 65
- Slide 66
- Slide 67
- Slide 68
- Slide 69
- Slide 70
- Slide 71
- Slide 72
- Slide 73
- Slide 74
- Slide 75
- Slide 76
- Slide 77
- Slide 78
- Slide 79
- Slide 80
- Slide 81
- Slide 82
- Slide 83
- Slide 84
- Slide 85
- Slide 86
- Slide 87
- Slide 88
- Slide 89
- Slide 90
- Slide 91
- Slide 92
- Slide 93
- Slide 94
- Slide 95
- Slide 96
- Slide 97
- Slide 98
- Slide 99
- Slide 100
- Slide 101
- Slide 102
- Slide 103
- Slide 104
- Slide 105
- Slide 106
- Slide 107
- Slide 108
- Slide 109
- Slide 110
- Slide 111
- Slide 112
- Slide 113
- Slide 114
- Slide 115
- Slide 116
- Slide 117
- Slide 118
- Slide 119
- Slide 120
- Slide 121
- Slide 122
- Slide 123
- Slide 124
- Slide 125
- Slide 126
- Slide 127
- Slide 128
- Slide 129
- Slide 130
- Slide 131
- Slide 132
- Slide 133
- Slide 134
- Slide 135
- Slide 136
- Slide 137
- Slide 138
- Slide 139
- Slide 140
- Slide 141
- Slide 142
- Slide 143
- Slide 144
- Slide 145
- Slide 146
- Slide 147
- Slide 148
- Slide 149
- Slide 150
- Slide 151
- Slide 152
- Slide 153
- Slide 154
- Slide 155
- Slide 156
- Slide 157
- Slide 158
- Slide 159
- Slide 160
- Slide 161
- Slide 162
- Slide 163
- Slide 164
- Slide 165
- Slide 166
- Slide 167
- Slide 168
- Slide 169
- Slide 170
- Slide 171
- Slide 172
- Slide 173
- Slide 174
- Slide 175
- Slide 176
- Slide 177
- Slide 178
- Slide 179
- Slide 180
- Slide 181
- Slide 182
- Slide 183
- Slide 184
- Slide 185
- Slide 186
- Slide 187
- Slide 188
- Slide 189
- Slide 190
- Slide 191
- Slide 192
- Slide 193
- Slide 194
- Slide 195
- Slide 196
- Slide 197
- Slide 198
- Slide 199
- Slide 200
- Slide 201
- Slide 202