
















































































Preview text:
CHÀO MỪNG CÁC EM HỌC SINH LUẬT CHƠI
• Có 4 câu hỏi, mỗi nhóm sẽ trả
lời 1 câu hỏi trong thời gian
20s, với mỗi câu trả lời đúng
sẽ có 1 hình ảnh ẩn số xuất hiện.
• Sau khi cả 4 nhóm đã hoàn
thành các câu hỏi, quan sát lần
lượt các bức tranh gợi ý và
tiến hành đoán từ khóa. ĐI TÌM ẨN SỐ 01 02 03 04 Câu 1: Trong T
các chất sau: Ca(OH) , H PO , HNO , 2 H PO 3 ,4 HNO3 2 3 4
NaOH, Fe(OH) . Số chất thuộc hợp chất base là
3. Số chất thuộc hợp chất base 3 A. 1. B. 2. C. 3. D. 4. Câu 2: 2: Công thức
ông thứ hóa học của phosphori phos c phori acid cid là A. HNO .3 B. H SO . 2 3 C. H SO . B. H PO . 2 4 3 4 Câu 3: 3: Tr T ong r số s các chất tsau s : :HCl,l Cu(OH) , NaOH, 2, NaOH, 2
H SO , KOH. Số chất thuộc hợp chất acid là 2SO ,
4 KOH. Số chất thuộc hợp chất acid 2 4 A. 1. B. 2. C. 3. D. 4. Câu 4: 4: Hợp Hợ chất tFe(O Fe( H) có tên gọi là 3 có tên 3 A. iron(III) hydroxide B. iron(II) hydroxide C. iron(III) hydride D. iron(II) hydride ĐI TÌM ẨN SỐ M u Ố I Bài 12: MUỐI MỤC TIÊU BÀI HỌC
- Nêu được khái niệm về muối (các muối thông thường là hợp chất được hình
thành từ sự thay thế ion H+ của acid bởi ion kim loại hoặc ion NH +). 4
- Chỉ ra được một số muối tan và muối không tan từ bảng tính tan.
- Trình bày được một số phương pháp điều chế muối.
- Đọc được tên một số loại muối thông dụng.
- Tiến hành được thí nghiệm muối phản ứng với kim loại, với acid, với base,
với muối; nêu và giải thích được hiện tượng xảy ra trong thí nghiệm (Viết
phương trình hoá học) và rút ra kết luận vế tính chất hoá học của muối.
- Trình bày được mối quan hệ giữa acid, base, oxide và muối; rút ra được kết
luận về tính chất hoá học của acid, base, oxide. MỞ ĐẦU
Muối là loại hợp chất có nhiều
trong tự nhiên, trong nước biển,
trong đất, trong các mỏ (hình 12.1).
Vậy muối là gì? Muối có những
tính chất hoá học nào? Mối liên hệ
giữa muối với các loại hợp chất
khác được thể hiện như thế nào?
Hình 12.1. Một số muối trong tự nhiên a. Muối ăn b. CaCO có (NaCl) có 3 nhiều trong nhiều trong
các mỏ đá vôi nước biển VIDEO NỘI DUNG BÀI HỌC I. Khái niệm muối II. Tên gọi muối
Tính chất hóa học của
III. Tính tan của muối IV. muối
Mối quan hệ giữa acid, V.
Một số phương pháp VI. base, oxide và muối điều chế muối I. KHÁI NIỆM MUỐI HOẠT ĐỘNG
Tìm hiểu về các
phản ứng tạo muối
Bảng 1. Phản ứng tạo thành muối, tên gọi và thành phần
phân tử của một số muối
Thành phần phân tử của
Công thức phân tử muối tạo thành Phản ứng
của muối tạo thành và tên gọi
Cation kim loại Anion gốc acid Kim loại + Acid Muối +Hydrogen ZnCl2 Zn2+ Cl- Zn +2HCl ZnCl + H 2 2 Zinc chloride Acid + Base Muối + Nước NaCl Na+ Cl- HCl + NaOH NaCl + H O 2 Sodium chloride Acid + Oxide base Muối + Nước CuSO4 Cu2+ SO 2- H SO + CuO CuSO + H O 4 2 4 4 2 Copper(II) sulfate
Quan sát Bảng 1 và thực hiện các yêu cầu:
1. Nhận xét về sự khác nhau giữa thành phần phân tử của
acid (chất phản ứng) và muối (chất sản phẩm). Đặc điểm
chung của các phản ứng ở Bảng 1 là gì?
2. Nhận xét về cách gọi tên muối. SO SÁNH THÀNH PHẦN ACID MUỐI BASE • Nguyên • Kim loại • Kim loại tử hiđro • Nhóm • Gốc acid • Gốc acid hydroxide
Cho biết các muối: Na PO , MgCl , 3 4 2
CaCO , CuSO , KNO tương ứng với acid 3 4 3
nào trong số các acid sau: HCl, H SO , 2 4 H PO , HNO , H CO . 3 4 3 2 3 Na PO H PO 3 4 3 4 MgCl HCl Lời giải 2 CaCO H CO 3 2 3 CuSO H SO 4 2 4 KNO HNO 3 3
Muối ammonium được tạo ra khi thay thế ion
H+ của acid bằng ion ammonium (NH +). 4
Ví dụ: NH NO (ammonium nitrate), (NH ) SO 4 3 4 2 4 (ammonium sulfate). Khái niệm muối là gì? * Khá K i niệm: ệm : Mu M ối là hợp ch c ất được ư ợc tạo ạ ra a khi thay thế ion H+ H +tro r ng aci ac d bằng ion kim m loại oại hoặc ặ ion am m am on m ium ( um NH + NH ). 4 ) 4 * Cô * C ng thức ng t p hức hâ h n t n ử củ c a m a uố m i g ồm có c at có c ion k im m l oại và ani và on gốc aci n gốc a d Dạ D n ạ g tổng q uát: M A x y ( M: ( n guyên tử ử K L, K x l L, à c à h c ỉ s ố KL. ố K A: A g ốc aci ốc d aci , y l , à chỉ à số của g số của ốc ac ốc i ac d.). TÊN GỌI II. CỦA MUỐI
Bảng 12.1. Tên gọi muối của một số acid Acid Muối Ví dụ Hydrochloric acid Muối chloride Sodium chloride: NaCl (HCl)
Sulfuric acid (H SO ) Muối sulfate
Copper(II) sulfate: CuSO 2 4 4 Phosphoric acid Muối phosphate
Potassium phosphate: K PO (H PO ) 3 4 3 4
Carbonic acid (H CO ) Muối carbonate Calcium carbonate: CaCO 2 3 3 Nitric acid (HNO ) Muối nitrate
Magnesium nitrate: Mg(NO ) 3 3 2 Tên Tên kim loại Tên gốc
(kèm hòa trị nếu KL muối
= có nhiều hóa trị) acid Ví dụ: Na SO : sodium sulfate; 2 4 NH Cl : ammonium chloride; 4 CaCl : calcium chloride; 2 Fe(NO ) : iron(III) nitrate. 3 3
Bảng 2. Tên gọi một số gốc acid Gốc acid Tên gọi Gốc acid Tên gọi -Cl chloride -CH COO 3 acetate -Br bromide =S sulfide -I iodide -HS hydrogensulfide -NO3 nitrate =CO3 carbonate =SO4 sulfate -HCO3 hydrogencarbonate -HSO4 hydrogensulfate PO4 phosphate =SO3 sulfite =HPO4 hydrogenphosphate LUYỆN TẬP
Gọi tên các muối sau: KCl, ZnSO , MgCO , Ca (PO ) , 4 3 3 4 2 Cu(NO ) , Al (SO ) . 3 2 2 4 3 Lời giải
KCl: Potassium chloride, ZnSO : Zinc sulfate, 4
MgCO : Magnesium carbonate, Ca (PO ) : Calcium 3 3 4 2
phosphate, Cu(NO ) : Copper nitrate, Al (SO ) : 3 2 2 4 3 Aluminium sulfate TÍNH TAN III. CỦA MUỐI
- Có muối tan tót trong nước như: NaCl, CuSO , 4 Ca(NO ) ... 3 2
- Có muối ít tan trong nước như: CaSO , PbCl ,... 4 2
- Có muối không tan trong nước như: CaCO , 3 BaSO , AgCl,... 4
Bảng 3. Bảng tính tan trong nước của một số muối CÁC KIM LOẠI
GỐC K Na Ag Mg Ca Ba Zn Pb Cu Fe Fe Al ACID I I I II II II II II 11 II III III -Cl t t k t t t t i t t t t -NO t t t t t t t t t t 1 t 3 =SO t t i t i k t k t t t t 4 =CO t t k k k k k k - k - - 3 t P : O
chất dễ tan t tro t ng nước. k kk: chk ất khô k ng tan ( k độ t k an nh k ỏ hơn 0,0 k 1 g/1 k 00 g nướkc), 4
i: chất ít tan (độ tan nhỏ hơn 1 g/100 g nước). (-): chất không tổn tại hoặc bị nước phân huỷ LUYỆN TẬP
Sử dụng bảng tính tan, cho biết muối nào sau đây tan được
trong nước: K SO , Na CO , AgNO , KCl, CaCl , BaCO , 2 4 2 3 3 2 3 MgSO4 Lời giải
Muối tan được trong nước: K SO , Na CO , AgNO , 2 4 2 3 3 KCl, CaCl MgSO 2, 4 IV. TÍNH CHẤT HÓA HỌC CỦA MUỐI
Giáo viên chia lớp thành 4 nhóm Nhiệm vụ:
Các nhóm cùng tìm hiểu các Trạm kiến thức và
hoàn thành phiếu học tập.
Kết thúc 1 trạm , 1 nhóm trong 4 nhóm báo cáo
kết quả của nhóm dựa trên phiếu học tập và các nhóm nhận xét.
Giáo viên nhận xét chung, cho điểm và chốt kiến thức bài học. TRẠM KIẾN THỨC TRẠM 1: PHÂN TRẠM 2: QUAN TÍCH SÁT Đọc sách giáo khoa, Quan sát video thí PTHS1 nghiệm, PHTS1 TRẠM 4: TỔNG KẾT TRẠM 3: TRẢI Hoàn thành phiếu NGHIỆM học tập số 1 Tiến hành làm thí nghiệm, PHTS1 TRẠM 1: PHÂN TÍCH Nhiệm vụ:
- Các nhóm đọc sách giáo khoa (tr 64-66), thảo luận trong 3 phút hoàn
thành câu 1, 2 trong phiếu học tập số 1.
Phiếu học tập số 1
1. Nêu tính chất hóa học của muối?
2. Thí nghiệm thể hiện từng tính chất hóa học của muối?
3. Cách tiến hành, hiện tượng, PTHH của từng thí nghiệm? 02 03 04 01 Tác dụng với acid
Tác dụng với base Tác dụng với muối TN2: Dung dịch TN3: Dung dịch
Tác dụng với kim loại H SO tác dụng muối CuSO tác 2 4 4 TN4: Dung dịch dụng NaOH TN1: Ngâm 1 đoạn BaCl Na CO tác dụng 2 2 3 dây Cu trong dung CaCl2 dịch AgNO3 TRẠM 2: QUAN SÁT Nhiệm vụ:
- Các nhóm cùng quan sát 5 video thí nghiệm thể hiện tính chất hóa
học của muối và hoàn thành câu hỏi số 3 trong PHT. 02 03 04 01 Tác dụng với acid
Tác dụng với base Tác dụng với muối TN2: Dung dịch TN3: Dung dịch
Tác dụng với kim loại H SO tác dụng muối CuSO tác 2 4 4 TN4: Dung dịch BaCl dụng NaOH Na CO tác dụng TN1: Ngâm 1 đoạn 2 2 3 dây Cu trong dung CaCl2 dịch AgNO3 VIDEO 02 03 04 01 Tác dụng với acid
Tác dụng với base Tác dụng với muối TN2: Dung dịch TN3: Dung dịch
Tác dụng với kim loại H SO tác dụng muối CuSO tác 2 4 4 TN4: Dung dịch BaCl dụng NaOH Na CO tác dụng TN1: Ngâm 1 đoạn 2 2 3 dây Cu trong dung CaCl2 dịch AgNO3 VIDEO 02 03 04 01 Tác dụng với acid
Tác dụng với base Tác dụng với muối TN2: Dung dịch TN3: Dung dịch
Tác dụng với kim loại H SO tác dụng muối CuSO tác 2 4 4 TN4: Dung dịch BaCl dụng NaOH Na CO tác dụng TN1: Ngâm 1 đoạn 2 2 3 dây Cu trong dung CaCl2 dịch AgNO3 VIDEO 02 03 04 01 Tác dụng với acid
Tác dụng với base Tác dụng với muối TN2: Dung dịch TN3: Dung dịch
Tác dụng với kim loại H SO tác dụng muối CuSO tác 2 4 4 TN4: Dung dịch BaCl dụng NaOH Na CO tác dụng TN1: Ngâm 1 đoạn 2 2 3 dây Cu trong dung CaCl2 dịch AgNO3 VIDEO
Các nhóm báo cáo kết quả
trong phiếu học tập STT Cách tiến hành
Hiện tượng quan sát được Viết PTHH Nhúng dây Cu trong dung dịch
Kim loại màu xám bám ngoài Cu + 2AgNO → Cu(NO ) + 2Ag 1 AgNO 3 3 2 3 dây đồng. Dd không màu Nhỏ vài giọt dd chuyển dần sang màu xanh 2 H SO vào ống 2 4 nghiệm có chứa 1ml dd BaCl H SO + BaCl → BaSO + 2HCl 2 4 2 4 2
Có kết tủa trắng xuất hiện Nhỏ vài giọt dd 3 CuSO vào ống 4 nghiệm có chứa
Xuất hiện chất không tan CuSO + 2NaOH N → a SO + Cu(OH) 1ml dd NaOH 4 2 4 2 màu xanh lơ Nhỏ từ từ dd 4 CaCl vào ống 2 nghiệm có chứa 1ml dd Na CO
Có kết tủa trắng xuất hiện 2 3 CaCl + Na CO NaCl + CaCO 2 2 3 3
TRẠM 3: TRẢI NGHIỆM Nhiệm vụ:
- Nhóm 1: Thực hành làm thí nghiệm 1.
- Nhóm 2: Thực hành làm thí nghiệm 2.
- Nhóm 3: Thực hành làm thí nghiệm 3.
- Nhóm 4: Thực hành làm thí nghiệm 4. TRẠM 4: TỔNG KẾT Nhiệm vụ:
- Các nhóm hoàn thành phiếu học tập số 1. Muối + Kim loại Muối
mới + Kim loại mới Muối + Acid
Muối mới + Acid mới Ví dụ: Cu + 2AgNO Cu(NO ) + 2Ag Ví dụ: H SO + BaCl BaSO + 2HCl 3 3 2 2 4 2 4
Có ít nhất một sản phẩm là chất
khí/chất ít tan/không tan,... Muối + Base
Muối mới + Base mới Muối + Muối 2 Muối mới Ví dụ: CuSO + 2NaOH Na SO + Cu(OH) . 4 2 4 2
Có ít nhất một sản phẩm là chất Ví dụ: CaCl + Na CO NaCl + CaCO 2 2 3 3
khí/chất ít tan/không tan,...
Có một muối không tan hoặc ít tan V. MỐI QUAN HỆ GIỮA ACID, BASE, OXIDE VÀ MUỐI
Sơ đồ biểu diễn mối quan hệ giữa các hợp chất vô cơ Oxide Base + Acid + Base Oxide Acid (1) (2) Muối (4) (6) + Base + Acid + Kim loại + Oxide acid + Oxide base (5) + Acid + Base (7) Base + Muối Acid + Muối Lời giải (4) Oxide Base (1) Muối Base Muối CaO + HCl → CaCl + H O Fe(OH) + HNO → Fe(NO ) + H O 2 2 2 3 3 2 2 (2) (5) Oxide Acid Muối Muối Acid K O + CO → K CO 2 2 2 3 BaCl + H SO → BaSO + HCl 2 2 4 4 (3) Muối Base (6) Acid Muối
CuCl + NaOH → Cu(OH) + NaCl KOH + H SO → K SO + H O 2 2 2 4 2 4 2 LUYỆN TẬP
Viết phương trình hoá học xảy ra giữa các dung dịch sau:
a) Dung dịch NaCl với dung dịch AgNO .3
b) Dung dịch Na SO với dung dịch BaCl . 2 4 2
c) Dung dịch K CO với dung dịch Ca(NO ) . 2 3 3 2 Lời giải a) NaCl + AgNO AgCl + NaNO 3 3 b) Na SO + BaCl BaSO + 2NaCl 2 4 2 4 c) K CO + Ca(NO ) CaCO + 2KNO 2 3 3 2 3 3 LUYỆN TẬP
Viết các phương trình hoá học theo sơ đồ chuyền hoá sau: CuO CuSO CuCl Cu(OH) 4 2 2 Lời giải (1) CuO + H SO CuSO + H O 2 4 4 2 (2) CuSO + 2NaCl CuCl + Na SO 4 2 2 4 (3) CuCl + 2NaOH Cu(OH) + 2NaCl 2 2 VI. MỘT SỐ PHƯƠNG PHÁP ĐIỀU CHẾ MUỐI Acid + Base Acid + Muối Ví dụ: Ví dụ: HC1 + NaOH NaCl + H O 2 MUỐI H SO + BaCl BaSO + HCl 2 4 2 4 Acid + Oxide Base Oxide Acid + Base Ví dụ: Ví dụ: 2HNO + CuO Cu(NO ) + H O 3 3 2 2 Muối + Muối CO + NaOH Na CO + H O 2 2 3 2 Ví dụ: NaCl + AgNO AgCl + NaNO 3 3 LUYỆN TẬP
Viết ba phương trình hoá học khác nhau để tạo ra Na SO 2 4 từ NaOH Lời giải (1) 2NaOH + H SO Na SO + 2H O 2 4 2 4 2 (2) NaOH + CuSO Na SO + Cu(OH) 4 2 4 2 (3) 2NaOH + SO Na SO + H O 3 2 4 2 LUYỆN TẬP
Viết ba phương trình hoá học khác nhau đề điều chế CuCl .2 Lời giải (1) 2HCl + CuO CuCl + H O 2 2 (2) Cu + 2HCl CuCl + H ↑ 2 2 (3) 2NaCl + CuSO CuCl + Na SO 4 2 2 4 VẬN DỤNG
Muối Al (SO ) được dùng trong công nghiệp để nhuộm 2 4 3
vải, thuộc da, làm trong nước,... Tính khối lượng
Al (SO ) tạo thành khi cho 51 kg Al O tác dụng hết với 2 4 3 2 3 dung dịch H SO . 2 4 EM CÓ BIẾT!
Ứng dụng của sodium carbonate (soda)
Soda là hoá chất thông dụng. Ngoài những ứng
dụng trong công nghiệp, soda còn có những ứng dụng trong đời sống.
Soda được coi là chất tẩy rửa đa năng, có thể làm
sạch dầu mỡ và khử trùng bề mặt. Để làm sạch
những vết bẩn khó giặt như dầu mỡ, trà, cà phê
bám trên quần áo cần ngâm quấn áo vào nước ấm
có hoà tan soda (theo tỉ lệ 8 gam/lít) khoảng 30
phút hoặc lâu hơn, sau đó tiến hành giặt như bình thường. LIÊN HỆ THỰC TẾ Muối làm trung hòa acid dạ dày ?
“Thuốc muối” chữa bệnh dạ dày Thành phần chính: NaHCO3 NaHCO + HCl NaCl + CO + H O 3 2 2
Sau khi uống thuốc do có CO nên thường ợ lên, giải 2
phóng bớt hơi làm bụng dễ chịu hơn MỘT SỐ ỨNG DỤNG NaCl: muối ăn, sát trùng
Al (SO ) : xử lí nước thải
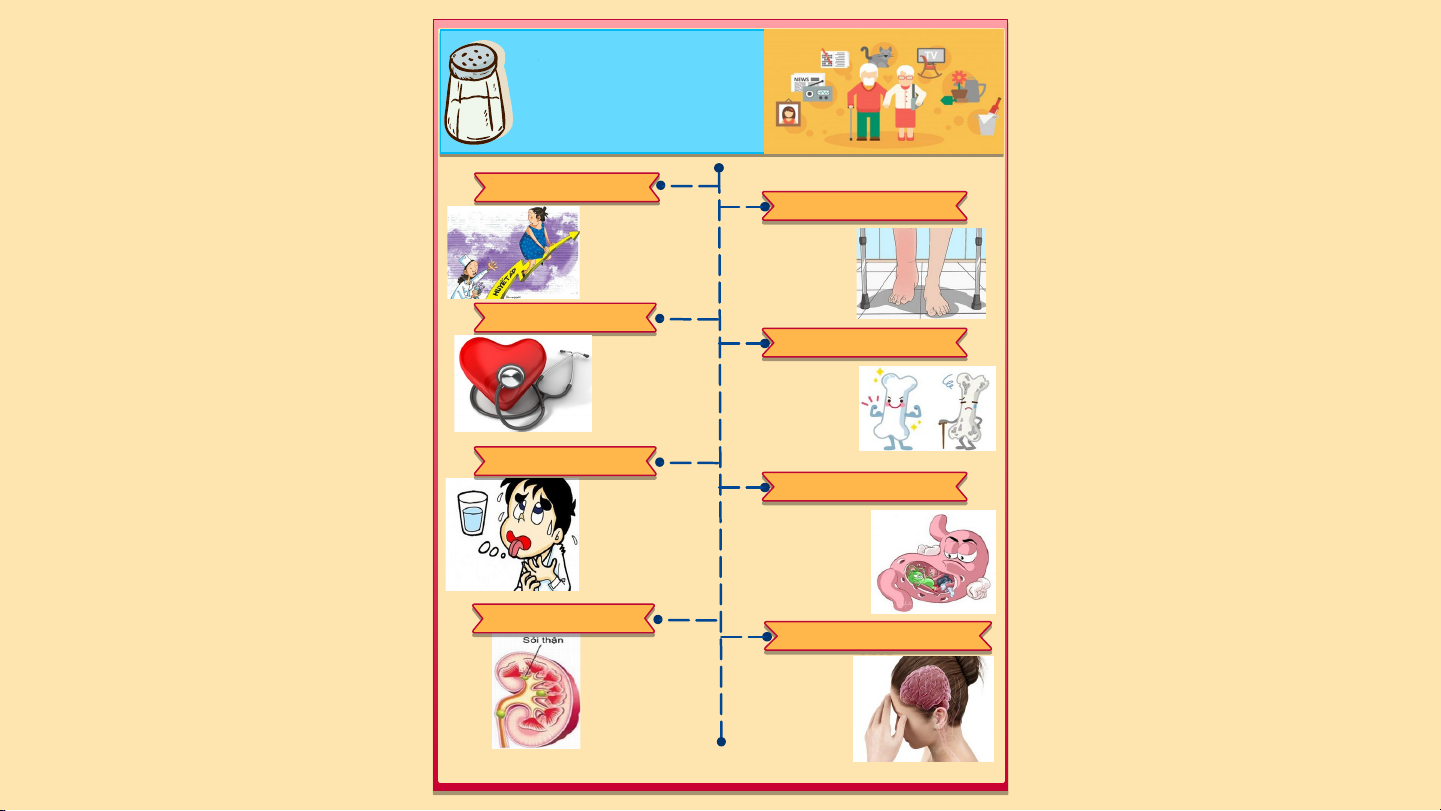
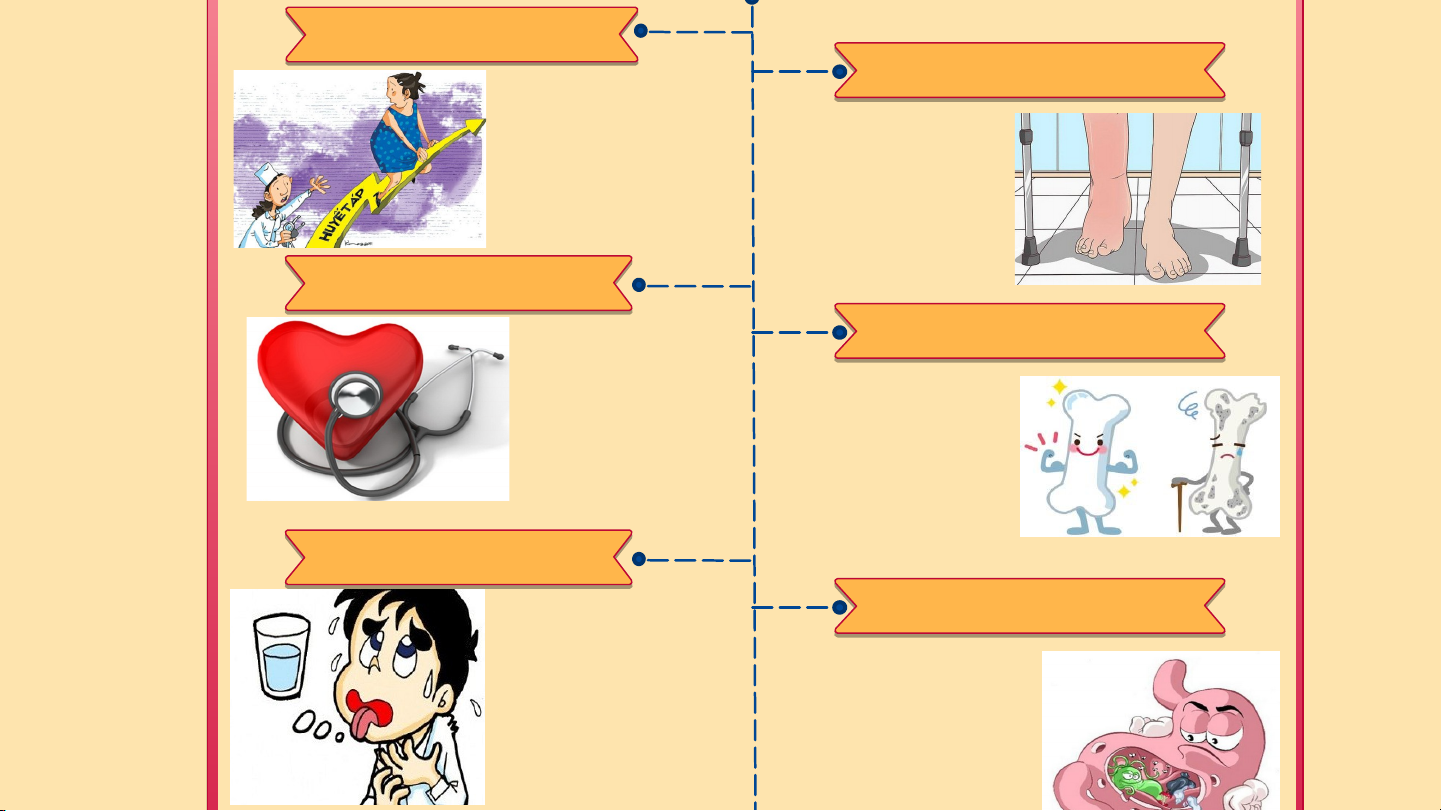
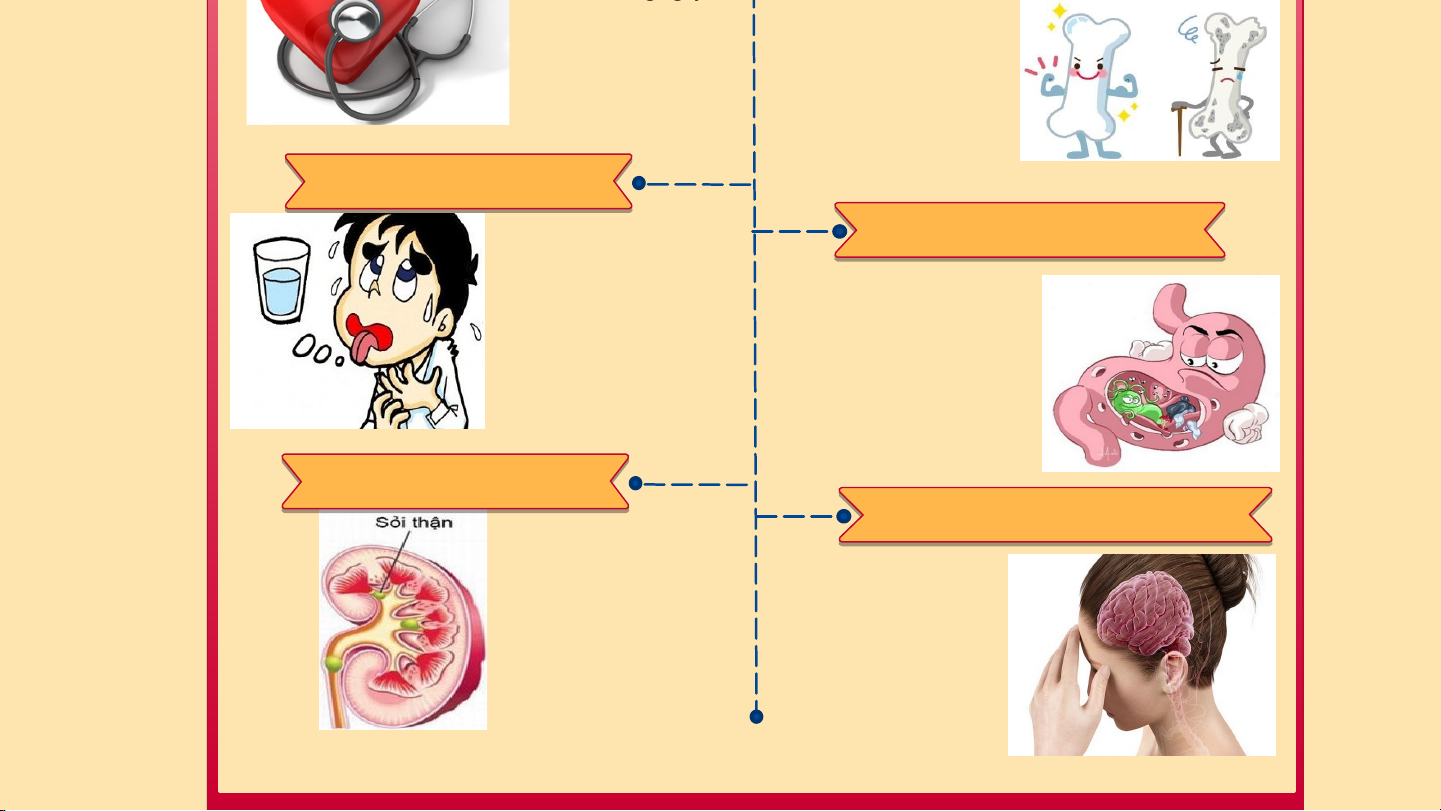
FeCl : giữ màu vải nhuộm 2 4 3 3 KNO : phân bón, pháo hoa Ba(NO ) : pháo hoa 3 3 2 LIÊN HỆ THỰC TẾ I II III Tác hại chế Tác hại chế Chế độ ăn độ ăn thừa độ ăn thiếu hợp lý muối muối TÁC HẠI CỦA CHẾ ĐỘ ĂN THỪA MUỐI TĂ T N Ă G N G H U H Y U Ế Y T Ế T Á P Á CÁC CÁ V C Ấ V N Ấ N ĐỀ Đ Ề V Ề V D A D Là tác hại phổ biến Gây phù nề ở tay, nhất chân. Những phần phù nề sẽ trở nên sung phồng và tăng nguy cơ viêm loét BỆN BỆ H N H T I T M IM MẠCH MẠCH LOÃNG XƯƠNG Tăng áp lực thẩm LOÃNG XƯƠN thấu làm tăng nguy cơ cao mắc các bệnh tim mạch có liên quan Khi ăn mặn làm
đặc biệt là đột quỵ xương bạn yếu và nhồi máu cơ hơn và có thể tim. gây bệnh loãng xương. MẤT MẤ T NƯ NƯỚC ỚC CÁC CÁ V C Ấ V N Ấ N Đ Ề Đ Ề V Ề V Ề D Ạ D Ạ DÀ D Y À Khi cơ thể dư lượng muối, có thể xảy ra
Thói quen ăn mặn có liên hiện tượng giữ hoặc
quan trực tiếp đến vấn đề bài tiết nước tiểu viêm loét dạ dày. Chúng quá nhiều dẫn đến
gây ra những ảnh hưởng tình trạng mất nước.
xấu đến các niêm mạc và
mô dạ dày, đẩy nhanh nguy cơ phát triển ung thư. RỐI RỐ I LO L Ạ O N Ạ N T H T Ậ H N ẬN GI G Ả I M Ả N M H N Ậ H N Ậ N T H T Ứ H C Ứ CỦ C A CỦ A NÃ N O ÃO Thận phải hoạt động nhiều hơn ở những người ăn Lượng muối dư thùa mặn, lâu ngày gây trong cơ thể khiến suy thận và làm não không thể tiếp tăng nguy cơ của nhận đầy đủ thông sỏi thận. tin từ môi trương. TĂ T N Ă G N H G U H Y U Ế Y T T Á P Á CÁ C C Á V Ấ V N Ấ N Đ Ề Đ Ề V Ề V D Ề A D
Là tác hại phổ biến nhất
Gây phù nề ở tay, chân. Những phần phù nề sẽ trở nên sung phồng và tăng nguy cơ viêm loét BỆN Ệ H N H T I T M MẠC Ạ H Tăng áp lực thẩm thấu LOÃ O N Ã G N X G Ư X ƠNG N làm tăng nguy cơ cao mắc các bệnh tim mạch có liên quan đặc Khi ăn mặn làm
biệt là đột quỵ và nhồi xương bạn yếu hơn máu cơ tim. và có thể gây bệnh loãng xương. MẤT Ấ N T ƯỚC Ớ CÁC Á C V Ấ V N Ấ Đ N Ề Đ V Ề V D Ề Ạ D D Ạ À D Y À Khi cơ thể dư lượng muối, có thể xảy ra
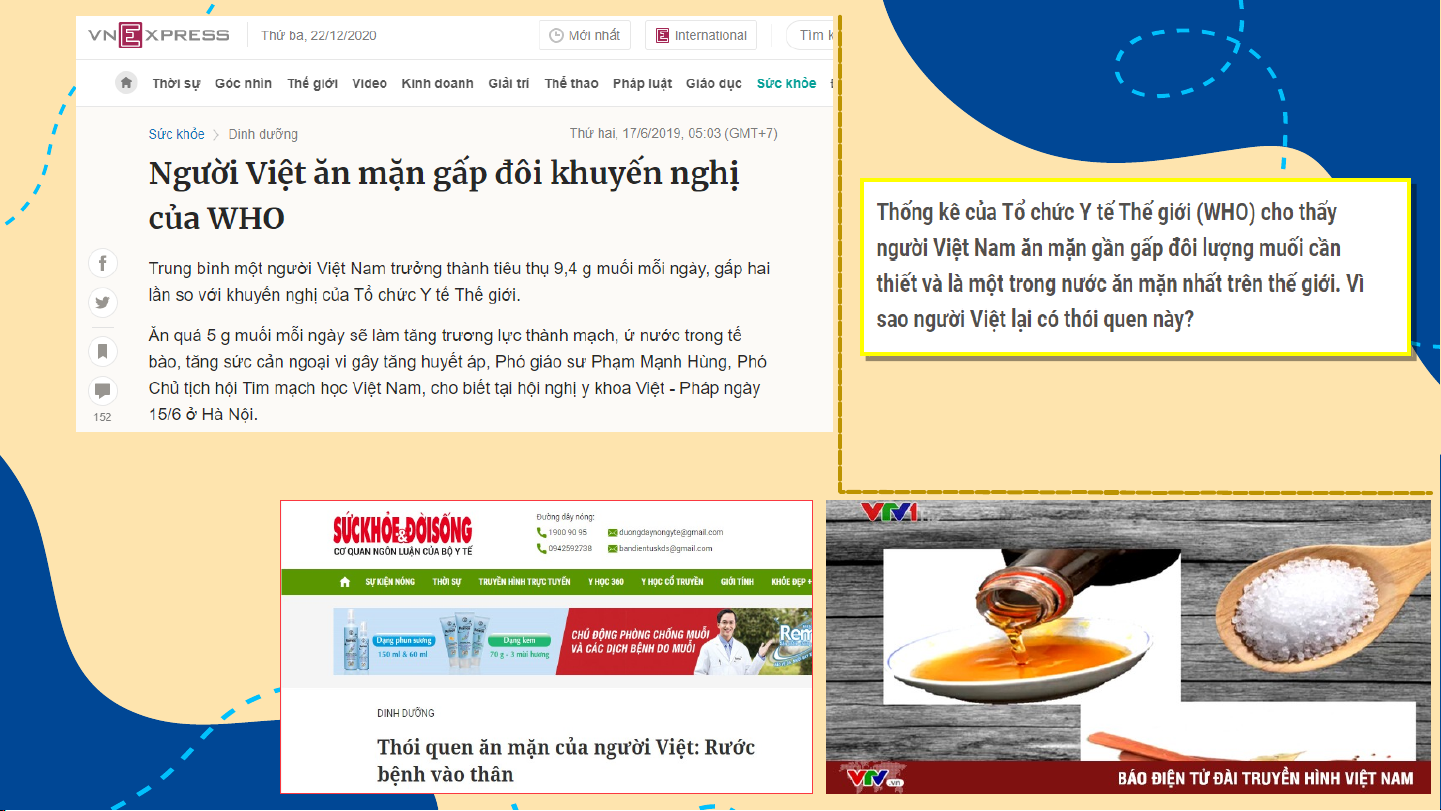
Thói quen ăn mặn có liên hiện tượng giữ hoặc
quan trực tiếp đến vấn đề
bài tiết nước tiểu quá
viêm loét dạ dày. Chúng gây nhiều dẫn đến tình
ra những ảnh hưởng xấu đến trạng mất nước.
các niêm mạc và mô dạ dày,
đẩy nhanh nguy cơ phát triển ung thư. Tăng áp lực thẩm thấu làm tăng nguy cơ cao mắc các bệnh tim mạch có liên Khi ăn mặn làm quan đặc biệt là đột xương bạn yếu hơn quỵ và nhồi máu cơ và có thể gây bệnh tim. loãng xương. MẤT Ấ N T ƯỚC Ớ CÁC Á C V Ấ V N Ấ Đ N Ề Đ V Ề V D Ề Ạ D D Ạ À D Y À Khi cơ thể dư lượng muối, có thể xảy ra
Thói quen ăn mặn có liên hiện tượng giữ hoặc
quan trực tiếp đến vấn đề
bài tiết nước tiểu quá
viêm loét dạ dày. Chúng gây nhiều dẫn đến tình
ra những ảnh hưởng xấu đến trạng mất nước.
các niêm mạc và mô dạ dày,
đẩy nhanh nguy cơ phát triển ung thư. RỐI Ố L I O L Ạ O N Ạ N T H T Ậ H N Ậ GI G ẢM Ả NH N Ậ H N Ậ N T HỨ H C C C ỦA Ủ N A Ã N O Ã Thận phải hoạt động nhiều hơn ở những người ăn mặn, lâu Lượng muối dư thùa ngày gây suy thận và trong cơ thể khiến não làm tăng nguy cơ của không thể tiếp nhận sỏi thận.
đầy đủ thông tin từ môi trương. C H Ế Đ Ộ Ă N THIẾU MUỐI
“ Muối là gia vị không thể thiếu trong mỗi bữa cơm gia đình” Giảm huyết áp Phù não Giảm chức năng tuyến giáp Mất kiểm soát cơ bắp Chuột rút cơ bắp, teo cơ Giảm lượng natri trong máu Gây mệt mỏi, chán ăn, buồn nôn Giảm thị lực mắt, mờ mắt
Tăng cholesteron xấu, tăng nguy cơ bệnh tim. THIẾU MUỐI
“ Muối là gia vị không thể thiếu trong mỗi bữa cơm gia đình” Giảm huyết áp Phù não Giảm chức năng tuyến giáp Mất kiểm soát cơ bắp Chuột rút cơ bắp, teo cơ Giảm lượng natri trong máu Giảm chức năng tuyến giáp Mất kiểm soát cơ bắp Chuột rút cơ bắp, teo cơ Giảm lượng natri trong máu Gây mệt mỏi, chán ăn, buồn nôn Giảm thị lực mắt, mờ mắt
Tăng cholesteron xấu, tăng nguy cơ bệnh tim. CHẾ ĐỘ DINH Dưỡng HỢP LÝ
Một chế độ ăn dinh dưỡng cần
hài hòa và cân đối giữa các nhóm thực phẩm Chế h độ d đ i ộ d nh n d h ư d ỡ ư n ỡ g n
Ăn bao nhiêu muối là vừa
Nên hạn chế các sản phẩm đóng hộp như khoai tây
chiên hoặc snack vì chúng có nhiều muối hơn bình thường.
Bạn không nên dung quá 2 thìa café muối/ ngày.
Một chế độ ăn dinh dưỡng cần
hài hòa và cân đối giữa các nhóm thực phẩm Chế C độ di hế nh độ di d nh ưỡng
Ăn bao nhiêu muối là vừa
Ăn bao nhiêu muối là vừa
Nên hạn chế các sản phẩm đóng hộp như khoai tây
chiên hoặc snack vì chúng có nhiều muối hơn bình thường.
Bạn không nên dung quá 2 thìa café muối/ ngày. VIDEO
GIẢM LƯỢNG MUỐI TRONG
KHẨU PHẦN ĂN HẰNG NGÀY
Lựa chọn thực phẩm tươi ngon Chuyển sang các món hấp
“ Bớt muối, chấm nhẹ tay, giảm ngay đồ mặn” EM ĐÃ HỌC
- Muối là những hợp chất được
- Muối tác dụng với kim loại,
tạo ra khi thay thế ion H+ trong dung dịch acid, dung dịch
acid bằng ion kim loại hoặc ion base, dung dịch muối. ammonium (NH +). 4
- Muối có thể được tạo ra bằng cách cho dung
dịch acid tác dụng với: base, oxide base, muối
hoặc cho hai dung dịch muối tác dụng với nhau,... EM ĐÃ HỌC
- Acid, base và oxide có các tính chất hoá học sau:
+ Dung dịch acid: làm quỳ tím chuyển sang màu đỏ, tác dụng
với kim loại, base, oxide base, muối.
+ Dung dịch base: làm quỳ tím chuyển sang màu xanh, tác
dụng với dung dịch acid, oxide acid và với dung dịch muối.
+ Oxide base tác dụng với dung dịch acid, oxide acid tác dụng với dung dịch base. CỦNG CỐ
ĐẠI CHIẾN CỜ CA RÔ
Đội chiến thắng ở vòng thi
mảnh ghép giành lợi thế.
Chọn vị trí trên bàn cờ ca rô
tương ứng với câu hỏi mà
nhóm sẽ trả lời. Trả lời
nhanh trong vòng 5s. Nếu trả
lời sai, vị trí sẽ thuộc về đội đối thủ.
ĐẠI CHIẾN CỜ CA RÔ 1 2 3 4 5 6 Câu hỏi phụ 7 8 9
ĐẠI CHIẾN CỜ CA RÔ
Cho dung dịch sulfuric acid (H SO ) loãng tác dụng với 2 4
muối sodium sulfite (Na SO ). Chất khí nào sinh ra ? 2 3 A. Khí hydroxygen B. Khí oxygen C. Khí sulfur dioxide D. Khí hydrosulfide Đáp Đ án: C Ô số 1
ĐẠI CHIẾN CỜ CA RÔ
Dung dịch muối tác dụng với dung dịch hydrochloric acid (HCl) là: A. Zn(NO )
B. AgNO . C. NaNO . D. Cu(NO ) . 3 2 3 3 3 2 Đáp á Đ n áp á : B Ô số 2
ĐẠI CHIẾN CỜ CA RÔ
Chất tác dụng được với CaCO là 3
A. Dung dịch NaCl. B. Dung dịch K SO . 2 4
C. Fe(OH) . D. Dung dịch HCl. 2 Đá Đ p á án: D Ô số 3
ĐẠI CHIẾN CỜ CA RÔ
Muối tác dụng được với loại hợp chất nào sau đây? A. Acid. B. Acidic oxide.
C. Basic oxide. D. Quì tím. Đáp á Đ n áp á : A Ô số 4
ĐẠI CHIẾN CỜ CA RÔ
Cặp chất nào sau đây xảy ra phản ứng?
A. CaCO và NaCl. B. CuCl và KNO . 3 2 3 C. Ba(OH) và FeCl . D. Zn(OH) và FeSO . 2 3 2 4 Đáp Đ án: C Ô số 5
ĐẠI CHIẾN CỜ CA RÔ
Cặp chất có thể cùng tồn tại trong một dung dịch là A. NaCl, AgNO . B. CaCl , Na CO . 3 2 2 3
C. K SO , BaCl .D. MgSO , NaNO . 2 4 2 4 3 Đáp Đ án: D Ô số 6
ĐẠI CHIẾN CỜ CA RÔ
Dùng dung dịch KOH phân biệt được hai muối:
A. NaCl và BaCl . B. NaCl và MgCl . 2 2
C. Na SO và Na CO . D. NaNO và Li CO . 2 4 2 3 3 2 3 Đáp Đ án: B Ô số 7
ĐẠI CHIẾN CỜ CA RÔ
Hãy cho biết muối nào có thể điều chế bằng phản ứng của
kim loại với dung dịch acid H SO loãng ? 2 4
A. ZnSO . B. Na SO . C. CuSO . D. MgSO . 4 2 3 4 3 Đáp á Đ n áp á : A Ô số 8
ĐẠI CHIẾN CỜ CA RÔ
Cho 50 g CaCO vào dung dịch HCl dư thể tích CO thu 3 2
được ở điều kiện chuẩn là:
A. 2,479 lít B. 1,2395 lít C. 12,395 lít D. 24,79 lít Đáp Đ án: C Ô số 9 CÂU HỎI PHỤ
Các cặp chất nào cùng tồn tại trong một dung dịch? 1. CuSO và HCl 2. H SO và Na SO 4 2 4 2 3 3. KOH và NaCl 4. MgSO và BaCl 4 2 A. (1; 2). B. (3; 4). C. (2; 4). D. (1; 3). DẶN DÒ
- Thiết kế sơ đồ tư duy nội dung bài “Muối”.
- Xem trước “Bài 13: Phân bón hóa học”. Thanks you !!! VIDEO VIDEO
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- NỘI DUNG BÀI HỌC
- I.
- HOẠT ĐỘNG
- Slide 22
- Slide 23
- SO SÁNH THÀNH PHẦN
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- II.
- Slide 30
- Slide 31
- Slide 32
- LUYỆN TẬP
- III.
- Slide 35
- Slide 36
- LUYỆN TẬP
- IV.
- Slide 39
- TRẠM KIẾN THỨC
- TRẠM 1: PHÂN TÍCH
- 04
- TRẠM 2: QUAN SÁT
- 04
- Slide 45
- 04
- Slide 47
- 04
- Slide 49
- 04
- Slide 51
- Slide 52
- Slide 53
- TRẠM 3: TRẢI NGHIỆM
- Slide 55
- Slide 56
- V.
- Slide 58
- Slide 59
- LUYỆN TẬP
- LUYỆN TẬP
- VI.
- Slide 63
- LUYỆN TẬP
- LUYỆN TẬP
- VẬN DỤNG
- Slide 67
- LIÊN HỆ THỰC TẾ
- Slide 69
- Slide 70
- Slide 71
- LIÊN HỆ THỰC TẾ
- Slide 73
- Slide 74
- Slide 75
- Slide 76
- Slide 77
- Slide 78
- Slide 79
- Slide 80
- Slide 81
- Slide 82
- Slide 83
- GIẢM LƯỢNG MUỐI TRONG KHẨU PHẦN ĂN HẰNG NGÀY
- EM ĐÃ HỌC
- EM ĐÃ HỌC
- CỦNG CỐ
- Slide 88
- Slide 89
- Slide 90
- Slide 91
- Slide 92
- Slide 93
- Slide 94
- Slide 95
- Slide 96
- Slide 97
- Slide 98
- Slide 99
- DẶN DÒ
- Slide 101
- Slide 102
- Slide 103



