














































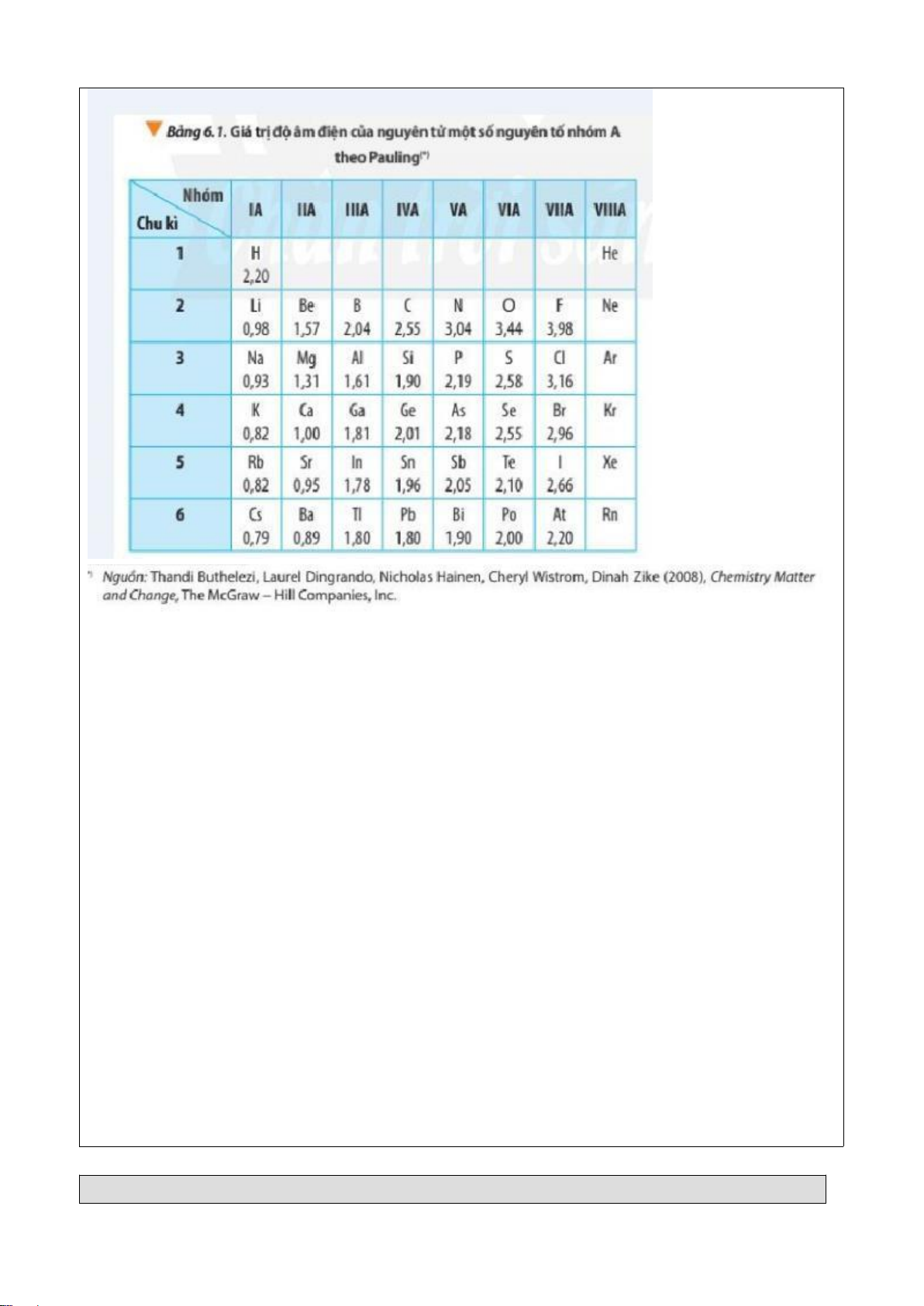
































































































Preview text:
BÀI DẠY: NHẬP MÔN HOÁ HỌC
Thời lượng: 2 tiết I. MỤC TIÊU 1. Năng lực hoá học: 1.1. Nhận thức hoá học
– Nêu được đối tượng nghiên cứu của hoá học.
– Trình bày được phương pháp học tập và nghiên cứu hoá học.
– Nêu được vai trò của hoá học đối với đời sống, sản xuất,. .
1.2. Tìm hiểu thế giới tự nhiên dưới góc độ hoá học
Thông qua hoạt động khai thác vốn kiến thức, kỹ năng đã học ở môn KHTN cấp THCS, vốn
kiến thức thực tế để tìm hiểu về đối tượng nghiên cứu của hoá học, vai trò của hoá học trong thực tiễn.
1.3. Vận dụng kiến thức kỹ năng đã học
- Vận dụng được phương pháp học tập từ môn KHTN cấp THCS để tìm hiểu về phương pháp
học tập và nghiên cứu hoá học.
- Vận dụng vốn tri thức đã biết về hoá học để tìm hiểu vai trò của hoá học trong thực tiễn. 2. Năng lực chung
Năng lực tự chủ và tự học: Xác định được nhiệm vụ học tập; đặt mục tiêu học tập chi tiết, cụ
thể để, khắc phục hạn chế.
Năng lực giao tiếp hợp tác: Biết chủ động trong giao tiếp, tự tin và biết kiểm soát cảm xúc, thái
độ khi nói trước nhiều người. 3. Phẩm chất
Chăm chỉ: Tích cực tìm tòi và sáng tạo trong học tập; có ý chí vượt qua khó khăn để đạt kết quả trong học tập.
II. THIẾT BỊ VÀ HỌC LIỆU
GV: - Hình ảnh về đối tượng nghiên cứu của hoá học, vật lý, sinh học, khoa học Trái Đất và bầu
trời…; vai trò của hoá học trong thực tiễn; Phiếu học tập, máy chiếu, máy tính.
HS: Đọc trước bài học, xem lại nội dung đã học ở môn KHTN; Báo cáo thuyết trình bằng
powpoint; Nguyên liệu làm son môi.
III. TIẾN TRÌNH DẠY HỌC
Hoạt động 1: Mở đầu (10 phút) a. Mục tiêu:
- Gắn kết những kiến thức, kỹ năng đã học về đối tượng nghiên cứu của các lĩnh vực KHTN ở
cấp THCS và từ những hiểu biết trong thực tế với bài học mới; Kích thích HS suy nghĩ thông
qua việc nêu được vai trò, đặc điểm, đối tượng nghiên cứu của hoá học, các nhánh chính của hoá
học. Từ đó, HS xác định nhiệm vụ học tập.
- Năng lực tự chủ và tự học: Xác định được nhiệm vụ học tập; đặt mục tiêu học tập chi tiết, cụ
thể để, khắc phục hạn chế.
b. Tổ chức thực hiện
* Chuyển giao nhiệm vụ: GV yêu cầu HS hãy quan sát các hình ảnh sau và điền các hình ảnh
thích hợp chỉ đối tượng nghiên cứu của các lĩnh vực KHTN vào phiếu học tập số 1:
Đối tượng nghiên cứu
Hình ảnh tương ứng
1. Sinh học nghiên cứu các sinh vật và sự sống trên Trái Đất
2. Thiên văn học nghiên cứu về vũ trụ
3. Hoá học nghiên cứu về chất và sự biến đổi của chất
4. Khoa học Trái Đất nghiên cứu về Trái Đất
5. Vật lý nghiên cứu về chất, năng lượng và sự vận động của chúng
* Thực hiện nhiệm vụ: Hs hoạt động cá nhân trả lời phiếu học tập số 1:
Sản phẩm: Câu trả lời của HS: 1 – e; 2 – a; 3- d; 4 – b; 5 – c.
* Báo cáo thảo luận: GV mời ngẫu nhiên HS trả lời
* Kết luận nhận định, định hướng:
GV nhận xét câu trả lời của HS về phiếu học tập số 1
GV nêu ra các câu hỏi để giúp HS xác định nhiệm vụ tiếp theo của bài học:
Câu 1: Hoá học nghiên cứu cụ thể những nội dung gì?
Câu 2: Đặc điểm của hoá học là gì?
Câu 3: Hoá học có mấy nhánh nghiên cứu chính? Đó là những nhánh nào?
GV giúp HS minh hoạ bằng sơ đồ các nhánh chính của hoá học:
Hoạt động 2: Hình thành kiến thức (70 phút)
Hoạt động 2.1. Đối tượng nghiên cứu của hoá học (20 phút)
a. Mục tiêu: – Nêu được đối tượng nghiên cứu của hoá học.
b. Tổ chức thực hiện
* Chuyển giao nhiệm vụ: Yêu cầu HS quan sát hình ảnh dưới đây và thảo luận nhóm để trả lời 4 câu hỏi
Câu 1: Từ hình 1.1, hãy chỉ ra các đơn chất và hợp chất. Viết công thức hoá học của chúng.
Câu 2: Từ hình 1.2, hãy sắp xếp theo thứ tự tăng dần mức độ trật tự trong cấu trúc 3 thể của bromine.
Câu 3: từ hình 1.3, hãy cho biết đâu là quá trình biến đổi vật lý, quá trình biến đổi hoá học. Giải thích.
Câu 4: Đối tượng nghiên cứu của hoá học là gì?
* Thực hiện nhiệm vụ:
Học sinh quan sát hình ảnh, thảo luận nhóm hoàn thành 4 câu hỏi Sản phẩm: Câu 1:
- Đơn chất: nhôm (aluminium): Al , nitrogen: N2;
- Hợp chất nước: H2O , muối ăn: NaCl.
Câu 2: Khí < lỏng < rắn
Câu 3: a. Biến đổi vật lý; b. Biến đổi hoá học: có dấu hiệu tạo thành chất mới
Câu 4: Đối tượng nghiên cứu của hoá học là chất và sự biến đổi của chất.
* Báo cáo thảo luận:
GV mời lần lượt 4 nhóm trình bày 4 câu hỏi, nhóm khác nhận xét bổ sung.
* Kết luận nhận định, định hướng:
GV nhận xét, kết luận nội dung về đối tượng nghiên cứu của hoá học:
Hoạt động 2.2 Vai trò của hoá học trong thực tiễn (15 phút)
a. Mục tiêu: Nêu được vai trò của hoá học đối với đời sống, sản xuất.
b. Tổ chức thực hiện
* Chuyển giao nhiệm vụ:
GV yêu cầu HS quan sát video: https://www.youtube.com/watch?v=of01SXf1wUE
Hãy nêu vai trò của hoá học trong đời sống và sản xuất
* Thực hiện nhiệm vụ: HS hoạt động cá nhân trả lời câu hỏi
Sản phẩm: câu trả lời của HS.
* Báo cáo thảo luận: GV mời HS xung phong trả lời câu hỏi.
HS khác nhận xét câu trả lời của bạn, bổ sung thêm một số lĩnh vực có vai trò của hoá học
* Kết luận, nhận định, định hướng: - GV kết luận nội dung.
- GV giao nhiệm vụ cho HS chuẩn bị ở nhà theo nhóm bằng powpoint cho tiết học sau để trình bày báo cáo trước lớp:
Hãy tưởng tượng bạn được mời tham gia hội thảo bàn về “phương pháp học tập và nghiên cứu
hoá học”. Hãy trình bày báo cáo về nội dung sau:
1. Làm thế nào để học tốt môn hoá học?
2. Triển khai phương pháp nghiên cứu hoá học ở trong trường của bạn như thế nào?
- Tổ chức cho các nhóm bốc thăm 1 trong 2 nội dung trên
Hoạt động 2.3. Phương pháp học tập và nghiên cứu hoá học (25 phút) a. Mục tiêu:
– Trình bày được phương pháp học tập và nghiên cứu hoá học.
– Vận dụng được phương pháp học tập từ môn KHTN cấp THCS để tìm hiểu về phương pháp
học tập và nghiên cứu hoá học.
– Xác định được nhiệm vụ học tập; đặt mục tiêu học tập chi tiết, cụ thể để, khắc phục hạn chế.
– Tích cực tìm tòi và sáng tạo trong học tập; có ý chí vượt qua khó khăn để đạt kết quả trong học tập.
– Biết chủ động trong giao tiếp, tự tin và biết kiểm soát cảm xúc, thái độ khi nói trước nhiều người.
b. Tổ chức thực hiện
* Chuyển giao nhiệm vụ:
- GV yêu cầu đại diện các nhóm thuyết trình báo cáo: Trình bày phương pháp học tập và nghiên cứu hoá học:
Hãy tưởng tượng bạn được mời tham gia hội thảo bàn về “phương pháp học tập và nghiên cứu
hoá học”. Hãy trình bày báo cáo về nội dung sau:
1. Làm thế nào để học tốt môn hoá học?
2. Triển khai phương pháp nghiên cứu hoá học ở trong trường của bạn như thế nào?
- GV thông báo tiêu chí đánh giá:
1. Làm thế nào để học tốt môn hoá học? STT
Yêu cầu về báo cáo thuyết trình Có Không 1
Ôn tập và nghiên cứu bài học trước khi đến lớp 2
Rèn luyện tư duy hoá học 3 Ghi chép 4 Luyện tập thường xuyên 5 Thực hành thí nghiệm 6 Sử dụng thẻ ghi nhớ 7
Hoạt động tham quan, trải nghiệm 8 Sử dụng sơ đồ tư duy 9
Thuyết trình rõ ràng lưu loát dễ hiểu 10
Hình ảnh, ví dụ rõ ràng, phù hợp
2. Triển khai phương pháp nghiên cứu hoá học ở trong trường của bạn như thế nào? STT
Yêu cầu về báo cáo thuyết trình Có Không 1
Phương pháp nghiên cứu lý thuyết 2
Phương pháp nghiên cứu thực nghiệm 3
Phương pháp nghiên cứu ứng dụng 4
Thuyết trình rõ ràng lưu loát dễ hiểu 5
Hình ảnh, ví dụ rõ ràng, phù hợp
* Thực hiện nhiệm vụ:
Các HS trong nhóm thống nhất lại nội dung đã chuẩn bị, bổ sung nội dung cần thiết.
* Báo cáo thảo luận:
GV mời đại diện lần lượt các nhóm lên trình bày báo cáo của nhóm mình.
Các nhóm khác bổ sung, phản biện, đặt câu hỏi cho việc thực hiện của nhóm trình bày.
* Kết luận, nhận định, định hướng:
GV kết luận, nhận xét đánh giá phần thuyết tình của các nhóm theo tiêu chí đánh giá đã công bố.
Hoạt động 3. Luyện tập (10 phút)
a. Mục tiêu: Luyện tập lại những nội dung đã được học
b. Tổ chức thực hiện:
* Chuyển giao nhiệm vụ:
GV yêu cầu HS hoạt động theo cặp để hoàn thành các câu hỏi dưới đây:
Câu 1: Nội dung nào dưới đây không phải là đối tượng nghiên cứu của hoá học?
a. Thành phần, cấu trúc của chất
b. Tính chất và sự biến đổi của chất c. Ứng dụng của chất
d. Sự lớn lên và sinh sản của tế bào.
Câu 2: Cho các bước trong phương pháp nghiên cứu hoá học như sau: a. Thực hiện nghiên cứu
b. Đưa ra phán đoán và xây dựng giả thuyết nghiên cứu.
c. Lập kế hoạch thực hiện quá trình nghiên cứu.
d. Đề xuất vấn đề nghiên cứu.
e. Viết, trình bày báo cáo, thảo luận, phản biện và kết luận về kết quả nghiên cứu.
Hãy sắp xếp các bước trên vào sơ đồ dưới đây để có quy trình nghiên cứu phù hợp: (1) (2) (3) (4) (5)
* Thực hiện nhiệm vụ:
HS thảo luận theo cặp hoàn thành 2 câu hỏi
Sản phẩm: Câu trả lời của HS
* Báo cáo và thảo luận:
GV mời đại diện 2 cặp trả lời 2 câu hỏi
Các HS khác nhận xét bổ sung
* Kết luận, nhận định, định hướng:
GV kết luận, nhận xét phần trả lời của HS.
Hoạt động 4: Vận dụng (10 phút) a. Mục tiêu:
- Vận dụng được phương pháp học tập từ môn KHTN cấp THCS để tìm hiểu về phương pháp
học tập và nghiên cứu hoá học.
b. Tổ chức thực hiện:
* Chuyển giao nhiệm vụ:
- GV hướng dẫn HS về nguyên liệu và các bước làm son môi:
Thực hành: chế tạo son môi từ dầu gấc:
* Nguyên liệu: 1 thìa dầu dừa, 1 thìa sáp ong trắng, 1 thìa bơ trắng, 1 vài giọt tinh dầu yêu thích
để tạo hương, ½ thìa dầu gấc (có thể điều chỉnh tăng giảm), 1 viên vitamin E * Thực hiện:
Cho dầu dừa, sáp ong, bơ và vitamin E vào cốc thuỷ tinh rồi đun cách thuỷ. Khuấy đều đến khi
hỗn hợp đồng nhất. Tắt bếp rồi thêm dầu gấc và tinh dầu, trộn đều. Đổ hỗn hợp khi còn đang nóng vào khuôn đựng son.
Lưu ý: có thể thay thế bằng các nguyên liệu khác tương tự: thay dầu dừa bằng dầu oliu, thay bơ
trắng bằng bơ thực vật, thay dầu gấc bằng dầu thực vật khác, có thể cho hoa dâm bụt, thanh long,
củ dền, cà rốt để tạo màu, tinh dầu thay bằng hương vani…
- GV giao nhiệm vụ cho HS về nhà thực hành làm son môi và nộp sản phẩm sau 1 tuần
* Thực hiện nhiệm vụ:
HS thực hành theo nhóm tại phòng bộ môn.
* Báo cáo thảo luận:
HS nộp sản phẩm vào tiết học của tuần sau
GV chấm điểm sản phẩm cho nhóm
* Kết luận, nhận định, định hướng:
GV nhận xét về sản phẩm của nhóm, kết luận về phương pháp nghiên cứu. TRƯỜNG THPT TRẦN PHÚ TỔ HÓA HỌC KHỐI 10
KẾ HOẠCH BÀI DẠY: THÀNH PHẦN CỦA NGUYÊN TỬ
Thời lượng: 05 tiết I. MỤC TIÊU DẠY HỌC:
Sau bài học này HS có thể: YÊU CẦU CẦN ĐẠT
Nhận thức hóa học
Nêu được thành phần của nguyên tử (các loại hạt cơ bản NĂNG LỰC HÓA
tạo nên hạt nhân và lớp vỏ nguyên tử, điện tích và khối HỌC lượng mỗi loại hạt).
Tìm hiểu thế giới tự
Nêu và giải thích được các thí nghiệm tìm ra thành phần
nhiên dưới góc độ hóa nguyên tử. học
Vận dụng kiến thức, kĩ So sánh được khối lượng của electron với proton và năng đã học
neutron, kích thước của hạt nhân với kích thước của nguyên tử.
Giải quyết vấn đề và
Thảo luận với các thành viên trong nhóm nhằm giải NĂNG LỰC sáng tạo
quyết các vấn đề trong bài học để hoàn thành nhiệm vụ CHUNG học tập.
Giao tiếp và hợp tác
Sử dụng ngôn ngữ khoa học để diễn đạt về thành phần
của nguyên tử (các loại hạt cơ bản tạo nên hạt nhân và
lớp vỏ nguyên tử, điện tích và khối lượng mỗi loại hạt);
Hoạt động nhóm một cách hiệu quả theo đúng yêu cầu
của GV, đảm bảo các thành viên trong nhóm đều được
tham gia và trình bày báo cáo.
Năng lực tự chủ và tự
Chủ động, tích cực tìm hiểu về thành phần cấu tạo học nguyên tử. PHẨM CHẤT Trung thực
Có ý thức tự học và tự tin trong học tập Trách nhiệm
Nhận biết được tầm quan trọng, vai trò của môn Hóa trong
cuộc sống, phục vụ đời sống con người.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
- Thiết bị dạy học
+ Thiết bị công nghệ, phần mềm: - Học liệu + Học liệu số: + Học liệu khác:
III. TIẾN TRÌNH DẠY HỌC:
A. BẢNG TÓM TẮT CÁC HOẠT ĐỘNG: Hoạt Mục tiêu Nội dung dạy PPDH- KTDH động học học trọng tâm Đánh giá Phương pháp Công cụ (thời gian) HĐ 1: Tạo tâm thế Phương pháp Vấn đáp Câu trả lời hứng thú vấn đáp của học Khởi cho HS sinh động-kết trước khi nối vào bài học mới. ( phút) HĐ 2:
Thành phần Nêu được thành Kĩ thuật sử dụng Vấn đáp Câu trả lời cấu
tạo phần của nguyên phương tiện trực của học Hình thành nguyên tử tử (các loại hạt quan. sinh kiến thức
Sự tìm ra cơ bản tạo nên Dạy học nêu và mới electron
hạt nhân và lớp giải quyết vấn
sự khám phá vỏ nguyên tử, đề thông qua câu ( phút) hạt
nhân điện tích và khối hỏi trong SGK. nguyên tử lượng mỗi loại Sự khám hạt). phá hạt nhân Nêu và giải nguyên tử thích được các
Cấu tạo hạt thí nghiệm tìm nhân nguyên ra thành phần tử nguyên tử. Kích thước và khối lượng nguyên tử HĐ 3:
Giúp HS hệ Câu hỏi 1,2, 3 Vấn đáp Câu trả lời Luyện tập thống lại sgk của học kiến thức đã sinh ( phút) học HĐ 5:
giúp HS vận Câu 4 SGK Vấn đáp Câu trả lời Vận dụng dụng kiến của học thức đã vào sinh áp dụng vào thực tiễn ( phút) cuộc sống. B. CÁC HOẠT ĐỘNG:
HĐ 1. Hoạt động khởi động-kết nối Thời gian: phút
1. Mục tiêu: Tạo tâm thế hứng thú cho HS trước khi vào bài học mới.
2. Tiến trình tổ chức hoạt động:
- GV chiếu hình ảnh mô phỏng mô hình nguyên tử:
- GV đặt vấn đề: Từ rất lâu, các nhà khoa học đã nghiên cứu các mô hình nguyên tử và cập nhật chúng
thông qua việc thu thập những dữ liệu thực nghiệm. Nguyên tử gồm những hạt cơ bản nào? Cơ sở nào để
phát hiện ra các hạt cơ bản đó và chúng có tính chất gì ? Chúng ta cùng đến với Bài 2. Thành phần của nguyên tử.
d. Phương pháp công cụ đánh giá và kết luận: Vấn đáp
e.Sản phẩm học sinh cần đạt: Câu trả lời của HS. HĐ 2.
HOẠT ĐỘNG HÌNH THÀNH KIẾN THỨC Thời gian: phút
Hoạt động 1. Thành phần nguyên tử
1. Mục tiêu: HS nêu được khái niệm nguyên tử, các thành phần của nguyên tử
2. Nội dung: GV giảng giải, phân tích, yêu cầu HS đọc sgk, thảo luận, trả lời câu hỏi.
3. Sản phẩm học tập: Câu trả lời của HS
4. Tổ chức thực hiện :
HOẠT ĐỘNG CỦA GIÁO VIÊN VÀ HS
DỰ KIẾN SẢN PHẨM
Bước 1. GV chuyển giao nhiệm vụ học tập
1. Thành phần cấu tạo nguyên tử
- GV nhắc lại cho HS biết về lịch sử của nguyên - Nguyên tử gồm:
tử từ các thông tin có sẵn trong sgk.
+ Hạt nhân chứa proton, neutron
- GV yêu cầu HS quan sát hình 2.1, trả lời câu
hỏi: Cho biết các thành phần nguyên tử gồm
+ Vỏ nguyên tử chứa electron. những loại hạt nào?
- GV trình bày: Từ kiến thức hóa học lớp 8, các
em đã biết được rằng, nguyên tử là hạt vô cùng
nhỏ và trung hòa về điện. Thành phần nguyên tử
gồm có lớp vỏ electron và hạt nhân gồm proton và neutron.
Bước 2. HS thực hiện nhiệm vụ học tập
- HS đọc thông tin, quan sát hình ảnh, trả lời câu hỏi.
Bước 3. Báo cáo kết quả hoạt động, thảo luận
- Đại diện 2- 3 HS đứng dậy trình bày câu trả lời
- HS khác nhận xét, đánh giá, bổ sung
Bước 4. Đánh giá kết quả thực hiện
- GV đánh giá, nhận xét, kết luận, chuyển sang nội dung mới.
Hoạt động 2. Sự tìm ra electron
Nhiệm vụ 1. Tìm hiểu một số khái niệm
1. Mục tiêu: Biết sự ra đời của electron, biết được diện tích đơn vị và quy ước.
2. Nội dung: GV trình bày, đặt câu hỏi, HS trả lời
3. Sản phẩm học tập: HS nắm vững kiến thức, trả lời câu hỏi
4. Tổ chức thực hiện :
HOẠT ĐỘNG CỦA GIÁO VIÊN VÀ HS
DỰ KIẾN SẢN PHẨM
Bước 1. GV chuyển giao nhiệm vụ học tập
2. Sự tìm ra electron
- GV yêu cầu HS đọc thông tin sgk, hướng dẫn HS * Trả lời:
tìm hiểu thí nghiệm (hoặc làm thí nghiệm) hình 2.2
- Màn huỳnh quang dùng để hứng các tia
của Thomson và đặt câu hỏi: phát ra từ cực âm
+ Em hãy cho biết vai trò của màn huỳnh quang
- Tia âm cực tích điện âm nên bị hút về
trong thí nghiệm ở hình 2.2
cực dương của trường điện
+ Quan sát hình 2.2, giải thích vì sao tia âm cực bị
- Tia âm cực là một loại hạt có khối
hút về cực dương của trường điện.
lượng và truyền theo đường thẳng.
+ Nết đặt một chong chóng nhẹ trên đường đi của tia *Kết luận:
âm cực thì chong chóng sẽ quay. Từ hiện tương đó,
hãy nêu kết luận về tính chất của tia âm cực?
- Trong nguyên tử tồn tại một loại hạt có
khối lượng và mang điện tích âm, được
- Sau khi HS trả lời, GV chiếu video về thí nghiệm
gọi là electron (kí hiệu là e)
Thomson cho cả lớp cùng quan sát, đối chiếu kết quả
HS đã trả lời trước đó. - Hạt electron có:
(https://www.youtube.com/watch?v=QaZ9SE_tNzU) + Điện tích: x
- Sau khi kết luận nội dung bài học, GV cho HS đọc + Khối lượng: = 9,11 x g
thông tin phần mở rộng để tìm hiểu về thí nghiệm
- Người ta chưa phát hiện được điện tích giọt dầu của Millakan.
nào nhỏ hơn 1,602 x nên nó được dùng
Bước 2. HS thực hiện nhiệm vụ học tập
làm điện tích đơn vị, điệ tích của electron được quy ước là -1.
- HS lắng nghe, tiếp nhận câu hỏi, trả lời
- GV phân tích và hướng dẫn vấn đề HS còn chưa nắm được.
Bước 3. Báo cáo kết quả hoạt động, thảo luận
- HS trình bày câu trả lời, ghi chép nội dung chính.
Bước 4. Đánh giá kết quả thực hiện
- GV đánh giá, nhận xét, kết luận, chuyển sang nội dung mới.
Hoạt động 3. Sự khám phá hạt nhân nguyên tử
1. Mục tiêu: Thông qua thí nghiệm của Rutherford, HS biết dược cấu tạo của nguyên tử cũng
như điện của nguyên tử.
2. Nội dung: GV mô phỏng th
3. Sản phẩm học tập: HS nắm được các bước cân bằng phản ứng
4. Tổ chức thực hiện :
HOẠT ĐỘNG CỦA GIÁO VIÊN VÀ HS
DỰ KIẾN SẢN PHẨM
Bước 1. GV chuyển giao nhiệm vụ học tập
3. Sự khám phá hạt nhân nguyên tử
- GV giới thiệu qua về thí nghiệm của Rutherford. *Trả lời:
- GV trình chiếu video cho HS quan sát:
- Các hạt alpha hầu hết đều xuyên thẳng
qua lá vàng. Do nguyên tử có cấu tạo
(https://www.youtube.com/watch?v=CaeZ3MLzY2E) rỗng, ở tâm chứa một hạt nhân mang
- Sau khi xem xong video, GV lần lượt đặt câu hỏi:
điện tích dương có kích thước rất nhỏ so
với kích thước nguyên tử nên các hạt
+ Quan sát thí nghiệm cho biết, các hạt có đường đi alpha có thể đi xuyên qua.
như thế nào? Giải thích?
- Nguyên tử oxygen có 8 electron nên
- GV chiếu hình ảnh kết quả thí nghiệm và đặt câu
hạt nhân của nguyên tử này có điện tích hỏi: là 8
+ Ở hình 2.4, kết quả thí nghiệm khám phá hạt ngân - Điện tích của hạt nhân nguyên tử do
nguyên tử của Rutherford, nguyên tử oxygen có 8
proton quyết định => Số đơn vị điện tích
electron. Vậy em hãy cho biết hạt nhân của nguyên tử hạt nhân = số proton
này có điện tích là bao nhiêu? *Kết luận:
+ Theo em, điện tích của hạt nhận nguyên tử do
thành phần nào quyết định. Từ đó rút ra mối quan hệ - Nguyên tử có cấu tạo rỗng, gồm hạt
giữa số đơn vị diện tích hạt nhân và số proton?
nhân ở trung tâm và lớp vỏ ở các
electron chuyển động xung quanh hạt
Bước 2. HS thực hiện nhiệm vụ học tập nhân.
- HS lắng nghe, tiếp nhận câu hỏi, trả lời
- Nguyên tử trung hoa về điện: số đơn vị
- GV phân tích và hướng dẫn vấn đề HS còn chưa
điện tích dương của hat nhân bằng số nắm được.
đơn vị điện tích âm của các electron trong nguyên tử.
Bước 3. Báo cáo kết quả hoạt động, thảo luận
- HS trình bày câu trả lời, ghi chép nội dung chính.
Bước 4. Đánh giá kết quả thực hiện
- GV đánh giá, nhận xét, kết luận, chuyển sang nội dung mới.
Hoạt động 4. Cấu tạo hạt nhân nguyên tử
1. Mục tiêu: Biết được sự xuất hiện của proton và neutron
2. Nội dung: GV trình bày, đặt câu hỏi, HS trả lời
3. Sản phẩm học tập: HS nắm được cấu tạo của hạt nhân nguyên tử
4. Tổ chức thực hiện :
HOẠT ĐỘNG CỦA GIÁO VIÊN VÀ HS
DỰ KIẾN SẢN PHẨM
Bước 1. GV chuyển giao nhiệm vụ học tập
4. Cấu tạo hạt nhân nguyên tử
- GV yêu cầu HS đọc thông tin mục 4, trả lời
- Hạt nhân nguyên tử gồm hai loại hạt là câu hỏi: proton và neutron
+ Hạt nhân gồm có những loại hạt nào? Các loại ·
Proton mang điện tích dương (+1)
hạt đó mang điện tích gì? (proton (+1) và neutron (ko mang điện)). · Neutron không mang điện
+ Nguyên tử natri (sodium) có điện tích hạt
- Proton và neutron có khối lượng gần bằng
nhân là +11. Cho biết số proton và số electron nhau.
trong nguyên tử này? (bằng 11)
+ Em hãy rút ra kết luận về khối lượng của
proton và neutron?(gần bằng nhau)
Bước 2. HS thực hiện nhiệm vụ học tập
- HS đọc thông tin sgk, trao đổi, thảo luận
- GV quan sát quá trình HS thực hiện
Bước 3. Báo cáo kết quả hoạt động, thảo luận
- Đại diện HS trình bày kết quả
Bước 4. Đánh giá kết quả thực hiện
- GV đánh giá, nhận xét, kết luận, chuyển sang nội dung luyện tập.
Hoạt động 5. Kích thước và khối lượng nguyên tử
1. Mục tiêu: So sánh được khối lượng, kích thước của hạt nhân với kích thước nguyên tử.
2. Nội dung: GV trình bày, đặt câu hỏi, HS trả lời
3. Sản phẩm học tập: HS nắm vững kiến thức
4. Tổ chức thực hiện :
HOẠT ĐỘNG CỦA GIÁO VIÊN VÀ HS
DỰ KIẾN SẢN PHẨM
Nhiệm vụ 1. So sánh kích thước nguyên tử và 5. Kích thước và khối lượng nguyên tử
hạt nhân nguyên tử
a. So sánh kích thước nguyên tử và hạt
Bước 1. GV chuyển giao nhiệm vụ học tập
nhân nguyên tử
- GV yêu cầu HS đọc thông tin mục 5, trả lời *Trả lời: câu hỏi:
- Tỉ lệ: đường kính nguyên tử : đường
+ Quan sat hình 2.6, hãy lập tỉ lệ giữa đường kính hạt nhân = : =
kính nguyên tử và đường kính hạt nhân của
nguyên tử carbon. Từ đó, rút ra nhận xét.
- Nhận xét: đường kính nguyên tử lớn
hơn đường kính hạt nhân khoảng 10000
+ Để biểu thị kích thước nguyên tử sử dụng lần. đơn vị nào?
*Kết luận: Nếu xem nguyên tử như một
- GV kết luận, yêu cầu HS đọc và tìm hiểu
quả cầu, trong đó các electron chuyển thông tin mở rộng.
động rất nhanh xung quanh hạt nhân thì
Bước 2. HS thực hiện nhiệm vụ học tập
nguyên tử đó có đường kính khoảng m
và đường kính hạt nhân khoảng m. Như
- HS đọc thông tin sgk, trao đổi, thảo luận
vậy, đường kính của nguyên tử lớn hơn
- GV quan sát quá trình HS thực hiện
đường kính của hạt nhân khoảng 10 000 lần.
Bước 3. Báo cáo kết quả hoạt động, thảo luận
- Đại diện HS trình bày kết quả
Bước 4. Đánh giá kết quả thực hiện
- GV đánh giá, nhận xét, kết luận, chuyển sang nội dung luyện tập.
*Nhiệm vụ 2. Tìm hiểu khối lượng của nguyên tử
Bước 1. GV chuyển giao nhiệm vụ học tập
- GV chiếu bảng tính chất của các loại hạt cơ
b. Tìm hiểu khối lượng của nguyên tử
bản trong nguyên tử, giải thích và phân tích cho *Trả lời: HS hiểu.
- Tỉ lệ: khối lượng proton / khối lượng electron = 1840 (lần)
- GV yêu cầu HS thảo luận cặp đôi:
=> Kết quả này cho thấy khối lượng của
+ Dựa vào bảng trên, hãy lập tỉ lệ khối lượng
các hạt electron không đáng kể so với
của một proton với khối lượng của một electron. khối lượng của proton và neutron, do đó
Kết quả này nói lên điều gì?
khối lượng của nguyên tử gần bằng khối lượng của hạt nhân.
+ Nguyên tử oxygen -16 có 8 proton 8 neutron
và 8 electron. Tính khối lượng nguyên tử oxygen *Kết luận:
theo đơn vị gam và amu.
Khối lượng của nguyên tử gần bằng khối
- GV kết luận, yêu cầu HS đọc và tìm hiểu
lượng hạt nhân do khối lượng của các thông tin mở rộng.
electron không đáng kể so với khối
lượng của proton và neutron.
Bước 2. HS thực hiện nhiệm vụ học tập
- HS trao đổi, thảo luận, GV quan sát quá trình HS thực hiện.
Bước 3. Báo cáo kết quả hoạt động, thảo luận
- Đại diện HS trình bày kết quả
Bước 4. Đánh giá kết quả thực hiện
- GV đánh giá, nhận xét, kết luận.
- GV tổng kết kiến thức bài học bằng sơ đồ tư duy. HĐ 3. LUYỆN TẬP Thời gian: phút
1. Mục tiêu: Giúp HS hệ thống lại kiến thức đã học
2. Tiến trình tổ chức hoạt động:
- GV trình chiếu câu hỏi:
Câu 1. Hãy cho biết dữ kiện nào trong thí nghiệm của Rutherford chứng minh nguyên tử có cấu tạo rỗng.
Câu 2. Thông tin nào sau đây không đúng?
1. Proton mang điện tích dương, nằm trong hạt nhân, khối lượng gần bằng 1 amu
2. Electron mang điện tích âm, nằm trong hạt nhân, khối lượng gần bằng 0 amu
3. Neutron không mang điện, khối lượng gần bằng 1 amu
4. Nguyên tử trung hòa điệ, có kích thước lớn hơn nhiều so với hạt nhân, nhưng có khối
lượng gần bằng khối lượng hạt nhân.
Câu 3. Mỗi phát biểu dưới đây mô tả loại hạt nào trong nguyên tử?
1. Hạt mang điện tích dương
2. Hạt được tìm thấy trong hạt nhân và không mang điện
3. Hạt mang điện tích âm.
- HS tiếp nhận câu hỏi, suy nghĩ và trả lời:
C1. Dữ kiện: hầu hết các hạt alpha đều xuyên thẳng qua lá vàng điều đó chứng tỏ nguyên tử có
cấu tạo rỗng nên các hạt alpha có thể đi xuyên qua lá vàng.
C2. Chọn đáp án B. Vì electron mang điện tích âm, chuyển động xung quanh hạt nhân nguyên tử
và có khối lượng sấp xỉ bằng 0,00055 amu C3. a) Hạt proton b) Hạt neutron c) Hạt electron
- GV đánh giá, nhận xét, chuyển sang nội dung tiếp theo.
e.Sản phẩm học sinh cần đạt: Câu trả lời của HS. HĐ 4.
HOẠT ĐỘNG VẬN DỤNG Thời gian: phút
1. Mục tiêu: giúp HS vận dụng kiến thức đã vào áp dụng vào thực tiễn cuộc sống.
2. Tiến trình tổ chức hoạt động:
a- GV yêu cầu HS hoàn thành bài tập 4 sgk:
Câu 4. a) Cho biết 1g electron có bao nhiêu hạt ?
1. b) Tính khối lượng của 1 mol electron (biết hằng số Avogadro có giá trị là 6,022 x )
- HS tiếp nhận nhiệm vụ, hoàn thành và báo cáo kết quả:
1. a) Vì 1 hạt electron nặng 9,11x10-28 g nên 1 g electron có số hạt là:
1 : 9,11 : 10-28 = 1,098 x 1027 (hạt)
1. b) 1 mol electron có chứa số hạt là 6,022 x 1023 hạt
Do đó 1 mol electron có khối lượng là:
6,022 x 1023 x 9,11 x 10-28 = 5,486 x 10-4 (g)
- GV nhận xét, đánh giá, kết thúc bài học.
*Hướng dẫn về nhà:
- Ôn tập và ghi nhớ kiến thức vừa học. - Hoàn thành bài tập sgk - Tìm hiểu nội dung bài
3. Sản phẩm học sinh cần đạt: Câu trả lời của HS IV. HỒ SƠ DẠY HỌC: V. BÀI TẬP TRƯỜNG THPT TRẦN PHÚ TỔ HÓA HỌC KHỐI 10
KẾ HOẠCH BÀI DẠY: NGUYÊN TỐ HOÁ HỌC
Thời lượng: 03 tiết I. MỤC TIÊU DẠY HỌC:
Sau bài học này HS có thể: YÊU CẦU CẦN ĐẠT
Nhận thức hóa học
Nêu được khái niệm về nguyên tố hoá học, đồng vị , số hiệu NĂNG LỰC HÓA
nguyên tử, kí hiệu nguyên tử HỌC
Tìm hiểu thế giới tự
Hs hiểu được trong tự nhiên các nguyên tố thường tồn tại
nhiên dưới góc độ hóa gồm nhiều đồng vị. học
Vận dụng kiến thức, kĩ Viết được kí hiệu nguyên tử, tính được nguyên tử khối trung năng đã học
bình, xác định được đồng vị.
Giải quyết vấn đề và
Thảo luận với các thành viên trong nhóm nhằm giải quyết NĂNG LỰC sáng tạo
các vấn đề trong bài học để hoàn thành nhiệm vụ học tập. CHUNG
Giao tiếp và hợp tác
Sử dụng ngôn ngữ khoa học để trình bày được các khái niệm
và kí hiệu liên quan đến nguyên tố hoá học. Hoạt động nhóm
một cách có hiệu quả theo đúng yêu cầu của giáo viên, đảm
bảo các thành viên trong nhóm đều đc tham gia và trình bày báo cáo.
Năng lực tự chủ và tự
Chủ động tích cực tìm hiểu về nguyên tố hoá học. học PHẨM CHẤT Trung thực
Có ý thức tự học và tự tin trong học tập Trách nhiệm
Nhận biết được tầm quan trọng, vai trò của môn Hóa trong
cuộc sống, phục vụ đời sống con người.
II.PHƯƠNG PHÁP VÀ KĨ THUẬT DẠY HỌC :
- Dạy học theo nhóm, nhóm cặp đôi.
- Kĩ thuật sử dụng phương triện trực quan.
- Dạy học nêu và giải quyết vấn đề thông qua câu hỏi trong SGK.
III. TIẾN TRÌNH DẠY HỌC:
A. BẢNG TÓM TẮT CÁC HOẠT ĐỘNG: Hoạt Mục tiêu Nội dung dạy PPDH- KTDH động học học trọng tâm Đánh giá Phương pháp Công cụ (thời gian) HĐ 1: Tạo tâm thế
Phương pháp vấn Vấn đáp Câu trả lời hứng thú cho đáp của học sinh Khởi HS trước khi động-kết vào bài học nối mới. ( phút) HĐ 2:
Tìm hiểu về Trình bày được Kĩ thuật sử dụng Vấn đáp Câu trả lời
điện tích hạt khái niệm về phương tiện trực của học sinh Hình thành
nhân , số khối nguyên tố hoá quan. kiến thức
của nguyên học. Số hiệu Dạy học nêu và mới
tử , số hiệu nguyên tử và kí giải quyết vấn đề nguyên tử hiệu nguyên tử. thông qua câu hỏi ( phút) ,khái niệm
Phát biểu được trong SGK. nguyên tố khái niệm đồng hoá học. vị, nguyên tử
Tìm hiểu khái khối. niệm đồng vị. Nguyên tử Tính được khối và nguyên tử khối nguyên tử trung bình ( theo khối trung bình amu ) dựa vào khối lượng nguyên tử và phần trăm số nguyên tử của các đồng vị theo phổ khối lượng được cung cấp. HĐ 3: Giúp HS hệ Câu hỏi 1,3,4 sgk Vấn đáp Câu trả lời Luyện tập thống lại kiến của học sinh thức đã học ( phút) HĐ 4: giúp HS vận Câu 2 SGK Vấn đáp Câu trả lời Vận dụng dụng kiến của học sinh thức đã vào áp dụng vào thực tiễn ( phút) cuộc sống. B. CÁC HOẠT ĐỘNG:
HĐ 1. Hoạt động khởi động-kết nối Thời gian: phút
1. Mục tiêu: Tạo tâm thế hứng thú cho HS trước khi vào bài học mới.
2. Tiến trình tổ chức hoạt động:
- GV chiếu hình ảnh mô phỏng kim cương và than chì trong SGK
- GV đặt vấn đề: Kim cương và than chì có vẻ ngoài khác nhau. Tuy nhiên, chúng dược tạo thành từ một
nguyên tố hoá học là nguyên tố carbon ( C). Nguyên tố hoá học là gì? Một nguyên tử của nguyên tố hoá
học có những đặc trưng cơ bản nào ?
d. Phương pháp công cụ đánh giá và kết luận: Vấn đáp
e.Sản phẩm học sinh cần đạt: Câu trả lời của HS. HĐ 2.
HOẠT ĐỘNG HÌNH THÀNH KIẾN THỨC Thời gian: phút
1. HẠT NHÂN NGUYÊN TỬ
Hoạt động 1. Tìm hiểu về điện tích hạt nhân
5. Mục tiêu: HS nêu được mối quan hệ giữa các loại hạt trong nguyên tử
6. Nội dung: GV giảng giải, phân tích, yêu cầu HS đọc sgk, thảo luận, trả lời câu hỏi.
7. Sản phẩm học tập: Câu trả lời của HS
8. Tổ chức thực hiện :
Nhiệm vụ : Từ việc quan sát hình 3.1 , cho biết nguyên tử nitrogen có bao nhiêu proton, neutron và
electron. Điện tích hạt nhân của nguyên tử nitrogen có giá trị bao nhiêu? . Qua đó thiết lập được mối
quan hệ giữa số đơn vị điện tích hạt nhân ( Z ) , số proton ( P) và số electron ( E).
Tổ chức dạy học : GV chia lớp thành 4-5 nhóm , yêu cầu các nhóm quan sát hình 3.1 trong SGK và
hướng dẫn HS báo cáo kết quả thảo luận nhóm để trả lời nội dung 1.
Sau hoạt động , GV hướng dẫn HS rút ra kiến thức trọng tâm theo gợi ý SGK. Phiếu học tập số 1
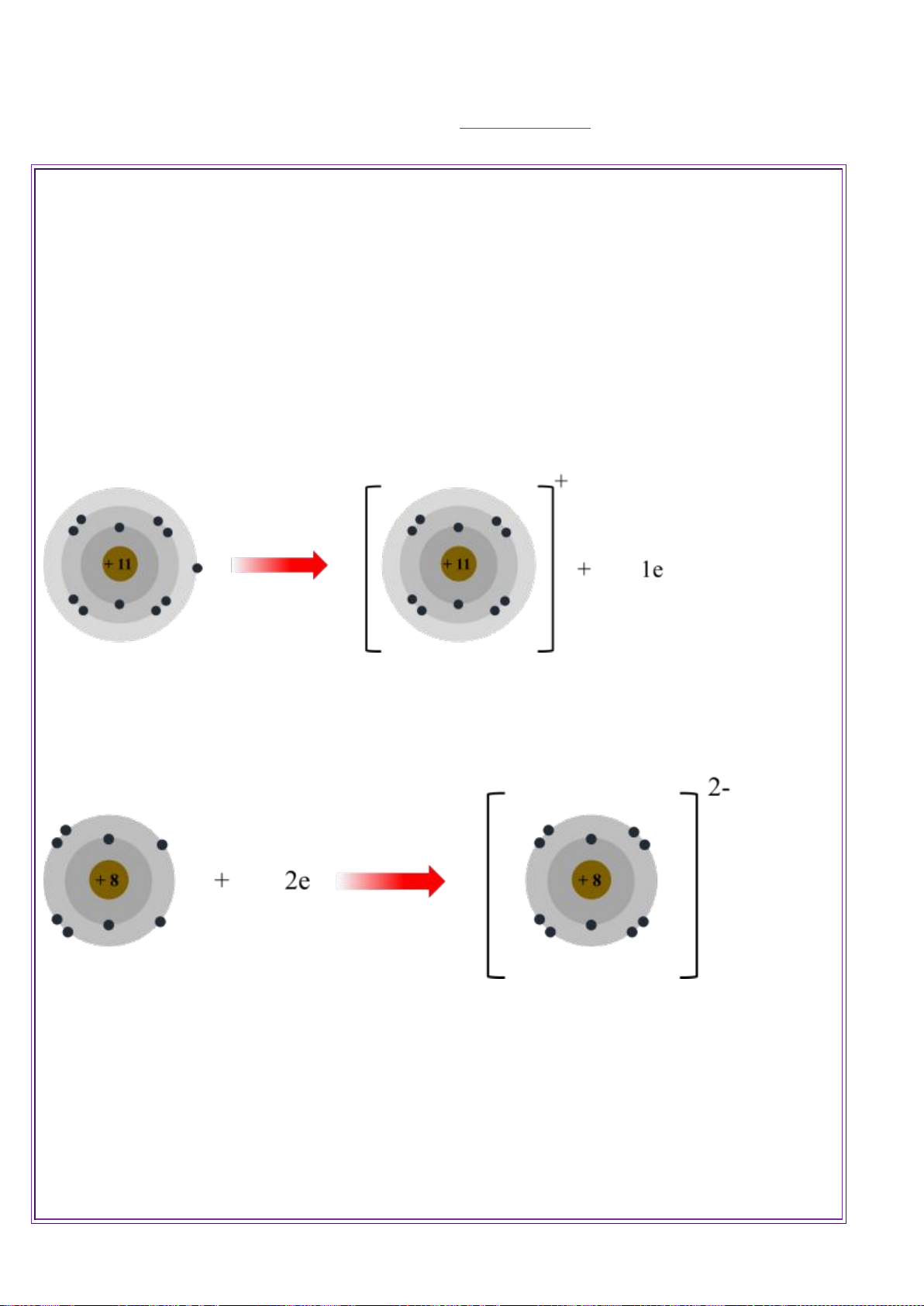
Vận dụng : Nguyên tử sodium có 11 proton. Cho biết số đơn vị điện tích hạt nhân và số electron của nguyên tử này. Câu trả lời : 11.
Hoạt động 2. Tìm hiểu về số khối của nguyên tử.
5. Mục tiêu: Biết được kí hiệu số khối, công thức tính.
6. Nội dung: GV trình bày, đặt câu hỏi, HS trả lời
7. Sản phẩm học tập: HS nắm vững kiến thức, trả lời câu hỏi
8. Tổ chức thực hiện :
Nhiệm vụ : Từ việc quan sát bảng 3.1 , hãy rút ra mối tương quan giữa số khối của nguyên tử ( A) với
tổng số P và N. Qua đó rút ra được cách tính số khối A.
Tổ chức dạy học : GV yêu cầu HS quan sát bảng 3.1 trong SGK hướng dẫn HS trả lời theo yêu cầu.
Sau hoạt động , GV hướng dẫn HS rút ra kiến thức trọng tâm theo gợi ý SGK.
2. NGUYÊN TỐ HOÁ HỌC.
Hoạt động 3. Tìm hiểu về số hiệu nguyên tử
5. Mục tiêu: Tìm hiểu kí hiệu số hiệu nguyên tử , số hiệu nguyên tử cho biết những yếu tố gì trong nguyên tử.
6. Nội dung: GV mô phỏng theo mô hình thí nghiệm trong SGK
7. Sản phẩm học tập: HS trả lời câu hỏi vận dụng- phiếu học tập số 2
8. Tổ chức thực hiện :
Nhiệm vụ : Đọc và quan sát mô hình thí nghiệm khảo sát bản chất tự nhiên của tia X của Henry
Moseley. Qua đó rút ra , mỗi nguyên tố có số P nhất định. Khi thay P chính là thay nguyên tố khác .
Từ đó rút ra số hiệu nguyên tử của một nguyên tố.
Tổ chức dạy học : GV yêu cầu HS quan sát mô hình trong SGK ( hoặc dùng máy chiếu phóng to
hình, có thể sử dụng hình động ) và hướng dẫn HS trả lời nội dung yêu cầu.
Sau hoạt động , GV hướng dẫn HS rút ra kiến thức trọng tâm theo gợi ý SGK. Phiếu học tập số 2
Vận dụng : Nguyên tố carbon có số hiệu nguyên tử là 6. Xác định điện tích hạt nhân của nguyên tử này. Câu trả lời : 6+
Hoạt động 4. Tìm hiểu khái niệm nguyên tố hoá học.
5. Mục tiêu: Biết được khái niệm nguyên tố hoá học
6. Nội dung: GV trình bày, đặt câu hỏi, HS trả lời
7. Sản phẩm học tập: Câu trả lời của HS
8. Tổ chức thực hiện :
Nhiệm vụ : Quan sát hình 3.2 trong SGK , cho biết số proton , số neutron , số electron và điện tích hạt
nhân của từng loại nguyên tử của nguyên tố hydrogen.
Tổ chức dạy học : GV yêu cầu HS quan sát hình 3.2 trong SGK , hướng dẫn HS trả lời.
Sau hoạt động , GV hướng dẫn HS rút ra kiến thức trọng tâm theo gợi ý SGK.
Hoạt động 5. Tìm hiểu kí hiệu nguyên tử.
5. Mục tiêu: Nắm được các đại lượng đặc trưng cơ bản của nguyên tử . Cách viết kí hiệu nguyên tử.
6. Nội dung: GV trình bày, đặt câu hỏi, HS trả lời
7. Sản phẩm học tập: HS nắm vững kiến thức
8. Tổ chức thực hiện :
Nhiệm vụ : Quan sát hình 3.3 trong SGK ,GV yêu cầu HS trả lời kí hiệu nguyên tử cho biết những thông tin nào ?
Tổ chức dạy học : GV yêu cầu HS quan sát hình 3.3 trong SGK hướng dẫn HS trả lời theo yêu cầu.
Sau hoạt động , GV hướng dẫn HS rút ra kiến thức trọng tâm theo gợi ý SGK. Phiếu học tập số 3
Vận dụng : Viết kí hiệu của nguyên tử oxygen. Biết nguyên tử của nguyên tố này có 8 electron và 8 neutron. 3.ĐỒNG VỊ .
Hoạt động 6: Tìm hiểu khái niệm đồng vị
1. Mục tiêu: Nắm được khái niệm đồng vị.
2. Nội dung: GV trình bày, đặt câu hỏi, HS trả lời
3. Sản phẩm học tập: HS nắm vững kiến thức
4. Tổ chức thực hiện :
Nhiệm vụ : Quan sát hình 3.2 trong SGK , GV yêu cầu HS so sánh điểm giống và khác nhau giữa các
loại nguyên tử của nguyên tố hydrogen.
Tổ chức hoạt động : GV nêu vấn đề : Trong tự nhiên , hầu hết các nguyên tố được tìm thấy dưới
dạng hỗn hợp của các đồng vị. Một nguyên tố hoá học dù ở dạng đơn chất hay hợp chất thì tỉ lệ giữa
các đồng vị của nguyên tố này là không đổi. …. Sau đó , GV rút ra nhận xét và trả lời nội dung yêu cầu.
Sau hoạt động , GV hướng dẫn HS rút ra kiến thức trọng tâm theo gợi ý SGK. Phiếu học tập số 4 Vận dụng :
Kim cương là một trong những dạng tồn tại của nguyên tố carbon trong tự nhiên. Nguyên tố này có 2
đồng vị bền với số khối lần lượt là 12 và 13 . Hãy viết kí hiệu nguyên tử của 2 đồng vị này.
5. NGUYÊN TỬ KHỐI VÀ NGUYÊN TỬ KHỐI TRUNG BÌNH
Hoạt động 7: Tìm hiểu nguyên tử khối
1. Mục tiêu: Nắm được định nghĩa nguyên tử khối.
2. Nội dung: GV trình bày, đặt câu hỏi, HS trả lời
3. Sản phẩm học tập: HS nắm vững kiến thức
4. Tổ chức thực hiện :
Nhiệm vụ : Từ việc tìm hiểu khái niệm nguyên tử khối trong SGK, GV rút ra khái niệm.
Tổ chức hoạt động : GV hướng dẫn và rút ra khái niệm nguyên tử khối . Hướng dẫn HS trả lời phiếu học tập số 5 :
Nguyên tử của nguyên tố Magnesium ( Mg) có 12 proton và 12 neutron. Nguyên tử khối của Mg là bao nhiêu?
Sau hoạt động , GV hướng dẫn HS rút ra kiến thức trọng tâm theo gợi ý SGK.
Hoạt động 8: Xác định nguyên tử khối trung bình.
5. Mục tiêu: Nắm được công thức tính nguyên tử khối trung bình.
6. Nội dung: GV trình bày, đặt câu hỏi, HS trả lời
7. Sản phẩm học tập: HS nắm vững kiến thức
8. Tổ chức thực hiện :
Nhiệm vụ : Qua việc tìm hiểu về phổ khối trong SGK , một số vấn đề trong thực tiễn đời sống đã
trình bày trong SGK…Từ đó lĩnh hội được cách tính nguyên tử khối trung bình.
Tổ chức hoạt động : GV hướng dẫn và rút ra kết luận nội dung trọng tâm của hoạt độn . Hướng dẫn
HS trả lời phiếu học tập số 6 :
Trong tự nhiên , nguyên tố copper có hai đồng vị với phần trăm số nguyên tử tương ứng là 63Cu
( 69,15% ) và 65Cu ( 30,85 % ) . Hãy tính nguyên tử khối trung bình của nguyên tố copper.
Sau hoạt động , GV hướng dẫn HS rút ra kiến thức trọng tâm theo gợi ý SGK. HĐ 3. LUYỆN TẬP Thời gian: phút
1. Mục tiêu: Giúp HS hệ thống lại kiến thức đã học
2. Tiến trình tổ chức hoạt động:
- GV trình chiếu câu hỏi:
Câu 1. Một nguyên tử X gồm 16 proton , 16 elctron và 16 neutron. Nguyên tử X có kí hiệu là:
Câu 3. Hoàn thành những thông tin chưa biết trong bảng sau : Đồng vị ? ? 65 30 Zn ? ? Số hiệu ? ? ? 9 11 nguyên tử Số khối ? ? ? ? 23 Số proton 16 ? ? ? ? Số neutron 16 20 ? 10 ? Số electron ? 20 ? ? ?
Câu 4. Trong tự nhiên , magnesium có 3 đồng vị bền là 24Mg, 25Mg và 26Mg . Phương pháp phổ khối
lượng xác nhận đồng vị 26Mg chiếm tỉ lệ phần trăm số nguyên tử là 11%. Biết rằng nguyên tử khối trung
bình của Mg là 24,32. Tính % số nguyên tử của đồng vị 24Mg, đồng vị 25Mg ?
- HS tiếp nhận câu hỏi, suy nghĩ và trả lời:
- GV đánh giá, nhận xét, chuyển sang nội dung tiếp theo.
e.Sản phẩm học sinh cần đạt: Câu trả lời của HS. HĐ 4.
HOẠT ĐỘNG VẬN DỤNG Thời gian: phút
1. Mục tiêu: giúp HS vận dụng kiến thức đã vào áp dụng vào thực tiễn cuộc sống.
2. Tiến trình tổ chức hoạt động:
a- GV yêu cầu HS hoàn thành bài tập 2 sgk:
Câu 2. Silicon là nguyên tố được sử dụng để chế tạo vật liệu bán dẫn , có vai trò quan trọng trong sản
xuất công nghiệp. Trong tự nhiên , nguyên tố này có 3 đồng vị với số khối lần lượt là 28,29,30. Viết kí
hiệu nguyên tử cho mỗi đồng vị của silicon. Biết nguyên tố silicon có số hiệu nguyên tử là 14.
- GV nhận xét, đánh giá, kết thúc bài học.
*Hướng dẫn về nhà:
- Ôn tập và ghi nhớ kiến thức vừa học. - Hoàn thành bài tập sgk - Tìm hiểu nội dung bài
3. Sản phẩm học sinh cần đạt: Câu trả lời của HS IV. HỒ SƠ DẠY HỌC: V. BÀI TẬP
BÀI 4. CẤU TRÚC LỚP VỎ ELECTRON CỦA NGUYÊN TỬ (5 tiết) MỤC TIÊU 1. Năng lực chung
- Tự chủ và tự học chủ động, tích cực tìm hiểu về cấu trúc lớp vỏ electron nguyên tử.
- Giao tiếp và hợp tác: Sử dụng ngôn ngữ khoa học để trình bày và so sánh được mô hình
của Rutherford - Bohr với mô hình hiện đại mô tả sự chuyển động của electron trong nguyên tử;
Hoạt động nhóm một cách hiệu quả theo đúng yêu cầu của GV, đảm bảo các thành viên trong
nhóm đéu được tham gia và trình bày báo cáo;
- Giải quyết vấn đề và sáng tạo: Thảo luận với các thành viên trong nhóm nhằm giải quyết
các vấn đề trong bài học để hoàn thành nhiệm vụ học tập. 2. Năng lực hóa học
- Nhận thức hóa học: Nêu được khái niệm vế orbital nguyên tử (AO), mô tả được hình
dạng của AO (s, p), số lượng electron trong 1 AO; Trình bày được khái niệm lớp, phân lớp
electron và mối quan hệ về số lượng phân lớp trong một lớp. Liên hệ được về số lượng AO trong một phân lớp.
- Tìm hiểu thế giới tự nhiên dưới góc độ hóa học: Trình bày và so sánh được mô hình của
Rutherford - Bohr (mô hình hành tinh nguyên tử) với mô hình hiện đại mô tả sự chuyển động
của electron trong nguyên tử, từ đó liên hệ với sự chuyển động của các hành tinh trong hệ Mặt Trời.
- Vận dụng kiến thức, kĩ năng đã học: Viết được câu hình electron nguyên tử theo lớp,
phân lớp electron và theo ô orbital khi biết số hiệu nguyên tử Z của 20 nguyên tố đầu tiên trong
bảng tuấn hoàn; dựa vào đặc điểm cấu hình electron lớp ngoài cùng của nguyên tử dự đoán
được tính chất hóa học cơ bản (kim loại hay phi kim) của nguyên tố tương ứng. 3. Phẩm chất
- Tham gia tích cực hoạt động nhóm phù hợp với khả năng của bản thân;
- Hình thành thói quen tư duy, vận dụng các kiến thức đã học với thực tiên cuộc sống;
- Có niềm say mê, hứng thú với việc khám phá và học tập hóa học.
Dựa vào mục tiêu của bài học và nội dung các hoạt động của SGK, GV lựa chọn phương
pháp và kĩ thuật dạy học phù hợp đề tổ chức các hoạt động học tập một cách hiệu quà và tạo
hứng thú cho HS trong quá trình tiếp nhận kiến thức, hình thành và phát triển năng lực, phẩm
chất liên quan đền bài học.
A. PHƯƠNG PHÁP VÀ KĨ THUẬT DẠY HỌC
- Dạy học theo nhóm, nhóm cặp đôi;
- Kĩ thuật sử dụng phương tiện trực quan;
- Dạy học nêu và giải quyết vấn đế thông qua câu hỏi trong SGK. B. TỔ CHỨC DẠY HỌC Khởi động
GV đặt vấn đề theo gợỉ ý SGK hoặc liên hệ với các tình huống trong thực tế.
Gợi ý tình huống: Khi lên xe buýt, để thuận tiên cho việc đi lại trên xe, người quản lí xe
thường sắp xếp những người lên trước vào hàng ghế trong cùng và những người lên sau ngồi
vào những hàng ghế kế tiếp cho đến hàng ghế sát cửa ra vào. Trong nguyên tử, các electron
được sắp xếp theo cách nào? Hành khách trên xe buýt
HÌNH THÀNH KIẾN THỨC MỚI
1. SỰ CHUYỂN ĐỘNG CỦA ELECTRON TRONG NGUYÊN TỬ
Hoạt động 1: Tìm hiểu sự chuyển động của electron trong nguyên từ theo sự phát triển
của mô hình nguyên tử
Nhiệm vụ: Từ việc quan sát Hình 4.1 và 4.2 trong SGK, GV yêu cầu HS so sánh mô hình
nguyên tử Rutherford - Bohr với mô hình nguyên tử hiện đại. Qua đó sẽ biết được sự chuyển
động của electron trong nguyên tử theo sự phát triển của mô hình nguyên tử.
Tổ chức dạy học: GV chia lớp thành 4-5 nhóm, yêu cầu các nhóm quan sát Hình 4.1 và 4.2
trong SGK (hoặc dùng máy chiếu phóng to hình, có thể sử dụng hình động) và hướng dẫn HS báo
cáo kết quả thảo luận nhóm để trả lời nội dung 1.
1. Quan sát Hình 4.1 và 4.2, so sánh điểm giống và khác nhau giữa mô hình Rutherford -
Bohr với mô hình hiện đại mô tả sự chuyên động của electron trong nguyên tử.
Điểm giống nhau: Nguyên tử gồm hạt nhân mang điện tích dương và vỏ nguyên tử chứa
electron mang điện tích âm. Electron chuyển động xung quanh hạt nhân. Điểm khác nhau: Mô hình Nôi dung Rutherford - Bohr - Chưa tìm ra hạt neutron.
- Các electron quay xung quanh hạt nhân theo từng quĩ đạo tròn ổn
định, trong đó mỗi quĩ đạo cỏ một mức năng lượng xác định. Hiện đại - Đã tìm ra hạt neutron. (Đám mây electron)
- Các electron chuyến động rất nhanh xung quanh hạt nhân không
theo một quỹ đạo xác định và tạo thành một đám mây electron mang điện tích âm.
Sau hoạt động, GV hướng dẫn HS rút ra kiến thức trọng tám theo gợi ý SGK. Vận dụng
* Hệ Mặt Trời gồm Mặt Trời ở trung tâm và các thiên thể quay quanh theo những quỹ đạo
xác định. Hãy cho biết mô hình nguyên tử của nhà khoa học nào được gọi là mô hình hành tinh
nguyên tử, tương tự như hệ Mặt Trời?
Câu trả lời: Mô hình nguyên tử Rutherford - Bohr.
Hoạt động 2: Tim hiểu vỏ orbital nguyên tử
Nhiệm vụ: Từ việc quan sát Hình 4.3 và 4.4 trong SGK, GV hướng dẫn HS hiểu được khái
niệm orbital nguyên tử và biết được hình dạng của orbital s, p.
Tổ chức dạy học: GV yêu cầu HS quan sát Hình 4.3 và 4.4 trong SGK, hướng dẫn HS trà lời nội dung 2 đến 4.
2. Quan sát Hình 4.3, phân biệt khái niệm đám mây electron và khái niệm orbital nguyên tử.
Giống nhau: Là khu vực không gian xung quanh hạt nhân chứa electron nguyên tử.
Khác nhau: Orbital là khu vực không gian xung quanh hạt nhân mà tại đó xác suất có mặt
(xác suất tìm thấy) electron khoảng 90%.
3. Cho biết khái niệm orbital nguyên tử xuất phát từ mô hình nguyên tử của Rutherford -
Bohr hay mô hình nguyên tử hiện đại.
Mô hình nguyên tử hiện đại.
4. Quan sát Hình 4.4, hãy cho biết điểm giống và khác nhau giữa các orbital p (p_, p? pz).
Giống nhau: đều có hình số 8 nổi.
Khác nhau: các orbital định hướng khác nhau trong không gian.
Để hiểu thêm khái niệm xác suất tìm thấy electron trong nguyên tử, GV có thể hướng dàn
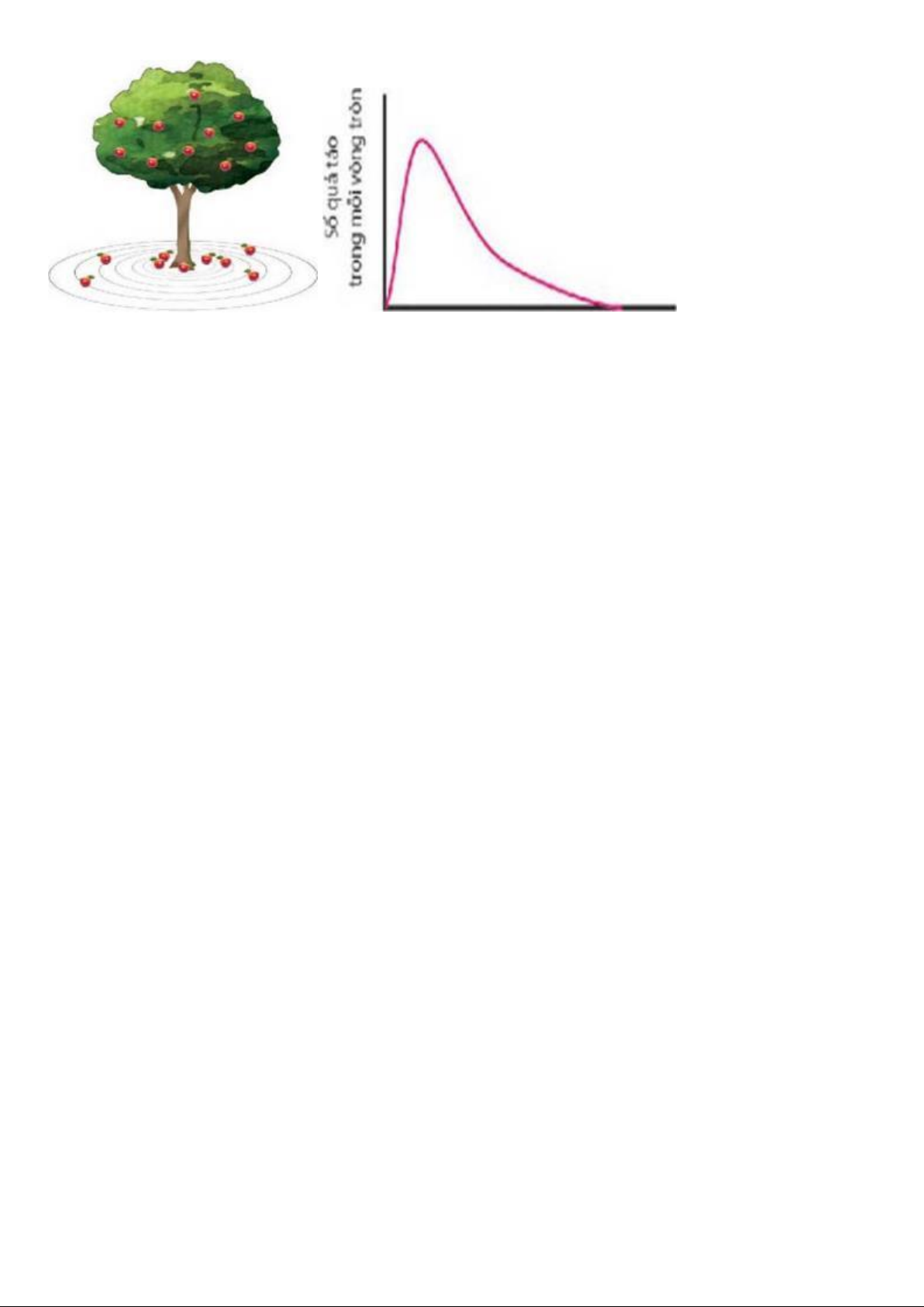
HS liên hệ hiện tượng thực tế: Khi các quả táo chín trên cây rơi xuống đất, chúng sẽ tập trung
nhiều ở khu vực nhất định dưới gốc cây. Vị trí xung quanh gốc cây mà số quả táo rơi xuống nhiều
nhất được xem là tại đó có xác suất lớn nhất tìm thấy các quả táo.
Khoảng cách từ gốc đến các quả táo
Từ đó khai thác bài học qua một số câu hỏi và nhiệm vụ, ví dụ:
1. Quan sát hình trên và cho biết các quả táo chín rơi xuống tập trung ở khu vực nào?
2. Khu vực nào ở gốc cây sẽ không tìm thây các quả táo rơi xuống?
3. Hãy liên hệ với xác suất có mặt các electron trong nguyên tử.
Sau hoạt động, GV hướng dẫn HS rút ra kiến thức trọng tám theo gợi ý SGK.
2. LỚP VÀ PHÂN LỚP ELECTRON
Hoạt động 3: Tìm hiều về lớp electron
Nhiệm vụ: Từ việc quan sát Hình 4.5 trong SGK, GV hướng dẫn HS tìm hiếu cách gọi tên
các lớp electron và hiểu được khái niệm lớp electron.
Tố chức dạy học: GV nêu vấn đế “Trong bảng tuần hoàn, lớp electron lớn nhất ứng với các
nguyên tố đã biết là 7. Các electron trong nguyên tử được sắp xếp theo thứ tự từ lớp n =1 đến n
=7’ , chiếu Hình 4.5 minh họa các lớp electron ở vỏ nguyên tử. GV yêu cầu HS quan sát Hình 4.6
trong SGK và hướng dẫn HS trà lời nội dung 5 và 6.
5. Quan sát Hình 4.5, nhận xét cách gọi tên các lớp electron bằng các chữ cái tương ứng
với các lớp từ 1 đến 7.
Các lớp electron được sắp xếp từ gần hạt nhân ra ngoài, được gọi tên bắt đầu từ chữ K
đến Q (theo bảng chửcái A, B, C, ...) tương ứng với các lớp từ 1 đến 7.
6. Từ Hình 4.5, cho biết lực hút của hạt nhân với electron ở lớp nào là lớn nhất và lớp nào là nhỏ nhất.
Lực hút của hạt nhân với electron lớp 1 là lớn nhất và lớp 7 là nhỏ nhất.
Sau hoạt động, GV hướng dẫn HS rút ra kiến thức trọng tám theo gợi ý SGK.
Hoạt động 4: Tìm hiểu về phân lớp electron
Nhiệm vụ: Từ việc quan sát Hình 4.6 trong SGK, HS hiểu được khái niệm phân lớp electron,
biết được các loại phân lớp electron và số lượng orbital trong mỗi phân lớp.
Tổ chức dạy học: GV yêu cầu HS quan sát Hình 4.6 trong SGK (có thể dùng máy chiếu
phóng to hình) và thảo luận nội dung 7.
7. Quan sát Hình 4.6, nhận xét vế số lượng phân lớp trong các lớp từ 1 đến 4.
- Lớp 1 có 1 phân lớp: 1s.
- Lớp 2 có 2 phân lớp: 2s, 2p.
- Lớp 3 có 3 phân lớp: 3s, 3p, 3d.
- Lớp 4 có 4 phân lớp: 4s, 4p, 4d, 4f.
Khái quát: Từ lớp 1 đến lớp 4, lớp thứ n có n phân lớp.
Giáo viên mở rộng: Lớp 5,6,7 giống lớp 4, thay số thứ tự lớp trước các phân lớp s, p, d, f.
Sau hoạt động, GV hướng dẫn HS rút ra kiến thức trọng tám theo gợi ý SGK.
3. CẤU HÌNH ELECTRON NGUYÊN TỬ
Hoạt động 5: Tìm hiểu về nguyên lí vững bền
Nhiệm vụ: Từ việc quan sát Hình 4.7 trong SGK, GV hướng dẫn HS hiểu được nguyên lí
vững bền Aufbau (Quy tắc Klechkovsky).
Tổ chức dạy học: GV yêu cấu HS quan sát Hình 4.7 trong SGK, thào luận nhóm và hướng
dẫn HS trả lời nội dung 9.
8. Quan sát Hình 4.7, nhận xét chiếu tăng năng lượng của các electron trên các AO ở trạng
thái cơ bản (trạng thái có năng lượng thấp nhất).
Nhìn chung, năng lượng của các electron trên các AO ở trạng thái cơ bản tăng theo số lớp
electron. Tuy nhiên, khi điện tích hạt nhân tăng có sự chèn mức năng lượng, mức 4s trở nên
thấp hơn 3d, mức 5s thấp hơn 4d,. .
Sau hoạt động, GV hướng dẫn HS rút ra kiến thức trọng tám theo gợi ý SGK.
Hoạt động 6: Tim hiểu nguyên li Pauli
Nhiệm vụ: Từ việc quan sát Hình 4.8, 4.9 trong SGK, hiểu được khái niệm electron độc
thân, electron ghép đôi và sự sắp xếp electron trên các orbital của nguyên tử.
Tổ chức dạy học: GV yêu cầu HS quan sát Hình 4.8, 4.9 trong SGK, thảo luận nhóm và
hướng dẫn HS trà lời nội dung 9,10.
9. Quan sát Hình 4.8, cho biết cách biểu diễn 2 electron trong một orbital dựa trên cơ sở nào.
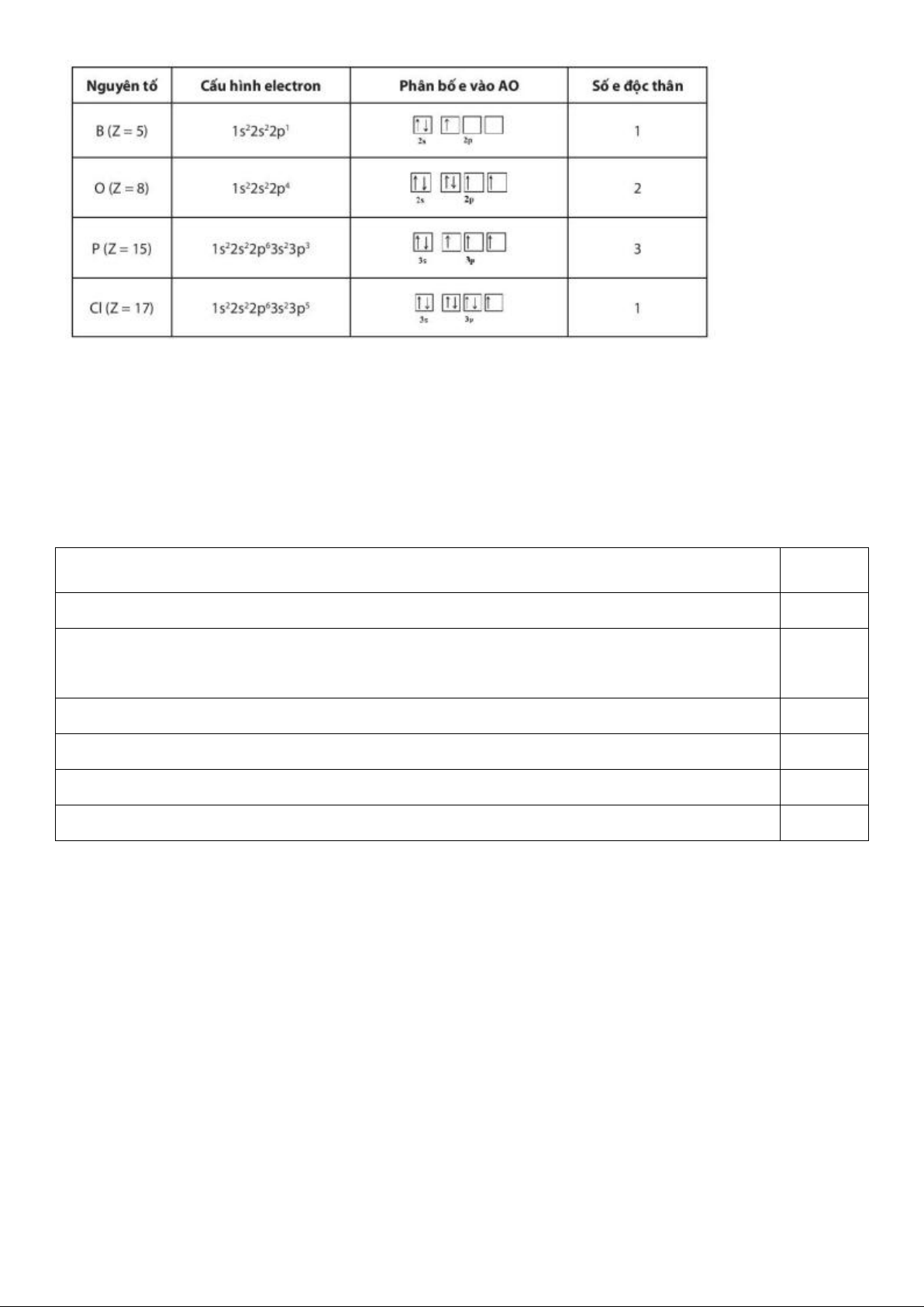
Trong một orbital, hai electron trong cùng AO có chiều quay ngược nhau.
10. Quan sát Hình 4.9, hãy cho biết nguyên tử oxygen có bao nhiêu electron ghép đôi và
bao nhiêu electron độc thân.
6 electron ghép đôi và 2 electron độc thân.
Sau hoạt động, GV hướng dán HS rút ra kiến thức trọng tâm theo gợi ý SGK.
Hoạt động 7: Xác định số AO và số electron tối đa trong một phân lớp và trong mỗi lớp
Nhiệm vụ: Từ việc quan sát Bảng 4.1 trong SGK, HS sử dụng dữ kiện cho sẵn để xác định
số AO và số electron tối đa trong một phân lớp và trong mỗi lớp.
Tổ chức dạy học: GV hướng dân HS quan sát Bảng 4.1 trong SGK, dựa vào các số liệu cho
sẵn, hướng dẫn HS trà lời nội dung 13.
11. Từ Bảng 4.1, hãy chi ra mối quan hệ giữa số thứ tự lớp và số electron tối đa trong mỗi lớp.
- Lớp n được chia thành n phân lớp.
- Mỗi phân lớp có số lượng AO nhất định.
- Mỗi AO chỉ chứa tối đa 2 electron.
Do đó, lớp n có tối đa 2n2 electron.
Sau hoạt động, GV hướng dẫn HS rút ra kiến thức trọng tám theo gợi ý SGK. Luyện tập
* Nguyên tử nitrogen có 2 lớp, trong đó có 2 phân lớp s và 1 phân lớp p. Các phân lớp s
đéu chứa số electron tối đa, còn phân lớp p chỉ chứa một nửa số electron tối đa. Nguyên tử
nitrogen có bao nhiêu electron?
2 phân lớp s: 4 electron; 1 phân lớp p: 3 electron. N có tổng cộng 7 electron.
Hoạt động 8: Tìm hiểu Quy tắc Hund
Nhiệm vụ: Từ việc quan sát Bảng 4.10 trong SGK, HS hiểu Quy tác Hund và biết cách phân
bổ các electron vào các ô lượng tử trong nguyên tử.
Tổ chức dạy học: GV hướng dẫn HS quan sát Hình 4.10 trong SGK, dựa vào các số liệu cho
sẵn, hướng dẫn HS trả lời nội dung 12 và 13.
12. Quan sát Hình 4.10, hãy nhận xét số lượng electron độc thân ở mỗi trường hợp.
Trường hợp (a) không có electron độc thân vì các orbital đã chứa đầy electron.
Trường hợp (b) vã (c), theo cách phân bố electron ở hai trường hợp này, số electron độc thân là nhiều nhất.
13. Hãy đề nghị cách phân bồ electron vào các orbital để số electron độc thân là tối đa.
Đầu tiên, điền các electron bằng dấu mũi tên hướng lên theo từ trái sang phải. Sau đó,
điền các electron bằng dấu mũi tên hướng xuống theo chiếu từ trái sang phải sao cho tổng số
mũi tên bằng số lượng electron của nguyên tử.
Sau hoạt động, GV hướng dẫn HS rút ra kiến thức trọng tâm theo gợi ý SGK. Luyện tập
* Trong các trường hợp (a) và (b) dưới đây, trường hợp nào có sự phân bố elcctron vào
các orbital tuân theo và không tuân theo quy tác Hund.
Trường hợp (a) tuân theo quy tắc Hund. Trường hợp (b) không tuân theo quy tắc Hund.
Hoạt động 9: Tim hiểu cách viết cấu hình electron nguyên tử
Nhiệm vụ: Từ việc tìm hiểu cách viết cấu hình electron nguyên tử trong SGK, GV hướng
dẫn HS cách viết cầu hình electron nguyên tử.
Tổ chức dạy học: GV hướng dẫn HS quan sát cách viết cấu hình electron nguyên tử trong
SGK.dựa vào các số liệu cho sẵn, hướng dân HS trả lời nội dung 14.
14. Cấu hình electron của một nguyên tử cho biết những thông tin gì?
- Số proton, số electron, số hiệu nguyên tử.
- Số lớp, số phân lớp của từng lớp và sự phân bó electron vào phân lớp của từng lớp.
Sau hoạt động, GV hướng dẫn HS rút ra kiên thức trọng tâm theo gợi ý SGK. Luyện tập
* Viết cấu hình electron nguyên tử của nguyên tố aluminium (Z = 13) và biếu diễn cấu
hình electron của aluminium theo ỏ orbital. Từ đó, xác định số electron độc thân của nguyên tử này.
Cấu hình e của AI: 1s2 2s2 2p63s2 3p1
Cấu hình e của Al theo orbital:
Al có 1 electron độc thân.
Hoạt động 10: Tìm hiểu đặc điểm cấu hình electron lớp ngoài cùng của nguyên tử
Nhiệm vụ: Từ việc quan sát Bảng 4.2 trong SGK, GV hướng dẫn HS tìm hiểu đặc điểm cấu
hình electron lớp ngoài cùng của nguyên tử.
Tổ chức dạy học: GV chia lớp thành 4-5 nhóm. GV hướng dẫn HS trong các nhóm quan sát
Bảng 4.2 trong SGK, dựa vào các số liệu cho sẵn, hướng dẫn HS đại diện mỗi nhóm trà lời nội dung 15.
15. Quan sát Bảng 4.2, hãy cho biết dựa trên cơ sở nào dễ dự đoán phosphorus là nguyên tố phi kim.
P có 5 electron lớp ngoài cùng.
Sau hoạt động, GV hướng dẫn HS rút ra kiến thức trọng tâm theo gợi ý SGK. Vận dụng
• Lithium là một nguyên tố có nhiều công dụng, được sử dụng trong chế tạo máy bay và
trong một số loại pin nhất định. Pin Lithium-lon (pin Li-lon) đang ngày càng phổ biến, nó cung
cấp năng lượng cho cuộc sóng của hàng triệu người mỗi ngày thông qua các thiết bị như máy
tính xách tay, điện thoại di động, xe Hybrid, xe điện,. . nhờ trọng lượng nhẹ, cung cấp năng
lượng cao và khả năng sạc lại. Dựa vào cầu hình electron nguyên tử (Bảng 4.2), hãy dự đoán
lithium là kim loại, phi kim hay khí hiếm?
Dựa vào cấu hình electron của Li, nhận thây Li có 1 electron ở lớp ngoài cùng. Từ đó có
thể dự đoán Li là nguyên tố kim loại.
C. HƯỚNG DẪN GIẢI BÀI TẬP 1. Phương án (1).
2. Câu hình electron: 1s2 2s2 2p4. Số hiệu nguyên tử: 8. 3. 4. Cấu hình electron C 1s22s22p2 4e lớp ngoài cùng Phi kim Na 1s22s22p63s1 1e lớp ngoài cùng Kim loại O 1s22s22p4 6e lớp ngoài cùng Phi kim
Phân phối chương trình dự kiến nội dung Bảng tuần hoàn các nguyên tố hóa học
BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC Số tiết
Cấu tạo của bảng tuần hoàn các nguyên tố hoá học 2
Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một chu kì và 2 trong một nhóm
Xu hướng biến đổi thành phần và một số tính chất của hợp chất trong một chu kì 1
Định luật tuần hoàn và ý nghĩa của bảng tuần hoàn các nguyên tố hoá học 2 Luyện tập 2 Tổng 9
KẾ HOẠCH DẠY HỌC
Chủ đề/ Bài học: BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC
Môn học/Hoạt động giáo dục: Hoá học; lớp: 10
Thời gian thực hiện: 2 tiết
I. MỤC TIÊU DẠY HỌC 1. Kiến thức:
Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn các nguyên tố hóa học.
Cấu tạo bảng tuần hoàn các nguyên tố hóa học: ô nguyên tố, chu kì, nhóm nguyên tố.
2. Mục tiêu về phẩm chất, năng lực: Phẩm chất, Yêu cầu cần đạt năng lực
2.1. Phẩm chất chủ yếu
Tích cực tìm tòi trong quá trình học tập tìm hiểu nội dung lịch sử phát minh Chăm chỉ bảng tuần hoàn các NTHH.
Thực hiện đầy đủ nhiệm vụ được phân công trong quá trình làm việc nhóm để
Trách nhiệm hoàn thành các PHT.
Mô tả và ghi chép lại đúng những gì đã quan sát được trong video tìm hiểu lịch Trung thực
sử phát minh bảng tuần hoàn các NTHH. 2.2. Năng lực chung
Tự chủ và tự Chủ động thực hiện những công việc của bản thân để hoàn thành các nhiệm vụ học
trong quá trình tìm hiểu nội dung cấu tạo bảng tuần hoàn các NTHH. Giải quyết
Xác định và làm rõ thông tin, ý tưởng mới và phức tạp từ các nguồn thông tin vấn đề và
khác nhau để thiết kế được bảng tuần hoàn chính xác. sáng tạo
Nêu được nhiều ý tưởng mới trong quá trình xây dựng bảng tuần hoàn.
Biết lựa chọn hình thức làm việc nhóm với quy mô phù hợp với yêu cầu nêu ra Giao tiếp và
trong các hoạt động nhóm để hoàn thành các PHT. hợp tác
Phân tích được các công việc cần thực hiện để hoàn thành các PHT tìm hiểu kiến
thức về cấu tạo bảng tuần hoàn.
2.3. Năng lực đặc thù môn Hóa học (Năng lực hóa học)
Nêu được lịch sử phát minh bảng tuần hoàn các nguyên tố hoá học.
Mô tả được cấu tạo của bảng tuần hoàn các nguyên tố hoá học.
Trình bày được các khái niệm liên quan (ô, chu kì, nhóm). Nhận thức
Nêu được nguyên tắc sắp xếp của bảng tuần hoàn các nguyên tố hoá học (dựa hóa học theo cấu hình electron).
Phân loại được nguyên tố (dựa theo cấu hình electron: nguyên tố s, p, d, f).
Phân tích được mối liên hệ giữa cấu hình và vị trí của nguyên tố trong bảng tuần hoàn.
Tìm hiểu thế Quan sát bảng tuần hoàn để rút ra được nguyên tắc sắp xếp các nguyên tố trong
giới tự nhiên bảng tuần hoàn. dưới góc độ
Quan sát video để tìm hiểu về lịch sử phát minh của bảng tuần hoàn các NTHH. hóa học
Vận dụng cấu hình electron nguyên tử, biết được vị trí của nguyên tố trong bảng
tuần hoàn và ngược lại. Vận dụng
Vận dụng kiến thức, kĩ năng đã học để viết cấu hình electron nguyên tử khi đã kiến thức, kĩ
biết vị trí của nguyên tố trong bảng tuần hoàn. năng đã học
Vận dụng kiến thức, kĩ năng đã học để xác định vị trí của một NTHH trong
bảng tuần hoàn thông qua số hiệu nguyên tử.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
1. Thiết bị dạy học: Các thiết bị hỗ trợ trình chiếu (máy tính, máy chiếu); Phần mềm hỗ trợ trình chiếu (Powerpoint);
2. Học liệu: Các phiếu hỗ trợ học tập gồm: Phiếu ghi bài; Phiếu học tập; Bảng kiểm quan sát hoạt
động nhóm. Các phiếu chi tiết ở phụ lục.
Link video lịch sử bảng tuần hoàn các NTHH: https://www.youtube.com/watch?v=8qS1iULbQfw
III. TIẾN TRÌNH DẠY HỌC
Hoạt động 1: XÁC ĐỊNH NHIỆM VỤ HỌC TẬP (10 phút) 1. Mục tiêu
Nêu được lịch sử phát minh bảng tuần hoàn các NTHH.
Tạo hứng thú và kích thích sự tò mò của HS vào chủ đề học tập.
HS tiếp nhận kiến thức chủ động, tích cực, hiệu quả.
Thật thà, trung thực trong việc quan sát video lịch sử phát minh bảng tuần hoàn các NTHH.
2. Nội dung hoạt động
GV trình chiếu đoạn video về lịch sử tìm ra bảng tuần hoàn.
HS theo dõi video và điền vào phiếu ghi bài. 3. Sản phẩm
HS thảo luận theo cặp, điền các thông tin liên quan tới lịch sử phát minh của bảng tuần hoàn các NTHH.
Từ việc quy kết các câu trả lời của HS và điều hướng của GV, GV tổng kết các nội dung học tập cốt lõi.
Nội dung ghi bài của HS:
Lịch sử phát minh bảng HTTH các NTHH
- Các nhà Triết học Hy Lạp cổ đại cho rằng: “Mọi vật được tạo thành từ đất, nước, gió và lửa”.
- Quy luật bộ ba được nhà bác học J. W. Döbereiner tìm ra vào năm 1817.
- Nhà địa chất học de Chancourtois đã nhận thấy tính tuần hoàn của các nguyên tố khi đặt các nguyên
tố ở hình dạng xoắn. Nhà bác học người Anh John Newlands đã tìm ra quy tắc quãng tám.
- Vào năm 1868 và 1869, nhà bác học người Nga D. I. Mendeleev đã gửi Bản thảo tới Hội khoa
học. Vào năm 1869, bảng tuần hoàn các NTHH được D. I. Mendeleev sắp xếp theo chiều tăng dần
khối lượng nguyên tử, gồm 63 nguyên tố.
- Nhà vật lí H. J. Monsley nhận thấy số hiệu nguyên tử quan trọng nhất đối với một NTHH.
4. Tổ chức thực hiện
Phương pháp dạy học hợp tác theo nhóm và sử dụng phương tiện trực quan.
Phương pháp đánh giá: Phương pháp quan sát, vấn đáp.
Công cụ đánh giá: phiếu ghi bài của HS.
Bước 1: Chuyển giao nhiệm vụ học tập
HS làm việc theo cặp (2HS).
GV yêu cầu HS theo dõi video, sau đó thảo luận để hoàn thành nội dung về lịch sử phát minh
bảng tuần hoàn các NTHH trong phiếu ghi bài.
Bước 2: Thực hiện nhiệm vụ học tập
HS quan sát video để tìm ra đáp án và hoàn thành phiếu ghi bài.
Bước 3: Báo cáo
GV mời đại diện 02 nhóm nhanh nhất nêu đáp án của mình.
GV cho các HS khác trong lớp nhận xét và bổ sung.
Bước 4: Tổng kết, đánh giá và định hướng
GV phân tích nhanh các câu trả lời của HS từ đó có thể chọn, tổng hợp và kết nối với ý kiến của nhiều HS khác nhau.
GV tóm tắt lịch sử phát minh của bảng tuần hoàn các NTHH. Định hướng cho HS chuyển sang hoạt động tiếp theo.
Hoạt động 2: HÌNH THÀNH KIẾN THỨC, KĨ NĂNG (60 phút)
Hoạt động 2.1. TÌM HIỂU NGUYÊN TẮC SẮP XẾP CÁC NGUYÊN TỐ TRONG
BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC (15 phút) 1. Mục tiêu
Nêu được nguyên tắc sắp xếp trong bảng tuần hoàn các NTHH (dựa theo cấu hình electron).
Góp phần phát triển năng lực giao tiếp và hợp tác, năng lực giải quyết vấn đề thông qua hoạt
động thảo luận nhóm để hoàn thành PHT số 1.
2. Nội dung hoạt động
HS thảo luận theo nhóm (3HS) hoàn thành PHT số 1. 3. Sản phẩm
Từ việc quy kết các câu trả lời của HS và điều hướng của GV, HS ghi bài các nội dung học tập cốt lõi.
Phiếu học tập số 1 – Nguyên tắc sắp xếp các NTHH trong bảng tuần hoàn
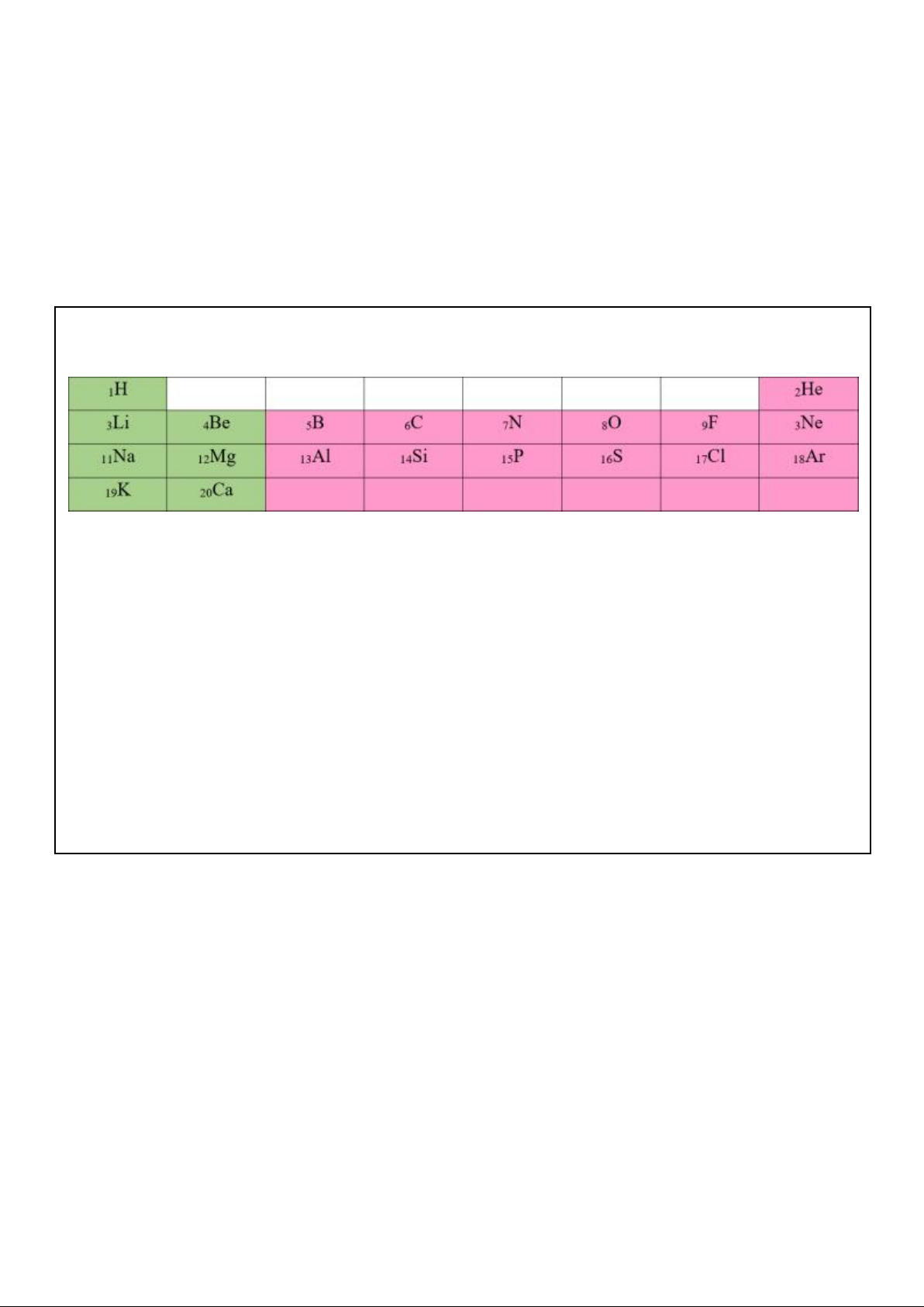
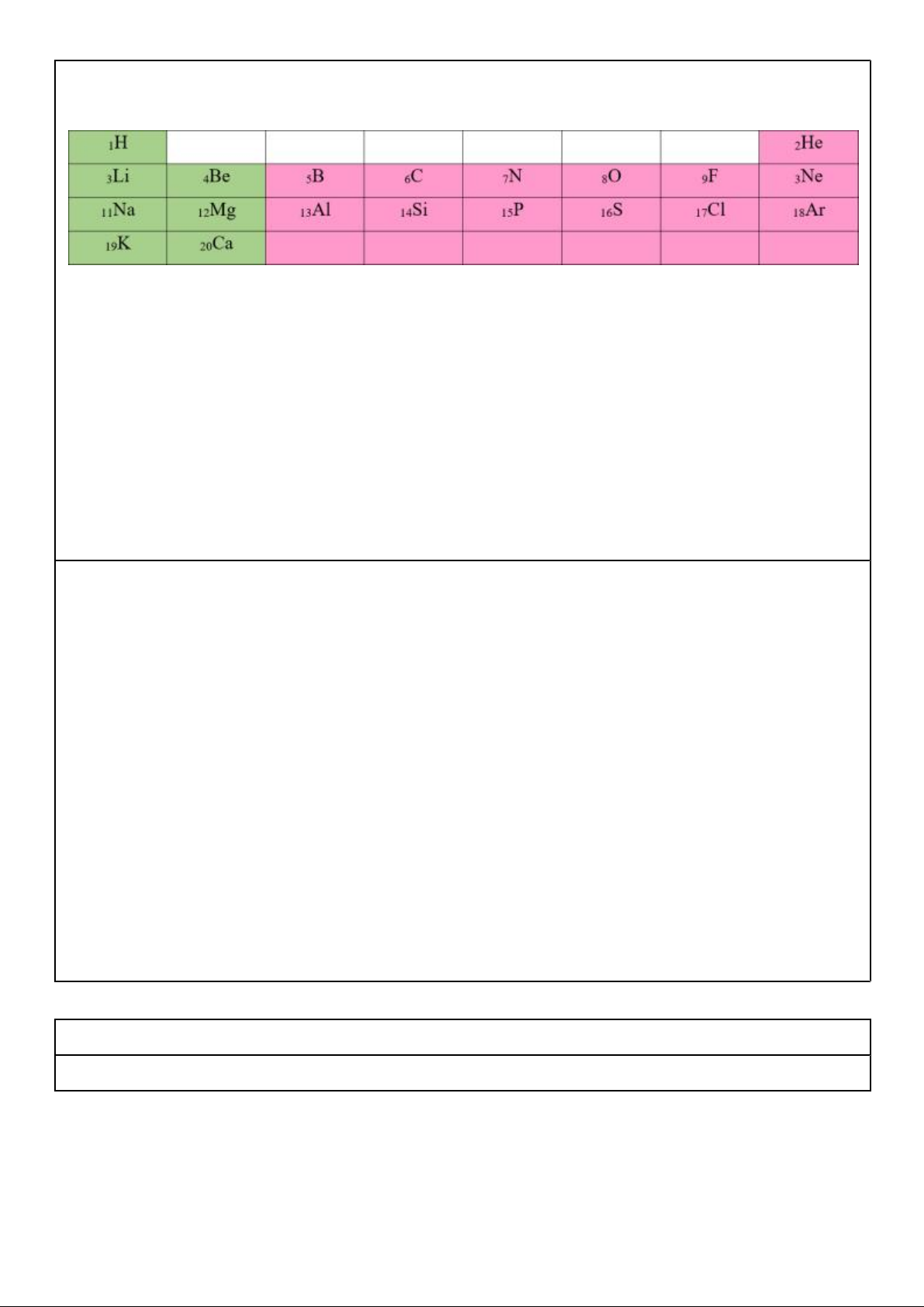
Cho bảng tuần hoàn sau (chỉ gồm 20 NTHH đầu tiên)
Câu 1. Quan sát bảng tuần hoàn các NTHH, chú ý điện tích hạt nhân nguyên tử của các nguyên
tố nguyên tắc sắp xếp thứ nhất.
Nguyên tắc thứ 1: Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
Câu 2. Viết cấu hình electron của các nguyên tử sau: 1H, 3Li, 4Be, 5B, 11Na, 12Mg, 13Al, 20Ca 1H: 1s1;
3Li: 1s2 2s1; 4Be: 1s2 2s2; 5B: 1s2 2s2 2p1;
11Na: 1s2 2s2 2p6 3s1; 12Mg: 1s2 2s2 2p6 3s2; 13Al: 1s2 2s2 2p6 3s2 3p1 ;
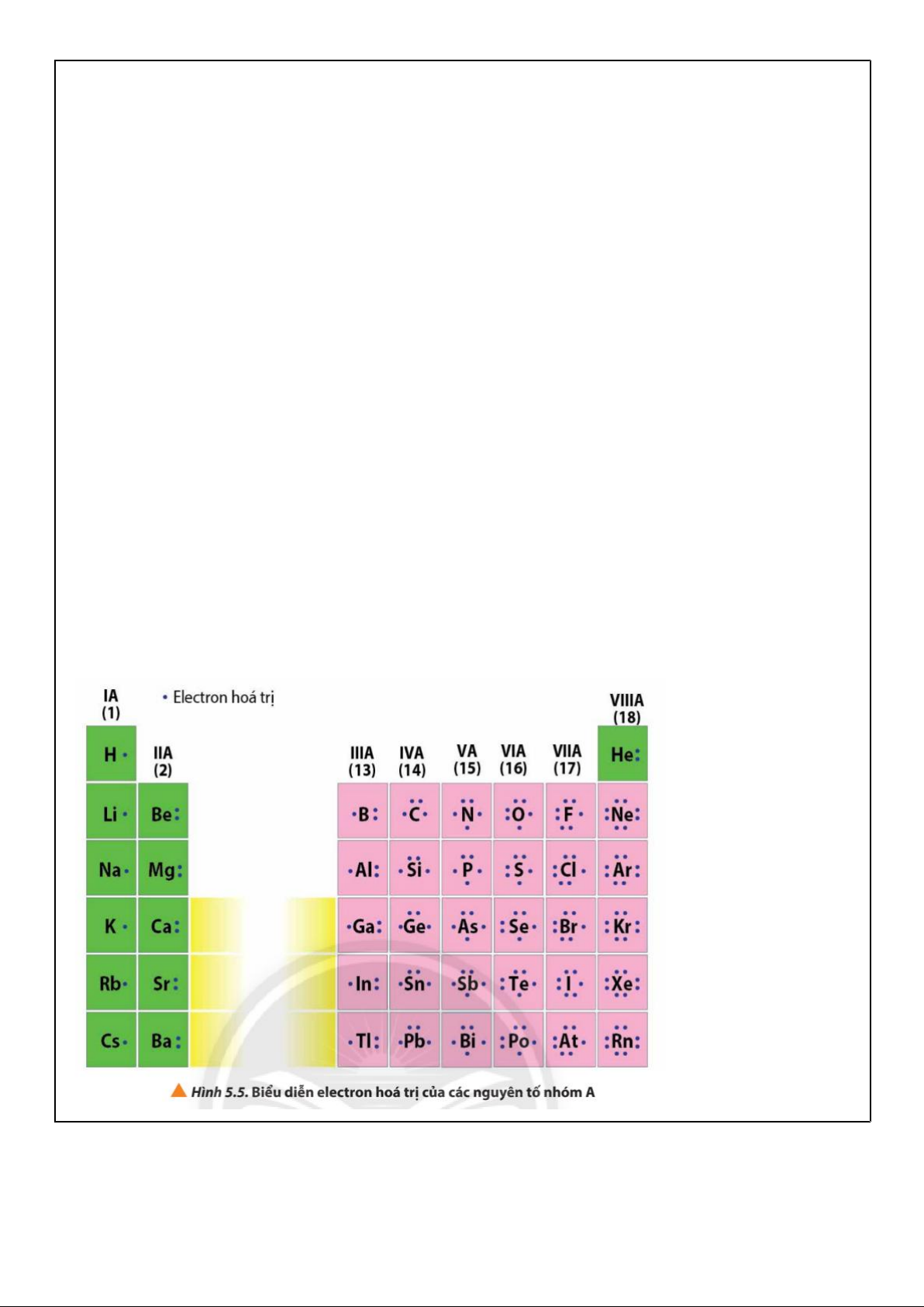
20Ca: 1s2 2s2 2p6 3s2 3p6 4s2.
a. Dựa vào cấu hình electron nguyên tử của các nguyên tố: Li, Be, B, Na, Mg, Al nguyên tắc thứ 2.
- Li, Be, B đều có hai lớp electron. Li, Be, B thuộc cùng một hàng trong bảng tuần hoàn và được
xếp ở hàng thứ 2 thuộc chu kì 2.
- Na, Mg, Al đều có ba lớp electron. Na, Mg, Al thuộc cùng một hàng trong bảng tuần hoàn và được
xếp ở hàng thứ 3 thuộc chu kì 3.
Nguyên tắc thứ 2: Các nguyên tố có cùng số lớp e trong nguyên tử được xếp thành 1 hàng ngang (Chu kì).
b. Dựa vào cấu hình electron nguyên tử của các nguyên tố H, Li, Na, Be, Mg, Ca. Xác định số
electron hóa trị nguyên tắc thứ 3.
- Li, Na, K đều có một electron ở lớp ngoài cùng (1e hóa trị) Xếp vào một cột.
- Be, Mg, Ca. Đều có hai electron ở lớp ngoài cùng (2e hóa trị) Xếp vào một cột
Nguyên tắc thứ 3: Các nguyên tố có số electron hoá trị trong nguyên tử như nhau được xếp thành 1 cột (Nhóm).
* Electron hóa trị: là những electron có khả năng tham gia hình thành liên kết hoá học.
* Số e hóa trị = số e lớp ngoài cùng + số e ở phân lớp sát lớp ngoài cùng chưa bão hòa (nếu có).
4. Tổ chức thực hiện
Phương pháp dạy học hợp tác theo nhóm và đàm thoại gợi mở.
Phương pháp đánh giá: Phương pháp quan sát, vấn đáp.
Công cụ đánh giá: bảng kiểm quan sát.
Bước 1: Chuyển giao nhiệm vụ học tập
GV phát PHT số 1, yêu cầu HS làm việc theo nhóm (3HS).
Bước 2: Thực hiện nhiệm vụ học tập
HS thảo luận theo nhóm để tìm ra đáp án và hoàn thành PTH số 1.
GV quan sát, có định hướng kịp thời cho HS nếu HS hiểu sai vấn đề.
Bước 3: Báo cáo
GV mời một số học sinh đại diện nhóm trình bày kết quả.
GV cho các HS khác trong lớp nhận xét và bổ sung.
Bước 4: Tổng kết, đánh giá và định hướng
GV phân tích nhanh các câu trả lời của HS từ đó có thể chọn, tổng hợp và kết nối với ý kiến của nhiều HS khác nhau
GV nhắc lại cách xác định số electron hóa trị của một nguyên tố.
GV giúp HS nhận ra những chỗ sai sót cần chỉnh sửa và chuẩn hóa kiến thức về các nguyên tắc
sắp xếp các NTHH vào bảng tuần hoàn các NTHH.
GV yêu cầu HS ghi nhận nội dung vào phiếu ghi bài.
Hoạt động 2.2: TÌM HIỂU CẤU TẠO BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC (35 phút) 1. Mục tiêu
Mô tả được cấu tạo của bảng tuần hoàn các NTHH.
Trình bày được các khái niệm liên quan (ô, chu kì, nhóm).
Phân loại được nguyên tố (dựa theo cấu hình electron: nguyên tố s, p, d, f).
Vận dụng kiến thức đã học để phân tích được mối liên hệ giữa cấu hình electron và vị trí của
nguyên tố trong bảng tuần hoàn các NTHH.
Phát triển năng lực hợp tác, năng lực giải quyết vấn đề thông qua hoạt động làm việc nhóm để
tìm ra cấu tạo của bảng tuần hoàn các NTHH.
Hoàn thành nhiệm vụ cá nhân đầy đủ và đúng thời gian.
2. Nội dung hoạt động
GV sử dụng phương pháp dạy học hợp tác kết hợp với kĩ thuật mảnh ghép để tổ chức dạy học nội dung này.
GV yêu cầu HS ở các “Nhóm chuyên sâu” thảo luận nhóm về các nội dung: cấu tạo của bảng
tuần hoàn các NTHH gồm ô nguyên tố, chu kì và nhóm nguyên tố.
Các HS ở nhóm chuyên sâu lần lượt sẽ trình bày những nội dung mà mình đảm nhận về cấu tạo
của bảng tuần hoàn các NTHH. Sau đó các “Nhóm mảnh ghép” thảo luận để rút ra cấu tạo của bảng
tuần hoàn các NTHH, đồng thời hoàn thành PHT số 2. 3. Sản phẩm
Nhiệm vụ học tập của “Nhóm chuyên sâu”
Phiếu màu trắng – Tìm hiểu về ô nguyên tố
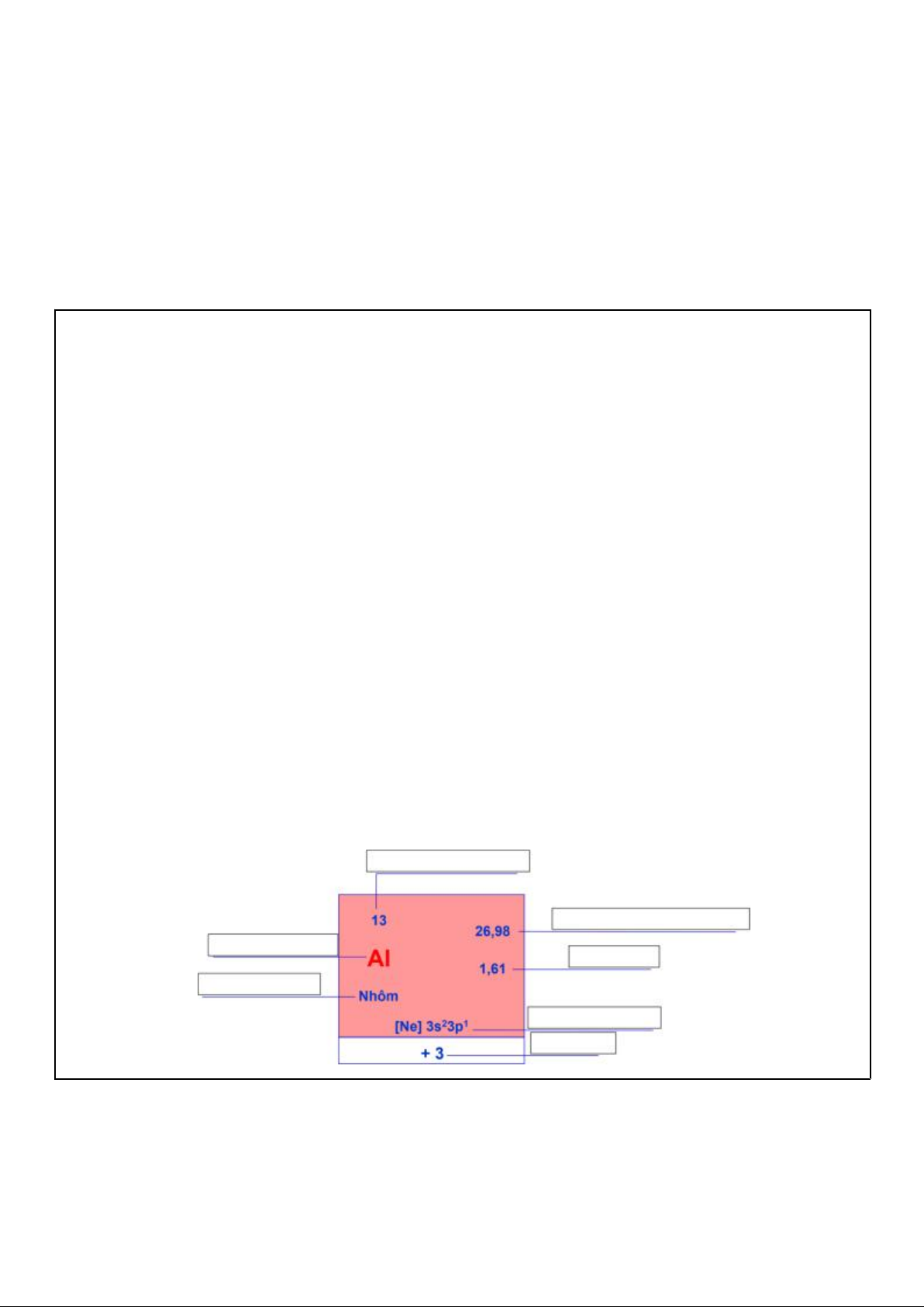
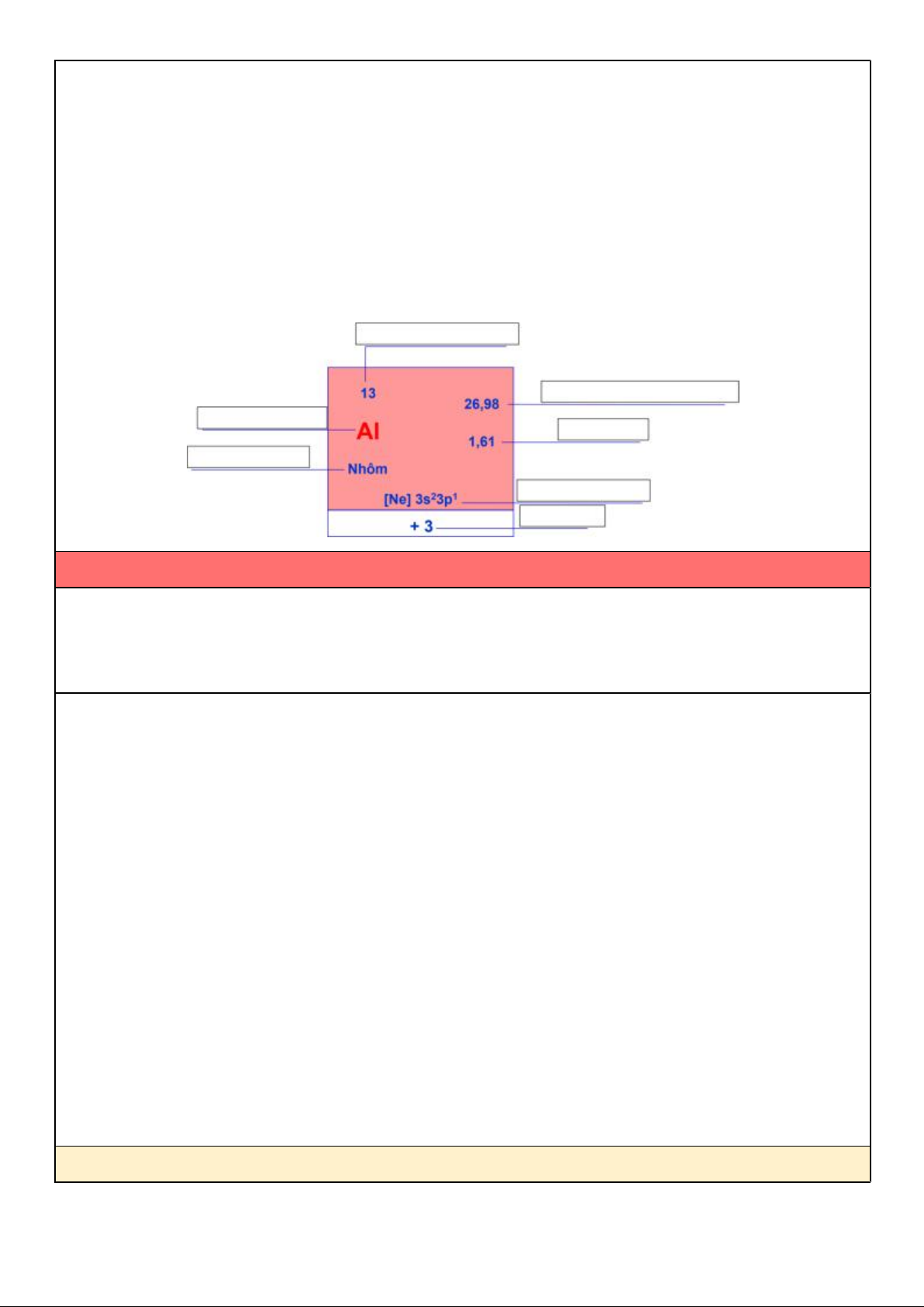
a) Cho biết ô nguyên tố là gì?
- Mỗi NTHH được xếp vào một ô trong bảng tuần hoàn gọi là ô nguyên tố.
b) Sử dụng bảng HTTH, hãy cho biết ô nguyên tố chứa đựng những thông tin nào về NTHH?
Nêu ví dụ cho một NTHH bất kì.
- Trong một ô nguyên tố có ghi các đặc điểm của NTHH đó như: tên nguyên tố; kí hiệu hóa học; số
hiệu nguyên tử; nguyên tử khối trung bình; độ âm điện; cấu hình electron nguyên tử; số oxh, . .
- Ví dụ: Trong ô của nguyên tố Clo có chứa các thông tin như:
+ Số hiệu nguyên tử Z = e = p = 17
+ Ký hiệu hóa học là Cl; tên nguyên tố là Clo;
+ Cấu hình electron nguyên tử là [Ne]3s23p5;
+ Nguyên tử khối trung bình là 35,45; Độ âm điện là 3,16; số oxi hóa là -1, 1, 3, (4), 5, 7.
c) Cách xác định STT ô nguyên tố như thế nào? Cho 1 ví dụ minh họa.
- Số thứ tự của ô nguyên tố đúng bằng số hiệu nguyên tử của nguyên tố đó.
STT ô = số hiệu nguyên tử = số đơn vị ĐTHN = số p = số e
- Ví dụ: nguyên tố Clo có số hiệu nguyên tử là 17 nên sẽ ở ô nguyên tố số 17.
d) Cho nguyên tố hóa học sau, hãy điền các thông tin còn thiếu vào chỗ trống.
Phiếu màu đỏ – Tìm hiểu về chu kì
a) Quan sát bảng tuần hoàn các NTHH cho biết thế nào là chu kì?
- Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp e, được xếp theo chiều ĐTHN nguyên tử tăng dần.
b) Bảng tuần hoàn các NTHH gồm có bao nhiêu chu kì? Số lượng chu kì nhỏ, số lượng chu
kì lớn? Số lượng nguyên tố có trong mỗi chu kì.
- Bảng tuần hoàn có 7 chu kì được đánh số từ 1 đến 7.
+ Chu kì 1, 2, 3 được gọi là chu kì nhỏ (mỗi chu kì có 8 nguyên tố, trừ chu kì 1 chỉ có 2 nguyên tố)
+ Chu kì 4, 5, 6 được gọi là chu kì lớn (chu kì 7 chưa hoàn thành) (chu kì 4,5 mỗi chu kì có 18
nguyên tố, chu kì 6 có 32 nguyên tố).
c) Kết hợp tìm hiểu SGK, hãy cho biết đặc điểm của chu kì là gì (chú ý về số lớp electron,
điện tích hạt nhân, nguyên tố đầu tiên và nguyên tố kết thúc)? Lấy ví dụ minh hoạ.
- Các nguyên tố trong cùng chu kì có số lớp electron bằng nhau và bằng STT của chu kì.
- Điện tích hạt nhân tăng dần theo chiều từ trái sang phải.
- Mở đầu chu kì là kim loại kiềm, cuối chu kì là khí hiếm.
- Ví dụ: chu kì 3 (từ Na đến Ar),
+ Trong cấu hình electron nguyên tử đều có 3 lớp electron.
+ Điện tích hạt nhân tăng dần từ 11+ đến 18+.
+ Nguyên tố đầu tiên là kim loại kiềm Na, nguyên tố kết thúc là Ar (khí hiếm).
d) Cách xác định số thứ tự của chu kì. Cho 1 ví dụ minh hoạ.
Số thứ tự của chu kì = số lớp electron.
- Ví dụ: nguyên tử C có cấu hình electron nguyên tử là 1s22s22p2, có 2 lớp e nên thuộc chu kì 2.
Phiếu màu vàng – Tìm hiểu về nhóm nguyên tố.
a) Tìm hiểu SGK cho biết nhóm nguyên tố là gì? Bảng tuần hoàn các NTHH
có bao nhiêu nhóm nguyên tố? Nêu cụ thể.
- Là tập hợp các nguyên tố mà nguyên tử của chúng có cấu hình e tương tự nhau do
đó có tính chất hoá học tương tự nhau và được xếp thành 1 cột.
- Bảng tuần hoàn các NTHH có 16 nhóm được chia thành nhóm A (8 cột) và nhóm B (10 cột).
- 8 nhóm A, kí hiệu từ IA đến VIIIA; 8 nhóm B, kí hiệu từ IIIB VIIIB.
b) Các nguyên tố nhóm A và B được cấu tạo từ các nguyên tố nào? Xác định
nguyên tố Na, Fe thuộc nhóm nguyên tố nào?
- Nhóm A: gồm các nguyên tố s, p.
- Nhóm B: gồm các nguyên tố d, f.
+ Na (Z = 11): 1s22s 22p 6 3s1, nguyên tử Na có e cuối cùng điền vào phân lớp s nên
Na là nguyên tố s nguyên tố Na thuộc nhóm A.
+ Fe (Z = 26): [Ar]3d64s2, nguyên tử Fe có e cuối cùng điền vào phân lớp d nên Fe là
nguyên tố d nguyên tố Fe thuộc nhóm B.
c) Để xác định thứ tự của nhóm cần dựa vào đặc điểm nào? - Dựa vào số e hóa trị.
d) Trình bày cách xác định số thứ tự nhóm A và nhóm B. Xác định nguyên tố
Na và Fe thuộc nhóm nguyên tố nào?
- Số thứ tự của nhóm A = Số e hóa trị = số e lớp ngoài cùng.
- Số thứ tự của nhóm B = Số e hóa trị.
+ Na (Z = 11): 1s22s 22p 63s1, nguyên tử Na có 1e hóa trị và là nguyên tố s nguyên tố Na thuộc nhóm IA.
+ Fe (Z = 26): [Ar]3d64s2, nguyên tử Fe có 8e hóa trị và là nguyên tố d nguyên tố Fe thuộc nhóm VIIB.
Nhiệm vụ học tập của “Nhóm mảnh ghép”: PHT số 2.
Phiếu học tập số 2 – Cấu tạo của bảng HTTH các NTHH
Vấn đề 1. Ô nguyên tố
a) Ô nguyên tố là: Mỗi NTHH được xếp vào một ô trong bảng tuần hoàn gọi là ô nguyên tố.
b) Số thứ tự của ô nguyên tố đúng bằng số hiệu nguyên tử của nguyên tố đó.
STT ô = số hiệu nguyên tử = số đơn vị ĐTHN = số p = số e
- Ví dụ: nguyên tố Clo có số hiệu nguyên tử là 17 nên sẽ ở ô nguyên tố số 17.
c) Cho nguyên tố hóa học sau, hãy điền các thông tin còn thiếu của NTHH đó vào chỗ trống. Vấn đề 2. Chu kì
a) Chu kì: là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp e, được xếp theo chiều
ĐTHN nguyên tử tăng dần.
b) Bảng HTTH có 7 chu kì được đánh số từ 1 đến 7.
- Chu kì 1, 2, 3 được gọi là chu kì nhỏ, mỗi chu kì có 8 nguyên tố (trừ chu kì 1 chỉ có 2 nguyên tố)
- Chu kì 4, 5, 6 được gọi là chu kì lớn, chu kì 4,5 mỗi chu kì có 18 nguyên tố; chu kì 6 có 32 nguyên
tố; chu kì 7 chưa hoàn thành.
c) Đặc điểm của chu kì. Lấy ví dụ minh hoạ.
Các nguyên tố trong cùng chu kì có số lớp electron bằng nhau và bằng STT của chu kì.
- Điện tích hạt nhân tăng dần theo chiều từ trái sang phải.
- Mở đầu chu kì là kim loại kiềm, cuối chu kì là khí hiếm.
- Ví dụ: chu kì 3 (từ Na đến Ar),
+ Trong cấu hình electron nguyên tử đều có 3 lớp electron.
+ Điện tích hạt nhân tăng dần từ 11+ đến 18+.
+ Nguyên tố đầu tiên là kim loại kiềm Na, nguyên tố kết thúc là Ar (khí hiếm).
d) Số thứ tự của chu kì = số lớp electron.
- Ví dụ: nguyên tử C có cấu hình electron nguyên tử là 1s22s22p2, có 2 lớp e nên thuộc chu kì 2.
Vấn đề 3. Nhóm nguyên tố
a) Nhóm nguyên tố là: là tập hợp các nguyên tố mà nguyên tử của chúng có cấu hình e tương tự
nhau do đó có tính chất hoá học tương tự nhau và được xếp thành 1 cột.
- Bảng tuần hoàn có 16 nhóm được chia thành nhóm A (8 cột) và nhóm B (10 cột).
- 8 nhóm A, kí hiệu từ IA đến VIIIA, 8 nhóm B, kí hiệu từ IIIB VIIIB.
b) Nhóm A: gồm các nguyên tố s, p; Nhóm B: gồm các nguyên tố d, f.
+ Na (Z = 11): 1s22s 22p 6 3s1, nguyên tử Na có e cuối cùng điền vào phân lớp s nên Na là nguyên tố
s nguyên tố Na thuộc nhóm A.
+ Fe (Z = 26): [Ar]3d64s2, nguyên tử Fe có e cuối cùng điền vào phân lớp d nên Fe là nguyên tố d
nguyên tố Fe thuộc nhóm B.
c) Để xác định thứ tự của nhóm cần dựa vào đặc điểm nào? - Dựa vào số e hóa trị
d) Trình bày cách xác định số thứ tự nhóm A và nhóm B.
- Số thứ tự của nhóm A = Số e hóa trị = số e lớp ngoài cùng.
- Số thứ tự của nhóm B = Số e hóa trị.
+ Na (Z = 11): 1s22s 22p 63s1, nguyên tử Na có 1e hóa trị và là nguyên tố s nguyên tố Na thuộc nhóm IA.
+ Fe (Z = 26): [Ar]3d64s2, nguyên tử Fe có 8e hóa trị và là nguyên tố d nguyên tố Fe thuộc nhóm VIIIB.
4. Tổ chức thực hiện
Phương pháp dạy học hợp tác theo nhóm, kĩ thuật mảnh ghép.
Phương pháp đánh giá: Phương pháp quan sát, vấn đáp.
Công cụ đánh giá: câu hỏi và đáp án.
Bước 1: Chuyển giao nhiệm vụ học tập
GV chia lớp thành 3 loại nhóm, đặt tên là trắng, đỏ, vàng gọi là các “Nhóm chuyên sâu”, trong
mỗi nhóm đánh số thứ tự các thành viên từ 1 đến hết (tùy theo số HS mà có thể chia thành 9 nhóm
hoặc 12 nhóm, số HS bằng nhau khoảng từ 4 – 5 HS/nhóm.
GV giao nhiệm vụ và hướng dẫn hoạt động “Nhóm chuyên sâu”:
+ Nhóm màu trắng: Tìm hiểu về ô nguyên tố.
+ Nhóm màu đỏ: Tìm hiểu về chu kì.
+ Nhóm màu vàng: Tìm hiểu về nhóm nguyên tố.
HS mỗi nhóm gọi là HS chuyên sâu. Mỗi “Nhóm chuyên sâu” làm việc trong thời gian 15 phút.
Sau khi các “Nhóm chuyên sâu” hoạt động xong, GV hướng dẫn HS thành lập các “Nhóm
mảnh ghép”: Cứ 3 HS chuyên sâu có cùng số thứ tự thành viên trong các nhóm trắng, đỏ, vàng hợp
lại thành một “Nhóm mảnh ghép”.
GV nêu nhiệm vụ của “Nhóm mảnh ghép”:
+ Các HS chuyên sâu lần lượt sẽ trình bày về nội dung mà mình đã nghiên cứu. Sau đó các
“Nhóm mảnh ghép” thảo luận về để rút ra cấu tạo của bảng tuần hoàn các NTHH.
+ Các nhóm mảnh ghép tổng kết về cấu tạo của bảng tuần hoàn các NTHH và hoàn thành PHT số 2.
+ Các nhóm mảnh ghép làm việc trong thời gian 15 phút.
Nhiệm vụ học tập của “Nhóm chuyên sâu”:
Phiếu màu trắng – Tìm hiểu về ô nguyên tố
a) Cho biết ô nguyên tố là gì?
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
b) Sử dụng bảng tuần hoàn các NTHH, hãy cho biết ô nguyên tố chứa đựng những thông tin nào
về nguyên tố hóa học? Nêu ví dụ cho một nguyên tố hóa học bất kì.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
c) Cách xác định STT ô nguyên tố như thế nào? Cho ví dụ.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
d) Cho nguyên tố hóa học sau, hãy điền các thông tin còn thiếu của NTHH đó vào chỗ trống.
Phiếu màu đỏ – Tìm hiểu về chu kì
a) Quan sát bảng tuần hoàn các NTHH cho biết thế nào là chu kì?
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
b) Bảng tuần hoàn các NTHH gồm có bao nhiêu chu kì? Số lượng chu kì nhỏ, số lượng chu kì
lớn? Số lượng nguyên tố có trong mỗi chu kì.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
c) Kết hợp tìm hiểu SGK, hãy cho biết đặc điểm của chu kì là gì (chú ý về số lớp electron, điện
tích hạt nhân, nguyên tố đầu tiên và nguyên tố kết thúc)? Lấy ví dụ minh hoạ.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
d) Cách xác định số thứ tự của chu kì.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Phiếu màu vàng – Tìm hiểu về nhóm nguyên tố.
a) Tìm hiểu SGK cho biết nhóm nguyên tố là gì? Bảng tuần hoàn các NTHH có bao
nhiêu nhóm nguyên tố? Nêu cụ thể
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
b) Các nguyên tố nhóm A và B được cấu tạo từ các nguyên tố nào? Xác định nguyên
tố Na, Fe thuộc nhóm nguyên tố nào?
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
c) Để xác định thứ tự của nhóm cần dựa vào đặc điểm nào?
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
d) Trình bày cách xác định số thứ tự nhóm A và nhóm B. Xác định nguyên tố Na
và Fe thuộc nhóm nguyên tố nào?
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Nhiệm vụ học tập của “Nhóm mảnh ghép”: PHT số 2.
Bước 2: Thực hiện nhiệm vụ học tập
HS hoạt động theo“Nhóm chuyên sâu” và “Nhóm mảnh ghép”. GV đi đến các nhóm để giám
sát hoạt động các nhóm, hướng dẫn HS hoạt động nhóm, giám sát thời gian và điều khiển HS chuyển nhóm.
Bước 3: Báo cáo
GV cho 3 nhóm nhanh nhất treo sản phẩm là nội dung các câu trả lời của PHT số 2 lên bảng/
khu vực nhóm, gọi đại diện của các nhóm lên trình bày.
Một số HS được mời trình bày câu trả lời theo quan điểm của nhóm.
Bước 4: Tổng kết đánh giá, định hướng
GV tổng kết, nhận xét, rút kinh nghiệm cho phần trình bày của nhóm.
Trên cơ sở kết nối các ý đúng từ HS và đáp án của câu hỏi, GV thực hiện 02 nhiệm vụ:
+ Nhiệm vụ 1: GV chiếu nội dung cấu tạo bảng tuần hoàn các NTHH, yêu cầu HS ghi nhận vào phiếu ghi bài.
+ Nhiệm vụ 2: GV định hướng cho HS tổng kết lại cấu tạo của bảng tuần hoàn các NTHH gồm ô
nguyên tố, chu kì, nhóm nguyên tố. Vị trí của một NTHH trong bảng tuần hoàn các NTHH.
Hoạt động 2.3. TÌM HIỂU MỐI LIÊN HỆ GIỮA VỊ TRÍ VÀ CẤU TẠO CỦANGUYÊN
TỬ TRONG BẢNG TUẦN HOÀN CÁC NTHH (10 phút) 1. Mục tiêu
Phân tích được mối liên hệ giữa cấu hình và vị trí của nguyên tố trong bảng tuần hoàn các NTHH.
Vận dụng cấu hình e, nêu được vị trí của nguyên tố trong bảng tuần hoàn các NTHH và ngược lại
HS tiếp nhận kiến thức chủ động, tích cực, hiệu quả.
2. Nội dung hoạt động
GV lưu ý cho HS về vị trí của 1 nguyên tố trong bảng tuần hoàn các NTHH gồm 3 yếu tố (ô, chu kì, nhóm).
Từ cấu hình electron nguyên tử của một nguyên tố, GV đặt vấn đề với HS về việc xác định vị trí
của nguyên tố đó trong bảng tuần hoàn các NTHH. 3. Sản phẩm
Đáp án của các câu hỏi do GV đặt ra:
Câu 1: Vị trí của một NTHH bất kì trong bảng tuần hoàn gồm những yếu tố nào?
Gồm ô nguyên tố, chu kì và nhóm nguyên tố.
Câu 2: Từ cấu hình electron nguyên tử của 1 nguyên tố bất kì có thể xác định được vị trí nguyên
tố đó trong bảng tuần hoàn các NTHH như thế nào? Và ngược lại.
Từ số hiệu nguyên tử (Z), có thể viết cấu hình eletron của nguyên tố đó.
+ Dựa vào số Z tìm ra ô nguyên tố.
+ Dựa vào số lớp e tìm ra chu kì
+ Dựa vào số e hóa trị tìm ra nhóm
Và ngược lại cũng có thể dựa vào vị trí để viết cấu hình electron của 1 nguyên tố bất kì.
Phần trả lời nhiệm vụ học tập (NVHT) số 3 của HS:
Câu 1: Xác định vị trí của nguyên tố R (Z = 10) trong bảng tuần hoàn các NTHH.
Nguyên tố 10R có cấu hình electron nguyên tử là: 1s2 2s2 2p6
Nguyên tử R có Z = 10 nên ở ô số 10;
có 2 lớp e thuộc chu kì 2;
có 8e lớp ngoài cùng, là nguyên tố p thuộc nhóm VIIIA;
Vị trí của nguyên tố R trong bảng HTTH là ở ô số 10, chu kì 2, nhóm VIIIA.
Câu 2: Viết cấu hình electron nguyên tử của nguyên tố M biết M ở chu kì 3, nhóm VA và tìm tên
của nguyên tố M. (Gợi ý: từ cấu hình electron nguyên tử Z tên nguyên tố)
Nguyên tố M ở chu kì 3 nên có 3 lớp electron;
ở nhóm VA nên có 5e hóa trị và là nguyên tố s hoặc p.
M có cấu hình electron nguyên tử là: 1s2 2s2 2p63s2 3p3 Z = 15 M là nguyên tố Photpho.
4. Tổ chức thực hiện
Phương pháp dạy học đàm thoại gợi mở.
Phương pháp đánh giá: Phương pháp quan sát, vấn đáp.
Công cụ đánh giá: câu hỏi và câu trả lời.
Bước 1: Chuyển giao nhiệm vụ học tập
GV yêu cầu HS xem lại nội dung cấu tạo bảng tuần hoàn các NTHH, đặt lần lượt các câu hỏi:
Câu 1: Vị trí của một NTHH bất kì trong bảng HTTH gồm những yếu tố nào?
Câu 2: Từ cấu hình electron nguyên tử của 1 nguyên tố bất kì có thể xác định được vị trí nguyên
tố đó trong bảng HTTH như thế nào? Và ngược lại.
Yêu cầu HS hoàn thành NVHT số 3 trong phiếu ghi bài. Gồm 2 câu hỏi:
Câu 1: Xác định vị trí của nguyên tố R (Z = 10) trong bảng HTTH các NTHH.
Câu 2: Viết cấu hình electron nguyên tử của nguyên tố M biết M ở chu kì 3, nhóm VA và tìm tên
của nguyên tố M. (Gợi ý: từ cấu hình electron nguyên tử Z tên nguyên tố).
Bước 2: Thực hiện nhiệm vụ học tập
HS làm việc cá nhân, dựa vào SGK kết hợp với nội dung ghi bài để trả lời câu hỏi theo suy nghĩ của bản thân.
Bước 3: Báo cáo
GV động viên HS trả lời và ghi nhận nội dung trả lời của HS.
Một số HS được mời trình bày câu trả lời theo quan điểm cá nhân.
Bước 4: Tổng kết, đánh giá và định hướng
GV phân tích nhanh các câu trả lời của một số HS để từ đó có thể chọn, tổng hợp và kết nối các
ý đúng từ nhiều HS khác nhau.
Trên cơ sở kết nối các ý đúng từ nhiều HS và đáp án của câu hỏi, GV thực hiện 02 nhiệm vụ:
+ Nhiệm vụ 1: GV công bố đáp án chính xác.
+ Nhiệm vụ 2: Giúp HS nhận ra được nhiệm vụ học tập ở các hoạt động tiếp theo là luyện tập.
Hoạt động 3: CỦNG CỐ - LUYỆN TẬP (12 phút) 1. Mục tiêu
Vận dụng cấu hình electron nguyên tử, nêu được vị trí của nguyên tố trong bảng tuần hoàn các NTHH và ngược lại.
Vận dụng kiến thức, kĩ năng đã học để viết cấu hình electron nguyên tử khi đã biết vị trí của
nguyên tố trong bảng tuần hoàn các NTHH.
Vận dụng kiến thức, kĩ năng đã học để xác định vị trí của một NTHH trong bảng tuần hoàn các
NTHH thông qua số hiệu nguyên tử.
Phát triển năng lực tự chủ và tự học thông qua hoạt động tự hoàn thành nội dung củng cố.
Phát triển năng lực giao tiếp và hợp tác, năng lực giải quyết vấn đề thông qua hoạt động thảo
luận nhóm, chia sẻ câu trả lời với các HS còn lại trong nhóm.
Hoàn thành nhiệm vụ cá nhân đầy đủ và đúng thời gian.
2. Nội dung hoạt động
HS sử dụng phần tổng kết phiếu ghi bài để tổng kết lại bài học.
HS làm việc cá nhân hoàn thành nội dung Củng cố trong phiếu ghi bài.
GV nhận xét, chỉ ra những lỗi sai của HS và chuẩn hóa kiến thức. 3. Sản phẩm
Kết quả trả lời các câu hỏi/bài tập trong phiếu ghi bài. CỦNG CỐ
Câu 1. Trong bảng tuần hoàn, các nguyên tố được sắp xếp theo nguyên tắc nào?
A. Theo chiều tăng của điện tích hạt nhân
B. Các nguyên tố có cùng số lớp e trong nguyên tử được xếp thành một hàng
C. Các nguyên tố có cùng số e hoá trị trong nguyên tử được xếp thành một cột D. Cả A, B, C đều đúng.
Câu 2. Trong bảng tuần hoàn các nguyên tố, số chu kì nhỏ và chu kì lớn là A. 3 và 3 B. 4 và 4 C. 3 và 4 D. 4 và 3
Câu 3: Các nguyên tố có cùng đặc điểm nào sau đây thì xếp thành một hàng ngang?
A. Có cùng số electron hóa trị.
B. Có cùng số lớp electron.
C. Có cùng khối lượng nguyên tử.
D. Có cùng tính chất hóa học.
Câu 4: Nhóm A bao gồm các nguyên tố: A. Nguyên tố s B. Nguyên tố p
C. Nguyên tố d và nguyên tố f.
D. Nguyên tố s và nguyên tố p
Câu 5: Nguyên tử của nguyên tố X có điện tích hạt nhân là 18+. Nguyên tố X ở ô số A. 20. B. 17. C. 19. D. 18.
Câu 6: Nguyên tố M thuộc chu kì 3, số electron hoá trị của M là 3. M là: A. 13Al B. 15P C. 17Cl D. 25Co
Câu 7: Vị trí của nguyên tử nguyên tố X (Z=15) trong bảng tuần hoàn là A. Chu kì 3, nhóm VB B. Chu kì 3, nhóm IIIB C. Chu kì 3, nhóm IIIA D. Chu kì 3, nhóm VA
Câu 8: Viết cấu hình e đầy đủ của các nguyên tố sau: a/ 1s22s22p63s23p64s2. b/ 1s22s22p63s23p4.
4. Tổ chức thực hiện
Phương pháp dạy học: Sử dụng bài tập hóa học.
Phương pháp đánh giá: Phương pháp hỏi – đáp.
Công cụ đánh giá: câu hỏi và đáp án.
Bước 1: Chuyển giao nhiệm vụ học tập
GV tóm tắt lại kiến thức và những điểm quan trọng của bài học.
HS lưu ý phần tổng kết trong phiếu ghi bài.
GV đưa ra nhiệm vụ học tập gồm các bài tập vận dụng ở mục Củng cố.
Bước 2: Thực hiện nhiệm vụ học tập
Ở hoạt động này GV cho HS hoạt động cá nhân là chủ yếu, có thể cho HS hoạt động cặp đôi để
chia sẻ kết quả giải quyết các câu hỏi trong tài liệu học tập.
HS thực hiện nhiệm vụ trong vòng 7 phút.
Bước 3: Báo cáo
Hoạt động chung cả lớp: GV mời một số học sinh trình bày kết quả, các HS khác góp ý bổ sung
Bước 4: Tổng kết đánh giá, định hướng
GV công bố đáp án cho các bài tập, cho HS tự đối chiếu bài làm của mình với đáp án.
GV nhận xét và đánh giá hoạt động. Yêu cầu HS hoàn thành NVHT số 1 và 2 ở nhà.
Hoạt động 4: VẬN DỤNG, TÌM TÒI MỞ RỘNG (8 phút) 1. Mục tiêu
Góp phần phát triển năng lực tìm tòi, khám phá, tra cứu, xử lý thông tin để thiết kế bảng tuần hoàn các NTHH.
Phát triển khả năng giải quyết vấn đề và sáng tạo của HS thông qua việc thiết kế bảng tuần hoàn các NTHH.
2. Nội dung hoạt động
HS lên ý tưởng thực hiện bảng tuần hoàn các NTHH. HS thực hiện ý tưởng tại nhà.
HS nộp sản phẩm vào tuần sau. 3. Sản phẩm
Ý tưởng thiết kế bảng tuần hoàn các NTHH.
Sản phẩm bảng tuần hoàn các NTHH (dự kiến):
4. Tổ chức thực hiện
Phương pháp dạy học đàm thoại gợi mở.
Phương pháp đánh giá: Phương pháp quan sát, vấn đáp.
Công cụ đánh giá: bảng tiêu chí đánh giá.
Bước 1: Chuyển giao nhiệm vụ học tập
GV yêu cầu HS quan sát bảng tuần hoàn các NTHH, hoặc tìm hiểu qua tài liệu, internet và đặt
vấn đề về việc thiết kế bảng HTTH.
Bước 2: Thực hiện nhiệm vụ học tập
HS làm việc theo tổ, dựa vào SGK kết hợp với việc tham khảo tài liệu từ internet để đưa ra được
ý tưởng thiết kế bảng tuần hoàn các NTHH.
Bước 3: Báo cáo
GV động viên HS trình bày ý tưởng và ghi nhận nội dung trả lời của HS.
GV nhận xét, góp ý, tư vấn về các ý tưởng của HS.
GV yêu cầu HS chốt ý tưởng và tiến hành thực tiện tại nhà.
Bước 4: Tổng kết, đánh giá và định hướng
GV quan sát và đánh giá HS qua hoạt động nhóm để lên ý tưởng thiết kế bảng tuần hoàn các
NTHH. GV có thể cho HS báo cáo kết quả HĐ vận dụng và tìm tòi mở rộng vào đầu giờ của buổi học
kế tiếp, GV cần kịp thời động viên, khích lệ HS.
IV. HỒ SƠ DẠY HỌC
A. NỘI DUNG DẠY HỌC CỐT LÕI
Nguyên tắc sắp xếp các nguyên tố trong bảng hệ thống tuần hoàn các nguyên tố hóa học.
Cấu tạo bảng hệ thống tuần hoàn các nguyên tố hóa học: ô nguyên tố, chu kì, nhóm nguyên tố. CÁC HỒ SƠ KHÁC PHIẾU GHI BÀI PHIẾU HỌC TẬP
Phiếu học tập số 1 – Nguyên tắc sắp xếp các NTHH trong bảng HTTH
Cho bảng HTTH sau (chỉ gồm 20 NTHH đầu tiên)
Câu 1. Quan sát bảng HTTH các NTHH đã cho bên trên, chú ý điện tích hạt nhân nguyên tử của
các nguyên tố nguyên tắc sắp xếp thứ nhất.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Câu 2. Viết cấu hình electron của các nguyên tử sau: 1H, 3Li, 4Be, 5B, 11Na, 12Mg, 13Al, 20Ca
a. Dựa vào cấu hình electron nguyên tử của các nguyên tố Li, Be, B, Na, Mg, Al kết hợp với quan
sát bảng HTTH các NTHH nguyên tắc thứ 2.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
b. Dựa vào cấu hình electron nguyên tử của các nguyên tố H, Li, Na, Be, Mg, Ca xác định electron
hóa trị. Kết hợp với quan sát bảng HTTH các NTHH nguyên tắc thứ 3.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
* Số e hóa trị = số e lớp ngoài cùng + Số e ở phân lớp sát lớp ngoài cùng chưa bão hòa (nếu có).
Phiếu học tập số 2 – Cấu tạo của bảng HTTH các NTHH
Vấn đề 1. Ô nguyên tố
a) Ô nguyên tố là: . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
b) Cách xác định STT ô nguyên tố như thế nào? Lấy ví dụ minh họa.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
c) Cho nguyên tố hóa học sau, hãy điền các thông tin còn thiếu của NTHH đó vào chỗ trống. Vấn đề 2. Chu kì
a) Chu kì là: . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
b) Bảng HTTH gồm có. . . . . . . . . .chu kì.
- Chu kì . . . . . . . là chu kì nhỏ, mỗi chu kì có . . . . . nguyên tố (trừ chu kì . . . . có. . . . . .nguyên tố).
- Chu kì . . . . . . . . . . . là chu kì lớn, chu kì 4, 5; mỗi chu kì có . . . . . . nguyên tố; chu kì 6 có . . . . . .
nguyên tố; chu kì. . . . . chưa hoàn thành.
c) Kết hợp tìm hiểu SGK, hãy cho biết đặc điểm của chu kì là gì (chú ý về số lớp electron, điện
tích hạt nhân, nguyên tố đầu tiên và nguyên tố kết thúc)? Lấy ví dụ minh hoạ.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
d) Cách xác định số thứ tự của chu kì. Lấy ví dụ minh họa.
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Vấn đề 3. Nhóm nguyên tố
a) Nhóm nguyên tố là: . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
- Bảng HTTH các NTHH có . . . . . . nhóm, được chia thành . . . . . . . . . . . . . và. . . . . . . . . . . . . . . .
- . . . . . . nhóm A được kí hiệu từ . . . . . . . . . . . . . ., . . . . . . nhóm A được kí hiệu từ . . . . . . . . . . . . . .
b) Các nguyên tố nhóm A và B được cấu tạo từ các nguyên tố nào? Xác định nguyên tố Na, Fe
thuộc nhóm nguyên tố nào?
- Nhóm . . . . . gồm các nguyên tố . . . . . . . . . . . . , nhóm . . . . . gồm các nguyên tố. . . . . . . . . . . . .
+ Na (Z = 11): . . . . . . . . . . . . , nguyên tử Na có e cuối cùng điền vào . . . . . . . . . . . . nên Na là
. . . . . . . . . . . . . . . . . . . . . nguyên tố Na thuộc nhóm . . . . . . . . . . . . .
+ Fe (Z = 26): . . . . . . . . . . . . . . . . . ., nguyên tử Fe có e cuối cùng điền vào. . . . . . . . . . . . . nên Fe
là . . . . . . . . . . . . . . . . . . . nguyên tố Fe thuộc nhóm . . . . . . . . . . . . .
c) Để xác định thứ tự của nhóm cần dựa . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
d) Trình bày cách xác định số thứ tự nhóm A và nhóm B.
- Số thứ tự của nhóm A = . . . . . . . . . . . . . . . . . . . . . . . =. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
- Số thứ tự của nhóm B = . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . - Ví dụ:
+ Na (Z = 11): 1s22s 22p 63s1, nguyên tử Na có . . . . . hóa trị và là nguyên tố. . . . . . nguyên tố Na thuộc nhóm . . . . .
+ Fe (Z = 26): [Ar]3d64s2, nguyên tử Fe có 8e hóa trị và là nguyên tố. . . . . . nguyên tố Fe thuộc nhóm . . . . .
BẢNG KIỂM QUAN SÁT HOẠT ĐỘNG NHÓM
Nhóm: . . . . . . . . . . . . . Tên thành viên: . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . STT Tiêu chí Có Không 1
Phân công nhiệm vụ trong nhóm hợp lí. 2
Các thành viên trong nhóm đều tích cực hoàn thành nhiệm vụ của mình. 3
Nhóm có thảo luận để thống nhất được kết quả và ghi vào phiếu ghi bài. 4
Nhóm báo cáo đầy đủ nội dung của câu hỏi. 5
Nhóm trao đổi tích cực ý kiến với các nhóm khác.
BẢNG TIÊU CHÍ ĐÁNH GIÁ SẢN PHẨM BẢNG TUẦN HOÀN Tiêu chí Mức độ Điểm đánh giá 20 15 10 5
Có đầy đủ các Có 50 - 70% nội Có 20 - 40% nội Có dưới 20% nội
nội dung yêu dung yêu cầu. dung yêu cầu. dung yêu cầu. cầu. 20 15 10 5
Nội dung chính Nội dung chính Nội dung khá Nội dung chưa
xác, khoa học, xác, chi tiết, nhưng chính xác, chưa chính xác, chưa Nội dung chi tiết. chưa khoa học, khoa học, chưa khoa học. chi tiết. 20 15 10 5
Nội dung có 50 - Nội dung có 20 -
Nội dung có dưới Nội dung không
70% liên quan 40% liên quan thực 20% liên quan liên quan thực thực tiễn. tiễn. thực tiễn. tiễn. 20 15 10 5
Bố cục cân đối, Bố cục cân đối, Bố cục khá cân Bố cục chưa cân rõ ràng. chưa rõ ràng.
đối, chưa rõ ràng. đối, chưa rõ ràng. 10 8 6 4
Màu sắc đẹp, hài Màu sắc đẹp, hài
Màu sắc chưa hài Màu sắc không hòa, thiết kế sáng hòa. hòa. hài hòa. Hình tạo . thức 10 7 4 1
Có sử dụng 50 - Có sử dụng 20 -
Có sử dụng dưới Không sử dụng
70% hình ảnh 40% hình ảnh thực 20% hình ảnh hình ảnh thực tế thực tế về ứng
tế về ứng dụng của thực tế về ứng về ứng dụng của dụng của các các NTHH dụng của các các NTHH NTHH NTHH Tổng cộng: TRƯỜNG THPT TRẦN PHÚ TỔ HÓA HỌC KHỐI 10 CHƯƠNG 2- BÀI 6
XU HƯỚNG BIẾN ĐỔI
MỘT SỐ TÍNH CHẤT CỦA NGUYÊN TỬ CÁC NGUYÊN TỐ, THÀNH PHẦN VÀ MỘT
SỐ TÍNH CHẤT CỦA HỢP CHẤT TRONG MỘT CHU KỲ VÀ NHÓM
Thời lượng: 2 tiết I. MỤC TIÊU DẠY HỌC:
Sau bài học này HS có thể: YÊU CẦU CẦN ĐẠT
Nhận thức hóa học
1. Giải thích được xu hướng biến đổi bán kính nguyên tử NĂNG LỰC
trong một chu kì, trong một nhóm (nhóm A) (dựa theo lực HÓA HỌC
hút tĩnh điện của hạt nhân với electron ngoài cùng và dựa
theo số lớp electron tăng trong một nhóm theo chiều từ trên xuống dưới).
2. Nhận xét và giải thích được xu hướng biến đổi độ
âm điện và tính kim loại, phi kim của nguyên tử các
nguyên tố trong một chu kì, trong một nhóm (nhóm A).
3. Nhận xét được xu hướng biến đổi thành phần và
tính chất acid/base của các oxide và các hydroxide
theo chu kì. Viết được phương trình hoá học minh hoạ.
Tìm hiểu thế giới tự
4. Quan sát hình ảnh, xử lý số liệu, đề xuất, biểu đạt
nhiên dưới góc độ được vấn đề. hóa học
Vận dụng kiến thức, 5. Vận dụng các kiến thức đã học để tìm hiểu tính chất
kĩ năng đã học
của các nguyên tố C,H,O,N tạo nên các hợp chất
thường gặp trong đời sống.
Giải quyết vấn đề và
6. Năng lực giải quyết vấn đề và sáng tạo NĂNG LỰC sáng tạo CHUNG
Giao tiếp và hợp tác
7. Năng lực giao tiếp và hợp tác
Năng lực tự chủ và
8. Năng lực tự học tự học PHẨM CHẤT Trung thực 9. Trung thực Trách nhiệm 10. Trách nhiệm.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
- Thiết bị dạy học
+ Thiết bị công nghệ, phần mềm: PPT
+ Thiết bị dạy học khác: Hóa chất Dụng cụ NaOH, PP, H2SO4, AlCl3, HCl Ống nghiệm: 4 Ống hút: 5 Kẹp ống nghiệm: 2 Cốc thủy tinh
Bảng nhóm ( giấy A3 hoặc giấy lịch tháng) Nam châm.
Sơ đồ phân nhóm, bảng tên nhóm - Học liệu
+ Học liệu số: file SGK + Học liệu khác:
III. TIẾN TRÌNH DẠY HỌC:
A. BẢNG TÓM TẮT CÁC HOẠT ĐỘNG: Hoạt Mục tiêu Nội dung dạy học PPDH- động trọng tâm KTDH Đánh giá học Phương Công cụ pháp (thời gian) HĐ 1: 6,7,8,9,10
Mối liên hệ giữa vị Nêu vấn đề Phương pháp Câu hỏi, Khởi trí- tính chất Hoạt động hỏi đáp bảng động- nhóm PP đánh giá kiểm kết nối qua sản phẩm học tập. ( 5 phút) HĐ 2,3,4: 1,6,7,8,9,10 Bán kính nguyên tử Nêu vấn đề Phương pháp Câu hỏi, ( 10 phút) Hoạt động hỏi đáp bảng nhóm PP đánh giá kiểm qua sản phẩm học tập. HĐ 5,6: 2,6,7,8,9,10 Độ âm điện Nêu vấn đề Phương pháp Câu hỏi, ( 10 phút) Hoạt động hỏi đáp bảng nhóm PP đánh giá kiểm qua sản phẩm học tập. HĐ 7,8: 2,6,7,8,9,10 Tính kim loại- Tính Nêu vấn đề Phương pháp Câu hỏi, (15 phút) phi kim Hoạt động hỏi đáp bảng nhóm PP đánh giá kiểm qua sản phẩm học tập. HĐ 9,10: 3,6,7,8,9,10 Tính acid-base của Nêu vấn đề Phương pháp Câu hỏi, oxide và hydroxide Hoạt động hỏi đáp bảng nhóm PP đánh giá kiểm qua sản phẩm ( 30 phút) học tập. HĐ 11: 4,6,7,8,9,10 ASPARTAME Nêu vấn đề Phương pháp Câu hỏi, Vân dụng Hoạt động hỏi đáp bảng nhóm PP đánh giá kiểm qua sản phẩm ( 5 phút) học tập. HĐ 12: 1,2,3,4,6,7,8,9,10 TRÒ CHƠI Nêu vấn đề Phương pháp Câu hỏi, Luyện tập QUIZIZZ hỏi đáp ( 5 phút) B. CÁC HOẠT ĐỘNG:
HĐ 1. Hoạt động khởi động-kết nối
MỐI LIÊN HỆ GIỮA VỊ TRÍ- TÍNH CHẤT Thời gian: 5 phút
1. Mục tiêu: 6,7,8,9,10
2. Tiến trình tổ chức hoạt động: a. Giao nhiệm vụ:
HS hoàn thành PHT1 theo nhóm
Nội dung PHT1: Viết cấu hình electron nguyên tử của nguyên tố, xác định vị trí các nguyên tố trong bảng tuần hoàn. (a) Li(Z=3); Na(Z=11); K(Z=19) (b) P(Z=15); S(Z=16); Cl(Z=17)
Nhận xét về đặc điểm e ngoài cùng cũng như vị trí các nguyên tố ở câu a,b.
Xác định tính chất của các nguyên tố ở câu a,b
Theo em những tính chất này có biến đổi không?
b. Thực hiện nhiệm vụ:
HS nhận PHT 1 và làm việc theo nhóm, trình bày nội dung vào bảng nhóm
c. Báo cáo- thảo luận:
Mỗi nhóm sẽ cử đại diện trình bày một ý theo yêu cầu của GV. Đồng thời các HS khác có thể góp ý thêm.
d. Phương pháp công cụ đánh giá và kết luận
Công cụ đánh giá: câu hỏi tự luận, bảng kiểm đánh giá kỹ năng hợp tác
GV dẫn: Trong một chu kỳ cũng như trong một nhóm của bảng tuần hoàn, một số tính chất của đơn
chất và hợp chất của các nguyên tố sẽ biến đổi theo qui luật nhất định phụ thuộc vào vị trí của các
nguyên tố đó trong bảng tuần hoàn.
e.Sản phẩm học sinh cần đạt: Li(Z=3) 1s22s1
STT 3 – Chu kỳ 2 – Nhóm IA Na(Z=11) 1s22s22p63s1
STT 11 – Chu kỳ 3 – Nhóm IA K(Z=19) 1s22s22p63s23p64s1
STT 19 – Chu kỳ 4 – Nhóm IA
Nguyên tử các nguyên tố có 1 e ngoài cùng, cùng thuộc nhóm IA và đều là kim loại.
Tính kim loại sẽ biến đổi từ Li đến K P(Z=15) 1s22s22p63s23p3
STT 15 – Chu kỳ 3 – Nhóm VA S(Z=16) 1s22s22p63s23p4
STT 16 – Chu kỳ 3 – Nhóm VIA Cl(Z=17) 1s22s22p63s23p5
STT 17 – Chu kỳ 3 – Nhóm VIIA
Nguyên tử các nguyên tố có 5,6,7 e ngoài cùng, đều thuộc chu kỳ 3 và đều là phi kim
Tính phi kim sẽ biến đổi từ P đến Cl HĐ 2. BÁN KÍNH NGUYÊN TỬ Thời gian: 3 phút
1. Mục tiêu: 1,6,8,9,10
2. Tiến trình tổ chức hoạt động: a. Giao nhiệm vụ:
HS hoàn thành PHT2 theo cá nhân
Nội dung PHT2: Một hạt nhân có điện tích +Z sẽ hút electron bằng một lực có độ lớn F= a Z2r a: hằng số;
r là khoảng cách từ hạt nhân tới electron Hãy cho biết
(a) Điện tích hạt nhân càng lớn thì lực hút e càng mạnh hay càng yếu?
(b) Khoảng cách giữa e và hạt nhân càng lớn thì e bị hạt nhân hút càng mạnh hay càng yếu?
b. Thực hiện nhiệm vụ:
HS suy nghĩ và có câu trả lời
c. Báo cáo- thảo luận: HS trình bày
d. Phương pháp công cụ đánh giá và kết luận
Công cụ đánh giá: câu hỏi tự luận
Đánh giá cá nhân dựa trên kết quả HS trình bày.
GV dẫn: Bán kính nguyên tử là khoảng cách từ hạt nhân đến electron ở lớp vỏ ngoài cùng.
e.Sản phẩm học sinh cần đạt:
(a) Điện tích hạt nhân càng lớn thì lực hút e càng mạnh
(b) Khoảng cách giữa e và hạt nhân càng lớn thì e bị hạt nhân hút càng yếu HĐ 3.
BÁN KÍNH NGUYÊN TỬ (tt) Thời gian: 5 phút
1. Mục tiêu: 1, 6,7,8,9,10
2. Tiến trình tổ chức hoạt động: a. Giao nhiệm vụ:
HS hoàn thành PHT3 theo nhóm Nội dung PHT3:
(a) Trong cùng 1 chu kỳ, khi đi từ trái sang phải, bán kính nguyên tử biến đổi thế nào? Giải thích.
(b) Trong một nhóm A, theo chiều tăng ĐTHN, bán kính nguyên tử biến đổi như thế nào? Giải thích.
b. Thực hiện nhiệm vụ:
HS nhận PHT 3 và làm việc theo nhóm, trình bày nội dung vào bảng nhóm
c. Báo cáo- thảo luận:
Mỗi nhóm sẽ cử đại diện trình bày theo yêu cầu của GV. Đồng thời các HS khác có thể góp ý thêm.
d. Phương pháp công cụ đánh giá và kết luận
Công cụ đánh giá: câu hỏi tự luận, bảng kiểm đánh giá kỹ năng hợp tác.
e.Sản phẩm học sinh cần đạt:
(a) Trong cùng 1 chu kỳ, khi đi từ trái sang phải, bán kính nguyên tử các nguyên tố giảm dần
Giải thích: Trong cùng 1 chu kỳ, nguyên tử các nguyên tố có cùng số lớp electron. Khi đi từ trái
sang phải ĐTHN tăng lực hút giữa hạt nhân với các e lớp ngoài cùng tăng bán kính nguyên tử giảm
(b) Trong một nhóm A, theo chiều tăng ĐTHN, bán kính nguyên tử tăng.
Giải thích: Trong một nhóm A, theo chiều từ trên xuống dưới, số lớp electron tăng dần nên bán kính nguyên tử tăng. HĐ 4.
BÁN KÍNH NGUYÊN TỬ (tt) Thời gian: 2 phút 1. Mục tiêu: 1,6,8,9,10
2. Tiến trình tổ chức hoạt động: a. Giao nhiệm vụ:
HS hoàn thành PHT4 theo cá nhân Nội dung PHT4:
Dựa vào xu hướng biến đổi bán kính nguyên tử của các nguyên tố trong bảng tuần hoàn, em hãy sắp
xếp các nguyên tố sau đây theo chiều tăng dần bán kính nguyên tử
Li , N , O , Na , K 3 7 8 11 19
b. Thực hiện nhiệm vụ:
HS suy nghĩ và có câu trả lời
c. Báo cáo- thảo luận: HS trình bày
d. Phương pháp công cụ đánh giá và kết luận
Công cụ đánh giá: câu hỏi tự luận.
e.Sản phẩm học sinh cần đạt:
Chiều tăng dần bán kính nguyên tử O< N< Li< Na< K HĐ 5. ĐỘ ÂM ĐIỆN Thời gian: 7 phút
1. Mục tiêu: 2,6,7,8,9,10
2. Tiến trình tổ chức hoạt động: a. Giao nhiệm vụ: GV dẫn:
Mô hình liên kết phân tử H2
Trong NH3, cặp e liên kết lệch về phía nguyên tử N do khả năng hút e của N mạnh hơn H => ĐÂĐ N > H
Khái niệm: Độ âm điện của một nguyên tử đặc trưng cho khả năng hút e của nguyên tử đó khi tạo thành liên kết hóa học.
HS hoàn thành PHT5 theo nhóm Nội dung PHT5:
Dựa vào khái niệm độ âm điện, giá trị độ âm điện của nguyên tử các nguyên tố phụ thuộc vào yếu tố nào?
Từ số liệu trong bảng 6.1, nhận xét sự biến đổi giá trị độ âm điện của nguyên tử các nguyên tố trong
một nhóm và trong một chu kỳ. Giải thích
b. Thực hiện nhiệm vụ:
HS nhận PHT 5 và làm việc theo nhóm, trình bày nội dung vào bảng nhóm
c. Báo cáo- thảo luận:
Mỗi nhóm sẽ cử đại diện trình bày theo yêu cầu của GV. Đồng thời các HS khác có thể góp ý thêm.
d. Phương pháp công cụ đánh giá và kết luận
Công cụ đánh giá: câu hỏi tự luận, bảng kiểm đánh giá kỹ năng hợp tác.
e.Sản phẩm học sinh cần đạt:
-Giá trị độ âm điện của nguyên tử các nguyên tố phụ thuộc vào đồng thời 2 yếu tố ĐTHN và bán kính nguyên tử
-Trong một chu kỳ, theo chiều tăng dần của ĐTHN, độ âm điện của nguyên tử các nguyên tố tăng dần
-Giải thích: Trong một chu kỳ, theo chiều tăng dần của ĐTHN, bán kính nguyên tử giảm, lực hút
giữa hạt nhân với e lớp ngoài cùng tăng độ âm điện tăng
-Trong một nhóm, theo chiều tăng dần của ĐTHN, độ âm điện giảm dần
-Giải thích: Trong một nhóm, theo chiều tăng dần của ĐTHN, bán kính nguyên tử tăng nhanh, lực
hút giữa hạt nhân với electron ngoài cùng giảm độ âm điện giảm HĐ 6. ĐỘ ÂM ĐIỆN (tt) Thời gian: 3 phút 1. Mục tiêu: 2,6,8,9,10
2. Tiến trình tổ chức hoạt động:
HS hoàn thành PHT2 theo cá nhân Nội dung PHT6:
Dựa vào xu hướng biến đổi độ âm điện của nguyên tử các nguyên tố trong bảng tuần hoàn, em
hãy xếp các nguyên tố sau đây theo chiều tăng dần độ âm điện của nguyên tử
Na (Z=11), K(Z=19), Mg(Z=12), Al(Z=13) a. Giao nhiệm vụ:
HS hoàn thành PHT6 theo cá nhân
b. Thực hiện nhiệm vụ:
HS suy nghĩ và có câu trả lời
c. Báo cáo- thảo luận: HS trình bày
d. Phương pháp công cụ đánh giá và kết luận
Công cụ đánh giá: câu hỏi tự luận
e.Sản phẩm học sinh cần đạt:
Chiều tăng dần độ âm điện KHĐ 7.
TÍNH KIM LOẠI – TÍNH PHI KIM Thời gian: 12 phút
1. Mục tiêu: 2,6,7,8,9,10
2. Tiến trình tổ chức hoạt động:
GV dẫn: Mô hình tạo ion ( Hình 6.3) a. Giao nhiệm vụ:
HS hoàn thành PHT7 theo nhóm Nội dung PHT7:
Viết quá trình hình thành ion Na+, F-
Tổng quát cho ion dương kim loại, ion âm phi kim
GV dẫn: Nguyên tử Na dễ nhường 1 e tạo ion Na+ => Na có tính kim loại
Nguyên tử F dễ nhận 1 e tạo ion F- => F có tính phi kim
Tính kim loại: là tính chất của một nguyên tố mà nguyên tử dễ nhường e. Nguyên tử càng dễ
nhường e tính kim loại càng mạnh
Tính phi kim: Là tính chất của một nguyên tố mà nguyên tử dễ nhận e. Nguyên tử càng dễ nhận e tính phi kim càng mạnh. GV đặt câu hỏi:
Khả năng nhường hoặc nhận e hóa trị của nguyên tử các nguyên tố nhóm A thay đổi như thế nào khi:
(a) đi từ đầu chu kỳ đến cuối chu kỳ
(b) đi từ đầu nhóm đến cuối nhóm
Từ đó nêu quy luật biến đổi tính kim loại, phi kim
b. Thực hiện nhiệm vụ:
HS hoàn thành PHT7 theo nhóm và trả lời câu hỏi của GV theo cá nhân
c. Báo cáo- thảo luận:
HS suy nghĩ và có câu trả lời
d. Phương pháp công cụ đánh giá và kết luận
Công cụ đánh giá: câu hỏi tự luận, bảng kiểm đánh giá kỹ năng hợp tác.
e.Sản phẩm học sinh cần đạt: Na Na+ + 1e F + 1e F-
TQ: M Mn+ + ne (n=1,2,3)
X + ne Xn- (n=1,2,3)
-Khả năng nhường hoặc nhận e hóa trị của nguyên tử các nguyên tố nhóm A khi:
(a) đi từ đầu chu kỳ đến cuối chu kỳ khả năng nhường e giảm, khả năng nhận e tăng
(b) đi từ đầu nhóm đến cuối nhóm khả năng nhường e tăng, khả năng nhận e giảm
-Quy luật biến đổi tính kim loại, phi kim:
Trong một chu kỳ, theo chiều tăng dần của ĐTHN, tính kim loại của các nguyên tố giảm dần, tính phi kim tăng dần
Trong một nhóm, theo chiều tăng dần của ĐTHN, tính kim loại của các nguyên tố tăng dần, tính phi kim giảm dần HĐ 8.
TÍNH KIM LOẠI – TÍNH PHI KIM (tt) Thời gian: 3 phút 1. Mục tiêu: 2,6,8,9,10
2. Tiến trình tổ chức hoạt động: a. Giao nhiệm vụ:
HS hoàn thành PHT8 theo cá nhân Nội dung PHT8:
Dựa vào xu hướng biến đổi tính kim loại, phi kim của các nguyên tố trong bảng tuần hoàn, hãy
sắp xếp các nguyên tố sau theo chiều giảm dần tính kim loại
Sodium (Z=11), Magnesium(Z=12), Potassium(Z=19)
b. Thực hiện nhiệm vụ:
HS suy nghĩ và có câu trả lời
c. Báo cáo- thảo luận: HS trình bày
d. Phương pháp công cụ đánh giá và kết luận
Công cụ đánh giá: câu hỏi tự luận
e.Sản phẩm học sinh cần đạt:
Chiều giảm dần tính kim loại K> Na>Mg HĐ 9.
TÍNH ACID-BASE CỦA OXIDE VÀ HYDROXIDE Thời gian: 20 phút
1. Mục tiêu: 3,4,6,7,8,9,10
2. Tiến trình tổ chức hoạt động a. Giao nhiệm vụ:
HS hoàn thành PHT9 theo nhóm Nội dung PHT9:
Xét một số phản ứng sau: Na2O + 2 HCl 2 NaCl + H2O NaOH + HCl NaCl + H2O Al2O3 +6 HCl 2AlCl3 + 3H2O Al(OH)3 +3 HCl AlCl3 +3H2O
Al2O3 +2 NaOH + 3H2O 2Na[Al(OH)4] Al(OH)3 + NaOH Na[Al(OH)4] SO3 + 2NaOH Na2SO4 + H2O
H2SO4 +2 NaOH Na2SO4 + 2H2O
Từ các phản ứng của oxide và hydroxide trên hãy nhận xét tính acid, base của chúng.
Cho các hóa chất: NaOH, PP, H2SO4, AlCl3, HCl hãy thiết kế và thực hiện thí nghiệm minh họa
tính chất của NaOH, H2SO4 và Al(OH)3
b. Thực hiện nhiệm vụ:
HS nhận PHT 9 và làm việc theo nhóm, trình bày nội dung vào bảng nhóm
c. Báo cáo- thảo luận:
Mỗi nhóm sẽ cử đại diện trình bày theo yêu cầu của GV. Đồng thời các HS khác có thể góp ý thêm.
d. Phương pháp công cụ đánh giá và kết luận Phương pháp: quan sát
Công cụ đánh giá: câu hỏi tự luận, bảng kiểm đánh giá kỹ năng hợp tác, bảng kiểm đánh giá kỷ
năng thực hành thí nghiệm.
e.Sản phẩm học sinh cần đạt: Na2O : basic oxide NaOH: base Al2O3: oxide lưỡng tính
Al(OH)3: hydroxide lưỡng tính SO3: acidic oxide H2SO4: acid TN1: NaOH + PP + H2SO4
TN2: AlCl3 + NaOH thu được kết tủa Al(OH)3 TN3: Al(OH)3 + NaOH TN4: Al(OH)3 + HCl
HS làm thí nghiệm minh họa. HĐ 10.
TÍNH ACID-BASE CỦA OXIDE VÀ HYDROXIDE (tt) Thời gian: 10 phút
1. Mục tiêu: 3,4,6,7,8,9,10
2. Tiến trình tổ chức hoạt động: a. Giao nhiệm vụ: Nội dung PHT10: Quan sát bảng sau.
Nêu xu hướng biến đổi tính acid- base của oxide và hydroxide trong 1 chu kỳ.
Tính acid -base của oxide và hydroxide tương ứng của các nguyên tố thuộc chu kỳ 2,3 NHÓM IA IIA IIIA IVA VA VIA VIIA Hóa trị cao I II III IV V VI VII nhất CT OXIDE R2O RO R2O3 RO2 R2O5 RO3 R2O7 cao nhất CT OXIDE Li2O BeO B2O3 CO2 N2O5 - - cao nhất CK 2 Tính chất Basic Oxide Acidic Acidic Acidic oxide lưỡng tính oxide oxide oxide CT LiOH Be(OH)2 H3BO3 H2CO3 HNO3 - - HYDROXIDE Tính chất Base Hydroxide Acid yếu Acid Acid mạnh lưỡng tính yếu mạnh CT OXIDE Na2O MgO Al2O3 SiO2 P2O5 SO3 Cl2O7 cao nhất CK 3 Tính chất Basic Basic Oxide Acidic Acidic Acidic Acidic oxide oxide lưỡng tính oxide oxide oxide oxide CT NaOH Mg(OH)2 Al(OH)3 H2SiO3 H3PO4 H2SO4 HClO4 HYDROXIDE Tính chất Base Base yếu Hydroxide Acid Acid Acid Acid mạnh lưỡng tính yếu trung mạnh rất bình mạnh
b. Thực hiện nhiệm vụ:
HS nhận PHT 10 và làm việc theo nhóm, trình bày nội dung vào bảng nhóm
c. Báo cáo- thảo luận:
Mỗi nhóm sẽ cử đại diện trình bày theo yêu cầu của GV. Đồng thời các HS khác có thể góp ý thêm.
d. Phương pháp công cụ đánh giá và kết luận
Công cụ đánh giá: câu hỏi tự luận, bảng kiểm đánh giá kỹ năng hợp tác
e.Sản phẩm học sinh cần đạt:
Trong một chu kỳ, theo chiều tăng dần của ĐTHN, tính base của oxide và hydroxide tương ứng
giảm dần, tính acid của chúng tăng dần HĐ 11. ASPARTAME Thời gian: 5 phút
1. Mục tiêu: 4,5,6,7,8,9,10
2. Tiến trình tổ chức hoạt động: a. Giao nhiệm vụ: Nội dung PHT11:
b. Thực hiện nhiệm vụ:
HS nhận PHT 11 và làm việc theo nhóm, trình bày nội dung vào bảng nhóm
c. Báo cáo- thảo luận:
Mỗi nhóm sẽ cử đại diện trình bày theo yêu cầu của GV. Đồng thời các HS khác có thể góp ý thêm.
d. Phương pháp công cụ đánh giá và kết luận
Công cụ đánh giá: câu hỏi tự luận, bảng kiểm đánh giá kỹ năng hợp tác
e.Sản phẩm học sinh cần đạt: H: CK 1 nhóm IA C: CK 2 nhóm IVA O: CK2 nhóm VIA N: CK 2 nhóm VA
Oxi có tính phi kim mạnh nhất HĐ 12. TRÒ CHƠI Thời gian: 5 phút
1. Mục tiêu: 1,2,3,4,5,6,7,8,9,10
2. Tiến trình tổ chức hoạt động: a. Giao nhiệm vụ: b. Thực hiện nhiệm vụ: c. Báo cáo- thảo luận:
d. Phương pháp công cụ đánh giá và kết luận
Công cụ đánh giá: câu hỏi trắc nghiệm được thiết kế trong trò chơi
e.Sản phẩm học sinh cần đạt: IV. HỒ SƠ DẠY HỌC:
BẢNG KIỂM ĐÁNH GIÁ KỸ NĂNG HỢP TÁC Tên: STT: NHÓM: Đạt Không đạt
1. Kỹ năng giao tiếp, tương tác với bạn
Biết lắng nghe và trình bày ý kiến một cách rõ ràng
Biết lắng nghe và biết thừa nhận ý kiến của người khác
Biết ngắt lời một cách hợp lí
Biết phản đối một cách lịch sự và đáp lại lời phản đối.
Biết thuyết phục người khác và đáp lại sự thuyết phục
2. Kỹ năng tạo môi trường hợp tác
( sự ảnh hưởng qua lại, sự gắn kết giữa các thành viên)
3. Kỹ năng xây dựng niềm tin
4. Kỹ năng giải quyết mâu thuẫn
BẢNG KIỂM ĐÁNH GIÁ KỸ NĂNG THỰC HÀNH THÍ NGHIỆM Tên: STT: NHÓM: Đạt Không đạt
1. Lựa chọn dụng cụ, hóa chất phù hợp cho mục đích thí nghiệm
2. Thực hiện đúng các thao tác thí nghiệm cơ bản: cầm,
kẹp ống nghiệm, lấy hóa chất, …
3. Biết ghi chép hiện tượng và các vấn đề xảy ra trong quá trình thí nghiệm.
4. Xử lý dụng cụ hóa chất sau thí nghiệm hợp lý, đúng quy định V. BÀI TẬP Bài tập trắc nghiệm
Câu 1: Dãy nguyên tố nào sau đây sắp xếp theo chiều tăng dần của bán kính nguyên tử? A. Be, F, O, C, Mg B. Mg, Be, C, O, F C. F, O, C, Be, Mg D. F, Be, C, Mg, O
Câu 2: Nguyên tử của nguyên tố nào có bán kính lớn nhất trong các nguyên tử sau đây? A. Al B. P C. S D. K
Câu 3: Dãy nguyên tố nào sau đây sắp xếp theo chiều tăng dần độ âm điện của nguyên tử? A. Li, F, N, Na, C. B. F, Li, Na, C, N. C. Na, Li, C, N, F. D. N, F, Li, C, Na.
Câu 4: Nguyên tử của nguyên tố nào sau đây có độ âm điện lớn nhất? cho biết nguyên tố này được
sử dụng trong công nghệ hàn, sản xuất thép và methanol. A. B. B. N. C. O. D. Mg.
Câu 5: Nguyên tử của nguyên tố nào sau đây có tính kim loại mạnh nhất ? Cho biết nguyên tố này
được sử dụng trong đồng hồ nguyên tử với độ chính xác ở mức giây trong hàng nghìn năm. A. Hydrogen. B. Beryllium. C. Caesium. D. Phosphorus.
Câu 6: Nguyên tử của nguyên tố nào sau đây có tính phi kim mạnh nhất? Cho biết nguyên tố này
có trong thành phần của hợp chất teflon, dược sử dụng để tráng chảo chống dính. A. Fluorine. B. Bromine. C. Phosphorus. D. Iodine.
Câu 7: Hydroxide nào có tính base mạnh nhất trong các hydroxide sau đây? Cho biết hợp chất này
được sử dụng làm chất phụ gia cho dầu bôi trơn của động cơ đốt trong. A. Calcium hydroxide. B. Barium hydroxide. C. Strontium hydroxide. D. Magnesium hydroxide.
Câu 8: Hydroxide nào có tính acid mạnh nhất trong các hydroxide sau đây? Cho biết hợp chất này
được dùng để phân hủy các quặng phức tạp; phân tích khoáng vật và làm chất xúc tác. A. Silicic acid. B. Sulfuric acid. C. Phosphoric acid. D. Perchloric acid.
Câu 9: Cho các nguyên tố X, Y, Z với số hiệu nguyên tử lần lượt là 4,12,20. Phát biểu nào sau đây sai?
A. Các nguyên tố này đều là các kim loại mạnh nhất trong chu kỳ.
B. Các nguyên tố này không cùng thuộc một chu kỳ.
C. Thứ tự tăng dần tính base là: X(OH)2, Y(OH)2, Z(OH)2.
D. Thứ tự tăng dần độ âm điện là Z, Y, X. Bài tập tự luận
Câu 1: Quan sát hình sau: A B C
Ba quả cầu A, B, C tượng trưng cho nguyên tử các nguyên tố helium, krypton và radon. Quả cầu nào là krypton?
Câu 2: Sắp xếp các nguyên tử sau đây theo thứ tự tăng dần độ âm điện: Cl, Al, Na, P, F.
Câu 3: Sắp xếp các nguyên tử sau đây theo thứ tự giảm dần tính kim loại: Na, Al, Si, Mg, P, Cl, S, F.
Câu 4: Độ âm điện của H, N, O lần lượt là 2,2; 3.0; 3.4.
Trong phân tử NH3, H2O cặp e liên kết sẽ bị lệch về phía nguyên tử nào?
Cặp e liên kết bị lệch nhiều hơn trong phân tử NH3 hay trong phân tử H2O
Câu 5: Viết phương trình phản ứng của các chất sau với nước (nếu có): Na2O, SO3, Cl2O7, CO2,
CaO, N2O5. Nhận xét về tính base, tính acid của các sản phẩm tạo thành.
Câu 6: Dựa vào hình 6.1 và bảng 6.1 trong SGK hãy vẽ đồ thị hoặc biểu đồ đối với hai đại lượng
bán kính nguyên tử và độ âm điện trong bảng số liệu trên. Quan sát và cho biết hai đại lượng này
biến thiên như thế nào. Giải thích. Hướng dẫn giải: TRƯỜNG THPT TRẦN PHÚ TỔ HÓA HỌC KHỐI 10
KẾ HOẠCH BÀI DẠY:
ĐỊNH LUẬT TUẦN HOÀN VÀ Ý NGHĨA CỦA BẢNG TUẦN HOÀN
CÁC NGUYÊN TỐ HOÁ HỌC
Thời lượng: 03 tiết
* NỘI DUNG KIẾN THỨC CỦA CHỦ ĐỀ:
- Phát biểu được định luật tuần hoàn;
- Trình bày được ý nghĩa của bảng tuần hoàn các nguyên tố hoá học: Mối liên hệ giữa vị trí
(trong bảng tuần hoàn các nguyên tố hoá học) với tính chất và ngược lại. I. MỤC TIÊU DẠY HỌC:
Sau bài học này HS có thể: YÊU CẦU CẦN ĐẠT
- Phát biểu được định luật tuần hoàn;
1. Nhận thức hóa
- Trình bày được ý nghĩa của bảng tuần hoàn các 1. NĂNG LỰC học
nguyên tố hoá học: Mối liên hệ giữa vị trí và cấu HÓA HỌC tạo.
- Dự đoán được tính chất hóa học các nguyên tố,
2. Tìm hiểu thế giới cũng như hợp chất của các nguyên tố đó thông
tự nhiên dưới góc
qua vị trí của nguyên tố đó trong BTH; độ hóa học
- So sánh tính chất của đơn chất cũng như hợp
chất của các nguyên tố.
- Giải thích được tính chất của một số nguyên tố
3. Vận dụng kiến
thông qua cấu tạo nguyên tử và vị trí của chúng
thức, kĩ năng đã trong BTH; học
- Giải được các bài tập liên quan đến BTH.
- Sử dụng ngôn ngữ phối hợp với dữ liệu, hình
1. Giải quyết vấn đề ảnh để trình bày thông tin và ý tưởng có liên quan và sáng tạo
đến cấu tạo và tính chất của các nguyên tố hóa học; 2. NĂNG LỰC
- Tham gia đóng góp ý kiến trong nhóm và tiếp
2. Giao tiếp và hợp CHUNG
thu sự góp ý, hỗ trợ của các thành viên trong tác nhóm;
3. Năng lực tự chủ - Lập kế hoạch, thực hiện kế hoạch để tìm hiểu về và tự học
định luật tuần hoàn và ý nghĩa.
- Có ý thức tôn trọng ý kiến của các thành viên trong nhóm khi hợp tác; 1. Trung thực 3. PHẨM
- Có ý thức hỗ trợ, hợp tác với các thành viên CHẤT
trong nhóm để hoàn thành nhiệm vụ;
- Chủ động lập và thực hiện kế hoạch giải quyết
2. Trách nhiệm vấn đề.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
- Thiết bị dạy học
+ Thiết bị công nghệ, phần mềm: Không
+ Thiết bị dạy học khác: Hóa chất Dụng cụ BTH khổ lớn Bảng con - Học liệu
+ Học liệu số: Không
+ Học liệu khác:
Phiếu học tập 01: Mối quan hệ giữa vị trí nguyên tố và cấu tạo nguyên tử của nó;
Phiếu học tập 02: Mối quan hệ giữa vị trí và tính chất của nguyên tố;
Phiếu học tập 03: So sánh tính chất của một nguyên tố với các nguyên tố lân cận;
Phiếu học tập 04: Bài tập trắc nghiệm.III. TIẾN TRÌNH DẠY HỌC:
A. BẢNG TÓM TẮT CÁC HOẠT ĐỘNG: HOẠT ĐỘNG HỌC NỘI DUNG DẠY HỌC MỤC TIÊU PPDH- KTDH (THỜI GIAN) TRỌNG TÂM Thông qua trò chơi “Ai
- Học sinh các nhóm nhanh chóng thảo HĐ 1: nhanh hơn” giúp học
Ôn tập Sự biến đổi theo
luận và điền các mũi tên tăng hoặc KHỞI ĐỘNG-KẾT sinh củng cố lại các
chiều tăng điện tích hạt
giảm vào BẢNG 1 trong 1 phút. NỐI (10PHÚT) kiến thức đã học của nhân
- Giáo viên chia học sinh trong lớp tiết học trước
thành 4 nhóm và tổ chức chơi trò chơi.
HĐ 2: HÌNH THÀNH KIẾN THỨC (80 PHÚT)
- GV cho học sinh chơi trò chơi: chọn
các mãnh ghép phù hợp ghép lại với
nhau (các mảnh ghép ở BẢNG 2).
Hoạt động 2.1. Định
- HS ghép các mảnh ghép lại sao cho Học sinh phát biểu luật tuần hoàn Định luật tuần hoàn
phù hợp để được nội dung hoàn chỉnh định luật tuần hoàn. (5 phút)
của định luật tuần hoàn.
- HS các nhóm trả lời bằng cách đưa đáp án bằng bảng phụ. - Đáp án: 1-3-2-5-4 Tìm hiểu mối quan hệ
- Giáo viên: cho 4 nhóm thảo luận và
Hoạt động 2.2. Mối
Mối quan hệ giữa vị trí giữa vị trí các nguyên
điền thông tin vào phiếu học tập số 1.
quan hệ giữa vị trí các nguyên tố trong tố trong bảng tuần hoàn
GV mời nhóm 1 dán kết quả phiếu học
nguyên tố và cấu tạo
bảng tuần hoàn với cấu với cấu tạo nguyên tử
tập số 1 lên bảng và trình bày. nguyên tử của nó tạo nguyên tử của của nguyên tố và
- GV mời các nhóm khác góp ý, bổ (30 phút)
nguyên tố và ngược lại. ngược lại. sung và kết luận.
- Giáo viên: cho 4 nhóm thảo luận và
Hoạt động 2.3. Mối quan Giải được các bài toán
điền thông tin vào phiếu học tập số 2.
Mối quan hệ giữa vị trí
hệ giữa vị trí nguyên tố liên quan đến mối quan
Hoạt động chung cả lớp: nguyên tố và tính chất
và tính chất nguyên tố
hệ giữa vị trí nguyên tố
GV mời các nhóm dán kết quả nguyên tố (25 phút) và tính chất nguyên tố
phiếu học tập số 2 lên bảng, GV mời 2 nhóm trình bày.
GV mời các nhóm khác góp ý, bổ sung và kết luận.
Kết luận: biết vị trí của một nguyên tố
trong BTH có thể suy ra tính chất hóa học cơ bản của nó
- Giáo viên: cho 4 nhóm thảo luận và
điền thông tin vào phiếu học tập số 3
Hoạt động chung cả lớp:
GV mời các nhóm 1 và 4 dán kết
Hoạt động 2.4. So sánh So sánh tính chất của So sánh tính chất của
quả phiếu học tập lên bảng
tính chất của một đơn chất và hợp chất
đơn chất và hợp chất của
GV mời các nhóm khác góp ý, bổ nguyên tố với các của một nguyên tố với một nguyên tố với các sung và kết luận nguyên tố lân cận các nguyên tố lân cận nguyên tố lân cận
Kết luận: Dựa vào quy luật biến đổi (20 phút)
tính chất của các nguyên tố trong BTH
có thể so sánh tính chất hóa học của
một nguyên tố với các nguyên tố lân cận.
Học sinh trả lời các câu
- GV tổ chức thi rung chuông vàng cho HĐ 3: hỏi trắc nghiệm theo
học sinh của 4 tổ bằng các câu hỏi trắc
HOẠT ĐỘNG LUYỆN các mức độ biết, hiểu Luyện tập
nghiệm phiếu học tập số 4 TẬP ( 40 PHÚT) và vận dụng nhằm nắm
- Các tổ trả lời câu hỏi bằng hình thức bắt được kiến thức đưa bảng phụ
- GV cho học sinh xem hình ảnh một số
BTH khác ngoài bảng của Mendeleep. HĐ 4: HOẠT ĐỘNG
HS có nhiệm vụ tìm kiếm các thông tin VẬN DỤNG / MỞ
Khẳng định BTH đang Vận dụng thực tế
- liên quan đến BTH mà giáo viên RỘNG (5 PHÚT)
học là bảng tối ưu nhất.
chiếu: tìm ra năm nào, ai tìm ra? Theo
quy luật nào? So sánh với BTH đang
học và rút ra kết luận. B. CÁC HOẠT ĐỘNG:
HĐ 1. Hoạt động khởi động-kết nối AI NHANH TAY HƠN Thời gian: 10 phút
1. Mục tiêu: 1.3; 2.3; 3.1; 3.2
2. Tiến trình tổ chức hoạt động:
a. Giao nhiệm vụ: chia học sinh trong lớp thành 4 nhóm và tổ chức chơi trò chơi.
b. Thực hiện nhiệm vụ: Học sinh các nhóm nhanh chóng thảo luận và điền các mũi tên tăng
hoặc giảm vào BẢNG 1 trong 1 phút.
c. Báo cáo-thảo luận: Hoàn thành bảng 1
d. Phương pháp công cụ đánh giá và kết luận: Đánh giá nhóm
e.Sản phẩm học sinh cần đạt: Bảng 1
HĐ 2.1 Hình thành kiến thức
ĐỊNH LUẬT TUẦN HOÀN Thời gian: 5 phút
1. Mục tiêu: 1.1; 2.1; 2.2; 2.3; 3.1; 3.2
2. Tiến trình tổ chức hoạt động:
a. Giao nhiệm vụ: chọn các mãnh ghép phù hợp ghép lại với nhau (các mảnh ghép ở BẢNG 2).
b. Thực hiện nhiệm vụ: HS ghép các mảnh ghép lại sao cho phù hợp để được nội dung hoàn
chỉnh của định luật tuần hoàn.
c. Báo cáo-thảo luận: Dùng bảng phụ đưa đáp án.
d. Phương pháp công cụ đánh giá và kết luận: Đánh giá nhóm.
e.Sản phẩm học sinh cần đạt: Thứ tự mảnh ghép 1-3-2-5-4
HĐ 2.2 Hình thành kiến thức
MỐI QUAN HỆ GIỮA VỊ TRÍ NGUYÊN TỐ VÀ CẤU TẠO NGUYÊN TỬ CỦA NÓ Thời gian: 30 phút
1. Mục tiêu: 1.2; 2.1; 2.2; 3.1; 3.2
2. Tiến trình tổ chức hoạt động:
a. Giao nhiệm vụ: 4 nhóm thảo luận và điền thông tin vào phiếu học tập số 1.
b. Thực hiện nhiệm vụ: Nhóm 1 dán kết quả phiếu học tập số 1 lên bảng và trình bày; các
nhóm khác góp ý, bổ sung và kết luận.
c. Báo cáo-thảo luận: Dán kết quả lên bảng.
d. Phương pháp công cụ đánh giá và kết luận: Đánh giá nhóm.
e.Sản phẩm học sinh cần đạt: Phiếu học tập số 1
HĐ 2.3 Hình thành kiến thức
MỐI QUAN HỆ GIỮA VỊ TRÍ NGUYÊN TỐ VÀ TÍNH CHẤT NGUYÊN TỐ Thời gian: 25 phút
1. Mục tiêu: 1.2; 1.3; 2.1; 2.2; 3.1; 3.2
2. Tiến trình tổ chức hoạt động:
a. Giao nhiệm vụ: 4 nhóm thảo luận và điền thông tin vào phiếu học tập số 2.
b. Thực hiện nhiệm vụ: 2 Nhóm lên bảng và trình bày phiếu học tập số 2; các nhóm khác góp
ý, bổ sung và kết luận.
c. Báo cáo-thảo luận: Dán kết quả lên bảng.
d. Phương pháp công cụ đánh giá và kết luận: Đánh giá nhóm.
e.Sản phẩm học sinh cần đạt: Phiếu học tập số 2
HĐ 2.4 Hình thành kiến thức
SO SÁNH TÍNH CHẤT CỦA MỘT NGUYÊN TỐ VỚI CÁC NGUYÊN TỐ LÂN CẬN Thời gian: 20 phút
1. Mục tiêu: 1.2; 1.3; 2.1; 2.2; 3.1; 3.2
2. Tiến trình tổ chức hoạt động:
a. Giao nhiệm vụ: 4 nhóm thảo luận và điền thông tin vào phiếu học tập số 3.
b. Thực hiện nhiệm vụ: Nhóm 1 và 4 lên bảng và trình bày phiếu học tập số 3; các nhóm khác
góp ý, bổ sung và kết luận.
c. Báo cáo-thảo luận: Dán kết quả lên bảng.
d. Phương pháp công cụ đánh giá và kết luận: Đánh giá nhóm.
e.Sản phẩm học sinh cần đạt: Phiếu học tập số 3
HĐ 3. Hoạt động Luyện Tập RUNG CHUÔNG VÀNG Thời gian: 40 phút
1. Mục tiêu: 1.3; 2.1; 2.2; 3.1; 3.2
2. Tiến trình tổ chức hoạt động:
a. Giao nhiệm vụ: thi rung chuông vàng cho học sinh của 4 tổ bằng các câu hỏi trắc nghiệm phiếu học tập số 4.
b. Thực hiện nhiệm vụ: Các tổ trả lời câu hỏi bằng hình thức đưa bảng phụ.
c. Báo cáo-thảo luận: Giơ bảng phụ.
d. Phương pháp công cụ đánh giá và kết luận: Đánh giá cá nhân tích điểm nhóm.
e.Sản phẩm học sinh cần đạt: Phiếu học tập số 4.
HĐ 4. : hoạt động vận dụng / mở rộng KHÁM PHÁ Thời gian: 5 phút
1. Mục tiêu: 1.3; 2.1; 2.2; 3.1; 3.2
2. Tiến trình tổ chức hoạt động:
a. Giao nhiệm vụ: học sinh xem hình ảnh một số BTH khác ngoài bảng của Mendeleep
b. Thực hiện nhiệm vụ: HS có nhiệm vụ tìm kiếm các thông tin liên quan đến BTH mà giáo
viên chiếu: tìm ra năm nào, ai tìm ra? Theo quy luật nào? So sánh với BTH đang học và rút ra kết luận.
c. Báo cáo- thảo luận:
d. Phương pháp công cụ đánh giá và kết luận
e.Sản phẩm học sinh cần đạt: IV. HỒ SƠ DẠY HỌC: 4.1 Phiếu học tập
BẢNG 1 - hoạt động 1
Sự biến đổi theo chiều tăng điện tích hạt nhân Trong 1 chu kì Trong 1 nhóm A
1. Số e lớp ngoài cùng
2. Bán kinh nguyên tử 3. Độ âm điện 4. Tính kim loại 5. Tính phi kim
6. Hóa trị của nguyên tố trong oxit cao nhất
7. Hóa trị của nguyên tố trong hợp chất khí với H
8. Tính axit của hidroxit tương ứng
9. Tính bazo của hidroxit tương ứng
BẢNG 2 - hoạt động 2.1 MẢNH 1 MẢNH 2 MẢNH 3 MẢNH 4 MẢNH 5
Tính chất của các tạo nên từ các cũng như thành phần theo chiều tăng của biến đổi tuần
nguyên tố và đơn nguyên tố đó
và tính chất của các điện tích hạt nhân hoàn chất hợp chất nguyên tử.
PHIẾU HỌC TẬP SỐ 1 - hoạt động 2.2
PHIẾU HỌC TẬP SÔ 1
Câu 1: Nguyên tố Na thuộc chu kì 3, nhóm IA trong bảng tuần hoàn. Hãy xác định các thông tin về
cấu tạo nguyên tử của Na
Số lớp electron: . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Số electron lớp ngoài cùng: . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Cấu hình electron nguyên tử của Na: . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Câu 2: Cho cấu hình electron của S là: 1s22s22p63s23p4. Hãy xác định vị trí của S trong bảng tuần hoàn.
Ô nguyên tố: . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Chu kì: . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Nhóm:. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Câu 3: Nối các cột ở bảng A và bảng B cho phù hợp CỘT A CỘT B
1. Số thứ tự của nguyên tố A. bằng số lớp e
2. Số thự tự của chu kì
B. bằng số e lớp ngoài cùng
3. Số thứ tự của nhóm A C. số proton, số e
PHIẾU HỌC TẬP SỐ 2 - hoạt động 2.3 Nhóm 1&3 Câu hỏi 7N 19K 12Mg 1. Viết cấu hình e
2. Xác định loại nguyên tố (s,p,d,f);
3. Xác tính chất nguyên tố ( kim loại, phi kim, khí hiếm);
4. Xác định hóa trị cao nhất với oxi và công thức oxit cao nhất;
5. Xác định hóa trị trong hợp chất khí với hiđro,và
công thức hợp chất khí với hiđro (nếu có);
6. Viết công thức hiđroxit cao nhất và nêu tính chất của hiđroxit đó. Nhóm 2&4 Câu hỏi 14Si 15P 20Ca 1. Viết cấu hình e
2. Xác định loại nguyên tố (s,p,d,f);
3. Xác tính chất nguyên tố ( kim loại, phi kim, khí hiếm);
4. Xác định hóa trị cao nhất với oxi và công thức oxit cao nhất;
5. Xác định hóa trị trong hợp chất khí với hiđro,và
công thức hợp chất khí với hiđro (nếu có);
6. Viết công thức hiđroxit cao nhất và nêu tính chất của hiđroxit đó.
PHIẾU HỌC TẬP SỐ 3 - hoạt động 2.4
PHIẾU HỌC TẬP SỐ 3 - nhóm 1,3
Cho các nguyên tố 19K; 12Mg; 20Ca. Sắp xếp theo chiều tăng dần - Độ âm điện - Tính kim loại
- Tính bazo của các hidroxit tương ứng:
PHIẾU HỌC TẬP SỐ 3 - nhóm 2,4
Cho các nguyên tố 7N; 15P; 14Si. Sắp xếp theo chiều tăng dần - Độ âm điện - Tính phi kim
- Tính axit của các hidroxit tương ứng
PHIẾU HỌC TẬP SỐ 4 - hoạt động 3
PHIẾU HỌC TẬP SỐ 4 Câu nhận biết:
Câu 1: Đại lượng nào sau đây không biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân? A. Độ âm điện. B.Tính kim loại. C. Tính axit.
D.Khối lượng riêng.
Câu 2: Các nguyên tố nhóm IA có điểm chung là
A. có 1 e lớp ngoài cùng. B. số nơtron
C. Có tính phi kim mạnh.
D. Có xu hướng nhận thêm 1 e khi hình thành liên kết hóa học.
Câu 3: Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân
A. tính kim loại và tính phi kim đều tăng dần.
B. tính kim loại giảm dần, tính phi kim tăng dần.
C. tính kim loại tăng dần, tính phi kim giảm dần.
D. tính phi kim và tính kim loại đều giảm dần.
Câu 4: Cấu hình e của 39K : 1s2 2s2 2p6 3s2 3p6 4s1. Vậy kết luận nào sau đây sai? 19
A. Có 20 notron trong hạt nhân.
B. Là nguyên tố mở đầu chu kỳ 4.
C. Nguyên tử có 7e ở lớp ngoài cùng.
D. Thuộc chu kỳ 4, nhóm IA.
Câu 5: Cho dãy nguyên tố nhóm IA: Li – Na – K – Rb – Cs. Theo chiều điện tích hạt nhân tăng, tính kim loại
A. yếu dần rồi mạnh dần. B. mạnh dần. C. yếu dần.
D. mạnh dần rồi yếu dần. Câu hỏi hiểu:
Câu 6: Cặp nguyên tố nào sau đây có tính chất tương tự nhau? A. Na và K. B. K và Ca. C. Na và Mg. D. Mg và Al.
Câu 7 : Nguyên tố X thuộc chu kỳ 3, nhóm VI có cấu hình là: A. 1s22s22p63s23p4. B. 1s22s22p63s23p2. C. 1s22s22p23s23d4. D. 1s22s22p63s23p6.
Câu 8: Nguyên tử của nguyên tố X có tổng số electron ở phân lớp p bằng 7. Vị trí của X trong bảng hệ thống tuần hoàn là:
A. STT 13; CK 3; nhóm IIIA.
B. STT 12; CK 3; nhóm IIA.
C. STT 20; CK 4; nhóm IIA.
D. STT 19; CK 4; nhóm IA.
Câu 9: Tính bazơ của dãy hiđroxit: NaOH, Mg(OH)2, Al(OH)3 biến đổi theo chiều A. tăng dần.
B. yếu dần rồi mạnh dần. C. yếu dần.
D. mạnh dần rồi yếu dần.
Câu 10: Xác định vị trí trong bảng HTTH của nguyên tố có số hiệu nguyên tử Z=11?
A. Chu kỳ 3, nhóm IA.
B. Chu kỳ 4, nhóm IIA.
C. Chu kỳ 3 ,nhóm IIA. D. Chu kỳ 4,nhóm IA. Câu hỏi vận dụng:
Câu 11: Cho các nguyên tố 9F, 16S, 17Cl, 14Si. Chiều giảm dần tính kim loại của chúng là:
A. F > Cl > S > Si.
B. F > Cl > Si > S.
C. Si >S >F >Cl.
D. Si > S > Cl > F.
Câu 12: Hợp chất với hiđro của nguyên tố X có công thức XH3. Biết % về khối lượng của oxi trong
oxit cao nhất của X là 74,07 %. Nguyên tử khối của X là A. 32. B. 52. C. 14. D. 31.
Câu 13: Hoà tan 0,45g một kim loại M trong dung dịch HCl rồi cô cạn thì được 2,225g muối khan. Vậy M là A. Al B. Mg C. Fe D. Cu
Câu 14 : Cho 6,4 g hỗn hợp hai kim loại nhóm IIA, thuộc hai chu kì liên tiếp, tác dụng hết với dung
dịch HCl dư thu được 4,48 lít khí hiđro (đktc). Các kim loại đó là A. Be và Mg. B. Mg và Ca. C. Ca và Sr. D. Sr và Ba.
MỘT SỐ BẢNG HỆ THỐNG TUẦN HOÀN KHÁC – HOẠT ĐỘNG 4
4.2 Bảng kiểm để học sinh tự đánh giá hoạt động
BẢNG KIỂM ĐỊNH LUẬT TUẦN HOÀN ST XÁC NHẬN YÊU CẦU CẦN ĐẠT T CÓ KHÔNG
Có xác định được sự biến đổi cấu hình electron nguyên tử của các nguyên tố trong 1 bảng tuần hoàn?
Có xác định được sự biến đổi bán kính nguyên tử của các nguyên tố trong bảng 2 tuần hoàn?
3 Có xác định được sự biến đổi độ âm điện của các nguyên tố trong bảng tuần hoàn?
Có xác định được sự biến đổi tính kim loại, tính phi kim của các nguyên tố trong 4 bảng tuần hoàn?
Có xác định được sự biến đổi tính axit- bazơ của các hợp chất các nguyên tố trong 5 bảng tuần hoàn?
6 Có phát biểu được định luật tuần hoàn không?
* Xây dựng thang đo đánh giá phẩm chất HS
- Tiêu chí cần đánh giá phẩm chất nhân ái, chăm chỉ, trách nhiệm khi tham gia hoạt động
nhóm tìm hiểu mối quan hệ giữa cấu tạo nguyên tử của nguyên tố và vị trí của nó trong bảng tuần hoàn
- Thang đánh giá dạng mô tả Mức độ 1 2 3 4 Gây cản trở các thành Không hợp tác với
Chỉ tôn trọng nhóm Tôn trọng các thành Nhân ái viên trong nhóm.
thành viên trong nhóm. trưởng. viên trong nhóm Đánh giá Có đóng góp nhiều
Cản trở hoạt động của Không tham gia hoạt Có những đóng Chăm chỉ cho hoạt động nhóm động nhóm. góp nhỏ cho nhóm nhóm Đánh giá Chưa sẵn sàng chịu Chịu trách nhiệm Tự giác chịu trách Trách
Không chịu trách nhiệm trách nhiệm về sản
về sản phẩm chung nhiệm về sản phẩm nhiệm về sản phẩm chung phẩm chung khi được yêu cầu chung. Đánh giá Các tiêu chí 3 2 1
Chủ động xung phong nhận
Không xung phong nhưng vui vẻ nhận
Miễn cưỡng khi nhận nhiệm vụ Nhận nhiệm vụ nhiệm vụ.
nhiệm vụ khi được giao. được giao. Đánh giá
- Hăng hái bày tỏ ý kiến, tham
- Còn ít tham gia ý kiến xây
- Tham gia ý kiến xây dựng kế hoạch Tham gia xây
gia xây dựng kế hoạch hoạt động
dựng kế hoạch hoạt động
hoạt động nhóm song đôi lúc chưa chủ dựng kế hoạch của nhóm. nhóm. động. hoạt động của
- Biết lắng nghe, tôn trọng, xem
- Chưa biết lắng nghe, tôn trọng
- Đôi lúc chưa biết lắng nghe và tôn nhóm
xét các ý kiến, quan điểm của
ý kiến của các bạn khác trong
trọng ý kiến của các bạn trong nhóm mọi người trong nhóm. nhóm. Đánh giá Thực hiện
Cố gắng hoàn thành nhiệm vụ
Cố gắng hoàn thành nhiệm vụ của bản
Cố gắng hoàn thành nhiệm vụ nhiệm vụ và hỗ
của bản thân, chủ động hỗ trợ
thân, chưa chủ động hỗ trợ các bạn
của bản thân nhưng chưa hỗ trợ trợ, giúp đỡ các các bạn khác trong nhóm. khác. các bạn khác. thành viên khác Đánh giá
Tôn trọng quyết Luôn tôn trọng quyết định chung Đôi khi chưa tôn trọng quyết định
Nhiều khi chưa tôn trọng quyết định chung của cả nhóm. chung của cả nhóm.
định chung của cả nhóm. Đánh giá
Có sản phẩm tương đối tốt theo
Có sản phẩm tốt theo yêu cầu đề Có sản phẩm tốt nhưng chưa đảm bảo Kết quả làm việc
yêu cầu đề ra nhưng chưa đảm
ra và đảm bảo đúng thời gian. thời gian. bảo thời gian. Đánh giá
Trách nhiệm với Tự giác chịu trách nhiệm về sản Chịu trách nhiệm về sản phẩm chung Chưa sẵn sàng chịu trách nhiệm
kết quả làm việc phẩm chung. khi được yêu cầu. về sản phẩm chung. chung Đánh giá V. BÀI TẬP :
NGUYÊN TẮC SẮP XẾP- CẤU TẠO BẢNG TUẦN HOÀN- VỊ TRÍ MỨC ĐỘ BIẾT
Câu1. Bảng tuần hoàn hiện nay không áp dụng nguyên tắc sắp xếp nào dưới đây?
A. Mỗi nguyên tố hóa học được xếp vào một ô trong bảng tuần hoàn.
B. Các nguyên tố được sắp xếp theo chiều tăng dần khối lượng nguyên tử.
C. Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng.
D. Các nguyên tố có cùng số electron hóa trị trong nguyên tử được xếp thành một cột.
Câu 2. Giá trị nào dưới đây không luôn luôn bằng số thứ tự của nguyên tố tương ứng?
A. Số điện tích hạt nhân nguyên tử.
B. Số hạt proton của nguyên tử.
C. Số hạt nơtron của nguyên tử.
D.Số hạt electron của nguyên tử.
Câu 3. Chu kì là tập hợp các nguyên tố mà nguyên tử của các nguyên tố này có cùng A. số electron. B. số lớp electron.
C. số electron hóa trị.
D. số electron ở lớp ngoài cùng.
Câu 4. Số thứ tự chu kì bằng A. số electron. B. số lớp electron.
C. số electron hóa trị.
D. số electron ở lớp ngoài cùng.
Câu 5. Mỗi chu kì lần lượt bắt đầu từ loại nguyên tố nào và kết thúc ở loại nguyên tố nào?
A. Kim loại kiềm và halogen.
B. Kim loại kiềm thổ và khí hiếm.
C. Kim loại kiềm và khí hiếm.
D. Kim loại kiềm thổ và halogen.
Câu 6. Trường hợp nào dưới đây không có sự tương ứng giữa số thứ tự chu kì và số nguyên tố của chu kì đó?
A. Chu kì 3 có 8 nguyên tố.
B. Chu kì 4 có 18 nguyên tố.
C. Chu kì 5 có 32 nguyên tố.
D. Chu kì 6 có 32 nguyên tố.
Câu 7. Nhóm nguyên tố là tập hợp các nguyên tố mà nguyên tử của các nguyên tố này có cùng A. số electron. B. số lớp electron.
C. số electron hóa trị.D. số electron ở lớp ngoài cùng.
Câu 8. Bảng tuần hoàn có
A. 18 cột, 8 nhóm A và 8 nhóm B.
B. 16 cột, 8 nhóm A và 8 nhóm B.
C. 18 cột, 8 nhóm A và 10 nhóm B.
D. 18 cột, 10 nhóm A và 8 nhóm B.
Câu 9. Mỗi nhóm A và B bao gồm loại nguyên tố nào?
A. Nhóm A gồm nguyên tố s và p, nhóm B gồm nguyên tố d và f.
B. Nhóm A gồm nguyên tố s và d, nhóm B gồm nguyên tố p và f.
C. Nhóm A gồm nguyên tố s và f, nhóm B gồm nguyên tố d và p.
D. Nhóm A gồm nguyên tố d và f, nhóm B gồm nguyên tố s và p.
Câu 10. Số thự tự của các nhóm A được xác định bằng
A. số electron ở phân lớp ngoài cùng
B. số electron thuộc lớp ngoài cùng.
C. số electron của hai phân lớp là (n–1)d và ns.
D. có khi bằng số electron lớp ngoài cùng, có khi bằng số electron của hai phân lớp là (n–1)d và ns.
Câu 11. Số thự tự của các nhóm B thường được xác định bằng
A. số electron độc thân.
B. số electron ghép đôi.
C. số electron thuộc lớp ngoài cùng.
D. số electron của hai phân lớp là (n–1)d và ns.
Câu 12. Trường hợp nào dưới đây không có sự phù hợp giữa số thứ tự nhóm và tên nhóm?
A. Nhóm IA – nhóm kim loại kiềm.
B. Nhóm IIIA – nhóm kim loại kiềm thổ.
C. Nhóm VIIA – nhóm halogen.
D. Nhóm VIIIA – nhóm khí hiếm.
Câu 14. Các nguyên tố hoá học trong bảng tuần hoàn được sắp xếp theo nguyên tắc:
A. Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp cùng một hàng.
B. Các nguyên tố có cùng số electron hoá trị trong nguyên tử được xếp thành một cột.
C. Các nguyên tố được sắp theo theo chiều tăng dần của điện tích hạt nhân nguyên tử.
D. Cả A, B, C đều đúng.
Câu 15. Các nguyên tố hoá học trong bảng tuần hoàn được sắp xếp theo chiều tăng dần của
A. số nơtron trong hạt nhân.
B. số proton trong hạt nhân.
C. số electron ở lớp ngoài cùng
D. cả B và C đều đúng.
Câu 16. Trong bảng tuần hoàn các nguyên tố hoá học có bao nhiêu chu kì nhỏ ? A. 1 B. 2 C. 3 D. 4
Câu 17. Chu kì là dãy nguyên tố có cùng A. số lớp electron.
B. số electron hóa trị. C. số proton.
D. số điện tích hạt nhân.
Câu 18. Trong bảng tuần hoàn hiện nay, số chu kì nhỏ (ngắn) và chu kì lớn (dài) là A. 3 và 3. B. 3 và 4. C. 4 và 3. D. 3 và 6.
Câu 19. Số nguyên tố thuộc chu kỳ 2 là A. 8 B. 18 C. 32 D. 50
Câu 20. Trong bảng tuần hoàn, chu kỳ nhỏ là A. chu kì 1 B. chu kì 2 C. chu kì 3 D. chu kỳ 1, 2, 3.
Câu 21. Chu kì chứa nhiều nguyên tố nhất trong bảng tuần hoàn hiện nay với số lượng nguyên tố là A. 18. B. 28. C. 32. D. 24.
Câu 22. Các nguyên tố ở chu kì 6 có số lớp electron là A. 4 B. 5 C. 6 D. 7
Câu 23. Số nguyên tố của chu kì 3 và 5 là A. 8 và 18 B. 8 và 8 C. 18 và 32 D. 8 và 32
Câu 24. Khối các nguyên tố p gồm các nguyên tố: A. nhóm IA và IIA.
B. nhóm IIIA đến nhóm VIIIA (trừ He).
C. nhóm IB đến nhóm VIIIB.
D. xếp ở hai hàng cuối bảng.
Câu 25. Các nguyên tố s thuộc nhóm nào trong bảng tuần hoàn ? A. IA. B. IIA. C. IIIA. D. IA, IIA.
Câu 26. Các nguyên tố p thuộc nhóm nào trong bảng tuần hoàn ? A. IVA, VA. B. VA, VIA. C. VIA, VIIA, VIIIA.
D. IIIA, IVA, VA, VIA, VIIA, VIIIA.
Câu 27. Các nguyên tố nhóm A trong bảng hệ thống tuần hoàn là A. các nguyên tố s. B. các nguyên tố p.
`C. các nguyên tố s và các nguyên tố p. D. các nguyên tố d.
Câu 28. Các nguyên tố họ d và f (nhóm B) đều là
A. Kim loại điển hình. B. Kim loại. C. Phi kim.
D. Phi kim điển hình
Câu 29. Trong BTH, nhóm các nguyên tố kim loại điển hình là A. IIIA B. IIA C. IA D. IV A
Câu 30. Trong BTH nhóm các nguyên tố phi kim điển hình là A. VIA B. VA C. IVA D. VIIA
Câu 31. Số thứ tự của nhóm A cho biết:
A. số hiệu nguyên tử.
B. số electron hoá trị của nguyên tử.
C. số lớp electron của nguyên tử.
D. số electron trong nguyên tử
Câu 32. Chỉ ra nội dung sai khi nói về các nguyên tố trong cùng một nhóm:
A. Có tính chất hoá học gần giống nhau.
B. Nguyên tử của chúng có cấu hình electron tương tự nhau.
C. Nguyên tử của chúng có số electron hoá trị bằng nhau.
D. Được sắp xếp thành một hàng.
Câu 33. Trừ chu kì 1, các chu kì khác bắt đầu từ loại nguyên tố nào và kết thúc ở loại nguyên tố nào ?
Đầu chu kì – cuối chu kì ?
A. kim loại kiềm thổ - khí hiếm
B. kim loại kiềm thổ - halogen
C. kim loại kiềm – khí hiếm
D. kim loại kiềm – halogen
Câu 34. Phát biểu nào sau đây là không đúng?
A. Trong chu kì, các nguyên tố được sắp xếp theo chiều điện tích hạt nhân tăng dần
B. Trong chu kì, các nguyên tố được sắp xếp theo chiều số hiệu nguyên tử tăng dần
C. Nguyên tử của các nguyên tố trong cùng một chu kì có số electron bằng nhau
D. Chu kì thường được bắt đầu là một kim loại kiềm, kết thúc là một khí hiếm MỨC ĐỘ HIỂU
Câu 1. Nguyên tố ở vị trí nào trong bảng tuần hoàn thì có cấu hình electron hóa trị là 4s1?
A. Chu kì 1, nhóm IVA.B. Chu kì 1, nhóm IVB.C. Chu kì 4, nhóm IB. D. Chu kì 4, nhóm IA.
Câu 2. Nguyên tố ở chu kì 5, nhóm VIIA có cấu hình electron hóa trị là A. 4s24p5 B.4d45s2 C. 5s25p5 D. 7s27p3
Câu 3. Nguyên tố ở vị trí nào trong bảng tuần hoàn thì có cấu hình electron hóa trị 4d25s2?
A. Chu kì 4, nhóm VB B. Chu kì 4, nhóm IIA C. Chu kì 5, nhóm IIA D. Chu kì 5, nhóm IVB
Câu 4. Nguyên tố ở chu kì 4, nhóm VIB có cấu hình electron hóa trị là A. 4s24p4. B. 6s26p2. C. 3d54s1. D. 3d44s2.
Câu 5. Chọn phát biểu không đúng.
A. Nguyên tử của các nguyên tố trong cùng chu kì đều có số lớp e bằng nhau.
B. Tính chất hóa học của các nguyên tố trong chu kì không hoàn toàn giống nhau.
C. Nguyên tử của các nguyên tố trong cùng nhóm có số e lớp ngoài cùng bằng nhau.
D. Tính chất hóa học của các nguyên tố trong cùng nhóm bao giờ cũng giống nhau.
Câu 6. Nguyên tử một nguyên tố có cấu hình elctron là 1s22s22p63s23p6. Vị trí nguyên tố trong BTH là
A. chu kỳ 6, nhóm IIIA B. chu kỳ 3, nhóm VIA C. chu kỳ 3, nhóm VIIIA D. chu kỳ 2, nhóm VIA
Câu 7. Nguyên tố có cấu hình electron nguyên tử là 1s22s22p63s1 thuộc nhóm và chu kì nào sau đây?
A. Nhóm IIIA, chu kì 1 B. Nhóm IA, chu kì 3 C. Nhóm IIA, chu kì 6 D. Nhóm IA, chu kì 4
Câu 8. Một nguyên tố có cấu hình electron nguyên tử là 1s22s22p63s23p1. Vị trí của nguyên tố đó trong bảng tuần hoàn là
A. nhóm IIIA, chu kì 3 B. nhóm IA, chu kì 3 C. nhóm IIA, chu kì 6 D. nhóm IIA, chu kì 7
Câu 9. Nguyên tố có STT trong BTH là 24. Cấu hình electron của nguyên tố đó là A. 1s22s22p63s23p63d6
B. 1s22s22p63s23p64s23d4
C. 1s22s22p63s23p63d44s2
D. 1s22s22p63s23p63d54s1
Câu 10. Nguyên tử 1 nguyên tố có cấu hình electron lớp ngoài cùng là 3s23p2. Vị trí nguyên tố đó trong BTH là
A. chu kỳ 2, nhóm IIA
B. chu kỳ 3, nhóm IIA
C. chu kỳ 3, nhóm IVA
D. chu kỳ 2, nhóm IVA
Câu 11. Nguyên tố X ở nhóm VIIA, chu kỳ 4. Điện tích hạt nhân của X là A. 35 B. 35+ C. 33 D. 33+
Câu 12. Nguyên tử của nguyên tố X có cấu hình electron 1s22s22p63s23p63d54s2 có vị trí trong BTH là
A. chu kỳ 4, nhóm IIA
B. chu kỳ 3, nhóm IVA
C. chu kỳ 4, nhóm VIIB
D. chu kỳ 4, nhóm VIIA
Câu 13. Nguyên tố X nằm ở ô thứ 26 của bảng tuần hoàn, vị trí của nguyên tố X trong bảng tuần hoàn là vị trí nào sau đây?
A. Chu kì 3, nhóm VIIIB
B.Chu kì 4, nhóm VIIIA
C. Chu kì 4, nhóm VIIIB
D.Chu kì 3, nhóm VIIIA
Câu 14. Nguyên tử của nguyên tố R có 3 electron thuộc phân lớp 3d. Vị trí của nguyên tố R trong bảng
tuần hoàn là vị trí nào sau đây?
A. Ô 23, chu kì 4, nhóm VB.
B. Ô 25, chu kì 4, nhóm VB.
C. Ô 24, chu kì 4, nhóm VIB.
D. Ô 21, chu kì 3, nhóm IIIB.
Câu 15. Nguyên tử X có phân lớp electron ngoài cùng là 3p4. Hãy chỉ ra câu sai sau đây khi nói về nguyên tử X.
A. Lớp ngoài cùng của nguyên tử X có 6 electron.
B. Hạt nhân nguyên tử X có 16 proton.
C. Trong bảng tuần hoàn, X nằm ở chu kì 3.
D. Trong bảng tuần hoàn, X nằm ở nhóm IVA.
Câu 16. Nguyên tắc sắp xếp các nguyên tố vào bảng tuần hoàn:
(a) Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
(b) Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp vào cùng một hàng.
(c) Các nguyên tố có cùng số electron hóa trị được xếp vào một cột.
(d) Số thứ tự của ô nguyên tố bằng số hiệu nguyên tử của nguyên tố đó. Số nguyên tắc đúng là A. 1 B. 2 C. 3 D. 4
Câu 17. Trong các mệnh đề sau:
(1). Nhóm B gồm các nguyên tố thuộc chu kì nhỏ và chu kì lớn.
(2). BTH gồm 4 chu kì và 8 nhóm.
(3). Nhóm A chỉ gồm các nguyên tố thuộc chu kì lớn.
(4). Các nguyên tố d và f còn được gọi là các nguyên tố kim loại chuyển tiếp.
Số mệnh đề phát biểu đúng là A. 3 B. 2 C. 1 D. 4
Câu 18. Cho các phát biểu sau:
(a) Bảng tuần hoàn có 7 chu kì, trong đó có 3 chu kì nhỏ và 4 chu kì lớn.
(b) Bảng tuần hoàn có 8 nhóm, số thứ tự của nhóm bằng số electron lớp ngoài cùng.
(c) Các nhóm A có số electron lớp ngoài cùng bằng số thứ tự của nhóm.
(d) Các nguyên tố s và p thuộc về các nhóm A.
(e) Các chu kì nhỏ (1, 2, 3) bao gồm các nguyên tố s, p. Số phát biểu đúng: A. 5 B. 2 C. 3 D. 4
Câu 19. Phát biểu nào sao đây không đúng:
A. Tất cả các nguyên tố nhóm IIB đều có 2 electron hóa trị.
B. Tất cả các nguyên tố nhóm VIIB đều có 7 electron hóa trị.
C. Tất cả các nguyên tố nhóm VIIIB đều có 8 electron hóa trị.
D. Tất cả các nguyên tố nhóm IB đều có 1 electron hóa trị
Câu 20. Cho các phát biểu sau:
(1). Các nguyên tố được sắp xếp theo chiều tăng dần của khối lượng nguyên tử.
(2). Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân.
(3). Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng.
(4). Các nguyên tố có cùng số electron hoá trị trong nguyên tử được xếp thành một cột.
(5). Các nguyên tố trong bảng tuần hoàn do Mendeleev công bố được sắp xếp theo chiều tăng dần bán kính nguyên tử.
(6). Nguyên tử của các nguyên tố trong cùng chu kì đều có số lớp e bằng nhau.
(7). Tính chất hóa học của các nguyên tố trong chu kì không hoàn toàn giống nhau.
(8). Nguyên tử của các nguyên tố trong cùng phân nhóm có số e lớp ngoài cùng bằng nhau.
(9). Tính chất hóa học của các nguyên tố trong cùng nhóm bao giờ cũng giống nhau.
Số phát biểu không đúng là A. 2 B. 3 C. 4 D. 5
*TOÁN XÁC ĐỊNH TÊN NGUYÊN TỐ DỰA CẤU TẠO NGUYÊN TỬ VÀ BẢNG TUẦN HOÀN
Câu 1. Nguyên tử của nguyên tố X có tổng số hạt proton, nơtron, electron là 52. Trong hạt nhân
nguyên tử X có số hạt không mang điện nhiều hơn số hạt mang điện là 1. Vị trí (chu kỳ, nhóm) của X
trong bảng tuần hoàn các nguyên tố hóa học là
A. chu kỳ 3, nhóm VA.
B. chu kỳ 2, nhóm VA.
C. chu kỳ 2, nhóm VIIA.
D. chu kỳ 3, nhóm VIIA.
Câu 2. Cho hai nguyên tố X và Y cùng nhóm ở hai chu kì kế tiếp nhau trong bảng tuần hoàn, tổng số
điện tích hạt nhân của hai nguyên tố là 32. Biết rằng nguyên tử khối của mỗi nguyên tố đều gấp hai trị
số điện tích hạt nhân nguyên tử của mỗi nguyên tố. X và Y là nguyên tố nào sau đây? A. Ca và Sr B. Mg và Ca C. Sr và Ba D. Na và K
Câu 3. Hai nguyên tố X, Y ở hai nhóm A liên tiếp trong bảng tuần hoàn. X thuộc nhóm V. Ở trạng thái
đơn chất X và Y không phản ứng với nhau. Tổng số proton trong hạt nhân của X và Y bằng 23. Hai nguyên tố X, Y là A. N, O. B. N, S. C. P, O. D. P, S.
Câu 4. A, B đứng kế tiếp nhau trong một chu kì của bảng tuần hoàn có tổng số đơn vị điện tích hạt nhân là 25. A, B là A. Li, Be. B. Mg, Al. C. K, Ca. D. Na, K.
Câu 5. A, B là hai nguyên tố cùng phân nhóm trong bảng tuần hoàn. Tổng số proton trong hai hạt nhân
nguyên tử A và B là 22. A, B có thể là A. Li và Na B. O và S C. N và P D. B, C đều đúng
Câu 6. Hai nguyên tố X và Y la hai nguyên tố ở hai nhóm A kế tiếp nhau có tổng điện tích dương bằng
23 và cùng thuộc một chu kì. X và Y là: A. N và S B. Si và F C. O và P D. Na và Mg
Câu 7. X và Y là 2 nguyên tố ở 2 phân nhóm kế tiếp nhau có tổng số proton bằng 23 (ZX < ZY). Có bao
nhiêu cặp X và Y thỏa mãn điều kiện trên A. 2 B. 3 C. 4 D. 5
Câu 8. X và Y là hai nguyên tố thuộc hai nhóm A kế tiếp nhau trong bảng tuần hoàn, ở trạng thái đơn
chất X và Y phản ứng được với nhau. Tổng số proton trong hạt nhân nguyên tử của X và Y 23. Biết
rằng X đứng sau Y trong bảng tuần hoàn. X là A. O B. S C. Mg D. P
Câu 9. X và Y là hai nguyên tố thuộc cùng một chu kì và thuộc hai nhóm A liên tiếp. Số proton của
nguyên tử Y nhiều hơn số proton của nguyên tử X. Tổng số hạt proton của nguyên tử X và Y là 33.
Nhận xét nào sau đây về X và Y là đúng
A. Đơn chất X là chất khí ở điều kiện thường
B. Độ âm điện của X lớn hơn độ âm điện của Y
C. Lớp ngoài cùng của nguyên tử Y (ở trạng thái cơ bản) có 5 electron
D. Phân lớp ngoài cùng của nguyên tố X (ở trạng thái cơ bản) có 4 electron
Câu 10. Hai nguyên tố X và Y thuộc hai nhóm A kế tiếp nhau trong một chu kỳ có tổng số proton
trong hai hạt nhân nguyên tử là 51. Số hiệu nguyên tử của X, Y lần lượt là
A. X (Z = 25), Y(Z = 26)
B. X (Z = 20), Y (Z = 31)
C. X (Z = 21), Y (Z = 30)
D. X (Z = 22), Y(Z = 29)
Câu 11. X và Y là hai nguyên tố kế tiếp nhau trong cùng một nhóm A của bảng tuần hoàn. Biết rằng
tổng số electron trong nguyên tử X và Y là 30, số electron của X nhỏ hơn số electron của Y. Phát biểu nào sau đây là sai?
A. X thuộc chu kì nhỏ và Y thuộc chu kì lớn của bảng tuần hoàn.
B. X và Y đều là những kim loại.
C. X và Y đều đứng đầu mỗi chu kì trong bảng tuần hoàn.
D. X và Y đều có cùng số lớp electron bão hòa. TÍNH CHẤT MỨC ĐỘ BIẾT
Câu 2. Cho 4 nguyên tố sau: K, Mg, Al, Na. Hãy sắp xếp theo chiều tính kim loại giảm dần. A. Na. Mg. K. Al. B. Na. K. Mg. Al. C. K. Na. Al. Mg. D. K. Na. Mg. Al.
Câu 3. Dãy nguyên tố sắp xếp theo chiều tính phi kim giảm dần A. Cl. F. S. P. B. Cl. S. P. S. C. F. Cl. S. P. D. P. S. Cl. S.
Câu 4. Trong các hợp chất oxit sau, oxit nào có tính axit mạnh nhất? A. SiO2 B. Na2O C. P2O5 D. Cl2O7
Câu 5. Trong các hợp chất oxit sau, hợp chất nào có tính bazơ mạnh nhất? A. Na2O B. Al2O3 C. MgO D. SiO2
Câu 6. Nguyên tử của nguyên tố nào sau đây có độ âm điện nhỏ nhất? A. I B. Cl C. F D. Br
Câu 8. Nhóm nguyên tố nào mà hợp chất oxit có hóa trị cao nhất ứng với công thức chung là X2O3? A. Nhóm IA B. Nhóm IIA C. Nhóm VA D. Nhóm IIIA
Câu 9. Nguyên tử của các nguyên tố kim loại kiềm có cấu hình electron lớp ngoài cùng là A. ns1 B. ns2 C. ns2np2 D. ns2np5
Câu 10. M là nguyên tố nhóm IA, oxit của nó có công thức hóa học là A. MO B. M2O C. MO2 D. M2O3
Câu 11. Kim loại nào sau đây là kim loại kiềm? A. Al. B. Li. C. Ca. D. Mg.
Câu 12. Nguyên tố R thuộc chu kì 3, nhóm VIIA của bảng tuần hoàn các nguyên tố hóa học. Công
thức oxit cao nhất của R là A. RO3. B. R2O7. C. R2O3. D. R2O.
Câu 13. Cấu hình electron nguyên tử nào là của nguyên tố kim loại chuyển tiếp? A. 1s22s2 B. 1s22s22p63s2 C. 1s22s22p63s23p64s2
D. 1s22s22p63s23p63d64s2
Câu 14. Kim loại hoạt động mạnh nhất ở vị trí nào trong bảng tuần hoàn? A. Ở đầu nhóm IA B. Ở cuối nhóm IA
C. Ở đầu nhóm VIIA
D. Ở cuối nhóm VIIA
Câu 15. Theo quy luật biến đổi tính chất của các đơn chất trong bảng tuần hoàn thì
A. phi kim mạnh nhất là iot.
B. kim loại mạnh nhất là Li.
C. phi kim mạnh nhất là oxi.
D. phi kim mạnh nhất là flo.
Câu 16. Đại lượng đặc trưng cho khả năng hút electron của nguyên tử các nguyên tố khi hình thành liên kết hoá học là A. Tính kim loại. B. Tính phi kim.
C. Điện tích hạt nhân. D. Độ âm điện.
Câu 17. Nguyên nhân của sự biến đổi tuần hoàn tính chất của các nguyên tố là sự biến đổi tuần hoàn
A. của điện tích hạt nhân.
B. của số hiệu nguyên tử.
C. cấu hình electron lớp ngoài cùng của nguyên tử.
D. cấu trúc lớp vỏ electron của nguyên tử.
Câu 18. Tính chất hóa học các nguyên tố được xác định trước tiên bằng:
A. Vị trí của nguyên tố trong BTH
B. Điện tích hạt nhân nguyên tử.
C. khối lượng nguyên tử
D. Cấu hình của lớp electron hóa trị.
Câu 19. Nguyên nhân của sự giống nhau về tính chất hoá học của các nguyên tố trong cùng một nhóm A là sự giống nhau về
A. số lớp electron trong nguyên tử.
B. số electron lớp ngoài cùng của nguyên tử.
C. số electron trong nguyên tử.
D. Cả A, B,C đều đúng.
Câu 20. Mệnh đề nào sau đây phát biểu đúng ?
A. Trong một nhóm chính, nguyên tử hai nguyên tố thuộc hai chu kì liên tiếp hơn kém nhau một lớp electron.
B. Nguyên tử của các nguyên tố trong một chu kì bao giờ cũng có số electron thuộc lớp ngoài cùng bằng nhau.
C. Số thứ tự của nhóm B bằng số electron ở lớp ngoài cùng của nguyên tử nguyên tố trong nhóm đó.
D. Các nguyên tố trong cùng một nhóm có tính chất hóa học giống nhau.
Câu 21. Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân thì
A. tính kim loại giảm dần, tính phi kim tăng dần.
B. tính kim loại tăng dần, tính phi kim giảm dần.
C. tính kim loại với tính phi kim đều giảm dần.
D. tính kim loại với tính phi kim đều tăng dần.
Câu 22. Chỉ ra nội dung đúng, khi nói về sự biến thiên tính chất của các nguyên tố trong cùng chu kì
theo chiều tăng dần của điện tích hạt nhân
A. Tính kim loại tăng dần.
B. Tính phi kim tăng dần.
C. Bán kính nguyên tử tăng dần.
D. Số lớp electron trong nguyên tử tăng dần.
Câu 23. Các nguyên tố trong cùng một nhóm A, theo chiều tăng của điện tích hạt nhân thì
A. tính kim loại tăng dần, đồng thời tính phi kim giảm dần.
B. tính kim loại giảm dần, đồng thời tính phi kim tăng dần.
C. tính kim loại và tính phi kim đồng thời tăng dần.
D. tính kim loại và tính phi kim đồng thời giảm dần.
Câu 24. Trong một chu kì đi từ trái sang phải theo chiều tăng dần của điện tích hạt nhân thì:
A. tính bazo và tính axit của các hidroxit tương ứng giảm dần.
B. tính bazo và tính axit của các hidroxit tương ứng tăng dần.
C. các hidroxit có tính bazơ giảm dần và tính axit tăng dần.
D. các hidroxit có tính bazơ tăng dần, tính axit giảm dần. MỨC ĐỘ HIỂU
Câu 1. Trong các hiđroxit dưới đây, chất nào có tính axit mạnh nhất? A. H2SO4. B. H2SeO4. C.HClO4. D. HBrO4.
Câu 2. Trong các hợp chất hiđroxit cao nhất của nguyên tố sau thì hợp chất nào có tính axit yếu nhất? A. Al(OH)3 B. H3PO4 C. H2SiO3 D. H2SO4
Câu 3. Sắp xếp theo chiều tăng dần tính bazơ của các hiđroxit sau?
A. NaOH < Al(OH)3< Mg(OH)2
B. Al(OH)3< Mg(OH)2< NaOH
C. Mg)OH)2< NaOH < Al(OH)3
D. Mg(OH)2< Al(OH)3< NaOH
Câu 4. Có các nhận định sau:
(1) Các nguyên tố trong cùng một nhóm có tính chất hoá học cơ bản giống nhau.
(2) Bắt đầu một chu kỳ bao giờ cũng là 1 kim loại kiềm và kết thúc bằng 1 khí hiếm (trừ dãy 1).
(3) Các nguyên tử các nguyên tố có cùng số lớp electron được xếp cùng 1 chu kỳ.
(4) Các nguyên tử của nguyên tố trong cùng 1 nhóm có số electron bằng nhau Chọn nhận định đúng. A. 1, 2, 3, 4 B. 2, 3, 4 C. 1, 2, 3 D. 1, 2, 4
Câu 5. Độ âm điện là đại lượng đặc trưng cho khả năng của nguyên tử
A. hút e khi tạo liên kết hoá học.
B. đẩy e khi tạo thành liên kết hoá học.
C. tham gia các phản ứng hóa học.
D. nhường hoặc nhận e khi tạo liên kết.
Câu 6. Sắp xếp theo chiều tăng dần độ âm điện
A. K < Na < Mg < Al B. Na < K < Mg < Al C. Al < Mg < Na < K
D. Na < Mg < Al < K
Câu 7. Nguyên tố M thuộc chu kỳ 3 nhóm VIIA của bảng tuần hoàn. Công thức oxit cao nhất và công
thức hợp chất với hiđro của nguyên tố M là công thức nào sau đây? A. M2O3 và MH3 B. MO3 và MH2 C. M2O7 và MH D. M2O và MH7 .
Câu 8. Cho nguyên tố A (Z = 13); B (Z = 16). Chọn nhận định đúng.
A. Tính kim loại của A > B
B. Bán kính nguyên tử của A > B
C. Độ âm điện của A < B
D. Cả A, B và C đều đúng.
Câu 9. Cho các nguyên tố M (Z = 11), X (Z = 17), Y (Z = 9) & R (Z = 19). Độ âm điện của các
nguyên tố tăng dần theo thứ tự
A. M < X < Y < R
B. R < M < X < Y
C. Y < M < X < R
D. M < X < R < Y
Câu 10. Cho các nguyên tố: K (Z = 19), N (Z = 7), Si (Z = 14), Mg (Z = 12). Dãy gồm các nguyên tố
được sắp xếp theo chiều giảm dần bán kính nguyên tử từ trái sang phải là A. N, Si, Mg, K. B. K, Mg, Si, N C. K, Mg, N, Si. D. Mg, K, Si, N.
Câu 11. Bán kính nguyên tử của các nguyên tố: 3Li, 8O, 9F, 11Na được xếp theo thứ tự tăng dần từ trái sang phải là A. F, O, Li, Na. B. F, Na, O, Li. C. F, Li, O, Na. D. Li, Na, O, F.
Câu 12. Dãy các nguyên tố sắp xếp theo chiều tăng dần tính phi kim từ trái sang phải là A. P, N, F, O. B. N, P, F, O. C. P, N, O, F. D. N, P, O, F.
Câu 16. Các kim loại X, Y, Z có cấu hình electron nguyên tử lần lượt là: 1s22s22p63s1; 1s22s22p63s2;
1s22s22p63s23p1. Dãy gồm các kim loại xếp theo chiều tăng dần tính khử từ trái sang phải là A. Z, Y, X. B. X, Y, Z. C. Y, Z, X. D. Z, X, Y.
Câu 18. Cho cấu hình electron nguyên tử của 3 nguyên tố X, Y, Z lần lượt là: 1s22s22p63s1;
1s22s22p63s23p64s1; 1s22s22p63s23p1. Nếu sắp xếp theo chiều tăng dần tính kim loại thì cách sắp xếp nào sau đây đúng? A. Z < X < Y B. Z < Y < X C. Y < Z < X D. X < Z < Y
Câu 19. Cho các nguyên tố X, Y, Z có số hiệu nguyên tử lần lượt là 6, 9, 17. Nếu sắp xếp các nguyên
tố theo thứ tự tính phi kim tăng dần thì dãy sắp xếp nào sau đây là đúng? A. Z < X < Y B. X < Y < Z C. X < Z < Y D. Y < Z < X
Câu 20. Nguyên tử X có cấu hình electron 1s22s22p5 thì ion tạo ra từ X sẽ có cấu hình electron nào sau đây? A. 1s22s22p4 B. 1s22s22p63s2 C. 1s22s22p6
D. Tất cả đều sai.
Câu 21. Trong bảng tuần hòan các nguyên tố hóa học, nguyên tố X ở nhóm IIA, nguyên tố Y ở nhóm
VA. Công thức của hợp chất tạo thành từ 2 nguyên tố trên có dạng là A. X2Y5 B. X3Y2 C. X2Y3 D. X5Y2
Câu 22. X và Y là hai nguyên tố thuộc cùng một chu kỳ, hai nhóm A liên tiếp. Số proton của nguyên
tử Y nhiều hơn số proton của nguyên tử X. Tổng số hạt proton trong nguyên tử X và Y là 33. Nhận xét
nào sau đây về X, Y là đúng?
A. Tính phi kim của X lớn hơn tính phi kim của Y.
B. Đơn chất X là chất khí ở điều kiện thường.
C. Lớp ngoài cùng của nguyên tử Y (ở trạng thái cơ bản) có 5 electron.
D. Phân lớp ngoài cùng của nguyên tử X (ở trạng thái cơ bản) có 4 electron.
Câu 23. Cho các tính chất và đặc điểm cấu tạo nguyên tử của các nguyên tố hóa học:
(a) Hóa trị cao nhất đối với oxi (b) khối lượng nguyên tử (c) số electron thuộc lớp ngoài cùng. (d) tính phi kim (e) số lớp electron (g) tính kim loại
Những tính chất biến đổi tuần hoàn cùng chiều theo chiều tăng dần của điện tích hạt nhân nguyên tử trong một chu kì là A. e, h, c B. a, c, e C. a, c, d D. g, h, e
Câu 24. Phát biểu nào sau đây đúng?
A. Nguyên tử nguyên tố M có cấu hình e lớp ngoài cùng là 4s1 vậy M thuộc chu kì 4, nhóm IA
B. X có cấu hình e nguyên tử là ns2np5 (n>2) công thức hiđroxit ứng với oxit cao nhất là của X là HXO4
C. Điện tích hạt nhân bằng số proton và bằng số electron có trong nguyên tử
D. Hạt nhân của tất cả các nguyên tử đều có proton và nơtron
* TOÁN DỰA VÀO % KHỐI LƯỢNG CÁC NGUYÊN TỐ
Câu 1. Công thức phân tử của hợp chất khí tạo bởi nguyên tố R & hiđro là RH3. Trong oxit mà R có
hóa trị cao nhất thì oxi chiếm 74,07% về khối lượng. Nguyên tố R là A. S. B. As. C. N. D. P.
Câu 2. Nguyên tử của nguyên tố X có cấu hình electron lớp ngoài cùng là ns2np4. Trong hợp chất khí
của nguyên tố X với hiđro, X chiếm 94,12% khối lượng. Phần trăm khối lượng của nguyên tố X trong oxit cao nhất là A. 50% B. 27,27% C. 60% D. 40%
Câu 3. Nguyên tố Y là phi kim thuộc chu kỳ 3, có công thức oxit cao nhất là YO3. Nguyên tố Y tạo với
kim loại M hợp chất có công thức MY, trong đó M chiếm 63,64% về khối lượng. Kim loại M là A. Mg B. Z n C. Fe D. Cu
Câu 4. Oxit cao nhất của 1 nguyên tố là RO3, trong hợp chất khí với hidro thì % về khối lượng của H
trong hợp chất trên là 5,88%. Vậy công thức của hợp chất khí với hidro là A. NH3 B. H2S B. H2Se D. H2Te
Câu 5. Ôxít cao nhất của 1 nguyên tố RO2, hợp chất của nó với H chứa 12,5% H về khối lượng. Nguyên tố đó là A. C B. H C. Si D. P
Câu 6. Nguyên tố R có hợp chất với hidro là RH4. oxit cao nhất của nguyên tố chứa 72,73% oxi về
khối lượng. Công thức hợp chất khí với hidro và oxit là A. SiH4, SiO B. SnH4, SnO2 C. PbH4, PbO2 D. CH4, CO2
Câu 7. Công thức oxit cao nhất của một nguyên tố có dạng R2O5, thành phần % của nó trong hợp chất
khí với hiđrô chiếm 91,176%. Tên của R là A. Nitơ B. Photpho C. Asen D. Bitmut
Câu 8. Nguyên tố R chiếm 38,79% về khối lượng trong oxit cao nhất. Biết R thuộc nhóm VIIA. Vậy R là A. Clo B. Brom C. Iot D. Flo
Câu 9. Oxit cao nhất của một nguyên tố ứng với công thức R2O5, hợp chất của nó với hiđro có 8,82%H. Vậy R là A. Nitơ B. Photpho C. Asen D. Bitmut
Câu 10. Một nguyên tố R có oxit bậc cao nhất là RO2. Trong hợp chất khí với hiđro, R chiếm 87,5%
về khối lượng. Tên của R là A. Silic B. Cacbon C. Chì D. Gecmani
Câu 11. Một nguyên tố X ở nhóm VIA. Oxit cao nhất của X có khối lượng mol phân tử 80 g/mol. Tên nguyên tố X là A. Lưu huỳnh B.Selen C. Telu D. Oxi
Câu 12. Một nguyên tố R có oxit bậc cao nhất là R2O5. Hợp chất khí với hiđrô của R có 17,65% khối lượng hiđrô. Vậy R là A. Nitơ B. Photpho C. Asen D. Bitmut
Câu 13. Một nguyên tử R có hợp chất với hiđrô là RH2. Trong đó, hiđrô chiếm 4,76% khối lượng.
Nguyên tử của nguyên tố R có số hạt mang điện gấp đôi số hạt không mang điện. Tên của R là A. Ca B. S C. Se D. Mg
Câu 14. Oxit cao nhất của nguyên tố nhóm VA có tỉ lệ khối lượng mX:m0 = 3,5:10. Nguyên tố đó là A. P B. As C. Sb D. N
Câu 15. Hidroxít cao nhất của một nguyên tố R có dạng HRO4. R cho hợp chất khí với hidro chứa
2,74% hiđro theo khối lượng. Vậy R là nguyên tố nào sau đây? A. Photpho B. Clo C. Brom D. Iot.
Câu 16. Hợp chất với hiđro của nguyên tố có công thức XH3. Biết % về khối lượng của oxi trong oxit
cao nhất của X là 56,34%. Nguyên tử khối của X là A.14. B. 31. C. 32. D. 52.
* TOÁN DỰA VÀO PHƯƠNG TRÌNH PHÀN ỨNG
Câu 1. Cho 1,67 gam hỗn hợp gồm hai kim loại ở hai chu kì liên tiếp thuộc nhóm IIA tác dụng hết với
dung dịch HCl (dư), thoát ra 0,672 lít khí H2 (đktc). Hai kim loại đó là A. Be & Mg B. Mg & Ca C. Ca & Sr D. Sr & Ba
Câu 2. Hòa tan hoàn toàn 6,645 gam hỗn hợp muối clorua của hai kim loại kiềm thuộc hai chu kì kế
tiếp nhau vào nước được dung dịch X. Cho toàn bộ dung dịch X tác dụng hoàn toàn với dung dịch
AgNO3 (dư), thu được 18,655 gam kết tủa. Hai kim loại kiềm trên là A. Na & K B. K & Rb C. Rb & Cs D. Li & Na
Câu 3. Khi hòa tan hoàn toàn m gam mỗi kim loại vào nước dư, từ kim loại nào sau đây thu được
thể tích khí H2 (cùng điều kiện nhiệt độ và áp suất) là nhỏ nhất? A. Ca B. Li C. Na D. K
Câu 4. Hòa tan hết một lượng hỗn hợp gồm K và Na vào H2O dư, thu được dung dịch X và 0,672 lít
khí H2 (đktc). Cho X vào dung dịch FeCl3 dư, đến khi phản ứng xảy ra hoàn toàn, thu được m gam
kết tủa. Giá trị của m là A. 2,14 B. 1,07 C. 3,21 D. 6,42
Câu 5. Hòa tan hết 4,68 gam kim loại kiềm M vào H2O dư, thu được 1,344 lít khí H2 (đktc). Kim loại M là A. Na B. K C. Li D. Rb
Câu 6. Hỗn hợp X gồm hai muối cacbonat của 2 kim loại kiềm thổ ở hai chu kì liên tiếp. Cho 7,65
gam X vào dung dịch HCl dư. Kết thúc phản ứng, cô cạn dung dịch thì thu được 8,75 gam muối khan. Hai kim loại đó là A. Mg và Ca B. Ca và Sr C. Be và Mg D. Sr và Ba
Trường THCS&THPT Tân Tiến Tổ Hoá – sinh – CN
CHỦ ĐỀ 3: LIÊN KẾT HOÁ HỌC
BÀI DẠY: QUY TẮC OCTET
Thời lượng: 1 tiết I. MỤC TIÊU 1. Năng lực hoá học:
Năng lực nhận thức hoá học: Trình bày và vận dụng được quy tắc octet trong quá trình hình
thành liên kết hoá học cho các nguyên tố nhóm A. 2. Năng lực chung
Năng lực giao tiếp hợp tác: Sử dụng ngôn ngữ khoa học để diễn đạt về quy tắc octet. 3. Phẩm chất
Trách nhiệm: Tích cực, tự giác và nghiêm túc rèn luyện, thực hiện nhiệm vụ học tập.
II. THIẾT BỊ VÀ HỌC LIỆU
Hình ảnh về sự hình thành liên kết của các nguyên tử H2, F2, N2, ion Na+, Cl-
III. TIẾN TRÌNH DẠY HỌC
Hoạt động 1 : Mở đầu (10 phút)
a. Mục tiêu: Giúp HS xác định được nhiệm vụ tìm hiểu về sự hình thành liên kết giữa các nguyên tử, quy tắc octet.
b. Nội dung: HS trả lời các câu hỏi dẫn dắt của GV về sự hình thành liên kết giữa các nguyên tử c. Sản phẩm:
Câu 1: Cấu hình của H: 1s1; He: 1s2
Câu 2: Vì cầu hình của He là cấu hình bền vững của khí hiếm
d. Tổ chức thực hiện:
* Chuyển giao nhiệm vụ: Yêu cầu HS quan sát hình và trả lời câu hỏi:
Câu 1. Hãy viết cầu hình electron của nguyên tử H và He
Câu 2. Vì sao nguyên tử helium luôn tồn tại độc lập, còn nguyên tử hydrogen lại kết hợp với nhau?
* Thực hiện nhiệm vụ: HS hoạt động cá nhân và trả lời câu hỏi
* Báo cáo và thảo luận:
GV gọi ngẫu nhiên HS lên bảng viết cấu hình electron cho câu 1
GV gọi HS xung phong trả lời cho câu 2
* Kết luận, nhận định, định hướng:
GV nhận xét câu trả lời của HS
GV dẫn dắt HS để vào bài: Khi hình thành liên kết, nguyên tử của các nguyên tố có xu hướng
hình thành lớp vỏ bền vững như của khí hiếm
GV định hướng những nội dung sẽ tìm hiểu trong bài học
Hoạt động 2: Hình thành kiến thức (30 phút) a. Mục tiêu:
- Trình bày và vận dụng được quy tắc octet trong quá trình hình thành liên kết hoá học cho các nguyên tố nhóm A.
- Sử dụng ngôn ngữ khoa học để diễn đạt về quy tắc octet.
- Tích cực, tự giác và nghiêm túc rèn luyện, thực hiện nhiệm vụ học tập. 1. Liên kết hoá học
a. Mục tiêu: Trình bày và vận dụng được quy tắc octet trong quá trình hình thành liên kết hoá
học cho các phân tử H2, F2, Cl2, O2.
b. Nội dung: HS quan sát hình, hoạt động nhóm và trả lời 2 câu hỏi c. Sản phẩm:
Câu 1: Các nguyên tử hydrogen và fluorine đã có xu hướng đạt đến cấu hình electron của
nguyên tử khí hiếm helium và neon.
Câu 2: Sự tạo thành phân tử chlorine (Cl2) và oxygen (O2) từ các nguyên tử tương ứng
d. Tổ chức thực hiện:
* Chuyển giao nhiệm vụ:
- GV yêu cầu HS quan sát hình ảnh về sự hình thành các phân tử hydrogen và fluorine - Gv chia lớp thành 4 nhóm
- GV chiếu câu hỏi thảo luận lên màn hình và yêu cầu HS thảo luận 5 phút hoàn thành 2 câu hỏi:
Câu 1: Các nguyên tử hydrogen và fluorine đã có xu hướng đạt đến cấu hình electron của nguyên tử khí hiếm nào?
Câu 2: Vận dụng hình ảnh trên, em hãy giải thích sự hình thành phân tử chlorine (Cl2) và
oxygen (O2) từ các nguyên tử tương ứng
* Thực hiện nhiệm vụ: HS thảo luận nhóm hoàn thành 2 câu hỏi
* Báo cáo và thảo luận:
Đại diện nhóm lên bảng trình bày kết quả thảo luận của nhóm
Các nhóm khác nhận xét, bổ sung
* Kết luận, nhận định, định hướng: GV nhận xét hoạt động của các nhóm và hướng dẫn HS kết luận nội dung
Phân tử được tạo nên từ các nguyên tử bằng các liên kết hoá học 2. Quy tắc octet
2.1. Cách vận dụng quy tắc octet trong sự hình thành phân tử nitrogen (N2)
a. Mục tiêu: Trình bày và vận dụng được quy tắc octet trong quá trình hình thành liên kết hoá học cho phân tử N2, HF.
b. Nội dung: HS quan sát hình, hoạt động cá nhân trả lời 2 câu hỏi c. Sản phẩm:
Câu 1: Mỗi nguyên tử nitrogen đã đạt được cấu hình electron bền vững của khí hiếm neon
Câu 2: Nguyên tử H và F lần lượt có 1 và 7 electron hoá trị. Để hình thành liên kết, mỗi nguyên
tử góp chung 1 electron tạo thành cặp electron chung. Nhờ đó nguyên tử H đạt được cấu hình
electron của khí hiếm He, còn nguyên tử F đạt được cấu hình electron của khí hiếm Ne như sau:
d. Tổ chức thực hiện:
* Chuyển giao nhiệm vụ: Gv chiếu hình ảnh về sự hình thành liên kết trong phân tử nitrogen
lên màn hình, yêu cầu HS quan sát và trả lời 2 câu hỏi vào phiếu học tập:
Câu 1: Từ hình ảnh, hãy cho biết mỗi nguyên tử nitrogen đã đạt được cấu hình electron bền vững của khí hiếm nào?
Câu 2: Từ những ví dụ về sự hình thành phân tử H2, F2, hãy cho biết nguyên tử của các nguyên
tố hydrogen và fluorine có xu hướng cho đi, nhận thêm hay góp chung các elctron hoá trị khi
tham gia liên kết hình thành phân tử hydrogen fluorine (HF)?
* Thực hiện nhiệm vụ: HS hoạt động cá nhân trả lời 2 câu hỏi vào phiếu học tập
* Báo cáo và thảo luận: HS ở các tổ trao đổi phiếu học tập để các bạn đánh giá chéo bài làm
của của mỗi thành viên thuộc các tổ khác nhau
* Kết luận, nhận định, định hướng:
GV nhận xét hoạt động của HS và hoạt động đánh giá các bạn của HS
GV hướng dẫn HS thêm về nội dung:
Để đạt cấu hình bền vững của khí hiếm gần nhất, nguyên tử của các nguyên tố có xu hướng
nhường, hoặc nhận thêm, hoặc góp chung các electron hoá trị với các nguyên tử khác khi tham gia liên kết hoá học.
2.2. Cách vận dụng quy tắc octet trong sự hình thành ion dương, ion âm
a. Mục tiêu: Trình bày và vận dụng được quy tắc octet trong quá trình hình thành ion dương, ion âm.
b. Nội dung: HS thảo luận nhóm hoàn thành 2 câu hỏi c. Sản phẩm:
Câu 1: Ion sodium và ion fluoride có cấu hình electron của các khí hiếm tương ứng là neon.
Câu 2: Nguyên tử lithium có 1 electron ở lớp ngoài cùng. Trong sự hình thành các liên kết hoá
học, nguyên tử lithium có xu hướng cho đi 1 electron ngoài cùng để đạt được cấu hình electron
bền vững của khí hiếm helium.
d. Tổ chức thực hiện:
* Chuyển giao nhiệm vụ:
GV chiếu hình ảnh về sự hình thành ion Na+, ion F-
Yêu cầu hS thảo luận nhóm trả lời 2 câu hỏi:
Câu 1: Ion sodium và ion fluoride có cấu hình electron của các khí hiếm tương ứng nào?
Câu 2: Trình bày sự hình thành ion lithium
* Thực hiện nhiệm vụ: HS thảo luận nhóm hoàn thành 2 câu hỏi vào phiếu học tập
* Báo cáo và thảo luận:
Gv mời đại diện 1 nhóm trình bày kết quả thảo luận nhóm.
Các nhóm trao đổi kết quả trong phiếu học tập cho các nhóm dánh giá chéo lẫn nhau.
* Kết luận, nhận định, định hướng
GV nhận xét hoạt động của các nhóm
GV hướng dẫn HS kết luận nội dung về quy tắc octet:
Quy tắc octet: trong quá trình hình thành liên kết hoá học, nguyên tử của các
nguyên tố nhóm A có xu hướng tạo thành lớp vỏ ngoài cùng có 8 electron
tương ứng với khí hiếm gần nhất (hoặc 2 electron với khí hiếm helium)
Hoạt động 3: Luyện tập (5 phút)
a. Mục tiêu: Củng cố lại những nội dung đã học.
b. Nội dung: HS hoạt động cá nhân hoàn thành các câu hỏi c. Sản phẩm: câu 1 – a; câu 2 – b
câu 3:Vì ở dạng đơn chất Na chưa đạt cấu hình electron bền vững, còn ở trong hợp chất NaCl,
ion Na+ đạt cấu hình electron bền vững của khí hiếm Ne nên khó tham gia phản ứng có sự nhường nhận electron. d. Tổ chức thực hiện:
* Chuyển giao nhiệm vụ: GV trình chiếu các câu hỏi và yêu cầu HS trả lời vào phiếu học tập gồm các câu hỏi sau:
Câu 1: Nguyên tử nitrogen và nguyên tử calcium có xu hướng nhận hay nhường lần lượt bao
nhiêu electron để đạt được cấu hình electron bền vững?
a. Nhận 3 electron, nhường 2 electron
b. Nhận 5 electron, nhường 5 electron
c. Nhường 2 elctron, nhận 3 electron
d. Nhường 3 electron, nhận 2 electron
Câu 2: Nguyên tử nguyên tố nào sau đây có xu hướng nhường đi 1 electron khi hình thành liên kết hoá học? a. carbon b. potassium c. helium d. fuorine
Câu 3: Ở dạng đơn chất, sodium (Na) rất dễ tham gia các phản ứng hoá học, nhưng muối ăn
được tạo nên từ Na và Cl lại không dễ tham gia các phản ứng mà có sự nhường hoặc nhận electron. Giải thích.
* Thực hiện nhiệm vụ: HS hoạt động cá nhân và trả lời câu hỏi
* Báo cáo và thảo luận:
HS nộp phiếu học tập cho GV
GV mời HS lần lượt trả lời các câu hỏi
* Kết luận, nhận định, định hướng:
GV nhận xét hoạt động của HS
Hướng dẫn HS chuẩn bị nội dung của phần liên kết ion.
TRƯỜNG THPT TRẦN PHÚ TỔ HÓA HỌC KHỐI 10
KẾ HOẠCH BÀI DẠY: LIÊN KẾT ION
Thời lượng: 02 tiết I. MỤC TIÊU DẠY HỌC:
Sau bài học này HS có thể: YÊU CẦU CẦN ĐẠT
Nhận thức hóa 1. Nêu được khái niệm liên kết ion. NĂNG LỰC học
2. Trình bày được sự hình thành liên kết ion (nêu một số HÓA HỌC
ví dụ điển hình tuân theo quy tắc octet).
3. Nêu được cấu tạo tinh thể NaCl.
4. Giải thích được vì sao các hợp chất ion thường ở
trạng thái rắn trong điều kiện thường (dạng tinh thể ion).
Tìm hiểu thế giới 5. Khám phá, tìm hiểu những bí ẩn của tự nhiên cũng
tự nhiên dưới góc như ứng dụng trong cuộc sống dựa trên kiến thức về liên độ hóa học kết ion.
Vận dụng kiến 6. Giải thích được cách hình thành liên kết hóa học của
thức, kĩ năng đã các hợp chất ion. học
7. Nêu được ứng dụng của các hợp chất ion.
Giải quyết vấn đề 8. Phân tích được tình huống trong học tập, trong cuộc NĂNG
LỰC và sáng tạo
sống; phát hiện và nêu được tình huống có vấn đề trong CHUNG
học tập, trong cuộc sống.
Giao tiếp và hợp 9. Biết theo dõi tiến độ hoàn thành công việc của từng tác
thành viên và cả nhóm để điều hoà hoạt động phối hợp;
biết khiêm tốn tiếp thu sự góp ý và nhiệt tình chia sẻ, hỗ
trợ các thành viên trong nhóm.
Năng lực tự chủ 10. Xác định được nhiệm vụ học tập dựa trên kết quả đã và tự học
đạt được; biết đặt mục tiêu học tập chi tiết, cụ thể, khắc phục những hạn chế. PHẨM CHẤT Trung thực
11. Thật thà, ngay thẳng trong báo cáo kết quả làm việc nhóm. Trách nhiệm
12. Tích cực, tự giác và nghiêm túc trong quá trình học tập.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
- Thiết bị dạy học
+ Thiết bị công nghệ, phần mềm: máy chiếu - Học liệu
+ Học liệu số: Video (link: http://surl.li/cfqyf)
+ Học liệu khác: Hình ảnh mô hình tinh thể; phiếu học tập số 1 và số 2.
III. TIẾN TRÌNH DẠY HỌC:
A. BẢNG TÓM TẮT CÁC HOẠT ĐỘNG: Hoạt động học Mục tiêu Nội dung dạy PPDH- (thời gian) học trọng tâm KTDH Đánh giá Phương pháp Công cụ
HĐ 1: Khởi 5, 8
Đặt vấn đề, mở Đàm thoại Hỏi - đáp Câu hỏi
động-kết nối đầu bài học (6 phút)
HĐ 2: Tìm hiểu 1, 8, 9, Khái niệm liên Đàm thoại Quan sát Phiếu học khái niệm ion 10, 11, 12 kết ion Hoạt động Hỏi - đáp tập số 1 (12 phút) nhóm theo kĩ thuật think – pair - share HĐ 3: Tìm 2, 10, 12
Sự hình thành Đàm thoại Quan sát Câu hỏi hiểu quá liên kết ion Hỏi - đáp trình hình thành liên kết ion (15 phút)
HĐ 4: Tìm hiểu 3, 6, 12
Cấu trúc của Thuyết trình Quan sát Câu hỏi
về tinh thể ion tinh thể ion Đàm thoại Hỏi - đáp (12 phút) HĐ 5: Tìm 4, 5, 12
Tính chất của Thuyết trình Quan sát Câu hỏi
hiểu về đặc hợp chất ion Đàm thoại Hỏi - đáp
điểm của hợp Hoạt động chất ion nhóm (10 phút)
HĐ 6: Luyện 4, 5, 7, Củng cố nội Thuyết trình Quan sát Phiếu học tập 12 dung bài học Đàm thoại Hỏi – đáp tập số 2 (20 phút) Hoạt động nhóm HĐ 7:
Vận 1, 2, 3, 4, Tổng kết và mở Thuyết trình Quan sát Phiếu học dụng
5, 6, 7, 8, rộng nội dung Đàm thoại Hỏi - đáp tập số 3 (15 phút) 10 bài học Hoạt động nhóm B. CÁC HOẠT ĐỘNG:
HĐ 1. Hoạt động khởi động-kết nối Thời gian: 06 phút 1. Mục tiêu: 5, 8
2. Tiến trình tổ chức hoạt động
a. Giao nhiệm vụ: GV đặt vấn đề:
- Nguyên tử là hạt vô cùng nhỏ trung hòa về điện, vậy các nguyên tử khi nhường hoặc nhận electron có
còn trung hòa điện không? Chúng mang điện tích dương hay âm?
- Các phần tử mang điện này được gọi là gì?
b. Thực hiện nhiệm vụ: HS suy nghĩ trả lời câu hỏi trong vòng 1 phút.
c. Báo cáo- thảo luận:
GV yêu cầu HS phát biểu.
d. Phương pháp công cụ đánh giá và kết luận
GV và HS cùng giải đáp sau khi hoàn thành nội dung bài học.
HĐ 2. Tìm hiểu khái niệm ion Thời gian: 12 phút
1. Mục tiêu: 1, 8, 9, 10, 11, 12
2. Tiến trình tổ chức hoạt động:
a. Giao nhiệm vụ: GV yêu cầu HS hoàn thành phiếu học tập số 1 b. Thực hiện nhiệm vụ:
- Sử dụng kĩ thuật think-pair-share
Think: HS làm việc cá nhân suy nghĩ giải quyết nhiệm vụ học tập trong 3 phút.
Pair: HS ghép cặp với bạn cùng bàn, thảo luận đưa ra đáp án chung trong vòng 2 phút.
Share: GV chọn một số HS bất kì chia sẻ đáp án của nhóm.
c. Báo cáo- thảo luận:
- HS được gọi trả lời các câu hỏi trong PHT số 1.
d. Phương pháp công cụ đánh giá và kết luận
- Các nhóm còn lại nhận xét câu trả lời của các bạn.
- GV điều chỉnh đáp án cho phù hợp.
- GV mở rộng: Bên cạnh các ion được tạo thành từ một nguyên tử (ion đơn nguyên tử) còn có các ion
được trạo thành từ hai hay nhiều nguyên tử (ion đa nguyên tử), ví dụ: NH4+, OH-, NO3-, HCO3-, SO42-, PO43-,. .
e. Sản phẩm học sinh cần đạt:
1. ion sodium: số electron ít hơn số proton 1 đơn vị
ion oxygen: số electron nhiều hơn số proton 2 đơn vị.
2. điện tích của ion sodium = “+” số electron mà nguyên tử đã nhường
điện ion oxygen = “-” số electron mà nguyên tử đã nhận
3. Ion sodium có cấu hình nguyên tử của nguyên tố neon (Ne)
Ion oxygen có cấu hình electron nguyên tử của nguyên tố neon (Ne)
Hai ion này bền vững về mặt hóa học vì có cấu hình electron bền vững của nguyên tử khí hiếm
gần nhất (quy tắc octet).
4. Ion dương (cation) được hình thành khi nguyên tử nhường electron.
Khi nhận electron, nguyên tử trở thành ion âm (anion).
HĐ 3. Tìm hiểu quá trình hình thành liên kết ion Thời gian: 15 phút
1. Mục tiêu: 2, 10, 12
2. Tiến trình tổ chức hoạt động: a. Giao nhiệm vụ:
GV cho HS quan sát video và trả lời các câu hỏi.
link video: http://surl.li/cfqyf Câu hỏi:
1. Trong các nguyên tố kim loại và phi kim, nguyên tử của những nguyên tố nào có xu hướng tạo thành
cation hoặc anion? Giải thích.
2. Ion Na+, ion Mg2+, ion Cl-, ion O2-. Nhưng ion nào sẽ hút nhau?
3. Quan sát video, hãy trình bày sự hình thành liên kết ion trong phân tử NaCl khi sodium tác dụng với chlorine.
4. Sau khi tìm hiểu sự hình thành liên kết ion trong phân tử NaCl, GV yêu cầu HS vận dụng: Trình bày sự
hình thành liên kết ion trong phân tử MgO khi megnesium tác dụng với oxygen.
b. Thực hiện nhiệm vụ: HS thực hiện nhiệm vụ cá nhân, quan sát video và trả lời câu hỏi trong 2 phút.
c. Báo cáo- thảo luận: GV gọi HS bất kì trả lời câu hỏi.
d. Phương pháp công cụ đánh giá và kết luận
- HS còn lại chú ý lắng nghe và nhận xét câu trả lời của các bạn.
- GV điều chỉnh đáp án cho phù hợp. - GV kết luận:
Những nguyên tố kim loại do có độ âm điện nhỏ và nguyên tử thường có 1, 2 hoặc 3 electron ở
lớp ngoài cùng nên có xu hướng nhường electron, tạo thành cation.
Những nguyên tố phi kim do có độ âm điện lớn và nguyên tử thường có 5, 6 hoặc 7 electron ở lớp
ngoài cùng nên có xu hướng nhận thêm electron, tạo thành anion.
Các ion liên kết chặt chẽ với nhau do sự cân bằng giữa lực hút (các ion trái dấu hút nhau) và lực
đẩy (các ion cùng dấu đẩy nhau) tạo thành liên kết ion.
Liên kết ion thường được hình thành khi kim loại điển hình tác dụng với phi kim điển hình.
e.Sản phẩm học sinh cần đạt:
1. Nguyên tố kim loại có xu hướng tạo thành cation. Nguyên tố phi kim có xu hướng tạo thành anion.
Vì để đạt cấu hình electron bền vững của khí hiếm, nguyên tố kim loại có xu hướng dễ nhường electron
hơn nhận electron. Ngược lại nguyên tố phi kim có xu hướng dễ nhận electron hơn nhường electron.
2. Na+ hút Cl-; Mg2+ hút Cl-; Na+ hút O2-; Mg2+ hút O2-.
3. Nguyên tử sodium (Na) và chlorine (Cl) lần lượt có 1 electron và 7 electron ở lớp ngoài cùng. Khi cho
sodium phản ứng với chlorine, nguyên tử Na đã nhường l elctron cho nguyên tử Cl để tạo thành các ion
Na+ và Cl- lần lượt có cấu hình bền của các khi hiếm neon và argon. Các ion trái dấu này hút nhau theo
lực hút tĩnh điện tạo nên phân tử NaCl.
4. Nguyên tử magnesium (Mg) và oxygen (O) lần lượt có 2 electron và 6 electron ở lớp ngoài cùng. Khi
cho magnesium phản ứng với oxygen, nguyên tử Mg đã nhường 2 elctron cho nguyên tử O để tạo thành
các ion Mg2+ và O2- đều có cấu hình bền của khí hiếm neon. Các ion trái dấu này hút nhau theo lực hút
tĩnh điện tạo nên phân tử MgO.
HĐ 4. Tìm hiểu về tinh thể ion Thời gian: 12 phút 1. Mục tiêu: 3, 6, 12
2. Tiến trình tổ chức hoạt động: a. Giao nhiệm vụ:
GV cung cấp kiến thức về cấu trúc của tinh thể ion.
- Tinh thể ion là loại tinh thể được tạo nên bởi các anion và cation.
- Trong inh thể ion, các ion được sắp xếp theo một trật tự nhất định trong không gian theo kiểu mạng lưới;
trong đó các nút mạng lưới là những ion dương và ion âm được sắp xếp luân phiên.
Hình ảnh cấu trúc tinh thể của một số hợp chất:
- Các ion liên kết chặt chẽ với nhau do sự cân bằng giữa lực hút (các ion trái dấu hút nhau) và lực đẩy
(các ion cùng dấu đẩy nhau).
GV yêu cầu HS quan sát hình 9.3 (sgk Chân Trời Sáng Tạo/tr. 56), trả lời câu hỏi: - 7a, 7b và 7c.
- Công thức hóa học của sodium chloride có phải là NaCl không?
b. Thực hiện nhiệm vụ: HS làm việc cá nhân trong 3 phút, trả lời câu hỏi.
c. Báo cáo- thảo luận: GV gọi HS bất kì trả lời câu hỏi.
d. Phương pháp công cụ đánh giá và kết luận
Các HS còn lại chú ý lắng nghe và nhận xét. GV kết luận:
- Tinh thể ion là loại tinh thể được tạo nên bởi các anion và cation.
- Trong inh thể ion, các ion được sắp xếp theo một trật tự nhất định trong không gian theo kiểu mạng lưới;
trong đó các nút mạng lưới là những ion dương và ion âm được sắp xếp luân phiên.
- Các ion liên kết chặt chẽ với nhau do sự cân bằng giữa lực hút (các ion trái dấu hút nhau) và lực đẩy
(các ion cùng dấu đẩy nhau).
- Trong tinh thể NaCl, mỗi ion Na+ được bao quanh bởi 6 ion Cl- gần nhất và mỗi ion Cl- cũng được bao
quanh bởi 6 ion Na+ gần nhất.
e.Sản phẩm học sinh cần đạt: Đáp án:
7a. NaCl có cấu trúc hình lập phương
7b. Tinh thể NaCl được hình thành từ các ion Na+ và Cl- sắp xếp cạnh nhau một cách luân phiên.
7c. Trong tinh thể NaCl, mỗi ion Na+ được bao quanh bởi 6 ion Cl- gần nhất và mỗi ion Cl- cũng được bao
quanh bởi 6 ion Na+ gần nhất.
Tinh thể sodium chloride gồm nhiều phân tử NaCl, công thức hóa học của muối ăn có dạng (NaCl)n
HĐ 5. Tìm hiểu về đặc điểm của hợp chất ion Thời gian: 10 phút 1. Mục tiêu: 4, 5, 12
2. Tiến trình tổ chức hoạt động:
a. Giao nhiệm vụ: Yêu cầu HS nhớ lại tính chất của tinh thể muối ăn NaCl, và đọc các thông tin sau. Trả lời các câu hỏi.
Thông tin: NaCl nóng chảy ở 801 oC, sôi ở 1465 oC; NaF nóng chảy ở 993 oC, sôi ở 1695 oC; CaO nóng
chảy ở 2572 oC, sôi ở 2850 oC. Câu hỏi.
1. Hãy kể tên một số hợp chất ion có xung quanh em và cho biết ở điều kiện thường, chúng tồn tại ở dạng nào?
2. Nhận xét về khả năng nóng chảy và khả năng bay hơi và khả năng tan trong nước của tinh thể NaCl.
3. Khi nào hợp chất sodium chloride có khả năng dẫn điện?
b. Thực hiện nhiệm vụ: HS làm việc theo cặp trong 3 phút, trả lời câu hỏi.
c. Báo cáo- thảo luận:
GV gọi HS bất kì trả lời câu hỏi, HS còn lại đưa ra nhận xét.
d. Phương pháp công cụ đánh giá và kết luận
GV kết luận: Trong điều kiện thường:
- Hợp chất ion thường tồn tại ở trạng thái rắn;
- Khó nóng chảy, khó bay hơi và không dẫn điện ở trạng thái rắn;
- Hợp chất ion thường dễ tan trong nước, tạo thành dung dịch có khả năng dẫn điện.
e.Sản phẩm học sinh cần đạt:
1. Một số hợp chất ion: NaCl, CaO, NaF, . . Điều kiện thường, chúng tồn tại ở trạng thái rắn.
2. Ở điều kiện thường, tinh thể NaCl khó nóng chảy và khó bay hơi.
3. NaCl tan trong nước, tạo thành dung dịch có khả năng dẫn điện. HĐ 6. Luyện tập Thời gian: 20 phút
1. Mục tiêu: 4, 5, 7, 12
2. Tiến trình tổ chức hoạt động:
a. Giao nhiệm vụ: Hoàn thành câu hỏi/bài tập trong phiếu học tập số 2
b. Thực hiện nhiệm vụ: HS làm việc theo cặp, theo luận trong vòng 5 phút.
c. Báo cáo- thảo luận: GV gọi HS lên bảng sửa bài.
d. Phương pháp công cụ đánh giá và kết luận
HS còn lại quan sát và nhận xét.
GV nhận xét và chốt đáp án.
e.Sản phẩm học sinh cần đạt:
Câu 1. Đáp án đúng: b, c
Câu 2. Đáp án đúng: b, c Câu 3. D
Câu 4. LiF, CaF2, AlF3, Li2O, CaO, Al2O3. 23 x 1000 x 5
Câu 5. Lượng sodium có trong 5,0 g muối ăn =
1966 mg nên lượng muối ăn đã tiêu thụ 58,5
như trên chưa vượt mức giới hạn cho phép. HĐ 7. Vận dụng Thời gian: 15 phút
1. Mục tiêu: 1, 2, 3, 4, 5, 6, 7, 8, 10
2. Tiến trình tổ chức hoạt động:
- GV và HS tổng kết nội dung thông qua trò chơi “Ô chữ hóa học”
- Giao nhiệm vụ học tập thực hiện nhiệm vụ: “Thiết kế mô hình tinh thể sodium chloride” a. Giao nhiệm vụ:
GV chia lớp thành các nhóm nhỏ hoặc hoạt nhóm đôi, tiến hành tổng kết bài học thông qua trò chơi “Ô
chữ hóa học” ; GV phát phiếu học tập số 3, các nhóm thảo luận, tìm câu trả lời trong 8 phút.
GV triển khao nhiệm vụ học tập: Thiết kế mô hình tinh thể sodium chloride.
Yêu cầu: Lựa chọn nguyên vật liệu phù hợp để thiết kế mô hình tinh thể sodium chloride. Gợi ý:
- Nguyên liệu có thể lựa chọn làm ion ở các nút mạng là đất sét, xốp,. .
- Nguyên liệu có thể lựa chọn làm liên kết là ống hút, tăm,. .
b. Thực hiện nhiệm vụ: HS thực hiện nhiệm vụ theo nhóm từ 4 – 5 HS.
c. Báo cáo- thảo luận:
Trò chơi “Ô chữ hóa học”
GV gọi đại diện nhóm báo cáo kết quả. HS còn lại lắng nghe và nhận xét.
Mô hình tinh thể sodium chloride
HS quay video thuyết minh về mô hình tinh thể sodium chloride khoảng 2-3 phút, đảm bảo các yêu cầu sau:
Về sản phẩm: Phản ảnh thực tế mô hình tinh thể sodium chloride (sắp xếp các ion trong tinh thể, hình học
tinh thể, phân biệt anion và cation,. .); Video có âm thanh và hình ảnh rõ ràng. Về thuyết minh:
- Phong cách thuyết trình tự tin, thu hút;
- Tốc độ nói vừa phải, giọng nói dễ nghe;
- Đầy đủ nội dung: thuyết minh về cách thiết kế mô hình, kiến thức liên quan đến tinh thể sodium;
d. Phương pháp công cụ đánh giá và kết luận
Đánh giá dựa theo yêu cầu cần đạt.
e.Sản phẩm học sinh cần đạt:
Trò chơi “Ô chữ hóa học” Ngang Dọc 1. Octet A. Electron 2. Helium B. Cation 3. Natri C. Argon 4. Liên kết ion
Mô hình tinh thể sodium chloride
Video sản phẩm của HS. IV. HỒ SƠ DẠY HỌC:
1. Video sự hình thành liên kết ion trong phân tử NaCl: http://surl.li/cfqyf
2. Phiếu học tập số 1
Tên nhóm: ______________________
Hoạt động: Ion là gì? Tư liệu
Hợp chất ion được tạo thành từ một kim loại điển hình và một phi kim điển hình, khi các nguyên
tử tham gia phản ứng sẽ tạo thành ion (nguyên tử mang điện). Các kim loại có xu hướng tạo thành cation
(ion dương) bằng cách cho electron. Các phi kim hình thành anion (ion âm) bằng cách nhận electron từ kim loại.
Quá trình hình thành ion được mô tả như sau: Hoặc: Na Na+ + 1e Nguyên tử sodium (Na) Ion sodium (Na+) Hoặc: O + 2e O2- Nguyên tử oxygen (O) Ion oxygen (O2-)
Hình 1. Hình minh họa quá trình hình thành ion Mục tiêu
Trong hoạt động này, các em sẽ được tìm hiểu thế nào là ion. Nhiệm vụ
Quan sát hình 1, trả lời các câu hỏi. Câu hỏi
1. Nhận xét số electron trên lớp vỏ với số proton trong hạt nhân của ion sodium và ion oxygen.
2. Trình bày cách tính điện tích của ion sodium và ion oxygen.
3. Ion sodium và ion oxygen có cấu hình electron nguyên tử của nguyên tố nào? Hai ion này có bền
vững về mặt hóa học không?
4. Ion dương (cation) được hình thành khi nguyên tử . . . . . electron.
Khi . . . . . . electron, nguyên tử trở thành ion âm (anion).
3. Phiếu học tập số 2
Tên nhóm: ______________________
Hoạt động: luyện tập Mục đích
Củng cố, khắc sâu nội dung bài học thông qua bài tập hóa học. Nhiệm vụ
Trả lời các câu hỏi sau:
Câu 1. Những phát biểu nào sau đây là đúng?
Hợp chất tạo nên bởi ion Al3+ và O2- là hợp chất (a) Cộng hóa trị. (b) Ion. (c) Có công thức Al2O3. (d) Có công thức Al3O2.
Câu 2. Những tính chất nào sau đây là tính của hợp chất ion?
(a) Tồn tại ở thể khí trong điều kiện thường.
(b) Có nhiệt độ nóng chảy và nhiệt độ sôi cao.
(c) Thường tồn tại ở thể rắn ở điều kiện thường.
(d) Có nhiệt độ nóng chảy và nhiệt độ sôi thấp.
Câu 3. Cho các ion sau: Ca2+, F-, Al3+, N3-. Số ion có cấu hình electron của khí hiếm neon là: A. 4. B. 2. C. 1. D. 3.
Câu 4. Cho các ion: Li+, Ca2+, Al3+, F-, O2-, PO43-. Hãy viết công thức tất cả các hợp chất ion (được tạo
nên từ một loại cation và anion) có thể được tạo thành từ các ion đã cho. Biết rẳng tổng điện tích của các
ion trong hợp chất bằng 0.
Câu 5. Ion Na+ đóng vai trò rất quan trọng trong việc điều hòa huyết áp của cơ thể. Tuy nhiên, nếu cơ thể
hấp thụ một lượng lớn ion này sẽ dẫn đến các vấn đề về tim mạch và thận. Các nhà khoa học khuyến cáo
nên hạn chế lượng ion Na+ nạp vào cơ thể nên thấp hơn 2300 mg, nhưng không ít hơn 500 mg miiux
ngày để đảm bảo nhu cầu sức khỏe cơ thể.
Giả sử có một người sử dụng 5,0 g muối ăn mỗi ngày thì lượng ion Na+ mà người ấy nạp vào cơ thể có
vượt mức giới hạn cho phép không?
4. Phiếu học tập số 3
Tên nhóm: ______________________
Hoạt động: Trò chơi “Ô chữ hóa học” Tư liệu Ngang Dọc
1. Quy tắc được sử dụng để giải thích sự hình A. Hạt cấu thành lớp vỏ nguyên tử.
thành liên kết giữa các nguyên tử.
2. Khí an toàn nhất được sử dụng để bơm vào B. Phần tử được tạo thành khi nguyên tử mất đi khinh khí cầu. electron.
3. Tên gọi khác của nguyên tố sodium.
C. Khí hiếm có cấu hình electron nguyên tử giống với ion Ca2+.
4. Liên kết hóa học giữa các phần tử mang điện tích trái dấu. Mục tiêu
Củng cố kiến thức liên quan đến liên kết ion Nhiệm vụ
Trả lời các câu hỏi ở hàng ngang và hàng đọc V. BÀI TẬP
Câu 1. Những phát biểu nào sau đây là đúng?
Hợp chất tạo nên bởi ion Al3+ và O2- là hợp chất (e) Cộng hóa trị. (f) Ion. (g) Có công thức Al2O3. (h) Có công thức Al3O2.
Câu 2. Những tính chất nào sau đây là tính của hợp chất ion?
(e) Tồn tại ở thể khí trong điều kiện thường.
(f) Có nhiệt độ nóng chảy và nhiệt độ sôi cao.
(g) Thường tồn tại ở thể rắn ở điều kiện thường.
(h) Có nhiệt độ nóng chảy và nhiệt độ sôi thấp.
Câu 3. Cho các ion sau: Ca2+, F-, Al3+, N3-. Số ion có cấu hình electron của khí hiếm neon là: B. 4. B. 2. C. 1. D. 3.
Câu 4. Cho các ion: Li+, Ca2+, Al3+, F-, O2-, PO43-. Hãy viết công thức tất cả các hợp chất ion (được tạo nên từ
một loại cation và anion) có thể được tạo thành từ các ion đã cho. Biết rẳng tổng điện tích của các ion trong hợp chất bằng 0.
Câu 5. Ion Na+ đóng vai trò rất quan trọng trong việc điều hòa huyết áp của cơ thể. Tuy nhiên, nếu cơ thể hấp
thụ một lượng lớn ion này sẽ dẫn đến các vấn đề về tim mạch và thận. Các nhà khoa học khuyến cáo nên hạn
chế lượng ion Na+ nạp vào cơ thể nên thấp hơn 2300 mg, nhưng không ít hơn 500 mg miiux ngày để đảm bảo
nhu cầu sức khỏe cơ thể.
Giả sử có một người sử dụng 5,0 g muối ăn mỗi ngày thì lượng ion Na+ mà người ấy nạp vào cơ thể có vượt
mức giới hạn cho phép không? TRƯỜNG THPT TRẦN PHÚ TỔ HÓA HỌC KHỐI 10
KẾ HOẠCH BÀI DẠY: LIÊN KẾT CỘNG HÓA TRỊ
Thời lượng: 4 tiết I. MỤC TIÊU DẠY HỌC:
Sau bài học này HS có thể: YÊU CẦU CẦN ĐẠT
1. Trình bày được khái niệm và lấy ví dụ về liên kết NĂNG LỰC
cộng hóa trị (liên kết đơn, đôi, ba) khi áp dụng quy tắc HÓA HỌC
Nhận thức hóa học Octet.
2. Viết được công thức Lewis của một số chất đơn giản.
3. Trình bày được khái niệm về liên kết cho nhận.
4. Phân biệt được các loại liên kết dựa theo độ âm điện.
5. Giải thích được sự hình thành liên kết xích ma, liên
kết pi qua sự xen phủ AO.
6. Trình bày được khái niệm năng lượng liên kết cộng hóa trị.
7. Lắp được mô hình phân tử một số chất.
Tìm hiểu thế giới tự
Thông qua các hoạt động: nghiên cứu bài học, thảo
nhiên dưới góc độ
luận, quan sát thực tiễn, tìm hiểu thông tin… tìm hiểu hóa học
các yêu cầu về mục tiêu nhận thức kiến thức ở trên.
Vận dụng kiến thức,
Từ kiến thức đã học, học học sinh có thể giải quyết
kĩ năng đã học
được các dạng bài tập giáo viên yêu cầu.
Giải quyết vấn đề và
Từ kiến thức đã học học sinh vận dụng giải quyết các NĂNG LỰC sáng tạo
câu hỏi liên quan đến hiện tượng trong tự nhiên, đời CHUNG sống.
Giao tiếp và hợp tác
Học sinh biết chủ động giao tiếp khi có vấn đề thắc
mắc. Thông qua làm việc nhóm nâng cao khả năng trình
bày ý kiến của bản thân, tự tin thuyết trình trước đám đông.
Năng lực tự chủ và
Chủ động tích cực thực hiện nhiệm vụ được giao, hỗ tự học
trợ bạn trong hoạt động nhóm PHẨM CHẤT Trung thực
Thật thà, ngay thẳng trong kết quả làm việc nhóm. Trách nhiệm
Có tinh thần trách nhiệm cao để hoàn thành tốt nhiệm vụ được giao.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
- Thiết bị dạy học
+ Thiết bị công nghệ, phần mềm:
- Laptop, bài giảng Powerpoint. - Padlet, GG Classroom.
+ Thiết bị dạy học khác: Hóa chất Dụng cụ
Mô hình lắp ráp phân tử - Học liệu
+ Học liệu số:
https://youtu.be/qDGrhskOQfc
https://youtu.be/5TkGDp_P38M
https://youtu.be/0Kxsiys4XNo
+ Học liệu khác: Kế hoạch bài giảng.
III. TIẾN TRÌNH DẠY HỌC:
A. BẢNG TÓM TẮT CÁC HOẠT ĐỘNG:
Hoạt động Mục tiêu
Nội dung dạy học PPDH- học trọng tâm KTDH Đánh giá
Phương pháp Công cụ (thời gian) HĐ 1:
Giúp HS nắm - GV chiếu sơ đồ - Đàm -Quan sát - HS
được cấu trúc tư duy của các thoại đánh giá Khởi nội dung của nhóm đã chuẩn bị - Kỹ đồng động-kết bài học. trước ở nhà. thuật đẳng nối - GV đọc các câu KWL- hỏi thắc mắc của KWLH ( 30 phút) các nhóm trong bảng KWL- KWLH và cho các bạn trả lời. HĐ 2: 2.1. Khái
- HS trình bày - GV mời 1 bạn - PP -Quan sát - HS niệm và ví được khái đại diện nhóm thuyết đánh giá dụ về liên
niệm và lấy ví trình bày khái trình đồng kết cộng
dụ về liên kết niệm và lấy ví dụ đẳng
hóa trị (liên cộng hóa trị và giải thích về sự kết đơn,
(liên kết đơn, hình thành liên kết đôi, ba) khi đôi, ba) khi cộng hóa trị (liên áp dụng áp dụng quy kết đơn, đôi, ba) quy tắc tắc Octet khi áp dụng quy Octet tắc Octet. ( 15 phút) 2.2. Công - Viết được - HS hoạt động - PP thảo -Quan sát, - Thẻ thức Lewis công thức e, nhóm hoàn thành luận đánh giá qua kiểm tra ( 15 phút) công thức phiếu HT số 1. nhóm SP học tập Lewis, CTCT của một số chất đơn giản. - Bảng kiểm 2.3. Công - HS viết - GV mời 1 bạn - PP - Quan sát, thức cho được công đại diện nhóm thuyết đánh giá qua nhận thức cho trình bày về LK trình SP học tập ( 10 phút) nhận. cho nhận trong ion NH4+, CO.
2.4. Phân - HS biết tính - HS hoạt động - PP thảo -Quan sát, - Thẻ biệt được
hiệu số độ âm nhóm hoàn thành luận đánh giá qua kiểm tra các loại
điện từ đó suy phiếu HT số 2. nhóm SP học tập liên kết ra được loại dựa theo liên kết. độ âm điện. ( 15phút) 2.5. Giải
-HS giải thích - HS hoạt động - PP thảo - Quan sát, - Thang
thích được được sự hình nhóm hoàn thành luận đánh đánh giá sự hình
thành liên kết phiếu HT số 3. nhóm giá qua SP thành liên xích ma, liên - PP học tập. kết xích kết pi qua sự hỏi/đáp ma, liên xen phủ AO. kết pi qua sự xen phủ AO. ( 20phút) 2.6.Trình
- HS trình bày - HS hoạt động - PP thảo - Quan sát, - Thang bày được được khái nhóm hoàn thành luận đánh đánh giá khái niệm niệm năng phiếu HT số 4. nhóm giá qua SP
năng lượng lượng liên kết - PP học tập. liên kết cộng hóa trị. hỏi/đáp cộng hóa trị. ( 15 phút) HĐ 3: - HS hoạt động - PP thảo - Quan sát - Thang Tổng kết nhóm lắp được luận - Đánh đánh giá Lắp được mô hình phân tử nhóm giá qua SP mô hình CH4, C2H4, C2H2, học tập. phân tử CO2. CH4, C2H4, Từ đó nhận xét C2H2, CO2. về loại LK trong - HS trả lời mỗi phân tử. phiếu kiểm - HS trả lời phiếu - Đánh - Bảng cá nhân. kiểm cá nhân để giá qua hồ sơ kiểm ( 20 phút) GV đánh giá mức học tập. độ nắm bài của HS. HĐ 4: Luyện tập Củng cố, - HS trả lời câu - PP kiểm - PP quan sát - Câu hỏi
khắc sâu kiến hỏi trắc nghiệm tra trắc ( 10 phút) thức đã học trong phiếu học nghiệm. trong bài. tập 5. HĐ 5: Giúp HS vận
- HS về nhà trả lời - PP thảo - Đánh - Câu hỏi Vận dụng dụng các kĩ câu hỏi trong luận giá qua hồ sơ tự luận. năng, vận phiếu học tập 6. - Kỹ học tập. dụng kiến thuật bể thức đã học cá. ( 30 phút) để giải quyết các tình huống trong thực tế. B. CÁC HOẠT ĐỘNG:
HĐ 1. Hoạt động khởi động-kết nối MỞ ĐẦU Thời gian: 30 phút
1. Mục tiêu: - Giúp HS có cái nhìn tổng quát về nội dung bài học.
- GV nắm được tình hình học sinh có chuẩn bị bài trước hay không và HS còn thắc mắc ở những phần nào.
2. Tiến trình tổ chức hoạt động: a. Giao nhiệm vụ:
- GV yêu cầu HS xem SGK, bài giảng, thông tin trên internet và thực hiện bảng KWL-KWLH
cá nhân sau đó thảo luận nhóm tổng hợp bảng KWL-KWLH cho nhóm.
- HS thảo luận nhóm vẽ sơ đồ tư duy.
b. Thực hiện nhiệm vụ:
- GV cho HS xem ảnh để dẫn dắt vào bài.
- GV chiếu sơ đồ tư duy của các nhóm đã chuẩn bị trước ở nhà.
- GV đọc các câu hỏi thắc mắc của các nhóm trong bảng KWL-KWLH.
c. Báo cáo- thảo luận:
- GV cho đại diện các nhóm trả lời các câu hỏi.
d. Phương pháp công cụ đánh giá và kết luận:
- HS sẽ đánh giá lẫn nhau.
e.Sản phẩm học sinh cần đạt:
- Bảng KWL-KWLH của nhóm. - Sơ đồ tư duy. HĐ 2.
HÌNH THÀNH KIẾN THỨC Thời gian: 90 phút 1. Mục tiêu:
1. Trình bày được khái niệm và lấy ví dụ về liên kết cộng hóa trị (liên kết đơn, đôi, ba) khi áp dụng quy tắc Octet.
2. Viết được công thức e, công thức Lewis, công thức CT của một số chất đơn giản.
3. Trình bày được khái niệm về liên kết cho nhận.
4. Phân biệt được LK CHT phân cực, LK CHT không phân cực và các loại liên kết dựa theo độ âm điện.
5. Giải thích được sự hình thành liên kết xích ma, liên kết pi qua sự xen phủ AO.
6. Trình bày được khái niệm năng lượng liên kết cộng hóa trị.
2. Tiến trình tổ chức hoạt động: a. Giao nhiệm vụ:
- GV hỏi và yêu cầu HS nêu khái niệm và lấy ví dụ về liên kết cộng hóa trị (liên kết đơn, đôi, ba),
nêu được khái niệm về liên kết cho nhận.
- GV yêu cầu HĐ nhóm thực hiện phiếu học tập 2: Vẽ CT Lewis và CTCT của 1 số chất đơn giản.
b. Thực hiện nhiệm vụ:
- HS nghe bạn trả lời và nhận xét, bổ sung.
- Các nhóm thảo luận và thực hiện phiếu học tập 2.
- GV hổ trợ nếu HS thắc mắc.
c. Báo cáo- thảo luận:
- HS treo bảng vẽ của nhóm mình, GV mời 1 nhóm chính xác nhất lên trình bày.
d. Phương pháp công cụ đánh giá và kết luận:
- GV đánh giá HS qua PP quan sát thảo luận nhóm.
- Công cụ đánh giá là bảng kiểm.
e.Sản phẩm học sinh cần đạt:
- Bảng vẽ CT Lewis và CTCT. HĐ 3. TỔNG KẾT Thời gian: 20 phút 1. Mục tiêu:
- GV chốt lại kiến thức trọng tâm.
2. Tiến trình tổ chức hoạt động: a. Giao nhiệm vụ:
- GV yêu cầu các nhóm lắp được mô hình phân tử CH4, C2H4, C2H2, CO2.
- HS trả lời phiếu kiểm cá nhân để GV đánh giá mức độ nắm bài của HS.
b. Thực hiện nhiệm vụ:
- Các nhóm lắp được mô hình phân tử CH4, C2H4, C2H2, CO2.
- GV phát phiếu trả lời cho HS.
c. Báo cáo- thảo luận:
- Đại diện các nhóm đưa mô hình đã lắp được.
d. Phương pháp công cụ đánh giá và kết luận
- PP đánh giá qua quan sát.
- Công cụ đánh giá là bảng kiểm.
- Đánh giá qua - Đánh giá qua kết phiếu trả lời của HS.
e.Sản phẩm học sinh cần đạt:
- Lắp được mô hình phân tử CH4, C2H4, C2H2, CO2.
- HS thực hiện phiếu kiểm cá nhân HĐ 4. LUYỆN TẬP Thời gian: 10 phút 1. Mục tiêu:
- Giúp HS vận dụng các kĩ năng, vận dụng kiến thức đã học để trả lời câu hỏi.
2. Tiến trình tổ chức hoạt động:
- GV phát phiếu học tập số 5 cho mỗi cá nhân/ Gv cũng có thể thiết kế trên phần mềm Kahoot/ Quizziz. a. Giao nhiệm vụ:
-GV phát phiếu học tập 5 , yêu cầu HS trả lời câu hỏi trắc nghiệm trong phiếu HT.
b. Thực hiện nhiệm vụ:
- HS trả lời câu hỏi trắc nghiệm trong phiếu học tập 5.
c. Báo cáo- thảo luận:
- GV đọc đáp án cho HS chấm chéo bài nhau.
d. Phương pháp công cụ đánh giá và kết luận:
- PP đánh giá qua sản phẩm học tập.
- Công cụ đánh giá là câu hỏi trắc nghiệm.
e. Sản phẩm học sinh cần đạt:
- HS trả lời từ 5 câu hỏi trở lên. HĐ 5. VẬN DỤNG Thời gian: 30 phút 1. Mục tiêu:
- Giúp HS vận dụng các kĩ năng, vận dụng kiến thức đã học để giải quyết các tình huống trong thực tế.
- Giúp HS có tinh thần đoàn kết, cùng nhau chia sẽ mọi khó khăn.
2. Tiến trình tổ chức hoạt động:
- GV yêu cầu HS tìm hiểu, giải quyết các câu hỏi/tình huống sau a. Giao nhiệm vụ:
- GV phát phiếu câu hỏi cho nhóm HS.
b. Thực hiện nhiệm vụ:
- HS trả lời câu hỏi theo thảo luận nhóm.
c. Báo cáo- thảo luận:
- GV kiểm tra bài làm của HS.
d. Phương pháp công cụ đánh giá và kết luận
- PP đánh giá qua sản phẩm học tập.
- Công cụ đánh giá là câu hỏi tự luận.
e.Sản phẩm học sinh cần đạt:
- HS nộp bài đúng thời hạn.
IV. HỒ SƠ DẠY HỌC:
HOẠT ĐỘNG KHỞI ĐỘNG: GIỚI THIỆU VÀO BÀI
PHIẾU HỌC TẬP SỐ 1
Câu 1: Hình ảnh dưới đây khiến em nhớ đến câu nói nào của chủ tịch Hồ Chí Minh về tinh thần đoàn kết?
Câu 2: Con người thể hiện sự đoàn kết bằng những cái bắt tay thế các nguyên tử hóa học thể hiện sự
đoàn kết của mình như thế nào?
Câu 3: Xem hình ảnh sau đây và cho biết bản chất của liên kết CHT có giống hay không?
PHIẾU HỌC TẬP SỐ 1
Viết được công thức e, công thức Lewis, CTCT của phân tử H2, O2, HF, CO2
PHIẾU HỌC TẬP SỐ 2
Câu 1: Từ hình ảnh vui sau, em hãy cho biết thế nào là LK CHT không phân cực và LK CHT phân
cực? Trong phân tử HCl, NH3, CO2 cặp e chung lệch về phía nguyên tử nào?
Câu 2: Dựa vào giá trị độ âm điện trong bảng tuần hoàn, tính hiệu số độ âm điện để suy ra loại liên kết
trong các phân tử sau: CH4, HCl, NH3, ACl3, MgO.
PHIẾU HỌC TẬP SỐ 3
Câu 1:- Em hãy cho biết liên kết nào trong mỗi phân tử dưới đây được tạo thành bởi sự xen phủ trục
hoặc là xen phủ bên của các obitan?
- Nêu sự hình thành LK sigma và LK pi?
Câu 2: - Dựa vào sự xen phủ các AO trong phân tử oxygen ở hình bên dưới, hãy cho biết liên kết được
tạo thành là liên kết gì?
- Số liên kết LK sigma và LK pi trong mỗi LK đơn, LK đôi, LK ba lần lượt là bao nhiêu?
PHIẾU HỌC TẬP SỐ 4
Câu 1: Năng lượng LK là gì? Câu 2:
- LK trong phân tử nào dễ bị phá vỡ hơn?
- Em hãy sáp xếp độ bền của LK đơn, LK đôi, LK ba?
PHIẾU HỌC TẬP SỐ 5
Trả lời các câu hỏi sau:
Câu 1. Liên kết được tạo nên giữa hai nguyên tử bằng một hay nhiều cặp electron chung, gọi là A. Liên kết ion.
B. Liên kết cộng hoá trị.
C. Liên kết kim loại. D. Liên kết hiđro.
Câu 2. Trong phân tử sẽ có liên kết cộng hoá trị phân cực nếu cặp electron chung
A. ở giữa hai nguyên tử.
B. Lệch về một phía của một nguyên tử.
C. Chuyển hẳn về một nguyên tử.
D. Nhường hẳn về một nguyên tử.
Câu 3. Hoàn thành nội dung sau: “Nói chung, các chất chỉ có ……………. không dẫn điện ở mọi trạng thái”.
A. liên kết cộng hoá trị
B. Liên kết cộng hoá trị có cực
C. Liên kết cộng hoá trị không có cực D. liên kết ion
Câu 4. Trong liên kết giữa hai nguyên tử, nếu cặp electron chung chuyển hẳn về một nguyên tử, ta sẽ có liên kết
A. cộng hoá trị có cực.
B. cộng hoá trị không có cực. C. ion. D. cho – nhận.
Câu 5. Để đánh giá loại liên kết trong phân tử hợp chất, người ta có thể dựa vào hiệu độ âm điện. Khi
hiệu độ âm điện của hai nguyên tử tham gia liên kết 1,7 thì đó là liên kết A. ion.
B. cộng hoá trị không cực.
C. cộng hoá trị có cực. D. kim loại.
Câu 6. Chọn phát biểu sai trong các câu sau:
A. Liên kết cộng hoá trị được tạo thành giữa những nguyên tố có tính chất gần giống nhau.
B. Liên kết cộng hoá trị được tạo thành giữa những nguyên tử phi kim.
C. Liên kết ion được tạo thành giữa hai nguyên tố có tính chất hoá học trái ngược nhau.
D. Liên kết cộng hoá trị được tạo thành giữa nguyên tố kim loại điển hình và phi kim điển hình.
Câu 7. Liên kết hóa học trong phân tử Br2 thuộc loại liên kết
A. cộng hóa trị không cực.
B. cộng hóa trị có cực C. ion D. hiđro
Câu 8. Liên kết hóa học trong phân tử flo, clo, brom, iot, oxi đều là A. Liên kết ion.
B. Liên kết cộng hóa trị có cực.
C. Liên kết cộng hóa trị không cực. D. Liên kết đôi.
Câu 9. Dãy gồm các chất trong phân tử chỉ có liên kết cộng hoá trị phân cực là A. HCl, O3, H2S. B. O2, H2O, NH3. C. H2O, HF, H2S. D. HF, Cl2, H2O.
Câu 10. Cho độ âm điện của các nguyên tố như sau: O (3,44), Cl (3,16), Mg (1,31), C (2,55), H (2,2).
Trong các phân tử: MgO, CO2, CH4, Cl2O. Số chất có kiểu liên kết cộng hóa trị có cực là A. 2. B. 3. C. 1. D. 4. Đáp án 1.B 2.B 3.C 4.A 5.A 6.D 7.A 8.C 9.C 10.C
PHIẾU HỌC TẬP SỐ 6
Câu 1: Các phân tử phân cực tan trong dung môi nào? Tại sao trong phân tử hợp chất hữu cơ có liên
kết kém bền? Nhiệt độ sôi thấp, khả năng dẫn điện của chất hữu cơ như thế nào?
Câu 2: Nitrogen chiếm khoảng 78% thể tích không khí nhưng chỉ hoạt động ở nhiệt độ cao. Vì sao
nitrogen là một chất khí không hoạt động ở điều kiện thường?
Câu 3: Trong một số trường hợp đặc biệt, khí nitrogen được sử dụng để bơm lốp (vỏ) xe thay cho
không khí là do khí oxygen có trong không khí có thể oxi hóa cao su theo thời gian. Khí nitrogen vì
sao khắc phục được nhược điểm này?
1. Bảng kiểm đánh giá kĩ năng thuyết trình của HS (đánh giá đồng đẳng): Tiêu chí Xác nhận Có Không
1. Diễn đạt trôi chảy, phát âm rõ ràng, chính xác.
2. Tốc độ vừa phải, ngưng ngắt câu đúng lúc, đúng chỗ. 3. Âm lượng vừa phải.
4. Có tương tác với người nghe trong khi trình thuyết trình.
5. Có kết hợp sử dụng ngôn ngữ cơ thể phù hợp.
2. Bảng kiểm cá nhân phần tổng kết: Xác nhận STT
Yêu cầu cần thực hiện được Có Không 1
Có nắm được khái niệm về liên kết cộng hóa trị hay không? 2
Có biết liên kết đơn, liên kết đôi, liên kết ba liên kết cho
nhận được hình thành như thế nào không? 3
Có biết sự xen phủ trục và xen phủ phủ bên để tạo thành
liên kết xích ma và liên kết pi hay không? 4
Có phân biệt được liên kết cộng hóa trị phân cực và liên
kết cộng hóa trị không phân cực hay không? 5
Có viết được công thức e, công thức cấu tạo, công thức Lewis không? 6
Có nắm được khái niệm về năng lượng liên kết hay không? 7
Có có biết tính hiệu độ âm điện để xác định loại liên kết hay không? V. BÀI TẬP
1. HS làm bài tập về nhà theo SGK.
2. Chuẩn bị cho bài học tiếp theo: LIÊN KẾT HYDROGEN.
TƯƠNG TÁC VANDERWAALS TRƯỜNG THPT TRẦN PHÚ TỔ HÓA HỌC KHỐI 10
KẾ HOẠCH BÀI DẠY: BÀI 11. LIÊN KẾT HYDROGEN VÀ TƯƠNG TÁC VAN DER WAALS
Thời lượng: 2 tiết I. MỤC TIÊU DẠY HỌC:
Sau bài học này HS có thể: YÊU CẦU CẦN ĐẠT
Nhận thức hóa học HS thấy được tầm quan trọng của các loại lực liên
kết phân tử trong sự tồn tại của thế giới xung NĂNG LỰC quanh. HÓA HỌC
Tìm hiểu thế giới tự Hoá học giúp con người khám phá, hiểu biết và
nhiên dưới góc độ
tiến đến chinh phục tự nhiên. hóa học
Vận dụng kiến
- Giải thích được tính chất vật lí của các chất và
thức, kĩ năng đã
so sánh được tính chất vật lí giữa các chất với học nhau.
Giải quyết vấn đề và Thảo luận với các thành viên trong nhóm nhằm sáng tạo
giải quyết các vấn đề trong bài học để hoàn thành NĂNG LỰC nhiệm vụ học tập. CHUNG
Giao tiếp và hợp tác Sử dụng ngôn ngữ khoa học để diễn đạt về sự
hình thành liên kết hydrogen; tương tác van der
Waals; Hoạt động nhóm một cách hiệu quả theo
đúng yêu cầu của GV, đảm bảo các thành viên
trong nhóm đều được tham gia thảo luận và thuyết trình.
Năng lực tự chủ và Chủ động, tích cực tìm hiểu về các loại lực liên tự học
kết phân tử, qua đó hiểu và giải thích được tính
chất vật lí của các chất. PHẨM CHẤT Trung thực
Dựa vào mục tiêu của bài học và nội dung các
hoạt động của SGK, GV lựa chọn phương pháp và
kĩ thuật dạy học phù hợp để tổ chức các hoạt động
học tập một cách hiệu quả và tạo hứng thú cho HS
trong quá trình tiếp nhận kiến thức, hình thành và
phát triển năng lực, phẩm chất liên quan đến bài học. Trách nhiệm
- Tham gia tích cực hoạt động nhóm phù hợp với khả năng của bản thân.
- Có niềm say mê, hứng thú với việc khám phá và học tập môn hoá học.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
- Dạy học theo nhóm, cặp đôi (hoặc sử dụng dạy học theo góc).
- Kỹ thuật sử dụng phương tiện trực quan.
- Dạy học nêu và giải quyết vấn đề thông qua các dạng câu hỏi trong SGK.
III. TIẾN TRÌNH DẠY HỌC:
A. BẢNG TÓM TẮT CÁC HOẠT ĐỘNG: Hoạt
Mục tiêu Nội dung dạy học trọng tâm PPDH- động KTDH Đánh giá học(thời gian) Phương Công pháp cụ HĐ 1: 1.giới
1. Nhện nước di chuyển nhẹ nhàng - Đặt vấn Hình ảnh
thiệu liên trên mặt nước; thạch sùng, tắc kè di đề GV trực quan kết chuẩn bị
hydrogen, chuyển dễ dàng trên trần nhà; . . sẵn các Khởi tương tác hình ảnh động- van der
2. Hydrogen sulfide (H2S) có khối
lượng phân tử lớn hơn nước (H - - cho 2O) kết Waals.
nhưng vì sao nhiệt độ sôi của H HS quan 2S sát các nối
(-60 °C) lại thấp hơn nhiều so với
nhiệt độ sôi của nước (100 °C)? hình ảnh ( 5 phút) HĐ 2: 2. Tìm I. LIÊN KẾT HYDROGEN 1. Từ Phiếu Điểm hiểu về việc quan số sát Hình học tập liên kết 11.1 số hydrogen trong SGK, GV 1,2,3,4 đặt vấn (20 phút) đề về sự
Hình 11.2. Liên kết hydrogen giữa các phân cực phân tử nước của một liên kết. Từ các hình 11.2 và 11.3 trong SGK, GV yêu cầu - L Hì iê
n nh k
1 ế1.t3.hyLdiêrongkeếnt ghiyữdarocgáecn phân HS trình tử
gi lữàa lựcácc hpúhtâtĩnnthử đaiệmnmgoiữniaa nguyên bày bản
tử H (đã liên kết với một nguyên tử chất của
mang độ âm điện lớn, thường là F, liên kết
O, N) ở phân tử này với một hydrogen.
nguyên tử phi kim mang điện tích 2. GV
âm lớn (thường là F, O, N) còn cặp chia lớp
electron hoá trị chưa tham gia liên thành 6 kết ở phân tử khác. nhóm,
- Liên kết hydrogen được biểu diễn mỗi bằng dấu ba chấm (. .). nhóm lần
- Do lực hút tĩnh điện yếu giữa lượt quan
nguyên tử hydrogen tích một phần sát các
điện tích dương với một nguyên tử hình 11.2
có độ âm điện lớn tích một phần và 11.3
điện tích âm nên liên kết hydrogen trong
yếu hơn So với liên kết cộng hoá trị SGK. GV
và liên kết ion là các loại liên kết yêu cầu
hình thành nên liên kết hoá học Ở từng các phân tử. nhóm HS trả lời lần
Luyện tập Điều gì đã khiến H2O lượt các
có nhiệt độ sôi cao hơn H2S? Giải câu hỏi thích. thảo luận
Nước có nhiệt độ sôi cao hơn 1, 2, 3, 4,
H2S do giữa nước có liên kết 5 và 6
hydrogen giữa các phân tử. Do trong
sulfur (S) có độ âm điện nhỏ SGK.
nên giữa các phân tử H2S không
có khả năng tạo liên kết hydrogen với nhau. HĐ 3: 3.Tìm Nhiệm Phiếu Điểm hiểu vai
* Tìm hiểu vai trò, ảnh vụ: Từ số trò, ảnh hưởng của liên kết việc quan học tập hưởng sát các số 5,6,7 của liên
hydrogen tới tính chất vật lí hình 11.4, kết của nước 115 và hydrogen 11,6 (15 tới tính
So với các hợp chất có cấu trúc trong chất vật SGK, GV phút) lí của
phân tử tương tự, các hợp chất có yêu cầu nước
liên kết hydrogen đều có nhiệt độ HS cung cấp các
sôi cao hơn do tạo được liên kết thông tin
hydrogen liên phân từ và tan tốt về tính chất vật lí
hơn trong nước do tạo được liên của nước.
kết hydrogen với các phân từ GV so sánh một
nước. Nước là một hợp chất có vài thông
nhiệt độ nóng chảy và nhiệt độ số vật lý giữa H
sôi cao hơn so với nhiều hợp chất 2O với NH3,
có cùng cấu trúc phân tử nhưng là chất có khối
không tạo được liên kết hydrogen lượng
giữa các phân tử với nhau. mol xấp xỉ với
Ngoài ra, nước còn là một dung nước để
môi tốt, không chỉ hoà tan được nổi bật
nhiều hợp chất ion, mà còn hoà các tính chất vật lí
tan được nhiều hợp chất có liên riêng của
kết cộng hoá trị phân cực. Đặc nước.
biệt, các hợp chất có thể tạo liên Tổ chức dạy học:
kết hydrogen với nước thường GV chia lớp làm 2 nhóm, một nhóm nêu các tính chất vật lí
tan tốt trong nước. Hầu hết các của nước
phàn ứng hoá học quan trọng đối và một
với sự sống đều diễn ra ở môi nhóm vận dụng các
trường nước bên trong tế bào. kiến thức đã học để giải thích 8* 8* 8" các tính
• • • H ---- 0 • ■ • H ---- o chất vật \_ \. ộ- 8* lý trên 8- 8* R
H • • • O ---- H • • • của nước, Ọ H • • • giúp HS 8* / / thảo luận R H các câu 8+ hỏi 4
Hình 11.4. Liên kết hydrogen
giửa alcohol và nước
Nước ở trạng thái rắn có
thể tích lớn hơn khi ở trạng
thái lỏng. Đó là do nước đá
có cấu trúc tinh thể phân tử
với bốn phân tử H,o phân
bố ở bốn đỉnh của một tứ
diện đều, bên trong là cấu
trúc rỗng (Hình 11.6). Điều
này lí giải tại sao nước đá
nổi được trên mặt nước lỏng
Hình 11.5. Liên kết hydrogen giửa ammonia và nước
Hình 11.6. Cấu trúc cùa tinh thế phân tử nước đá
Giải thích vì sao một phân tử nước
có thề tạo được liên kết hydrogen
tối đa với bón phân tử nước khác.
Nhờ CÓ liên kết hydrogen mà ở
điều kiện thườngnước ở thề lỏng,
có nhiệt độ sôi cao (100 °C). HĐ 4: 4.Giới
II. TƯƠNG TÁC VAN DER Nhiệm Phiếu Luyện thiệu về WAALS vụ: Từ Điểm việc quan học tập tập tương tác
1. Giới thiệu về tương tác số sát các số ( 20 van der
van der Waals (van đơ hình 11.7 và 11.8 8,9,10,11 phút) Waals Van) trong SGK, GV
Các phân từ có lưỡng cực đặt vấn
tạm thời củng có thể làm đề về sự hình
các phân từ lân cận xuất thành các
hiện các lường cực cảm lưỡng cực tạm thời
ứng. Do đó, các phân từ có và lưỡng
thể tập hợp thành một cực cảm ứng, cũng
mạng lưới với các tương như các
tác lưỡng cực cảm ứng , cách hút nhau của chúng trong việc hình thành tương tác van der Waals.Tổ chức dạy
được gọi là tương tác van học: GV der Waals (Hình 11.8). chia lớp thành 5
Bảng 11.1. Nhiệt độ sôi và nhóm,
nhiệt độ nóng chảy của các khí hiế yê m u cầu và giúp từng nhóm HS trả lời lần lượt các câu hỏi thảo luận 9, 10, 11, 12 và 13 trong SGK. Khí hiếm He Ne Ar Xe Kr Rn Nhiệt độ nóng - - - - - -
272 °C 247 °C 189 °C 157 °C 119 °C 71 °C chày Nhiệt - - - - - - độ sỏi
269 °C 246 °C 186 °C 152 °C 108 °C 62 °C • Tương tác van der Waals là
lực tương tác yếu giữa các phân tử,
được hình thành do sự xuất hiện
cùa các lưỡng cực tạm thời và lưỡng cực cảm ứng. • Tương tác van der Waals
làm tăng nhiệt độ nóng chảy và
nhiệt độ sôi của các chất. Khi khói
lượng phân tử tăng, kích thước
phân tử tăng thì tương tác van der Waals tăng. B. CÁC HOẠT ĐỘNG:
HĐ 1. Hoạt động khởi động-kết nối : Thời gian: phút
giới thiệu liên kết hydrogen, tương tác van der Waals. 1. Mục tiêu: 1
2. Tiến trình tổ chức hoạt động: a. Nhiệm vụ:
-GV chuẩn bị sẵn các hình ảnh –
b. Thực hiện nhiệm vụ:
Cho HS quan sát các hình ảnh
c. Báo cáo- thảo luận:
1. nhện nước di chuyển nhẹ nhàng trên mặt nước; thạch sùng, tắc kè di chuyển dễ dàng trên trần nhà; . .
2. Hydrogen sulfide (H2S) có khối lượng phân tử lớn hơn nước (H2O) nhưng vì sao nhiệt độ sôi của H2S
(-60 °C) lại thấp hơn nhiều so với nhiệt độ sôi của nước (100 °C)?
HĐ 2. Tìm hiểu về liên kết hydrogen Thời gian: phút 1. Mục tiêu: 2
2. Tiến trình tổ chức hoạt động: a. Giao nhiệm vụ:
GV chia lớp thành 6 nhóm, mỗi nhóm lần lượt quan sát các hình 11.2 và 11.3 trong SGK.
GV yêu cầu từng nhóm HS trả lời lần lượt các câu hỏi thảo luận 1, 2, 3, 4 trong SGK.
b. Thực hiện nhiệm vụ - Báo cáo- thảo luận::
- Từ việc quan sát Hình 11.1 trong SGK, GV đặt vấn đề về sự phân cực của một liên kết.
- Từ các hình 11.2 và 11.3 trong SGK, GV yêu cầu HS trình bày bản chất của liên kết hydrogen.
c. Phương pháp công cụ đánh giá và kết luận
1. Giữa liên kết S-H và liên kết 0-H, liên kết nào phân cực mạnh hơn? Vì sao?
2. Quan sát các hình từ 11.2 đến 11.3, hãy hiểu thế nào là liên kết hydrogen giữa các phân tử?
3. So sánh độ bền của liên kết hydrogen với liên kết cộng hoá trị và liên kết ion.
4. Điều gì đã khiến H2O có nhiệt độ sôi cao hơn H2S? Giải thích.
d. Sản phẩm học sinh cần đạt:
1. Do oxygen có độ âm điện mạnh hơn sulfur nên kết 0-H phân cực mạnh hơn so với liên kết S-H. 2. (Nội dung trọng tâm)
3. Nước có nhiệt độ sôi cao hơn H2S do giữa nước có liên kết hydrogen giữa các phân tử. Do sulfur (S) có
độ âm điện nhỏ nên giữa các phân tử H2S không có khả năng tạo liên kết hydrogen với nhau.
4. Nước có nhiệt độ sôi cao hơn H2S do giữa nước có liên kết hydrogen giữa các phân tử. Do sulfur (S) có
độ âm điện nhỏ nên giữa các phân tử H2S không có khả năng tạo liên kết hydrogen với nhau. HĐ 3.
Tìm hiểu vai trò, ảnh hưởng của liên kết hydrogen tới tính chất vật lí của nước Thời gian: phút 1. Mục tiêu: 3
2. Tiến trình tổ chức hoạt động:
a. Giao nhiệm vụ: GV chia lớp làm 2 nhóm.
Nhóm1: nêu các tính chất vật lí của nước
Nhóm 2: vận dụng các kiến thức đã học để giải thích các tính chất vật lý trên của nước, giúp HS thảo luận các câu hỏi
b. Thực hiện nhiệm vụ - Báo cáo- thảo luận:
Từ việc quan sát các hình 11.4, 115 và 11,6 trong SGK, GV yêu cầu HS cung cấp các thông tin về tính
chất vật lí của nước. GV so sánh một vài thông số vật lý giữa H2O với NH3, là chất có khối lượng mol xấp
xỉ với nước để nổi bật các tính chất vật lí riêng của nước
c. Phương pháp công cụ đánh giá và kết luận
1.So sánh nhiệt độ sôi và khả năng hòa tan trong nước giữa NH3 và CH4. Giải thích.
2.Giải thích vì sao một phân tử nước có thể tạo được liên kết hydrogen tối đa với bốn phân tử nước khác? Vận dụng
* Vì sao nên tránh ướp lạnh các lon bia, nước giải khát, . . trong ngăn đá của tủ lạnh?
d.Sản phẩm học sinh cần đạt:
1. Do chỉ có NH3, có khả năng tạo liên kết hydrogen với nước nên NH3 tan tốt trong nước so với CH4.
2. Mỗi phân tử nước có đúng hai nguyên tử hydrogen δ+ và hai cặp electron chưa tham gia liên kết trên
oxygen. Do mỗi một trong số các nguyên tử hydrogen δ+ và cặp electron trên Oxygen đều có thể tham gia
vào liên kết hydrogen nên một phân tử nước riêng lẻ có thể liên kết hydrogen với tối đa bốn phân tử nước khác như sau:
Liên kết hydrogen liên phân tử Vận dụng
Do nước đá có cấu trúc tinh thể phân tử với bốn phân tử H2O phân bố ở bốn đỉnh của một tứ diện đều,
bên trong là cấu trúc rỗng nên nước ở trạng thái rắn có thể tích lớn hơn khi trạng thái lỏng. Điều này
khiến các lon bia, nước giải khát, . . khi làm lạnh trong ngăn đá của tủ lạnh có thể phát nổ do sự tăng thể tích của nước.nước HĐ 4.
Giới thiệu về tương tác van der Waals Thời gian: phút 1. Mục tiêu: 4
2. Tiến trình tổ chức hoạt động: a. Giao nhiệm vụ:
GV chia lớp thành 5 nhóm, yêu cầu và giúp từng nhóm HS trả lời lần lượt các câu hỏi thảo luận 9, 10, 11, 12 và 13 trong SGK.
b. Thực hiện nhiệm vụ- Báo cáo- thảo luận::
Từ việc quan sát các hình 11.7 và 11.8 trong SGK, GV đặt vấn đề về sự hình thành các lưỡng cực tạm
thời và lưỡng cực cảm ứng, cũng như các cách hút nhau của chúng trong việc hình thành tương tác van der Waals.
c. Phương pháp công cụ đánh giá và kết luận
1.Quan sát Hình 117, cho biết thế nào là một lưỡng cực tạm thời?
2. Các lưỡng cực tạm thời và lưỡng cực cảm ứng hút nhau bằng lực hút nào?
3. Giải thích xu hướng biến đổi bán kính nguyên tử, nhiệt
độ nóng chảy và nhiệt độ sôi của các nguyên tố khí hiếm trong Bảng 11.1. Vận dụng
* Tại sao nhện nước có thể di chuyển trên mặt nước?
d. Sản phẩm học sinh cần đạt:
1. Trong phân tử, các electron di chuyển một cách ngẫu nhiên xung quanh hạt nhân dẫn đến tại một thời
điểm bất kì nào đó, có thể có nhiều electron ở một bên của phân tử, tạo ra một lượng điện tích âm tạm
thời ở phía này và một lượng điện tích dương tạm thời ở phía bên kia, tức tạo một lưỡng cực tức thời.
2. Các lưỡng cực tạm thời và lưỡng cực cảm ứng hút nhau bằng lực hút tĩnh điện.
3. Trong nhóm VIIIA, khi đi từ helium (He) đến radon (Rn), số lớp electron tăng dần làm bán kinh nguyên tử cũng tăng dần.
- Từ helium đến radon, kích thước nguyên tử và số electron tăng dần làm tương tác van der Waals
giữa các nguyên tử khí hiếm cũng tăng dần, dẫn đến nhiệt độ nóng chảy và nhiệt độ sôi từ helium đến radon tăng dần. Vận dụng
- Mỗi phân tử nước đều tạo liên kết hydrogen với các phân tử nước xung quanh theo mọi hướng, trừ các
phân tử nằm ở bề mặt. Điều này tạo ra sức căng bề mặt biến mọi bề mặt nước thành một “màng căng” vô hình.
- Một số côn trùng như nhện nước có khối lượng rất nhỏ. Vì vậy, chân của chúng không chọc thủng được
màng căng này mà chỉ tạo ra “vết lún” trên bề mặt, cho phép côn trùng di chuyển được trên mặt nước. IV. HỒ SƠ DẠY HỌC: 1. Nội dung HS ghi bài: I LIÊN KẾT HYDROGEN
- Liên kết hydrogen giữa các phân tử là lực hút tĩnh điện giữa nguyên tử H (đã liên kết với một nguyên tử mang
độ âm điện lớn, thường là F, O, N) ở phân tử này với một nguyên tử phi kim mang điện tích âm lớn (thường là
F, O, N) còn cặp electron hoá trị chưa tham gia liên kết ở phân tử khác.
- Liên kết hydrogen được biểu diễn bằng dấu ba chấm (. .).
- Do lực hút tĩnh điện yếu giữa nguyên tử hydrogen tích một phần điện tích dương với một nguyên tử có độ âm
điện lớn tích một phần điện tích âm nên liên kết hydrogen yếu hơn So với liên kết cộng hoá trị và liên kết ion là các loại liên
kết hình thành nên liên kết hoá học Ở các phân tử.
Luyện tập Điều gì đã khiến H2O có nhiệt độ sôi cao hơn H2S? Giải thích.
Nước có nhiệt độ sôi cao hơn H2S do giữa nước có liên kết hydrogen giữa các phân tử. Do sulfur (S) có
độ âm điện nhỏ nên giữa các phân tử H2S không có khả năng tạo liên kết hydrogen với nhau.
2. Tìm hiểu vai trò, ảnh hưởng của liên kết hydrogen tới tính chất vật lí
So với các hợp chất có cấu trúc phân tử tương tự, các hợp chất có liên kết hydrogen đều có nhiệt độ sôi cao
hơn do tạo được liên kết hydrogen liên phân từ và tan tốt hơn trong nước do tạo được liên kết hydrogen với
các phân từ nước. Nước là một hợp chất có nhiệt độ nóng chảy và nhiệt độ sôi cao hơn so với nhiều hợp chất
có cùng cấu trúc phân tử nhưng không tạo được liên kết hydrogen giữa các phân tử với nhau.
Ngoài ra, nước còn là một dung môi tốt, không chỉ hoà tan được nhiều hợp chất ion, mà còn hoà tan được
nhiều hợp chất có liên kết cộng hoá trị phân cực. Đặc biệt, các hợp chất có thể tạo liên kết hydrogen với nước
thường tan tốt trong nước. Hầu hết các phàn ứng hoá học quan trọng đối với sự sống đều diễn ra ở môi trường
Hình 11.5. Liên kết hydrogen giửa ammonia và nước nước bên trong tế bào. 8* 8* 8"
• • • H ------------ 0 • ■ • H ------------- o \_ \. ộ- 8* 8- 8* R
H • • • O --------------H • • • Ọ -------------- H • • • 8* / / R H 8+
Hình 11.4. Liên kết hydrogen giữa alcohol và nước
Nước ở trạng thái rắn có thể tích lớn hơn khi ở trạng thái lỏng. Đó là do nước đá có cấu trúc tinh thể phân tử
với bốn phân tử H,o phân bố ở bốn đỉnh của một tứ diện đều, bên trong là cấu trúc rỗng (Hình 11.6). Điều này
lí giải tại sao nước đá nổi được trên mặt nước lỏng
Hình 11.6. Cấu trúc cùa tinh thế phân tử nước đá
Giải thích vì sao một phân tử nước có thề tạo được liên kết hydrogen tối đa với bón phân tử nước khác.
Nhờ CÓ liên kết hydrogen mà ở điều kiện thườngnước ở thề lỏng, có nhiệt độ sôi cao (100 °C).
II. TƯƠNG TÁC VAN DER WAALS
1. Giới thiệu về tương tác van der Waals (van đơ Van)
Các phân từ có lưỡng cực tạm thời củng có thể làm các phân từ lân cận xuất hiện các lường cực cảm
ứng. Do đó, các phân từ có thể tập hợp thành một mạng lưới với các tương tác lưỡng cực cảm ứng , được gọi là tương tác van der Waals (Hình 11.8). Khí hiếm He Ne Ar Xe Kr Rn Nhiệt độ
Bảng 11.1. Nhiệt độ sôi và nhiệt độ nóng chảy của các khí hiếm
nóng chày -272 °C -247 °C -189 °C -157 °C -119 °C -71 °C Nhiệt độ sôi
-269 °C -246 °C -186 °C -152 °C -108 °C -62 °C •
Tương tác van der Waals là lực tương tác yếu giữa các phân tử, được hình thành do sự xuất hiện cùa các
lưỡng cực tạm thời và lưỡng cực cảm ứng. •
Tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất. Khi khói lượng phân
tử tăng, kích thước phân tử tăng thì tương tác van der Waals tăng.
2. Hình ảnh trực quan và phiếu học tập:
Nhện nước di chuyển nhẹ nhàng trên mặt nước
PHIẾU HỌC TẬP SỐ 1
Giữa liên kết S-H và liên kết 0-H, liên kết nào phân cực mạnh hơn? Vì sao?
PHIẾU HỌC TẬP SỐ 2
Quan sát các hình từ 11.2 đến 11.3, hãy hiểu thế nào là liên kết hydrogen giữa các phân tử?
PHIẾU HỌC TẬP SỐ 3
So sánh độ bền của liên kết hydrogen với liên kết cộng hoá trị và liên kết ion
PHIẾU HỌC TẬP SỐ 4
Điều gì đã khiến H2O có nhiệt độ sôi cao hơn H2S? Giải thích.
PHIẾU HỌC TẬP SỐ 5
So sánh nhiệt độ sôi và khả năng hòa tan trong nước giữa NH3 và CH4. Giải thích.
PHIẾU HỌC TẬP SỐ 6
.Giải thích vì sao một phân tử nước có thể tạo được liên kết hydrogen tối
đa với bốn phân tử nước khác?
PHIẾU HỌC TẬP SỐ 7
Vì sao nên tránh ướp lạnh các lon bia, nước giải khát, . . trong ngăn đá của tủ lạnh?
PHIẾU HỌC TẬP SỐ 8
Quan sát Hình 117, cho biết thế nào là một lưỡng cực tạm thời?
PHIẾU HỌC TẬP SỐ 9
Các lưỡng cực tạm thời và lưỡng cực cảm ứng hút nhau bằng lực hút nào?
PHIẾU HỌC TẬP SỐ 10
Giải thích xu hướng biến đổi bán kính nguyên tử, nhiệt
độ nóng chảy và nhiệt độ sôi của các nguyên tố khí hiếm trong Bảng 11.1.
PHIẾU HỌC TẬP SỐ 11
Tại sao nhện nước có thể di chuyển trên mặt nước? V. BÀI TẬP 30 phút 1. Đáp án B. 2. Đáp án D. 3. Đáp án A. 4. a) b) 5.
Tuy có phân tử khối thấp hơn, nhưng do
chỉ có NH3 tạo được liên kết hydrogen
giữa các phân tử với nhau nên NH3 có nhiệt độ sôi cao hơn so với PH3,. Tương tự, do cũng chỉ có NH3 tạo được
liên kết hydrogen với nước nên NH3 tan tốt trong nước so với PH3 rất ít tan trong nước. TRƯỜNG THPT CHƠN THÀNH TỔ HÓA HỌC KHỐI 10 CHƯƠNG 4
PHẢN ỨNG OXI HÓA - KHỬ
Bài: PHẢN ỨNG OXI HÓA KHỬ Số tiết: 4 Tiết I. MỤC TIÊU DẠY HỌC:
Sau bài học này HS đạt được các năng lực và phẩm chất sau: YÊU CẦU CẦN ĐẠT
Nhận thức hóa học
1. (3). Nêu được khái niệm và xác định số oxi hóa của các
nguyên tử các nguyên tố trong hợp chất.
2. (4). Nêu được khái niệm về phản ứng oxi hóa - khử và ý NĂNG LỰC HÓA
nghĩa của phản ứng oxi hóa – khử. HỌC
3. (5). Xác định được số oxi hóa của các nguyên tử các nguyên tố.
4. (6). Cân bằng được phản ứng oxi hóa - khử
theo phương pháp thăng bằng electron.
Vận dụng kiến thức,
5. (7) Phát hiện, mô tả, giải thích được một số
kĩ năng đã học
hiện tượng về phản ứng trong cuộc sống và
trong tự nhiên, ứng dụng của hoá học trong cuộc sống.
Năng lực tự chủ và tự 6. (1) Chủ động, tích cực tự nghiên cứu để hoàn thành học
nhiệm vụ học tập. Trong quá trình hoạt động nhóm, chủ
động phân công nhiệm vụ cho các thành viên của nhóm,
tự quyết định cách thức thực hiện nhiệm vụ, giúp đỡ các
thành viên trong nhóm hoàn thành nhiệm vụ.
-Điều chỉnh được thái độ, hành vi của bản thân; luôn bình NĂNG LỰC
tĩnh và có cách cư xử đúng. CHUNG
- Sẵn sàng đón nhận và quyết tâm vượt qua thử thách trong học tập.
Giao tiếp và hợp tác
7.(2)-Biết chủ động trong giao tiếp; tự tin và biết kiểm
soát cảm xúc, thái độ khi nói trước nhiều người. Nhận
biết và thấu cảm được suy nghĩ, tình cảm, thái độ của người khác.
– Biết sử dụng ngôn ngữ kết hợp với các loại phương tiện phi
ngôn ngữ đa dạng để trình bày thông tin, ý tưởng và để thảo
luận, lập luận, đánh giá về các vấn đề trong khoa học, phù hợp với khả năng.
- Biết chủ động đề xuất mục đích hợp tác để giải quyết một
vấn đề do bản thân và những người khác đề xuất; biết lựa
chọn hình thức làm việc nhóm với phù hợp với yêu cầu và nhiệm vụ.
- Phân tích được các công việc cần thực hiện để hoàn thành
nhiệm vụ của nhóm; sẵn sàng nhận công việc khó khăn của nhóm.
-Biết theo dõi tiến độ hoàn thành công việc của từng thành
viên và cả nhóm để điều hoà hoạt động phối hợp; biết khiêm
tốn tiếp thu sự góp ý và nhiệt tình chia sẻ, hỗ trợ các thành viên trong nhóm. PHẨM CHẤT Chăm chi
(8)Tích cực tìm tòi, sáng tạo trong học tập, có ý chí vượt
qua khó khăn hoàn thành nhiệm vụ học tập. Trách nhiệm
(9) Tích cực, tự giác, nghiêm túc hoàn thành các nhiệm
vụ học tập. Sẵn sàng chịu trách nhiệm về những lời nói và
hành động của bản thân.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU 1. Học liệu
- Một số hình ảnh về phản ứng oxi hóa khử, nguyên nhân.
+ Video ý nghĩa của phản ứng oxi hóa khử với cuộc sống. + Các phiếu học tập.
Phiếu học tập số 1,2,3: Xác định sự thay đổi số oxi hóa của một số nguyên tố trong phản ứng oxi hóa khử; xác
định chất khử và chất oxi hoá, biểu diễn quá trình oxi hóa khử, cân bằng phản ứng oxi hóa khử theo phương pháp thăng bằng electron.
Phiếu học tập số 4: luyện tập 2. Thiết bị:
- Máy chiếu, máy vi tính, bảng phụ
III. TIẾN TRÌNH DẠY HỌC
B. MÔ TẢ CHUNG CÁC HOẠT ĐỘNG HỌC Hoạt động Mục
Nội dung dạy học trọng PPDH- Đánh giá học (thời tiêu tâm KTDH Phương Công cụ gian) pháp HĐ khởi Tạo - Trực quan. Quan sát, hỏi Câu hỏi. động hứng thú - Thảo luận đáp. (10 phút)? và nhu theo cặp đôi cầu tìm hiểu kiến thức HĐ 1: 1,8 Số oxi hóa - Dạy học
Đánh giá qua Câu hỏi. HTKT hợp tác. sản phẩm. (35 phút) HĐ 2: 2,3,8
Chất khử-chất oxi hoá; sự - Dạy học Đánh giá qua Câu hỏi. HTKT
khử-sự oxi hoá, hiểu thế hợp tác. sản phẩm. (35 phút)
nào là phản ứng oxi hóa- khử. HĐ 3: 4
Lập phương trình hoá học - Dạy học Đánh giá qua Câu hỏi. HTKT
của phản ứng oxi hoá khử hợp tác, đàm sản phẩm. (45 phút) (cân bằng theo phương thoại, nêu
pháp thăng bằng electron) vấn đề. HĐ 4: 2,6
ý nghĩa của phản ứng oxi - Dạy học Đánh giá qua Bảng hỏi HTKT hóa- khứ hợp tác. sản phẩm. ngắn . (10 phút) HĐ 4:: 1,2,3
- Thuyết trình Đánh giá qua Rubric, Luyện tập theo chủ đề,
sản phẩm. hỏi câu hỏi. (40 phút) trò chơi. đáp, viết. HĐ 4: Vận 2,5,7 - Hợp tác Đánh giá qua Câu hỏi. dụng và mở sản phẩm rộng (5 phút)
B. CÁC HOẠT ĐỘNG HỌC
HĐ 1. Hoạt động khởi động-kết nối Thời gian: 10 phút 1. Mục tiêu:
HS huy động được một số kiến thức, kĩ năng, kinh nghiệm đã có của bản thân về các phản ứng oxi
hóa – khử xảy ra trong đời sống thực tiễn để kích thích sự tò mò, mong muốn tìm hiểu bài học mới.
2. Tổ chức hoạt động học: a. Giao nhiệm vụ:
- GV chiếu một số hình ảnh về các phản ứng: Đinh sắt bị gỉ, đốt cháy than, củi quá trình luyện
gang, thép trong nhà máy . .yêu cầu HS quan sát.
(1) Em thấy những hiện tượng hóa học gì qua các hình ảnh trên?
(2) Nguyên nhân nào dẫn đến các hiện tượng hóa học trên?
b. Thực hiện nhiệm vụ:
- HS xem hình ảnh và thảo luận theo cặp để trả lời câu hỏi.
c. Báo cáo- thảo luận:
- Học sinh xung phong trình bày trước lớp, các học sinh khác bổ sung.
e. Sản phẩm học sinh cần đạt:
- HS nhận biết mô tả được các hiện tượng.
- Nêu được các hiện tượng trên là do phản ứng hóa học giữa các chất.
d. Phương pháp công cụ đánh giá và kết luận
- GV nhận xét và đặt vấn đề vào bài
Trong các hiện tượng trên đều xảy ra phản ứng thuộc loại oxi hóa khử.
HOẠT ĐỘNG HÌNH THÀNH KIẾN THỨC HĐ 1. SỐ OXI HÓA Thời gian: 35 phút 1. Mục tiêu: 1,8
2. Tổ chức hoạt động: -Chia lớp thành 4 nhóm, nhóm trưởng, thư kí a. Giao nhiệm vụ:
Yêu cầu HS nghiên cứu SGK trả lời những câu hỏi trong phiếu học tập số 1:
Phiếu học tập số 1
1) - Xác định điện tích trên các nguyên tử trong các phân tử: NaCl
Viết công thức electron của phân tử HCl. Cho biết điện tích của nguyên tử H và nguyên tử
clo là bao nhiêu nếu giả sử rằng các electron dùng chung chuyển hẳn về phía nguyên tử có độ âm điện lớn hơn?
- Nêu khái niệm số oxi hóa? Cách biểu diễn số oxi hóa?
2) Xác định số oxi hóa của các nguyên tố trong các chất sau: NaCl, Cu, HCl, O2, H2SO4, NH3,
NO3-, NH4+, Fe2(SO4)3 (giải thích cách làm).
Gợi ý: đọc, vận dụng các quy tắc tính số oxi hóa.
3) Nêu cách xác định số oxi hóa?
b. Thực hiện nhiệm vụ:
HS làm việc theo nhóm, các nhóm phân công nhiệm vụ cho từng thành viên hoàn thành phiếu học tập số 1. - Nghiên cứu SGK
- Thảo luận thống nhất ý kiến
- Trình bày câu 2 vào bảng phụ
c. Báo cáo- thảo luận:
Câu 1: 1 HS trả lời, các thành viên khác nhận xét, phản biện.
Câu 2: Các nhóm triưng bày sản phẩm, 1 nhóm báo cáo sản phẩm, 3 nhóm còn lại nhận xét, đánh giá.
Câu 3: Các nhóm tham gia chơi trò “Ai nhanh hơn”. Câu hỏi thảo luận
- Bạn đã áp dụng quy tắc cụ thể nào, làm như thế nào để tính số oxi hóa của các nguyên tố?
- Em có nhận xét gì về số oxi hóa của nguyên tố kim loại và các gốc axit trong hợp chất (về dấu và sự liên quan với hóa trị)?
d. Sản phẩm học sinh cần đạt:
Câu 1: NaCl được tạo bởi ion Na+ và Cl-, điện tích của Na là 1+, của Cl là 1-
Trong phân tử HCl, giữa nguyên tử H và nguyên tử Cl liên kết nhau bằng 1 cặp electron chung,
nguyên tử clo có độ âm điện lớn hơn. Nếu cặp e chung lệch hẳn về phía nguyên tử clo thì nguyên tử H
mất 1 e nên mang điện tích là 1+, nguyên tử clo được thêm 1 e nên mang diện tích là 1-.
Số oxi hóa là điện tích xuất hiện trên nguyên tử khi giả định cặp electron dùng chung chuyển hẳn về
phía nguyên tử có độ âm điện lớn hơn.
Biểu diễn số oxi hóa: Dấu phía trước số, ví dụ: +1 Câu 2:
+ +1−1, 0 , +1−1; 0 ; +1+6−2; −3+1; +5−2 +1 +6 −2
�� �� �� � �� � −; −3 +; +3
2 �2 � �4 � �3 � �3 � �4 ��2( � �4)3
Câu 3: Số oxi hóa được tính theo Quy tắc xác định số oxi hóa.
Quy tắc 1: Trong các đơn chất, số oxi hóa của các nguyên tố bằng không.
Quy tắc 2: Trong hầu hết các hợp chất, số oxi hóa của hidro bằng +1 (trừ một số trường hợp đặc
biệt như hidrua kim loại NaH, CaH2…). Số oxi hóa của oxi bằng -2 (trừ OF2, H2O2…).
Quy tắc 3: Trong một phân tử, tổng số oxi hóa của các nguyên tố bằng không.
Quy tắc 4: Trong ion đơn nguyên tử, số oxi hóa của nguyên tố bằng điện tích của ion đó.
Trong ion đa nguyên tử, tổng số oxi hóa của các nguyên tố bằng điện tích của ion đó.
Hệ quả: Trong hợp chất số oxi hóa của kim loại bằng + hóa trị.
Số oxi hóa của cả gốc axit bằng – hóa trị.
e. Phương pháp công cụ đánh giá và kết luận
- Đánh giá qua sản phẩm của HS và dùng bảng hỏi ngắn
Câu hỏi: Xác định số oxi Trả lời KQ hóa
Câu 1: Số oxi hóa của nguyên tố Mn trong đơn chất Mn
Câu 2: Số oxi hóa của nguyên tố S trong H2S
Câu 3: Số oxi hóa của nguyên tố N trong N2O
Câu 4: Số oxi hóa của nguyên tố Cl trong ion Cl-
Câu 5: Số oxi hóa của nguyên tố S trong ion H2SO4
Câu 6: Số oxi hóa của nguyên tố Fe trong ion Fe(NO3)2
Câu 7: Số oxi hóa của nguyên tố N trong ion NH4+ HĐ 2.
CHẤT KHỬ-CHẤT OXI HOÁ; SỰ KHỬ-SỰ OXI HOÁ, PHẢN ỨNG OXI HÓA-KHỬ. Thời gian: 35 phút 1. Mục tiêu: 2,6,7,8
2. Tiến trình tổ chức hoạt động: a. Giao nhiệm vụ:
- GV yêu cầu học sinh nghiên cứu sách giáo khoa trước ở nhà và hoàn thành phiếu học tập số 2.
PHIẾU HỌC TẬP SỐ 2
1) Điền từ hoặc cụm từ vào chỗ trống và hoàn thành các yêu cầu sau:
- Chất khử là chất…(1)…… electron. Sau phản ứng số oxi hóa nguyên tố trong chất khử tăng hay giảm?
- Chất oxi hóa là chất…(2)… electron. Sau phản ứng, số oxi hóa của nguyên tố trong chất oxi hóa tăng hay giảm?
- Quá trình oxi hóa là quá trình…(3)…… electron.
- Quá trình khử là quá trình…(4)…… electron.
- Chất bị oxi hóa là chất . . (5). .
- Chất bị khử là là chất . (6). .
- Phản ứng oxi hóa – khử là phản ứng hóa học, trong đó có sự ……. . (7)…. .giữa các chất phản
ứng hay phản ứng oxi hóa – khử là phản ứng hóa học trong đó có sự…(8)… số oxi hóa của một số nguyên tố.
Câu 2) Phản ứng Mg + Cl2 MgCl2 có phải là phản ứng oxi hóa khử hay không?
- Làm cách nào em biết một phản ứng là phản ứng oxi hóa khử?
- Nếu phản ứng trên là phản ứng oxi hóa khử, hãy xác định chất khử, chất oxi hóa.
b. Thực hiện nhiệm vụ:
- Học sinh thực hiện nhiệm vụ cá nhân ở nhà.
- HĐ chung cả lớp: Học sinh hoạt động theo nhóm, thảo luận thống nhât ý kiến.
c. Báo cáo- thảo luận:
- GV chụp ảnh sản phẩm của 2 nhóm, trình chiếu hỗ trợ HS báo cáo
- 2 nhóm báo cáo kết quả (mỗi nhóm 1 nội dung), các nhóm khác góp ý, phản biện, bổ sung.
d. Sản phẩm học sinh cần đạt: Câu 1:
+ Chất khử (chất bị oxi hóa) là chất nhường electron, số oxi hóa tăng.
+ Chất oxi hóa (chất bị khử) là chất thu electron, số oxi hóa giảm.
+ Quá trình oxi hóa (sự oxi hóa) là quá trình nhường (cho, mất) electron.
+ Quá trình khử (sự khử) là quá trình thu (nhận lấyu electron.
ĐN: Phản ứng oxi hóa – khử là phản ứng hóa học, trong đó có sự chuyển electron giữa các chất
phản ứng, hay pư oxi hóa – khử là phản ứng hóa học trong đó có sự thay đổi số oxi hóa của một số nguyên tố.
Câu 2: Phản ứng Mg + Cl2 MgCl2 là phản ứng oxi hóa khử hay không
- Muốn biết một phản ứng có phải là phản ứng oxi hóa khử hay không, ta tính số oxi hóa của các
nguyên tố trong phản ứng. Phản ưng oxi hóa khử có nguyên tố có số oxi hóa thay đổi so với trước phản ứng.
Trong phản ứng trên, Mg có số oxi hóa thay đổi từ 0 lên +2; Clo từ 0 xuống -1 => pư oxi hóa
khử. Chất khử là Mg (tăng số oxi hóa), chất oxi hóa là Cl2 (giảm số oxi hóa).
e. Phương pháp công cụ đánh giá và kết luận
* Lưu ý trong phản ứng oxi hóa khử luôn xảy ra đồng thời quá trình oxi hóa và quá trình khử và
tổng số electron nhường đi bằng tổng số electron nhận vào.
Chất khử tham gia quá trình oxi hóa, chất oxi hóa tham gia quá trình khử.
-Công cụ đánh giá: Phiếu học tập số 3
PHIẾU HỌC TẬP SỐ 3 2
1) Cho các quá trình: Fe Fe + 2e 6 4
và : S 2e S
- Hãy cho biết quá trình nào là quá trình oxi hóa, quá trình nào là quá trình khử?
2) Cho 1 ví dụ phản ứng oxi hóa khử, xác định chất khử, chất oxi hóa, chất bị khử, chất bị oxi
hóa, biểu diễn quá trình oxi hóa, quá trình khử và 1 phản ứng không phải là phản ứng oxi hóa khử. HĐ 4
Ý NGHĨA CỦA PHẢN ỨNG OXI HÓA -KHỬ Thời gian: 10 phút 1. Mục tiêu: 2,7
2. Tiến trình tổ chức hoạt động: a. Giao nhiệm vụ:
chia làm 4 nhóm, 2 nhóm làm 1 yêu cầu.
1) Trình bày (kèm hình ảnh, hoặc video ngắn) ứng dụng to lớn của phản ứng oxi hóa khử trong cuộc
sống (lĩnh vực hot, hoặc HS thích) (2-3 VD) phổ biến và có tầm quan trọng trong sản xuất và đời sống.
2) Trình bày (kèm hình ảnh, hoặc video ngắn) tác hại của phản ứng oxi hóa khử phổ biến, ảnh hưởng
nặng trong cuộc sống (2-3 VD).
https://bacdau.vn/ban-can-biet-gi-ve-phan-ung-oxi-hoa-khu
b. Thực hiện nhiệm vụ:
- HS tìm hiểu ở nhà và hoàn thành nhiệm vụ học tập.
- Hs đưa sản phẩm lên nhóm zalo của lớp trong vòng 1 tuần. Các nhóm xem thảo luận đưa ra 3 ưu điểm
và 1 hạn chế cho nhóm làm sản phẩm. Bình chọn xếp hạng A,B,C,D cho sản phẩm của các nhóm.
c. Báo cáo- thảo luận:
HS xem sản phẩm trên nhóm zalo lớp
Các nhóm xem thảo luận đưa ra 3 ưu điểm và 1 hạn chế cho mỗi sản phẩm và bình chọn
d. Phương pháp công cụ đánh giá và kết luận
* Đánh giá sản phẩm của HS thông qua bảng kết quả bình chọn và trình bày của HS
- GV: Nhận xét, chốt kiến thức, cho điểm khuyến khích các nhóm.
e. Sản phẩm học sinh cần đạt (minh họa):
Phản ứng oxi hoá – khử là loại phản ứng hoá học khá phổ biến trong tự nhiên và có tầm quan trọng trong
sản xuất và đời sống. Trong đời sống:
1) Ứng dụng to lớn của phản ứng oxi hóa khử trong cuộc sống:
- Sự hô hấp, quá trình thực vật hấp thụ khí CO2 giải phóng oxi, sự trao đổi chất và hàng loạt quá trình
sinh học khác đều có cơ sở là các phản ứng oxi hoá - khử. duy trình cuộc sống as PTHH: CO 2 + H2O C6H12O6 + O2
- Phần lớn năng lượng ta dùng là năng lượng của phản ứng oxi hoá – khử. Sự cháy của xăng dầu trong
các động cơ đốt trong, sự cháy của than, củi, các quá trình điện phân, các phản ứng xảy ra trong pin, ăc
quy đều là phản ứng oxi hoá – khử.
Đốt gas (bếp gas, bật lửa gas): 2C4H10 + 13O2 → 8CO2 + 10H2O o
Sự cháy của than, củi: C + O t 2 CO2
Trong sản xuất: Là cơ sở của các quá trình sản xuất hoá học như: - Luyện kim.
Luyện gang: Dùng cacbon oxit khử sắt (III) o Fe t 2O3 + 3CO 2Fe + 3CO2
- Pin: đủ các loại . . (điện thoại đang nghiên cứu tìm ra pin có dung lượng lớn, dùng được 1 tháng . . )
2) Tác hại của phản ứng oxi hóa khử:
- Dụng cụ bằng kim loại bị ăn oxi hóa => tổn thất => cách hạn chế
- lão hóa => con người nhanh già => tìm giải pháp chậm lại (trường sinh)
* Nhà khoa học, doanh nghiệp kết nối để phục vụ con người => tạo ra lợi nhuận lớn HĐ 3.
LẬP PHƯƠNG TRÌNH PHẢN ỨNG OXI HÓA KHỬ Thời gian: 45 phút 1. Mục tiêu: 4
2. Tiến trình tổ chức hoạt động: a. Giao nhiệm vụ:
- GV tổ chức hoạt động nhóm (chia lớp thành 4 nhóm), yêu cầu HS nghiên cứu SGK, thảo luận
nhóm hoàn thành nhiệm vụ ở phiếu học tập số 3.
PHIẾU HỌC TẬP SỐ 3
1) Phương pháp thăng bằng electron, dựa trên nguyên tắc nào? Nêu các bước cơ bản cần thực
hiện để cân bằng được một phản ứng oxi hóa khử bằng pp thăng bằng e.
2) Áp dụng: cân bằng phản ứng oxi hóa khử sau bằng phương pháp thăng bằng electron.
a/ C + H2SO4 → CO2 + SO2 + H2O
b/ Cu + HNO3 → Cu(NO3)2 + NO2 + H2O.
Cách tìm hệ số cho axit trong hai phản ứng trên khác nhau như thế nào?
b. Thực hiện nhiệm vụ:
- HS thực hiện công việc của nhóm.
c. Báo cáo- thảo luận:
- HĐ chung cả lớp: bốc thăm chọn nhóm báo cáo, các nhóm còn lại phản biện.
- Cách biểu diễn quá trình oxi hóa và quá trình khử?
- Cách chọn hệ số cho chất khử và chất oxi hóa?
d. Sản phẩm học sinh cần đạt:
Câu 1: + Các bước cân bằng phản ứng oxi hóa khử theo phương pháp thăng bằng electron:
Bước 1: Xác định số oxi hóa của các nguyên tố trong phản ứng để tìm chất khử, chất oxi hóa.
Bước 2: Viết các quá trình khử, quá trình oxi hóa cân bằng mỗi quá trình.
Bước 3: Tìm hệ số thích hợp cho chất khử, chất oxi hóa sao cho tổng số electron do chất khử
nhường bằng tổng số electron do chất oxi hóa nhận
Bước 4: Đặt các hệ số của chất khử và chất oxihóa vào sơ đồ phản ứng, từ đó tính ra hệ số
của các chất khác có mặt trong phương trình hóa học. Câu 2: 0 6 4 4
a/ C H S O C O S O H O 2 4 2 2 2 Chất khử chất oxi hóa 0 4 1
C C 4e 6 4 2
S 2e S 0 6 4 4
C 2 H S O C O 2S O 2H O 2 4 2 2 2 0 5 2 2
b/ Cu H N O Cu NO N O H . O 3 32 2 Chất khử chất oxi hóa 0 2 3
C u Cu 2e 5 2 2
N 3e N
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O.
+ Ở phản ứng 1 hệ số của axit chính là hệ số của chất oxi hóa vì axit chỉ đóng vai trò chất oxi hóa.
Ở phản ứng 2 hệ số của axit lớn hơn hệ số của chất oxi hóa vì một số phân tử axit là chất oxi
hóa và một số phân tử tạo muối (làm môi trường)
e. Phương pháp công cụ đánh giá và kết luận
- GV Hướng dẫn lại các bước cân bằng phản ứng oxi hóa khử. a b
Lưu ý cách biểu diễn quá trình oxi hóa: X X (b a)e c d
và quá trình khử : Y (c d)e Y
Chất khử tham gia quá trình oxi hóa (bị oxi hóa)
Chất oxi hóa tham gia quá trình khử (bị khử)
Bước 4: Đặt hệ số của chất khử, chất oxi hóa và sp của các quá trình oxi hóa khử lên sơ đồ pư,
sau đó kiểm tra và cân bằng cấc nguyên tố khác, thông thường theo thứ tự KL, gốc axit (PK), H, O.
- Cách chọn hệ số: lấy bội số chung bé nhất ….
- Đánh giá hoạt động của cấc nhóm qua quan sát quá trình hoạt động và sản phẩm của nhóm
- Kiểm tra: Cân bằng cấc ptpư sau theo PP thăng bằng e: 1) H2S + O2 SO2 + H2O
2) Fe + H2SO4 - Fe2(SO4)3 + SO2 + H2O HĐ 5. LUYỆN TẬP Thời gian: 45 phút 1. Mục tiêu: 1,2,3
2. Tiến trình tổ chức hoạt động: a. Giao nhiệm vụ:
- Giáo viên tổ chức cho học sinh tham gia chơi game trên Quizizz hoàn thành phiếu học tập số 4.
b. Thực hiện nhiệm vụ:
- HS tham gia game trên Quizizz bằng điện thoại di động; giải thích câu trả lời hoặc nhận xét theo yêu cầu của giáo viên.
c. Báo cáo- thảo luận:
- Tổng hợp, thông báo kêt quả game. Giải quyết các vấn đề còn vướng mắc
- HS trình bày cách cân bằng các ptpu ở các câu 12,13,14,15.
d. Phương pháp công cụ đánh giá và kết luận
- Giáo viên kết luận và đánh giá theo thang điểm cá nhân sau mỗi câu hỏi (trắc nghiệm, điền khuyết).
e. Sản phẩm học sinh cần đạt:
PHIỀU HỌC TẬP SỐ 4
Câu 1: Trong hợp chất nào dưới đây, nguyên tử của nguyên tố nitrogen có số oxi hóa +4? A. NH3. B. NO2. C. HNO3. D. KNO2.
Câu 2: Trong hợp chất K2CO3, số oxi hóa của nguyên tử nguyên tố carbon là A. -4. B. -2. C. +4. D. +2.
Câu 3: Trong ion nào dưới đây, nguyên tử của nguyên tố sulfur có số oxi hóa +4? A. 2 SO . HSO . SO . S O . 4 B. 4 C. 2 3 D. 2 2 3
Câu 4: Trong phản ứng oxi hóa khử thì
A. chất khử là chất nhường electron, có số oxi hóa giảm.
B. chất khử là chất nhường electron, có số oxi hóa tăng.
C. chất khử là chất thu electron, có số oxi hóa giảm.
D. chất khử là chất thu electron, có số oxi hóa tăng.
Câu 5: Phản ứng oxi hóa khử là phản ứng
A. có sự chuyển electron giữa các chất phản ứng.
B. có sự chuyển nguyên tố oxi giữa các chất phản ứng.
C. có sự chuyển nguyên tố hidro giữa các chất phản ứng.
D. có sự chuyển hạt proton giữa các chất phản ứng. 2 3
Câu 6: Hãy cho biết Fe Fe1e là quá trình nào sau đây? A. Oxi hóa. B. Khử. C. Nhận proton.
D. Tự oxi hóa – khử.
Câu 7: Hãy cho biết 6 4
S 2e S là quá trình nào sau đây? A. Oxi hóa. B. Khử. C. Nhận proton.
D. Tự oxi hóa – khử.
Câu 8: Phát biểu nào dưới đây đúng về vai trò của các chất trong phản ứng:
Cl2 + KOH → KCl + KClO3 + H2O?
A. Cl2 là chất oxi hóa, KOH là chất khử.
B. KOH khử Cl2 thành KCl.
C. KOH bị Cl2 oxi hóa thành KClO3.
D. Cl2 vừa là chất khử, vừa là chất oxi hóa.
Câu 10: Trong phản ứng nào dưới đây cacbon thể hiện đồng thời tính oxi hoá và tính khử? o t
A. C 2H2 CH4. o t
B. 3C 4Al Al4C3. o t
C. 3C CaO CaC2 CO. o t
D. C CO2 2CO.
Câu 11: Nhận định nào dưới đây không đúng?
A. Phản ứng oxi hóa khử rất ít xảy ra trong thực tế.
B. Trong đời sống, phần lớn năng lượng ta dùng là năng lượng của phản ứng oxi hóa- khử.
C. Phản ứng oxi hóa- khử là cơ sở hóa học của các quá trình sản xuất gang, thép, nhôm,.
D. Trong sự cháy diễn ra các phản ứng oxi hóa khử.
Câu 12: Cho phương trình hoá học: S + H2SO4 → SO2 + H2O.
Hệ số nguyên và tối giản của chất oxi hoá trong phản ứng trên là . . . . . . . . . . . . . .
Câu 13: Cho phương trình hoá học: aCu + bH2SO4 → cCuSO4 + dSO2 + eH2O.
Tỉ lệ a: b là. . . . . . . . . . . .
Câu 14: Cho phương trình phản ứng: aKBr + bH2SO4 → cBr2 + dSO2 + eK2SO4 + fH2O.
Tổng hệ số cân bằng của các chất trong phương trình trên là. . . . . . . .
Câu 15: Cho phản ứng: KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O.
Tỉ lệ số phân tử HCl đóng vai trò chất khử /tổng số phân tử HCl của phản ứng trên là. . . . . HĐ 6.
VẬN DỤNG TÌM TÒI, MỞ RỘNG Thời gian: 45 phút 1. Mục tiêu: 2,5,7
-Kết nối với chủ đề tiếp theo- Năng lượng hóa học
2. Tiến trình tổ chức hoạt động: a. Giao nhiệm vụ:
- Yêu cầu học sinh tìm hiểu trả lời các câu hỏi sau:
Câu 1. Trong cơ thể người, phản ứng hóa học nào đã trực tiếp tạo ra năng lượng cho cơ thể hoạt động?
Hãy viết ít nhất 1 phương trình phản ứng minh họa và cho biết các phản ứng đó có phải là phản ứng oxi hóa khử hay không?
Câu 2. Phản ứng tạo thành tinh bột trong cây xanh có phải là phản ứng oxi hóa khử hay không, phản
ứng này có ý nghĩa như thế nào?
Câu 3. Thực phẩm bị hỏng khi để lâu trong không khí, quá trình này có xảy ra phản ứng hóa học hay
không? Bảo quản thực phẩm bằng phương pháp hút chân không dựa trên nguyên tắc nào?
Câu 4. Trình bày một số phản ứng oxi hóa khử khác trong thực tế cuộc sống.
b. Thực hiện nhiệm vụ:
Câu 1,2,3: HS làm việc theo nhóm: thảo luận
Câu 4: Học sinh thực hiện nghiên cứu theo nhóm ở nhà và trình bày vào giấy khổ lớn (A1) hoặc thiết kế file powerpoint.
c. Báo cáo- thảo luận:
Một số gợi ý, câu hỏi thảo luận, kết nối
1. Nguồn gốc các chất glucose, amino acid, chất béo trong cơ thể người? (nếu học sinh không nêu được)
2. Làm thế nào để biết các phản ứng trên là phản ứng oxi hóa khử?
3. Nhiều phản ứng sinh ra năng lượng, năng lượng này từ đâu mà có?
d. Sản phẩm học sinh cần đạt:
Câu 1: Trong cơ thể người, tinh bột chuyển hóa thành ghucose, chất đạm (protein) chuyển hóa thành các
amino acid, chất béo bị thủy phân thành glicerol và acid béo sau đó lại được tổng hợp thành chất béo.
Một phần glucozơ, chất béo, amino acid được chuyển đến tế bào, tại đây các chất này bị oxi hóa bởi oxi
tạo ra năng lượng cho cơ thể hoạt động. Ptpư : C6H12O6 + 6O2 6CO2 + 6 H2O
HS có thể viết ptpư của một chất béo hoặc amino acid bất kì.
Các phản ứng này đều thuộc loại phản ứng oxi hóa khử, trong đó oxi là chất oxi hoá.
Câu 2: Phản ứng tạo tinh bột trong cây xanh (còn gọi là phản ứng quang hợp): là phản ứng oxi hóa khử as 6nCO + 5nH O ( C H O ) + 6nO 2 2 diepluc 6 10 5 n 2 Ý nghĩa của phản ứng:
- Cân bằng lượng CO2 và O2 trong không khí.
-Tạo tinh bột làm thực phẩm cho người và nhiều động vật.
Câu 3. Khi để lâu trong không khí, thực phẩm bị hỏng do nhiều nguyên nhân, nhưng luôn có phản ứng
hóa học làm chuyển hóa các chất trong thực phẩm thành nhiều chất gây hại đến sức khỏe con người,
trong đó phản ứng giữa thực phẩm với khí oxi là một trong những phản ứng chủ yếu gây nên hiện tượng này.
Hiện nay, phương pháp hút chân không đã được phổ biến để bảo quản thực phẩm.
Nguyên tắc của phương pháp này là hút hết không khí trong túi thực phẩm, hạn chế tối đa lượng
khí oxi tiếp xúc với thực phẩm, tránh việc các chất trong thực phẩm bị oxi hóa và biến chất. Câu 4: (mở)
- Học sinh bắt thăm báo cáo sản phẩm trước lớp vào đầu tiết học sau, các nhóm nhận xét, phản biện, bổ sung.
e. Phương pháp công cụ đánh giá và kết luận
- Đánh giá qua sản phẩm.
TRƯỜNG THPT PHƯỚC BÌNH TỔ HÓA HỌC KHỐI 10
KẾ HOẠCH BÀI DẠY:
ENTHALPY TẠO THÀNH VÀ BIẾN THIÊN
ENTHALPY CỦA PHẢN ỨNG HÓA HỌC
Thời lượng: 04 tiết – SGK CTST I. MỤC TIÊU DẠY HỌC:
Sau bài học này HS có thể: YÊU CẦU CẦN ĐẠT
Nhận thức hóa học
Trình bày được khái niệm về phản ứng tỏa nhiệt, phản ứng NĂNG LỰC HÓA
thu nhiệt, điều kiện chuẩn (áp suất 1 bar – nhiệt độ 250C HỌC
hoặc 298K, enthalpy tạo thành (nhiệt tạo thành) ∆ o fH298 và
biến thiên enthalpy (nhiệt phản ứng) của phản ứng ∆ o rH298
Nêu được ý nghĩa và dấu ∆ o rH298
Tìm hiểu thế giới tự
Tiến hành được các thí nghiệm về phản ứng tỏa nhiệt và thu
nhiên dưới góc độ hóa nhiệt học
Vận dụng kiến thức, kĩ Tìm hiểu, đưa ra được ví dụ và rút ra kết luận về sự thay đổi năng đã học
nhiệt độ của các quá trình xảy ra trong tự nhiên
Giải quyết vấn đề và
Thảo luận với các thành viên trong nhóm nhằm giải quyết NĂNG LỰC sáng tạo
các vấn đề trong bài học để hoàn thành nhiệm vụ học tập. CHUNG
Giao tiếp và hợp tác
Hoạt động nhóm một cách hiệu quả để hoàn thành các nhiệm vụ được giao.
Năng lực tự chủ và tự
Chủ động, tích cực tìm hiểu về sự đa dạng của năng lượng học
hóa học của hầu hết các phản ứng hóa học cũng như quá
trình chuyển thể của chất PHẨM CHẤT Trung thực
Có ý thức tự học và tự tin trong học tập Trách nhiệm
Nhận biết được tầm quan trọng, vai trò của môn Hóa trong
cuộc sống, phục vụ đời sống con người.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
- Thiết bị dạy học
+ Thiết bị công nghệ, phần mềm: - Học liệu + Học liệu số: + Học liệu khác:
III. TIẾN TRÌNH DẠY HỌC:
HOẠT ĐỘNG KHỞI ĐỘNG-KẾT NỐI Thời gian: phút
1. Mục tiêu: Tạo tâm thế hứng thú cho HS trước khi vào bài học mới.
2. Tiến trình tổ chức hoạt động:
- GV tiến hành hai thí nghiệm:
+ TNA: Đốt một ngọn nến cháy sáng
+ TNB: Hòa tan phân ure vào nước
Yêu cầu học sinh cảm nhận nhiệt độ của hai thí nghiệm trên.
- GV đặt vấn đề về hai thí nghiệm trên để vào bài.
d. Phương pháp công cụ đánh giá và kết luận: Vấn đáp
e.Sản phẩm học sinh cần đạt: Câu trả lời của HS.
HOẠT ĐỘNG HÌNH THÀNH KIẾN THỨC Thời gian: phút
1.PHẢN ỨNG TỎA NHIỆT
Mục tiêu: HS biết khái niệm về phản ứng tỏa nhiệt
Nội dung: GV giảng giải, phân tích, yêu cầu HS đọc sgk, thảo luận, trả lời câu hỏi.
Sản phẩm học tập: Câu trả lời của HS
Tổ chức thực hiện:
HOẠT ĐỘNG CỦA GIÁO VIÊN VÀ HS
DỰ KIẾN SẢN PHẨM
Hoạt động 1: tìm hiểu phản ứng tỏa nhiệt
Từ thí nghiêm A, Hình 13.1 và thực hiện thí nghiệm 1
trong SGK, GV hướng dẫn học sinh nhận xét về sự thay
đổi nhiệt độ của phản ứng và môi trường xung quanh.
Qua đó sẽ trình bày được khái niệm phản ứng tỏa nhiệt
Tổ chức dạy học: gv chia lớp thành các nhóm, yêu cầu
học sinh thực hiện các nhiệm vụ: thảo luận câu hỏi 1,2 và
thực hiện thí nghiệm 1 trong SGK
1. Viết phương trình hoá học cứa phản ứng xảy ra ở Hình Fe2O3(s) + 4Al(s) Fe(s) + Al2O3(s)
13.1 và nêu nhận xét vé sư thay đối nhiệt của phản ứng
Phản ứng cháy mãnh liệt và tỏa nhiệt rất cao, đó.
tăng nhiệt độ của phàn ứng làm nóng chày kim loai.
Phản ứng xảy ra làm tăng nhiệt độ của phản
ứng và môi trường xung quanh.
2. Thưc hiện thí nghiệm 1. Nêu hiên tượng xảy ra. Rút ra Hiên tương xảy ra: CaO tác dụng với nước,
kết luận về sự thay đổi nhiệt độ chất lỏng trong cốc. Giải tan một phần và phàn ứng toà nhiệt, phản thích ứng hoá hoc:
CaO(s) + H2O(l) Ca(OH)2 (aq)
Ghi nhận sự thay đổi nhiệt độ theo thời gian của phản ứng. Nhiệt độ oC
Cốc nước trước khi thêm Cao Ngay sau khi cho CaO vào Sau 2 phút
Kết luận: phản ứng xảy ra cso sự tăng về nhiệt độ
Giải thích: phản ứng tỏa nhiệt
Nêu khái niệm về phản ứng tỏa nhiệt?
Phản ứng tỏa nhiệt là phản ứng có sự giải
phòng nhiệt năng ra môi trường.
2. PHẢN ỨNG THU NHIỆT
Mục tiêu: HS biết khái niệm về phản ứng thu nhiệt
Nội dung: GV giảng giải, phân tích, yêu cầu HS đọc sgk, thảo luận, trả lời câu hỏi.
Sản phẩm học tập: Câu trả lời của HS
Tổ chức thực hiện:
HOẠT ĐỘNG CỦA GIÁO VIÊN VÀ HS
DỰ KIẾN SẢN PHẨM
Hoạt động 2: tìm hiểu phản ứng thu nhiệt
Nhiệm vụ: Từ việc quan sát thí nghiệm B, Hình
13.3 và thực hiện thí nghiệm 2 trong SGK, HS trình
bầy được khái niệm phàn ửng thu nhiệt.
Tổ chức dạy học: GV chia lớp thành các nhóm và
yêu cầu các nhóm HS thực hiện các nhiệm vụ: thảo
luận câu hỏi 3,4,5 và thực hiện thí nghiệm 2 trong SGK.
Có hiện tượng sủi bot viên sủi tan dần.
3.Khi thả viên vitamin C sủi vào cốc nước như Hình Viên sủi có chứa thành phần là muối carbonate và
13.3, em hảy dự đoán sư thay đổi nhiệt độ cùa nước acid hữu cơ. Khi viên sủi tiếp xúc với nước, hai trong cốc.
thành phần trên sẽ tiếp xúc với nhau và tao ra lượng
lớn khí CO2 giúp viên sủi hòa tan nhanh và làm
giảm nhiệt độ của môi trường
Phân ứng phân hủy đá vôi (CaCO3) cần phải cung
4.Trong phản ứng nung đá vôi (CaCO3), nếu ngừng cấp năng lượng liẻn tục. Nếu ngừng cung cấp nhiệt,
cung cấp nhiệt, phản ứng có tiếp tục xảy ra không? phản ứng không thể tiếp tục xảy ra.
Hiện tượng xảy ra: Trước khi đốt nóng hỗn hợp
5.Thực hiện thí nghiệm 2. Nêu hiện tượng trước và không có hiện tượng. Sau khi đốt nóng hỗn hợp khi
sau khi đốt nóng hổn hợp. Nếu ngừng đốt nóng thì
O2, thu đươc ở bình tam giác. Ngừng đốt nóng thì
phản ứng có xày ra không?
phản ứng không xảy ra nữa.
Phương trinh hoá học cùa phản ứng: 2KClO3(s) 3O2(g) + 2KCl(s)
Két luận: phản ứng xảy ra cần có sự cung cấp nhiệt năng cho hệ
Phản ứng thu nhiệt là phản ứng hóa học trong đó có
Khái niệm phản ứng thu nhiệt
sự hấp thu nhiệt năng từ môi trường.
3. BIẾN THIÊN ENTHALPY CHUẨN CỦA PHẢN ỨNG
Mục tiêu: biết được điều kiện chuẩn, biến thiên enthalpy chuẩn của phản ứng
Nội dung: GV giảng giải, phân tích, yêu cầu HS đọc sgk, thảo luận, trả lời câu hỏi.
Sản phẩm học tập: Câu trả lời của HS
Tổ chức thực hiện:
HOẠT ĐỘNG CỦA GIÁO VIÊN VÀ HS
DỰ KIẾN SẢN PHẨM
Hoạt động 3: Tìm hiểu về biến thiên enthalpy của phản ứng
Nhiệm vụ: Từ khái niệm về biến thiẻn enthalpy và biến
thiên enthalpy chuẩn cúa một phản ứng hoá học, HS trình
bày được biến thiên enthalpy của phản ứng.
Tổ chức dạy học: Hoạt động theo cặp: Từ biến thiên
enthalpy của phản ứng theo dạng tổng quát đã cho trong
SGK. HS phân biệt biến thiẻn enthalpy của phản ứng so
với kiên thức đã học. Xác định được điều kiện chuẩn đối
với chất khí, chất tan trong dung dịch. -
Biến thiên enthalpy của phản ứng là
- Khái niệm về biến thiên emthalpy của phản ứng?
lượng nhiệt tỏa ra hay thu vào của một
phản ứng hóa học trong quá trình đẳng áp
(áp suất không thay đổi) -
Biến thiên enthalpy của phản ứng
(nhiệt phản ứng) được ký hiệu ∆r H (r là
viết tắt của từ reaction: phản ứng), thường
được tính theo đơn vị kJ hoặc kcal. -
Enthalpy của một phản ứng hóa học
6. Biến thiên enthalpy chuẩn của một phản ứng hoá hoc được, được kí hiệu ∆ o rH298 là nhiệt kèm
được xác định trong điếu kiện nào?
theo phản ứng được đo ở điều kiện chuẩn -
Điêu kiện chuẩn: áp suát 1 bar (đối
với chất khí), nồng độ 1 mol/l (đối với
chất tan trong dung dịch) và thường chon
nhiệt độ 25°C (hay 298 K) -
Là biến thiên enthalpy chuẩn của
một phản ứng hóa học phụ thuộc vào sp –
sản phẩm; cđ – chất đầu. Không phu thuộc vào các sp trung gian.
Hoạt động 4: Tìm hiểu về phương trình nhiệt hóa học
Nhiệm vụ: Từ khái niệm phương trình nhiệt hóa học, HS
viết được phương trình nhiệt hoá học và xác định được
phản ứng thu nhiệt hay tỏa nhiệt dựa vào giá tri của ∆ o rH298
Tổ chức dạy học: dựa vào phản ứng tổng quát và giá trị của ∆ o
rH298 , dạy hoc theo phương pháp giải quyết vấn đề
giúp HS học tập thông qua thảo luận nội dung 7 và luyện Chất phản ứng. tập. Sản phẩm ∆ o rH298 < 0 Điều kiện phản ứng.
7.Phương trinh nhiệt hoá hoc cho biết thông tin gì về phản Trạng thái các chất. ứng hóa học? aA + bB cC + Dd ∆ o rH298
với A, B là chất đầu – cđ C, D là sản phẩm – sp
Viết dạng tổng quát của phương trình nhiệt hóa học ∆ 298 rH0 < 0 – tỏa nhiệt ∆ 298 rH0 > 0 – thu nhiệt
Lấy ví dụ minh họa…hướng dẫn học sinh phần luyện tập trong SGK.
4. ENTHALPY TẠO THÀNH (NHIỆT TẠO THÀNH CỦA PHẢN ỨNG)
Mục tiêu: Biết được enthalpy tạo thành của một số chất thường gặp
Nội dung: GV giảng giải, phân tích, yêu cầu HS đọc sgk, thảo luận, trả lời câu hỏi.
Sản phẩm học tập: Câu trả lời của HS
Tổ chức thực hiện:
HOẠT ĐỘNG CỦA GIÁO VIÊN VÀ HS
DỰ KIẾN SẢN PHẨM
Hoạt động 5: Tìm hiểu enthalpy tạo thành
Nhiệm vụ: Từ ví dụ 3 và ý nghĩa của các giá trị ∆ o fH298.
HS trình bày đưọc enthalpy tao thành cùa một số chất thướng gặp.
Tổ chức dạy học: Hoạt động theo cặp hoặc theo nhóm: Từ
khái niệm enthalpy tạo thành, thảo luận câu hỏi số 8đưa ra
kết luận về tính bền cùa hợp chất SO2, ở câu 11, từ bảng
13.1 HS nêu được nhiệt tạo thành của các hợp chất lấy
nhiệt từ môi trường (phản ứng thu nhiệt).
- Khái niệm enthalpy tạo thành
- Enthalpy tạo thành của một chất là
nhiệt kèm theo phản ứng tạo thành 1 mol
chất đó từ các đơn chất bền vững.
- Enthalpy tạo thành của đơn chất bằng 0.
- Enthalpy tạo thành (nhiệt tạo thành)
được kí hiệu ∆f H (f là viết tắt của từ
formation: tạo thành), thường tính theo đơn
8. Phân biệt enthalpy tạo thành của một chất và biến thiên vị kJ hay kcal.
enthalpy của phản ứng, Lấy ví dụ minh hoạ? VD: S(s) + O o
2(g) SO2(g) ∆fH298(SO2,g) = -
296,80 kJ/mol – enthalpy tạo thành
Zn(s) + HCl(aq) ZnCl(aq) + H o 2(g) ∆�H298
= -152,6 kJ/mol – biến thiên enthalpy của Trả lời câu 9,10,11. phản ứng.
5. Ý NGHĨA CỦA DẤU VÀ GIÁ TRỊ ∆ � �����
Mục tiêu: Biết được ý nghĩa và dấu của giá trị ∆ o �H298
Nội dung: GV giảng giải, phân tích, yêu cầu HS đọc sgk, thảo luận, trả lời câu hỏi.
Sản phẩm học tập: Câu trả lời của HS
Tổ chức thực hiện:
HOẠT ĐỘNG CỦA GIÁO VIÊN VÀ HS
DỰ KIẾN SẢN PHẨM
Hoạt động 6: Tìm hiểu về dấu và giá trí biến thiên enthalpy của phản ứng
Nhiệm vụ: từ ví dụ 4 và việc quan sát Hình 13.5,
HS trình bày được biên thiên enthalpy của phản
ứng dựa vào các yếu tố nào. HS vẽ được sơ đồ
biểu diễn biến thiên enthalpy của một số phản ứng
thường gặp. Nhận xét về giá trị của ∆ o fH298 sp so với ∆ o fH298 (cđ).
Tổ chức day học: Hoạt động theo nhóm nhận xét vé giá trị của ∆ o o
fH298 sp so với ∆fH298 (cđ) và
vận dụng vẽ sơ đồ biểu diễn biến thiên enthalpy
của phản ứng nhiệt phân CaCO3 theo gợi ý tù Hình 13.5.
Sau khi học sinh thảo luận các câu hỏi trong sgk,
gv hướng dẫn học sinh rút ra nhận xét về dấu và giá trị ∆ o rH298
HOẠT ĐỘNG LUYỆN TẬP Thời gian: phút
1. Mục tiêu: Giúp HS hệ thống lại kiến thức đã học
2. Tiến trình tổ chức hoạt động:
- GV hướng dẫn học sinh làm các bài tập trong sgk và sbt
- GV đánh giá, nhận xét, chuyển sang nội dung tiếp theo.
e.Sản phẩm học sinh cần đạt: Câu trả lời của HS. HĐ 4.
HOẠT ĐỘNG VẬN DỤNG Thời gian: phút
1. Mục tiêu: giúp HS vận dụng kiến thức đã vào áp dụng vào thực tiễn cuộc sống.
2. Tiến trình tổ chức hoạt động:
* hãy làm cho nhà em sạch bong với hỗn hợp baking soda NaHCO3 và giấm (CH3COOH). Hỗn hợp này
tạo ra một lượng lớn bọt. Phương trình nhiệt hóa học của phản ứng: NaHCO3(s) + CH o
3COOH CH3COONa(aq) + CO2(g) + H2O(l) ∆rH298= 94,30 kJ
Phản ứng trên là tỏa nhiệt hay thu nhiệt? Vì sao? Tìm những ứng dụng khác của phàn ứng trên?
Đây là phản ứng thu nhiệt vì ∆ o fH298> 0.
Trong các sản phẩm tự nhiên, baking soda (NaHCO3) giúp làm sạch khử mùi, làm mềm mảng bám trong
khi giấm giúp loại bỏ mùi hôi và một số vết bẩn cứng đầu khác
Ngoài tác dụng tẩy rửa củaa phản ứng giữa baking soda và giấm nhưng ứng dụng khác cùa phàn ứng trên
lả: giúp tẩy trắng quần áo; thông tắc bồn cầu; vệ sinh máy giặt; khử mùi,. .
*Hướng dẫn về nhà:
- Ôn tập và ghi nhớ kiến thức vừa học. - Hoàn thành bài tập sgk
- Tìm hiểu nội dung bài 14
3. Sản phẩm học sinh cần đạt: Câu trả lời của HS
TRƯỜNG THPT PHƯỚC BÌNH TỔ HÓA HỌC KHỐI 10 KẾ HOẠCH BÀI DẠY:
BÀI 14. Ý NGHĨA VÀ CÁCH TÍNH BIẾN THIÊN ENTHALPY.
Thời lượng: 3 tiết I. MỤC TIÊU DẠY HỌC:
Sau bài học này HS có thể: YÊU CẦU CẦN ĐẠT
Nhận thức hóa – Tính được o H của một phản ứng dựa r 298 NĂNG LỰC học
vào bảng số liệu năng lượng liên kết, nhiệt tạo thành cho sẵn. HÓA HỌC - Vận dụng công thức: o H = r 298 �b(cđ) - �b(sp) và o H = o H (sp) - o H (cđ) r 298 r 298 r 298
Tìm hiểu thế giới
Hoá học giúp con người khám phá, hiểu biết và
tự nhiên dưới góc tiến đến chinh phục tự nhiên. độ hóa học
Vận dụng kiến
Tìm hiểu và giải thích một số kiến thức liên
thức, kĩ năng đã
quan đến enthalpy của phản ứng. học
Giải quyết vấn đề
Thảo luận với các thành viên trong nhóm, liên
hệ thực tiễn nhằm giải quyết các vấn đề trong NĂNG LỰC và sáng tạo bài học và cuộc sống. CHUNG
Giao tiếp và hợp
Hoạt động nhóm theo đúng yêu cầu của GV, tác
đảm bảo các thành viên trong nhóm đều được
tham gia hoạt đọng hiệu quả.
Năng lực tự chủ
Chủ động, tích cực tìm và giải thích một số và tự học
kiến thức liên quan đến enthalpy của phản ứng.
PHẨM CHẤT Trung thực
Dựa vào mục tiêu của bài học và nội dung
các hoạt động của SGK, GV lựa chọn phương
pháp và kĩ thuật dạy học phù hợp để tổ chức
các hoạt động học tập một cách hiệu quả và
tạo hứng thú cho HS trong quá trình tiếp nhận
kiến thức, hình thành và phát triển năng lực,
phẩm chất liên quan đến bài học. Trách nhiệm
– Có trách nhiệm tham gia tích cực hoạt động
nhóm và cặp đôi phù hợp với khả năng của bản thân;
– Cẩn thận, khách quan và trung thực và thực
hiện an toàn trong quá trình làm thực hành;
– Có niềm say mê, hứng thú với việc khám phá và học tập.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
- Dạy học theo nhóm, cặp đôi (hoặc sử dụng dạy học theo góc).
- Kỹ thuật sử dụng phương tiện trực quan.
- Dạy học nêu và giải quyết vấn đề thông qua các dạng câu hỏi trong SGK.
III. TIẾN TRÌNH DẠY HỌC:
A. BẢNG TÓM TẮT CÁC HOẠT ĐỘNG: Hoạt Mục
Nội dung dạy học trọng tâm PPDH- động tiêu KTDH Đánh giá học(thời gian) Phương Công pháp cụ HĐ 1: 1. Giới
1. Sử dụng hình ảnh trong SGK về sự cháy của - Đặt Hình thiệu
methane, GV đặt câu hỏi :” Biến thiên enthalpy vấn đề ảnh cách tính GV biến
của phản ứng trên được tính toán dựa trên các chuẩn bị trực Khởi thiên giá trị nào?”. sẵn các quan động- enthalpy hình ảnh kết của phản - Cho nối ứng. HS quan sát các ( 5 phút) hình ảnh HĐ 2: 2. Tính
1. XÁC ĐỊNH BIẾN THIÊN ENTHALPY 1. Từ Phiếu Điểm biến
CỦA PHẢN ỨNG DỰA VÀO NĂNG việc học tập số quan sát thiên LƯỢNG LIÊN KẾT. Hình số 1,2,3 enthalpy 14.1 của phản trong ứng dựa SGK, (40 phút) GV vào năng hướng lượng dẫn HS liên kết. rút ra được cách tính enthalpy của phản ứng dựa vào năng lượng liên kết. 2. Hoạt động theo nhóm, yêu cầu HS thực hiện các nhiệm vụ: thảo luận câu hỏi 1,2,3 và trình bày kết quả theo yêu cầu của GV. Rút ra
Bảng 14.1. Năng lượng liên kết của một số được
liên kết cộng hóa trị cách tính Tổng quát: enthalpy o H = r 298 �b(cđ) - �b(sp) của phản Với
�b(cđ) , �b(sp): tổng năng lượng liên ứng.
kết trong phân tử chất đầu và sản phẩm của phản ứng. Luyện tập Xác định o
H của phản ứng sau dựa vào giá r 298 trị Eb ở bảng 14.1
CH4(g) + Cl2(g) ���� CH3Cl(g) + HCl(g)
Cho biết phản ứng trên tỏa nhiệt hay thu nhiệt? Hướng dẫn:
Bước 1: Tính năng lượng để phá vỡ 1 mol CH4 và 1 mol Cl2.
Tổng năng lượng thu vào để phá vỡ liên kết:
Eb(CH4) + Eb(Cl2) =4x413+243 = 1 895 Kj
Bước 2: Tính năng lượng hình thành 1 mol CH3Cl(g) và 1 mol HCl(g).
Tổng năng lượng tỏa ra để hình thành liên kết:
Eb(CH3Cl) + Eb(HCl) = 3x143+339+427 = 2 005 Kj
Bước 3: Tính biến thiên enthalpy của phản ứng theo công thức: o H = 1 8895 – 2 005 = -110 Kj r 298 Do o H < 0 r 298 phản ứng tỏa nhiệt Vận dụng
Dựa vào số liệu về năng lượng liên kết ở bảng
14.1 , hãy tính biến thiên enthalpy của 2 phản ứng sau: 2H2(g) + O2(g) to 2H2O(g) C7H16(g) + 11O2(g) to 7CO2(g) + 8H2O(g)
So sánh kết quả thu được, từ đó cho biết H2 hay
C7H16 là nhiên liệu cho tên lửa( biết trong
C7H16 có 6 liên kết C-C và 16 liên kết C-H). Hướng dẫn
Hidrogen là một loại khí có nhiệt cháy cao nhất
trong tất cả các loại nhiên lieuj trong thiên
nhiên, đã được sử dụng làm nhiên liệu trong
tàu vũ trụ . Hidrogen là nguồn nhiên liệu an
toàn, không gây sự cố môi trường cho con
người, sản phẩm cháy chỉ là nước(H2O), được
gọi là nhiên liệu sạch kí tưởng. (1) o H =2 x 432+ 498 - 4 x 467=-506Kj r 298 (2) o H
=6 x 347+16 x 413 + 11 x 498 - 14 r 298 x 745 - 16 x 467 = -3 734 Kj
Nếu lấy cùng khối lượng nhiên liệu chứng tỏ
hydrogen là một loại khí có nhiệt cháy rất cao. Luyện tập Tính o H của 2 phản ứng sau: r 298 3O2(g) 2O3(g) (1) 2O3(g) 3O2(g) (2) Liên hệ giữa giá trị o H với độ bền của O r 298 3,
O2 và giải thích, biết phân tử O3 gồm 1 liên kết
đôi O=O và 1 liên kết đơn O-O. (1) 3O2(g) 2O3(g) o
H = 3 x 498 - 2 x (498 + 204) = +90 kJ r 298 (2) 2O3(g) 3O2(g) o
H = 2 x (498 + 204) - 3 x 498 = -90 Kj r 298
Dựa vào kết quả tính toán cho thấy quá trình O2 2O và 3O2 2O3 có o H > 0, chứng r 298
tỏ không có khả năng tồn tại. Qúa trình 2O3 3O2 có o H
< 0, chứng tỏ khả năng tồn tại r 298
của O2, do đó O2 là trạng thái bền của nguyên tố oxygen. HĐ 3: 3.Tính Phiếu Điểm biến
2. XÁC ĐỊNH BIẾN THIÊN 1.Nghiên học tập số thiên
ENTHALPY CỦA PHẢN ỨNG DỰA cứu ví enthalpy VÀO ENTHALPY TẠO THÀNH. dụ 3,4, số 4 của
Cho phương trình hóa học tổng quát: GV phản hướng ứng dựa Aa+Bb Mm + nN dẫn HS (30 vào rút ra enthalpy
Có thể tính được biến thiên enthalpy được phút) tạo
chuẩn của một phản ứng hóa học cách tính thành. ( o
H ) khi biết các giá trị 0 Δ H của enthalpy r 298 f 298 của phản
tất các các chất đầu và sản phẩm theo ứng dựa công thức sau: vào enthalpy o H = m x 0 Δ H (M)+n x 0 Δ H (N) tạo r 298 f 298 f 298 thành. – a x 0 Δ H (A) – b x 0 Δ H (B) 2. Hoạt f 298 f 298 động Tổng quát : theo nhóm, o H = 0 Δ H (sp) - 0 Δ H (cđ) r 298 f 298 f 298 yêu cầu HS thực Với 0 Δ H (sp), 0 Δ H (cđ) : tổng enthalpy f 298 f 298 hiện các
tạo thành ở điều kiện chuẩn tương ứng của sản nhiệm
phẩm, chất đầu của phản ứng. vụ: thảo luận câu
Vận dụng: Tính biến thiên enthalpy của phản hỏi 4 và
ứng phân hủy trinitroglycerin ( C3H5O3(NO2)3), trình bày
theo phương trình sau ( biết nhiệt tạo thành của kết quả
trinitroglycerin là -370,15 kJ/ mol) theo yêu cầu của C3H5O3(NO2)3) to
6N2(g) + 12CO2(g) GV. Rút +10H2O(g) + O2(g) ra được
Hãy giải thích vì sao trinitroglycerin được ứng cách tính
dụng làm thành phần thuốc súng không khói? enthalpy Áp dụng công thức: của phản o H =12x 0 Δ H (CO Δ H (H r 298 f 298 2)+10X 0 f 298 2O)- ứng và 4x 0 Δ H ( C vận dụng f 298 3H5O3(NO2)3)
=12 x (-393,50) + 10 x (-241,82) - 4 x (- tính giá 370,15) trị o = -5659,6Kj H r 298 Do giá trị o H
= -5659,6Kj <<0, tỏa nhiệt của các r 298
mạnh, phản ứng tạo các chất khí là phản CO ứng
2,H2O,N2 và O2 nên trinitroglycerin được sử dụng làm chất nổ. trong Luyện tập phần
Dựa vào giá trị enthalpy tạo thành ở bảng 13.1, luyện tập. hãy tính giá trị o
H của các phản ứng sau: r 298 CS2(l)+ 3O2(g) to CO2(g) + SO2(g) (1) 4NH3(g) + 3O2(g) to 2N2(g) + 6H2O(g) (2) Hướng dẫn (1) CS2(l)+ 3O2(g) to CO2(g) + SO2(g) Áp dụng công thức: o H = 0 Δ H (CO Δ H (SO r 298 f 298 2)+2 x 0 f 298 2) - 0 Δ H (CS f 298 2)
= -393,50+2x(296,8) -87,9 = -1 075 kJ (2) 4NH3(g) + 3O2(g) to 2N2(g) + 6H2O(g) o H = 6 x 0 Δ H ( Δ H ( r 298 f 298 H2O) - 4 x 0 f 298 NH3) = 6 x (-241,82) -4 x (45,90) = -1 267,32 kJ B. CÁC HOẠT ĐỘNG:
HĐ 1. Hoạt động khởi động-kết nối : Thời gian: 5 phút
Giới thiệu cách tính biến thiên enthalpy của phản ứng.
1. Mục tiêu: Tính được o H
của một phản ứng dựa vào bảng số liệu năng lượng liên kết, r 298
nhiệt tạo thành cho sẵn.
2. Tiến trình tổ chức hoạt động: a. Nhiệm vụ:
-GV chuẩn bị sẵn các hình ảnh –
b. Thực hiện nhiệm vụ:
Cho HS quan sát các hình ảnh
c. Báo cáo- thảo luận:
Biến thiên enthalpy của phản ứng được tính toán dựa trên giá trị năng lượng liên kết hoặc dựa vào enthalpy tạo thành.
HĐ 2. Tính biến thiên enthalpy của phản ứng dựa vào năng lượng liên kết. Thời gian: 40 phút
1. Mục tiêu: Tính được o H
của một phản ứng dựa vào bảng số liệu năng lượng liên kết, r 298
nhiệt tạo thành cho sẵn.
2. Tiến trình tổ chức hoạt động: a. Giao nhiệm vụ:
Hoạt động theo nhóm, yêu cầu HS thực hiện các nhiệm vụ: thảo luận câu hỏi 1,2,3 và trình bày
kết quả theo yêu cầu của GV. Rút ra được cách tính enthalpy của phản ứng.
b. Thực hiện nhiệm vụ - Báo cáo- thảo luận::
Từ việc quan sát Hình 14.1 trong SGK, GV hướng dẫn HS rút ra được cách tính enthalpy của
phản ứng dựa vào năng lượng liên kết.
c. Phương pháp công cụ đánh giá và kết luận
1. Quan sát hình 14.1 cho Biết liên kết hóa học nào bị phá vỡ, liên kết hóa học nào được hình
thành khi H2 phản ứng với O2 tạo thành H2O (ở thể khí)
2. Tính biến thiên enthalpy của phản ứng dựa vào năng lượng liên kết phải viết được công thức
cấu tạo của tất cả các chất trong phản ứng để xác đínhố lượng và loại liên kết. Xác định số lượng
mỗi loại liên kết trong các phân tử sau: CH4, CH3Cl, NH3, CO2.
3. Dựa vào năng lượng liên kết ở Bảng 14.1, tính biến thiên enthalpy của phản ứng và giải thích
vì sao nitrogen (N≡N) chỉ phản ứng với oxygen (O=O) ở nhiệt độ cao hoặc có tia lửa điện để tạo
thành nitrogen monoxide( N=O). N2(g) + O2(g) to 2NO(g)
d. Sản phẩm học sinh cần đạt:
1. Liên kết hóa học bị phá vỡ là H-H và O=O.
Liên kết hóa học được hình thành là H-O-H
2. CH4 có 4 liên kết đơn C-H
CH3Cl có 3 liên kết đơn C-H và 1 liên kết đơn C-Cl
NH3 có 3 liên kết đơn N-H
CO2 có 2 liên kết đôi C=O
3. Tổng năng lượng thu vào để phá vỡ liên kết :
Eb(N≡N) + Eb(O=O) = 945 + 498 = 1 443 kJ
Tổng năng lượng tỏa ra để hình thành liên kết : Eb(N=O) = 2 x 607 = 1 214 kJ
Eb của chất đầu lớn hơn giá trị Eb sản phẩm của phản ứng. Phản ứng thu nhiệt. o H
= 1 443 - 1 214 = 229 kJ > 0 . Nitrogen(N r 298
≡N) chỉ phản ứng với oxygen (O=O) ở nhiệt
độ cao hoặc có tia lửa điện để tạo thành nitrogen monoxide( N=O).
Cách tính enthalpy của phản ứng dựa vào năng lượng liên kết chỉ áp dụng cho liên kết cộng hóa
trị và ở trạng thái khí.
Ví dụ : C2H6(g) + Cl2(g) ���� C2H5Cl(g) + HCl(g) HĐ 3.
Tính biến thiên enthalpy của phản ứng dựa vào enthalpy tạo thành. Thời gian: 30 phút
1. Mục tiêu: Tính được o H
của một phản ứng dựa vào bảng số liệu năng lượng liên kết, r 298
nhiệt tạo thành cho sẵn.
2. Tiến trình tổ chức hoạt động:
a. Giao nhiệm vụ: Hoạt động theo nhóm, yêu cầu HS thực hiện các nhiệm vụ: thảo luận câu hỏi
4 và trình bày kết quả theo yêu cầu của GV. Rút ra được cách tính enthalpy của phản ứng và vận dụng tính giá trị o H
của các phản ứng trong phần luyện tập. r 298
b. Thực hiện nhiệm vụ - Báo cáo- thảo luận:
Nghiên cứu ví dụ 3,4, GV hướng dẫn HS rút ra được cách tính enthalpy của phản ứng dựa vào enthalpy tạo thành.
c. Phương pháp công cụ đánh giá và kết luận
Gía trị biến thiên enthalpy của phản ứng có liên quan tới hệ số các chất trong phương trình nhiệt
hóa học không? Gía trị enthalpy tạo thành thường được đo ở điều kiện nào?
d.Sản phẩm học sinh cần đạt:
Giá trị biến thiên enthalpy của phản ứng có liên quan tới hệ số các chất trong phương trình nhiệt hóa học.
Khi tính giá trị biến thiên enthalpy của phản ứng thì cần nhân hệ số tỉ lượng với enthalpy tạo
thành của các chất tương ứng.
- Giá trị enthalpy tạo thành thường được đo ở điều kiện chuẩn: Áp suất 1 bar (đối với chất khí),
nồng độ 1 mol/L (đối với chất tan trong dung dịch) và thường chọn nhiệt độ 25oC (hay 298K) IV. HỒ SƠ DẠY HỌC: 1. Nội dung HS ghi bài:
1. XÁC ĐỊNH BIẾN THIÊN ENTHALPY CỦA PHẢN ỨNG DỰA VÀO NĂNG LƯỢNG LIÊN KẾT.
Phản ứng hóa học xảy ra khi có sự phá vỡ các liên kết hóa học của các chất đầu(cđ) và hình thành các
liên kết hóa học của các sản phẩm (sp). Sự phá vỡ liên kết cần cung cấp nằn lượng, sự hình thành các
liên kết lại giải phóng năng lượng. Tổng quát: o H = r 298 �b(cđ) - �b(sp) Với
�b(cđ) , �b(sp): tổng năng lượng liên kết trong phân tử chất đầu và sản phẩm của phản ứng.
Tính biến thiên enthalpy của phane ứng dựa vào năng lượng liên kết được áp dụng cho phản ứng trong
đó các chất đều có liên kết cộng hóa trị ở thể khí khi biết giá trị năng lượng liên kết của tát cả các chất trong phản ứng.
2. XÁC ĐỊNH BIẾN THIÊN ENTHALPY CỦA PHẢN ỨNG DỰA VÀO ENTHALPY TẠO THÀNH.
Cho phương trình hóa học tổng quát: Aa+Bb Mm + nN
Có thể tính được biến thiên enthalpy chuẩn của một phản ứng hóa học ( o H ) khi biết các r 298 giá trị 0
Δ H của tất các các chất đầu và sản phẩm theo công thức sau: f 298 o H = m x 0 Δ H (M)+n x 0 Δ H (N) – a x 0 Δ H (A) – b x 0 Δ H (B) r 298 f 298 f 298 f 298 f 298 Tổng quát : o H = 0 Δ H (sp) - 0 Δ H (cđ) r 298 f 298 f 298 Với 0 Δ H (sp), 0
Δ H (cđ) : tổng enthalpy tạo thành ở điều kiện chuẩn tương ứng của sản phẩm, f 298 f 298
chất đầu của phản ứng.
2. Hình ảnh trực quan và phiếu học tập:
Bảng 14.1. Năng lượng liên kết của một số liên kết cộng hóa trị
PHIẾU HỌC TẬP SỐ 1
Quan sát hình 14.1 cho Biết liên kết hóa học nào bị phá vỡ, liên kết
hóa học nào được hình thành khi H2 phản ứng với O2 tạo thành H2O (ở thể khí)
PHIẾU HỌC TẬP SỐ 2
Tính biến thiên enthalpy của phản ứng dựa vào năng lượng liên kết phải
viết được công thức cấu tạo của tất cả các chất trong phản ứng để xác
đínhố lượng và loại liên kết. Xác định số lượng mỗi loại liên kết trong các
phân tử sau: CH4, CH3Cl, NH3, CO2.
PHIẾU HỌC TẬP SỐ 3
Dựa vào năng lượng liên kết ở Bảng 14.1, tính biến thiên enthalpy
của phản ứng và giải thích vì sao nitrogen (N≡N) chỉ phản ứng với
oxygen (O=O) ở nhiệt độ cao hoặc có tia lửa điện để tạo thành nitrogen monoxide( N=O). N2(g) + O2(g) to 2NO(g)
PHIẾU HỌC TẬP SỐ 4
Gía trị biến thiên enthalpy của phản ứng có liên quan tới hệ số các chất
trong phương trình nhiệt hóa học không? Gía trị enthalpy tạo thành
thường được đo ở điều kiện nào V. BÀI TẬP 50 phút 1. Giá tri o H cùa các phån úng: r 298 a)N2H4(g) N2(g) + 2H2 (g) o
H = 4 x 391 + 418- 945 – 2 x 432 = 173 kJ r 298 b) 4HCl(g) + O2(g) to 2Cl2(g) + 2H2O(g) o H
= 4 x 427 + 498 - 2 x 243 -2 x 467 = 786 kJ r 298 15
2. Phån úng: C6H6(l) + 15O2(g) to 6CO2(g) + 3H2O(g) 2 o H : +49,0 0 -393,50 -241,82 r 298 o H
= 6 x (-393,50) + 3 x (-241 ,82) - 49 = -3 037,46 kJ r 298
Phản ứng: C3H8(g) + 5 O2(g) to 3CO2(g) + 4H2O(g) o H : -105 0 -393,50 -241,82 r 298 o H
= 3 x (-393,50) + 4 x (-241 ,82) - 105 = -2 042,78 kJ r 298 Số mol propane = 1 o H = −2 042,78 = -46,42 kJ 44 r 298 44 Số mol benzene = 1 o H = −3 037,46 = -38,94 Kj 78 r 298 78
Lượng nhiệt sinh ra khi đót cháy 1,0 g propane C3H8(g) nhiều hơn so với lượng nhiệt sinh ra khi đót cháy 1,0 g benzene C6H6(l).
3. Phản ứng: 2Al(s) + Fe2O3(s) to Fe(s) + Al2O3(s) o H : 0 - 825,50 0 -1 676,00 r 298 o
H = -1 676,00 -(-825,50) = -850,5 kJ r 298 Giá tri o H
càng âm sẽ càng thuận lợi cho phån úng xảy ra. r 298 4. SO2(g) + O2(g) SO3(g) o H = —98,5 kJ/mol r 298
Số mol SO2: 1,125 mol. Lượng nhiêt giải phóng: -98,5 x 1,125 = -110,81 kJ 5. 2H2(g) + O2(g) to 2H2O(l) o H = -484,0 kJ r 298 a) Do o H < 0 nên nước (H r 298
2O) Có năng lượng thấp hơn hỗn hợp oxygen và hydrogen
b)Sơ đồ biến thiên năng lượng:
6. a) Tính biến thiên enthalpy chuẩn cùa phản ứng dựa vào nhiệt tạo thành:
Phương trình hóa học cùa phản ứng: C3H8(g) + 5O2(g) to 3CO2(g) + 4H2O(g) o H : -105 0 -393,50 -241,82 r 298 o H
= 3 x (-393,50) + 4 x (-241,82) - 105 = -2042,78 kJ r 298
b) Tính biến thiên enthalpy chuẩn của phản ứng dựa vào năng lượng liên kết Áp dụng công thúc: o H = r 298 Eb(cd)— Eb(sp)
Phân tử C3H8 Có số liên kết là: C-H: 8; C-C: 2. o
H = 8 x 413 + 2 x 347 +5 x 498 – 3 x 2 x 745 - 4 x 2x 467= -1 718 kJ r 298
Biến thiên enthalpy chuẩn của phản ứng dựa vào nhiệt tạo thành có giá trị -2 042,78 kJ âm hơn so
với biến thiên enthalpy chuẩn của phản ứng dựa vào năng lượng liên kết -1 718 kJ. Tuần: Tiết: Lớp dạy:
BÀI 18: HYDROGEN HALIDE VÀ MỘT SỐ PHẢN ỨNG CỦA ION HALIDE
Thời gian thực hiện: tiết ( phút) I. MỤC TIÊU 1. Năng lực 1.1. Năng lực hóa học
1.1.1. Nhận thức hóa học
- Hydrogen halide, tính chất vật lí của các hydrogen halide, nhận xét và giải thích được xu
hướng biến đổi nhiệt độ sôi của các hydrogen halide từ HCl tới HI dựa vào tương tác van der Waals.
- Giải thích sự bất thường về nhiệt độ sôi của HF so với các HX khác.
- Tính acid của các hydrohalic acid, xu hướng biến đổi tính acid của dãy hydrohalic acid.
- Trình bày được tính khử của các ion halide (Cl-, Br-, I-) thông qua phản ứng với chất oxi hóa là sunfuric acid.
1.1.2. Tìm hiểu thế giới tự nhiên dưới góc độ hoá học
- Thực hiện được thí nghiệm phân biệt các ion F-, Cl-, Br-, I- bằng cách cho dung dịch silver
nitrate vào dung dịch muối của chúng.
- Nêu được ứng dụng của một số hydrogen halide, vai trò của acid HCl trong quá trình tiêu hóa
của dạ dày, trong việc khắc chữ lên thủy tinh, sử dụng AgI trong quá trình tạo mưa nhân tạo…
1.1.3. Vận dụng kiến thức kĩ năng đã học
- Quan sát thí nghiệm, rút ra được kết luận về tính chất của ion halide.
- Vấn dụng kiến thức đã học giải thích một số hiện tượng đời sống, giải và làm được các bài tập
về hydrogen halide, hydrohalic acid, ion halide. 1.2. Năng lực chung - Năng lực tự học - Năng lực hợp tác
- Năng lực phát hiện và giải quyết vấn đề - Năng lực giao tiếp 2. Phẩm chất
- Cần cù siêng năng chịu khó, trung thực, trách nhiệm
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
- Hóa chất: Các dung dịch NaF, NaCl, NaBr, NaI và AgNO3 có nồng độ 0,1M.
- Dụng cụ: ống nghiệm, ống hút, giá đỡ
- Bộ câu hỏi và đáp án trắc nghiệm hydrogen halide, ion halide
- Phiếu học tập ( xem phụ lục), SGK
- Bảng kiểm (xem phụ lục).
III. PHƯƠNG PHÁP VÀ KĨ THUẬT DẠY HỌC
1/ Phương pháp dạy học: Phương pháp dạy học nhóm, dạy học nêu vấn đề.
2/ Các kĩ thuật dạy học - Hỏi đáp tích cực. - Thí nghiệm trực quan.
IV. TIẾN TRÌNH DẠY HỌC
1. Hoạt động 1: Mở đầu
a) Mục tiêu: Từ phần mở đầu khắc hoa văn lên thủy tinh và tạo tình huống có vấn đề là ion
halide có vai trò gì trong việc khắc thủy tinh, kích thích hứng thú HS tìm hiểu về bài học hydrogen halide. b) Tổ chức thực hiện:
GV yêu cầu cả lớp đọc phần khởi động tạo vấn đề, mời 1 HS đọc to rõ cho cả lớp. c) Sản phẩm cần đạt
Bản chất của quá trình khắc chữ lên thủy tinh là quá trình hóa học nào? Vai trò của ion halide
trong phản ứng trên là gì? HS tập trung tích cực tìm hiểu bài mới.
2. Hoạt động 2: Hình thành kiến thức ( phút) a) Mục tiêu:
- Hydrogen halide, tính chất vật lí của các hydrogen halide, nhận xét và giải thích được xu
hướng biến đổi nhiệt độ sôi của các hydrogen halide từ HCl tới HI dựa vào tương tác van der Waals.
- Giải thích sự bất thường về nhiệt độ sôi của HF so với các HX khác.
- Tính acid của các hydrohalic acid, xu hướng biến đổi tính acid của dãy hydrohalic acid.
- Trình bày được tính khử của các ion halide (Cl-, Br-, I-) thông qua phản ứng với chất oxi hóa là sunfuric acid.
- Thực hiện được thí nghiệm phân biệt các ion F-, Cl-, Br-, I-.
- Nêu được ứng dụng của một số hydrogen halide
b) Tổ chức thực hiện:
Hoạt động của GV và HS
Sản phẩm cần đạt
1. Tính chất vật lí của hydrogen
1. Tính chất vật lí của hydrogen halide halide
-Hydrogen halide là hợp chất của hydrogen (H) với
-Chuyển giao nhiệm vụ học tập
halogen (X=F, Cl, Br, I) tổng quát là HX, gồm có:
+ GV:HS đọc SGK cho biết hydrogen
HF(hydrogen flouride), HCl( hydrogen chloride),
halide là gì? Có những hydrogen halide HBr ( hydrogen bromide) và HI ( hydrogen nào? iodide).
+ GV: HS dựa vào bảng 18.1 và hình
- Các hydrogen halide là các chất khí, không màu,
18.1 SGK trình bày tính chất vật lí và
tan tốt trong nước ( riêng HF tan vô hạn), có nhiệt
cho biết nhiệt độ sôi của các hydrogen
độ sôi thấp và tăng dần từ HCl tới HI nguyên nhân
halide từ HCl đến HI biết đổi như thế
là khối lượng phân tử tăng làm tăng năng lượng nào? Giải thích?
cần thiết cho quá trình sôi, đồng thời sự tăng kích
+ GV: Quan sát hình 18.2 giải thích
thước và số electron trong phân tử dẫn tới tương
nhiệt độ sôi bất thường và độ tan vô
tác van der Waals giữa các phân tử tăng.
hạn trong nước của hydrogen fluoride
- Hydrogen flouride có nhiệt độ sôi cao bất thường
so với các hydrogen halide khác?
và có độ tan vô hạn trong nước. Nguyên nhân phân
tử hydrogen flouride hình thành liên kết hydrogen
HS thực hiện nhiệm vụ học tập
liên phân tử loại liên kết này bền hơn tương tác van
+ HS đọc thông tin SGK, quan sát hình
der Waals nên nhiệt độ sôi của hydrogen flouride ảnh, trả lời câu hỏi.
cao bất thường hơn so với các hydrogen halide
-Báo cáo kết quả hoạt động
khác. HF tan vô hạn trong nước bởi vì HF tạo liên
+ HS đứng dậy trình bày câu trả lời
kết hydrogen với nước mạnh hơn các HX khác.
+ HS khác nhận xét, đánh giá, bổ sung
Đánh giá kết quả thực hiện
- GV đánh giá, nhận xét, kết luận đúc
kết vấn, chuyển sang nội dung mới. 2. Hydrohalic acid 2. Hydrohalic acid
-Chuyển giao nhiệm vụ học tập
- Các hydrogen halide khi tan trong nước được
GV đặt câu hỏi yêu cầu HS trả lời
dung dịch hydrohalic acid tương ứng.
+ Hydrohalic acid có tính chất hóa học Hydrohalic HF HX ( HCl, HBr, HI) nào? acid Tính acid Yếu Mạnh
+ Sự biến đổi tính acid của các Ăn mòn thủy tinh + QT hóa đỏ
hydrohalic acid? Giải thích? 4HF + SiO2 SiF4 + Td kim loại trước
+ Hydrohalic acid tác dụng được với + 2H2O H + Td với basic oxide,
những chất nào? Tính chất riêng biệt base và một số muối của HF là gì?
Tính acid tăng dần từ HF tới HI
+ Em hãy đề xuất cách bảo quản HF < HCl < HBr < HI
hydrofouric acid trong phòng thí
Ta bảo quản acid HF trong các bình nhựa hoạc nghiệm? nhôm, inox
+ Hoàn thành các phương trình hóa học (1)NaOH + HF NaF + H2O sau: (2)Zn + 2HCl ZnCl2 + H2 (1)NaOH + HF (3)CaO + 2HBr CaBr2 + H2O (2)Zn + HCl
(4)K2CO3 + 2HI 2KI + CO2 + H2O (3)CaO + HBr (4)K2CO3 + HI
HS thực hiện nhiệm vụ học tập
+ HS đọc thông tin SGK, quan sát hình ảnh, trả lời câu hỏi.
-Báo cáo kết quả hoạt động
+ HS đứng dậy trình bày câu trả lời
+ HS khác nhận xét, đánh giá, bổ sung
Đánh giá kết quả thực hiện
- GV đánh giá, nhận xét, kết luận đúc
kết vấn, chuyển sang nội dung mới.
3. Tính khử của ion halide
3. Tính khử của ion halide
Chuyển giao nhiệm vụ học tập
-Khi đun nóng muối halide của ion chloride không
GV phát phiếu học tập số 1 yêu cầu HS khử được H2SO4 đặc, chi xảy ra phản ứng trao đổi.
hoàn thành phiếu học tập, trả lời các
KCl + H2SO4 đặc KHSO4 + HCl↑ câu hỏi sau:
-Ion bromide khử H2SO4 thành SO2 và ion Br- bị
+ Nhận xét sự thay đổi số oxi hóa của
oxi hóa thành Br2, sản phẩm có màu vàng đậm
nguyên tố halogen trong phản ứng với ( màu của Br2). H2SO4 đặc? 2K 1 + 2H 6 O O
+Viết các quá trình oxi hóa khử, cân Br 2 S 4 đặc K2SO4 + 4 S 2 + 0 Br + 2H 2 2O
bằng phương trình phản ứng?
-Ion iodide có thể khử H2SO4 thành H2S, S, SO2
HS thực hiện nhiệm vụ học tập
tùy vào điều kiện phản ứng, ion I- bị oxi hóa thành
+ HS đọc thông tin SGK, quan sát hình I2 có màu đen tím. ảnh, trả lời câu hỏi. 2K 1 6
I + 2H2 S O4 đặc K2SO4 + 4S O2 + 0I + 2H 2 2O
-Báo cáo kết quả hoạt động 6
+ HS đứng dậy trình bày câu trả lời
6K 1I + 4H2 S O4 đặc 3K2SO4 + 0S + 3 0I + 4H 2 2O
+ HS khác nhận xét, đánh giá, bổ sung 8K1 6 2
I + 5H2 S O4 đặc 4K2SO4 + H2 S + 4 0I + 4H 2 2O
Đánh giá kết quả thực hiện Nhận xét:
- GV đánh giá, nhận xét, kết luận đúc
Tính khử:F-< Cl-< Br- < I-
kết vấn, chuyển sang nội dung mới.
Phản ứng nào chứng minh tính khử ion halide
4. Nhận biết ion halide trong dung
4. Nhận biết ion halide trong dung dịch dịch
Để phân biệt các ion F-, Cl-, Br-, I- trong dụng dịch
Chuyển giao nhiệm vụ học tập
ta dùng dung dịch silver nitrate (AgNO3) vào dung
GV chia lớp thành 4 nhóm phát phiếu dịch muối của chúng.
học tập số 2, tiến hành thí nghiệm. Halide ion F- Cl- Br- I-
HS đọc SGK và tiến hành thí nghiệm Thuốc thử
báo cáo kết quả TN, trình bày cách Dung dịch Không Có kết Có kết Có
nhận biết ion halide trong dung dịch? AgNO3 ht tủa màu tủa kết
HS thực hiện nhiệm vụ học tập trắng màu tủa
+ HS đọc thông tin SGK, quan sát hình (AgCl) vàng màu ảnh, trả lời câu hỏi. nhạt vàng
-Báo cáo kết quả hoạt động (AgBr) (AgI)
+ HS đứng dậy trình bày câu trả lời
+ HS khác nhận xét, đánh giá, bổ sung
Đánh giá kết quả thực hiện
- GV đánh giá, nhận xét, kết luận đúc
kết vấn, chuyển sang nội dung mới.
5. Ứng dụng của hydrogen halide
5. Ứng dụng của hydrogen halide
Chuyển giao nhiệm vụ học tập
Hydrogen halide có nhiều ứng dụng trong đời sống
GV yêu cầu HS đọc SGK trình bày ứng và sản xuất.
dụng của các hydrogen halide, hoàn
-Hydrogen flouride (HF): tẩy cặn trong thiết bị trao
thành phiếu học tập số 3.
đổi nhiệt, chất xúc tác lọc dầu, dược phẩm, làm giàu uranium
-Hydrogen chloride (HCl): dùng để loại bỏ gỉ thép,
sản xuất chất tẩy rửa nhà vệ sinh, sản xuất hợp chất vô cơ và hữu cơ,…
-Hydrogen bromide (HBr):dùng làm chất xúc tác
tổng hợp hữu cơ, sản xuất nhựa, sản xuất vi mạch điện tử,…
-Hydrogen iodide (HBr): chất khử phổ biến trong
phản ứng hóa học, dùng làm sản xuất iodine, alkyl iodine,…
3.3. Hoạt động 3: Luyện tập (khoảng phút)
a) Mục tiêu: Tái hiện và vận dụng những kiến thức đã học trong bài về hydrogen halide, tính
chất vật lí, tính chất hóa học, giải thích nhiệt độ sôi, độ tan, tính acid của các hydrohalic acid,
sự biến đổi tính acid, tính khử của ion halide, viết phương trình hóa học, phân biệt ion halide,
ứng dụng của hydrogen halide.
b) Tổ chức thực hiện: GV phát phiếu bài tập số 1 yêu cầu HS làm vào và lên bảng sửa bài. (HS
lên bảng, giáo viên sửa bài sau khi các em làm xong). ( xem phần hồ sơ dạy học)
c) Sản phẩm: HS điền đầy đủ đúng các nội dung trong phiếu bài tập số 1.
3.4. Hoạt động 4: Vận dụng (khoảng phút)
a) Mục tiêu: Vận dụng được kiến thức đã học về hydrogen halide, ion halide, tăng cường mở
rộng các dạng bài tập cho HS.
b) Cách thức tổ chức thực hiện: GV phát phiếu số bài tập 2 trắc nghiệm yêu cầu HS làm vào và
gọi tên từng em sửa từng câu.
c) Sản phẩm: HS trả lời đúng các câu trắc nghiệm, giải thích được sự lựa chọn của mình.
V. PHỤ LỤC: Hồ sơ dạy học và bảng kiểm
1. Phiếu học tập và phiếu bài tập
Phiếu học tập số 1:
PHIẾU HỌC TẬP SỐ 1
TÍNH KHỬ CỦA ION HALIDE
Nhiệm vụ 1: Thảo luận và hoàn thành các yêu cầu sau:
1. Xác định số oxi hóa của các nguyên tố halogen và nguyên tố sulfur (S) trong các phản ứng sau
2. Nêu vai trò của các chất trong phản ứng trên ( chất oxi hóa, chất khử).
3. Viết các quá trình oxi hóa khử và cân bằng phản ứng bằng phương pháp thăng bằng electron.
4. Dự đoán tính khử của các ion halide từ F- tới I- ( quy luật nào) Phản ứng hóa học Nhận xét
KCl + H2SO4 đặc KHSO4 + HCl
KBr + H2SO4 đặc K2SO4 + SO2 + Br2 + H2O
KI + H2SO4 đặc K2SO4 + SO2 + I2 + H2O
KI + H2SO4 đặc K2SO4 + S + I2 + H2O
KI + H2SO4 đặc K2SO4 + H2S + I2 + H2O
Kết luận: tính khử ion halide từ F- tới I-:. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Nhiệm vụ 2. Hoàn thành bài tập sau
Phản ứng nào dưới đây chứng minh tính khử của ion halide
(1)BaCl2 + H2SO4 đặc BaSO4 + 2HCl
(2)4HCl + MnO2 MnCl2 + Cl2 + 2H2O
(3)2HBr + H2SO4 Br2 + SO2 + H2O (4)HI + NaOH NaI + H2O
PHIẾU HỌC TẬP SỐ 2
NHẬN BIẾT ION HALIDE
Nhiệm vụ. Trước khi tiến hành thí nghiệm thảo luận và hoàn thành các yêu cầu sau
1. Cho biết hóa chất và dụng cụ cần thiết
2. Cách tiến hành thí nghiệm
3. Tiến hành thí nghiệm, ghi chép hiện tượng
4. Viết phương trình phản ứng 5. Báo cáo Hóa chất dụng cụ
Cách tiến hành thí nghiệm Hóa chất: Bước 1: Dụng cụ: Bước 2: Kết quả thí nghiệm Phương trình phản ứng Ống nghiệm 1: Ống nghiệm 2: Ống nghiệm 3: Ống nghiệm 4:
Kết luận: để nhận biết các ion halide:. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Trình bày cách nhận biết 2 dung dịch CaCl2 và NaNO3 viết phương trình hóa học xảy ra Dung dịch Dung dịch CaCl2 Dung dịch NaNO3 Thuốc thử
PHIẾU BÀI TẬP SỐ 1.
(yêu cầu HS đóng hết sách vở khi làm)
Câu 1. Nhiệt độ sôi của các hydrogen halide biến đổi như thế nào? Giải thích?
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Câu 2. Giải thích nhiệt độ sôi bất thường của hydrogen flouride so với các hydrogen halide còn lại?
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Câu 3. Em hãy cho biết làm sao để có được các dung dịch hydrohalic acid? Giải thích vì sao
không bảo quản dung dịch hydroflouric acid trong các bình thủy tinh?
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Câu 4. Trình bày tính chất hóa học của các hydrohalic acid? Viết phương trình minh họa cho các tính chất vừa nêu?
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Câu 5. Trình bày cách phân biệt ion halide? Từ đó nêu cách nhận biết hai dung dịch KCl và Ca(NO3)2?
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
Câu 6. Viết phương trình hóa học cho các trường hợp sau:
a/ Cho kim loại Fe tác dụng với dung dịch HCl
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
b/ Cho dung dịch KOH phản ứng với dung dịch HBr
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
c/ Cho muối CaCO3 phản ứng với dung dịch HI
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
d/ Cho dung dịch AgNO3 tác dụng với dung dịch HBr
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
PHIẾU BÀI TẬP SỐ 2
( HS không xem tài liệu)
Câu 1. Dung dịch acid nào sau đây không thể bảo quản trong bình thủy tinh? A. HCl. B. H2SO4.. C. HF. D. HNO3.
Câu 2. Bệnh viêm loét dạ dày gây ra bởi nguyên nhân là dư thừa lượng chất nào dưới đây? A. KI. B. NaCl. C. HBr. D. HCl.
Câu 3. Nhiệt độ sôi của hydrogen halide nào sau đây cao nhất? A. HF. B. HBr. C. HCl. D. HI.
Câu 4. Dãy nào sau đây sắp xếp đúng theo thứ tự giảm dần tính acid của các dung dịch hydrohalic acid?
A. HI > HBr > HCl > HF.
B. HF > HCl > HBr > HI.
C. HCl > HBr > HI > HF.
D. HCl > HBr > HF > HI.
Câu 5. Có thể phân biệt 4 dung dịch NaF, NaCl, NaBr, NaI đựng trong các lọ bị mất nhãn bằng dung dịch: A. AgNO3. B. NaNO3. C. BaCl2. D. Na2SO4.
Câu 6. Dung dịch HBr có thể phản ứng với? A. Cu. B. dd Na2SO4. C. Na2CO3. D. Ag.
Câu 7. Tính khử của ion halide nào yếu nhất? A. F-. B. Cl-. C. Br-. D. I-.
Câu 8. Nước muối sinh lí thường dùng để súc miệng sát khuẩn,. . có nồng độ tương đương các
dịch trong cơ thể cong người. Nước muối sinh lí là
A. Dung dịch soidum chloride 0,9%.
B. Dung dịch sodium fluoride 0,9%.
C. Dung dịch sodium bromide 0,9%.
D. Dung dịch sodium iodide 0,9%.
Câu 9. Từ HCl đến HI nhiệt độ sôi tăng là do
A. Lực tương tác van der Waals giữa các phân tử tăng.
B. Khối lượng phân tử tăng.
C. Độ dài liên kết giảm.
D. Cả A và B đều đúng
Câu 10. Cho phương trình: NaX rắn + H2SO4 đặc t0
HX ↑ + NaHSO4. Chất NaX là chất nào sau đây? A. NaCl. B. NaF. C. NaBr. D. NaI.
Câu 11. Liên kết trong phân tử nào sau đây có độ phân cực lớn nhất? A. H-Cl. B. H-F. C. H-Br. D. H-I.
Câu 12. Hydrogen halide nào sau đây tan vô hạn trong nước? A. HCl. B. HI. C. HBr. D. HF.
Câu 13. Hydrohalic acid nào sau đây là acid yếu? A. HF. B. HCl. C. HBr. D. HI.
Câu 14. Chất nào dưới đây được sử dụng trong quá trình tạo mưa nhân tạo? A. AgNO3. B. AgI. C. AgBr. D. AgF.
Câu 15. Muối halide nào sau đây có nhiều ứng dụng quan trọng trong đời sống như làm muối
ăn, chất điện giải, chất tẩy rửa, thuốc nhỏ mắt,…? A. NaI. B. CaI2. C. NaBr. D. NaCl.
2. Bảng kiểm để học sinh tự đánh giá hoạt động 2,3,4. BẢNG KIỂM
(Đánh X vào ô “Đạt” hoặc “Không đạt” cho các tiêu chí các nội dung trọng tâm) TIÊU CHÍ GHI CHÚ STT Tính khử ion
Nhận biết ion (hay sai chổ nào) Hydrogen halide Hydrohalic acid halide halide- Ứng dụng Đạt Không Đạt Không Đạt Không Đạt Không đạt đạt đạt đạt 1 2
3. Đáp án phiếu học tập và phiếu bài tập
PHIẾU HỌC TẬP SỐ 1
TÍNH KHỬ CỦA ION HALIDE
Nhiệm vụ 1: Thảo luận và hoàn thành các yêu cầu sau:
5. Xác định số oxi hóa của các nguyên tố halogen và nguyên tố sulfur (S) trong các phản ứng sau
6. Nêu vai trò của các chất trong phản ứng trên ( chất oxi hóa, chất khử).
7. Viết các quá trình oxi hóa khử và cân bằng phản ứng bằng phương pháp thăng bằng electron.
8. Dự đoán tính khử của các ion halide từ F- tới I- ( quy luật nào) Phản ứng hóa học Nhận xét -1 +6 +6 -1
-Số oxi hóa của các nguyên tố
KCl + H2SO4 đặc KHSO4 + HCl không thay đổi.
-Ion chloride không khử được
H2SO4, chỉ xảy ra phản ứng trao đổi. -1 +6 +4 0
Số oxh của nguyên tố S giảm:
2KBr + 2H2SO4 đặc K2SO4 + SO2 + Br2 + 2H2O H2SO4 là chất oxi hóa
Của Br tăng: Br- là chất khử
Các quá trình oxi hóa khử
Như vậy tính khử Br- > Cl- -1 0 quá trình oxi hóa: 1 2Br Br2 + 2e +6 +4 quá trình khử: 1 S + 2e S -1 +6 +4 0
Số oxh hóa của S giảm từ +6
2KI + 2H2SO4 đặc K2SO4 + SO2 + I2 + 2H2O xuống +4, 0, -2
Số oxh của I tăng -1 lên 0
Các quá trình oxi hóa khử-1 0 quá trình oxi hóa: 1 2I I
Tùy vào điều kiện KI tác dụng 2 + 2e +6 +4
với H2SO4 cho ra nhiều sản quá trình khử: 1 S + 2e S phẩm khử tương tự cho 2 pt sau
Như vậy: tính khử của I- > Br- -1 +6 0 0 >Cl-
6KI + 4H2SO4 đặc 3K2SO4 + S + 3I2 + 4H2O -1 +6 -2 0
8KI + 5H2SO4 đặc 4K2SO4 + H2S + 4I2 + 4H2O
Kết luận: tính khử ion halide từ F- tới I-: tăng dần F-< Cl-
Nhiệm vụ 2. Hoàn thành bài tập sau
Phản ứng nào dưới đây chứng minh tính khử của ion halide
(5)BaCl2 + H2SO4 đặc BaSO4 + 2HCl
(6)4HCl + MnO2 MnCl2 + Cl2 + 2H2O
(7)2HBr + H2SO4 Br2 + SO2 + H2O (8)HI + NaOH NaI + H2O
Các phản ứng 2, 3 thể hiện tính khử của ion halide vì có sự thay đổi số oxh ở ion halide
còn phản ứng 1 và 4 là các phản ứng trao đổi.
PHIẾU HỌC TẬP SỐ 2
NHẬN BIẾT ION HALIDE
Nhiệm vụ. Trước khi tiến hành thí nghiệm thảo luận và hoàn thành các yêu cầu sau
1. Cho biết hóa chất và dụng cụ cần thiết
2. Cách tiến hành thí nghiệm
3. Tiến hành thí nghiệm, ghi chép hiện tượng
4. Viết phương trình phản ứng 5. Báo cáo Hóa chất dụng cụ
Cách tiến hành thí nghiệm
Hóa chất:các dung dịch NaF, NaCl, NaBr,
Bước 1: Cho 4 ống nghiệm lên giá đánh số
NaI và AgNO3 đều có nồng độ 0,1M.
từ 1 tới 4 cho vào 4 ống theo thứ tự lần lượt
từ 1 đến 4 NaF, NaCl, NaBr, NaI đều khoảng
Dụng cụ: 4 ống nghiệm, ống hút, giá để ống 2ml. nghiệm.
Bước 2: nhỏ vào 4 ống nghiệm vài giọt AgNO3 Kết quả thí nghiệm Phương trình phản ứng
Ống nghiệm 1: không hiện tượng
Ống nghiệm 2: có kết tủa trắng
AgNO3 + NaCl AgCl ↓ + NaNO3
Ống nghiệm 3: có kết tủa vàng nhạt
AgNO3 + NaBr AgBr ↓ + NaNO3
Ống nghiệm 4: có kết tủa vàng
AgNO3 + NaI AgI ↓ + NaNO3
Kết luận: để nhận biết các ion halide: ta dùng dung dịch AgNO3
Trình bày cách nhận biết 2 dung dịch CaCl2 và NaNO3 viết phương trình hóa học xảy ra Dung dịch Dung dịch CaCl2 Dung dịch NaNO3 Thuốc thử Dung dịch AgNO3 Có kết tủa trắng AgCl Không hiện tượng
PT: 2AgNO3 + CaCl2 2AgCl↓ + Ca(NO3)2
PHIẾU BÀI TẬP SỐ 1.
(yêu cầu HS đóng hết sách vở khi làm)
Câu 1. Nhiệt độ sôi của các hydrogen halide biến đổi như thế nào? Giải thích?
-Nhiệt độ sôi của các hydrogen halide tăng dần từ HCl đến HI. Do tương tác van der Waals
tăng, và khối lượng phân tử tăng. Trong đó nhiệt độ sôi của HF cao hơn nhiều so với các hydrogen halide còn lại.
Câu 2. Giải thích nhiệt độ sôi bất thường của hydrogen flouride so với các hydrogen halide còn lại?
-Nhiệt độ sôi của HF cao bất thường so với các hydrogen halide còn lại là do: giữa các phân tử
HF có tạo liên kết hydrogen với nhau tạo vì vậy HF khó bay hơi hơn so với các hydrogen halide khác.
Câu 3. Em hãy cho biết làm sao để có được các dung dịch hydrohalic acid? Giải thích vì sao
không bảo quản dung dịch hydroflouric acid trong các bình thủy tinh?
-Để thu được các hydrohalic acid ta cho các khí hydrogen halide tan vào nước được các dung dịch hydrohalic acid.
-Không bảo quản HF trong bình thủy tinh vì acid HF có tính ăn mòn thủy tinh PT: 4HF + SiO2 SiF4 + 2H2O
Câu 4. Trình bày tính chất hóa học của các hydrohalic acid? Viết phương trình minh họa cho các tính chất vừa nêu?
- Các hydrohalic acid có tính acid: HF là acid yếu nhưng có tính ăn mòn thủy tinh, các axit HCl,
HBr, HI là các acid mạnh độ mạnh tăng dần, chúng thể hiện đầy đủ tính chất của một acid mạnh + làm quỳ tím hóa đỏ
+ tác dụng với kim loại hoạt động trước hydrogen: Fe + 2HBr FeBr2 + H2
+ tác dụng với basic oxide: 2HCl + CaO CaCl2 + H2O
+ tác dụng với base: HBr + NaOH NaBr + H2O
+ tác dụng với một số muối: HI + NaHCO3 NaI + CO2 + H2O
Câu 5. Trình bày cách phân biệt ion halide? Từ đó nêu cách nhận biết hai dung dịch KCl và Ca(NO3)2?
- Để phân biệt các ion F-, Cl-, Br-, I- trong dụng dịch ta dùng dung dịch silver nitrate (AgNO3)
vào dung dịch muối của chúng. Halide ion F- Cl- Br- I- Thuốc thử Dung dịch Không Có kết Có kết Có AgNO3 ht tủa màu tủa kết trắng màu tủa (AgCl) vàng màu nhạt vàng (AgBr) (AgI)
Trình bày cách nhận biết 2 dung dịch Ca(NO3)2 và KCl viết phương trình hóa học xảy ra Dung dịch Dung dịch KCl Dung dịch Ca(NO3)2 Thuốc thử Dung dịch AgNO3 Có kết tủa trắng AgCl Không hiện tượng
PT: AgNO3 + KCl AgCl↓ + KNO3
Câu 6. Viết phương trình hóa học cho các trường hợp sau:
a/ Cho kim loại Fe tác dụng với dung dịch HCl Fe + 2HCl FeCl2 + H2
b/ Cho dung dịch KOH phản ứng với dung dịch HBr KOH + HBr KBr + H2O
c/ Cho muối CaCO3 phản ứng với dung dịch HI
CaCO3 + 2HI CaI2 + CO2 + H2O
d/ Cho dung dịch AgNO3 tác dụng với dung dịch HBr AgNO3 + HBr AgBr + HNO3
PHIẾU BÀI TẬP SỐ 2
( HS không xem tài liệu)
Câu 1. Dung dịch acid nào sau đây không thể bảo quản trong bình thủy tinh? A. HCl. B. H2SO4.. C. HF. D. HNO3.
Câu 2. Bệnh viêm loét dạ dày gây ra bởi nguyên nhân là dư thừa lượng chất nào dưới đây? A. KI. B. NaCl. C. HBr. D. HCl.
Câu 3. Nhiệt độ sôi của hydrogen halide nào sau đây cao nhất? A. HF. B. HBr. C. HCl. D. HI.
Câu 4. Dãy nào sau đây sắp xếp đúng theo thứ tự giảm dần tính acid của các dung dịch hydrohalic acid?
A. HI > HBr > HCl > HF.
B. HF > HCl > HBr > HI.
C. HCl > HBr > HI > HF.
D. HCl > HBr > HF > HI.
Câu 5. Có thể phân biệt 4 dung dịch NaF, NaCl, NaBr, NaI đựng trong các lọ bị mất nhãn bằng dung dịch: A. AgNO3. B. NaNO3. C. BaCl2. D. Na2SO4.
Câu 6. Dung dịch HBr có thể phản ứng với? A. Cu. B. dd Na2SO4. C. Na2CO3. D. Ag.
Câu 7. Tính khử của ion halide nào yếu nhất? A. F-. B. Cl-. C. Br-. D. I-.
Câu 8. Nước muối sinh lí thường dùng để súc miệng sát khuẩn,. . có nồng độ tương đương các
dịch trong cơ thể cong người. Nước muối sinh lí là
A. Dung dịch soidum chloride 0,9%.
B. Dung dịch sodium fluoride 0,9%.
C. Dung dịch sodium bromide 0,9%.
D. Dung dịch sodium iodide 0,9%.
Câu 9. Từ HCl đến HI nhiệt độ sôi tăng là do
A. Lực tương tác van der Waals giữa các phân tử tăng.
B. Khối lượng phân tử tăng.
C. Độ dài liên kết giảm.
D. Cả A và B đều đúng.
Câu 10. Cho phương trình: NaX rắn + H2SO4 đặc t0
HX ↑ + NaHSO4. Chất NaX là chất nào sau đây? A. NaCl. B. NaNO3. C. NaBr. D. NaI.
Câu 11. Liên kết trong phân tử nào sau đây có độ phân cực lớn nhất? A. H-Cl. B. H-F. C. H-Br. D. H-I.
Câu 12. Hydrogen halide nào sau đây tan vô hạn trong nước? A. HCl. B. HI. C. HBr. D. HF.
Câu 13. Hydrohalic acid nào sau đây là acid yếu? A. HF. B. HCl. C. HBr. D. HI.
Câu 14. Chất nào dưới đây được sử dụng trong quá trình tạo mưa nhân tạo? A. AgNO3. B. AgI. C. AgBr. D. AgF.
Câu 15. Muối halide nào sau đây có nhiều ứng dụng quan trọng trong đời sống như làm muối
ăn, chất điện giải, chất tẩy rửa, thuốc nhỏ mắt,…? A. NaI. B. CaI2. C. NaBr. D. NaCl.
Document Outline



