








Preview text:
lOMoARcPSD|35973522 Chương 5: HÓA SINH PROTID MỤC TIÊU HỌC TẬP
Sau khi học xong bài này học viên phải:
- Trình bày được cấu tạo hóa học của 20 acid amin tham gia vào cấu trúc protein của cơ thể.
- Trình bày được quá trình thoái biến chung của các acid amin.
- Trình bày được quá trình thoái biến riêng của 20 acid amin.
- Mô tả được cấu trúc, quá trình thoái biến và sinh tổng hợp hemoglobin.
- Phân tích được nguồn gốc và các con đường chuyển hóa (khử độc) của ammoniac.
- Trình bày được các phản ứng của chu trình urê.
- Làm được các xét nghiệm định lượng nồng độ albumin, protein toàn phần,
hemoglobin, ure trong máu (khi tiến hành thực tập). Trình bày được nguyên lý
định lượng và ý nghĩa của các xét nghiệm này trên lâm sàng.
- Biểu hiện được quan điểm về rối loạn chuyển hóa protein trong thời đại hiện nay.
- Tư vấn được cho bệnh nhân về chế độ ăn có đủ các acid amin cần thiết. 1. Đại cương
Trong các tổ chức của người và động vật protid chiếm tỷ lệ cao (20 %) so
với glucid và lipid (1- 5%). Protid là thuật ngữ chung dùng để chỉ các hợp chất
hữu cơ gồm acid amin, peptid, protein và proteid.
Dựa theo thành phần hóa học, protid được chia thành hai loại
Protid thuần (protein) là protid mà thành phần cấu tạo của nó chỉ gồm các
acid amin. Ví dụ như albumin, globulin, protamin, histon.
Protid phức tạp (proteid) là protid có hai thành phần:
- Một phần là protein (gồm các acid amin)
- Một phần không phải là protein (còn gọi là nhóm ngoại).
Các nhóm ngoại khác nhau nên tên gọi của protid cũng khác nhau. Ví dụ
như phosphoproteid (nhóm ngoại là gốc phosphat), nucleoproteid (acid nucleic),
lipoproteid (lipid), glycoproteid (glucid)..vv. 2. Acid amin
2.1. Cấu tạo và phân loại acid amin. 2.1.1. Cấu tạo.
Acid amin là acid hữu cơ trong đó một hay hai nguyên tử hydro được thay
thế bằng nhóm amin (NH2). Tùy theo vị trí của nhóm amin ở carbon nào mà các
acid amin có tên gọi khác nhau: , , ...
Trong cơ thì hầu hết là dạng - acid amin, công thức chung của acid -acid
amin (trừ prolin và hydroxyprolin) như sau: 1
Downloaded by Di?p ??ng Ng?c (tanphatthpt@gmail.com) lOMoARcPSD|35973522 R - CH - COOH NH2
Các acid amin khác nhau phân biệt bởi các gốc R. Bản chất hóa học và
các tính chất lí, hóa của gốc R quyết định cấu tạo đa dạng và các chức năng của protid.
2.1.2. Phân loại acid amin.
Phân loại theo nhu cầu dinh dưỡng, các acid amin chia thành hai loại:
- Acid amin cần thiết: Là các acid amin cơ thể không tự tổng hợp được
phải lấy từ bên ngoài vào qua ăn, uống, tiêm truyền. Có 8 acid amin cần thiết là
methionin, valin, tryptophan, isoleucin, leucin, phenylalanin, threonin, lysin.
- Acid amin không cần thiết là các acid amin cơ thể có thể tự tổng hợp
được. đó là alanin, prolin, glycin, serin...
Phân loại theo chuyển hóa, các acid amin được chia thành ba loại:
- Acid amin sinh đường như alanin, arginin...
- Acid amin sinh ceton như leucin, isoleucin...
- Acid amin vừa sinh đường, vừa sinh ceton như tryptophan, phenylalanin, tyrosin.
Phân loại theo cấu tạo hóa học, các acid amin được chia thành 2 loại (Bảng 1.1)
- Acid amin mạch thẳng, gồm: mạch thẳng trung tính (Gly, Ala, Val, Leu,
Ileu, Ser, Thr, Cys, Met), mạch thẳng acid (Glu, Asp), mạch thẳng kiềm (Lys, Arg).
- Acid amin mạch vòng và dị vòng: mạch vòng trung tính (Phe, Tyr, Trp),
mạch vòng có tính kiềm (His, Pro).
Các khái niệm trung tính, acid amin acid, acid amin kiềm được hiểu như sau:
Acid amin trung tính: Cấu tạo phân tử có 1 nhóm NH2 và 1 nhóm COOH.
Ví dụ như alanin, serin...(bảng 1.1).
Acid amin acid: có 2 nhóm COOH, 1 nhóm NH2 trong phân tử. Ví dụ acid
glutamic, acid aspartic (bảng 1.1).
Acid amin kiềm: phân tử có 2 nhóm NH2 và 1 nhóm COOH. Ví dụ lysin, arginin (bảng 1.1)...
Ngoài ra dựa vào cấu tạo và tính chất lí, hóa của gốc R có thể chia acid amin thành 4 loại:
- Acid amin không phân cực: Ala, Val, Leu, Ileu, Trp, Pro, Phe, Met.
- Acid amin phân cực không tích điện: Gly, Ser, Thr, Cys, Tyr, Asn, Gln.
- Acid amin acid (tích điện âm): Asp, Glu.
- Acid amin kiềm (tích điện dương): Lys, Arg, His.
2.2. Tính chất chung của acid amin. 2
Downloaded by Di?p ??ng Ng?c (tanphatthpt@gmail.com) lOMoARcPSD|35973522
2.2.1. Tính chất lưỡng tính:
Tính chất lưỡng tính của acid amin là do phân tử của nó có nhóm amin
(NH2) mang tính kiềm và nhóm carbocyl (COOH) mang tính acid.
- Ở môi trường kiềm acid amin phân ly như một acid và mang điện tích âm: R - CH - COOH + [ OH ] R - CH - COO + H2O NH2 NH2
- Ở môi trường acid, acid amin phân ly như một base và mang điện tích dương: + R - CH - COOH + [ H ] R - CH - COOH + NH2 NH3
Ứng dụng tính chất lưỡng tính của acid amin để điện di phân tích hỗn hợp
các acid amin. Ở giá trị pH nào đó của môi trường mà tổng các điện tích của
phân tử bằng không, acid amin trung hòa về điện, pH đó gọi là pH đẳng điện (kí
hiệu là pHi) của acid amin. Mỗi loại acid amin có pHi riêng. Ví dụ pHi của
alanin là 6,0 ; của acid glutamic là 3,22.
2.2.2. Tính chất hóa học của acid amin:
Tính chất thuộc nhóm NH2:
+ Khử amin: Khử amin là sự tách nhóm NH2 ra khỏi các acid amin. Nếu nhóm
NH2 của acid amin được tách trực tiếp để thành NH3 thì được gọi là sự khử amin trực
tiếp. Nếu nhóm NH2 chuyển cho một acid -cetonic tạo acid glutamic, sau đó glutamic
khử amin oxy hóa thì gọi là khử amin gián tiếp. Xem thêm phần thoái biến chung của các acid amin).
+ Phản ứng Ninhydrin: Xảy ra theo 2 giai đoạn.
- Giai đoạn 1: Nhờ khử amin- oxy hóa acid amin (xảy ra song song với khử
CO2) tạo nên ninhydrin dạng oxy hóa: R O O R OH OH CH - NH2 + C - H + CO2 + NH3 + OH H COOH O O O Aminoacid Ninhydrin (d¹ng khö) Ninhydrin (d¹ng oxy ho¸)
- Giai đoạn 2: NH3 tạo thành kết hợp với nihydrin dạng khử và ninhydrin
dạng oxy hóa tạo nên phức hợp màu xanh tím (trừ prolin cho màu vàng): 3
Downloaded by Di?p ??ng Ng?c (tanphatthpt@gmail.com) lOMoARcPSD|35973522 O O O O H H OH HO - 3H2O H + N + N H HO O O O O Ninhydrin Ninhydrin Phøc hî p mµu xanh tÝm (d¹ng oxy ho¸) (d¹ng khö)
Người ta ứng dụng phản ứng này để định lượng acid amin bằng phương
pháp sắc kí các acid amin. Sau khi phân chia hỗn hợp acid amin trong cột trao
đổi ion, hỗn hợp đó được nhuộm với dung dịch ninhydrin tạo thành phức hợp
màu, cường độ màu tỷ lệ với nồng độ acid amin và được đo tự động. Đây là
phương pháp được ứng dụng trong lâm sàng để định lượng acid amin trong máu,
nước tiểu, dịch não tủy.
Bảng 1.1: Phân loại acid amin theo cấu tạo hóa học. 4
Downloaded by Di?p ??ng Ng?c (tanphatthpt@gmail.com) lOMoARcPSD|35973522 § Æ c ®iÓm cÊu t¹o Tªn acid amin ViÕt t¾ t C«ng thøc ho¸ häc pHi Glycin Gly CH2 - COOH 5,97 NH2 Alanin Ala CH3 - CH - COOH 6,02 NH2 Valin Val H3C - CH - CH - COOH 5,97 CH3 NH2 Leusin Leu H3C - CH - CH2 - CH - COOH 5,98 m¹ c h CH3 NH2 t h ¼n g Isoleusin Ile CH3 - CH2 - CH - CH - COOH 6,02 Tr u n g CH t Ýn h 3 NH2 Serin Ser CH2 - CH - COOH 5,68 OH NH2 Threonin Thr CH3 - CH - CH - COOH 6,53 OH NH2 Cystein Cys CH2 - CH - COOH 5,02 SH NH2
Methionin Met CH2 - CH2 - CH - COOH 5,75 S - CH3 NH2 Acid aspartic Asp HOOC -CH2 - CH - COOH 2,97 NH2 M¹ c h t h ¼n g
Asparagin Asn H2N - CO - CH2 - CH - COOH 5,41 a c id NH2
Acid glutamic Glu HOOC - CH2 - CH2 - CH - COOH 3,22 NH2
Glutamin Gln H2N - CO - CH2 - CH2 - CH - COOH 5,65 NH2 § Æ c ® iÓm cÊu t¹o Tªn acid amin ViÕt t¾ t C«ng thøc ho¸ häc pHi Arginin Arg
HN = C - NH - (CH2)3 - CH - COOH 10,76 m¹ c h NH2 NH2 t h ¼n g k iÒm
Lysin Lys H2N - CH2 - (CH2)3 - CH - COOH 9,59 NH2 Histidin His N CH2 - CH - COOH 7,58 NH2 NH 5 Phenylalanin Phe CH2 - CH - COOH 5,98
Downloaded by Di?p ??ng Ng?c (tanphatthpt@gmail.com) NH2 lOMoARcPSD|35973522
Tính chất thuộc nhóm carbocyl (-COOH):
Các acid amin bị khử carbocyl (CO2) tạo thành các amin tương ứng. - CO2 R - CH - COOH R - CH2 - NH2 NH 2 Amin
Đa số các amin có hoạt tính sinh học như tyramin, histamin được tạo ra khi
khử CO2 từ tyrosin và histidin tương ứng.
Một số tính chất riêng của acid amin:
Để phát hiện, nhận biết các thành phần riêng của acid amin (trong dịch thuỷ
phân protid), người ta sử dụng một số tính chất lên màu của nó. Sau đây chúng
ta tham khảo một số phản ứng để nhận biết và bán định lượng một số acid amin. Tên phản ứng Thuốc thử
Acid amin cần Màu phản ứng xác định Millon HgNO3/ HNO3 Tyr Đỏ Cantoprotein HNO3 đặc, sôi Phe, Tyr Vàng Adamkievis a.glyocylic/ H2SO4 đ.đ Tyr Xanh-tím Sacaguichi -naphtol & NaHBr Arg Đỏ(anh đào) 3. Chuyển hóa acid amin
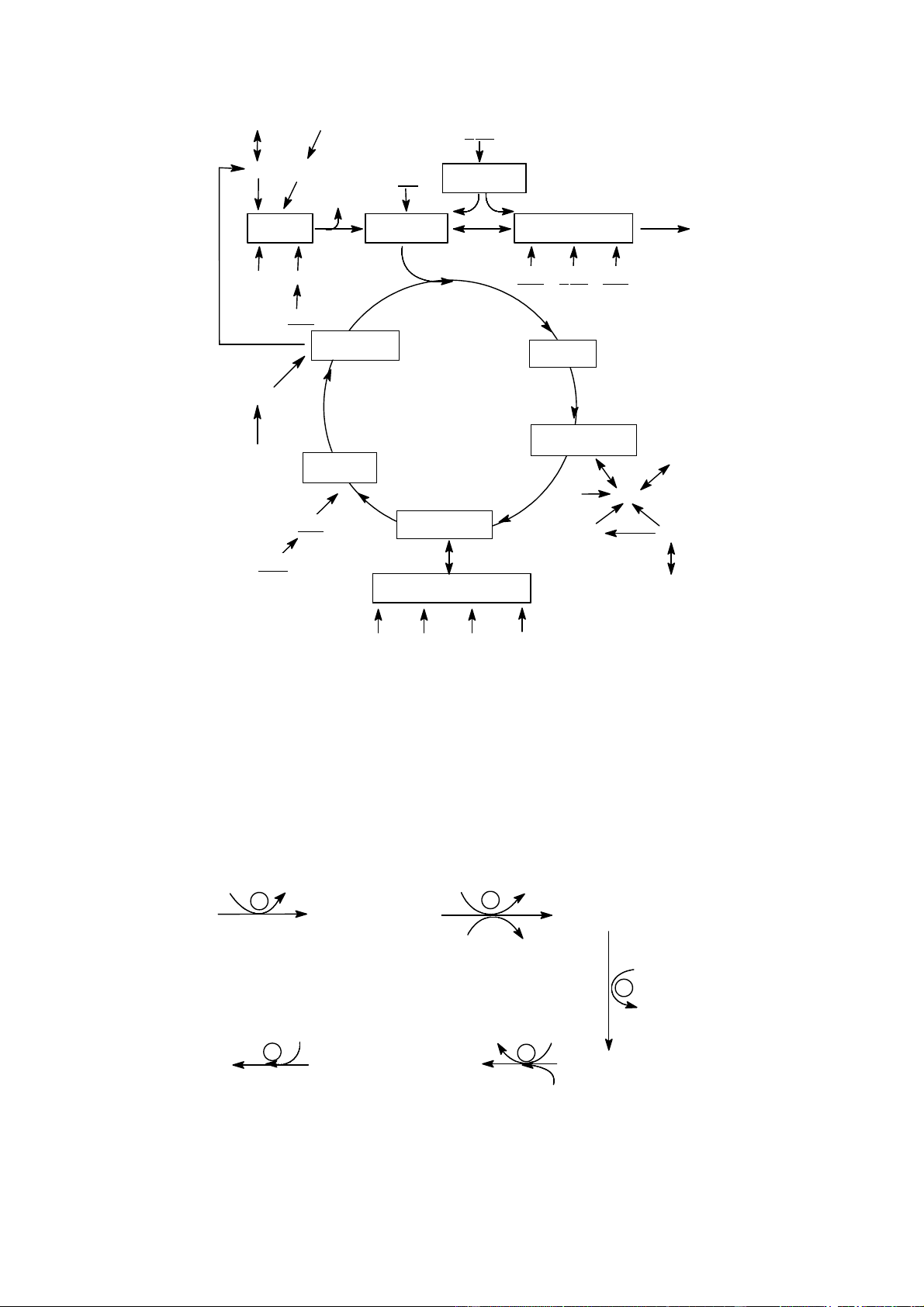
3.1. Thoái biến chung của các acid amin
Những con đường thoái biến acid amin không thuận nghịch với con đường tổng
hợp mặc dù có những giai đoạn chung cho cả hai quá trình này. Có hai con đường
chính để loại nhóm amino ra khỏi acid amin là khử amin và trao đổi amin. 3.1.1. Khử amin.
Trong cơ thể, có 4 kiểu khử amin. Đó là:
(1) Khử amin thủy phân: Hydrolase R – CH - COOH R – CH - COOH + H2O + NH3 NH2 OH
(2) Khử amin khử (hydro): 6
Downloaded by Di?p ??ng Ng?c (tanphatthpt@gmail.com) lOMoARcPSD|35973522 Dehydrolas R – CH - e COOH R – CH2 - NH + COOH 3 NH (Acid 2 béo) NADH+ NAD H+ +
(3) Khử amin nội phân tử: R – CH - COOH Desaminase R – CH=CH - COOH NH + 3 NH (Acid béo không bão hòa) 2
(4) Khử amin - oxi hóa: R – CH - COOH Desaminase NH R – CO - COOH + 3 NH 2 (α ceto acid)
Đối với người, động vật, thực vật và phần lớn vi sinh vật ái khí, khử amin oxy
hóa là chủ yếu (ngoại trừ ở gan Ser, Thr, Cys: khử amin thủy phân và His: khử amin nội phân tử). Khử amin - oxi hóa:
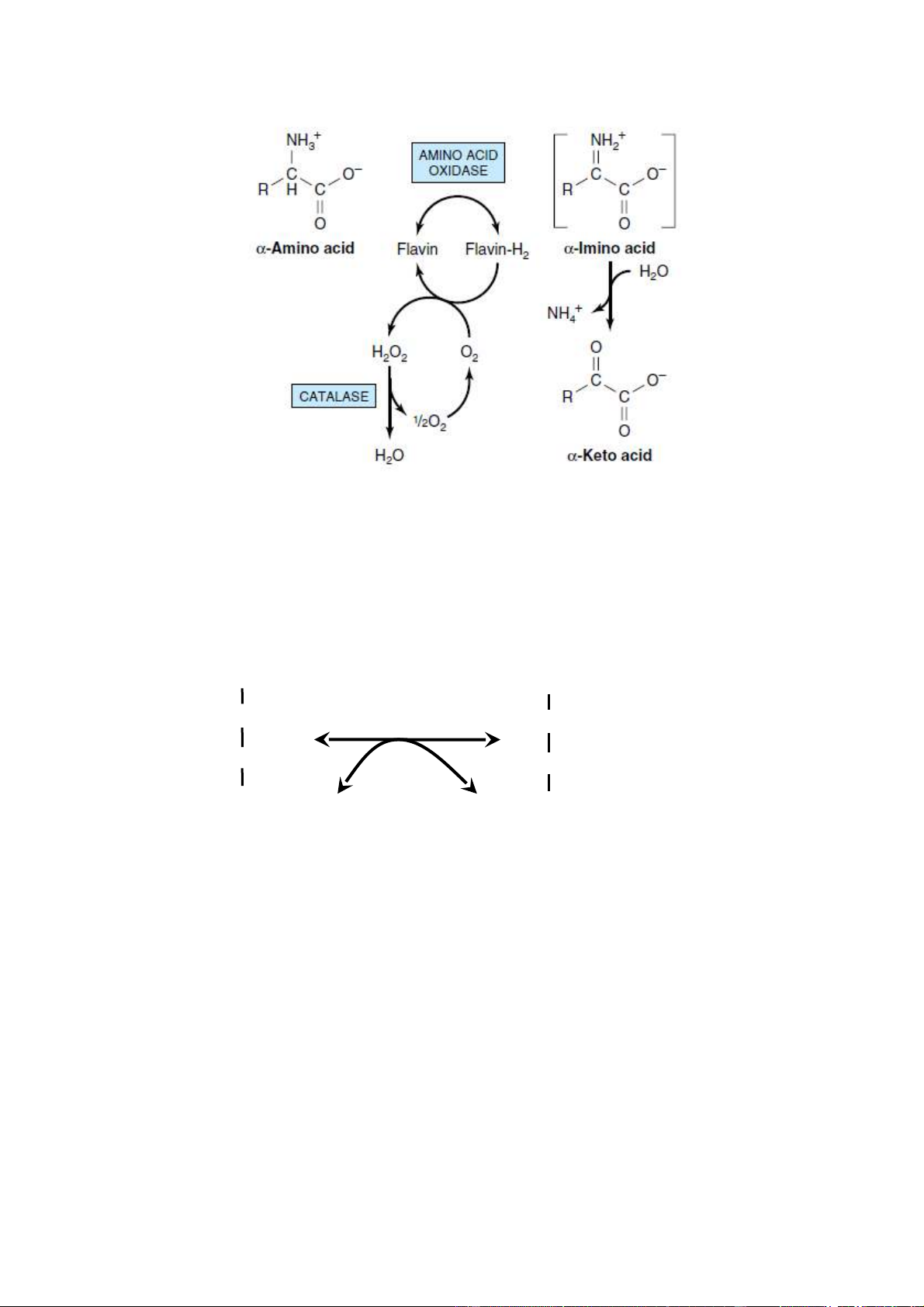
Khử amin oxy hóa được xúc tác bởi các acid amin oxidase (những enzym
flavoprotein chứa CoE là FAD hoặc FMN), sử dụng oxy là chất nhận điện tử, diễn ra qua hai giai đoạn:
Giai đoạn 1: Acid amin bị khử hydrogen để thành imino acid tương ứng.
Giai đoạn 2: Hợp nước tạo thành -cetoacid và giải phóng NH3. 7
Downloaded by Di?p ??ng Ng?c (tanphatthpt@gmail.com) lOMoARcPSD|35973522
Hình 1: Sơ đồ quá trình khử amin oxy hóa
Có các oxidase đặc hiệu với D-acid amin và L-acid amin. Các D-acid amin
oxidase chứa FAD, các L-acid amin oxidase chứa FMN. Nhìn chung, sự khử amin oxy
hóa của các acid amin diễn ra không đáng kể.
Trong các oxydase, chỉ có L-Glutamat dehydrogenase (GLDH) của gan là có
hoạt tính cao và xúc tác tiêu tốn ít năng lượng. Nó sử dụng CoE là NAD hoặc NADP
và xúc tác phản ứng sau: COO COO - - CH- GLD CH= NH2 H O + NH3 (CH2)2 (CH2)2 COO COO H NAD(P NAD(P) + ) H+ H Glutamat α Cetoglutarat
Quá trình khử amin oxy hóa của acid glutamic nhờ xúc tác của enzym GLDH tạo
α ceto glutaric acid và NH3 gọi là khử amin oxy hóa trực tiếp.
Glutamatdehydrogenase có trong ty thể và bào tương của tế bào gan của động vật
có vú. Nó là enzym dị lập thể, GDP và ADP hoạt hóa, còn GTP và ATP ức chế enzym.
Phản ứng khử amin của glutamat có ý nghĩa quan trọng vì một mặt nó cung cấp NH3
cho tổng hợp urê, sử dụng NH3 để tổng hợp glutamat. Mặt khác glutamat là acid amin
duy nhất bị khử amin oxy hóa trực tiếp với tốc độ cao ở gan và có vai trò trung tâm
trong việc khử amin của các acid amin.
3.1.2. Chuyển (hoặc trao đổi) amin.
Những phản ứng quan trọng nhất của chuyển hóa acid amin là chuyển nhóm
amin cho -cetoacid. Phản ứng được xúc tác bởi transaminase (hoặc amino
transferase), chứa CoE là pyridoxalphosphat (vitamin B6). 8
Downloaded by Di?p ??ng Ng?c (tanphatthpt@gmail.com) lOMoARcPSD|35973522 O C H R1 – CH - H R2 – CH - CH2OPO32-…Enz COOH O H3 COOH NH NH C N 2 2 Transaminas Acid amin 1 Acid amin 2 e H2 R1 – CH2 - C H N R2 – CH2 - COOH H α-ceto acid CH2OPO32-…Enz COOH O H3 α-ceto acid 1 C 2 N
Trong phản ứng này, nhóm -NH2 của acid amin được chuyển gián tiếp (qua
pyridoxal phosphat) cho C của -cetoacid (thường là -cetoglutarat). Mất nhóm -
amin, acid amin trở thành -cetoacid tương ứng, còn -cetoacid nhận nhóm amin sẽ trở
thành acid amin tương ứng.
Phần lớn các acid amin (ít nhất là 12, gồm Ala, Asp, Asn, Cys, Ile, Leu, Lys, Phe,
Tyr, Try, Val) loại nhóm amin bằng cách trao đổi amin. Cặp -cetoacid-acid amin quan
trọng nhất đối với phản ứng trao đổi amin của các acid amin là -cetoglutarat-glutamat.
Phản ứng trao đổi có liên quan với sự tổng hợp các acid amin không cần thiết, sự thoái
biến của phần lớn acid amin (trừ lysin và threonin).
Các transaminase có ở bào tương và ty thể có tính đặc hiệu cơ chất khác nhau,
phân bố rộng rãi trong tổ chức.
Trong các transaminase, có 2 enzym quan trọng nhất về mặt lâm sàng là
AST/GOT (Glutamat-Oxaloacetat-Transaminase) và ALT/GPT (Glutamat-Pyruvat-
Transaminase). Chúng xúc tác hai phản ứng tương ứng sau: COO- COO- COO- COO- GOT CH - NH C=O C=O + CH - NH 2 + 2 CH (CH CH (CH) 2 2)2 2 2 COO- COO- COO- COO- (Aspartat) (-cetog l u
tarat) (oxaloacetat) (Glutamat) COO- COO- COO- COO- GPT CH C=O + CH - NH 2 - NH2 + C=O 2 CH CH (CH) 2 (CH2)2 3 2 COO- COO- (Alanin) (- c
e toglutarat) (Pyruvat) (Glutamat)
GOT có nhiều trong tế bào cơ tim. GPT có nhiều trong tế bào gan. Sự tăng hoạt
độ GOT, GPT trong máu phản ánh tình trạng hủy hoại tế bào gan do đó có giá trị chẩn
đoán và tiên lượng bệnh lý gan, mật.
Mối liên quan giữa trao đổi amin và khử amin (khử amin gián tiếp) 9
Downloaded by Di?p ??ng Ng?c (tanphatthpt@gmail.com) lOMoARcPSD|35973522
Phần lớn acid amin đều loại nhóm amin bằng cách trao đổi amin bởi lẽ các
transaminase có hoạt tính cao trong khi L- acid amin oxidase có hoạt tính thấp. Nhờ
trao đổi amin, nhóm amin của các acid amin được chuyển cho glutamat.
Mặt khác, glutamat là acid amin duy nhất được khử amin-oxi hóa mạnh dưới tác
dụng của glutamat-dehydrogenase có hoạt tính cao.
Do đó, phần lớn acid amin chuyển nhóm amin cho -cetoglutarat để thành
glutamat sau đó glutamat khử amin-oxi hóa. R - CH - COOH cetoglutarat NAD(P)H2 + NH3 NH2 (amino acid) R - CO - COOH Glutamat NAD(P) + H2O ceto acid) Transaminase Glutamat dehydrogenase
Nhờ sự kết hợp giữa hai quá trình khử amin và trao đổi amin, nhóm amin của hầu
hết acid amin được tách ra dưới dạng NH3. Đó là sự khử amin gián tiếp diễn ra đối với phần lớn acid amin. 3.1.3. Khử carboxyl.
Diễn ra tương đối dễ dàng và phổ biến. Phản ứng được xúc tác bởi các
decarboxylase đặc hiệu cho mỗi acid amin, chứa CoE là pyridoxalphosphat (B6) decarboxylase R - CH - NH R - CH 2 2 - NH2 COOH CO (Amin) 2
Nhiều amin tạo thành có tác dụng dược lý và sinh lý đặc biệt nên được gọi là các
amin sinh học. Chúng tham gia điều hòa chuyển hóa và chức năng của các cơ quan tổ chức.
Ví dụ: Sự khử carboxyl của histidin, dưới tác dụng của histidin decarboxylase, sẽ tạo thành histamin. CH CH His-decarboxylase 2 - CH2 - NH2 2 - CH - COOH HN N (Histamin) HN N NH2 (His)
Histamin có tác dụng giãn mạch, co cơ trơn và tăng tính thám thành mạch.
Sự khử carboxyl của glutamat ở tổ chức thần kinh sẽ tạo thành amino butyric acid (GABA) Glutamat decarboxylase HOOC - (CH HOOC - (CH 2)2 - CH - COOH 2)2 - CH2 - NH2 (Glu) C O 2 (GABA) 1
Downloaded by Di?p ??ng Ng?c (tanphatthpt@gmail.com) lOMoARcPSD|35973522
GABA là một loại acid amin duy trì sự hoạt động bình thường của não bộ đặc
biệt là các neuron thần kinh. GABA đóng vai trò chính trong việc giảm bớt sự hoạt
động của các neuron thần kinh và ức chế sự lan truyền của các tế bào dẫn truyền. Cùng
với niacinamide và inositol, GABA ngăn căn cản các truyền dẫn căng thẳng và bất an
đến vùng thần kinh trung ương bằng việc chiếm giữ các vùng tiếp nhận tin các tế bào
này, khống chế các vùng tiếp nhận tin. Vì thế, GABA giúp cho cơ thể được thư giãn, an thần.
Sự khử CO2 của tryptophan (Try), 5- hydroxytryptophan (5- oxy Tryp), 3,4 -
dihydroxyphenylalanin (DOPA) sẽ tạo thành tryptamin, serotonin, dihydroxyphenyl
ethylamin (dopamin) tương ứng.
Serotonin và dopamin có tác dụng trái ngược nhau đối với hệ thần kinh trung
ương. Serotonin làm giảm hoạt động, ngược lại dopamine kích thích làm tăng hoạt
động của não. Serotonin có liên quan tới quá trình ngủ và trí nhớ, cảm xúc đồng thời
có tác dụng co thắt các động mạch nhỏ và ức chế thần kinh trung ương tương tự như các thuốc gây mê.
3.1.4. Số phận của các sản phẩm thoái biến acid amin Amoniac (NH3):
Amoniac được tạo thành từ sự khử amin của acid amin và từ sự thoái biến của
purin và pyrimidin. Amoniac là chất độc đối với cơ thể. NH3 tiếp tục được chuyển hóa
theo một số con đường giúp cơ thể giải độc amoniac.
Tạo thành glutamin – dạng vận chuyển của NH3:
NH3 tạo thành ở tổ chức kết hợp với glutamat dưới tác dụng của glutamin
synthetase tạo thành glutamin. Năng lượng tổng hợp do ATP cung cấp. O O C - OH C - NH ATP ADP + Pi 2 (CH (CH 2)2 + NH 2)2 3 + H2O Glutamin- CH - NH CH - NH 2 2 Syntetase COOH COOH (Glutamat) (Glutamin)
Nhờ sự tạo thành glutamin nên nồng độ NH3 trong máu rất thấp (0,1 - 0,2 mg/l)
còn nồng độ glutamin trong máu cao hơn (so với các acid amin khác)
Glutamin, dạng vận chuyển của NH3, không độc sẽ theo máu tới gan và thận. Ở
đây, glutamin bị thủy phân bởi glutaminase, giải phóng NH3 và glutamat. O O C - NH2 H C - OH 2O NH3 (CH2)2 (CH2)2 CH - NH Glutaminase 2 CH - NH2 COOH COOH (Glutamin) (Glutamat)
Ở gan, NH3 được sử dụng để tổng hợp urê. Ở thận, NH3 được sử dụng để tổng hợp amoni (NH +
4 ). Ở não, sự tạo thành glutamin là con đường chính để giải độc NH3.
Nồng độ NH3 trong máu cao, nhưng lượng glutamat do máu cung cấp cho não không
đủ nên não phải tổng hợp glutamat từ -cetoglutarat để đáp ứng cho tổng hợp glutamin. 1
Downloaded by Di?p ??ng Ng?c (tanphatthpt@gmail.com) lOMoARcPSD|35973522
Tổng hợp urê (vòng urê)
Vòng urê diễn ra chủ yếu ở gan. Ngoài gan, thận, phổi não cũng tổng hợp một
lượng nhỏ urê. Vòng urê còn được gọi là vòng Krebs - Henseleit hoặc vòng ornithin.
Các phản ứng của vòng urê:
Phản ứng 1: Tạo thành carbamylphosphat
Một phân tử NH3 kết hợp với CO2, cần 2 ATP, dưới tác dụng của
carbamylphosphat syntetase, để tạo thành carbamylphosphat.
Phản ứng diễn ra như sau:
Đầu tiên một phân tử ATP hoạt hóa CO2 để thành carboxyphosphat gắn với
enzym. Sau đó phân tử ATP thứ hai phản ứng với chất trung gian gắn với enzym trong
phản ứng kết hợp với NH3 để tạo thành carbamylphosphat.
Ở gan có hai loại carbamylphosphat syntetase (CPS) khác nhau.
Carbamylphosphat syntetase tham gia vào vòng urê là carbamylphosphat syntetase I,
có ở matrix ty thể, chất hoạt hóa dị lập thể của nó là N-acetylglutamat.
Carbamylphosphat syntetase II, có ở bào tương, tham gia tổng hợp pyrimidin không cần N-acetylglutamat.
Phản ứng 2: Tạo thành citrulin
Nhóm carbamyl của carbamylphosphat được chuyển tới nhóm -amino của
ornitin để tạo thành citrulin, dưới tác dụng của enzym ornitin transcarbamylase. O NH NH H 2 2 - C H2 2N - N -C - NH - C H2 C = O CH CH 2 2 O + CH CH + Pi 2 2 - O - P = O CH - NH CH - NH 3 3 O- COO- COO-
(Carbamylphosphat) (Ornitin) (Citrulin)
Enzym ornitin transcarbamylase (OTC) cũng có ở ty thể. Citrulin khuếch tán từ ty thể ra bào tương.
Phản ứng 3: Tạo thành arginosuccinat
Ở bào tương, citrulin kết hợp với aspartat để tạo thành arginosuccinat, dưới sự
xúc tác của enzym arginosuccinat syntetase. Cơ chế phản ứng như sau: 1
Downloaded by Di?p ??ng Ng?c (tanphatthpt@gmail.com) lOMoARcPSD|35973522 NH NH O NH + COO- 2 2 C C = O O - P - O Adenossin C NH - CH NH NH O NH ATP PPi COO- AMP CH2 (CH (CH 2)3 2)3 +H (CH COO- 3N - CH 2)3 + CH - NH + CH + 3 CH - NH 2NH3 CH2 3 COO- COO- COO- COO-
(Citrilin) (ChÊt trung gian) (Aspartat) (Arginosuccinat)
Phản ứng 4: Tạo thành arginin.
Arginosuccinat bị phân cắt dưới tác dụng của enzym arginosuccinat lyase, thành arginin và fumarat. NH + COO- NH + 2 2 COO- C NH - CH C NH2 CH NH COO- NH + CH (CH (CH 2)3 2)3 COO- CH - NH + CH - NH + 3 3 COO- COO-
(arginosuccinat) (arginin) (Fumarat)
Phản ứng 5: Thủy phân arginin tạo thành urê. Arginin bị thủy phân bởi arginase, tạo thành urê và ornitin. NH + 2 NH H2O NH 2 C NH 2 2 (CH + NH C =O 2)3 CH - NH + (CH2)3 NH 3 2 + COO- CH - NH3 COO- (Arginin) (Ure) (Ornitin )
Arginase, enzym tetramer còn có ở não thận và các cơ quan khác.
Ornitin sau đó được vận chuyển vào ty thể. Urê khuyếch tán vào máu, đào thải
qua thận ra nước tiểu. Một phần khuyếch tán vào ruột non và bị phân hủy bởi urease
của vi khuẩn ruột để tạo NH3 và quay trở lại gan. Urease có ở thực vật và vi sinh vật
thủy phân urê thành CO2 và hai phân tử NH3.
Vòng urê có liên quan với các quá trình chuyển hóa khác, đặc biệt là vòng Krebs.
Mối liên quan này thông qua CO2, ATP (do vòng Krebs cung cấp) và qua các chất trung
gian fumarat, aspartat như sau: 1
Downloaded by Di?p ??ng Ng?c (tanphatthpt@gmail.com) lOMoARcPSD|35973522 Ty thÓ Bµo t ¬ng AcetylCoA Oxaloacetat Malat Malat Citrat Succinat Glutamat Oxaloacetat cetoglutarat CO2 CO2 cetoglutarat Aspartat Glutamat NH3 + CO2 + ATP Citrulin Citrulin Arginosuccinat Carbamyl Fumarat Phosphat Semialdehyt cña Ornitin Ornitin Arginin Glutamic
Hình 2. Mối liên quan giữa vòng urê và vòng Krebs. Tạo muối ở thận. NH +
3 được dùng để tổng hợp ion amoni (NH4 ) NH + 3 + H+ ==> NH4 NH +
4 sẽ kết hợp với các gốc acid để đào thải ra nước tiểu dưới dạng muối amoni.
Nhờ quá trình này mà thận tham gia điều hòa cân bằng acid-base.
Sử dụng trong các phản ứng amin hóa:
NH3 được dùng cho nhiều phản ứng amin hóa. Ví dụ: Amin hóa cetoacid thành acid amin:
R - CO - COOH + NH3 R - CH - COOH NH2
Nhờ phản ứng này mà cơ thể có thể tổng hợp được một số acid amin.
Tổng hợp carbamylphosphat để tổng hợp urê, tổng hợp base pyrimidin.
Các -cetoacid
Các -cetoacid được khử CO2 thành acid béo rồi chuyển hóa theo acid béo, hoặc
được amin hóa, trao đổi amin thành acid amin. Các amin
Các amin sinh học, sau khi phát huy tác dụng được bất hoạt thường là khử amin
oxy hóa tạo thành aldehyt tương ứng và NH3, dưới tác dụng của monoamino oxidase
(MAO) hoặc diamino oxidase (DAO). Phản ứng tổng quát như sau: 1
Downloaded by Di?p ??ng Ng?c (tanphatthpt@gmail.com) lOMoARcPSD|35973522 MAO/DAO R - CH2 - NH2 R - CHO + NH3 FAD FADH2 H2O2 O2
Aldehyt biến đổi thành acid béo: Dehydrogenase
R - CHO R - COOH
MAO có vai trò quan trọng trong điều hòa sinh tổng hợp và phận hủy các amin
sinh học. Các chất ức chế MAO (như ipraniazide, garmin, pargilin) được sử dụng
trong điều trị bệnh tâm thần.
3.2. Thoái biến riêng của các acid amin.
Bộ khung cacbon của các acid amin có thể được sử dụng để cung cấp năng
lượng. Đầu tiên các acid amin biến đổi thành các hợp chất trung gian. Sau đó từ các
hợp chất trung gian biến đổi thành glucid hoặc lipid hoặc cả hai.
Phần lớn các acid amin là các acid amin sinh đường, chỉ có leucin là hoàn toàn
sinh ceton. Có 5 acid amin vừa sinh đường, vừa sinh ceton: isoleucin, lysin,
phenylalanin, tyrosin và tryptophan.
Số phận bộ khung cacbon của acid amin được tổng quát như sau (hình 5):
Các acid amin sinh ceton biến đổi thành acetylCoA hoặc acetoacetylCoA.
Các acid amin sinh đường đều qua oxaloacetat để thành PEP và sau đó thành glucose. 1
Downloaded by Di?p ??ng Ng?c (tanphatthpt@gmail.com) lOMoARcPSD|35973522 Glucose Ser Leu PEP Gly Ile HMG-CoA CO2
Pyruvat AcetylCoA AcetoacetylCoA ThÓ ceton Cys Ala Trp Lys Tyr Trp oxaloacetat Citrat Asp Vßng KREBS -cetoglutarat Asn Gln Fumarat His Glu Tyr SuccinylCoA Pro Orn Phe Arg Methyl malonylCoA Val Ile Met Thr
Hình 3: Số phận bộ khung cacbon của acid amin
Tên các hợp chất trung gian được đóng khung
Tên các acid amin sinh ceton được gạch chân
2.2.1. Thoái biến của acid amin sinh ceton: leucin.
Leucin chuyển amin, biến đổi thành thioesterCoA, khử CO2, oxi hóa, carboxyl
hóa và cuối cùng hydrat hóa thành -hydroxy--methyl-glutaryl-CoA (HMG-CoA). NAD NADH2 CG Glu 1 2
Leu -ceto-iso caproat isovalerylCoA FHE Transaminase CoASH CO2 FAD dehydrogenase 3 FADH2 H2O Pi + ADP ATP 5 4 HMG-CoA -methylglutaconylCoA -methyl crothylCoA hydratase carboxylase CO2
Hình 4: Sự biến đổi của leucin tới HMGCoA 1
Downloaded by Di?p ??ng Ng?c (tanphatthpt@gmail.com) lOMoARcPSD|35973522
Phức hợp enzym -ceto isocaproat dehydrogenase (FHE) xúc tác phản ứng (2)
theo cơ chế tương tự như pyruvat và -cetoglutarat-dehydrogenase, trong đó có sự
tham gia của TPP, lipoat, CoASH, FAD và NAD. Ở bệnh “nước tiểu có mùi sirup",
phức hợp này bị thiếu hụt gây tích lũy cetoacid (-ceto isocaproic).
Từ HMG-CoA có thể tổng hợp cholesterol, do đó leucin được dùng để tổng hợp
steroid. Mặt khác, từ HMG-CoA có thể tạo thành acetoacetat và acetylCoA nên leucin là acid amin sinh ceton.
Cholesterol ← HMG-CoA → Acetoacetat + AcetylCoA
Một acid amin nào đó tạo thành acetylCoA cũng có thể coi là sinh ceton vì từ
acetylCoA có thể tạo thành acetoacetat như sau: CoASH 2 AcetylCoA AcetoacetylCoA Thiolase AcetylCoA HMG-CoA syntetase CoASH AcetylCoA Acetoacetat HMG-CoA HMG-CoA lyase
2.2.2. Thoái biến của acid amin sinh đường và sinh ceton
Isoleucin (Ile): Isoleucin thoái biến theo một loạt phản ứng tương tự như leucin: CG Glu NAD NADH2 1 2
Ileu -ceto-etylbutyrat methylbutyrylCoA Transaminase FHD CoASH CO2 FAD 3 FADH2 H2O 4
-methyl -hydroxybutyrylCoA TiglylCoA hydratase NAD 5 NADH2 O=C - S CoA CH3 - CH C=O CH3 CoASH Thiolase
CH3 - CH2 - CO - SCoA CH3 - CO - SCoA
PropionylCoA sinh ® êng AcetylCoA
Hình 5: Sự thoái biến của isoleucin
(FHD-phức hợp dehydrogenase) 1
Downloaded by Di?p ??ng Ng?c (tanphatthpt@gmail.com) lOMoARcPSD|35973522
Các phản ứng đầu tiên (từ 1-3) dẫn đến acid béo không bão hòa giống như leucin.
Tuy nhiên acetylCoA tạo thành dưới tác dụng của thiolasse chứ không phải của enzym
phân cắt. PropioxylCoA sau đó có thể carboxyl hóa để thành methylmalonylCoA; chất
này đồng phân hóa thành succinylCoA, vào vòng Krebs và cuối cùng tạo thành
pyruvat, glucose hoặc glycogen.
Phenylalanin (Phe) và tyrosin (Tyr).
Phenylalanin gắn oxy biến đổi thành tyrosin: Phøc hî p Phe-hydroxylase Phenylalanin Tyrosin O2 H2O H4-BP H2-BP NADPH2 NADP+
Phức hợp enzym phenylalanin hydroxylase sử dụng CoE biopterin (BP) cung cấp hydro.
+ Tyrosin chuyển amin, oxi hóa, đồng phân hóa, thủy phân để tạo thành
acetoacetat (sinh ceton) và fumarat (sinh ®ường): O CG Glu 2 CO2
Tyr p-hydroxyphenylpyruvat Homogentisat Tyr transaminase oxidase O2 Homogentisat oxidase
(thiÕu hôt trong alcapto niÖu) issomerase Fumaroyl acetoacetat Malloylacetoacetat H2O Hydrolase Acetoacetat Fumarat (Sinh ceton) (Sinh ® êng)
Hình 6: Chuyển hóa của tyrosin
Tyrosin chuyển amin cho -cetoglutarat dưới tác dụng của tyrosin transaminase.
Enzym này được cảm ứng bởi glucocorticoid. p-hydroxyphenylpyruvat dưới tác dụng
của oxidase được hydroxyl hóa, khử carboxyl và sắp xếp lại chuỗi bên tạo thành
homogentisat (một hydroquinon).
Homogentisat bị oxy hóa mở vòng phenyl cho maleoylaceto-acetat và cuối cùng cho acetoacetat và fumarat.
Khi thiếu hụt di truyền homogentisat oxidase trong bệnh alcapto-niệu,
homogentisat bài tiết ra nước tiểu, bị oxy hóa thành sản phẩm có màu đen. Bệnh
thường có viêm khớp và tăng tích lũy sắc tố màu đen ở tổ chức liên kết. 1
Downloaded by Di?p ??ng Ng?c (tanphatthpt@gmail.com) lOMoARcPSD|35973522 Lysin (Lys).
Lysin là một trong số ít acid amin không khử amin. Lysin có hai con đường
chuyển hóa ở động vật. Cả hai con đường đều dẫn đến tạo thành -aminoadipat. L-Saccharopin Lysin Khö amin NAD oxi hãa NADH2 Glu
-aminoadipaldehyd -aminoadipat CG Glu CO2 CO2 AcetoacetylCoA CrotonylCoA -cetoadipat CoASH
Hình 7: Chuyển hóa của lysin
-amino adipat khử carboxyl oxi hóa (do phức hợp enzym, tương tự như pyruvat,
-ceto glutarat), thành crotonylCoA, chất trung gian trong -oxi hóa acid béo. Từ
crotonylCoA có thể tạo thành acetoacetylCoA để rồi thành acetoacetat hoặc acetylCoA. Tryptophan:
Chuyển hóa phức tạp cho cả alanin (sinh đường) và acetylCoA (sinh ceton). H2O HCOOH O2
L-Try N-Formyl-kynurenin L-Kynurenin Try-pyrrolase O L-Alanin O 2 2 (3%) CO2 -hydroxy anthranilat D-Ribose5P Kynureninase (B6) (97%) CO N 2 ADH2 NAD
-aminomuconat -cetoadipat H2O NH3 Aceto acetylCoA
Hình 8: Chuyển hóa của tryptophan
Enzym tryptophan pyrrolase mở vòng pyrrol. Enzym này cũng được cảm ứng bởi
glucocorticoid. Chuỗi bên của Try bị phân cắt cho alanin và -hydroxy anthranilat.
Chất này khử carboxyl và khử thành -ceto adipat. Từ đây sự biến đổi tương tự lysin
và cho acetoacetylCoA. Tryptophan còn biến đổi thành NAD, do đó pellagra (thiếu
vitamin PP (niacin)) có thể điều trị bằng tryptophan.
Kynureninase (cần CoE B6) xúc tác sự biến đổi kynurenin và hydroxykynurenin
thành hydroxy anthranilat. Thiếu B6 sẽ làm giảm chuyển hóa các dẫn xuất kynurenin.
Chúng đi dến các tổ chức ngoài gan và ở đó biến đổi thành acid xanturenic. 1
Downloaded by Di?p ??ng Ng?c (tanphatthpt@gmail.com) lOMoARcPSD|35973522 Kynurenin Kynurenic ThiÕu B6 Xanturenic ThiÕu B6 -hydroxykynurenin
Các chất chuyển hóa của tryptophan có nhiều trong nước tiểu gặp trong một số
bệnh: Lao, tiểu đường, bệnh Hogdkin, bệnh bạch cầu, ung thư bang quang, đa u tủy…
Các chất này là các dấu ấn sinh học của bệnh.
2.2.3. Thoái biến của các acid amin sinh đường.
Alanin, aspartat (hoặc asparagin) và glutamat (hoặc glutamin):
+ Ala, Asp, Glu được chuyển hóa bởi các phản ứng chuyển amin, tạo thành các
chất trung gian của vòng Krebs: Ala G P T Pyruvat CG Glu Asp G O T Oxaloacetat CG Glu Glu G O T -cetoglutarat Oxaloacetat Asp
+ Glutamin và asparagin tách nhóm NH2 bởi phản ứng thủy phân dưới tác dụng
của glutaminase và asparaginase: Gln/Asn Glu/Asp H2O NH3 NH +
3 tạo thành được dùng để tổng hợp urê (ở gan) và NH4 (ở thận). Ngoài ra
NH3 còn được dùng cho nhiều chất nhận ở các phản ứng tổng hợp ví dụ như tổng hợp ozamin, purin và pyrimidin. Glycin, serin, cystein:
Những acid amin đều tạo thành pyruvat: 5,10 metylen THF THF NH3 Gly Ser Pyruvat Ser-transhydroxymetylase Ser-dehydratase H2O SO32- H2O desulfinase O2 H+ CG Glu
Cys Cystein sulfinic -sulfinylpyruvat
Enzym serin dehydratase biến đổi trực tiếp serin thành pyruvat. Glycin biến đổi
thành serin khi nhận nhóm hydroxymetyl từ 5,10-metylen tetrahydrofolat (THF). 2
Downloaded by Di?p ??ng Ng?c (tanphatthpt@gmail.com) lOMoARcPSD|35973522
Nguyên tử S của Cys đầu tiên bị oxy hóa, sản phẩm được chuyển amin và gốc sulfide
bị thủy phân tạo thành pyruvat. Threonin:
Biến đổi thành succinylCoA: NAD NADH Thr-dehydratase 2 DH Thr C etobutyrat PropionylCoA NH3 CoASH CO2 SuccinylCoA
Threonin khử amin thủy phân dưới tác dụng của enzym threonin dehydratase (tác
dungj tương tự như serin dehydratase) tạo thành -ceto butyrat chất này khử carboxyl
oxi hóa thành propionylCoA dưới tác dụng của phức hợp dehydrogenase (tương tự như pyruvat).
PropionylCoA có thể carboxyl hóa thành methylmalonylCoA, rồi chất này đồng
phân hóa thành succinylCoA sau đó qua vòng Krebs để tạo pyruvat. Methionin:
Cũng tạo thành cetobutyrat do đó được chuyển hóa như threonin: H2O PPi
Met + ATP S-Adenosyl methionin (SAM) Met-Adenosin transferase CH3 chÊt nhËn methyl S-Adenosyl homocystein
S-Adenosyl methionin (SAM) là chất cho nhóm methyl (-CH3) chính trong cơ
thể. Nó chuyển nhóm metyl methyl tới nhóm -NH2 hoặc -OH cho nhiều chất nhận.
Dưới đây là một số chất nhận và sản phẩm: Chất cho Chất nhận Sản phẩm SAM Guanidoacetat Creatin SAM Phosphatidyl ethalolamin Phosphatidyl cholin SAM rARN và tARN ARN methyl hóa SAM ADN ADN methyl hóa SAM Nor-adrenalin Adrenalin
Homocystein tạo thành từ S-adenosylhomocystein biến đổi thành homoserin.
Homoserin khử CO2, hydrat hóa, giống threonin, tạo thành - cetobutyrat và sau đó thành propionat: 2
Downloaded by Di?p ??ng Ng?c (tanphatthpt@gmail.com) lOMoARcPSD|35973522 S-Adenosyl homocystein H2O Adenosin Homocystein Serin H2O Cystathionin H2O Adenosin Homoserin NH3 cetobutyrat CoASH NAD CO NADH 2 2 PropionylCoA
Arginin: Biến đổi thành glutamic: H2O Ure CG Glu NAD NADH2
Arg Ornithin Glutamat semialdehyd Glutamat Arginase H2O Prolin:
Qua 2 lần oxy hóa tạo thành glutamic: FAD FADH COO- 2 NAD NADH2 CH2 DH DH CH H 2 N COOH N COOH 2O H H 2N - CH COOH Prolin Glutamat Valin:
Biến đổi thành succinylCoA. Giống như các acid amin phân nhánh khác (Leu,
Ile), đầu tiên là chuyển nhóm amin, sau đó khử CO2, oxi hóa, tạo thành
methylmaloylCoA, rồi chất này đồng phân hóa thành succinylCoA: NAD NADH chuyÓn amin 2
Val -ceto isovalerat isobutyrylCoA DH CoASH CO2 FAD FADH2 H2O
MetacrylylCoA -hydroxy isobutyrylCoA DH hydratase
H2O CoASH NAD NADH2 Methyl malonaldehyd CoASH H2O MethylmalonylCoA SuccinylCoA 2
Downloaded by Di?p ??ng Ng?c (tanphatthpt@gmail.com) lOMoARcPSD|35973522
Các acid amin phân nhánh đều có 3 giai đoạn thoái biến đầu tiên giống nhau, tương ứng như sau: Leu, Ile, Val 1 ChuyÓn amin -ceto acid t ¬ng øng 2 K
= hö carboxyl-oxi hãa (do phøc hî p DH) AcylCoA-thioester t ¬ng øng 3 = dehydrogenase
AcylCoA-thioester kh«ng b· o hßa ë t ¬ng øng Leu Ile 4 5 6 Val
HMG-CoA PropionylCoA + AcetylCoA SuccinylCoA
Ở người, chỉ có một enzym carboxyl-oxi hóa xúc tác phản ứng (2) cho cả 3 -
cetoacid. Ở bệnh “nước tiểu có mùi siro” do thiếu enzyme khử carboxyl-oxi hóa di
truyền, phản ứng (2) bị ức chế, các -cetoacid tăng trong máu và nước tiểu làm nước
tiểu có mùi đặc trưng. Còn bệnh "nhiễm acid isovaleric máu” là do thiếu hụt enzym iso
valerylCoA dehydrogenase. Sau khi tiêu hóa thức ăn giàu protid nồng độ acid iso
valeric máu tăng trong khi các -cetoacid tương ứng của Ile và Leu không tăng. Histidin:
Biến đổi thành glutamic: COO- COO- COO- H CH 2N - CH CH 2 CH Histidinase Urocanase CH 2 CH 2 HN HN HN NH3 H2O O N N N Histidin Urocanat COO- COO- HN=CH-NH -CH H CH 2N - H THF 5-formimino-THF 2O CH2 CH2 CH2 CH2 CH2 CH2 COO- COO- Formiminoglutamat Glutamat
Hình 9: Sự biến đổi histidin thành glutamat
Đầu tiên, His khử amin tạo thành chất trung gian không bão hòa urocanat. Chất
này hợp nước mở vòng imidazol, tạo thành formiminoglutamat. Formiminoglutamat
chuyển nhóm formimino cho tetrahydrofolat (THF) và tạo thành glutamat. 2
Downloaded by Di?p ??ng Ng?c (tanphatthpt@gmail.com) lOMoARcPSD|35973522
Bệnh "histidin máu" là do thiếu hụt histidinase. Bệnh nhân bị khó nói và líu lưỡi.
Điều trị bằng cách hạn chế thức ăn chứa Histidin (tuy nhiên sẽ làm trẻ em chậm lớn).
2.4. Sinh tổng hợp acid amin.
Cơ thể có thể tổng hợp được các acid amin không cần thiết bao gồm Gly, Ser,
Ala, Asp, Asn, Glu, Gln, Pro, Tyr, Cys, Hyp.
Tổng hợp acid amin không cần thiết từ các chất trung gian của vòng Krebs:
Một số acid amin như Alanin, aspartat, asparagin, glutamat, glutamin có thể
được tổng hợp từ các chất trung gian hóa học của vòng Krebs (acetylCoA, oxaloacetat, cetoglutarat): Glu CG Pyruvat L- Alanin GPT Acetyl CoA Glu C G Citrat L- Aspartat Oxxaloacetat GOT cetoglutarat Succinyl CoA Aspartat GOT Oxaloacetat (OXAC) Glutamat
Hình 10: Sinh tổng hợp acid amin từ các chất trung gian của vòng Krebs
Các amid của Aspartat và glutamat (asparagin và glutamin) đều được tổng hợp trong cơ thể người. ATP ADP + Pi L- Glutamat L Glutamin Glutamin syntetase ATP AMP + PPi + L-Aspartat + NH4 L-Asparagin Tổng hợp serin:
Serin được tổng hợp từ 3-phosphoglycerat, chất trung gian của đường phân và vòng pentosephosphat. 2
Downloaded by Di?p ??ng Ng?c (tanphatthpt@gmail.com) lOMoARcPSD|35973522 Pi H + 2O NAD NADH + H+ D-Glycerat 2-Phospho 3-Phospho 3-Phospho glycerat glycerat h y d r oxypyruvat + NAD L-Glutamat NADH + H+ -cetoglutarat Ala Pyruvat Pi H O 2
Hydroxypyruvat L-Serin o-Phospho-L-Serin
Từ 3-phosphoglycerat đến serin có hai con đường khác nhau: Con đường bên
phải chứa các chất trung gian được phosphoryl hóa, con đường bên trái thì không chứa
laoij hợp chất này. Serin là tiền chất cho ethanolamin, cholin, betain, glycin, cystein,
sarcosin, pyruvat và sphingosin. Tổng hợp cystein:
Cystein được tổng hợp nhờ phản ứng ngưng tụ của L-homocystein và L-serin
dưới tác dụng của enzym cystathionin syntetase để tạo thành L-cystathionin: H O 2
L-homocystein + L-serin L-cystathionin Cystathionin syntetase
Sau đó cystathionin bị thủy phân dưới tác dụng của enzym cystathioninase để tạo
thành L-homoserin và L-cystein: H O 2
L-cystathionin L-homoserin + L-cystein Cystathionase
Một số bệnh di truyền ở người gây thiếu hụt enzym có liên quan đến cystein.
Bệnh homocystin niệu do thiếu enzym cystathionin syntetase nên homocystein không
được chuyển thành cystathionin và sẽ bị oxy hóa thành homocystin. Bệnh cystathionin
niệu do cystathionin không được phân cắt để tạo thành cystein nên có một lượng lớn
cystathionin trong nước tiểu. Ở bệnh này, enzym cystathioninase được tổng hợp nhưng
ái lực với coenzym của nó, pyridoxal phosphat bị giảm mạnh.
Cystein cần cho tổng hợp protein, glutathion và taurin.
Homocystein cần cho tổng hợp cystein được tạo thành từ L-methionin: H2O PPi
L-Methionin + ATP S-Adenosyl methionin Methionyl adenosyl transferase CH3 chÊt nhËn methyl S-Adenosyl homocystein H2O L-homocystein + Adenosin
Tổng hợp acid amin không cần thiết từ các acid amin khác: Glycin:
Glycin được tổng hợp từ serin. Nhóm hydroxymethyl của serin được chuyển cho
THF (tetrahydroxyfolat) để tạo thành 5,10-methylen-THF, Gly và nước: 2
Downloaded by Di?p ??ng Ng?c (tanphatthpt@gmail.com) lOMoARcPSD|35973522
L-Serin + THF 5,10-methylen-THF + Gly + H2O
Glycin cũng có thể được tổng hợp từ glyoxalat. Các enzym bào tương khử
carboxyl của serin để tạo ethanolamin, chất này chuyển amin thành glycolaldehyd, sau
đó aldehyd này oxi hóa thành glyoxalat. Sau đó glyoxalat chuyên amin thành glycin: CO2 chuyÓn amin
L-Ser Ethanolamin Glycolaldehyd [2H] chuyÓn amin [2H] Glycin Glyoxalat Glycolat
Thiếu hụt enzym chuyển hóa glyoxalat sẽ gây bệnh di truyền tăng oxalat niệu
nguyên phát type I đặc trưng bởi bài tiết quá nhiều oxalat đước tạo thành từ sự oxy hóa glyoxalat ứ đọng. Tyrosin:
Tyrosin được tổng hợp từ phenylalanin nên nếu đủ Phe thì Tyr cũng được tổng hợp đủ. Phenylalanin hydroxylase L-Phe + O2 L-Tyrosin + H2O H4-Biopterin H2-Biopterin NADP+ NADPH + H+
Phenylalanin hydroxylase cần coenzym là tetrahydro biopterin có liên quan đến
bệnh di truyền phenylceto-niệu. Trong nước tiểu của bệnh nhân chứa các chất chuyển
hóa bất thường của Phe như phenyl-pyruvat, o-hydroxyphenylacetat, phenyllactat
phenylacetylglutamin và cả Phe. Bệnh nhân có dấu hiệu đần độn. Điều trị bằng hạn chế ăn phenylalanin. Prolin:
Prolin được tổng hợp từ arginin: 2
Downloaded by Di?p ??ng Ng?c (tanphatthpt@gmail.com) lOMoARcPSD|35973522 COO H3+N - CH H2O Ure (CH + 2)2 - CH2 - NH3 L-Arginin L-Ornitin Arginase -cetoglutarat glutamat CH2 - CH2 CH CH - COO- COO- N H2O O NH2 NADH + H+ L-Glutamat--semialdehyd NAD+ N COO- H L-Prolin Arginin và Histidin:
Hai acid amin này cần cho sự phát triển của trẻ em
+ Arginin được tạo thành từ ornitin. Glutamat là chất cho carbon chủ yếu.
Glutamat oxi hóa thành glutamat semialdehyd rồi chuyển amin thành ornitin. Trẻ em
không tổng hợp đủ ornitin theo con đường này.
+ Histidin là acid amin cần thiết ở người lớn. Nó được huy động từ carnosin và
anserin, hai dipeptid dự trữ ở cơ chứa histidin. 3. Peptid 3.1. Cấu tạo:
Hai hay nhiều acid amin kết hợp với nhau bằng liên kết peptid (- CO- NH)
tạo thành chuỗi polypeptid. Liên kết peptid tạo thành khi nhóm COOH của acid
amin này kết hợp với nhóm NH2 của acid amin khác.
Ví dụ dipeptid (Alanyl - glycin) có thể tạo thành theo phương trình sau: - H2O
CH3 - CH - COOH + H2N - CH - COOH CH - CH - CO - NH - CH2 - COOH NH2 NH2 Alanin Glycin Alanyl-glycin
Chuỗi peptid có > 50 gốc acid amin được gọi là polypeptid. Phân tử protid
có thể tạo thành từ một hoặc nhiều chuỗi polypeptid.
3.2. Tính chất của peptid.
- Ở các peptid tự nhiên có rất ít nhóm NH2 và nhóm COOH vì chúng kết
hợp với nhau để tạo thành liên kết peptid. Nếu nhóm NH2 ở đầu chuỗi peptid 2
Downloaded by Di?p ??ng Ng?c (tanphatthpt@gmail.com) lOMoARcPSD|35973522
được gọi là N – tận, và xác định bằng phản ứng Edman. Nếu nhóm COOH ở
cuối gọi là C - tận, và được xác định bằng phản ứng với hydrazin.
- Các liên kết peptid tác dụng với ion đồng II trong môi trường kiềm tạo
thành phức màu xanh tím (phản ứng Biure).
- Thực tế có thể tổng hợp được polypeptid, bằng phương pháp hóa học đơn
thuần với cấu tạo đã biết.
Một số peptid quan trọng như carnosin (vận chuyển phospho), glutathion
(vai trò quan trọng trong oxy hóa khử sinh học) và một số peptid là hormone
như oxytoxin, vasopressin, insulin.
4. Protid phức tạp (Proteid, protein liên hợp). 4.1. Cấu tạo
Là protid có hai thành phần: protein và nhóm ngoại. Protein liên kết với
nhóm ngoại bằng liên kết đồng hóa trị hoặc liên kết yếu khác. Tên của proteid
gọi theo tên của nhóm ngoại. Ví dụ:
- Lipoprotein: Nhóm ngoại là lipid
- Glycoprotein: Nhóm ngoại là glucid
- Cromoprotein: Nhóm ngoại là Hem....
Trong khuôn khổ của chương trình chỉ giới thiệu về chromoprotein (đại
diện là hemoglobin, cytochrom), nucleoprotein.
Chromoprotein: Là proteid mà nhóm ngoại là một chất màu, ví dụ như
hemoglobin hoặc enzym chứa flavin, các cytochrom. 4.1.1. Hemoglobin
Kí hiệu là Hb, có trọng lượng phân tử là 67 - 70.000 đơn vị cacbon.
Cấu tạo: từ 4 dưới đơn vị, mỗi dưới đơn vị gồm 1 Hem kết hợp với globin
(chuỗi polypeptid). Trong đó có 2 chuỗi (141 acid amin) và 2 chuỗi (146 acid amin).
Hem: gồm 4 nhân pyrol liên kết với nhau bằng cầu nối menten (-CH=).
Một Hem có 4 nhóm metyl (M: - CH3), 2 nhóm vinyl (V: - CH = CH2) và 2 gốc
propionyl (P:- CH2- CH2- COOH) gắn với đỉnh phía ngoài của nhân pyrol.
Sắt II gắn với globin qua gốc histidyl và với các đỉnh phía trong của nhân
pyrol bằng 2 liên kết đồng hóa trị (kí kiệu bằng nét liền ) và 2 liên kết phối
trí (kí hiệu bằng nét gạch gạch ----).
Hem không chỉ là nhóm ngoại của hemoglobin mà còn cả myoglobin,
catalase, peroxydase, cytochrom B, C và C1.
Công thức cấu tạo của hemoglobin và sự gắn oxy của nó có thể trình bày theo sơ đồ sau: 2
Downloaded by Di?p ??ng Ng?c (tanphatthpt@gmail.com) lOMoARcPSD|35973522 M V M V HC CH CH HC N M N M M +O M +2 2 +2 N Fe N N Fe N P V -O2 V N P N HC CH HC CH P M P M N imidazol N N O2 Globin Globin Tính chất của Hb:
+ Hb kết hợp với oxy tạo thành oxyhemoglobin (HbO2): Hb + O2 HbO2
Sự tạo thành và phân huỷ HbO2 xảy ra rất nhanh ở hồng cầu, phụ thuộc vào
áp suất riêng phần của oxy (pO2).
Ở phổi pO2 lớn nên HbO2 tạo thành dễ dàng, ở tổ chức pO2 giảm do đó
HbO2 phân ly giải phóng oxy cung cấp cho các tổ chức.
+ Kết hợp với CO2 tạo thành carbohemoglobin (HbCO2): Hb + CO2 HbCO2
+ Kết hợp với oxyt carbon (CO) với ái lực rất lớn, tạo thành carboxyhemoglobin: Hb + CO HbCO
HbCO rất độc, không có khả năng vận chuyển oxy. Do ái lực của CO với
Hb cao, gấp tới 210 lần so với oxy cho nên CO còn đẩy O2 ra khỏi HbO2: HbO2 + CO HbCO + O2
Khi bị ngộ độc CO, cần cho thở oxy có thêm CO2 để tăng áp suất riêng
phần của O2, tạo HbO2 nhiều hơn (mũi tên ngược lại). + oxi hóa:
Hb bị oxy hóa bởi 1 số chất như fericyanua, clorat, nitrit tạo thành methemoglobin (MetHb): Hb MetHb + e 2
Downloaded by Di?p ??ng Ng?c (tanphatthpt@gmail.com) lOMoARcPSD|35973522
Methemoglobin là chất không có khả năng vận chuyển oxy. Nếu nồng độ
MetHb máu cao, da bệnh nhân xanh tái, nặng có thể bị tử vong. Chiều ngược lại
của phản ứng có thể dùng vitamin C hoặc enzym.
+ Có hoạt tính enzym (Peroxidase).
Tính chất này được ứng dụng để xác định sự có mặt của máu trong pháp y
và trong chẩn đoán bệnh (Ví dụ nghiệm pháp Benzidin để phát hiện máu trong nước tiểu). + Tính chất đệm:
Hệ đệm hemoglobinat là một trong các hệ đệm quan trọng nhất của máu.
Hệ đệm Hb có thể biểu diễn như sau: + + H Hb H HbO2 TÝnh acid yÕu vµ KHb KHbO2 TÝnh base yÕu 4.1.2. Cytochrom:
Có nhiều loại cytochrom (cyt) như cyt b, cyt c, cyt a và cyt.450 trong
chuyển hóa thuốc và chất lạ.
Gồm một Hem gắn với chuỗi polypeptid, chúng khác nhau về cấu tạo phần
protein. Hem cũng có 4 nhân pyrol chứa sắt. Nhưng hai mạch vinyl đã bị khử và
liên kết với 2 gốc cystein của protein. Ngoài ra sắt còn liên kết với 2 gốc histidin như trong hemoglobin.
Vai trò của cytochrom nói chung là vận chuyển điện tử, tham gia xúc tác
các phản ứng oxi hóa khử trong cơ thể người và động vật.
4.2. Chuyển hóa protid (Chuyển hóa của hemoglobin)
Phần này chủ yếu trình bày chuyển hóa của chromoproteid, trong đó quan trọng
nhất là chuyển hóa của hemoglobin, chuyển hóa của nucleoproteid được nêu ở chương acid nucleic.
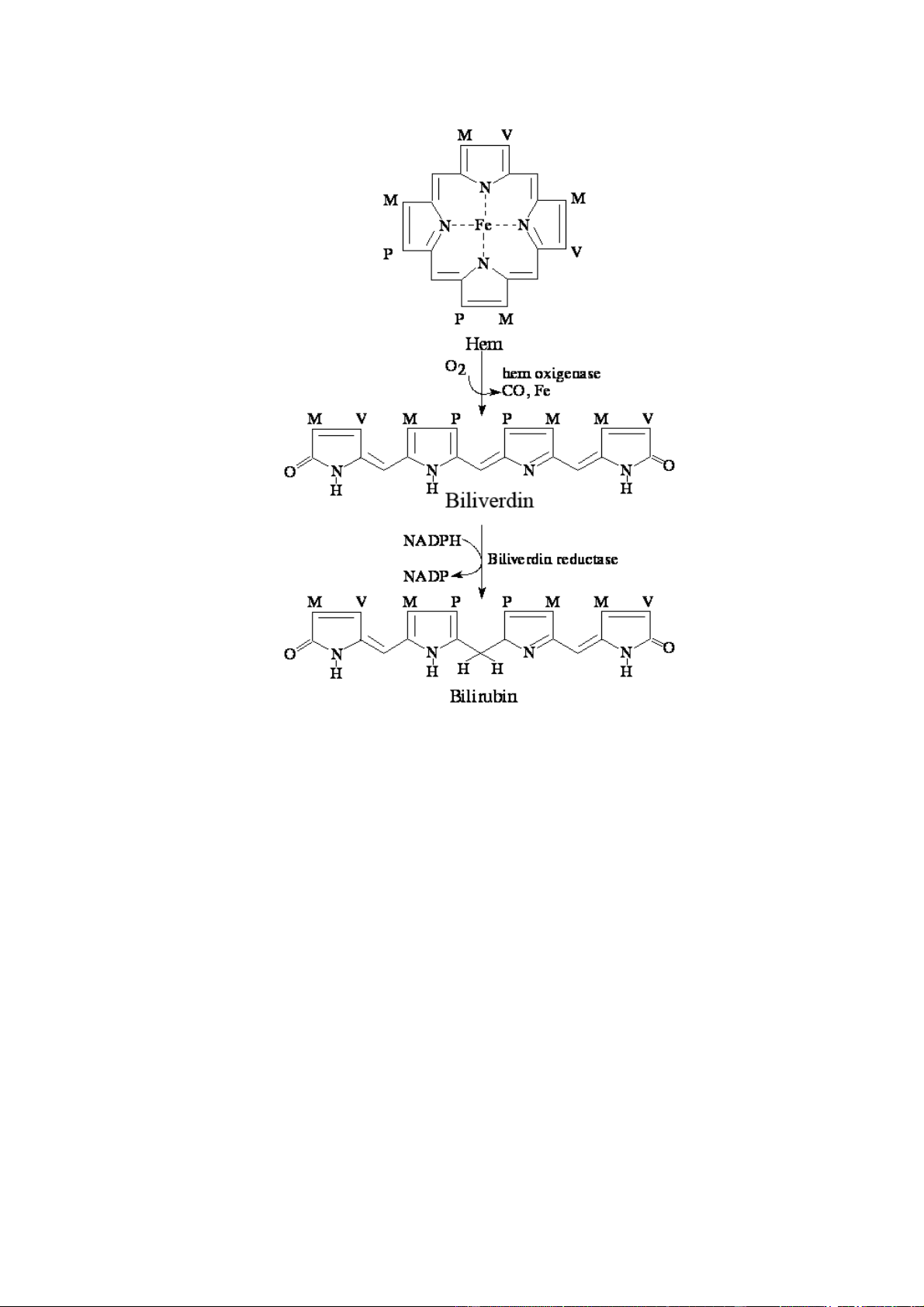
4.2.1.Thoái biến của hemoglobin.
Quá trình thoái biến của hemoglobin được tóm tắt như sau:
Biến đổi hemoglobin thành bilirubin ở hệ thống võng nội mô:
Ở người bình thường, đời sống trung bình của hồng cầu là 120 ngày. Sau đó
hồng cầu già bị phá hủy bởi các tế bào của hệ thống võng nội mô (tủy xương, gan
lách…). Ở giai đoạn này, hemoglobin biến đổi thành bilirubin.
Đầu tiên là sự mở vòng protoporphyrin IX của hem tại cầu methyl (nối giữa
pyrrol I và II). Sự mở vòng này là phản ứng oxy hóa được xúc tác bởi oxidase và
carbon của cầu methyl bị loại ra dưới dạng carbon monoxyt (CO). Verdoglobin (hoặc
choleglobin) tạo thành là một tetrapyrrol mạch thẳng, còn gắn với Fe2+ và globin.
+ Sau đó, Fe2+ và globin được tách ra, verdoglobin biến đổi thành biliverdin. Sắt
được cơ thể sử dụng lại, còn globin bị phân cắt thành các acid amin.
Sự phá hủy của verdoglobin đi kèm với sự khử của 1 trong các pyrrol, làm thay
đổi phổ hấp thụ của tetrapyrrol từ đỏ (verdoglobin) thành xanh (bilirubin).
+ Tiếp đó, biliverdin bị khử bởi reductase, ở cầu methyl , tạo thành bilirubin có
màu vàng đỏ. Bilirubin không tan trong nước nhưng tan trong các dung môi của lipid hoặc trong chính lipid. 3
Downloaded by Di?p ??ng Ng?c (tanphatthpt@gmail.com) lOMoARcPSD|35973522 oxi hãa më vßng (+ 2H) Khö Hemoglobin Verdoglobin CO Fe globin + 2H, Khö Biliverdin Bilirubin
Quá trình thoái biến của hemoglobin được tóm tắt theo sơ đồ sau:
Hệ thống võng nội Hemoglo mô bin Oxi C hóa O Verdoglo bin K Fe hử Biliver2+ Glob in U D P - G din U D P K Ru hử Bilirubin Bili Grubi an n Biliru ột bin TDMá LH LH u Stercobilinog en Nước Urobilinogen Stercobil tiểu in Urobilin Phâ n
Hình 11: Sự thoái biến của Hemoglobin
Cũng có tài liệu cho rằng, đầu tiên chuỗi globin tách ra, hem được giải phóng vào
bào tương và bị thoái biến thành bilirubin. 3
Downloaded by Di?p ??ng Ng?c (tanphatthpt@gmail.com) lOMoARcPSD|35973522
Hình 12: Sự tạo thành bilirubin từ hem. Vận chuyển bilirubin:
80% bilirubin được tạo thành do sự giáng hóa của Hb, 20% còn lại là sản phẩm
chuyển hóa của các chromoprotein khác như (myoglobin, cytochrom) và sự tăng đột
biến sản xuất hem. Bilirubin tạo thành từ hệ thống võng nội mô được chuyển về máu,
được gọi là bilirubin tự do. Bilirubin tự do không tan trong nước, cho phản ứng diazo
chậm, khi định lượng nó cần phải hòa tan trong một dung môi nào đó (cafein,
digitonin...) nên còn được gọi là bilirubin gián tiếp. Bilirubin được vận chuyển trong
máu dưới dạng kết hợp với protein huyết tương, chủ yếu là albumin (một phân tử
bilirubin kết hợp với một phân tử alobumin). Khi albumin đã bão hòa bilirubin,
bilirubin thừa có xu hướng gắn vào lipid của tổ chức, đặc biệt ở tổ chức thần kinh. Có
một số yếu tố làm giảm sự gắn của albumin với bilirubin, ví dụ như trạng thái nhiễm
acid (acidose), các acid béo tự do cạnh tranh với bilirubin.
Tạo thành bilirubin liên hợp ở gan: 3
Downloaded by Di?p ??ng Ng?c (tanphatthpt@gmail.com) lOMoARcPSD|35973522 2 UDP-Glucuronat + Bilirubin O O O O C = O C = O CH CH 2 2 CH2 CH2 M V M M M V O N N N N O H H H H H H Bilirubin diglucuronat
Hình 13: Sự tổng hợp bilirubin liên hợp
Bilirubin được vận chuyển tới gan. Ở trong tế bào gan, bilirubin tự do được liên
hợp với glucuronat để tạo thành bilirubin liên hợp. Phản ứng liên hợp xảy ra giữa hai
gốc propionat (P) của bilirubin và 2 phân tử glucuronat (dưới dạng hoạt hóa là uridin
diphosphat glucuronat) dưới sự xúc tác của glucuronyl transferase, tạo thành bilirubin
diglucuronat. Có một số ít bilirubin liên hợp dưới bilirubin monoglucuronat. Bilirubin
liên hợp tan trong nước, cho phản ứng diazo nhanh nên còn được gọi là bilirubin trực tiếp.
Bilirubin được tế bào gan bài tiết vào mật và túi mật. Ở túi mật, được cô đặc và
dự trữ. Bilirubin là sắc tố chính của mật người và chiếm khoảng 15 - 20% trọng lượng khô của mật.
Sự biến đổi bilirubin ở ruột.
Bilirubin liên hợp theo mật xuống ruột và bị biến đổi bởi enzym của vi khuẩn
ruột. Đầu tiên là sự khử liên hợp, giải phóng bilirubin. Sau đó bilirubin bị khử (gắn
thêm 12 nguyên tử hydrogen) tạo thành các hợp chất không màu là urobilinogen và
stereobilinogen. Phần lớn urobilinogen và stercobilinogen được đào thải theo phân, bị
oxy hóa bởi oxy của không khí, tạo thành urobilin và stercobilin, làm cho phân có màu
vàng (khi lượng nhỏ) hoặc màu nâu (khi lượng lớn). Người ta thường gộp chung cả hai
sắc tố này là "stercobilinogen" phân.
Một lượng nhỏ urobilinogen và stercobilinogen được tái hấp thu bởi ruột, một
phần từ tuần hoàn trong máu, được lọc bởi thận qua nước tiểu. Chúng oxi hóa trong
nước tiểu, tạo thành urobilin và stercobilin, làm cho nước tiểu có màu vàng. Người ta
gọi chung cả hai sắc tố này là "urobilin" nước tiểu. Bình thường, nước tiểu có khoảng
1 - 4 mg/24h urobilin và urobilinogen, còn phân có khoảng 40 - 280 mg/24h stercobilinogen.
Một phần urobilinogen và stereobilinogen sau khi tái hấp thu theo máu tĩnh mạch
cửa về gan. Ở gan chúng có thể tái oxy hóa thành bilirubin để rồi xuống ruột, tạo thành
“chu trình gan ruột” của bilirubin.
Khi thiếu hụt vi khuẩn ruột (do dùng kháng sinh hoặc trẻ sơ sinh…) bilirubin
không bị khử mà bị oxy hóa thành biliverdin làm cho phân có màu xanh. 3
Downloaded by Di?p ??ng Ng?c (tanphatthpt@gmail.com) lOMoARcPSD|35973522
4.2.2.Tổng hợp hemoglobin.
Hồng cầu lưới có các enzyme cần cho tổng hợp hemoglobin. Các phản ứng tổng
hợp hemoglobin diễn ra cả ở ty thể và bào tương. Quá trình tổng hợp hemoglobin được diễn ra như sau:
Bµo t ¬ng Ty thÓ Bµo t ¬ng SuccinylCoA + Glycin CoASH CO2 ALA-Syntetase -aminolevulinic acid (ALA) ALA HEM HEM 2 pt 2 H2O Globin Fe2+ Hem syntetase Porphobilinogen Protoporphyrin IX 4 pt 4 NH3 Hb 6 H2 Uroporphyrinogen III Protoporphyrinogen IX 4 CO2 2 CO2 P V Coproporphyrinogen III 4 H Coproporphyrinogen III
Hình 14: Tổng hợp hemoglobin Tổng hợp hem:
Quá trình tổng hợp hem diễn ra cả ở bào tương và ty thể, gồm các phản ứng sau:
Phản ứng 1: Phản ứng ngưng tụ giữa succinylCoA với glycin, tạo thành -
aminolevulinic acid (ALA), được xúc tác bởi ALA-syntetase diễn ra ở ty thể: COO- COO- CH2 NH3+ (CH2)2 ALA-syntetase CH + CH 2 2 C = O + H2O + CO2 + CoASH C - SCoA COO- CH2 O NH3+
SuccinylCoA Glycin -aminolevulinic (ALA)
ALA chuyển ra bào tương. Các phản ứng tiếp theo diễn ra ở bào tương. 3
Downloaded by Di?p ??ng Ng?c (tanphatthpt@gmail.com) lOMoARcPSD|35973522 M V N M M N Fe N P V N P M Hem 7 M V M V N N SuccinylCoA M H M M H M 6 + Glycin N N N H H N H H 1 P V P V N N ALA P M P M Protoporphyrin IX Protoporphyrinogen IX 2 t y t h Ó 5 bµ o t ¬n g A P M P COOH HOOC CH2 N N CH CH P A M M 2 H H 2 4 3 N H H N N H H N H H A P P P N CH N N 2 H NH2 P A P M
Porphobilinogen Uroporphyrinogen III Coproporphyrinogen III
Hình 15: Sinh tổng hợp hem
+ Phản ứng 2: Ngưng tụ 2 phân tử ALA, tạo thành Porphobilinogen (PBG), dưới
sự xúc của enzym porphobilinogen syntetase (hoặc ALA-dehydratase). P COOH A COOH COOH CH2 COOH CH2 CH2 CH2 2 H CH 2O 2 CH2 H2C O = C C = O CH2 CH2 N NH CH2 NH 2 2 NH H 2 3
Downloaded by Di?p ??ng Ng?c (tanphatthpt@gmail.com) lOMoARcPSD|35973522
Porphobilinogen là một dẫn xuất pyrrol gồm một nhân pyrrol, gốc acetyl (A), gốc
propionyl (P) và nhóm amin (- NH2). Có thể viết tóm tắt như sau: A P CH N 2 H NH2 (PBG) + Phản ứng 3:
Ngưng tụ 4 phân tử porphobilinogen (PBG) cùng với khử amin, tạo thành uroporphyrinogen III: A P N P A H [4 PBG] N H H N A H P N P A Uroporphyrinogen III
Phản ứng được xúc tác bởi sự kết hợp của 2enzym uroporphyrinogen I syntetase
và uroporphyrinogen III cosyntetase. Uroporphyrinogen III gồm 4 nhân pyrrol, 4
nhóm acetyl (A) ở các vị trí 1, 3, 5, 8 và 4 nhóm propionyl (P) ở các vị trí 2, 4, 6, 7. + Phản ứng 4:
Khử carboxyl, tạo thành coproporphyrinogen III, dưới tác dụng của
uroporphyrinogen decarboxylase. Enzym tác động trên chuỗi bên, khử carboxyl: 4
nhóm acetyl (A) thành methyl (M) và 2 nhóm propionyl ở vị trí 2, 4 thành vinyl (V).
Corprophyrinogen III đi vào ty thể. Các phản ứng tiếp theo diễn ra ở ty thể như sau: + Phản ứng 5:
Oxi hóa corproporphyrinogen III thành protoporphyrinogen IX, dưới tác dụng
của corproporphyrinogen oxidase ty thể. Cơ chế tác dụng chưa rõ. + Phản ứng 6:
Oxi hóa protoporphyrinogen IX thành protoporphyrin IX, dưới tác dụng của
ptoroporphyrinogen oxidase ty thể. + Phản ứng 7:
Gắn sắt, thành hem, dưới tác dụng của ferrochelatase (hoặc hem syntetase).
Điều hòa sinh tổng hợp hem:
Sự tổng hợp hem được điều hòa bởi enzym ALA syntetase. Hem (và cả hematin)
tác dụng như một chất trấn áp sự tổng hợp ALA syntetase và như một chất ức chế dị
lập thể enzym. Có khoảng 100 thuốcvà chất chuyển hóa khác nhau có thể cảm ứng
tổng hợp ALA syntetase; Ví dụ: 3,5 dicarbethoxy-1,4 dihydrocollidin làm tăng hoạt độ
enzym 40 lần sau điều trị. Câu hỏi ôn tập 3
Downloaded by Di?p ??ng Ng?c (tanphatthpt@gmail.com) lOMoARcPSD|35973522
1. Trình bày cấu tạo và chuyển hóa của các acid amin?
2. Nguồn gốc và số phận của ammoniac trong cơ thể? Nêu các phản ứng của chu trình ure?
3. Trình bày cấu tạo, tính chất và chuyển hóa của hemoglobin? 3
Downloaded by Di?p ??ng Ng?c (tanphatthpt@gmail.com)
Document Outline
- Chương 5:
- HÓA SINH PROTID
- 2.1. Cấu tạo và phân loại acid amin.
- 2.2. Tính chất chung của acid amin.
- Tính chất thuộc nhóm NH2:
- Bảng 1.1: Phân loại acid amin theo cấu tạo hóa học.
- Tính chất thuộc nhóm carbocyl (-COOH):
- Một số tính chất riêng của acid amin:
- 3. Chuyển hóa acid amin
- 3.1. Thoái biến chung của các acid amin
- 3.1.1. Khử amin.
- (1) Khử amin thủy phân:
- (2) Khử amin khử (hydro):
- (3) Khử amin nội phân tử:
- (4) Khử amin - oxi hóa:
- Hình 1: Sơ đồ quá trình khử amin oxy hóa
- 3.1.2. Chuyển (hoặc trao đổi) amin.
- Mối liên quan giữa trao đổi amin và khử amin (khử amin gián tiếp)
- 3.1.3. Khử carboxyl.
- 3.1.4. Số phận của các sản phẩm thoái biến acid amin
- Amoniac (NH3):
- Các phản ứng của vòng urê:
- Phản ứng 1: Tạo thành carbamylphosphat
- Phản ứng 2: Tạo thành citrulin
- Phản ứng 3: Tạo thành arginosuccinat
- Phản ứng 4: Tạo thành arginin.
- Phản ứng 5: Thủy phân arginin tạo thành urê. Arginin bị thủy phân bởi arginase, tạo thành urê và ornitin.
- Hình 2. Mối liên quan giữa vòng urê và vòng Krebs.
- Tạo muối ở thận.
- NH3 + H+ ==> NH4+
- Sử dụng trong các phản ứng amin hóa:
- Các -cetoacid
- Các amin
- R - CHO R - COOH
- 3.2. Thoái biến riêng của các acid amin.
- Hình 3: Số phận bộ khung cacbon của acid amin
- 2.2.1. Thoái biến của acid amin sinh ceton: leucin.
- Hình 4: Sự biến đổi của leucin tới HMGCoA
- 2.2.2. Thoái biến của acid amin sinh đường và sinh ceton
- Isoleucin (Ile): Isoleucin thoái biến theo một loạt phản ứng tương tự như leucin:
- Hình 5: Sự thoái biến của isoleucin
- Phenylalanin (Phe) và tyrosin (Tyr).
- Hình 6: Chuyển hóa của tyrosin
- Lysin (Lys).
- Hình 7: Chuyển hóa của lysin
- Tryptophan:
- Hình 8: Chuyển hóa của tryptophan
- 2.2.3. Thoái biến của các acid amin sinh đường.
- Alanin, aspartat (hoặc asparagin) và glutamat (hoặc glutamin):
- Glycin, serin, cystein:
- Threonin:
- Methionin:
- Arginin: Biến đổi thành glutamic:
- Prolin:
- Valin:
- Histidin:
- Hình 9: Sự biến đổi histidin thành glutamat
- 2.4. Sinh tổng hợp acid amin.
- Tổng hợp acid amin không cần thiết từ các chất trung gian của vòng Krebs:
- Hình 10: Sinh tổng hợp acid amin từ các chất trung gian của vòng Krebs
- Tổng hợp serin:
- Tổng hợp cystein:
- Tổng hợp acid amin không cần thiết từ các acid amin khác:
- 3.1. Cấu tạo:
- 3.2. Tính chất của peptid.
- 4.1. Cấu tạo
- 4.1.1. Hemoglobin
- 4.1.2. Cytochrom:
- 4.2. Chuyển hóa protid (Chuyển hóa của hemoglobin)
- 4.2.1.Thoái biến của hemoglobin.
- Hình 11: Sự thoái biến của Hemoglobin
- Hình 12: Sự tạo thành bilirubin từ hem.
- Hình 13: Sự tổng hợp bilirubin liên hợp
- 4.2.2.Tổng hợp hemoglobin.
- Hình 14: Tổng hợp hemoglobin
- Tổng hợp hem:
- Hình 15: Sinh tổng hợp hem




