











Preview text:
2024 Tháng 10 Tài liệu Hóa Đại Cương 01
Trắc nghiệm · Tự luận
Fanpage: UChemstudy - Gochochoa NC Quét QR xem KEY
CÂU HỎI ÔN TẬP HÓA ĐẠI CƯƠNG I 2024 – 2025
TRẮC NGHIỆM & TỰ LUẬN
Thời gian làm bài: phút (không kể thời gian phát đề)
Đề thi có 16 trang bao gồm 100 câu trắc nghiệm + 15 câu tự luận
Họ và tên sinh viên: ................................................................... MÃ ĐỀ 001
Mã số sinh viên: ........................................................................ CK 1
BẢNG PHÂN LOẠI TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC 18 1 H 2 13 14 15 16 17 He 2 Li Be B C N O F Ne 3 Na Mg 3 4 5 6 7 8 9 10 11 12 Al Si P S Cl Ar 4 K Ca Se Ti V
Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 5 Rb Sr Y
Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe 6 Cs Ba La Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Hf 7 Fr Ra Ac Rf Db Sg Bh Hs Mt Lanthanid
Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Actinid
Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr
Một số hằng số và công thức hữu dụng 23 1 − 8 1 − 34 N = 6,022 10 mol c = 310 ms h = 6,62610− Js A 1 − 1 − 1 − 1
R = 0,082 Latmmol K = 8,31Jmol K− H hoahoi 1 1 lnP − lnP = − 1 2 R T T 2 1 18 2,17810− E = − J n 2 n
Phần 1: CÂU HỎI TRẮC NGHIỆM
GECH 1: Cho các quá trình sau:
(1) Khi lực đẩy cân bằng lực hút, các ion dừng lại và cách nhau một khoảng cách nhất định.
(2) Các nguyên tử sẽ tiến hành cho nhận electron để tạo thành các cation và anion.
(3) Giữa chúng xuất hiện lực đẩy giữa các vỏ electron.
(4) Các ion ngược dấu sẽ hút nhau và tiến lại gần nhau.
Theo lý thuyết tĩnh điện hiện đại, cơ chế tạo thành liên kết ion theo trật tự các quá trình sau:
Ⓐ.4 – 3 – 1 – 2.
Ⓑ. 2 – 4 – 1 – 3.
Ⓒ. 1 – 4 – 3 – 2.
Ⓓ. 2 – 4 – 3 – 1.
GECH 2: Nguyên tử của nguyên tố X có tổng số electron nằm trên phân lớp d là 3. Có các phát biểu sau đây về X:
(a) Nguyên tử X có 23 hạt mang điện. (b) X là nguyên tố họ s.
Biên soạn và Sưu tầm: LÊ HẢI NAM Trang 1 – Mã đề 001
(c) Electron cuối cùng của X có số lượng chính n = 4.
(d) X thuộc chu kỳ 4, nhóm IIA.
(e) Ở trạng thái bình thường X có 3 electron độc thân. Số các phát biểu sai là: Ⓐ. 4 Ⓑ. 3 Ⓒ. 5 Ⓓ. 2
GECH 3: Vị trí trong bảng hệ thống tuần hoàn của nguyên tố có cấu hình: 1s22s22p63s23p63d44s2 là:
Ⓐ. Chu kỳ 4, phân nhóm IIB.
Ⓑ. Chu kỳ 3, phân nhóm IIB.
Ⓒ. Chu kỳ 4, phân nhóm VIB.
Ⓓ. Cấu hình electron không tồn tại.
GECH 4: Hình ảnh nào sau đây là phù hợp với cấu trúc của phân tử BH3 trong không gian. Cho biết (ZB = 5, ZH = 1) Ⓐ. Ⓑ. Ⓒ. Ⓓ.
GECH 5: Phát biểu nào sau đây là sai?
Ⓐ. Số electron độc thân của S (Z = 16) chỉ có thể có là 2.
Ⓑ. Nguyên tử N có 5 electron hóa trị và có thể tạo được 4 liên kết cộng hóa trị.
Ⓒ. Nguyên tố Clo có thể có 1, 3, 5, 7 electron độc thân.
Ⓓ. Cr (Z = 24) có 6 electron độc thân ở trạng thái bình thường.
GECH 6: Ion X2+ có phân lớp electron cuối cùng là 3d6. Bộ bốn số lượng tử của electron cuối cùng
trong ion X3+ là: (với giá trị ml xếp tăng dần)
Ⓐ. n = 3, l = 2, ml = 2, ms = +1/2.
Ⓑ. n = 3, l = 2, ml = 0, ms = +1/2.
Ⓒ. n = 4, l = 0, ml = 0, ms = -1/2.
Ⓓ. n = 3, l = 2, ml = - 2, ms = -1/2.
GECH 7: Đồng trong tự nhiên có 2 đồng vị là 65Cu và 63Cu. Khối lượng nguyên tử trung bình của đồng
là 63,54. Clo trong tự nhiên có 2 đồng vị là 35Cl (chiếm 75,77%) và 37Cl. Tính thành phần phần trăm
theo khối lượng của 65Cu trong phân tử CuCl2 gần nhất với giá trị nào? Ⓐ. 87%. Ⓑ. 73%. Ⓒ. 27%. Ⓓ. 13%.
GECH 8: Số cặp electron hóa trị liên kết và không liên kết của nguyên tử trung tâm trong phân tử CH4
lần lượt là: (Cho biết ZC = 6, ZH = 1) Ⓐ. (4, 0). Ⓑ. (1, 3). Ⓒ. (2, 2). Ⓓ. (3, 1).
GECH 9: Khi dự đoán trạng thái lai hóa của SO2, gọi σ là số nguyên tử biên, X là tổng số electron hóa
trị trong phân tử, phát biểu nào sau đây là đúng?
Ⓐ. σ = 2, X = 16, lai hóa sp3, cấu trúc góc.
Ⓑ. σ = 3, X = 24, lai hóa sp3, cấu trúc tháp.
Ⓒ. σ = 2, X = 18, lai hóa sp2, cấu trúc góc.
Ⓓ. σ = 2, X = 18, lai hóa sp2, cấu trúc đường thẳng.
GECH 10: Cho nguyên tử X, Y có bộ 4 số lượng tử của electron cuối cùng lần lượt là (1, 0, 0, +1/2) và
(3, 1, -1, -1/2). Có các phát biểu về phân tử X2Y: (a) X2Y có liên kết ion.
(b) X2Y có nguyên tử trung tâm ở trạng thái lai hóa sp.
(c) X2Y có tính bão hòa và có tính định hướng.
(d) X2Y có cấu trúc hình học phân tử là cấu trúc đường thẳng. Phát biểu nào là đúng? Ⓐ. (b). Ⓑ. (c). Ⓒ. (a). Ⓓ. (d).
Biên soạn và Sưu tầm: LÊ HẢI NAM Trang 2 – Mã đề 001
GECH 11: Thuyết cơ học lượng tử không chấp nhận điều nào sau đây:
Ⓐ. Ở trạng thái cơ bản, các electron sắp xếp sao cho số electron độc thân là nhiều nhất.
Ⓑ. Số lượng tử spin cho biết chiều tự quay của electron xung quanh trục của nó.
Ⓒ. Trong một nguyên tử không có 2 electron có cùng bốn số lượng tử.
Ⓓ. Số lượng tử orbital (l) xác định mức năng lượng của electron.
GECH 12: Cho các yếu tố sau:
(1) Độ âm điện của các nguyên tử trong phân tử.
(2) Sự lai hóa của nguyên tử trung tâm.
(3) Cặp electron hóa trị tự do trong phân tử. (4) Độ dài liên kết.
(5) Năng lượng liên kết.
Các yếu tố có ảnh hưởng đến độ lớn góc hóa trị của phân tử là: Ⓐ. (2, 3). Ⓑ. (1, 2). Ⓒ. (3, 4). Ⓓ. (4, 5).
GECH 13: Cho các phân tử sau đây: F2, CO2, H2, CH4, CCl4. Số lượng các phân tử có moment lưỡng
cực khác không là: (Cho biết ZF = 9, ZC = 6, ZO = 8, ZH = 1, ZCl = 17) Ⓐ. 2. Ⓑ. 3. Ⓒ. 0. Ⓓ. 1.
GECH 14: Liên kết chủ yếu có mặt trong hợp chất KBr là:
Ⓐ. Liên kết hydrogen.
Ⓑ. Liên kết cộng hóa trị.
Ⓒ. Liên kết ion.
Ⓓ. Liên kết kim loại.
GECH 15: Phát biểu nào sau đây là đúng đối với phân tử CO2
Ⓐ. Có bậc liên kết bằng 1.
Ⓑ. Có hai liên kết .
Ⓒ. Có hai liên kết cộng hóa trị.
Ⓓ. Phân tử có tính phân cực.
GECH 16: Cho phân tử CH≡C–CH=C=C=CH2. Số liên kết σ và liên kết π trong phân tử này lần lượt là: Ⓐ. (9 – 5).
Ⓑ. (4 – 11). Ⓒ. (5 – 9). Ⓓ. (11 – 4).
GECH 17: Góc tạo bởi các orbital lai hóa sp2 thông thường là: Ⓐ. 109o28’. Ⓑ. 90o. Ⓒ. 120o. Ⓓ. 180o.
GECH 18: Cho các phát biểu sau:
a) Khi tạo liên kết thì liên kết π được hình thành đầu tiên và có vai trò định hướng phân tử.
b) Nếu trong phân tử có liên kết π nhiều tâm thì phân tử có bậc liên kết không phải là số nguyên.
c) Liên kết đôi kém bền hơn liên kết ba.
d) Sự định hướng của liên kết cộng hóa trị được quyết định bởi sự lai hóa của nguyên tử trung
tâm tham gia tạo liên kết. Phát biểu sai là: Ⓐ. (a). Ⓑ. (d). Ⓒ. (b). Ⓓ. (c).
GECH 19: Nguyên tử X có electron cuối cùng mang bộ bốn số lượng tử n = 3, l = 0, ml = 0, ms = +1/2.
Nguyên tử X có số hạt mang điện lớn hơn hạt không mang điện là 10 hạt. Tỷ số giữa số hạt không
mang điện và số hạt mang điện trong hạt nhân của X là: Ⓐ. 0,92. Ⓑ. 1,09. Ⓒ. 1,9. Ⓓ. 0,52.
GECH 20: Theo thuyết liên kết hóa trị VB thì hình ảnh nào sau đây không là hình ảnh của orbital (các orbital) lai hóa: Ⓐ. Ⓑ. Ⓒ. Ⓓ.
Biên soạn và Sưu tầm: LÊ HẢI NAM Trang 3 – Mã đề 001
GECH 21: Hình ảnh sau đây mô tả quá trình lai hóa nào của các orbital nguyên tử: Ⓐ. sp3. Ⓑ. s3p. Ⓒ. sp. Ⓓ. sp2.
GECH 22: Có tối đa bao nhiêu nguyên tử có cùng các số lượng tử sau: n = 2, l = 2 Ⓐ. 6. Ⓑ. 10. Ⓒ. 8. Ⓓ. 0.
GECH 23: Cho các yếu tố sau đây:
(1) Sự lai hóa của nguyên tử trung tâm.
(2) Cấu trúc hình học của phân tử.
(3) Cặp electron hóa trị tự do trong phân tử.
(4) Độ dài liên kết giữa các nguyên tử trong tử trong phân tử.
Các yếu tố có ảnh hưởng đến tính phân cực của một phân tử cộng hóa trị là: Ⓐ. (1, 3, 4). Ⓑ. (1, 2, 3).
Ⓒ. (1, 2, 3, 4). Ⓓ. (2, 3, 4).
GECH 24: Các nguyên tố có độ âm điện cao nhất trong bảng hệ thống tuần hoàn thuộc nhóm:
Ⓐ. Khí hiếm.
Ⓑ. Kim loại kiềm.
Ⓒ. Kim loại kiềm thổ. Ⓓ. Halogen.
GECH 25: Liên kết ion có những đặc điểm cơ bản nào?
Ⓐ. Tính không bão hòa, không định hướng và không phân cực.
Ⓑ. Tính không bão hòa, không định hướng và phân cực.
Ⓒ. Tính không bão hòa, định hướng và không phân cực.
Ⓓ. Tính bão hòa, không định hướng và phân cực.
GECH 26: Nguyên tố R tạo hợp chất khí với hydrogen có công thức RH3. Trong oxit cao nhất, nguyên
tố R chiếm xấp xỉ 43,67% khối lượng. Nguyên tử khối của R là: Ⓐ. 14. Ⓑ. 31. Ⓒ. 32. Ⓓ. 16.
GECH 27: Cho các phát biểu sau:
(a) Liên kết ion là liên kết phân cực mạnh.
(b) Liên kết cộng hóa trị là liên kết không phân cực.
(c) Orbital s che phủ với orbital s sẽ tạo thành liên kết cộng hóa trị kiểu σ.
(d) Orbital p che phủ với orbital p sẽ tạo thành liên kết cộng hóa trị kiểu π.
(e) Liên kết đôi có bậc liên kết bằng 2.
Số các phát biểu đúng là: Ⓐ. 4. Ⓑ. 2. Ⓒ. 1. Ⓓ. 3.
GECH 28: Cho 3 ion: K+, Ar, Cl-. Năng lượng ion hóa của các tiểu phân được sắp xếp giảm dần là:
Ⓐ. K+ > Cl- > Ar.
Ⓑ. Cl- > Ar > K+.
Ⓒ. K+ > Ar > Cl-.
Ⓓ. Ar > K+ > Cl-.
GECH 29: Có các phát biểu sau đây về liên kết hóa học:
(a) Liên kết hóa học có bản chất điện.
(b) Các electron tham gia tạo liên kết được gọi là các electron hóa trị.
(c) Độ dài liên kết càng tăng thì năng lượng liên kết càng giảm.
(d) Bậc liên kết càng tăng thì năng lượng liên kết càng tăng.
(e) Liên kết ion không có tính định hướng.
Có bao nhiêu phát biểu là đúng? Ⓐ. 4. Ⓑ. 3. Ⓒ. 5. Ⓓ. 2.
GECH 30: Liên kết hóa học có bản chất gì?
Ⓐ. Nhiệt. Ⓑ. Cơ. Ⓒ. Điện. Ⓓ. Quang.
Biên soạn và Sưu tầm: LÊ HẢI NAM Trang 4 – Mã đề 001
GECH 31: Cho các nguyên tử Li (Z = 3), C (Z = 6), N (Z = 7), O (Z = 8), Na (Z = 11)
Sắp xếp các nguyên tử trên theo chiều tăng dần năng lượng ion hóa thứ nhất.
Ⓐ. Na < Li < C < O < N.
Ⓑ. Na < Li < C < N < O.
Ⓒ. Li < Na < C < N < O.
Ⓓ. Li < Na < C < O < N.
GECH 32: Độ dài sóng λ của photon phát xạ khi electron từ quĩ đạo Bohr, n = 5 sang quĩ đạo n = 2 có giá trị là Ⓐ. 410 nm. Ⓑ. 434 nm. Ⓒ.486 nm. Ⓓ. 565 nm.
GECH 33: Cho các phân tử sau đây có cùng kiểu lai hóa sp3: CH4, NH3 và H2O. Độ lớn góc hóa trị của
các phân tử trên được sắp xếp theo trật tự đúng là:
Ⓐ. CH4 > H2O > NH3.
Ⓑ. Do có cùng kiểu lai hóa nên các phân tử có góc hóa trị bằng nhau.
Ⓒ. CH4 > NH3 > H2O.
Ⓓ. NH3 > H2O > CH4.
GECH 34: Nguyên tử X có electron cuối cùng mang bộ 4 số lượng tử là (3, 1, +1, -1/2). Phát biểu nào
sau đây về X là đúng:
Ⓐ. X có 15 electron ở trạng thái bình thường.
Ⓑ. X nằm ở chu kỳ 4 trong bảng hệ thống tuần hoàn.
Ⓒ. X có một electron độc thân ở trạng thái bình thường.
Ⓓ. X là nguyên tố khí trơ.
GECH 35: Hạt nhân của nguyên tử Y có 29 proton. Cấu hình electron Y ở điều kiện bình thường là:
Ⓐ. [Ne]3d104s1.
Ⓑ. [Ar]3d104s1.
Ⓒ. [Ar]3d94s2. Ⓓ. [Ne]3d94s2.
GECH 36: Hòa tan 5 gam NaCl vào 45 gam nước thu được dung dịch X. Nồng độ phần trăm của dung dịch X là:
Ⓐ. 11,1%. Ⓑ. 5%. Ⓒ. 10%. Ⓓ. 90%.
GECH 37: Phát biểu nào sau đây là đúng?
Ⓐ. Dung dịch là hệ đồng thể gồm hai hay nhiều chất mà thành phần của nó có thể thay đổi trong một giới hạn rộng.
Ⓑ. Dung dịch là hệ dị thể.
Ⓒ. Ở cùng một điều kiện, áp suất hơi bão hòa của dung dịch luôn cao hơn áp suất hơi bão hòa
của dung môi nguyên chất.
Ⓓ. Nước luôn sôi ở nhiệt độ 100oC.
GECH 38: Hãy tính nhiệt độ đông đặc của dung dịch không điện ly Glucose C6H12O6 5% trong nước
ở áp suất 1atm. Biết rằng ở 1 atm, nước đông đặc ở 0oC và có hằng số nghiệm lạnh là 1,86 kg.độ/mol.
Ⓐ. – 0,54 oC.
Ⓑ. – 1,09 oC. Ⓒ. 0,54 oC. Ⓓ. 0 oC.
GECH 39: Một bình kín dung tích 10 lít chứa đầy không khí ở đktc. Người ta nạp thêm vào bình 5 lít
không khí (đktc). Sau đó nung bình đến 273oC. Hỏi áp suất cuối cùng trong bình là bao nhiêu?
Ⓐ. 2 atm. Ⓑ. 1 atm. Ⓒ. 4 atm. Ⓓ. 3 atm.
GECH 40: Phát biểu nào sau đây là sai đối với dung dịch NaCl?
Ⓐ. Nhiệt độ sôi của dung dịch không tuân theo định luật Raoult.
Ⓑ. Khi pha loãng thì độ dẫn điện của dung dịch giảm.
Ⓒ. Không tồn tại phân tử trung hòa.
Ⓓ. Ở 1atm, nhiệt độ sôi của dung dịch lớn hơn 100oC.
Biên soạn và Sưu tầm: LÊ HẢI NAM Trang 5 – Mã đề 001
GECH 41: Hòa tan hoàn toàn 8 gam NaOH vào nước được 800ml dung dịch Y. Nồng độ mol/l của dung dịch Y là:
Ⓐ. 0,12 M. Ⓑ. 0,5 M. Ⓒ. 4 M. Ⓓ. 0,25 M.
GECH 42: Hòa tan 18,0 gam glucozơ trong 200,0 gam nước. Vậy dung dịch có nồng độ molan là
Ⓐ. 0,3 mol/kg.
Ⓑ. 0,4 mol/kg.
Ⓒ. 0,5 mol/kg. Ⓓ. 0,6 mol/kg.
GECH 43: Chọn phương án đúng.
Chọn các phân tử và ion có cấu hình không gian là tứ diện đều: Ⓐ.CH + 2-
4, SiH4, CCl4, NH4 , SO4 .
Ⓑ. SF4, NH3, H2O, COCl2. Ⓒ.BF3, CO2, SO2, CH2O.
Ⓓ. CH4, SiF4, CH3Cl, CH2Cl2.
GECH 44: Chọn so sánh đúng về góc liên kết:
Ⓐ.CH4 > NH3 > H2O > NF3.
Ⓑ. C2H6 > C2H4 > C2H2 (góc CCH)
Ⓒ. NF3 > NCl3 > NBr3 > NI3.
Ⓓ. CO2 > SO2 > NO2.
GECH 45: Chọn phương án đúng. Nguyên tử 15P trong phân tử PCl5 ở trạng thái lai hóa:
Ⓐ. sp3d2. Ⓑ. sp3d. Ⓒ. sp2. Ⓓ. sp3.
GECH 46: Chọn phát biểu sai:
Ⓐ.Nhiệt độ sôi của chất lỏng là nhiệt độ ở đó áp suất hơi bão hòa của nó bằng với áp suất môi trường
Ⓑ.Ở cùng nhiệt độ, áp suất hơi bão hòa của dung môi trong dung dịch chất tan khó bay hơi, luôn
nhỏ hơn áp suất hơi bão hòa của dung môi tinh khiết.
Ⓒ.Nhiệt độ sôi của dung dịch chứa chất tan không bay hơi luôn luôn cao hơn nhiệt độ sôi của
dung môi nguyên chất ở cùng điều kiện áp suất ngoài.
Ⓓ.Nhiệt độ đông đặc của dung môi nguyên chất luôn thấp hơn nhiệt độ đông đặc của dung môi
trong dung dịch ở điều kiện áp suất ngoài.
GECH 47: Chọn phương án đúng.
Chọn các chất có liên kết phân tử (hydrogen và Vander Waals)
1. Tinh thể NaCl. 2. HF (l). 3. Na (s). 4. H2O (aq). 5. Dung dịch NH3.
Ⓐ. Chỉ 1, 3.
Ⓑ. Chỉ 2, 4, 5.
Ⓒ. Chỉ 2, 4. Ⓓ. Tất cả.
GECH 48: Độ dài sóng 𝜆 của bức xạ do nguyên tử H phát xạ ra tuân theo hệ thức: 1 7 1 1 = 1,09710 − 2 2 n n 1 2
Với trạng thái đầu n = 3 và trạng thái cuối n = 1, bức xạ này ứng với sự chuyển electron:
Ⓐ.Từ lớp 3 xuống lớp 1, bức xạ thuộc dãy Lyman.
Ⓑ.Từ lớp 1 lên lớp 3, bức xạ thuộc dãy Lyman.
Ⓒ.Từ lớp 3 xuống lớp 1, bức xạ thuộc dãy Balmer.
Ⓓ.Từ lớp 1 lên lớp 3, bức xạ thuộc dãy Balmer.
GECH 49: Trong các chất Al2O3, CaO, KCl, CsCl chất nào có năng lượng mạng tinh thể nhỏ chất? Ⓐ.Al2O3. Ⓑ. CaO. Ⓒ. KCl. Ⓓ. CsCl.
GECH 50: Hợp chất nào sau đây không thể tạo thành dung dịch đồng nhất với nước? Ⓐ.CH3OH. Ⓑ. CH3COOH.
Ⓒ. HOCH2CH2OH. Ⓓ. CCl4.
Biên soạn và Sưu tầm: LÊ HẢI NAM Trang 6 – Mã đề 001
GECH 51: Công thức electron của N + 2 là 2 2 2 2 4 1 π π 2 2 2 2 1 4 π Ⓐ. 1s 1s 2s 2s 2p 2p . Ⓑ. 1s 1s 2s 2s 2p 2p . Ⓒ. 2 2 2 2 4 2 π . Ⓓ. 2 2 2 2 4 1 π . 1s 1s 2s 2s 2p 2p 1s 1s 2s 2s 2p 2p
GECH 52: Nhiệt độ nóng chảy của H2O, H2S, H2Se, H2Te biến thiên như sau:
Ⓐ.Tăng dần trong dãy trên.
Ⓑ.Giảm dần trong dãy trên.
Ⓒ.Nhiệt độ nóng chảy của H2O > H2S < H2Se < H2Te.
Ⓓ.Nhiệt độ nóng chảy của H2O < H2S > H2Se > H2Te.
GECH 53: Một hợp chất ion kết tinh trong ô mạng lập phương. Biết rằng các ion dương Ax+ chiếm
các vị trí đỉnh và tâm của các ô mạng cơ sở, các ion âm By- chiếm vị trí tâm các mặt ô mạng cơ sở.
Công thức hóa học của hợp chất đó là Ⓐ.AB. Ⓑ. AB2. Ⓒ. A2B3. Ⓓ. A2B.
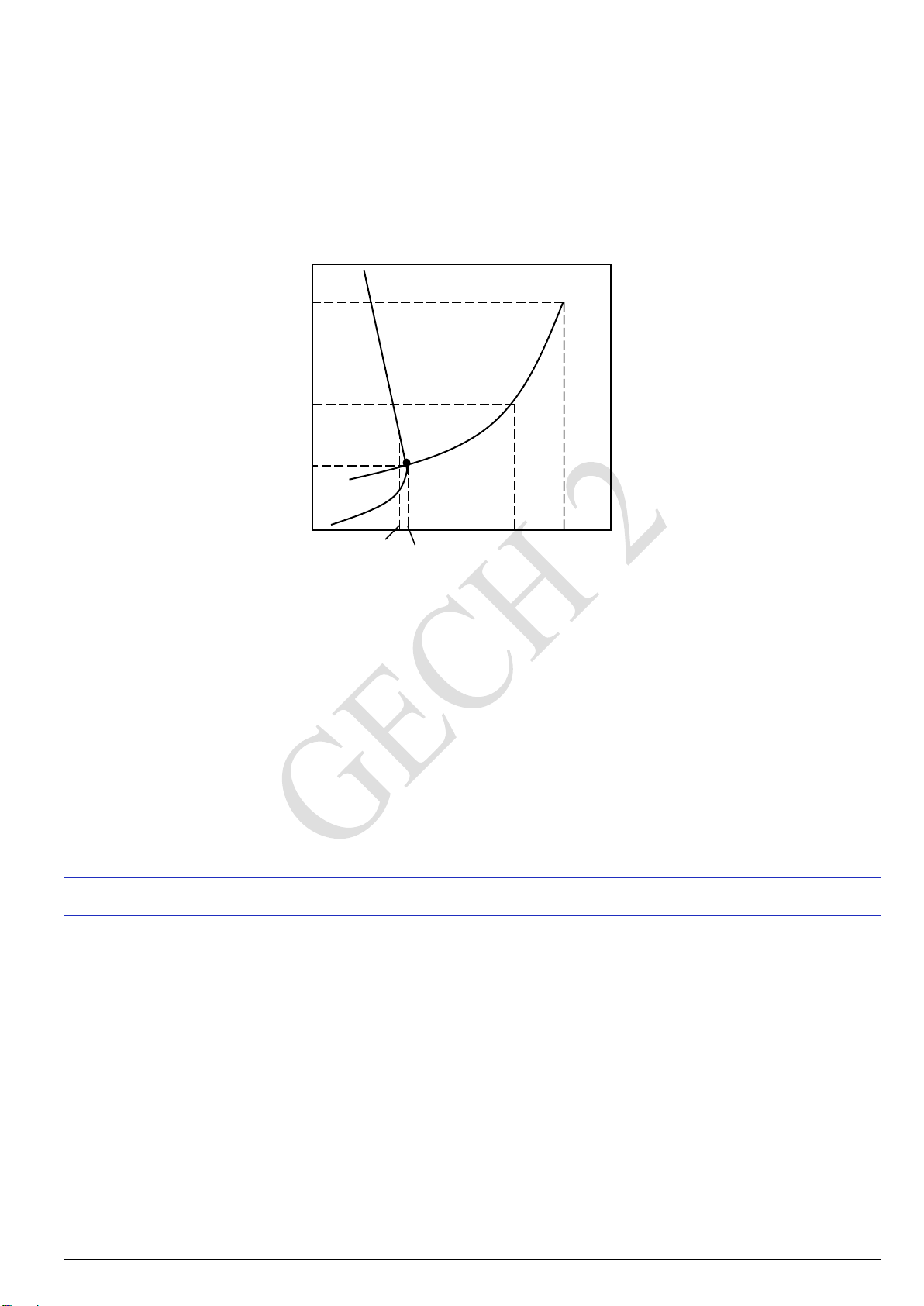
GECH 54: Trong giản đồ sau, đường biểu diễn cân bằng Rắn Khí, là đường cong Ⓐ.AC. Ⓑ. AB. Ⓒ. CD. Ⓓ. AD.
GECH 55: Chọn phương án đúng. Cấu hình electron hóa trị của phân tử CO là 2 2 2 4 2 2 4 2 Ⓐ. ( π = π . Ⓑ. ( π = π . 2s ) ( 2s ) ( 2p 2p ) ( 2p ) 2s ) ( 2s ) ( 2p ) ( 2p 2p ) 2 2 2 2 2 2 2 4 1 2 Ⓒ. ( π π . Ⓓ. ( π = π 2s ) ( 2s ) ( 2p 2p ) ( 2p ) ( 2p ) 2s ) ( 2s ) ( 2p ) ( 2p ) ( 2p )
GECH 56: Chọn phương án đúng. Cấu hình electron hóa trị của phân tử CN- là 2 2 2 4 2 2 4 1 1 Ⓐ. ( π = π . Ⓑ. ( π = π . 2s ) ( 2s ) ( 2p 2p ) ( 2p ) ( 2p ) 2s ) ( 2s ) ( 2p ) ( 2p 2p ) 2 2 2 2 2 2 2 4 2 Ⓒ. ( π π . Ⓓ. ( π = π . 2s ) ( 2s ) ( 2p 2p ) ( 2p ) 2s ) ( 2s ) ( 2p ) ( 2p ) ( 2p )
GECH 57: Chọn phương án đúng. Sự thêm electron vào MO phản liên kết dẫn đến hệ quả nào sau đây?
Ⓐ.Tăng độ dài liên kết và giảm năng lượng liên kết.
Ⓑ.Tăng độ dài liên kết và tăng năng lượng liên kết.
Ⓒ.Giảm độ dài liên kết và tăng năng lượng liên kết.
Ⓓ.Giảm độ dài liên kết và giảm năng lượng liên kết.
GECH 58: Chọn câu sai:
Ⓐ.Sự sắp xếp của các tiểu phân trong chất tinh thể tuân theo một quy luật chặt chẽ.
Ⓑ.Chất tinh thể có cấu trúc và hình dạng xác định.
Ⓒ.Chất vô định hình có tính bất đẳng hướng.
Ⓓ.Chất vô định hình không có nhiệt độ nóng chảy xác định.
GECH 59: Cho các phát biểu sau
1) Tốc độ khếch tán của chất lỏng giảm khi nhiệt độ tăng.
2) Lực tương tác giữa các phân tử chất lỏng càng lớn thì độ nhớt chất lỏng càng tăng.
3) Độ nhớt của chất lỏng giảm khi nhiệt độ tăng. Chọn phát biểu đúng:
Biên soạn và Sưu tầm: LÊ HẢI NAM Trang 7 – Mã đề 001 Ⓐ.Chỉ 1, 2. Ⓑ. 1, 2, 3.
Ⓒ. Chỉ 1, 3. Ⓓ. Chỉ 2, 3.
GECH 60: Chọn đáp án đúng. Chất nào trong số các chất sau ở trạng thái rắn có mạng kim loại: Ⓐ.Pd. Ⓑ. I2. Ⓒ. Si. Ⓓ. Se.
GECH 61. Chọn đáp án đúng. Chất nào sau trong số các chất sau ở trạng thái rắn có mạng ion: Ⓐ.AlCl3. Ⓑ. CsCl. Ⓒ. FeCl3. Ⓓ. MnF7.
GECH 62: Chọn đáp án sai. Dung dịch A có nồng độ phần trăm a, nồng độ mol CM, khối lượng riêng
d (g/ml), phân tử lượng của A là M, s là độ tan tính theo g/100g H2O: 100s 100a 10ad C M a = s = C = M a = M Ⓐ. 100 − s Ⓑ. 100 − a Ⓒ. M Ⓓ. 10d
GECH 63: Xác định độ tan của NaCl (g/100g H2O) ở 20oC biết nồng độ molan của NaCl trong dung
dịch NaCl bão hòa ở nhiệt độ này là 5,98 m. Ⓐ.350. Ⓑ. 17,5. Ⓒ. 35.
Ⓓ. Không thể xác định.
GECH 64: Xác định độ tan của KOH (g/100g H2O) ở 20oC biết nồng độ phần mol của KOH trong dung
dịch KOH bão hòa ở nhiệt độ này là 0,265. (Cho biết MKOH = 56 g/mol) Ⓐ.11,2. Ⓑ. 112. Ⓒ. 56. Ⓓ. 5,6.
GECH 65: Chọn chất khó hóa lỏng nhất: Ⓐ.CO2. Ⓑ. Ne. Ⓒ. N2. Ⓓ. SO2.
GECH 66: Chọn phương án sai:
Ⓐ.Do có liên kết hydrogen nên nước đá có cấu trúc đặc biệt, tương đối xốp nên tỷ khối nhỏ, nên
nước đá nổi trên nước lỏng.
Ⓑ.CsF có liên kết ion thuần túy (55Cs).
Ⓒ.Lực tương tác Van der Waals giữa các phân tử trung hòa được giải thích bằng ba hiệu ứng:
hiệu ng định hướng, hiệu ứng cảm ứng và hiệu ứng khếch tán.
Ⓓ. Lực Van der Waals trong các chất: F2, Cl2, Br2, I2 được quyết định bởi tương tác khuếch tán.
GECH 67: Trong ion ClO - -
2 , kiểu lai hóa của nguyên tử Cl và dạng hình học của ion ClO2 là: Ⓐ.sp2 và góc.
Ⓑ. sp3 và góc.
Ⓒ. sp và thẳng hàng. Ⓓ. sp3d và thẳng.
GECH 68: Chọn phát biểu đúng. Ion X2- có phân lớp electron ngoài cùng là 3p6
1) Cấu hình electron hóa trị X là 3s23p4.
2) X2- có điện tích hạt nhân Z = 18.
3) X thuộc chu kỳ 3, phân nhóm chính VIA trong bảng hệ thống tuần hoàn. 4) X có số oxy hóa -2. Ⓐ.Chỉ 1, 3, 4.
Ⓑ. Chỉ 1, 3.
Ⓒ. 1, 2, 3, 4. Ⓓ. Chỉ 2, 4.
GECH 69: Chọn phương án đúng. Sắp xếp các hợp chất cộng hóa trị sau theo chiều tăng dần góc liên kết: (1) NO - - 2, (2) NO3 , (3) NO2 Ⓐ.3, 1, 2. Ⓑ. 2, 1, 3. Ⓒ. 1, 2, 3. Ⓓ. 3, 2, 1.
GECH 70: Chọn phương án đúng.
Xét các phân tử và ion sau: O + - 2- 2 , O2, O2 , O2 1) Ion O 2- 2 nghịch từ.
2) Độ bền liên kết tăng dần từ trái sang phải.
3) Độ dài liên kết tăng dần từ trái sang phải.
4) Bậc liên kết tăng dần từ trái sang phải.
Biên soạn và Sưu tầm: LÊ HẢI NAM Trang 8 – Mã đề 001 Ⓐ.Chỉ 2, 4. Ⓑ. 1, 2, 4. Ⓒ. 1, 3. Ⓓ. 2, 3.
GECH 71: Trong các phân tử CO2, NH3, BCl3, CH4 phân tử có μ (momen lưỡng cực) khác 0 là
Ⓐ. CH4. Ⓑ. CO2. Ⓒ. NH3. Ⓓ. BCl3.
GECH 72: Hòa tan 456 g CH3COOH vào nước để thu được 1 lít dung dịch có khối lượng riêng bằng
1,04 g/ml. Tính nồng độ molan của dung dịch Ⓐ.7,31m. Ⓑ. 13,01m. Ⓒ. 19,31m. Ⓓ. 23,01m.
GECH 73: Xét các phân tử sau: BCl3, SF6, CO2. Trạng thái lai hóa của các nguyên tử trung tâm B, S, C lần lượt là: Ⓐ.sp3, sp3, sp.
Ⓑ. sp2, sp3d2, sp.
Ⓒ. sp2, sp3d, sp2. Ⓓ. sp3d, sp3d2, sp.
GECH 74: Trong số các liên kết sau, liên kết nào có tính ion lớn nhất? Ⓐ.C-O. Ⓑ. C-F. Ⓒ. C-C. Ⓓ. C-N.
GECH 75: Nguyên tố Y có điện tử kế cuối được biểu diễn bằng bộ 4 số lượng tử: n = 4; l = 1; ml = -1;
ms = -1/2. Xác định điện tích hạt nhân và vị trí của Y trong bảng hệ thống tuần hoàn:
Ⓐ.Z = 35; chu kỳ 4, phân nhóm VIIB.
Ⓑ. Z = 33, chu kỳ 4, phân nhóm VIIA.
Ⓒ. Z = 34, chu kỳ 4, phân nhóm VIA.
Ⓓ. Z = 17, chu kỳ 3, phân nhóm VIIA.
GECH 76: Trong số các góc liên kết sau, góc nào có giá trị lớn nhất?
Ⓐ.H-N-H trong phân tử NH3.
Ⓑ. H-O-H trong phân tử H2O.
Ⓒ. Cl-C-Cl trong phân tử CCl4.
Ⓓ. O-C-O trong phân tử CO2.
GECH 77: Chọn phát biểu sai:
Ⓐ.Ở cùng nhiệt độ, áp suất hơi bão hòa của dung dịch luôn luôn nhỏ hơn áp suất hơi bão hòa của dung môi.
Ⓑ. Dung dịch có nhiệt độ sôi thấp hơn và nhiệt độ đông đặc cao hơn dung môi nguyên chất.
Ⓒ. Ở cùng một nhiệt độ, chất nào dễ bay hơi sẽ có áp suất hơi bão hòa lớn hơn.
Ⓓ. Nồng độ dung dịch càng lớn, áp suất hơi bão hòa của dung dịch càng nhỏ.
GECH 78: Trong các phân tử CCl4, H2O, CS2, BF3, SiH4, NH3. Phân tử phân cực là: Ⓐ.CCl4, CS2, NH3. Ⓑ. H2O, NH3.
Ⓒ. BF3, SiH4, H2O. Ⓓ. CCl4, H2O, NH3.
GECH 79: Phát biểu nào sau đây không đúng với quy luật biến đổi tính chất của các nguyên tố hóa
học thuộc phân nhóm chính trong bảng hệ thống tuần hoàn của các nguyên tố hóa học:
Ⓐ.Độ âm điện của các nguyên tử tăng dần theo chiều từ trái sang phải trong cùng một chu kỳ.
Ⓑ. Bán kính của các ion đẳng điện tử giảm khi z tăng.
Ⓒ. Năng lượng ion hóa thứ nhất (I1) tăng dần theo chiều từ trên xuống trong cùng một phân nhóm.
Ⓓ. Bán kính nguyên tử các nguyên tố giảm dần theo chiều từ trái sang phải trong cùng 1 chu kỳ.
GECH 80: Hòa tan đường saccarozơ vào nước, nhiệt độ sôi (t0s) và nhiệt độ đông đặc (t0đ) của dung
dịch này (ở áp suất 1 atm) sẽ có giá trị:
Ⓐ. t0s < 1000C và t0đ < 00C.
Ⓑ. t0s > 1000C và t0đ < 00C.
Ⓒ. t0s > 1000C và t0đ > 00C.
Ⓓ. t0s < 1000C và t0đ > 00C.
GECH 81: Trong nguyên tử Ar (Z=18) có bao nhiêu điện tử có số lượng tử spin ms = +1/2? Ⓐ.9. Ⓑ. 8. Ⓒ. 6. Ⓓ. 5.
GECH 82: Xem vân đạo 5d, số lượng tử chính n, số lượng tử phụ l và số điện tử tối đa có thể có trong
vân đạo 5d lần lượt là: Ⓐ.5, 3, 10. Ⓑ. 5, 2, 6. Ⓒ. 5, 4, 10. Ⓓ. 5, 2, 10.
Biên soạn và Sưu tầm: LÊ HẢI NAM Trang 9 – Mã đề 001
GECH 83: Cho các hợp chất và ion sau: SF - -
6, NO2 ; IBr2 ; H2O. Trạng thái lai hóa của nguyên tử trung
tâm dạng hình học của các hợp chất và ion này lần lượt là:
Ⓐ.sp3d2 – bát diện; sp2 – dạng góc; sp3d – thẳng hàng; sp3 – dạng góc.
Ⓑ. sp3d2 – bát diện; sp – thẳng hàng; sp – thẳng hàng; sp3 – dạng góc.
Ⓒ. sp3d2 – bát diện; sp – thẳng hàng; sp3d – thẳng hàng; sp3 – dạng góc.
Ⓓ. sp3d2 – bát diện; sp2 – dạng góc; sp – thẳng hàng; sp3 – dạng góc.
GECH 84: Một dung dịch có thể tích 500 ml chứa 9 gam chất tan X không bay hơi không điện ly. Biết
áp suất thẩm thấu của dung dịch đo được ở 00C là 2,24 atm. Xác định khối lượng mol phân tử của chất X (g/mol)
Ⓐ. 180. Ⓑ. 45. Ⓒ. 36. Ⓓ. 90.
GECH 85: Chọn so sánh đúng về góc liên kết các ion sau: 1) ClO - 2- + 3 2) CO3 3) NH4 Ⓐ.2 < 1 < 3.
Ⓑ. 3 < 2 < 1.
Ⓒ. 1 < 3 < 2. Ⓓ. 2 < 3 < 1.
GECH 86: Chọn phương án đúng. Xác định hợp chất ion trong các hợp chất sau: 1) MgF2. 2) SnI4. 3) CO Ⓐ.Chỉ 1,2. Ⓑ. 1, 2, 3. Ⓒ. Chỉ 1.
Ⓓ. Không có hợp chất nào.
GECH 87: Chọn phương án đúng về cấu hình không gian và cực tính của các phân tử (với 6C là
nguyên tử trung tâm) sau đây:
1) CH2F2 tứ diện, có cực.
2) HCHO tháp tam giác, có cực.
3) BHF2 tam giác phẳng, có cực. 4) COS góc, có cực.
Ⓐ. 2, 3, 4.
Ⓑ. Chỉ 3, 4. Ⓒ. 1, 3. Ⓓ. 1, 2, 4.
GECH 88: Chọn phương án đúng. Chộn các dãy sắp xếp các chất theo nhiệt độ nóng chảy giảm dần. 1) FeO > FeS > FeSe
2) MgCl2 > MnCl2 > ZnCl2
3) TiCl2 > TiCl3 > TiCl4
4) CsF > HF > CO2 > Ne
Ⓐ. Chỉ 1, 4. Ⓑ. Chỉ 3.
Ⓒ. Chỉ 2, 3. Ⓓ. Tất cả.
GECH 89: Chọn phát biểu sai
1) Liên kết ion là liên kết không định chỗ.
2) Không có hợp chất chứa 100% liên kết cộng hóa trị.
3) Ở trạng thái dung dịch, NaCl dẫn điện kém.
4) Liên kết giữa kim loại và phi kim là liên kết ion. Ⓐ.Tất cả.
Ⓑ. Chỉ 3, 4.
Ⓒ. Chỉ 1, 2. Ⓓ. Chỉ 1, 4.
GECH 90: Chọn phát biểu sai
Ⓐ. Liên kết hydrogen liên phân tử sẽ làm tăng nhiệt độ sôi của chất lỏng.
Ⓑ. Liên kết kim loại, hydrogen và Van der Waals là các loại liên kết yếu.
Ⓒ. Liên kết cộng hóa trị và liên kết ion là các loại liên kết mạnh.
Ⓓ. Tất cả các liên kết đều có bản chất điện.
GECH 91: Chọn phương án đúng. Trong hợp chất HNO3, số oxy hóa và hóa trị nito lần lượt là Ⓐ.+4; 5. Ⓑ. +5; +4. Ⓒ. +4; 4. Ⓓ. +5; 4.
GECH 92: Chọn phương án đúng. Trong các hợp chất: AlCl3; CCl4; KCl và CaCl2, hợp chất có tính cộng
hóa trị nhiều nhất và hợp chất có tính ion nhiều nhất có kết quả lần lượt là: Ⓐ.AlCl3; KCl. Ⓑ. CCl4; KCl. Ⓒ. KCl; CCl4. Ⓓ. CaCl2; AlCl3.
Biên soạn và Sưu tầm: LÊ HẢI NAM Trang 10 – Mã đề 001
GECH 93: Chọn phát biểu đúng. Cho dãy các hydrua H2S của các nguyên tố phân nhóm VIAa khi đi
từ trên xuống: H2O → H2S → H2Se → H2Te thì khả năng lai hóa của X:
Ⓐ.Tăng dần do kích thước tăng dần.
Ⓑ. Như nhau và đều lai hóa sp3.
Ⓒ. Như nhau và đều lai hóa sp2.
Ⓓ. Giảm dần do mật độ electron không đủ lớn.
GECH 94: Chọn phát biểu sai
Ⓐ.Liên kết giữa hai phi kim luôn là liên kết cộng hóa trị.
Ⓑ. Liên kết giữa kim loại và phi kim luôn là liên kết ion.
Ⓒ. Tất cả các rượu lỏng đều có tạo liên kết hydrogen.
Ⓓ. Liên kết giữa hai kim loại là liên kết kim loại.
GECH 95: Chọn phát biểu sai về phương pháp MO. Trong phân tử cộng hóa trị:
Ⓐ.Các electron của các nguyên tử thì chỉ chịu lực tác dụng của hạt nhân nguyên tử đó.
Ⓑ. Các orbital nguyên tử được chia thành 3 loại: MO liên kết MO phản liên kết và MO không liên kết.
Ⓒ. Phân tử là tổ hợp thống nhất của các hạt nhân nguyên tử và electron, trạng thái electron được
đặc trưng bằng hàm số sóng phân tử.
Ⓓ. Các orbital phân tử được tạo thành do sự tổ hợp tuyến tính(cộng hoặc trừ) các orbital nguyên
tử, số MO tạo thành bằng số AO tổ hợp.
GECH 96: Chọn phát biểu đúng về hệ số Vant’ Hoff:
(1) Hệ số Vant’ Hoff của các hợp chất bất kỳ luôn lớn hơn, bé hơn hoặc bằng 1.
(2) Hệ số Vant’ Hoff của các hợp chất ion luôn lớn hơn 1.
(3) Hệ số Vant’ Hoff của các hợp chất không phân ly bằng 1.
Ⓐ. Chỉ 1, 3 đúng
Ⓑ. Tất cả đều đúng Ⓒ. Chỉ 1, 2 đúng Ⓓ. Chỉ 1 đúng.
GECH 97: Tính áp suất thẩm thấu của dung dịch Ba(NO3)2 0,06 M ở 5 °C (muối phân ly hoàn toàn)
Ⓐ.0,452 atm.
Ⓑ. 2,051 atm.
Ⓒ. 4,103 atm. Ⓓ. 0,205 atm.
GECH 98: Chọn câu sai:
Ngược lại với NaCl, LiI tan nhiều trong rượu, tan ít trong nước, nhiệt độ nóng chảy thấp. Lí do là vì:
Ⓐ.Liên kết trong phân tử LiI mang nhiều đặc tính cộng hoá trị, trái lại liên kết trong phân tử NaCl
mang nhiều đặc tính ion.
Ⓑ. LiI có khối lượng phân tử lớn hơn NaCl.
Ⓒ. Ion Li+ có bán kính nhỏ hơn Na+, trong khi ion I- có bán kính lớn hơn Cl- nên sự phân cực của
các ion trong LiI mạnh hơn.
Ⓓ. Liên kết Li-I ít phân cực hơn liên kết Na-Cl.
GECH 99: Etylen glycol (EG) là chất chống đông trong bộ tản nhiệt của động cơ ô tô hoạt động ở
vùng bắc và nam cực trái đất. Tính thể tích EG cần thêm vào bộ tản nhiệt có 8 lít nước để có thể làm
việc ở nhiệt độ thấp nhất là -15 °C. Cho biết khối lượng riêng của EG là 1,11g/cm3. Hằng số nghiệm
đông của nước bằng 1,86 độ/mol. Cho phân tử lượng của EG là 62.
Ⓐ. 4,8 lít Ⓑ. 3,6 lít Ⓒ. 7,2 lít Ⓓ. 6 lít.
GECH 100: Áp suất hơi của 1-propanol là 10,0 torr ở 14,7 °C. Khi đó, áp suất hơi ở nhiệt độ 52,8 °C
gần nhất với giá trị nào dưới đây? (Biết rằng nhiệt hóa hơi của 1-propanol là H = 47,2 kJ / mol) Ⓐ. 100,50 torr. Ⓑ. 10,02 atm. Ⓒ. 0,99 atm. Ⓓ. 9,98 atm.
----------HẾT PHẦN TRẮC NGHIỆM----------
Biên soạn và Sưu tầm: LÊ HẢI NAM Trang 11 – Mã đề 001 Phần 2: TỰ LUẬN
GECH 1: In its natural state, silicon contains three isotopes: Isotopes Atomic mass Percentage % 28Si 27,977 92,23 29Si 28,976 4,67 30Si 29,974 3,10
Determine the average atomic mass of silicon. GECH 2:
a) Viết công thức Lewis của các phân tử ion sau: CO 2- - + 2-
2; CO3 ; NO2 ; NO2 ; SO2; SO4 , BF3, SF4.
b) Viết công thức Lewis cho các phân tử ion sau: COBr 2- 2- 2; O2 ; C2 ; NO+, O3, HCHO.
c) Viết công thức Lewis và cho biết kiểu lai hóa nguyên tử trung tâm, dạng hình học trong không
gian của các phân tử và ion sau: IOF -
5, ClF3, SF4, SOF4, OCN-; PCl6 .
GECH 3: Xác định trạng thái lai hóa của nguyên tử trung tâm và dạng hình học trong không gian của các ion ClO-, ClO - - -
2 , ClO3 và ClO4 , từ đó so sánh độ bền của 4 ion.
GECH 4: Viết công thức Lewis của ICl3 và I2Cl6. Hãy dự đoán trạng thái lai hóa của nguyên tử trung
tâm và cho biết dạng hình học phân tử của ICl3 và I2Cl6. GECH 5:
a) Hãy xây dựng giản đồ MO (orbital phân tử) và viết cấu hình electron ion phân tử CN-. Dựa vào
giản đồ MO của CN- hãy cho biết từ tính của của ion phân tử CN-, CN, CN+ và cho biết chất nào bền nhất.
b) Hãy xây dựng giản đồ MO (orbital phân tử) và viết cấu hình electron ion phân tử O -2. Dựa vào giản đồ MO của O - - +
2 hãy cho biết từ tính của của ion phân tử O2 , O2, O2 và cho biết chất nào
hay ion nào có độ dài liên kết ngắn nhất.
c) Hãy xây dựng giản đồ MO (orbital phân tử) và viết cấu hình electron ion phân tử C2. Dựa vào giản đồ MO của C - 2-
2, hãy cho biết từ tính của của ion phân tử C2, C2 , C2 và so sánh độ bền liên kết giữa chúng.
d) Dựa vào thuyết MO, hãy giải thích từ tính của phân tử F2 và ion CO+. Xác định bậc liên kết.
GECH 6: Năng lượng liên kết của phân tử O +
2 là -498kJ/mol, trong khi năng lượng liên kết của O2 là
664kJ/mol. Hãy giải thích điều đó?
GECH 7: Hãy giải thích tại sao khi F +
2 mất một electron thành F2 thì độ bền bậc liên kết tăng còn N2 chuyển thành N +
2 thì độ bền liên kết lại giảm xuống. GECH 8:
a) Tinh thể vanadi (V) có cấu trúc lập phương tâm khối. Bán kính kim loại vanadi là 0,131nm.
Tính khối lượng thể tích của vanadi, biết rằng khối lượng của nguyên tử vanadi là 50,94 g/mol.
b) Đồng kết tinh dưới dạng lập phương tâm mặt. Khối lượng thể tích của đồng là 8,96 g/cm3.
Tính bán kính kim loại của đồng, biết rằng MCu = 63,5 g/mol.
c) Bạc kim loại kết tinh ở mạng lập phương tâm diện. Độ dài một cạnh của ô mạng cơ sở là 4,09
Ao. Tính khối lượng riêng của bạc kim loại, biết rằng MAg=108 g/mol.
d) Sắt monooxit FeO có cấu trúc mạng tinh thể lập phương tâm diện giống NaCl với thông số
mạng a = 0,432 nm. Hãy tính khối lượng riêng của tinh thể FeO đó.
Biên soạn và Sưu tầm: LÊ HẢI NAM Trang 12 – Mã đề 001
e) Phân tử CuCl kết tinh dưới dạng lập phương tâm mặt. Tính thông số mạng a của ô mạng cơ
sở biết rằng khối lượng riêng của CuCl là 4,316 g/cm3, Phân tử khối của đồng là 63,5 (g/mol) và clo là 35,5 (g/mol).
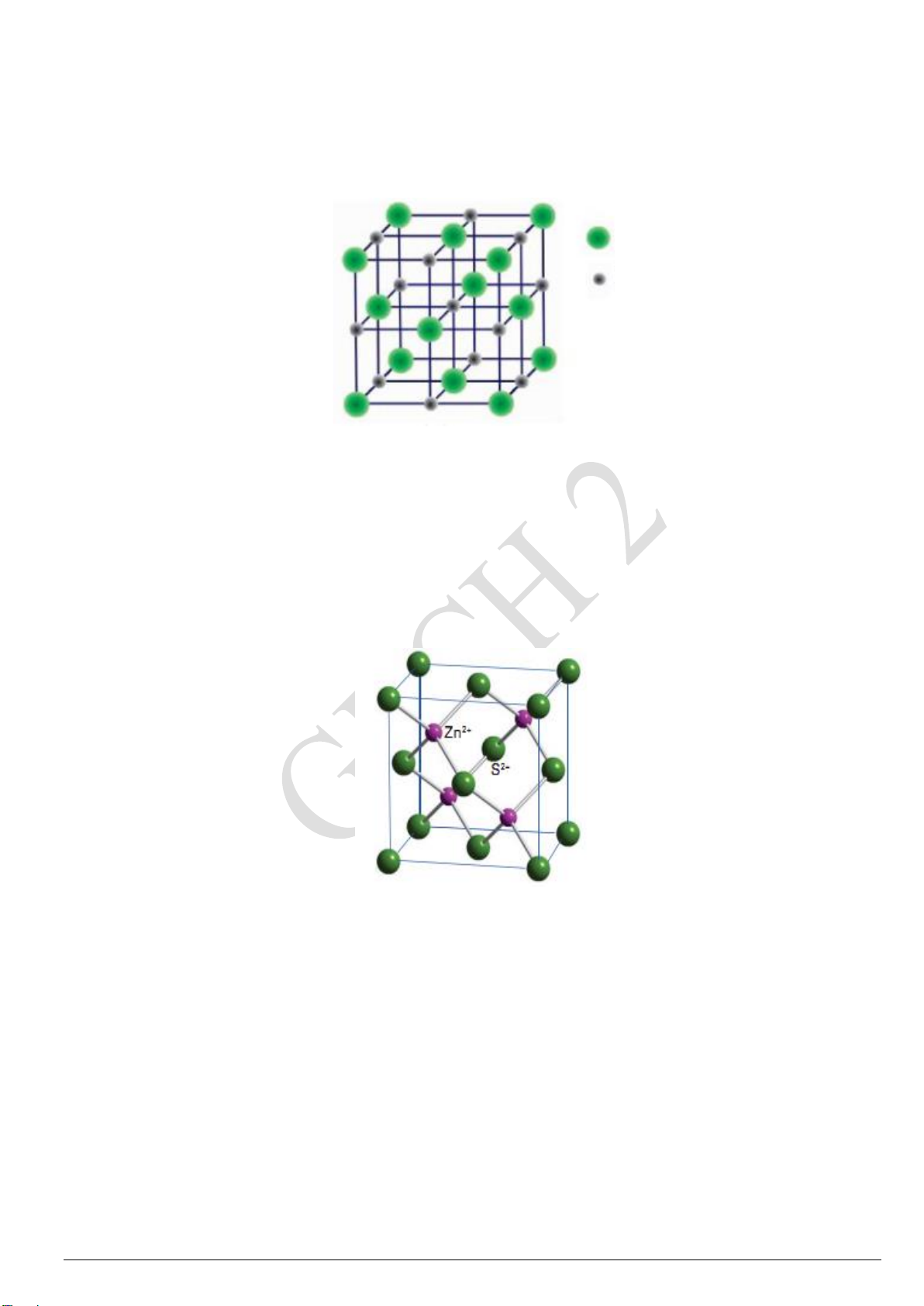
f) Tinh thể LiH có cấu trúc kiểu NaCl (Hình 1). Tính thông số mạng a của ô mạng cơ sở, biết
rằng khối lượng thể tích của tinh thể LiH là 0,82 g/cm3, khối lượng mol của LiH là 7,9489 g/mol. H- Li+ Hình 1
g) Bạc là kim loại có cấu trúc tinh thể lập phương tâm diện. Bán kính nguyên tử Ag và Au lần lượt
là 144 pm và 147 pm. Tính số nguyên tử Ag có trong một ô mạng cơ sở, khối lượng riêng của
bạc. Mặt khác, một mẫu hợp kim vàng – bạc cũng có cấu trúc tinh thể lập phương tâm diện.
Biết hàm lượng Au trong mẫu hợp kim này là 10%. Tính khối lượng riêng của mẫu hợp kim.
Cho biết nguyên tử khối của Ag là 108 g/mol và Au là 197 g/mol. o
h) Zinc sulfide (ZnS) crystallizes in a sphalerite lattice (Pic. 2) with lattice parameters a = 5,96
Calculate the density of ZnS knowing the atomic mass of Zn = 65 (u) and S = 32 (u). GECH 9: Pic. 2
a) So sánh độ lớn góc liên kết của các phân tử sau đây: PI3; PCl3; PBr3; PF3. Giải thích.
b) So sánh nhiệt độ nóng chảy của các chất sau: NaCl; KCl; MgO. Giải thích.
c) So sánh moment lưỡng cực giữa hai phân tử NH3 và NF3. Giải thích.
d) So sánh nhệt độ sôi của H2O và HF. Giải thích.
GECH 10: Nguyên tử của nguyên tố X phi kim X có electron cuối cùng có bộ 4 số lượng tử thỏa mãn: ml + l = 0; n + ms = 3/2.
a) Xác định số hiệu nguyên tử, gọi tên nguyên tố X.
b) Vẽ giản đồ MO, dự đoán cấu hình electron của phân tử X2. Tính bậc liên kết và tính chất thuận từ của X2.
GECH 11: Tại sao SiO2 là một chất rắn ở nhiệt độ phòng nóng chảy ở 1973K trong khi đó CO2 lại chất
khí ở nhiệt độ phòng nóng chảy ở 217K.
Biên soạn và Sưu tầm: LÊ HẢI NAM Trang 13 – Mã đề 001
GECH 12: Nguyên tử của nguyên tố X có tổng số hạt là 180, trong đó tổng các hạt mang điện gấp
1,432 lần số hạt không mang điện. Viết cấu hình electron của nguyên tử X. Xác định chu kì, nhóm
của X trong bảng hệ thống tuần hoàn. Cho biết tên và kí hiệu của nguyên tố X. Dự đoán các số oxi
hóa có thể có của X. Dùng ô lượng tử để giải thích.
GECH 13: Knowing the boiling temperature of CS2 is 46,20oC, boiling point constant is 2,37. Dissolve
1,024 gram sulfur into 20 gram CS2 and the boiling point of the resulting solution is 46,67oC. Give
the molecular formula of the element sulfur.
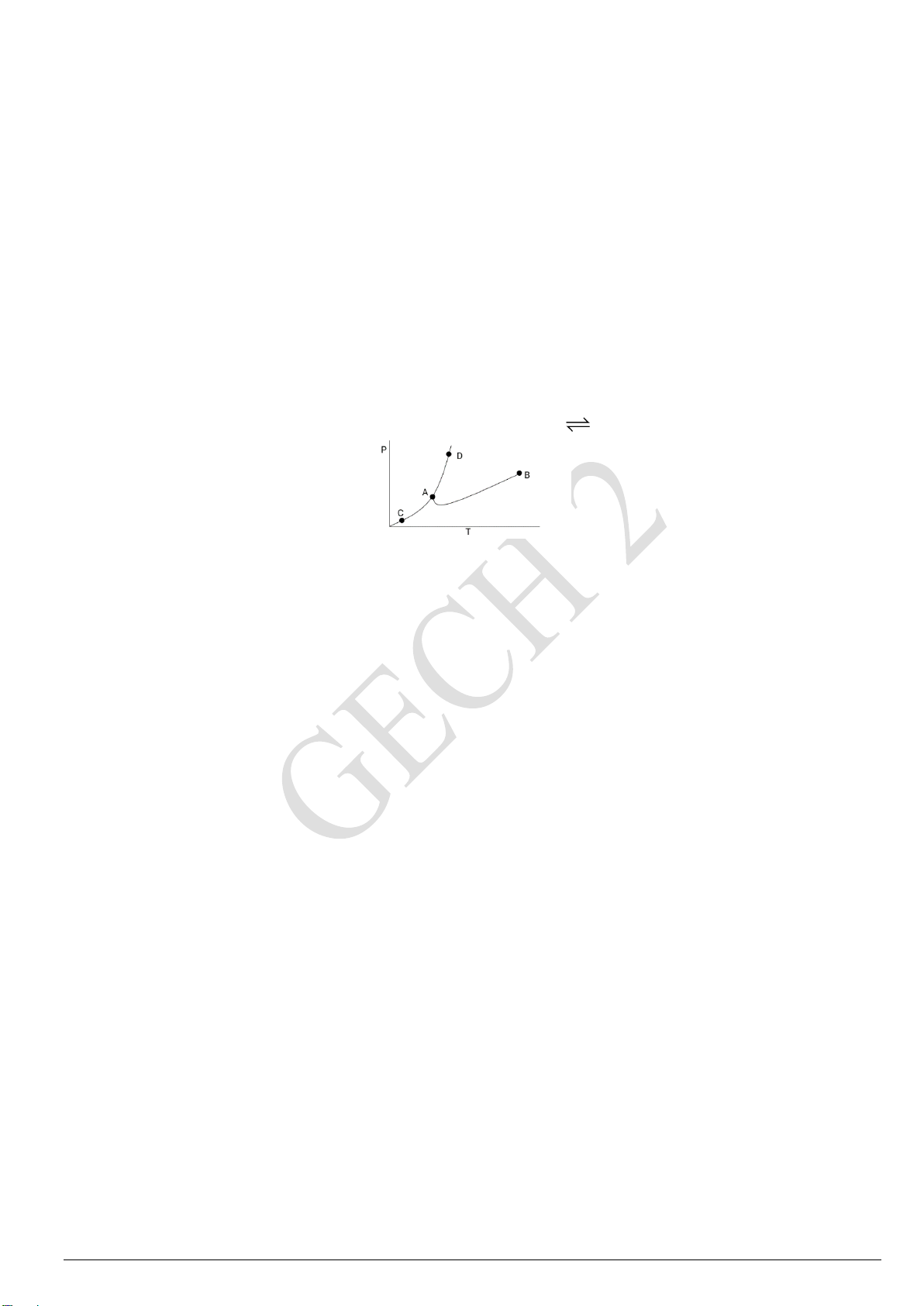
GECH 14: Cho giản đồ pha của nước như hình dưới: C B 218 Lỏng P (atm) Rắn 1 O 0,06 Hơi A’ A O ToC 0,01 100 374
Giản đồ pha của nước ở áp suất trung bình
a) Đường nào thể hiện trạng thái cân bằng rắn và hơi là đường nào?
b) Tại trạng thái có P = 250 atm và T = 3000C. Hệ tồn tại ở thể nào?
c) Tại vùng giới hạn bởi các đường OC và OA. Hệ tồn tại ở thế nào?
d) Hãy mô tả quá trình chuyển pha của H2O từ nhiệt độ 300oC về -30oC với điều kiện áp suất không đổi 1 atm.
e) Hãy giải thích vì sao nước đá không nóng chảy mà thăng hoa ở điều kiện dưới 0,006 atm cho
dù nhiệt độ ngày càng tăng.
GECH 15: Sắp xếp theo thứ tự giảm dần bán kính (có giải thích) của các nguyên tử và ion sau: Al,
Al3+, Na, Na+, Mg, Mg2+, F-, O2-.
----------HẾT----------
PHẦN LÀM BÀI TỰ LUẬN
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
Biên soạn và Sưu tầm: LÊ HẢI NAM Trang 14 – Mã đề 001
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
Biên soạn và Sưu tầm: LÊ HẢI NAM Trang 15 – Mã đề 001
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
.......................................................................................................................................................................
Mọi ý kiến đóng góp về đề vui lòng trao đổi qua mail: lehai1722004@gmai.com
Biên soạn và Sưu tầm: LÊ HẢI NAM Trang 16 – Mã đề 001



