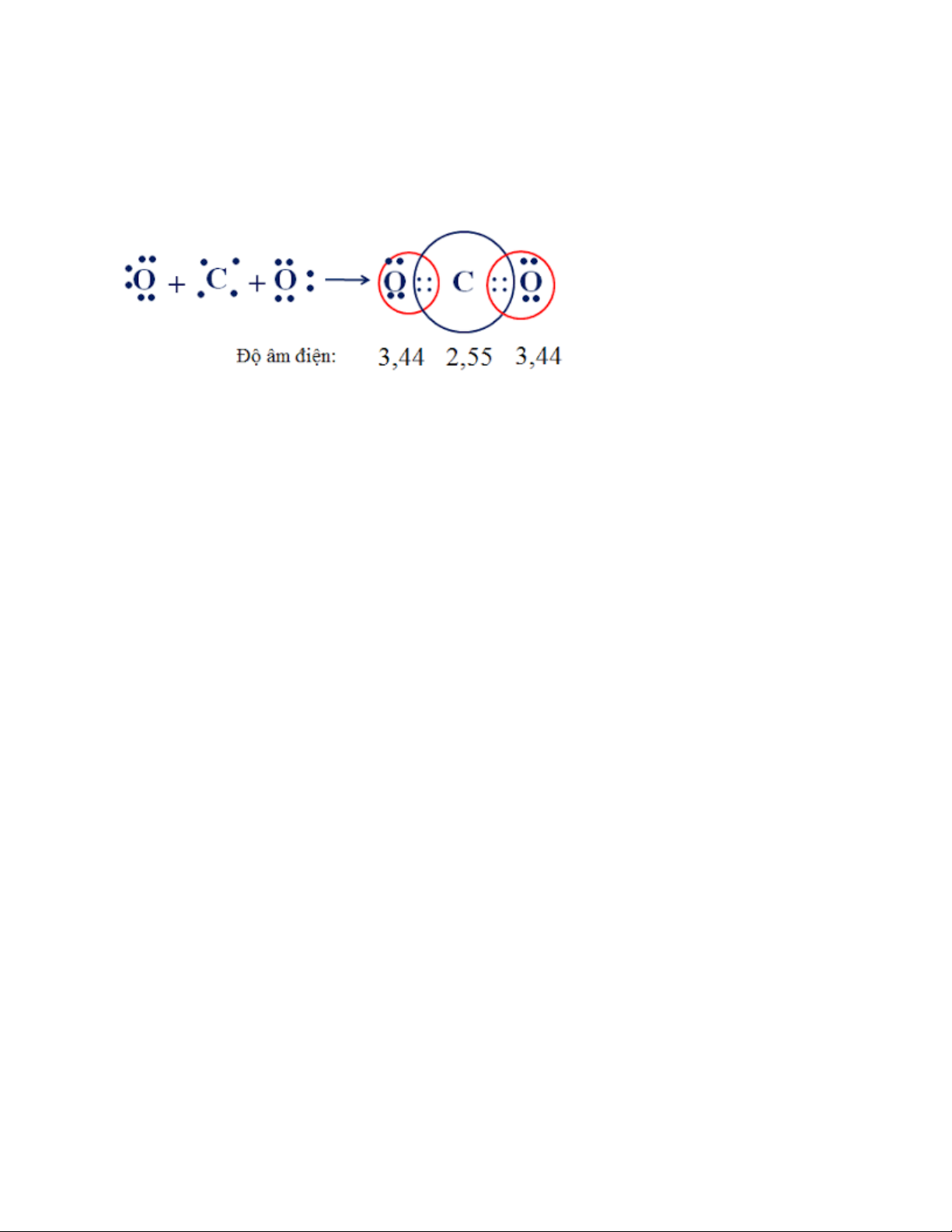

Preview text:
Hóa 10 bài 13: Liên kết cộng hóa trị
A. Tóm tắt lý thuyết hóa 10 bài 13
1. Liên kết cộng hóa trị hình thành giữa các nguyên tử giống nhau. Sự hình thành đơn chất.
Định nghĩa: Là liên kết được hình thành giữa 2 nguyên tử bằng một hay
nhiều cặp electron dùng chung.
a) Sự hình thành phân tử H2
H• + •H → H : H → H - H → H2
Mỗi nguyên tử hiđro có 1 e; 2 nguyên tử hiđro liên kết với nhau bằng cách
mỗi nguyên tử góp 1e tạo thành 1 cặp e chung trong phân tử H2. Quy ước
Mỗi châm (-) bên kí hiệu nguyên tố biểu diễn 1 electron ở lớp ngoài cùng.
Kí hiệu H : H được gọi là công thức electron, thay 2 chấm (:) bằng 1 (-) ta có
H-H được công thức cấu tạo
Giữa 2 nguyên tử H có 1 cặp electron chung, liên kết biểu thị bằng (-), đó là liên kết đơn.
b) Sự hình thành phân tử N2
Trong phân tử N2, mỗi nguyên tử Nito đạt được cấu hình 8 electron giống khí
hiếm Ar bằng cách mỗi nguyên tử góp 3 electron tạo thành electron chung N (Z= 7): 1s22s22p3
:N:. + .: N: → :N:::N: → N ≡ N CT e CTCT
Hai nguyên tử N liên kết với nhau bằng 3 cặp electron liên kết biểu thị bằng 3
gạch (≡ ) => hình thành liên kết 3
Các phân tử H2, O2, N2, Cl2.. tạo nên từ hai nguyên tử của cùng một nguyên tố
(có độ âm điện như nhau) nên cặp electron chung không bị lệch về phía nguyên tử nào.
c) Khái niệm liên kết cộng hóa trị
Định nghĩa: Liên kết cộng hóa trị là liên kết được tạo nên từ 2 nguyên tửu
bằng 1 hay nhiều cặp electron chung.
Mỗi cặp electron chung tạo nên 1 liên kết cộng hóa trị, nên ta có liên kết đơn
(trong phân tử H2) và liên kết ba (trong phân tử N2)
Liên kết trong các phân tử H2 và N2 tạo nên từ 2 nguyên tử của cùng 1 nguyên
tố (có độ âm điện như nhau), do đó cặp e dung chung không bị lệch về phía
nguyên tử nào, gọi là liên kết cộng hóa trị không phân cực.
2. Liên kết giữa các nguyên tử khác nhau. Sự hình thành hợp chất.
a) Sự hình thành phân tử HCl
Trong phân tử hiđro, mỗi nguyển tử (H và Cl) góp 1 electron tạo thành một
cặp electron chung để tạo liên kết cộng hóa trị. Cặp electron liên kết bị lệch về
phía Clo, (Độ âm điện của Cl là 3,5 lớn hơn độ âm điện của H là 2,1) liên kết
cộng hóa trị này bị phân cực. Công thức electron:
Công thức cấu tạo: H – Cl
Đây là liên kết cộng hóa trị phân cực
b) Sự hình thành phân tử khí cacbonic CO2 (Có cấu tạo thẳng)
Hóa trị của một nguyên tố trong hợp chất cộng hóa trị gọi là cộng hóa trị và
bằng số liên kết mà nguyên tử nguyên tố đó tạo ra được với các nguyên tử khác trong phân tử.
Công thức cấu tạo: O = C = O
Theo công thức electron, mỗi nguyên tử C hay O đều có 8e ở lớp ngoài cùng
đạt cấu hình của khí hiếm nên phân tử CO2 bền vững.
c) Dấu hiệu nhận biết liên kết cộng hóa trị có trong phân tử
Phân tử đơn chất và hợp chất được hình thành từ phi kim.
VD: O2, F2, H2, N2, F2O, HF, H2O,….
3. Hiệu độ âm điện và liên kết hóa học
Hiệu số độ âm điện: Δx
Từ 0,0 ≤ Δx < 0,4 thì liên kết được gọi là liên kết cộng hóa trị không cực.
Nếu 0,4 ≤ Δx < 1,7 thì liên kết được gọi là liên kết cộng hóa trị có cực.
Nếu Δx ≥ 1,7 liên kết ion
Ví dụ: Trong NaCl có hiệu độ âm điện Δx = độ âm điện của Na - độ âm điện
của Cl = 3,16 - 0,93 = 2,23 => Vậy liên kết giữa Na với Cl là liên kết ion
So sánh liên kết cộng hóa trị không cực, cộng hóa trị có cực và liên kết ion
Giống nhau: Các nguyên tử kết hợp với nhau tạo ra mỗi nguyên tử lớp
electron ngoài cùng bền vững giống cấu trúc của khí hiếm (quy tắc bát tử) Khác nhau Cộng hóa trị không Cộng hóa trị có cực Liên kết ion cực
Cặp electron chung Nguyên tử kim loại Sự hình
Cặp electron ở giữa 2 lệch về nguyên tử nhường electron, thành liên nguyên tử
có độ âm điện lớn nguyên tử phi kim kết hơn nhận electron Giữa 2 phi kim Giũa kim loại điển Điều kiện
Giữa 2 phi kim giống mạnh yếu khác hình và phi kim điển liên kết hệt nhau nhau hình.
B. Giải Hóa 10 bài 13: Liên kết cộng hóa trị
C. Giải SBT Hóa 10 bài 13