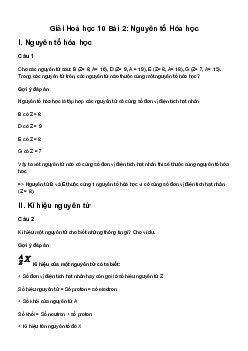Preview text:
HÓA HỌC 10 BÀI 2
HẠT NHÂN NGUYÊN TỬ NGUYÊN TỐ HÓA HỌC ĐỒNG VỊ
A. Tóm tắt trọng tâm lý thuyết Hóa 10 bài 1
I. Hạt nhân nguyên tử
1. Điện tích hạt nhân
Nếu hạt nhân nguyên tử có Z hạt proton thì điện tích hạt nhân là Z+ và số đơn
vị điện tích hạt nhân là Z.
Số dơn vị điện tích hạt nhân = số p = số e = Z 2. Số khối
Số khối của hạt nhân (A) bằng tổng số proton (Z) và tổng số notron (N) Công thức: A = Z + N
II. Nguyên tố hóa học 1. Định nghĩa
Nguyên tố hóa học là những nguyên tử có cùng điện tích hạt nhân (cùng số proton, số electron)
Ví dụ: Tất cả các nguyên tử có cùng số đơn vị điện tích hạt nhân là 12 đều là nguyên tố Magie
2. Số hiệu nguyên tử
Số đơn vị điện tích hạt nhân nguyên tử của một nguyên tố được gọi là số hiệu
nguyên tử của nguyên tố đó, kí hiệu Z.
3. Kí hiệu nguyên tử
Số đơn vị điện tích hạt nhân và số khối được coi là những đặc trưng cơ bản của nguyên tử.
Kí hiệu nguyên tử AX Z
- X là kí hiệu nguyên tố
- A là số khối (A = Z + N)
- Z là số hiệu nguyên tử III. Đồng vị
Đồng vị là những nguyên tử có cùng số proton nhưng khác số notron, do đó số
khối của chúng khác nhau. 16 17 18
Ví dụ: Nguyên tố O có 3 đồng vị là ; O ; O O 8 8 8
IV. Nguyên tử khối và nguyên tử khối trung bình 1. Nguyên tử khối
Nguyên tử khối là khối lượng tương đối của nguyên tử. Công thức A = mp + mn
- Nguyên tử khối cho biết khối lượng nguyên tử đó nặng gấp bao nhiêu lần đơn
vị khối lượng nguyên tử
2. Nguyên tử khối trung bình A .x + A .y + A .z + ....A .n Công thức 1 2 3 n A = 100
- Trong đó A1, A2, A3,… là số khối của các đồng vị.
- x,y,z,… là thành phần % của các đồng vị.
Ví dụ 1: Oxi có 3 đồng vị là: 16 17 18
O (x = 90%); O (x = 6%); O (x = 4%) 8 1 8 2 8 3 biết
Nguyên tử khối trung bình của O là: A .x + A .y + A .z 16.90 +17.6 +18.4 1 2 3 A = = 16,14 100 100
Ví dụ 2: Xét 50 nguyên tử X có 27 nguyên tử X1 và 23 nguyên tử X2.
Số khối A1 = 35 + 44 = 79; A2 = 35 + 46 = 81 79.27 + 81.23 Ta có A = 79,92 50
B. Bài tập mở rộng nâng cao
Bài 1. Nguyên tử Al có điện tích hạt nhân là 13+. Trong nguyên tử Al số hạt
mang điện nhiều hơn số hạt không mang điện là 12 hạt. Hãy cho biết số khối của nhôm. Hướng dẫn giải
Ta có: Điện tích hạt nhân của Al là 13+, tức p = 13 (1)
Theo đề bài ta có: (p + e) - n = 12 (2)
Giải (1) và (2) ta được n= 14
Số khối A = p + n = 13 + 14 = 27
Vậy số khối của Al là 27. 79
Bài 2. Trong tự nhiên nguyên tố Brom có 2 đồng vị, trong đó đồng vị Br 35
chiếm 54,5% về số lượng. Số khối của đồng vị còn lại bằng bao nhiêu Hướng dẫn giải
Đặt A2 là số khối của đồng vị thứ hai
Phần trăm số lượng của nó là: 100 - 54,5 = 45,5
x .A + x .A 54,5.79 + 45,5.A Ta có: 1 1 2 2 2 M = = = 79,91 = A = 81 2 100 100
Bài 3. Cho hợp chất MX3, biết: Tổng số hạt là 196 trong đó số hạt mang điện
nhiều hơn số hạt không mang điện là 60. Nguyên tử hối của X lớn hơn của M là
8. Tổng 3 loại hạt trong X- nhiều hơn trong ion M3+ là 16. Hãy xác định M và X
thuốc đồng vị nào của 2 nguyên tố đó Hướng dẫn giải
Trong M có Z proton, Z electron, N notron
X có Z’ proton, Z’ electron, N’ nơtron => Hệ phương trình:
(2Z + N) + (6Z '+ 3N ') =196 Z =13
(2Z + 6Z ') − (N + 3N ') = 60 Z ' =17 =
(Z '+ N ') − (Z − N ) = 8 N = 14
(2Z '+ N '+1) −(2Z + N −3) =16 N ' =18
= A = 27; A = 35 M X 27 35 = M ; M 13 17 12 13 16 17 18
Câu 4. Cacbon có 2 đồng vị C ; C ; O ; O O 6 6 . Oxi có 3 8 8 8 . Số phân tử CO2 được tạo thành? Hướng dẫn giải
Phân tử CO2 được tạo thành từ 1 nguyên tử cacbon và 2 nguyên tử oxi. Phân tử
CO2 đối xứng tạo thành 1 đồng vị cacbon với 2 nguyên tử của 1 đồng vị oxi. Có
2 đông vị cacbon và 3 đồng vị oxi => Số phân tử CO2 đối xứng = 2.3 = 6
Phân tử CO2 không đối xứng tạo thành từ 1 đồng vị cacbon và 2 nguyên tử của
2 đông vị oxi khác nhau. Có 2 đồng vị cacbon và 3 cặp đồng vị oxi khác nhau =>
số phân tử CO2 không đối xứng = 2.3 = 6
Vậy tổng số phân tử CO2 = 12 phân tử