




Preview text:
HÓA HỌC 9 BÀI 10: MỘT SỐ MUỐI QUAN TRỌNG
I. Tóm tắt nội dung kiến thức trọng tâm
1. Muối natri clorua (NaCl)
1.1. Trạng thái tự nhiên
- Natri clorua tồn tại ở dạng hòa tan trong nước biển.
+ Cho nước biển bay hơi, ta được chất rắn là hỗn hợp của nhiều muối, thành phần chính là NaCl
+ Trong 1 m3 nước biển có hòa tan chừng 27 kg NaCl, 5 kg MgCl2, 1 kg CaSO4 và
một khối lượng nhỏ những muối khác.
- Ngoài ra, trong lòng đất cũng chứa một khối lượng muối natri clorua kết tinh gọi là muối mỏ.
Những mỏ muối có nguồn gốc từ những hồ nước mặn đã cạn đi từ hàng triệu năm.
Hình 1.1. Ruộng muối
1.2. Tính chất vật lý của muối tinh khiết
- Muối NaCl là chất rắn kết tinh không màu hoặc màu trắng
- Điểm nóng chảy: 801 độ C, điểm sôi 1413 độ C, tỷ trọng 2.16g/cm3
- Độ hòa tan trong nước 35.9g/ml (25 độ C).
- Cấu trúc tinh thể: Mỗi nguyên tử có 6 nguyên tử cận kề tạo ra cấu trúc bát diện. Sự
phân bổ này được gọi là khớp nối lập phương kín.
1.3. Tính chất hóa học
- NaCl là chất điện li mạnh, phân li hoàn toàn trong nước, tạo ra các ion âm và dương.
- Natri Clorua là muối của bazo khá mạnh và axit mạnh nên nó mang tính trung
tính → do đó tương đối trơ về mặt hóa học.
- Tác dụng với muối Ag+ (phản ứng trao đổi): NaCl + AgNO3 → AgCl + NaNO3
- Tác dụng với nước: Ứng dụng để sản xuất HCl. 1.4. Cách khai thác
- Ở những nơi có biển hoặc hồ nước mặn, người ta khai thác NaCl từ nước mặn trên.
Cho nước mặn bay hơi từ từ, thu được muối kết tinh.
- Ở những nơi có mỏ muối, người ta đào hầm hoặc giếng sâu đến mỏ muối để lấy
muối lên. Muối mỏ sau khi khai thác, được nghiền nhỏ và tinh chế để có muối sạch. 1.5. Ứng dụng
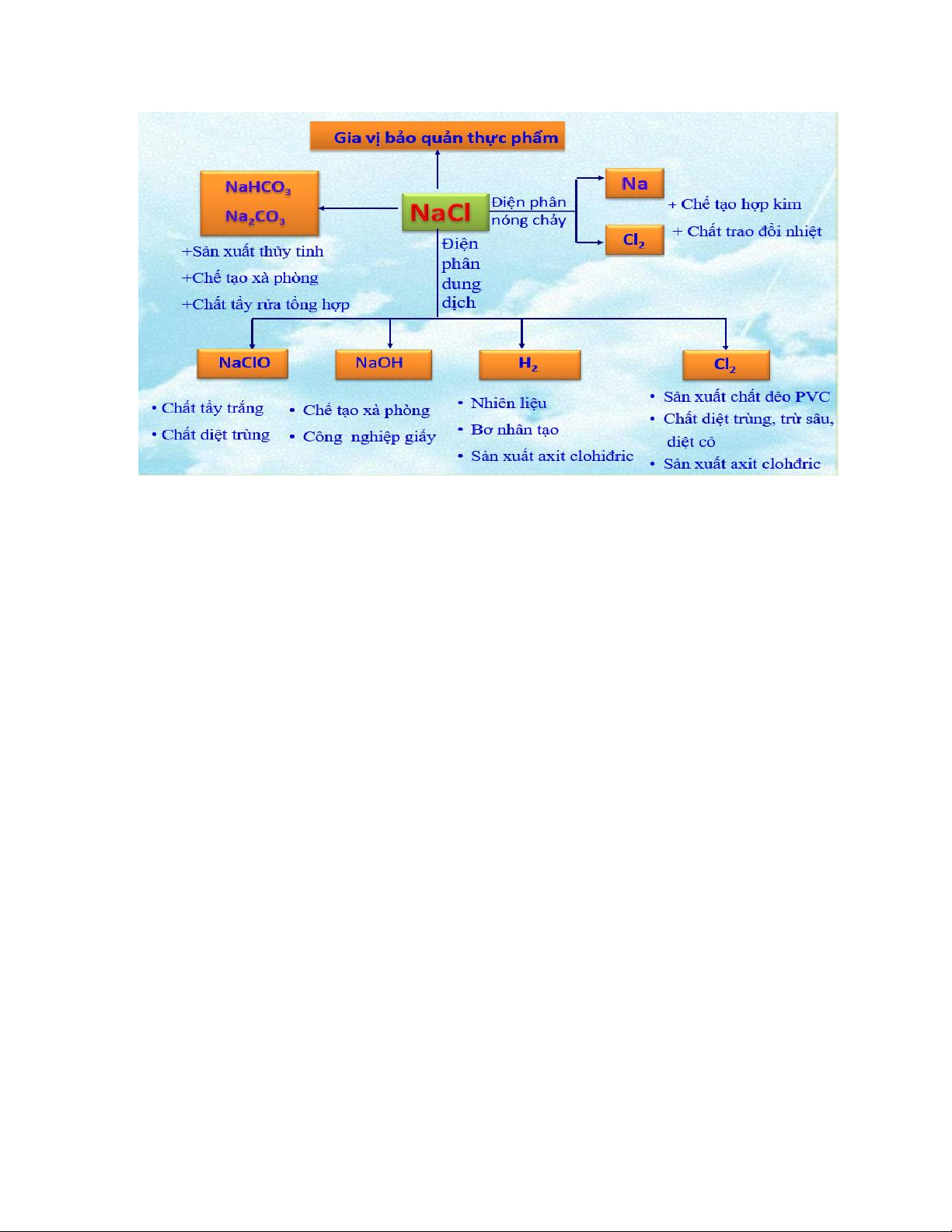
Muối NaCl có rất nhiều ứng dụng trong đời sống và sản xuất, nó được dùng để:
- Làm gia vị và bảo quản thực phẩm. Muối iot là muối ăn NaCl có trộn thêm một ít KIO3 + KI
- Làm nguyên liệu để sản xuất: Na, NaOH, H2, Cl2, Na2CO3, nước Javen (NaClO),…
Hình 1.2 Ứng dụng của NaCl II. Kali nitrat KNO3
Muối kali nitrat còn có tên gọi là diêm tiêu, là chất rắn màu trắng. Trong tự nhiên
chỉ có 1 lượng nhỏ kali nitrat. 1.1. Tính chất:
- KNO3 là chất rắn, tan nhiều trong nước, khi tan thu nhiệt, o - KNO t
3 bị nhiệt phân: 2KNO3 2KNO2 + O2 1.2. Ứng dụng:
- Dùng chế tạo thuốc nổ - Làm phân bón
- Bảo quản thực phẩm trong công nghiệp.
II. Bài tập mở rộng củng cố
Câu 1. Trong tự nhiên muối natri clorua có nhiều trong A. Nước mưa B. Nước biển C. Nước giếng khoan D. Cây cối thực vật
Câu 2. Thuốc thử dùng để phân biệt Na2SO4 và Na2SO3 A. Dung dịch AgNO3 B. Dung dịch NaOH C. Dung dịch BaCl2 D. Dung dịch HCl
Câu 3. Muối nào dưới đây bị nhiệt phân hủy A. NaCl B. FeS2 C. KNO3 D. CuCl2
Câu 4. Ứng dụng nào dưới đâykhông phải là ứng dụng của NaCl
A. Chế tạo thuốc nổ đen
B. Gia vị và bảo quan thực phẩm
C. Làm nguyên liệu sản xuất NaOH
D. Làm nguyên liệu cơ bản cho nhiều ngành công nghiệp hóa chất.
Câu 5. Cặp chất nào dưới đây không thể tồn tại trong cùng một dung dịch. A. NaNO3 và HCl B. NaNO3 và BaCl2 C. K2SO4 và BaCl2 D. BaCO3 và NaCl
Câu 6. Trường hợp nào sau đây có phản ứng tạo sản phẩm là chất kết tủa màu xanh?
A. Cho AgNO3 tác dụng với dung dịch NaCl
B. Cho Zn vào dung dịch AgNO3.
C. Cho dung dịch NaOH vào dung dịch FeCl3.
D. Cho dung dịch KOH vào dung dịch CuSO4.
Câu 7. Cho 400 gam dung dịch KOH 5,6% vào dung dịch CuCl2 dư, sau phản ứng
thu được lượng chất kết tủa là:
A. 19,6 gam B. 9,8 gam C. 4,9 gam. D. 17,4 gam.
Câu 8. Phản ứng biểu diễn đúng sự nhiệt phân của muối bari cacbonat (phản ứng đều có nhiệt độ) A. 2BaCO3 → 2BaO + CO + O2 B. 2BaCO3 → 3BaO + CO2 C. BaCO3 → BaO + CO2 D. 2BaCO3 → 2Ba + CO2 + O2
Câu 9. Cho x gam Na2CO3 vào dung dịch HCl, sau phản ứng thu được 3,36 lít khí ở
đktc. Tính giá trị của x là
A. 20,70 B. 10,35 C. 41,40 D. 31,05
Câu 10. Muối tan trong nước là
A. Cu3(PO4)2 B. AgCl C. K3PO4 D. Ag3PO4
III. Đáp án bài một số muối quan trọng Câu 1 Câu 2 Câu 3 Câu 4 Câu 5 B D C A C Câu 6 Câu 7 Câu 8 Câu 9 Câu 10 D A C A C
Câu 7. mdd KOH = mdd KOH . C% = 400.5,6% = 22,4 gam
=> nKOH = mKOH: MKOH = 22,4/56 = 0,4 mol
Phương trình hóa học: 2KOH + CuCl2→ Cu(OH)2 ↓+ 2KCl Theo phương trình: 2 1 Phản ứng: 0,4 mol x mol
Từ phương trình hóa học ta có nCu(OH)2= 1/2 nKOH = 0,2 mol
=> mCu(OH)2= nCu(OH)2 . MCu(OH)2 = 0,2.(64 + 2.16 + 2) = 19,6 gam Câu 9. Phương trình hóa học:
K2CO3 + 2HCl → 2KCl + CO2 ↑ + H2O 0,15 → 0,15 nCO2 = 3,36/22,4 = 0,15 mol
Theo phương trình hóa học: nK2CO3 = nCO2 = 0,15 mol nK2CO3 = nCO2 = 0,15 mol
=> x = mK2CO3= 0,15.138 = 20,7 gam




