Preview text:
HÓA HỌC 9 BÀI 14: THỰC HÀNH
TÍNH CHẤT HÓA HỌC CỦA BAZƠ VÀ MUỐI
I. Dụng cụ hóa chất
1. Dụng cụ thí nghiệm
Giá để ống nghiệm, ống nhỏ giọt, cốc nước, kẹp ống nghiệm
2. Hóa chất thí nghiệm
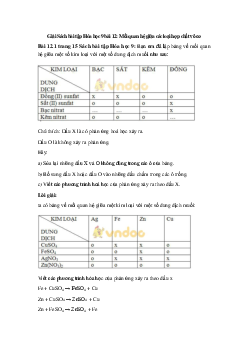
Dung dịch NaOH, dung dịch HCl, dung dịch H2SO4, dây đồng, dung dịch
BaCl2, dung dịch AgNO3, dung CuSO4
II. Tiến hành thí nghiệm
1. Tính chất hóa học của bazơ
Thí nghiệm 1: Natri hidroxit tác dụng với muối
Cách tiến hành thí nghiệm: Nhỏ vài giọt dung dịch NaOH vào ống nghiệm
chứa 1ml dung dịch FeCl3. Lắc nhẹ ống nghiệm
Hiện tượng: Xuất hiện kết tủa màu nâu đỏ
Giải thích: Dung dịch sau phản ứng tạo thành có kết tủa màu nâu đỏ vì chất
mới sinh ra là Fe(OH)3 có màu nâu đỏ.
Phương trình phản ứng hóa học:
3NaOH + FeCl3 → 3NaCl + Fe(OH)3
Thí nghiệm 2: Đồng (II) hidroxit tác dụng với axit
Cách tiến hành: Cho một ít Cu(OH)2 vào đấy ống nghiệm, nhỏ vài giọt dung
dịch HCl. Lắc nhẹ ống nghiệm.
Hiện tượng: Kết tủa tan dung dịch có màu xanh lam
Giải thích: Kết tủa tan ra có màu xanh lam do HCl phản ứng với Cu(OH)2 tạo
ra muối CuCl2 ( muối của đồng có màu xanh làm)
Phương trình hóa học:
Cu(OH)2 + 2HCl → CuCl2 + 2H2O
2. Tính chất hóa học của muối
Thí nghiệm 3: Đồng (II) sunfat tác dụng với kim loại
Cách tiến hành thí nghiệm: Ngâm đinh sắt nhỏ, sạch trong ống nghiệm có
chứa 1ml dung dịch CuSO4. Để khoảng 4-5 phút
Hiện tượng: Xuất hiện chất rắn màu đỏ bám vài đinh sắt.
Giải thích: Fe đẩy Cu ra khỏi dung dịch muối CuSO4, chất rắn màu đỏ là (Cu)
bám trên bề mặt đinh sắt.
Phương trình phản ứng hóa học: Fe + CuSO4 → FeSO4 + Cu
Thí nghiệm 4: Bari clorua tác dụng với muối
Cách tiến hành thí nghiệm: Nhỏ vài giọt dung dịch BaCl2 vào ống nghiệm có
chứa 1 ml dung dịch Na2SO4
Hiện tượng: Dung dịch sau phản ứng xuất hiện kết tủa trắng.
Giải thích: Do BaCl2 tác dụng với Na2SO4 tạo kết tủa trắng BaSO4
Phương trình hóa học:
BaCl2 + Na2SO4 → BaSO4 + 2NaCl
Thí nghiệm 5: Bari clorua tác dụng với axit
Cách tiến hành thí nghiệm: Nhỏ vài giọt dung dịch BaCl2 vào ống nghiệm có chứa 1ml dung dịch H2SO4
Hiện tượng: Dung dịch xuất hiện kết tủa trắng
Giải thích: Do BaCl2 tác dụng với H2SO4 tạo ra kết tủa màu trắng BaSO4
Phương trình phản ứng hóa học
BaCl2 + H2SO4 → BaSO4 + 2HCl
III. Bản tường trình Số thí nghiệm Tiến hành thí Hiện tượng, giải Phương trình hóa nghiệm thích học Thí nghiệm 1 Thí nghiệm 2 Thí nghiệm 3 Thí nghiệm 4 Thí nghiệm 5