

Preview text:
HÓA HỌC 9 BÀI 8: MỘT SỐ BAZƠ QUAN TRỌNG
I. Tóm tắt nội dung kiến thức trọng tâm A. Natri hiđroxit
1. Tính chất vật lí
- Là chất rắn, không màu, hút ẩm mạnh, tan nhiều trong nước, tỏa nhiệt
- Dung dịch NaOH có tính nhờn, làm bục vải giấy, làm mòn da, còn được gọi là dung dịch xút hoặc xút ăn da.
2. Tính chất hóa học
NaOH có những tính chất hóa học của một bazơ tan
a. Làm đổi màu chất chỉ thị
- Đổi màu quỳ tím thành xanh.
- Dung dịch phenolphthalein không màu thành màu hồng.
b. Tác dụng với axit (Tạo thành muối và nước) NaOH + HCl → NaCl + H2O
c. Tác dụng với oxit axit (tạo thành muối và nước) 2NaOH + CO2 → Na2CO3 + H2O 3. Ứng dụng
Có nhiều ứng dụng rộng rãi trong công nghiệp và đời sống
- Sản xuất xà phòng, chất tẩy rửa, bột giặt
- Sản xuất tơ nhân tạo - Sản xuất giấy - Chế biến dầu mỏ
- Dùng nhiều trong ngành công nghiệp hóa chất khác 4. Sản xuất NaOH
Phương pháp: điện phân dung dịch NaCl bão hòa
- Thùng điện phân có màng ngăn giữa 2 cực 2NaCl + 2H2O dpdd
2NaOH + H2 + Cl2 (có màng ngăn)
B. Canxi hiđroxit - Thang pH 1. Tính chất
a. Cách pha chế dung dịch Ca(OH)2
- Có tên gọi thông thường là nước vôi trong.
- Để có được nước vôi trong tiến hành hòa tan 1 ít vôi tôi Ca(OH)2 trong nước, ta được nước
vôi (hay còn gọi vôi sữa), lọc vôi nước thu được chất lỏng trong suốt, không màu là dung
dịch Ca(OH)2. còn được gọi là nước vôi trong.
b. Tính chất hóa học
Ca(OH)2 mang đầy đủ tính chất hóa học của một dung dịch bazơ tan.
- Làm đổi màu chỉ thị: quỳ tím chuyển thành màu đỏ, phenolphtalenin thành màu hồng
- Tác dụng với axit (tạo ra muối và nước)
Ca(OH)2 + 2HCl → CaCl2 + 2H2O
- Tác dụng với oxit axit (tạo ra muối và nước) Ca(OH)2 + CO2 → CaCO3 + H2O c. Ứng dụng
- Làm vật liệu trong xây dựng
- Khử chua đất trồng trọt
Khử độc các chất thải công nghiệp, diệt trùng chất thải sinh hoạt và xác chết động vật,… 2. Thang pH
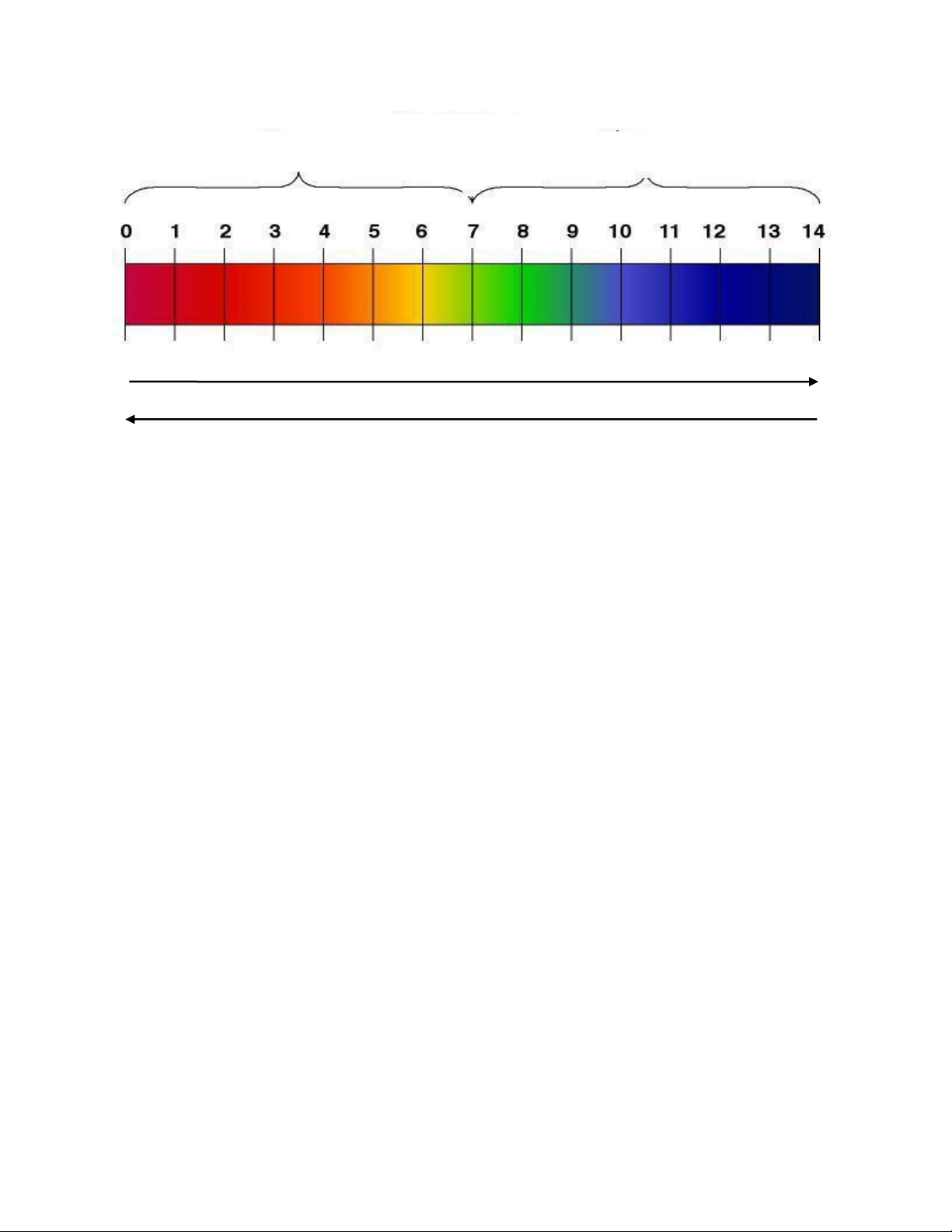
Nếu pH = 7 → Dung dịch trung tính (không có tính axit, không có tính ba zơ)
Nếu PH <7 → Dung dịch có tính axit. pH càng nhỏ, độ axit càng lớn
Nếu pH>7 → Dung dịch có tính ba zơ. pH càng lớn, độ bazơ càng mạnh. pH Axit Kiềm Trung tính
Độ bazơ tăng dần Độ axit tăng dần
II. Bài tập mở rộng củng cố
Câu 1. Dung dịch có pH > 7 là A. NaOH B. CuO C. HCl D. KCl
Câu 2. Dung dịch NaOH có thể phản ứng được với dãy chất hóa học nào sau đây A. HCl, Na2O, CO2 B. CO2, SO2, H2SO4 C. H2SO4, KCl, CO2 D. MgO, SO2, HCl
Câu 3. Dãy hóa chất nào dưới đây đều tác dụng được với dung dịch Ca(OH)2? A. CO2, HCl, Na2O B. BaO, HCl, Ca(HCO3)2 C. HCl, BaO, CO2 D. P2O5, HCl, Na2CO3
Câu 4. Cho phản ứng sau: NaCl + H2O dpdd
X + H2 + Cl2 (có màng ngăn) X là: A. Na B. NaOH C. Na2O D. NaHCO3
Câu 5. Dãy gồm bazơ tan trong nước là:
A. NaOH, Ca(OH)2, KOH và Cu(OH)2
B. NaOH, Ca(OH)2, Cu(OH)2 và Zn(OH)2
C. NaOH, CaOH)2, Ba(OH)2 và KOH
D. NaOH, KOH, Ca(OH)2 và Ba(OH)2
Câu 6. Dung dịch Ba(OH)2 không có tính chất hóa học nào sau đây
A. Làm quỳ tím chuyển sang màu xanh B. Tác dụng với axit C. Bị nhiệt phân
D. Tác dụng với oxit axit
Câu 7. Dung dịch nào dưới đây có pH <7 A. KCl B. HCl C. KOH D. NaCl
Câu 8. Có 3 lọ mất nhãn, mỗi lọ đựng riêng biệt các dung dịch sau: NaCl, NaOH, Ba(OH)2
Thuốc thử để nhận biết các chất trên là:
A. Quỳ tím và dung dịch NaCl B. Quỳ tím và Na2SO4
C. Quỳ tím và dung dịch HCl
D. Nước và dung dịch KOH
Câu 9. Để trung hòa hoàn toàn dung dịch chứa 8 gam NaOH cần 50 ml dung dịch H2SO4.
Nồng độ mol của dung dịch H2SO4 đã dùng là: A. 1M B. 0,1M C. 2M D. 0,2M
Câu 10. Dẫn 1,12 lít khí CO2 (đktc) và 56 gam dung dịch NaOH 15%. Khối lượng mỗi chất
có trong dung dịch thu được sau phản ứng là: A. 2,8 gam và 7,9 gam B. 5,6 gam và 6 gam C. 5,6 gam và 7,9 gam D. 2,8 gam và 6 gam
III. Đáp án - Hướng dẫn giải 1A 2B 3D 4B 5D 6C 7B 8B 9C 10A Câu 9. nNaOH = 840 = 0,2 mol
2NaOH + H2SO4 → Na2SO4 + 2H2O 0,2 → 0,1 nH ct 0,1 2SO4 ( ) C = = . = 2M M V 0, 05 H2SO4 (dd ) Câu 10. C%.mdd 100% n = = 0,15 mol KOH 56 nCO2 = 1,12/22,4 = 0,05 mol Xét tỉ lệ số mol: n 0,15 KOH T = =
= 3 > 2 => Sản phẩ là muối K2SO3 và dư KOH. n 0, 05 CO2 2KOH + SO2 → K2SO3 + H2O 0,05 0,1 0,05 mK2SO3 = 0,05.158 = 7,9 gam
nKOH phản ứng: nKOH = 2.nSO2 = 2.0,05 = 0,1 mol
nKOH dư = 0,15 - 0,1 = 0,05 mol => mKOH = 0,05.56 = 2,8 (gam)