


















Preview text:
lOMoAR cPSD| 58490434 lOMoAR cPSD| 58490434 MỤC LỤC Nội dung Trang
BÀI 1 LIÊN KẾT CỘNG HÓA TRỊ VÀ HÌNH DẠNG PHÂN TỬ ........................................ 3
1.1 Công thức Lewis ............................................................................................................ 3
1.2 Nhóm chức ......................................................................................................................
5 1.3 Góc liên kết và hình dạng phân tử ...............................................................................
6 1.4 Hiệu ứng điện tử trong hóa học hữu cơ .......................................................................
8 ❖ Câu hỏi (bài tập) củng cố .............................................................................................. 11 BÀI 2 ALKANE VÀ
CYCLOALKANE
.................................................................................. 14 2.1 Cấu tạo của alkane
...................................................................................................... 14 2.2 Đồng phân cấu tạo
(Constitutional isomerism) của alkane ..................................... 15 2.3 Danh pháp của
alkane ................................................................................................. 15 2.4 Cycloalkane
.................................................................................................................. 18
2.5 Cấu dạng (Conformation) của alkane và cycloalkane ............................................. 19
2.6 Đồng phân cis, trans trong cycloalkane ..................................................................... 23
2.7 Tính chất vật lý ............................................................................................................ 25
2.8 Phản ứng của alkane ................................................................................................... 25
2.9 Ứng dụng ...................................................................................................................... 26
2.10 Giới thiệu riêng về methane ...................................................................................... 27
❖ Câu hỏi (bài tập) củng cố .............................................................................................. 28
BÀI 3 ĐỒNG PHÂN LẬP THỂ .............................................................................................
31 3.1 Tính quang hoạt ...........................................................................................................
31 3.2 Chiral (tính chất không trùng vật - ảnh) ...................................................................
33 3.3 Cấu hình tương đối và cấu hình tuyệt đối .................................................................
36 3.4 Ý nghĩa khoa học và thực tiễn của hóa học lập thể .................................................. 39
3.4.1 Ý nghĩa khoa học và thực tiễn của hóa học lập thể trong hóa dược .................... 39
3.4.2 Ý nghĩa khoa học và thực tiễn của hóa học lập thể trong hóa sinh...................... 41
3.4.3 Ý nghĩa khoa học và thực tiễn của hóa học lập thể trong nông nghiệp ............... 41
3.4.4 Ý nghĩa khoa học và thực tiễn của hóa học lập thể trong vật liệu ....................... 42
Cách biểu diễn một phân tử chiral trên mặt phẳng giấy ............................................... 43
❖ Câu hỏi (bài tập) củng cố .............................................................................................. 43
BÀI 4 ACID - BASE ...............................................................................................................
46 4.1 Acid và base Arrhenius ...............................................................................................
46 4.2 Acid và base Bronsted – Lowry ..................................................................................
46 4.3 Hằng số phân ly acid, pKa ...........................................................................................
48 4.4 Cân bằng trong phản ứng acid base ..........................................................................
49 4.5 Cấu tạo phân tử và tính acid ...................................................................................... 50
4.6 Acid và base Lewis .......................................................................................................
52 ❖ Câu hỏi (bài tập) củng cố ..............................................................................................
53 BÀI 5 ALKENE
....................................................................................................................... 55 5.1 Cấu tạo
của alkene ....................................................................................................... 55 5.2 Danh
pháp .................................................................................................................... 56 5.3 Tính
chất vật lý ............................................................................................................ 57 5.4 Tính
chất hóa học ........................................................................................................ 57 lOMoAR cPSD| 58490434
5.5 Ứng dụng ......................................................................................................................
65 ❖ Câu hỏi (bài tập) củng cố ..............................................................................................
66 BÀI 6 ALKYNE
....................................................................................................................... 68
6.1 Cấu tạo của alkyne ...................................................................................................... 68
6.2 Danh pháp .................................................................................................................... 68
6.3 Phân loại ....................................................................................................................... 69
6.4 Tính chất vật lý ............................................................................................................ 69
6.5 Tính acid của 1 – Alkyne ............................................................................................. 69
6.6 Điều chế alkyne ............................................................................................................ 70
6.7 Phản ứng cộng electrophile của alkyne ..................................................................... 71
6.8 Phản ứng hydrate hóa alkyne tạo aldehyde và ketone ............................................. 73
6.9 Phản ứng khử của alkyne............................................................................................ 74
6.10 Ứng dụng .................................................................................................................... 75
❖ Câu hỏi (bài tập) củng cố .............................................................................................. 75
BÀI 7 HALOALKANE VÀ PHẢN ỨNG HALOGEN HÓA VÀ PHẢN ỨNG GỐC TỰ DO lOMoAR cPSD| 58490434
..................................................................................................................................................
78 7.1 Cấu tạo của haloalkane ...............................................................................................
78 7.2 Danh pháp ....................................................................................................................
78 7.3 Tính chất vật lý của haloalkane..................................................................................
78 7.4 Điều chế haloalkane bằng phản ứng halogen hóa alkane ........................................
81 7.5 Phản ứng halogen hóa tại carbon allyl ......................................................................
83 7.6 Phản ứng cộng HBr vào alkene theo cơ chế gốc tự do .............................................
84 7.7 Vài nét về ứng dụng thực tiễn và tác hại của một số nhóm alkyl halide đối với môi trường
................................................................................................................................. 85 ❖ Câu
hỏi (bài tập) củng cố .............................................................................................. 86 BÀI 8
PHẢN ỨNG THẾ VÀ PHẢN ỨNG KHỬ .................................................................. 88 8.1
Một số khái niệm.......................................................................................................... 88 8.2
Phản ứng thế thân hạch (Nucleophilic Substitution) ............................................... 91 8.3
Phản ứng tách (Elimination reaction) ..................................................................... 100 8.4
Sự cạnh tranh giữa phản ứng SN1, SN2, E1, E2 ...................................................... 105 ❖
Câu hỏi (bài tập) củng cố ............................................................................................ 107
BÀI 9 ALCOHOL..................................................................................................................
111 9.1 Cấu tạo và danh pháp ...............................................................................................
111 9.3 Tính acid và tính base của alcohol ...........................................................................
112 9.4 Phản ứng của alcohol với kim loại hoạt động .........................................................
113 9.5 Sự chuyển đổi alcohol thành haloalkane và sulfonate............................................
114 9.7 Phản ứng oxi hóa alcohol ..........................................................................................
120 9.8 Rượu và sức khỏe con người .....................................................................................
122 ❖ Câu hỏi (bài tập) củng cố ............................................................................................ 123 BÀI 10 ETHER, SULFIDE VÀ EPOXIDE
......................................................................... 126 10.1 Ether
......................................................................................................................... 126 10.2
Epoxide ..................................................................................................................... 130 10.3
Sulfide ....................................................................................................................... 132 ❖
Câu hỏi (bài tập) củng cố ............................................................................................ 133
BÀI 11 HỢP CHẤT CƠ KIM ...............................................................................................
136 11.1 Hợp chất cơ magnesium và hợp chất cơ lithium ..................................................
136 11.2 Tác chất lithium dialkylcuprate (Tác chất Gilman) .............................................
139 ❖ Câu hỏi (bài tập) củng cố ............................................................................................ 139 TÀI LIỆU THAM KHẢO
................................................................................................... 141
❖ Mục tiêu học tập: Sau khi học xong bài này, người học có thể:
- Trình bày sự hình thành liên kết hóa học. - Vẽ công thức cấu tạo theo Lewis.
- Phân loại các nhóm chức trong hóa học hữu cơ.
- Trình bày hiệu ứng trong hóa học hữu cơ.
- Sử dụng đúng mũi tên cong để chỉ sự di chuyển của electron.
- Phân biệt các loại liên kết, Dự đoán góc liên kết và hình dạng phân tử. lOMoAR cPSD| 58490434
BÀI 1 LIÊN KẾT CỘNG HÓA TRỊ VÀ HÌNH DẠNG PHÂN TỬ
1.1 Công thức Lewis
1.1.1 Sự hình thành liên kết hóa học
Theo Lewis, nguyên tử tham gia tạo liên kết hóa học cần đạt được cấu hình electron bão
hòa của lớp ngoài cùng, giống như của nguyên tử khí hiếm. Nguyên tử đạt được lớp hóa trị bão hòa theo hai cách.
(1) Nguyên tử cho hoặc nhận electron để đạt được lớp hóa trị bão hòa . Nguyên tử nhận
electron trở thành anion (mang điện tích âm), nguyên tử cho electron trở thành cation
( mang điện tích dương). Ion mang điện tích âm và ion mang điện tích dương tương tác
với nhau hình thành tinh thể ion như sodium chloride (NaCl), trong đó mỗi ion mang điện
tích dương sẽ được bao quanh bởi các ion mang điện tích âm và ngược lại . Ta gọi tương
tác này là tương tác ion.
(2) Nguyên tử có thể dùng chung electron với một hoặc nhiều nguyên tử khác để đạt được
lớp hóa trị bão hòa. Liên kết hóa học được tạo thành do sự dùng chung electron gọi là liên kết cộng hóa trị.
Liên kết có một phần liên kết ion và một phần liên kết cộng hóa trị gọi là liên kết cộng hóa trị phân cực.
1.1.2 Độ âm điện và liên kết hóa học
Bảng 1.1 Giá trị độ âm điện cho các nguyên tử lOMoAR cPSD| 58490434
Phân loại liên kết hóa học dựa vào sự chênh lệch độ âm điện giữa hai nguyên tử liên kết
với nhau được thể hiện ở bảng 1.2 phân loại liên kết hóa học.
Bảng 1.2 Phân loại liên kết hóa học
Chênh lệch độ âm điện giữa hai nguyên tử Loại liên kết Nhỏ hơn 0.5
Cộng hóa trị không phân cực (Nonpolar covalent) Từ 0.5 đến 1.9 Cộng hóa trị phân cực (Polar covalent) Lớn hơn 1.9 Ion
Trong liên kết cộng hóa trị phân cực, nguyên tử có độ âm điện lớn hơn sẽ hút cặp electron
liên kết về phía nó, nên nó có điện tích âm riêng phần, ký hiệu là
, nguyên tử có độ âm điện
nhỏ hơn sẽ có điện tích dương riêng phần, ký hiệu là
. Ta dùng mũi tên để biểu diễn cho
liên kết cộng hóa trị phân cực với đầu mũi tên hướng về nguyên tử có độ âm điện lớn. H Cl H Cl
Độ phân cực của liên kết cộng hóa trị được đo lường bằng vectơ gọi là moment lưỡng cực
liên kết (bond dipole moment), ký hiệu là µ.
1.1.3 Công thức Lewis cho phân tử và ion đa nguyên tử Lưu
ý khi vẽ công thức Lewis:
(1) Xác định số electron hóa trị trong phân tử hoặc ion.
(2) Xác định sự sắp xếp giữa các nguyên tử trong phân tử.
(3) Nối các nguyên tử với nhau bằng liên kết đơn. Sắp xếp các electron còn lại cho các
nguyên tử sau cho tất cả các nguyên tử đều đạt quy tắc bát tử (8 electron ở lớp ngoài
cùng cho các nguyên tử ngoại trừ hydrogen là 2 electron ở lớp ngoài cùng).
(4) Cặp electron liên kết giữa hai nguyên tử được biểu diễn bằng đường gạch đơn, còn cặp
electron không liên kết được biểu diễn bằng hai chấm.
(5) Hai nguyên tử có thể liên kết với nhau bằng liên kết đơn, liên kết đôi, hoặc liên kết ba.
(6) Đa số trong các phân tử thì: xung quanh nguyên tử carbon có 4 cặp electron liên kết,
xung quanh nguyên tử nitrogen có 3 cặp electron liên kết và 1 cặp electron không liên
kết, xung quanh nguyên tử oxygen có 2 cặp electron liên kết và 2 cặp electron không
liên kết, xung quanh nguyên tử halogen có 1 cặp electron liên kết và 3 cặp electron không liên kết. lOMoAR cPSD| 58490434 H O H H N H H H Cl H H CH H H2O NH3 CH4 HCl Hydrogen chloride Nước Ammonia Methane H H H C C H H HH O C C C O OO C H H H C2H2 CH2O H2CO3 Acid C2H4 Ethylene Acetylene Formaldehyde carbonic
Bảng 1.3 Công thức Lewis cho một vài hợp chất lOMoAR cPSD| 58490434
1.2 Nhóm chức 1.2.1 Alcohol
Alcohol là hợp chất hữu cơ có chứa nhóm – OH (hydroxyl) liên kết với carbon tứ diện c
( arbon liên kết với bốn nguyên tử). Ví dụ như ethanol. H H C O H
H C C O H H H
A l c o h o l
E t h a n o l
Chúng ta cũng có thể biểu diễn alcohol bằng công thức cấu tạo rút gọn. Ví dụ ethanol là
CH 3 CH 2 OH hay CH 3 – CH 2 – OH.
Alcohol được phân loại thành alcohol bậc 1 (1o o
– primary), alcohol bậc 2 (2 – secondary) và alcohol bậc 3 (3 o
– tertiary) phụ thuộc vào số nguyên tử carbon liên kết với carbon mang nhóm – OH. H H C H 3
H 3 C C O H
H 3 C C O H
H 3 C C O H H C H 3 C H 3
A l c o h o l 1 o
A l c o h o l 2 o
A l c o h o l 3 o 1.2.2 Amine
Amine là hợp chất hữu cơ có chứa nhóm amino, trong đó nguyên tử nitrogen liên kết với lOMoAR cPSD| 58490434
một, hai hoặc ba nguyên tử carbon bằng liên kết đơn. Amine được phân loại amine bậc 1 –
nguyên tử nitrogen liên kết với một nguyên tử carbon, amine bậc 2 – nguyên tử nitrogen liên
kết với hai nguyên tử carbon và amine bậc 3 – nguyên tử nitrogen liên kết với ba nguyên tử carbon. N HH N H3CH H3C N H H H H3C N CH3 CH3 CH3 Ammonia Methylamine Dimethylamine Trimethylamine (amine 1o) (amine 2o) (amine 3o)
1.2.3 Aldehyde và ketone
Nhóm chức có trong aldehyde và ketone là nhóm C=O (carbonyl). Formaldehyde, CH2O,
Để dự đoán góc liên kết trong phân tử hoặc ion, ta lưu ý đến thuyết đẩy các cặp electron ở
lớp hóa trị (valence-shell electron pair repulsion – VSEPR).
Sau đây ta dùng thuyết VSEPR để dự đoán góc liên kết trong phân tử methane, CH4. Công
thức Lewis của CH4 cho thấy xung quanh nguyên tử carbon có bốn vùng electron. Mỗi vùng lOMoAR cPSD| 58490434
chứa một cặp electron liên kết với một nguyên tử hydrogen. Theo VSEPR, bốn vùng electron
này nằm ở những vị trí sao cho khoảng cách giữa chúng là xa nhất, và vị trí phù hợp là khi góc
giữa hai cặp electron là 109,5o, và hình dạng phân tử là dạng tứ diện. Góc liên kết H – C – H
trong methane thực nghiệm đo được là 109,5o.
Ta dự đoán hình dạng của phân tử ammonia, NH3 theo cách tương tự. Công thức Lewis
của NH3 cho thấy xung quanh nguyên tử nitrogen có bốn vùng electron. Trong đó, ba vùng
chứa cặp electron liên kết với nguyên tử hydrogen và một vùng chứa cặp electron không liên
kết. Theo VSEPR, ta dự đoán rằng bốn vùng electron này sắp xếp theo dạng tứ diện, góc liên
kết H – N – H là 109,5o và hình dạng phân tử là hình tháp đáy tam giác. Góc thực nghiệm quan
sát được là 107,3o. Có sự khác biệt nhỏ giữa độ lớn góc liên kết dự đoán và thực nghiệm được
giải thích là do cặp electron không liên kết đẩy cặp electron kế bên mạnh hơn so với cặp lOMoAR cPSD| 58490434 electron liên kết.
Hình 1. 1 Công thức Lewis và hình dạng phân tử của methane
( a) Công thức Lewis ( b) Hình dạng phân tử
Ta xét tiếp một số phân tử có nguyên tử được bao xung quanh bởi ba vùng electron như
trong phân tử formaldehyde và ethylene .
Theo VSEPR, liên kết đôi được xem như một vùng electron. Trong formaldehyde, xung
quanh nguyên tử carbon có ba vùng electron, hai vùng chứa liên kết đơn C – H và một vùng
chứa liên kết đôi C = O. Trong ethylene, mỗi nguyên tử carbon cũng được bao quanh bởi ba vùng electron.
Ba vùng electron ở xa nhau nhất khi chúng đồng phẳng và tạo thành một góc 120o, dạng
tam giác phẳng. Vì vậy, dự đoán góc H – C – H và H – C – O trong formaldehyde và góc H
– C – H và H – C – C trong ethylene là 120o, và tất cả các nguyên tử đều đồng phẳng. Góc liên
kết thực nghiệm có giá trị khá gần với góc dự đoán.
Những dạng khác của phân tử, nguyên tử trung tâm được bao xung quanh bởi hai vùng
electron như carbon dioxide (CO2) và acetylene (C2H2).
Trong carbon dioxide, carbon được bao xung quanh bởi hai vùng electron. Mỗi vùng chứa
hai cặp electron. Trong acetylene, mỗi carbon được bao xung quanh bởi hai vùng electron. Một
vùng chứa cặp electron tạo liên kết đơn, và một vùng chứa ba cặp electron tạo liên kết ba. Trong lOMoAR cPSD| 58490434
mỗi trường hợp, hai vùng electron này ở xa nhất khi chúng nằm thẳng hàng với nhau qua
nguyên tử trung tâm tạo nên một góc 180o. Cả carbon dioxide và acetylene đều lOMoAR cPSD| 58490434
Để có thể phân loại hiệu ứng cảm, người ta qui ước chọn nguyên tử hydrogen để so sánh
(nối C – H được xem như không phân cực I = 0). Hiệu ứng cảm chia ra hai loại: (1) nguyên tử
hay nhóm nguyên tử có khuynh hướng đẩy điện tử (hút điện tử yếu hơn hydrogen) gây hiệu
ứng cảm dương I+. (2) nguyên tử hay nhóm nguyên tử có khuynh hướng hút điện tử (hút điện
tử mạnh hơn hydrogen) gây hiệu ứng cảm âm I –.
Hiệu ứng cảm có tính chất sau: chỉ liên quan đến điện tử của nối đơn , truyền dọc theo
mạch , giảm dần ảnh hưởng khi càng xa tâm gây ra hiệu ứng.
Các nhóm gây hiệu ứng cảm âm I – :
+ Các halogen khi độ âm điện càng lớn thì hiệu ứng càng mạnh (– F > – Cl > – Br >– I).
+ Các nhóm mang điện tích dương: – NR + + + +
3 , – PR3 , – OR2 , – SR2 .
+ Các nhóm trung hòa có nguyên tử có độ âm điện lớn: – NH2, – OH, – SH, – NR2, – PR2
+ Các nhóm trung hòa có nối lưỡng cực: – NO2, – SO3H, – C=O.
Các nhóm gây hiệu ứng cảm dương I + :
+ Các nhóm alkyl có hiệu ứng cảm I + yếu: gia tăng theo thứ tự sau đây: lOMoAR cPSD| 58490434 CH3 CH3 CH3 < CH2CH3 < CH CH3 < C CH3 CH3
+ Các nhóm có nguyên tử mang điện tích âm: như oxide, sulfur,… cho điện tử tương đối
dễ dàng. Như vậy, gây hiệu ứng I+ mạnh: O: < S:
1.4.2 Hiệu ứng cộng hưởng (Resonance effect)
Trong một liên kết đôi cô lập, sự khác biệt giữa hai nguyên tử nối hoặc giữa các nhóm thế
gắn trên 2 nguyên tử nối đưa đến một sự bất đối xứng tương tự như hiệu ứng cảm trong nối
. Nhưng một hiện tượng mới xuất hiện trong các phân tử có liên kết đôi tiếp cách (conjugate).
Trong trường hợp này, sự phân phối điện tử khác hẳn sự phân phối trong các cơ cấu có nối hóa
trị thông thường, và không một cơ cấu nối cộng hóa trị riêng biệt nào thích hợp với tất cả tính
chất của phân tử. Một số lý tính và hóa tính của các chất này được giải thích thỏa đáng bởi sự
lai hóa của nhiều cấu tạo Lewis, gọi là công thức cộng hưởng, chúng khác nhau ở vị trí các điện tử.
a) Sự phân cực của nối đôi cộng hóa trị
Xét nối cộng hóa trị đôi C=O trong phân tử formaldehyde. Nguyên tử oxygen có độ âm
điện lớn hơn nguyên tử carbon nên hút 2 điện tử của liên kết về phía nó. Ta nói liên kết đôi bị phân cực.
Ta đã biết một nối cộng hóa trị đôi gồm: một nối bền và một nối kém bền. Các điện tử
của nối linh động hơn. Do đó, sự phân cực của liên kết đôi dễ thực hiện hơn sự phân cực của nối đơn.
b) Sự phân cực của nối ba cộng hóa trị
Hiện tượng phân cực nói trên cũng xảy ra dễ dàng với nối ba vì trong nối này ta có: một nối và 2 nối .
Một cách tổng quát, khi có một nối đa giữa 2 nguyên tử có độ âm điện khác nhau, các điện
tử bị hút về phía nguyên tử có độ âm điện lớn, gây nên sự phân cực của nối. ❖ CHÚ THÍCH:
(1) Nối trong liên kết đôi cũng bị phân cực khi 2 nguyên tử nối với nhau có độ âm điện
khác nhau. Tuy nhiên, vì các điện tử linh động hơn điện tử , sự di chuyển của điện tử
gây nên sự phân cực quan trọng hơn. Trong hóa học của carbon, điện tử của nối là do các
điện tử p tạo thành. Tính linh động của điện tử thực ra là của điện tử p, do cách phủ bên
của vân đạo p với nhau tạo thành. lOMoAR cPSD| 58490434
Khi có điều kiện thích hợp các điện tử p của những nhị liên cô lập (cặp electron không
liên kết) cũng có thể bị hút và di chuyển trong phân tử.
(2) Trong trường hợp có liên kết giữa 2 nguyên tử giống nhau ta vẫn có hiệu ứng cộng
hưởng do hai nguyên nhân: Sự linh động của điện tử và Ảnh hưởng của tâm gây hiệu ứng cảm.
c) Định nghĩa hiệu ứng cộng hưởng
Hiệu ứng cộng hưởng là hiện tượng xảy ra khi có sự di chuyển của điện tử hay điện tử p trong phân tử.
Tương tự như hiệu ứng cảm, người ta quy ước:
+ Nguyên tử hay nhóm nguyên tử hút điện tử gây ra hiệu ứng cộng hưởng âm (R-).
+ Nguyên tử hay nhóm nguyên tử đẩy điện tử gây ra hiệu ứng cộng hưởng dương (R+).
Sự di chuyển của điện tử được biểu diễn bằng một mũi tên cong chỉ rõ vị trí và hướng di
chuyển của điện tử (mũi tên chỉ sự di chuyển của electron chứ không phải dùng để chỉ sự di
chuyển của nguyên tử). Mũi tên bắt đầu tại liên kết đôi (liên kết ba) hoặc cặp electron không
liên kết và kết thúc tại nguyên tử có thể nhận một liên kết hoặc tạo một cặp electron không liên
kết trên nguyên tử đó. O O N N O O
Hiệu ứng cộng hưởng có thể truyền trong phân tử khi có:
+ Nối đa tiếp cách (cộng hưởng
): ta có nối đa tiếp cách khi nối đa này cách với nối đa kia một nối đơn . H2C CH CH CH2 H2C CH CH CH2 H2C CH CH CH2
+ Nối đa tiếp cách với nguyên tử có nhị liên p cô lập (cộng hưởng p – ): điện tử cô lập
được gọi là điện tử tự do hoặc điện tử không liên kết. Ta có nối đa và nhị liên cô lập p tiếp cách khi
chúng cách nhau bởi một nối đơn . C H C l :
H 2 C C H H2C Cl:
+ Nối đa tiếp cách với nguyên tử có vân đạo p trống (cộng hưởng p – ): vân đạo p trống
là vân đạo p không có điện tử. lOMoAR cPSD| 58490434
H3C phân cực và liên kết ion? (a) LiF (b) CH3F (c) MgCl2 (d) HCl
Bài 2: Sử dụng biểu tượng và
chỉ sự phân cực của mỗi liên kết cộng hóa trị sau: (a) C – Cl (b) S – H (c) C – S (d) P – H
Bài 3: Viết công thức Lewis cho các hợp chất và ion sau. Không có hợp chất nào ở dạng vòng. (a) Hydrogen peroxide, H2O2 (b) Hydrazine, N2H4 (c) Methanol, CH3OH (d) Ion amide, NH - - 2
(e) Ion bicarbonate, HCO3 (f) Ion acetate, CH3COO-
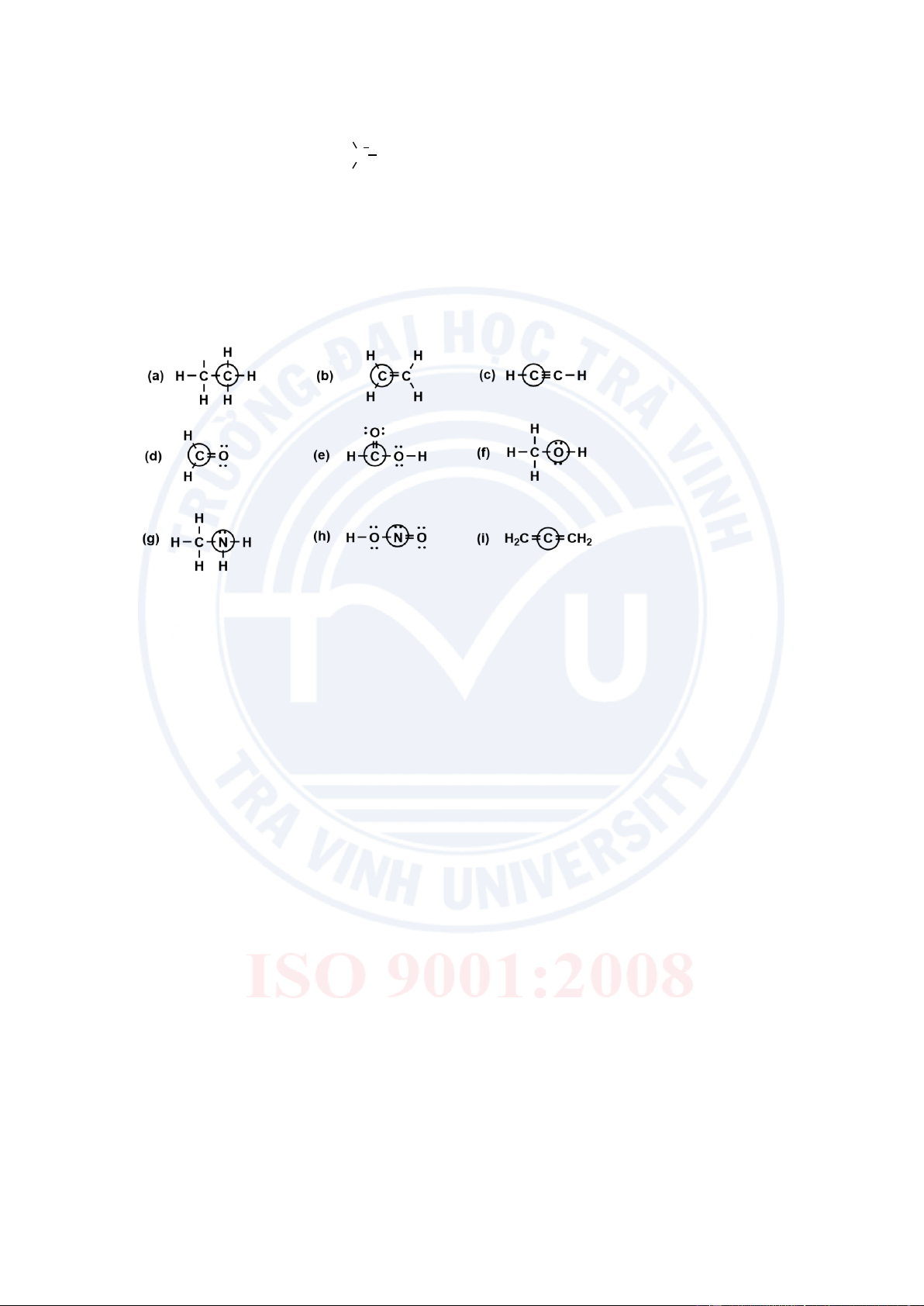
Bài 4: Dùng VSEPR dự đoán góc liên kết của mỗi nguyên tử được đánh dấu sau đây: lOMoAR cPSD| 58490434 2 lOMoAR cPSD| 58490434
Bài 9: Cho công thức cấu tạo của cation tert – butyl H3C C CH3 H C 3
(a) Có bao nhiêu electron trong lớp hóa trị của carbon mang điện tích dương?
(b) Sử dụng VSEPR, dự đoán góc liên kết tại carbon mang điện tích dương.
(c) Cho biết trạng thái lai hóa của carbon mang điện tích dương.
Bài 10: Cho biết trạng thái lai hóa của các nguyên tử được đánh dấu sau: H lOMoAR cPSD| 58490434 BÀI 2
ALKANE VÀ CYCLOALKANE lOMoAR cPSD| 58490434
❖ Mục tiêu học tập: Sau khi học xong bài này, người học có thể:
- Trình bày cấu tạo, cấu dạng, cách gọi tên, tính chất vật lý của alkane và cycloalkane.
- Ứng dụng phản ứng của alkane. Nội dung của bài
2 chủ yếu về tính chất vật lý và hóa học của alkane – một hợp chất hữu cơ đơn giản nhất. Hydrocarbon Bão hòa Không bão hòa Alkane Alkene Alkyne Arene Chỉ có liên kết Có liên kết đôi Có liên kết ba Có chứa vòng đơn carbon – carbon – carbon – benzene carbon carbon carbon H H H H
H C C H
H C C H C C H H H H Ethane Ethene Ethyne Benzene
2.1 Cấu tạo của alkane Methane (CH 4
) là alkane đơn giản nhất. Methane có cấu tạo tứ diện, tất cả các góc o o
H – C – H trong phân tử đều có độ lớn là 109,5 . Tương tự với alkane tiếp theo là ethane (C2H6)
cũng có cấu tạo tứ diện, và tất cả các góc liên kết trong phân tử đều xấp xỉ 109,5 . Các alkane
khác có hình dạng trong không gian 3D phức tạp hơn methane và ethane, tuy nhiên bốn liên
kết trên mỗi carbon vẫn sắp xếp theo dạng tứ diện và tất cả các góc liên kết đều xấp xỉ 109,5o.
Có hai cách biểu diễn cấu tạo của alkane: thứ nhất là vẽ công thức cấu tạo có chỉ ra tất cả
nguyên tử carbon và hydrogen; thứ hai là vẽ công thức cấu tạo dạng góc – đường (line –
angle formula). Trong công thức góc – đường, mỗi giao điểm giữa các đường thẳng và điểm
đầu và điểm cuối của các đường thẳng biễu diễn cho một nguyên tử carbon. Mặc dù nguyên
tử hydrogen không được chỉ ra trong công thức góc – đường, nhưng chúng ta phải hiểu là các



