











Preview text:
BỘ GIÁO DỤC VÀ ĐÀO TẠO
KÌ THI CHỌN ĐỘI TUYỂN OLYMPIC NĂM 2016
Hướng dẫn chấm gồm 17 trang
HƯỚNG DẪN CHẤM ĐỀ THI CHÍNH THỨC Môn: HOÁ HỌC Ngày thi thứ hai: 25/3/2016 I. Hướng dẫn chung:
1. Cán bộ chấm thi chấm đúng như đáp án – thang điểm của Bộ Giáo dục và Đào tạo.
2. Nếu có câu nào, ý nào mà thí sinh có cách trả lời khác so với đáp án nhưng vẫn đúng thì vẫn cho
điểm tối đa của câu, ý đó theo thang điểm.
3. Cán bộ chấm thi không quy tròn điểm bài thi. II. Đáp án – thang điểm
Các chữ và ký hiệu viết tắt trong đề: mCPBA: axit m-clopebenzoic; Bn: Benzyl; Ph: Phenyl; Et: etyl;
Me: Metyl; DMF: dimetylfomamit; DMSO: dimetyl sunfoxit; t-Bu: tert-butyl; i-Pr: isopropyl; Ts: tosyl;
Ac: Axetyl; LDA: liti diisopropyl amidua; Boc: tert-butoxicarbonyl; PPA: axit polyphotphoric; THF:
tetrahydrofuran; Py: Pyridin; NBS: N-bromsucxinimit; DCC: N,N’-dixiclohexylcacbodiimit; PDC:
Pyridini dicromat; TMS: Trimetylsilan; DEAD: Dietyl axetylendicacboxylat; as: ánh sáng Câu I. (3,5 điểm)
1. Xác định cấu trúc của các chất A, B, C D
, và E trong sơ đồ chuyển hóa terpenoit sau:
2. Đun terpenoid 3,7-dimetylocta-2,6-dienol (geraniol) với etyl vinyl ete (có xúc tác H+) thu được
andehit mạch hở F (C12H20O). Xác định công thức cấu tạo của F và đề xuất cơ chế phản ứng tạo thành F.
3. Phân tử hydrocarbon G (C8H ) chỉ 8
gồm các liên kết đơn và chứ cacbon bậc ba tương đương nhau.
Cho chất G phản ứng với H2/Pd ở điều kiện khắc nghiệt thu được chất H (C8H10) và chất I
(C8H14). Trong phân tử của I, tỉ lệ số nguyên tử cacbon bậc hai và bậc ba là 3:1. Chất G phản ứng
với CBr4/NaOH 50% thu được chất K (C8H7Br) và L (C8H Br 6 ). 2
Đồng phân hóa G bằng AgClO4
thu được cunean. Trong phân tử cunean chỉ chứa cacbon bậc ba và chia làm ba nhóm tương
đương nhau. Xác định cấu trúc các chất G, H, I, K, L và cunean.
4. Gừng gió và thanh hao hoa vàng là hai cây thuốc Việt Nam. Từ gừng gió người ta tách được
Zerumbon [(2E, 6E, 10E)-2,6,9,9-tetrametylxicloundeca-2,6,10-trien-1-on]. Từ thanh hao hoa
vàng người ta tách được Artemisinin. Zerumbon và artemisinin là hai tecpenoit đều có hoạt tính
chống ung thư. Thuốc lai X có cấu trúc chứa hai hợp phần Zerumbon và Artemisinin có hoạt tính
ưu việt hơn so với các thuốc đơn. Quy trình tổng hợp thuốc lai X theo ba giai đoạn: -
Giai đoạn biến tính Artemisinin: Trang 1/17 -
Giai đoạn biến tính Zerumbon: Zerumbon phản ứng với m-CPBA trong dung môi CH2Cl 2thu
được chất N1. Cho N1 phản ứng với NH2OH.HCl trong dung môi etanol thu được hỗn hợp
gồm chất N2 và chất N3 (là đồng phân hình học của nhau). Xử lý hỗn hợp trên với ZnCl2
trong dung môi CH3CN và môi trường khí trơ. Loại bỏ dung môi, xử lý và tách sản phẩm
bằng sắc ký cột thu được hai chất N4 và N5 là đồng phân tỉ lệ 1:4 có công thức phân tử C15H NO 23 .2 -
Giai đoạn tạo thuốc lai X: Cho N5 phản ứng với M2 (xúc tác bazơ) trong dung môi CH3CN
thu được thuốc lai X có công thức phân tử C32H49NO .7
Xác định công thức cấu tạo của các chất M1, M2, N1, N4, N5 và công thức lập thể của N2 và N3. Hướng dẫn chấm
1. Cấu trúc của các chất A, B C , , D và E trong sơ đồ: 2. Công thức của F F
và đề xuất cơ chế tạo thành
3. Cấu trúc các chất G, H, I, K, L và cunean
4. Công thức cấu tạo của các chất M1, M2, N1, N4, N5 và X, công thức lập thể của N2 và N3. Trang 2/17 Câu 2. (4,0 điểm)
1. Cho phlorogluxinol (1,3,5-trihydroxibenzen) phản ứng với cloaxetonitrin (ClCH CN) 2 khi có mặt
ZnCl2 thu được chất A (C8H NO 8
3Cl). Sục khí HCl vào dung dịch chứa chất A rồi đun hồi lưu thu
được chất B. Đun hỗn hợp gồm B, metyl iodua và K o
2CO3 trong DMF ỏ 80 C. Chiết sản phẩm
bằng etyl axetat rồi cất loại dung môi thu được chất C. Vừa khuấy vừa đun nhẹ ở 60oC trong 30
phút hỗn hợp gồm C và 3,4-dimetoxybenzandehit trong metanol có cho thêm KOH thu được chất D (C19H18O6).
a) Xác định công thức cấu tạo các chất A, B, ,
C D, Đề xuất cơ chế phản ứng tạo thành A và B.
b) Xử lý D bằng H2O2 thu được chất E (C19H18O ). 7
Khử chất E bằng H2/Pd-C thu được chất F (C H 19 O 20
7). Xử lý chất F bằng K2CO3 thu được flavonoit G. Xác định công thức cấu tạo các chất E, F và G.
2. Esomeprazole, dạng đồng phân (S) của omeprazole, được dùng để điều trị chứng viêm loét dạ dày
theo cơ chế ức chế “kênh bơm proton” H+/K+/ATPase làm giảm sự bài tiết axit dạ dày.
Omeprazole được tổng hợp theo sơ đồ sau:
Biết K có công thức phân tử C9H12NOCl.HCl
Độ bền của omeprazole đạt cực đại tại pH = 11. Omeprazole
rất kém bền trong môi trường axit (tại pH = 2, thời gian bán hủy của
hợp chất này là 105 giây) là do omeprazole bị proton hóa và sau đó
chuyển vị tạo thành chất hoạt động X. Trong dạ dày, chất X bám
được vào các tế bào chứa “kênh bơm proton” trên thành dạ dày nhờ
phản ứng với hợp phần cystein trong protein của tế bào tạo ra cầu
disunfua. Cho hằng số phân ly axit của omeprazole pKa1 = 3,98, pKa2 = 8,70.
a) Xác định công thức cấu tạo các chất H, , I K và L.
b) Xác định dạng tồn tại chính của omeprazole tại pH = 3, 7 và 11. Biết tại pH = 3 omeprazole chưa bị chuyển hóa thành X.
c) Đề xuất cơ chế tạo thành X từ omeprazole. Viết sơ đồ phản ứng của X khi gắn vào các tế bào thành dạ dày.
d) Xác định cấu trúc của esomeprazole.
e) Esomeprazole thương mại được sản xuất dưới dạng muối magie MgEs - 2.3H O (Es 2 là anion của
omeprazole), có độ tan trong nước tại 25 C là 3,5.10 o
-4 (mol/L). Tính pH của dung dịch bão hòa MgEs -14
2 và tích số tan của muối này. Cho biết KW = 10 . Trang 3/17 Hướng dẫn chấm
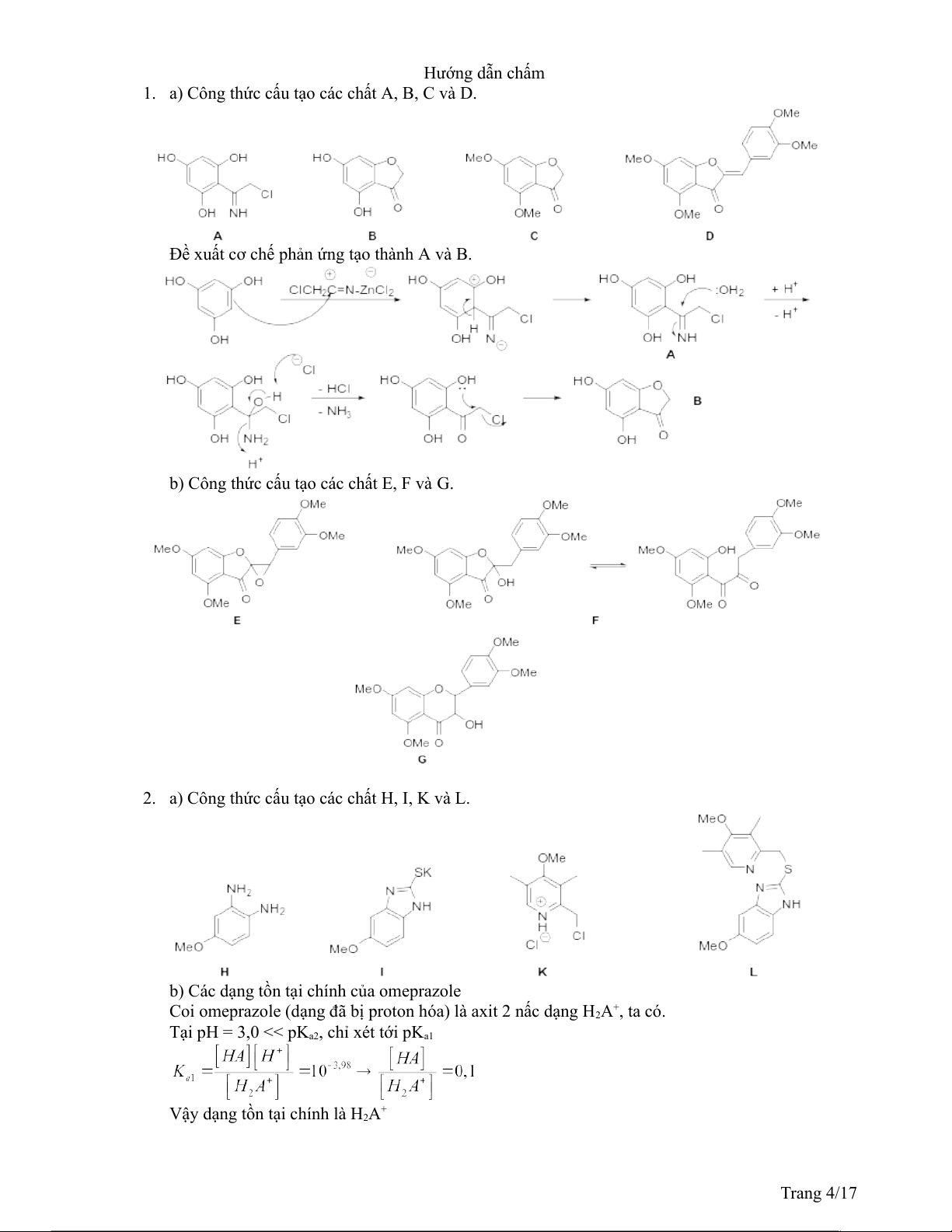
1. a) Công thức cấu tạo các chất A, B, C và D.
Đề xuất cơ chế phản ứng tạo thành A và B.
b) Công thức cấu tạo các chất E, F và G.
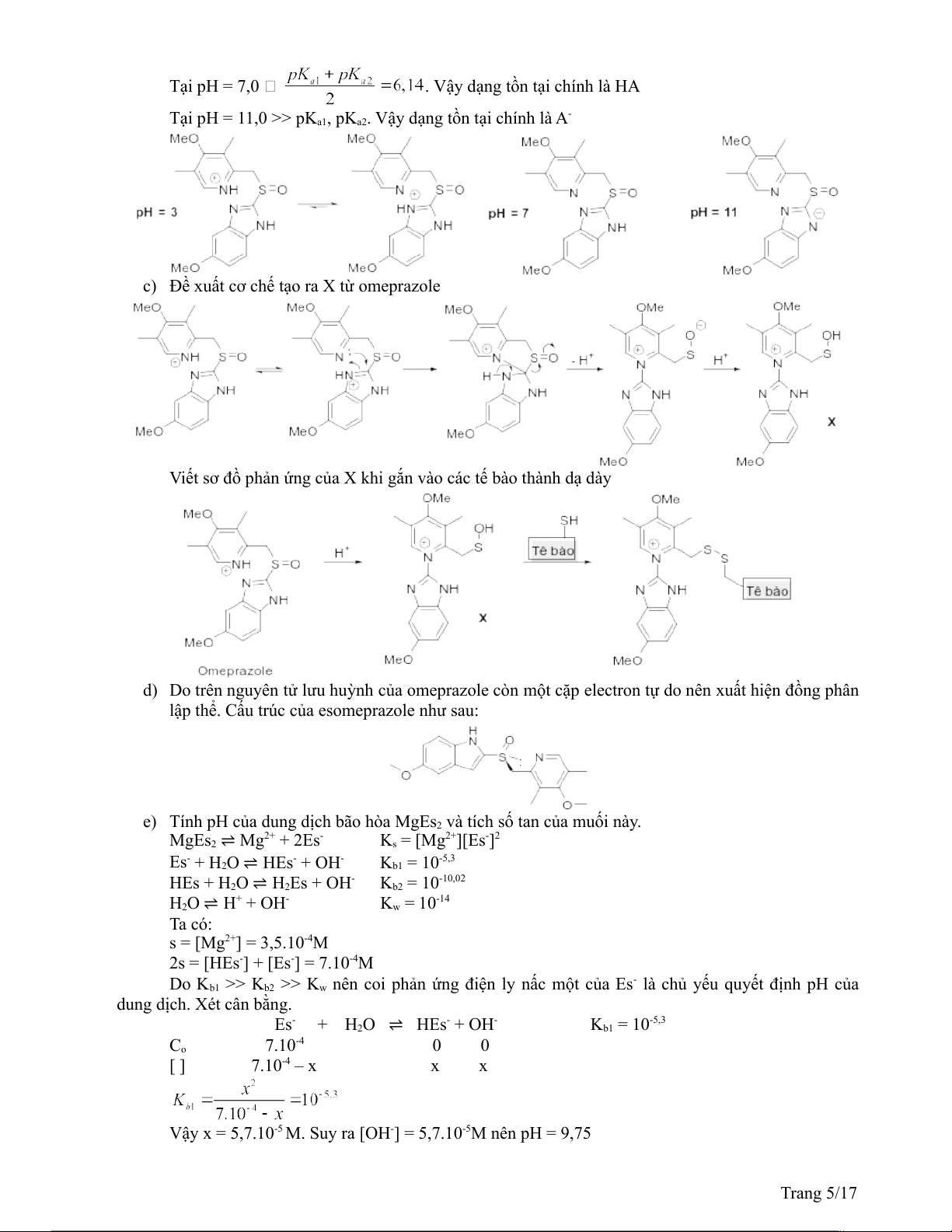
2. a) Công thức cấu tạo các chất H, I K , và L.
b) Các dạng tồn tại chính của omeprazole
Coi omeprazole (dạng đã bị proton hóa) là axit 2 nấc dạng H2A+, ta có.
Tại pH = 3,0 << pKa2, chỉ xét tới pKa1
Vậy dạng tồn tại chính là H2A+ Trang 4/17 Tại pH = 7,0
. Vậy dạng tồn tại chính là HA Tại pH = 11,0 >> pK -
a1, pKa2. Vậy dạng tồn tại chính là A
c) Đề xuất cơ chế tạo ra X từ omeprazole
Viết sơ đồ phản ứng của X khi gắn vào các tế bào thành dạ dày
d) Do trên nguyên tử lưu huỳnh của omeprazole còn một cặp electron tự do nên xuất hiện đồng phân
lập thể. Cấu trúc của esomeprazole như sau:
e) Tính pH của dung dịch bão hòa MgEs và tích số tan của muối này 2 . MgEs - 2+ - 2 Mg ⇌ 2+ + 2Es Ks = [Mg ][Es ]2 Es- + H O - - -5,3 2 ⇌ HEs + OH K = 10 b1 HEs + H O - -10,02 2 H ⇌ Es + OH 2 K = 10 b2 H + - 2O ⇌ H + OH Kw = 10-14 Ta có: s = [Mg2+] = 3,5.10-4M 2s = [HEs-] + [Es-] = 7.10-4M Do K - b1 >> K
b2 >> Kw nên coi phản ứng điện ly nấc một của Es là chủ yếu quyết định pH của dung dịch. Xét cân bằng. Es- + H O - - -5,3 2 ⇌ HEs + OH K = 10 b1 C -4 o 7.10 0 0 [ ] 7.10-4 – x x x
Vậy x = 5,7.10-5 M. Suy ra [OH- -5 ] = 5,7.10 M nên pH = 9,75 Trang 5/17 K -4 -4 -5 2 -10
s = 3,5.10 (7.10 – 5,7.10 ) = 1,45.10 Câu III (3,0 điểm) .
1. Thủy phân thevetin-B (C43H O 68
18, là glycosit trợ tim) với xúc tác axit thu được D-glucozơ, chất A
(C7H14O5) và chất B. Chất A thuộc loại
O-metyl-L-andozơ với cấu hình tuyệt đối của C3 khác với
cấu hình tuyệt đối của các nguyên tử cacbon khác. A có khả năng tạo thành osazon với
phenylhydrazin. Khi cho thevetin-B phản ứng với
MeI/Ag2O, sau đó thủy phân bằng enzym β-glicozidaza thì
thu được 2,3,4,6-tetra-O-metyl-D-glucozơ, 2,3,4-tri-O-
metyl-D-glucozơ và chất C. Thủy phân chất C với enzym
-glicozidaza thu được chất D (C8H16O ) và chất 5 E. Chất
D là dẫn xuất của chất A D
. Chất phản ứng với HIO thu 4
được etanal và (2S, 3S)-2,3-dimetoxybutandial.
a) Vẽ công thức Fisơ của các chất A và D.
b) Vẽ công thức Havooc (Haworth) hợp phần gluxit (glycon) của thevetin-B.
2. Stevioside được tách ra từ cỏ ngọt, có độ ngọt gấp khoảng 100 lần so với đường mía, được dùng
trong công nghiệp nước giải khát. Khác với các chất tạo ngọt thiên nhiên khác, stevioside có lợi
cho sức khỏe, chống sâu răng và phòng ngừa bệnh tiểu đường. Stevioside không bị thủy phân bởi
enzym -glicozidaza trong cơ thể người để sinh ra gluxit nên không tạo năng lượng.
Khi thủy phân hoàn toàn các liên kết glycozit trong stevioside thu được D-glucozơ và một
terpenoid F chứa hai nhóm chức (đều chứa oxy) dạng X-G-Y có khối lượng phân tử 318. Thủy phân
không hoàn toàn stevioside thu được D-glucozơ và chất H (C26H O 40 ). Khi axetyl hóa 8 H thu được chất I (C36H O 50
13). Thủy phân không hoàn toàn stevioside trong một điều kiện khác thu được chất K (C H 32 O 50 ) 13
và D-glucozơ. Chất K phản ứng với ancol tạo thành este. Metyl hóa hoàn toàn các nhóm hydroxi trong
stevioside bằng MeI/Ag2O thu được chất L1. Thủy phân hoàn toàn các liên kết glycozit của L1 thu được
hỗn hợp L2. Khử hóa L2 bằng NaBH4 thu được hỗn hợp L3. Khi axetyl hóa L3 thu được 1,5-di-O-
axetyl-2,3,4,6-tetra-O-metyl-D-glucitol (chất M) và 1,2,5-tri-O-axetyl-3,4,6-tri-O-metyl-D-glucitol (chất
N) theo tỉ lệ 2:1 (về số mol) kèm theo một dẫn xuất axetyl của terpenoit F.
a) Vẽ công thức Fisơ của các chất M và N
b) Nhóm chức nào có mặt trong terpenoid F? Biết X là nhóm chức có mặt trong H, còn Y là nhóm chức có mặt trong K
c) Để tổng hợp terpenoid F người ta thực hiện sơ đồ chuyển hóa sau:
Xác định cấu trúc các chất X1, X2, X3, X4, X5, X6, X7, X8 và terpenoid F.
d) Xác định cấu dạng của stevioside, biết tất cả các vòng 6 cạnh đều tồn tại ở dạng ghế.
3. Thổ phục linh là một cây thuốc quý của Việt Nam được sử dụng trong các bài thuốc dân gian
nhằm cải thiện tuần hoàn não. Astilbin là một hợp chất có hàm lượng cao trong rễ cây thổ phục
linh. Từ astilbin chuyển hóa thành ( )alphitonin qua taxifolin theo sơ đồ sau: Trang 6/17
a) Xác định cấu trúc của taxifolin.
b) Đề nghị cơ chế để giải thích quá trình tạo thành ( )alphitonin từ taxifolin. Hướng dẫn chấm
1. + Thủy phân permetylthevetin-B với enzym β-glicozidaza tạo thành 2,3,4,6-tetra-O-metyl-D-
glucozơ; 2,3,4-tri-O-metyl-D-glucozơ và hợp chất . Suy ra C
Thevetin-B có cấu trúc kiểu [β-D-
glucopyranoyl-(1 6)-β-D-glucopyranoyl-(1 x)]-C (Do vị trí OH số 5 đã nằm trong vòng, không xuất hiện 5-O-metyl). + A (C7H14O ): 5
A thuộc loại O-metyl-D-andozơ với cấu hình tuyệt đối của C3 khác với cấu hình
tuyệt đối của các nguyên tử cacbon khác. A có khả năng tạo osazon với phenylhydrazin suy ra
cacbon bất đối của A cuối cùng có cấu hình S. Vậy nên C3 có cấu hình R. Nguyên tử cacbon C2
liên kết với OH mà không liên kết với OMe.
+ D (C8H16O ) là dẫn xuất của 5
A (C7H14O5), D phản ứng với HIO , thu được (2 4 S S ,3 )-2,3-
dimetoxybutandial và etanal, nguyên tử cacbon C2 liên kết với OH. Do vậy xác định được công
thức chiếu Fisơ của D và A. + Thủy phân với enzym C
-glucozidaza thu được D và E suy ra D và E liên kết với nhau bởi liên kết -glycozit.
Công thức Fisơ của A và D
Công thức Haworth hợp phần glycon
2. a) Vẽ công thức Fisơ các chất M và N
b) Nhóm chức nào có mặt trong terpenoid F?
Có MH = 480 trong khi MF = 318, chênh lệch 162 đơn vị, trong khi phân tử khối của glucozơ là
180 chứng tỏ H là sản phẩm tạo glycozit giữa glucozơ với F (kèm theo sự mất đi một phân tử H O). 2 Sản
phẩm axetyl hóa H chứa 5 nhóm axetyl, như vậy H có 5 nhóm -OH, trong đó 4 nhóm -OH thuộc hợp
phần glucozơ. Nhóm -OH còn lại thuộc hợp phần của F. Vậy X là nhóm OH.
Lập luận tương tự đối với K, K được tạo thành bởi hai hợp phần glucozơ và hợp phần F. Do X là
nhóm OH nên Y là nhóm COOH.
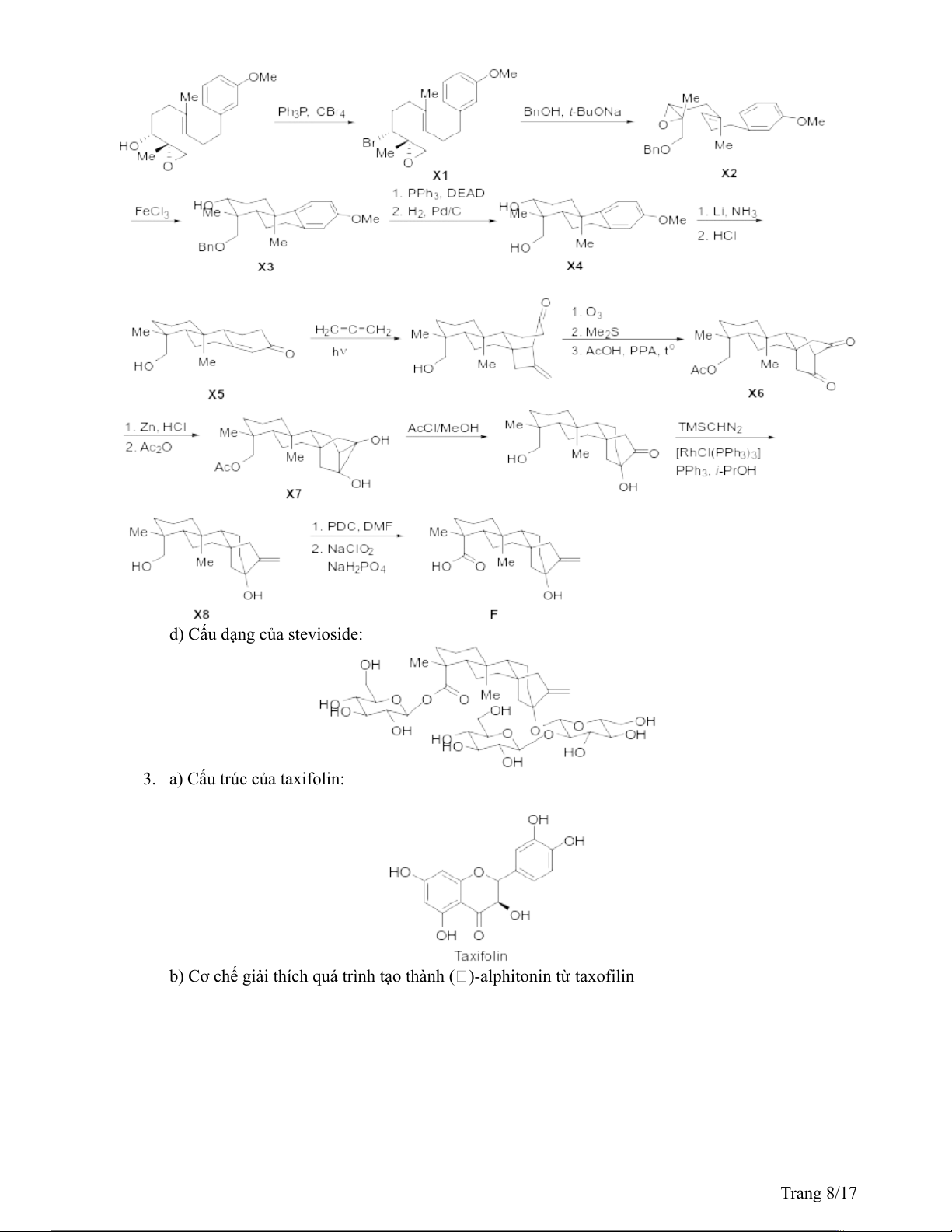
c) Cấu trúc các chất X1, X2, X3, X4, X5, X6, X7, X8 và terpenoid F. Trang 7/17
d) Cấu dạng của stevioside:
3. a) Cấu trúc của taxifolin:
b) Cơ chế giải thích quá trình tạo thành ( )-alphitonin từ taxofilin Trang 8/17 Câu IV. (3,0 điểm)
1. Phản ứng domino thường xảy ra êm dịu trải qua nhiều giai đoạn trung gian, thân thiện với môi
trường và có chọn lọc lập thể cao. Đề xuất cơ chế phản ứng domino chuyển hóa N,N’-
dimetylbarbituric theo sơ đồ:
2. Đề xuất cơ chế giải thích sự hình thành sản phẩm của các phản ứng sau, biết trong các phản ứng
đều hình thành trung gian xeten và đều trải qua giai đoạn chuyển vị [3.3].
3. Từ các chất hữu cơ chứa không quá 4 nguyên tử cacbon, viết sơ đồ điều
chế axit 5,5-dietylbarbituric (các chất vô cơ cần thiết và điều kiện phản ứng có sẵn).
4. Chất lỏng ion phân cực, có nhiệt độ sôi cao được dùng làm dung môi trong
tổng hợp “xanh” các chất hữu cơ. Sau phản ứng thu hồi sản phẩm bằng
cách chiết với các dung môi thông thường, xúc tác và chất lỏng ion được
tái sử dụng nhiều lần.
a) Từ (S)-valin (các hóa chất khác tùy ý), viết quy trình tổng hợp chất lỏng ion A.
b) Quy trình tiên tiến (hiệu suất cao, chọn lọc lập thể và ít chất thải) tổng hợp “xanh” thuốc kháng
viêm ibuprofen (chứa nhóm -COOH và có cấu hình S) như sau: Chất lỏng ion Trang 9/17
Xác định cấu trúc các chất B, C và ibuprofen. Hướng dẫn chấm
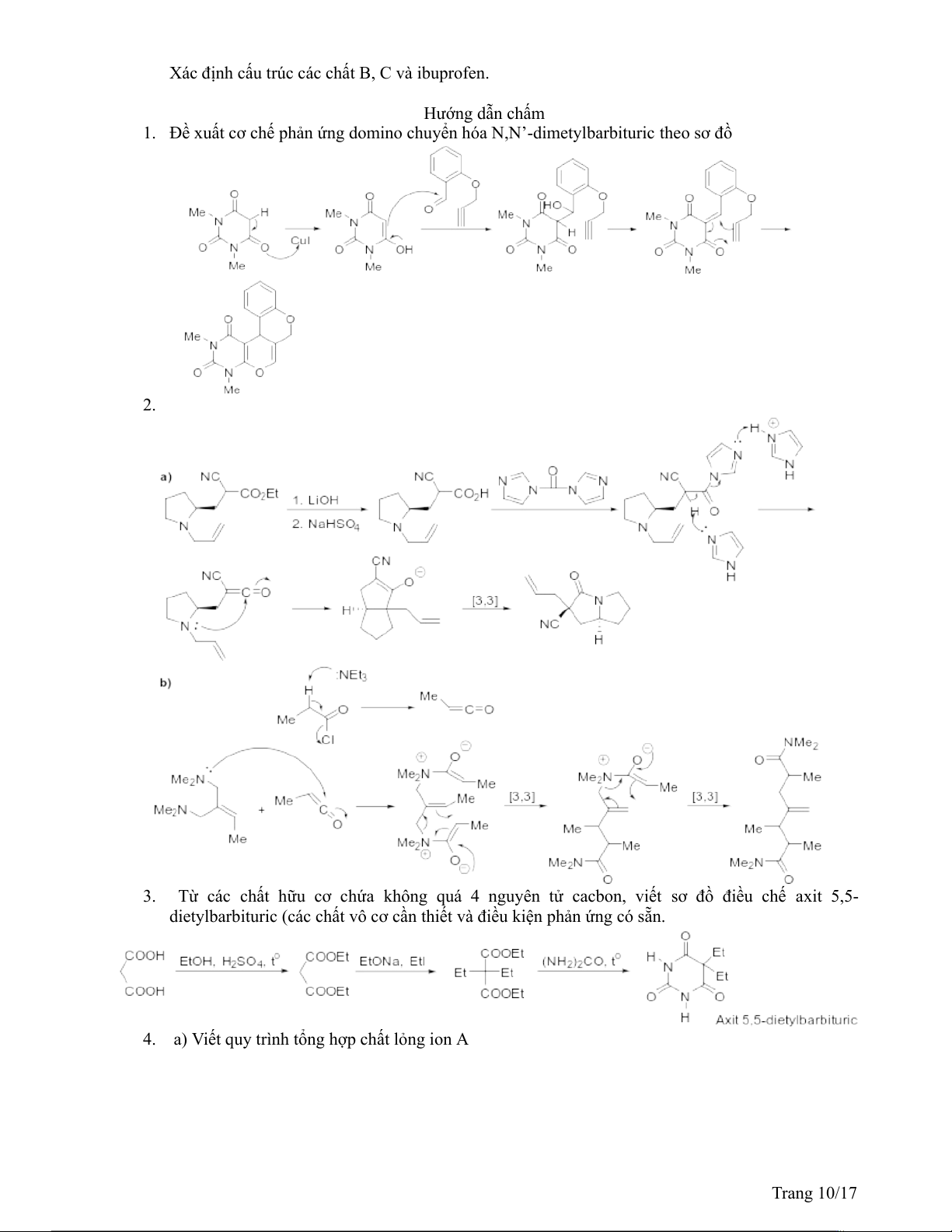
1. Đề xuất cơ chế phản ứng domino chuyển hóa N,N’-dimetylbarbituric theo sơ đồ 2.
3. Từ các chất hữu cơ chứa không quá 4 nguyên tử cacbon, viết sơ đồ điều chế axit 5,5-
dietylbarbituric (các chất vô cơ cần thiết và điều kiện phản ứng có sẵn.
4. a) Viết quy trình tổng hợp chất lỏng ion A Trang 10/17
b) Xác định cấu trúc các chất B, C và Ibuprofen Câu V. (3,5 điểm)
1. Saquinavir được sử dụng để sản xuất thuốc invirase kháng virus. Từ anilin, benzylamin, andehit
axetic, etyl axetat, phenylalanin, asparagin, t-butylamin, ancol benzylic, etylen glycol, (Boc)2O, DCC, NBS, Me CuLi, 2
thiết lập sơ đồ tổng hợp saquinavir (các chất vô cơ và điều kiện phản ứng có sẵn).
2. Codycepin (E) được tách ra từ nấm đông trùng hạ thảo có tác dụng ngăn ngừa ung thư do trong
quá trình tổng hợp AND tế bào ung thư nhầm lẫn adenosin với codycepin, vì thế tế bào có nguy
cơ ung thư sẽ chết. Codycepin được tổng hợp theo sơ đồ sau:
a) Xác định cấu trúc các chất A, B, C, D và cordycepin, biết enzym reductase có vai trò khử hóa.
b) Dưới xúc tác của enzym adenosin deaminaza, codycepin chuyển thành deoxynosin F (C10H N 14
4O4) không còn hoạt tính. Dưới xúc tác của
enzym transaminaza, deoxynosin F chuyển về codycepin. Cho biết cấu
tạo của F và mô tả cơ chế chuyển hóa E thành F.
c) Mô tả cấu trúc một đoạn ADN lỗi được hình thành từ 1 phân tử
cordycepin và 1 phân tử thymidin (liên kết qua este của axit photphoric
giống trong chuỗi ADN bình thường).
3. Trong cơ thể thực vật, ankaloit được sinh tổng hợp từ các amino axit dưới tác dụng của enzym.
Con đường sinh tổng hợp norcoclaurin từ L-tyrosin (G) dưới tác dụng của 4 loại enzym E1, E2, E3 E4 ,
(trong đó có enzym decarboxylaza) theo sơ đồ sau: Trang 11/17
a) Trên cơ sở vai trò của các enzym, xác định công thức cấu tạo của các chất H, , I K và L.
b) Thực vật họ Cactaceae chứa ankaloit Mescalin. Con đường sinh tổng hợp Mescalin theo sơ đồ sau
Trong đó quá trình metyl hóa được thực hiện bởi tác nhân sinh học SAM (S-adenosylmethionin
có vai trò giống như tác nhân hóa học MeI/Ag O). 2
Xác định cấu tạo của các chất M, N, P, Q, S và mescalin.
c) Norcoclaurin còn được chuyển hóa thứ cấp tạo thành
papaverin. Viết sơ đồ mô tả quá trình sinh hóa chuyển norcoclaurin thành papaverin.
d) Papaverin có tác dụng làm giảm sự co thắt của cơ trơn theo
cơ chế ức chế enzym chuyển hóa nucleotit X1 thành X2.
Trong tế bào X1 tồn tại ở dạng monoanion (photpho chiếm
9,44% khối lượng), X2 tồn tại ở dạng dianion (photpho chiếm 8,98% khối lượng). Nucleotit X1
được hình thành theo con đường thủy phân ribonucleotit triphotphat.
Xác định cấu trúc của X1 và X2, biết trong phân tử X1 chứa bazơ nitơ điển hình và không chứa vòng lớn hơn 6 cạnh.
Cho biết cấu trúc các bazơ nitơ và nucleotit điển hình sau: Z: bazơ nitơ X: H, OH Hướng dẫn chấm
1. Các hợp phần cơ bản để xây dựng cấu trúc của saquinavir Hợp phần A Hợp phần B Hợp phần C Hợp phần D Tổng hợp hợp phần A: Tổng hợp hợp phần C: Trang 12/17 Tổng hợp hợp phần D: Tổng hợp saquinavir:
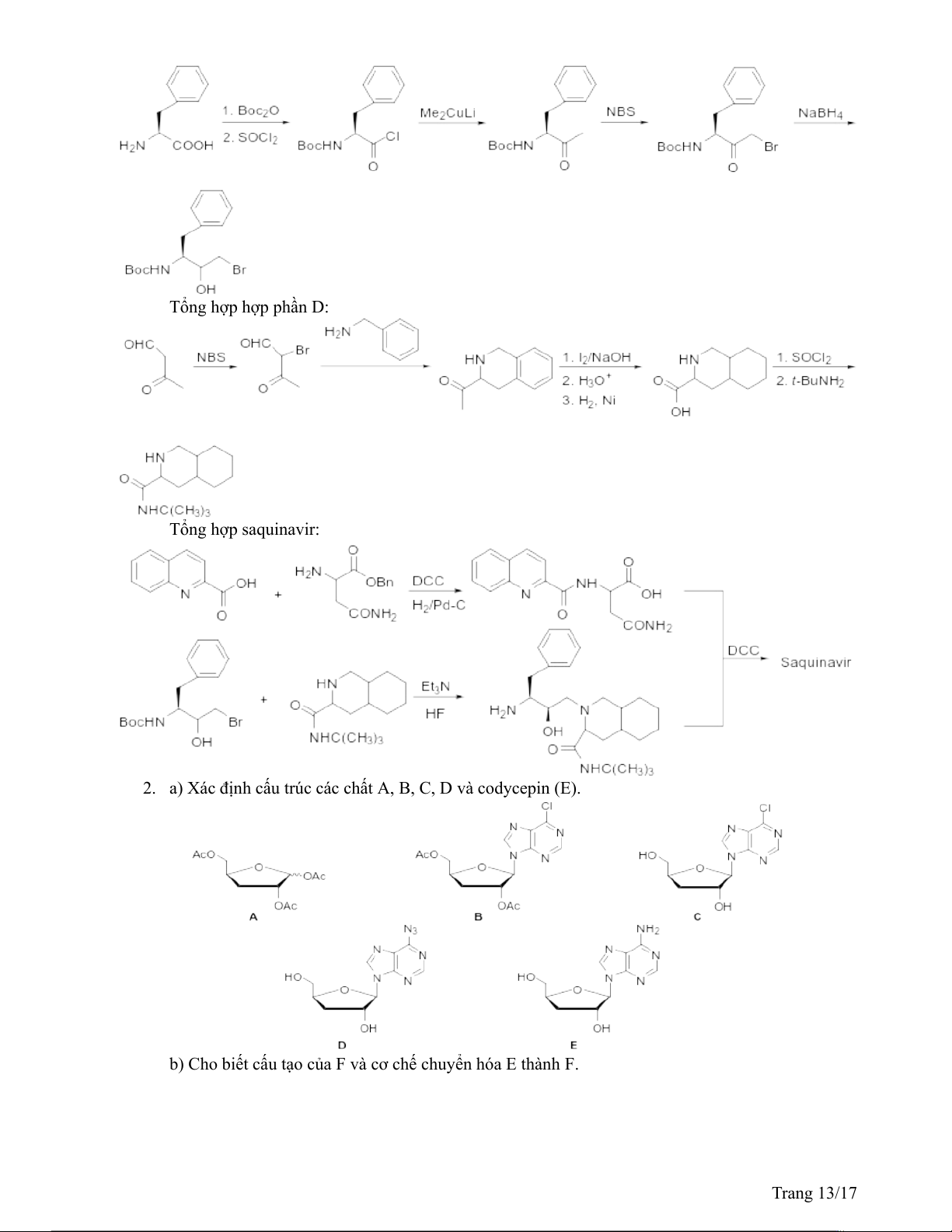
2. a) Xác định cấu trúc các chất A, B, C, D và codycepin (E).
b) Cho biết cấu tạo của F và cơ chế chuyển hóa E thành F. Trang 13/17
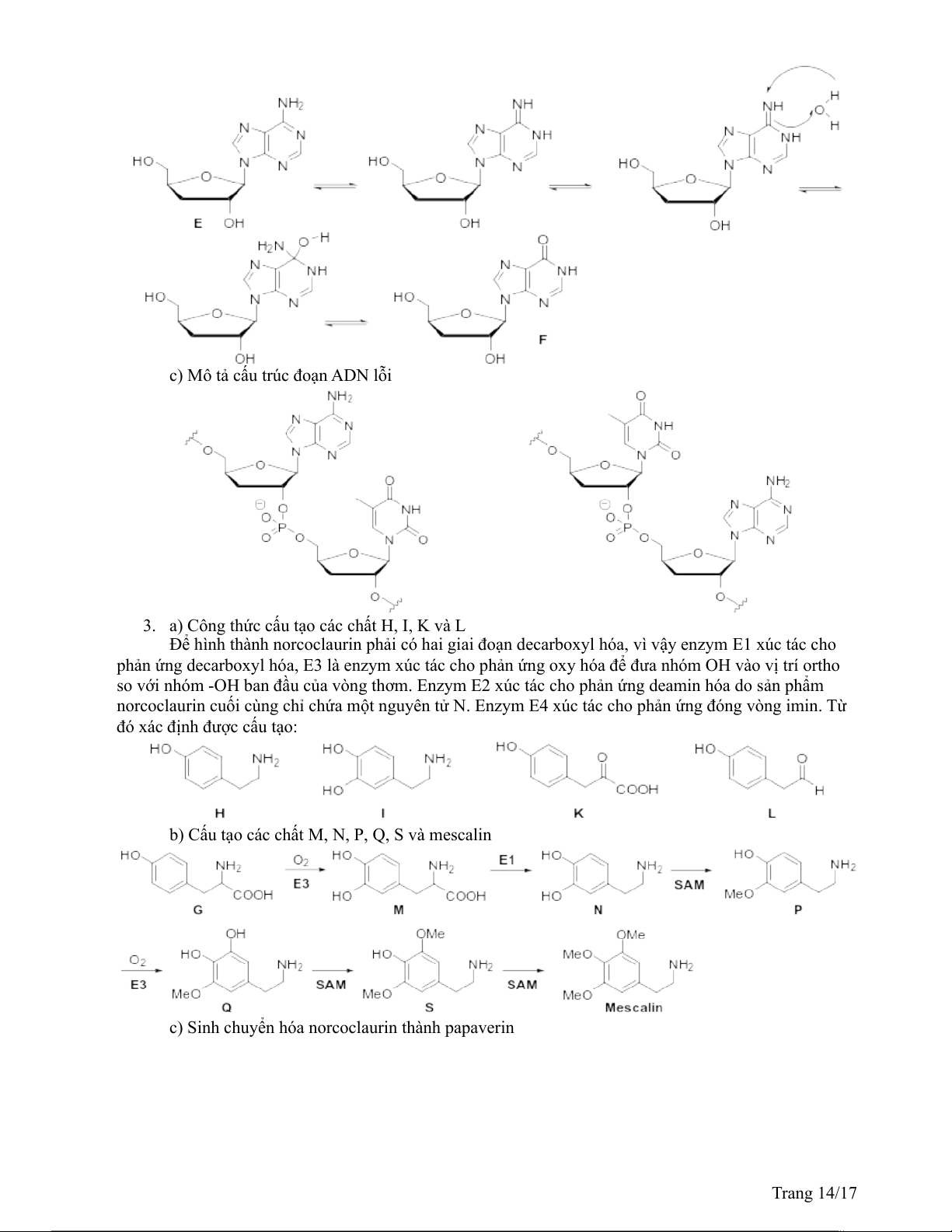
c) Mô tả cấu trúc đoạn ADN lỗi
3. a) Công thức cấu tạo các chất H, I, K và L
Để hình thành norcoclaurin phải có hai giai đoạn decarboxyl hóa, vì vậy enzym E1 xúc tác cho
phản ứng decarboxyl hóa, E3 là enzym xúc tác cho phản ứng oxy hóa để đưa nhóm OH vào vị trí ortho
so với nhóm -OH ban đầu của vòng thơm. Enzym E2 xúc tác cho phản ứng deamin hóa do sản phẩm
norcoclaurin cuối cùng chỉ chứa một nguyên tử N. Enzym E4 xúc tác cho phản ứng đóng vòng imin. Từ
đó xác định được cấu tạo:
b) Cấu tạo các chất M, N, P, Q, S và mescalin
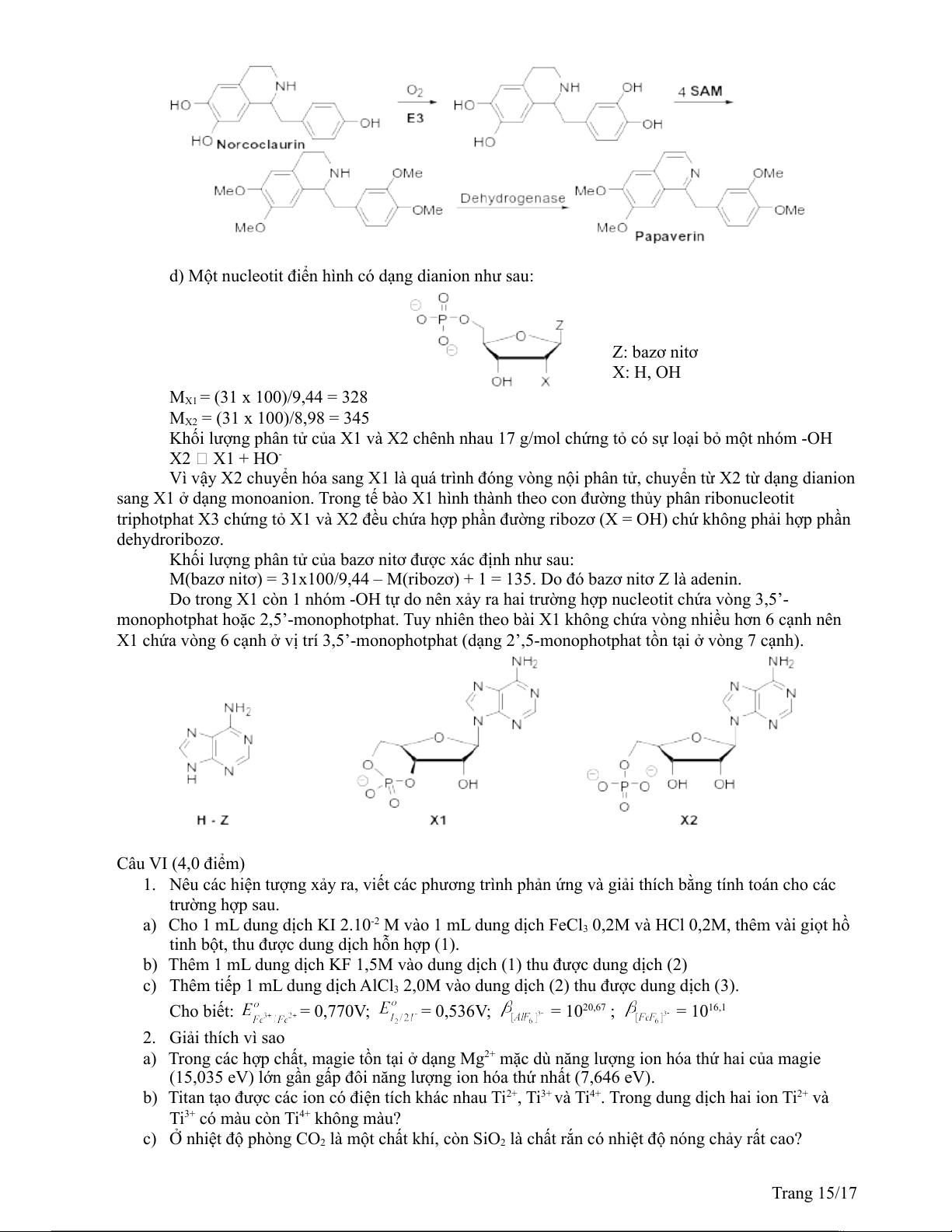
c) Sinh chuyển hóa norcoclaurin thành papaverin Trang 14/17
d) Một nucleotit điển hình có dạng dianion như sau: Z: bazơ nitơ X: H, OH MX1 = (31 x 100)/9,44 = 328 MX2 = (31 x 100)/8,98 = 345
Khối lượng phân tử của X1 và X2 chênh nhau 17 g/mol chứng tỏ có sự loại bỏ một nhóm -OH X2 X1 + HO-
Vì vậy X2 chuyển hóa sang X1 là quá trình đóng vòng nội phân tử, chuyển từ X2 từ dạng dianion
sang X1 ở dạng monoanion. Trong tế bào X1 hình thành theo con đường thủy phân ribonucleotit
triphotphat X3 chứng tỏ X1 và X2 đều chứa hợp phần đường ribozơ (X = OH) chứ không phải hợp phần dehydroribozơ.
Khối lượng phân tử của bazơ nitơ được xác định như sau:
M(bazơ nitơ) = 31x100/9,44 – M(ribozơ) + 1 = 135. Do đó bazơ nitơ Z là adenin.
Do trong X1 còn 1 nhóm -OH tự do nên xảy ra hai trường hợp nucleotit chứa vòng 3,5’-
monophotphat hoặc 2,5’-monophotphat. Tuy nhiên theo bài X1 không chứa vòng nhiều hơn 6 cạnh nên
X1 chứa vòng 6 cạnh ở vị trí 3,5’-monophotphat (dạng 2’,5-monophotphat tồn tại ở vòng 7 cạnh). Câu VI (4,0 điểm)
1. Nêu các hiện tượng xảy ra, viết các phương trình phản ứng và giải thích bằng tính toán cho các trường hợp sau.
a) Cho 1 mL dung dịch KI 2.10-2 M vào 1 mL dung dịch FeCl 0,2M và HCl 0,2M, thêm vài giọt hồ 3
tinh bột, thu được dung dịch hỗn hợp (1).
b) Thêm 1 mL dung dịch KF 1,5M vào dung dịch (1) thu được dung dịch (2)
c) Thêm tiếp 1 mL dung dịch AlCl 2,0M vào dung dịch (2) thu được dung dịch (3). 3 Cho biết: = 0,770V; = 0,536V; = 10 ; 20,67 = 1016,1 2. Giải thích vì sao
a) Trong các hợp chất, magie tồn tại ở dạng Mg2+ mặc dù năng lượng ion hóa thứ hai của magie
(15,035 eV) lớn gần gấp đôi năng lượng ion hóa thứ nhất (7,646 eV).
b) Titan tạo được các ion có điện tích khác nhau Ti2+, Ti3+ 4+ 2+
và Ti . Trong dung dịch hai ion Ti và
Ti3+ có màu còn Ti4+ không màu?
c) Ở nhiệt độ phòng CO2 là một chất khí, còn SiO là chất rắn có nhiệt độ nóng chảy rất 2 cao? Trang 15/17
d) Nitơ chỉ tạo được hợp chất NF , nhưng không tạo được hợp chất NF 3
, trong khi đó photpho tạo 5
được hợp chất PF và PF 3 ? Cả NF 5 3 và PF đều có cấu 3
tạo tháp tam giác, còn PF có cấu tạo lưỡng 5 chóp tam giác.
3. Trộn 10 mL dung dịch Cu(NO3) 0,02M với 10 mL 2
dung dịch NH 2,00M thu được 20 mL 3 dung
dịch A. Trộn 20 mL dung dịch A với 80 mL
dung dịch KCN 0,25M, sau khi phản ứng xảy ra
hoàn toàn thu được 100 mL dung dịch B. Tính nồng độ cân bằng của các cấu tử chính có trong dung dịch B. Cho biết: K -14 W = 10 ; Ka(HCN) = 10-9,33 -9,24 ; = 10 = 10 ; 12,93 = 1030,25 = +0,153V ; -0,960V Hướng dẫn chấm
1. a) Khi thêm 1 mL dung dịch KI 2.10-2 M vào 1 mL dung dịch FeCl 0,2M và HCl 0,2M. 3
C(Fe3+) = 0,1M; C(I-) = 10-2M; C(H+) = 0,1M Trong hệ có phản ứng: 2Fe3+ + 2I- 2Fe ⇌ 2+ + I2 (1) Fe3+ + e ⇌ Fe2+ = 0,770V 2I- ⇌ I + 2e 2 = 0,536V
∆E(1) = 0,77 – 0,536 = 0,234 V
Hằng số cân bằng phản ứng (1): K1 =
K1 lớn nên có thể coi phản ứng (1) xảy ra hoàn toàn: 2Fe3+ + 2I- 2Fe2+ + I2
Trước phản ứng (M) 0,1 10-2
Sau phản ứng (M) 9.10-2 0 10-2 5.10-3
Dung dịch hỗn hợp (1) có màu xanh (hoặc xanh đen) do tạo hỗn hợp I với hồ tinh bột. 2
b) Thêm 1 mL dung dịch KF 1,5M vào dung dịch (1) được 3 mL dung dịch (2). Thành phần chính của (2): ; ;
Trong hệ xảy ra các phản ứng (2) và (3) (đều xảy ra hoàn toàn do = 10 và K 16,1 rất lớn) 1 như sau: Fe3+ + 6F- [FeF ⇌ 16,1 6]3- (2) = 10
Trước phản ứng (M) 6.10-2 0,5
Sau phản ứng (M) 0 0,14 6.10-2
Do tạo phức [FeF6]3- bền nên thế tiêu chuẩn điều kiện của hệ sắt giảm mạnh Như vậy nên I oxy hóa được Fe2+ 2 theo phản ứng (3): 2Fe2+ - - + I + 12F 2 2[FeF ⇌ 6]3- + 2I K = 3 (3)
K3 rất lớn nên phản ứng (3) xảy ra hoàn toàn: 2Fe2+ - - + I + 12F 2 2[FeF ⇌ 6]3- + 2I
Trước phản ứng (M) 2/3.10-2 10-2/3 0,14 6.10-2
Sau phản ứng (M) 0 0 0,10 (6 + 2/3).10-2 2/3.10-2
Do I bị khử hết thành I- 2
nên dung dịch hỗn hợp (2) mất màu xanh. Trang 16/17
c) Thêm 1 mL dung dịch AlCl 2M vào dung dịch hỗn hợp (2) được 4 mL 3 dung dịch (3). Thành phần chính của hệ: ; ;
Trong hệ xảy ra các phản ứng: Al3+ + 6F- [AlF ⇌ 20,67 6]3- = 10 (4) Vì >>
nên có phản ứng thế của Al3+ vào phức [FeF6]3- Al3+ + [FeF 3+ 4,57 6]3- [AlF ⇌ 6]3- + Fe K = 5 . = 10 (5) Ở phản ứng (4): Al3+ + 6F- [AlF6]3-
Trước phản ứng (M) 0,5 0,075
Sau phản ứng (M) 0,4875 0 0,0125 Ở phản ứng (5) Al3+ + [FeF 3+ 6]3- [AlF6]3- + Fe
Trước phản ứng (M) 0,4875 0,05 Sau phản ứng (M) 0,4375 0 0,0625
Do Fe3+ được giải phóng từ phức [FeF 3+
6]3- nên thế của hệ sắt lại cao hơn hệ I2/2I- nên Fe lại oxy hóa I- thành I .2 2Fe3+ + 2I- 2Fe2+ + I2
Trước phản ứng (M) 0,05 5.10-3
Sau phản ứng (M) 0,045 0 5.10-3 2,5.10-3
Dung dịch hỗn hợp (3) lại có màu xanh (xanh đen) của hỗn hợp I với hồ tinh bột. 2
2. a) Ion Mg2+ nhỏ hơn và có điện tích lớn hơn. Do đó năng lượng tỏa ra khi tinh thể được tạo thành
từ ion Mg2+ nhiều hơn từ Mg+. Lượng tăng năng lượng mạng lưới dư đủ để bù trừ cho năng lượng
ion hóa Mg+ thành Mg2+. Mặt khác Mg2+ có cấu hình electron bền vững giống khí hiếm Ne (1s 2s 2 22p6) còn Mg+ (1s 2s 2 22p 3s 6
1) không có cấu hình bền của khí hiếm.
b) Ti (Z = 22) (Ar)3d24s có thể có các ion 2 Ti2+ 0 3+ 1 0 4+ 0 0 (Ar)3d 4s 2
, Ti (Ar)3d 4s , Ti (Ar)3d 4s . Trong
dung dịch các ion Ti2+, Ti3+ có màu do có bước chuyển electron giữa các AO d, hấp thụ một bức
xạ của ánh sáng, các bức xạ còn lại tổ hợp cho ta một màu xác định, còn Ti4+ không màu vì không
còn electron d, không có bước chuyển electron, không hấp thụ ánh sáng.
c) Các phân tử CO có cấu tạo thẳng (O = C = O) không phân cực (do momen của 2 hai lưỡng cực
điện C=O ngược chiều nhau nên tổng momen lưỡng cực bằng không) và tương tác với nhau bằng
lực khuếch tán yếu. Vì vậy cacbon dioxit là chất khí ở nhiệt độ thường.
Silic dioxit không có công thức cấu tạo như CO .
2 Trong silic dioxit, các nguyên tử Si và O liên
kết với nhau bằng các liên kết cộng hóa trị đơn, bền vững. Do đó silic dioxit là chất rắn, có nhiệt độ nóng chảy cao.
d) N (Z = 7) có cấu hình electron 1s22s 2p 2
3. N có 4 AO hóa trị gồm 2s và 2p với 3 electron độc
thân nên chỉ có khả năng tạo 3 liên kết cộng hóa trị (bởi đôi electron dùng chung) với 3 nguyên tử
F (1s22s22p , có 1 electron độc thân). Do đó với flo, nitơ tạo được hợp chất NF 5 .3
P (Z = 15) có cấu hình electron (Ne)3s23p có khả năng tạo hợp chất PF 3 như nitơ. 3 Vì các mức
năng lượng của các phân lớp trong cùng một lớp AO khác nhau không nhiều nên 1 trong 2e của
3s di chuyển lên 3d tạo ra 5e độc thân 3s13p 3d 3 nên có thể tạo ra PF 1 .5 NF 3
3 và PF đều có cấu trúc tháp tam giác vì ở nguyên tử trung tâm (N, P) có lai hóa s 3 p . Các
obitan lai hóa sp với 1e xen phủ với 3
AO-p có electron độc thân của F tạo ra các liên kết bền
vững. Mây electron sp3 với 2e còn lại đẩy các mây electron của liên kết làm biến dạng tứ diện
(góc liên kết 109o28’) thành tháp tam giác (góc liên kết ~107 ). o PF 3 3
5 có cấu trúc lưỡng tháp tam giác vì ở P có lai hóa sp d; 5 obitan lai hóa sp d của P xen phủ với
5 AO-d có electron độc thân của 5 nguyên tử F tạo ra 5 liên kết hướng về các đỉnh của lưỡng tháp tam giác. Trang 17/17
3. Sau khi trộn, nồng độ ban đầu của các cấu tử trong dung dịch A là: ; Do = 1,00 M >>
= 0,01 M và phức [Cu(NH3)4]2+ có β rất lớn, do vậy phản ứng sau xảy ra hoàn toàn: Cu2+ + 4NH 3 [Cu(NH3)4]2+ (1) Trước phản ứng (M) 0,01 1 Sau phản ứng (M) - 0,96 0,01
Sau khi trộn dung dịch A với dung dịch KCN ; ; Phản ứng: 2[Cu(NH - - +
3)4]2+ + 9CN + H2O ⇌ 2[Cu(CN)4]2- + CNO + 2NH4 + 6NH 3 K = ? 2 x NH + H + - -9,24 3 O 2 ⇌ NH4 + OH K = K b W/Ka = 10 2 x [Cu(NH3)4]2+ Cu ⇌ 2+ + 4NH3 10-12,28 2 x Cu2+ + e ⇌ Cu+ K = 102,58 2 x Cu2+ + 4CN- [Cu(CN) ⇌ 4]2- 1 x CN- + 2OH- CNO ⇌ - + H2O + 2e 2[Cu(NH - - +
3)4]2+ + 9CN + H2O ⇌ 2[Cu(CN)4]2- + CNO + 2NH4 + 6NH 3 (2) K = K . -1 43,74 b .K. .K = 10
Do K rất lớn nên phản ứng (2) xảy ra hoàn toàn: 2[Cu(NH - - +
3)4]2+ + 9CN + H2O ⇌ 2[Cu(CN)4]2- + CNO + 2NH4 + 6NH3
Trước phản ứng (M) 2.10-3 0,2 0,192
Sau phản ứng (M) - 0,191 2.10-3 1.10-3 2.10-3 0,198 Thành phần giới hạn: ; ; ; Tính pH của dung dịch B CN- + H O 2 HCN + OH ⇌ - (3) NH + - 3 + H O 2 NH ⇌ 4 + OH (4) H + - -14 2O ⇌ H + OH KW = 10 (5)
So sánh (3), (4) và (5) ta có thể bỏ qua cân bằng (5) so với cân bằng (3), (4). Vì [NH + + + + -3
4 ] = [NH4 ](1) + C(NH4 )có sẵn = [NH4 ](4) + 2.10 [NH + + -3 4 ](4) = [NH4 ] – 2.10
Theo (3) và (4) ta có biểu thức [OH-] = [HCN] + [NH + -3 4 ] – 2.10 (*) Trong đó:
Thay vào phương trình (*) ta được phương trình: (**)
Với giả thiết ban đầu [NH - 3] = ; [CN ] = . Thay vào (**) ta tính
được [H+] = 5,12.10-12M [OH-] = 1,95.10-3 M. Trang 18/17 Kiểm tra lại:
Cân bằng trong dung dịch B 2[Cu(CN) - + - -64,59 4]3- + CNO + 2NH4 + 6NH3 2[Cu(NH ⇌ 3)4]2+ + 9CN + H O 2 K = 10 (6)
C: 2.10-3 10-3 1,76.10-3 0,198 – 0,189
[ ]: (2.10-3-2x) (10-3-x) (1,76.10-3-2x) (0,198-6x) 2x (0,189 + 9x)
Giả thiết x << 10-3 thì ta được 0,1899x = 4,6875.10 2 -84
x = 3,9.10-39M (Giả thiết trên là đúng)
Thành phần cân bằng trong dung dịch B là: [CNO-] = 10-3M [CN-] = 0,189M [HCN] = 2,16.10-3M [NH + -3 3] = 0,198M [NH4 ] = 1,76.10 M [[Cu(CN) -39 4]3-] = 0,02M [[Cu(NH3)4]2+] = 3.9.10 M [H+] = 5,12.10-12M [OH-] = 1,95.10-3M Trang 19/17




