














Preview text:
MỤC LỤC
CHƯƠNG 1: NHỮNG KHÁI NIỆM VÀ ĐỊNH LUẬT CƠ BẢN TRONG HÓA
HỌC ...................................................................................................................................1
1.1. Một số khái niệm cơ bản..............................................................................................1
1.2. Một số định luật cơ bản ...............................................................................................2
1.3. Thuyết nguyên tử của Dalton ......................................................................................4
1.4. Hệ đơn vị .....................................................................................................................4
Chương 2: CẤU TẠO NGUYÊN TỬ VÀ BẢNG HỆ THỐNG TUẦN HOÀN
CÁC NGUYÊN TỐ HOÁ HỌC ..................................................................................... 7
2.1. Cấu tạo nguyên tử ........................................................................................................7
2.2. Các số lượng tử ............................................................................................................8
2.3. Các qui luật phân bố electron ....................................................................................10
2.4. Bảng hệ thống tuần hoàn các nguyên tố ....................................................................13
Chương 3: CẤU TẠO PHÂN TỬ VÀ LIÊN KẾT HOÁ HỌC .................................19
3.1. Liên kết hoá học không dựa trên cơ học lượng tử .....................................................19
3.2. Liên kết hoá học theo cơ học lượng tử ......................................................................22
Chương 4: PHỨC CHẤT ..............................................................................................28
4.1. Một số khái niệm .......................................................................................................28
4.2. Danh pháp các hợp chất phức ....................................................................................29
4.3. Hằng số tạo phức .......................................................................................................31
Chương 5: CẤU TẠO VẬT THỂ ..................................................................................32
5.1. Liên kết giữa các phân tử ...........................................................................................32
5.2. Các trạng thái tập hợp chất ........................................................................................36
Chương 6: NHIỆT ĐỘNG HOÁ HỌC .........................................................................39
6.1. Một số khái niệm cơ bản về nhiệt động học ..............................................................39
6.2. Nguyên lý thứ nhất của nhiệt động học .....................................................................40
6.3. Nhiệt hoá học .............................................................................................................41
6.4. Nguyên lý thứ hai của nhiệt động học .......................................................................44
Chương 7: ĐỘNG HOÁ HỌC VÀ CÂN BẰNG PHẢN ỨNG ..................................49
Trường Cao đẳng Dược Sài Gòn
215E, Nơ Trang Long, Phường 12, Quận Bình Thạnh, Tp. Hồ Chí Minh
Website: https://truongcaodangduocsaigon.edu.vn
7.1. Tốc độ phản ứng ........................................................................................................49
7.2. Phương trình động học của phản ứng ........................................................................53
7.3. Cân bằng hoá học .......................................................................................................54
Chương 8: SỰ HÌNH THÀNH VÀ TÍNH CHẤT CỦA DUNG DỊCH .....................58
8.1. Những vấn đề chung về nồng độ ...............................................................................58
8.2. Độ tan .........................................................................................................................61
8.3. Tính chất của dung dịch chứa chất tan không điện ly và không bay hơi ..................64
Chương 9: DUNG DỊCH CHẤT ĐIỆN LY ..................................................................67
9.1. Thuyết điện ly ............................................................................................................67
9.2. Thuyết acid – base .....................................................................................................69
9.3. Tích số ion của nước – pH của một số dung dịch .....................................................71
9.4. Dung dịch đệm ...........................................................................................................75
CHƯƠNG 10: PHẢN ỨNG OXY HOÁ KHỬ VÀ DÒNG ĐIỆN .............................78
10.1. Phản ứng oxy hoá khử .............................................................................................78
10.2. Pin Galvanic .............................................................................................................80
Chương 11: HOÁ VÔ CƠ ..............................................................................................84
11.1. Danh pháp chất vô cơ theo Dược điển việt nam ......................................................84
11.2. Một số chất vô cơ có liên quan đến ngành Dược ....................................................86
TÀI LIỆU THAM KHẢO ..............................................................................................92
Trường Cao đẳng Dược Sài Gòn
215E, Nơ Trang Long, Phường 12, Quận Bình Thạnh, Tp. Hồ Chí Minh
Website: https://truongcaodangduocsaigon.edu.vn
Trường Cao đẳng Dược Sài Gòn
215E, Nơ Trang Long, Phường 12, Quận Bình Thạnh, Tp. Hồ Chí Minh
Website: https://truongcaodangduocsaigon.edu.vn
Chương 1: Những khái niệm và định luật cơ bản trong hoá học CHƯƠNG 1:
NHỮNG KHÁI NIỆM VÀ ĐỊNH LUẬT CƠ BẢN TRONG HÓA HỌC Mục tiêu:
• Trình bày được một số khái niệm cơ bản trong Hoá học: Nguyên tử, nguyên tố, phân tử, hợp chất:
• Trình bày được các định luật cơ bản của Hoá học và biết cách vận dụng để giải các bài tập Hoá học:
• Rèn luyện tác phong thận trọng, tỉ mỉ, nghiêm túc, chính xác trong thực hành, học tập.
1.1. Một số khái niệm cơ bản
1.1.1. Nguyên tố hoá học
Nguyên tố hóa học là tập hợp các nguyên tử cùng loại có cùng số proton trong hạt nhân.
1.1.2. Đơn chất, hợp chất
- Đơn chất: là chất mà phân tử của nó chỉ gồm các nguyên tử của một nguyên tố liên kết với nhau.
Thí dụ: Na, C, O2, Fe, Cu, N2…
- Hợp chất: Là chất mà phân tử của nó gồm những nguyên tử của các nguyên tố
khác loại liên kết với nhau.
Thí dụ: BaO, KMnO4, NaCl… 1.1.3. Nguyên tử
Nguyên tử là phần tử nhỏ nhất của nguyên tố hoá học có trong thành phần của đơn chất và hợp chất.
Hóa học đại cương vô cơ | 1
Trường Cao đẳng Dược Sài Gòn
215E, Nơ Trang Long, Phường 12, Quận Bình Thạnh, Tp. Hồ Chí Minh
Website: https://truongcaodangduocsaigon.edu.vn
Chương 1: Những khái niệm và định luật cơ bản trong hoá học
Nguyên tử được cấu thành bởi lớp vỏ electron và hạt nhân. Trong hạt nhân nguyên tử
có 2 loại hạt cơ bản: proton và nơtron. 1.1.4. Phân tử
Phân tử là hạt vi mô đại diện cho chất có khả năng tồn tại độc lập và mang đầy đủ tính
chất hoá học của chất. Do vậy, nếu phân tử bị chia nhỏ thì nó không còn có đủ tính chất
hoá học của chất. Thông thường, phân tử gồm 2 nguyên tử trở lên liên kết với nhau (ngoại
trừ khí trơ gồm 1 nguyên tử). Những nguyên tử này có thể là cùng loại như phân tử oxy
hay khác loại như phân tử nước, phân tử khí carbonic... Các đơn chất của một kim loại là
tập hợp những nguyên tử của kim loại đó, vì vậy trong kim loại, nguyên tử cũng chính là phân tử.
1.2. Một số định luật cơ bản
1.2.1. Định luật bảo toàn khối lượng
Định luật: Khối lượng của các sản phẩm phản ứng bằng khối lượng của chất tham gia phản ứng - Ứng dụng:
a) Cân bằng phương trình hóa học:Sự bảo toàn khối lượng chứng tỏ trong phản ứng
hóa học chỉ xảy ra sự đổi chỗ của các nguyên tử từ phần tử này sang phần tử khác (hay số
nguyên tử của mỗi nguyên tố được bảo toàn). Do đó, số nguyên tử của mỗi nguyên tố ở 2
vế của phương trình phản ứng phải bằng nhau.
b) Tính khối lượng của các chất tham gia phản ứng và sản phẩm theo quy tắc tỉ lệ
thuận dựa theo phương trình phản ứng.
1.2.2. Định luật thành phần không đổi
Định luật: Một hợp chất dù được điều chế bằng cách nào đi nữa thì bao giờ cũng có
thành phần xác định và không đổi.
Thí dụ: Nước có thể được điều chế bằng nhiều cách khác nhau: - Đốt hydro trong oxy
- Đốt hydrocarbon trong oxy (hay trong không khí).
Hóa học đại cương vô cơ | 2
Trường Cao đẳng Dược Sài Gòn
215E, Nơ Trang Long, Phường 12, Quận Bình Thạnh, Tp. Hồ Chí Minh
Website: https://truongcaodangduocsaigon.edu.vn
Chương 1: Những khái niệm và định luật cơ bản trong hoá học
- Phản ứng của một acid và một base…
Song khi phân tích thành phần người ta đều thấy nước gồm 2 nguyên tố H và O với
tỉ lệ khối lượng không đổi là 1:8.
1.2.3. Phương trình trạng thái khí lý tưởng
Ở nhiệt độ không quá thấp và áp suất không quá cao (so với nhiệt độ và áp suất thường),
phần lớn các khí tuân theo một hệ thức gọi là phương trình trạng thái khí lí tưởng: PV=nRT
Với: P: áp suất của khí, V: thể tích của khí, n: số mol của khí,
T: nhiệt độ tuyệt đối, R: hằng số khí.
Các khí có tính chất thỏa mãn phương trình này được gọi là khí lí tưởng.
1.2.4. Định luật đương lượng 1.2.4.1. Khái niệm
- Đương lượng của một nguyên tố là số lượng nguyên tố đó có thể kết hợp hoặc thay thế
một mol nguyên tử hyđro trong phản ứng hoá học.
Thí dụ, trong các hợp chất HCl, H2O, PH3, CH4 đương lượng của các nguyên tố Cl, O,
P, C lần lượt là 1, 1/2, 1/3, 1/4 mol nguyên tử của nguyên tố đó.
- Khối lượng đương lượng (Đ) hay còn gọi là đương lượng khối của môt nguyên tố là
khối lượng tính ra gam của một đương lượng của nguyên tố đó.
- Cách tính đương lượng khối: = M E Z
- Với n được xác định như sau:
+ Đối với 1 nguyên tố: z= hóa trị của nó
Hóa học đại cương vô cơ | 3
Trường Cao đẳng Dược Sài Gòn
215E, Nơ Trang Long, Phường 12, Quận Bình Thạnh, Tp. Hồ Chí Minh
Website: https://truongcaodangduocsaigon.edu.vn
Chương 1: Những khái niệm và định luật cơ bản trong hoá học
+ Đối với một base: z= số nhóm –OH tham gia phản ứng
+ Đối với một acid: z= số nguyên tử H tham gia phản ứng H3PO4 + NaOH → NaH2PO4 + H2O H3PO4 + 2NaOH → Na2HPO4 + 2H2O H3PO4 + 3NaOH → Na3PO4 + H2O
Đương lượng của H3PO4 lần lượt là 98/1, 98/2, 98/3.
+ Đối với một muối: z= tổng điện tích của ion dương hoặc ion âm trong phân tử muối đó
1.2.4.2. Định luật đương lượng
Định luật: Các nguyên tố cũng như các hợp chất tác dụng vừa đủ với nhau theo các
khối lượng tỉ lệ thuận với đương lượng của chúng. m E A + B
→ các sản phẩm thì A = A m E B B
1.3. Thuyết nguyên tử của Dalton
Giả thuyết 1: Vật chất đề được tạo thành từ các nguyên tử.
Giả thuyết 2: Các nguyên tử của cùng một nguyên tố sẽ có cùng một cấu trúc và tính chất.
Giả thuyết 3: Các nguyên tử không thể bị phân chia, không thể được sinh ra hoặc mất đi.
Giả thuyết 4: Các nguyên tử của các nguyên tố khác nhau kết hợp với nhau để tạo ra các hợp chất.
Giả thuyết 5: Trong các phản ứng hóa học, các nguyên tử có thể kết hợp, phân tách hoặc tái sắp xếp lại 1.4. Hệ đơn vị
1.4.1. Các đơn vị cơ bản
Hóa học đại cương vô cơ | 4
Trường Cao đẳng Dược Sài Gòn
215E, Nơ Trang Long, Phường 12, Quận Bình Thạnh, Tp. Hồ Chí Minh
Website: https://truongcaodangduocsaigon.edu.vn
Chương 1: Những khái niệm và định luật cơ bản trong hoá học Đại lượng Đơn vị Kí hiệu Chiều dài Mét M Khối lượng Kilogam Kg Thời gian Giây S Dòng điện Ampe A Nhiệt độ Kelvin K Lượng chất Mol Mol Cường độ sáng Candela cd
1.4.2. Một số đơn vị trong Hoá học. 1.4.2.1. Mol
Mol là lượng vật chất chứa 6,022.1023 hạt vi mô (phân tử, nguyên tử, ion, electron, photon...).
1.4.2.2. Đơn vị khối lượng nguyên tử, phân tử
Đơn vị khối lượng nguyên tử (đơn vị carbon - đ.v.C) có khối lượng bằng 1/12 khối
lượng của nguyên tử carbon 12C.
1 đơn vị khối lượng nguyên tử = 1 đ.v.C = 1,66.10-27kg
Khối lượng nguyên tử tương đối của nguyên tố: là khối lượng trung bình tính theo
đ.v.C của nguyên tử của nguyên tố đó. Từ giá trị này sẽ tính ra được khối lượng nguyên tử
kilogam (theo đơn vị SI). Thí dụ, khối lượng tương đối của nguyên tử lưu huỳnh bằng 32
có nghĩa là khối luợng của một nguyên tử lưu huỳnh là 32 đ.v.C tương ứng với:
1,66.10-27 (kg) x 32 = 53,12.10-27kg.
* Khối lượng phân tử tương đối của hợp chất:
Hóa học đại cương vô cơ | 5
Trường Cao đẳng Dược Sài Gòn
215E, Nơ Trang Long, Phường 12, Quận Bình Thạnh, Tp. Hồ Chí Minh
Website: https://truongcaodangduocsaigon.edu.vn
Chương 1: Những khái niệm và định luật cơ bản trong hoá học
Khối lượng phân tử tương đối của hợp chất là khối lượng trung bình tính theo
đ.v.C phân tử của hợp chất. Từ giá trị này sẽ tính ra được khối lượng phân tử kilogam
(theo đơn vị SI). Thí dụ, khối lượng phân tử tương đối của CaCO3 bằng 100 có nghĩa là
một phân tử CaCO3 có khối lượng 100 đ.v.C, tương ứng với:
1,66.10-27 (kg) x 100 = 1,66.10-25kg.
Hóa học đại cương vô cơ | 6
Trường Cao đẳng Dược Sài Gòn
215E, Nơ Trang Long, Phường 12, Quận Bình Thạnh, Tp. Hồ Chí Minh
Website: https://truongcaodangduocsaigon.edu.vn
Chương 2: Cấu tạo nguyên tử và bảng hệ thống tuần hoàn các nguyên tố hoá học Chương 2:
CẤU TẠO NGUYÊN TỬ VÀ BẢNG HỆ THỐNG
TUẦN HOÀN CÁC NGUYÊN TỐ HOÁ HỌC Mục tiêu:
• Trình bày được hai cách biểu diễn nguyên tử (cấu hình electron và sơ đồ ô lượng tử):
• Trình bày được cấu tạo bảng hệ thống tuần hoàn Mendeleep:
• Trình bày được một số tính chất tuần hoàn các nguyên tố Hoá học:
• Vận dụng làm được các bài tập về hóa học, độ âm điện, năng lượng ion hóa:
• Rèn luyện tác phong thận trọng, tỉ mỉ, nghiêm túc, chính xác trong thực hành, học tập.
2.1. Cấu tạo nguyên tử
Một nguyên tử được cấu tạo từ một hạt nhân đặc khít tích điện tương và hạt nhân này
được bao quanh bởi các điện tử tích điện âm nằm ở khoảng cách khá xa hạt nhân
(Hình 2.1). Hạt nhân được cấu tạo từ các hạt thứ cấp gọi là proton, tích điện dương, và
neutron, trung hòa về điện. Bởi vì nguyên tử vốn dĩ trung hòa về điện, nên số proton tích
điện dương tổng cộng trong hạt nhân và số điện tử tích điện âm ở vùng không gian xung
quanh hạt nhân chắc chắn phải bằng nhau.
Hình 2.1: Mô hình nguyên tử. Hạt nhân đặt khít tích điện dương tập trung hầu hết khối
lượng của nguyên tử và được bao bọc bởi các điện tử tích điện âm. Phối cảnh ba chiều bên
phải cho thấy bề mặt tập trung điện tử theo tính toán. Mật độ điện tử tăng dần khi càng tiến
về phía hạt nhân và lớn gấp 40 lần ở bề mặt của khối rắn màu xanh so với bề mặt lưới màu xám.
Mặc dù có đường kính rất nhỏ, vào khoảng 10-4 đến 10-5 met (m), hạt nhân lại là nơi
chứa đựng hầu như toàn bộ khối lượng của nguyên tử. Điện tử nhẹ đến nỗi có thể bỏ qua
khối lượng của chúng và di chuyển vòng quanh hạt nhân ở khoảng cách vào khoảng
10-10 m. Do đó, một nguyên tử thường có đường kính vào khoảng 2 × 10-10 m, hoặc 200
Hóa học đại cương vô cơ | 7
Trường Cao đẳng Dược Sài Gòn
215E, Nơ Trang Long, Phường 12, Quận Bình Thạnh, Tp. Hồ Chí Minh
Website: https://truongcaodangduocsaigon.edu.vn
Chương 2: Cấu tạo nguyên tử và bảng hệ thống tuần hoàn các nguyên tố hoá học
picomet (pm), trong đó 1 pm = 10-12 m. Để có thể hình dung được sự nhỏ nhắn của nguyên
tử, hãy cùng xem một thí dụ về một đường viết chì mảnh. Đường viết chì này có độ rộng
tương đương với 3 triệu nguyên tử carbon. Các nhà hóa học và hóa sinh học vẫn còn sử
dụng đơn vị angstrom (Å) để biểu diễn khoảng cách trong nguyên tử, trong đó 1Å = 100pm = 10-10 m.
2.2. Các số lượng tử
Các hàm sóng Ψ được gọi là các orbital nguyên tử (viết tắt là AO) và kí hiệu lần
lượt là: ls, 2s, 2p ...3d... Trong đó các chữ số dùng để chỉ lớp orbital, còn các chữ cái
s, p, d dùng để chỉ các phân lớp.
Mỗi hàm sóng Ψ (hay mỗi AO) được đặc trưng bởi 4 tham số n, 1, m, ms gọi là
các số lượng tử. Các số lượng tử xuất hiện trong quá trình giải phương trình
Schrodinger để tìm một số đại lượng vật lí đặc trưng cho một AO như năng lượng,
momen động lượng, hình chiếu của momen động lượng, momen quay của electron trên AO đó.
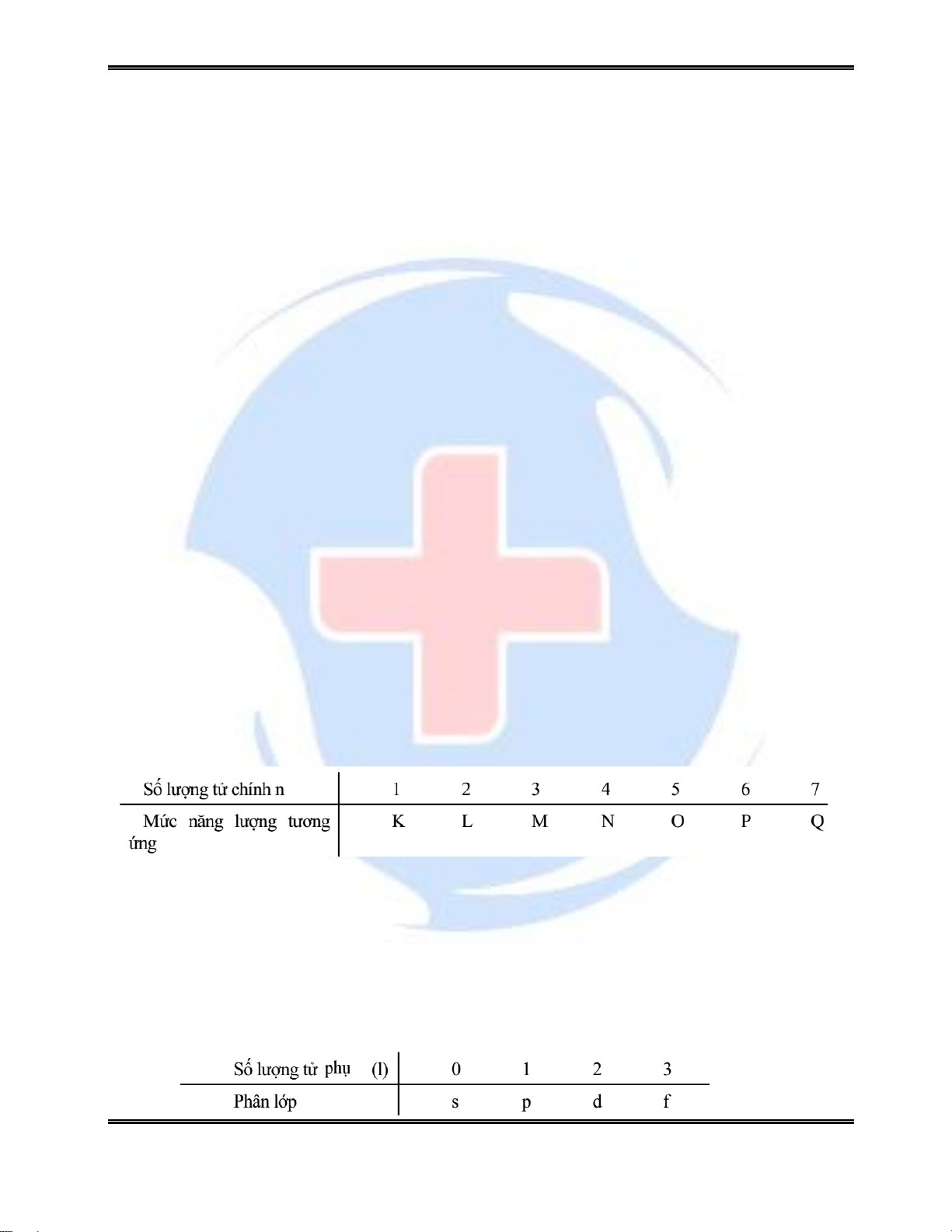
2.2.1. Số lượng tử chính n
Về trị số: nhận các giá trị nguyên dương: 1, 2 ...
Về ý nghĩa: xác định năng lượng của electron hay lớp electron
Các AO có n giống nhau sẽ có cùng một mức năng lượng và tạo ra một lớp orbital nguyên tử
2.2.2. Số lượng tử phụ l – Phân lớp electron
Về trị số: l nhận các giá trị nguyên từ 0 đến (n - 1). Ứng với một giá trị của n thì có n giá trị của l.
Về ý nghĩa: Xác định hình dạng và tên của orbital. Những electron có cùng giá trị l
lập nên một phân lớp và có năng lượng như nhau. Lớp thứ n có n phân lớp.
Hóa học đại cương vô cơ | 8
Trường Cao đẳng Dược Sài Gòn
215E, Nơ Trang Long, Phường 12, Quận Bình Thạnh, Tp. Hồ Chí Minh
Website: https://truongcaodangduocsaigon.edu.vn
Chương 2: Cấu tạo nguyên tử và bảng hệ thống tuần hoàn các nguyên tố hoá học
Hình 2.2. Hình dạng các mây điện tử s, p và d
Muốn chỉ ra một phân lớp thuộc lớp nào người ta viết số thứ tự lớp trước kí hiệu phân lớp.
Thí dụ: 2s chỉ electron (hayAO) thuộc phân lớp s (1 = 0) của lớp 2 (n = 2). 3d
d (1 = 2). . . 3 (n = 3).
2.2.3. Số lượng tử từ ml
m nhận các giá trị từ - 1 đến + 1 kể cả số 0. Như vậy ứng với một giá trị của 1
có 21 + 1 giá trị của m.
Hóa học đại cương vô cơ | 9
Trường Cao đẳng Dược Sài Gòn
215E, Nơ Trang Long, Phường 12, Quận Bình Thạnh, Tp. Hồ Chí Minh
Website: https://truongcaodangduocsaigon.edu.vn
Chương 2: Cấu tạo nguyên tử và bảng hệ thống tuần hoàn các nguyên tố hoá học
Như vậy các AO có m khác nhau sẽ định hướng khác nhau trong không gian, m
quyết định hướng của AO hay hướng của mây electron.
Phân lớp s 1 = 0 m = 0
chỉ có một cách định hưóng
Phân lớp p 1=1 m = -1, 0,+1 có ba cách định hướng tương ứng: px, pz, pz
Phân lớp d 1 = 2 m= -2, -1, 0, +1, +2 có năm cách định hướng tương ứng: dxy , dyz, dz2 , dx2y2, d zx
2.2.4. Số lượng tử spin ms
Nghiên cứu quang phổ của các nguyên tố người ta thấy cần giả thiết thêm rằng
electron ngoài chuyển động quanh nhân còn tự quay quanh trục riêng của nó. Chuyển
động này được gọi là spin và được đặc trưng bằng số lượng tử spin ms
Về giá trị: chỉ nhận một trong 2 giá trị +1/2 hay -1/2 và không phụ thuộc gì vào các số lượng tử trên.
Về ý nghĩa: đặc trưng cho độ dao động tự do của electron
Trong từ trường ngoài trạng thái m = +1/2 có năng lượng thấp hơn. s
Như vậy, một điện tử trong nguyên tử được xác định bằng 4 số lượng tử: n, l, ml, ms.
Các số lượng tử này đặc trưng cho năng lượng, thể tích, hình dạng và spin của điện tử. Khi
nguyên tử thay đổi từ trạng thái lượng tử này sang trạng thái lượng tử khác thì giá trị của
các số lượng tử cũng thay đổi và mây điện tử sẽ được sắp xếp lại.
2.3. Các qui luật phân bố electron
2.3.1. Nguyên lý Pauli
Năm 1925, Pauli đã phát biểu nguyên lí: Trong một nguyên tử không thể có 2 điện tử
có 4 số lượng tử hoàn toàn giống nhau. Từ nguyên lý Pauli có thể dễ dàng nhận thấy rằng,
trên một orbital chỉ có thể có 2 điện tử với số spin (-1/2) và (+1/2). Như vậy, phân lớp s (có
1 orbital) chỉ có thể có tối đa 2 điện tử; p (3 orbital) – 6 điện tử; d (5 orbital) – 10 điện tử; f
(7 orbital) – 14 điện tử ...
Hóa học đại cương vô cơ | 10
Trường Cao đẳng Dược Sài Gòn
215E, Nơ Trang Long, Phường 12, Quận Bình Thạnh, Tp. Hồ Chí Minh
Website: https://truongcaodangduocsaigon.edu.vn
Chương 2: Cấu tạo nguyên tử và bảng hệ thống tuần hoàn các nguyên tố hoá học
2.3.2. Nguyên lý vững bền
Trong nguyên tử các điện tử có xu hướng chiếm các ô lượng tử thuộc những phân lớp
có mức năng lượng thấp nhất. Khi nguyên tử có mức năng lượng thấp nhất là nguyên tử
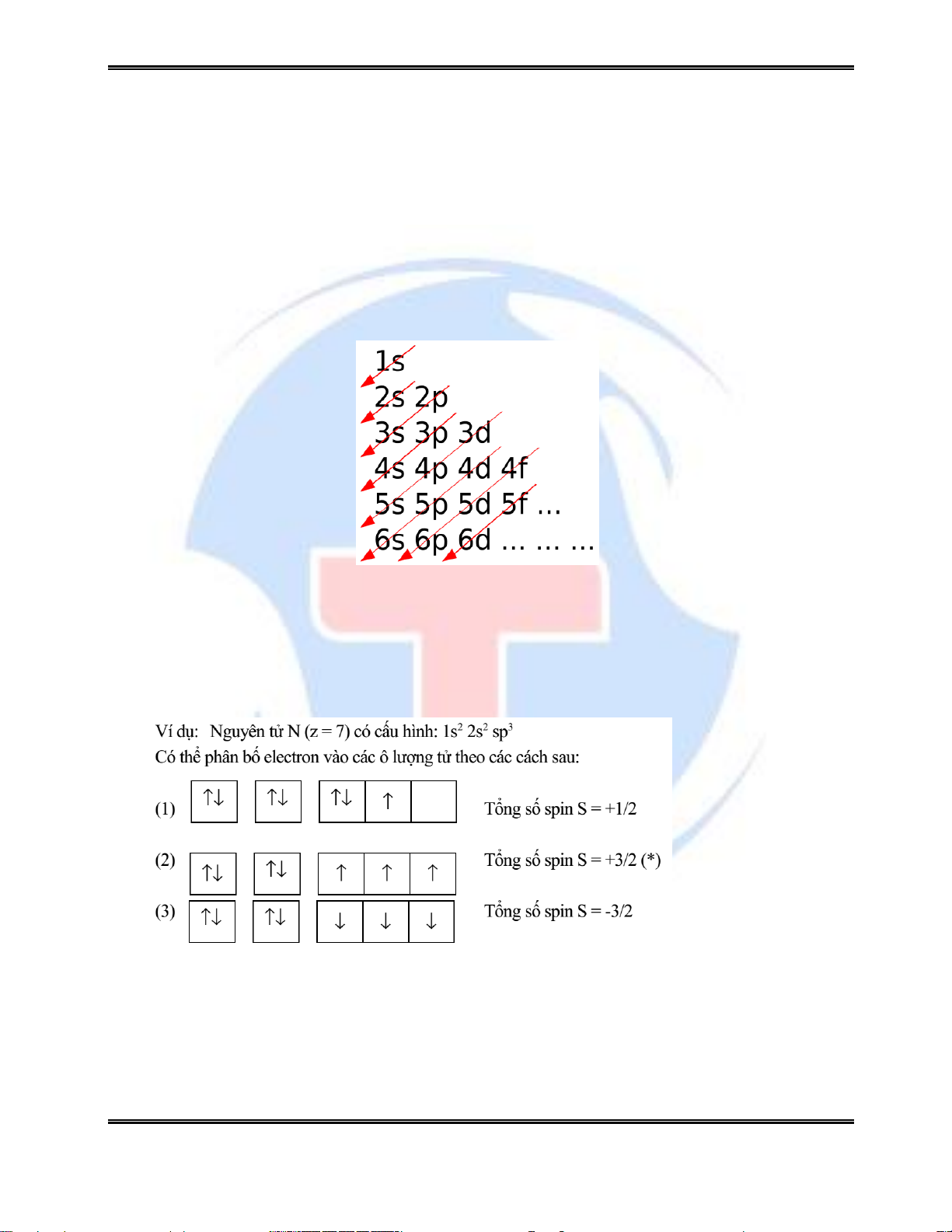
đang nằm ở trạng thái bền nhất. Trạng thái này được gọi là trạng thái cơ bản. Qui tắc Klechkowski:
Trong nguyên tử, năng lượng của các phân lớp electron tăng dần theo thứ tự sau: 1s 2s
2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s … 2.3.3. Qui tắc Hund
“Các electron của một nguyên tử có xu hướng chiếm khắp các obitan có năng lượng
như nhau theo cách nào đó để tổng spin của chúng là tối đa”.
Cu (z = 29) ls2 2s2 2p6 3s2 3p6 3d10 4s1
Cr (z = 24) ls2 2s2 2p6 3s2 3p6 3d5 4s1
Cấu hình 3d10 4s1 (trạng thái vội bão hoà) bền hơn cấu hình 3d9 4s2
Cấu hình 3d5 4s1 (trạng thái vội nửa bão hoà) bền hơn cấu hình 3d4 4s2
Hóa học đại cương vô cơ | 11
Trường Cao đẳng Dược Sài Gòn
215E, Nơ Trang Long, Phường 12, Quận Bình Thạnh, Tp. Hồ Chí Minh
Website: https://truongcaodangduocsaigon.edu.vn
Chương 2: Cấu tạo nguyên tử và bảng hệ thống tuần hoàn các nguyên tố hoá học
Ngoài cách biểu diễn các AO dưới dạng công thức như trên, người ta còn biểu diễn
mỗi AO bằng một ô vuông gọi là ô lượng tử. Các AO của cùng một phân mức được biểu
diễn bằng những ô vuông liền nhau. Thí dụ: ls 2s 2p 3d
Trong mỗi ô lượng tử (mỗi AO) chỉ có thể có 2 electron có spin ngược nhau được
biểu diễn bằng 2 mũi tên ngược nhau
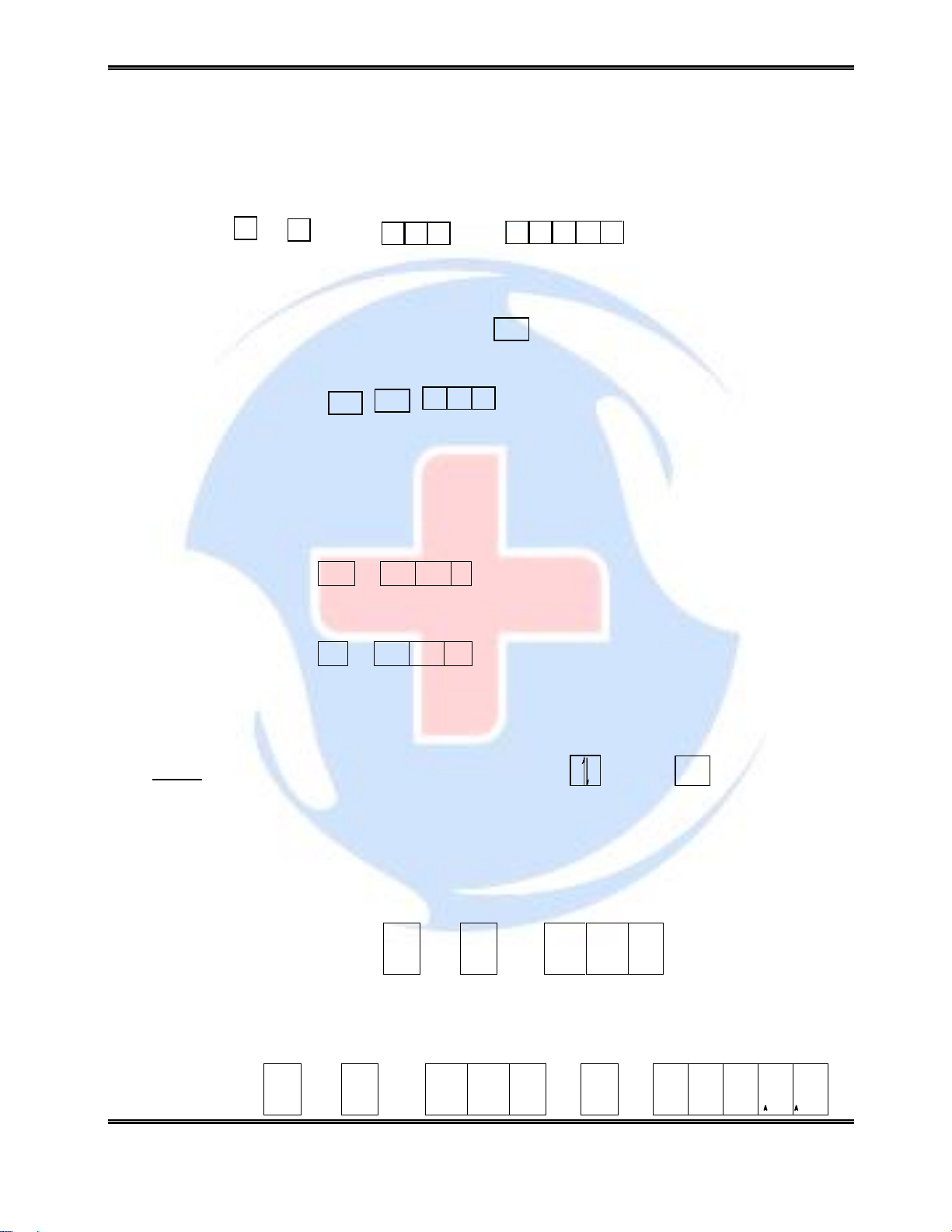
Thí dụ :N (z = 7) ls2 2s2 2p3 ↑ ↑ ↑ ↓↑ ↓↑
Thông thường chỉ cần viết cấu hình electron đối với các phân mức ở lớp ngoài cùng
và phân mức d hoặc f ở lớp sát ngoài cùng mà chưa bão hoà.
Thí dụ: C (z = 6) 2s2 2p2 Trạng thái cơ bản ↑↓ ↑ ↑ C* ↑ ↑ ↑ ↑ Trạng thái kích thích
Như vậy ở trạng thái cơ bản C có hai electron độc thân còn ở trạng thái kích thích nó có bốn
electron độc thân. Chính các electron độc thân này là các electron hoá trị. ↓↑
Chú ý: biễu diễn 2 electron cùng một orbital có thể là hoặc ; nhưng nếu là
electron độc thân phải là
Một số Thí dụ:
O (Z = 8) Cấu hình electron: Dạng chữ 1s2 2s2 2p4 Dạng ô lượng tử ↓↑ ↑↓ ↑↓ ↑ ↑
S (Z=16) Cấu hình electron: Dạng chữ 1s2 2s2 2p6 3s2 3p4 ↓↑ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑ ↑ ↑ ↑ Dạng ô lượng tử
Hóa học đại cương vô cơ | 12
Trường Cao đẳng Dược Sài Gòn
215E, Nơ Trang Long, Phường 12, Quận Bình Thạnh, Tp. Hồ Chí Minh
Website: https://truongcaodangduocsaigon.edu.vn
Chương 2: Cấu tạo nguyên tử và bảng hệ thống tuần hoàn các nguyên tố hoá học
2.4. Bảng hệ thống tuần hoàn các nguyên tố
2.4.1. Cấu tạo bảng hệ thống tuần hoàn
2.4.1.1.Nguyên tắc sắp xếp
Bảng hệ thống tuần hoàn các nguyên tố được sắp xếp theo các nguyên tắc cơ bản
- Các nguyên tố được sắp xếp theo trật từ tăng dần số hiệu nguyên tử (số thứ tự) từ
trái sang phải và từ trên xuống dưới.
- Những nguyên tố mà nguyên tử có cùng số lớp vỏ electron được xếp trong cùng 1
hàng; cùng số electron hóa trị thuộc phân lớp s, p được xếp trên cùng một cột. Các nguyên
tố mà nguyên tử có electron cuối cùng thuộc phân lớp d, f được xếp vào cột phụ (phân nhóm phụ).
- Các nguyên tố mà nguyên tử có electron cuối cùng thuộc phân lớp s, p được
xếp vào nhóm chính, nhóm A. Nhóm phụ được ký hiệu là nhóm B
2.4.1.2.Các đặc điểm nổi bậc
Theo kết quả nghiên cứu tính đến năm 2015, bảng hệ thống tuần hoàn các nguyên tố
hóa học chứa số lượng các nguyên tố được xếp trong 7 chu kỳ (hàng) và 8 nhóm (cột).
Ô nguyên tố: Mỗi nguyên tố hóa học được xếp vào 1 ô của bảng, gọi là ô nguyên tố.
STT của ô nguyên tố bằng số hiệu nguyên tử của nguyên tố đó.
Thí dụ: Mg chiếm ô 12 trong bảng tuần hoàn
→ Số hiệu nguyên tử của Mg là 12.
→ Hạt nhân nguyên tử Mg có 12 p.
→ Vỏ nguyên tử Mg có 12 e.
Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được
xếp theo chiều điện tích hạt nhân tăng dần.
- Có 7 chu kì tương ứng với 7 lớp e của nguyên tử.
- Chu kì thường bắt đầu bằng một kim loại kiềm và kết thúc bằng một khí hiếm (trừ chu kì 1 ,chu kì 7).
Nhóm nguyên tố là tập hợp các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau. Các khối nguyên tố
Hóa học đại cương vô cơ | 13
Trường Cao đẳng Dược Sài Gòn
215E, Nơ Trang Long, Phường 12, Quận Bình Thạnh, Tp. Hồ Chí Minh
Website: https://truongcaodangduocsaigon.edu.vn
Chương 2: Cấu tạo nguyên tử và bảng hệ thống tuần hoàn các nguyên tố hoá học
+ Khối nguyên tố s: gồm nhóm IA (kim loại kiềm) và nhóm IIA (kim loại kiềm thổ)
+ Khối nguyên tố p: gồm nhóm IIIA đến VIIIA.
→ Nhóm A gồm khối nguyên tố s và p.
+ Khối nguyên tố d: gồm các nhóm IB đến VIIIB.
+ Khối nguyên tố f: gồm các nguyên tố nằm ở hai hàng cuối bảng.
→ Nhóm B gồm khối nguyên tố d và f.
2.4.2. Một số tính chất tuần hoàn của các nguyên tố
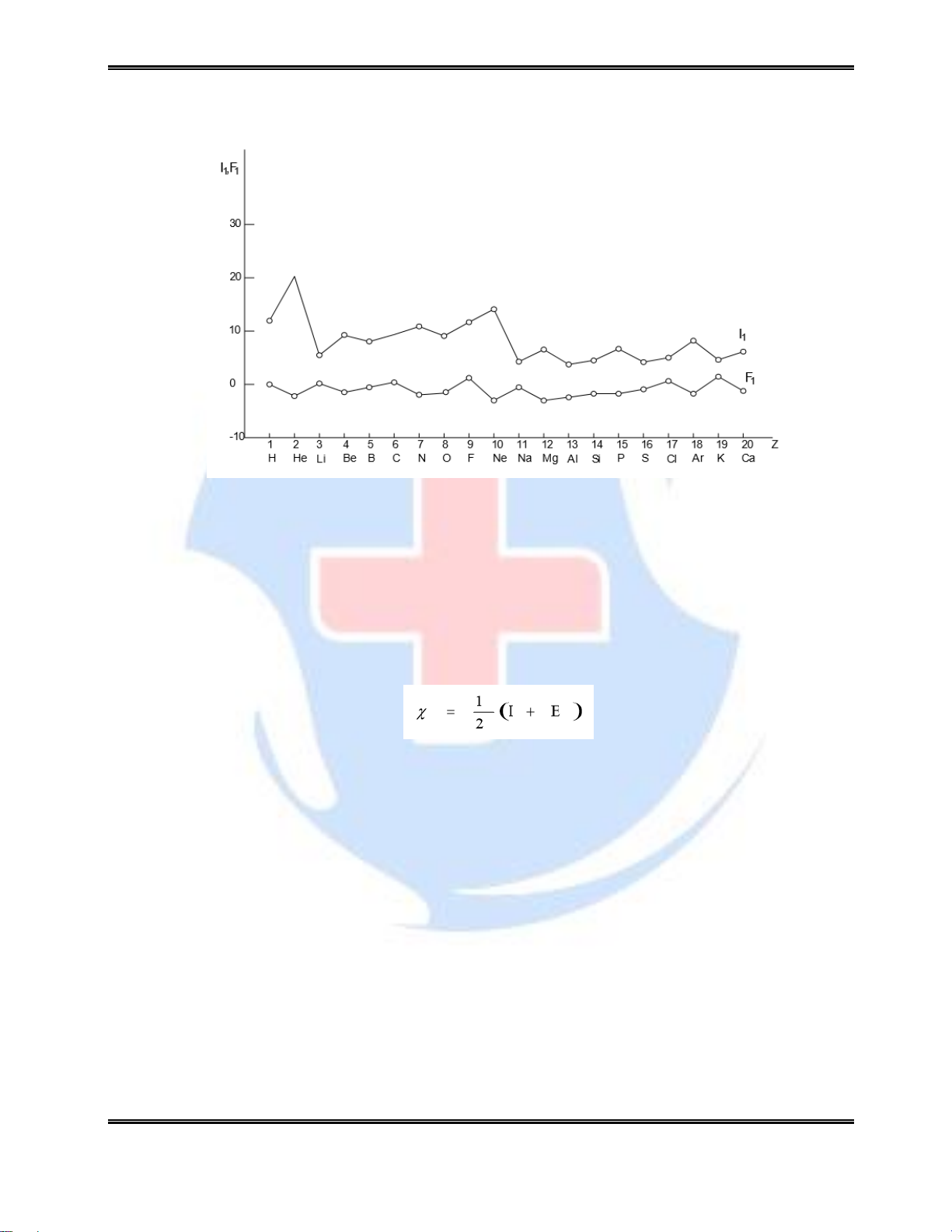
2.4.2.1. Năng lượng ion hóa
Hình 2.3. Sự phụ thuộc I vào số thứ tự Z
Năng lượng ion hoá I là năng lượng cần thiết để tách một điện tử ra khỏi nguyên tử
nằm ở trạng thái cơ bản: Z → Z+ + e Năng lượng ion hoá có giá trị dương. Đối với
nguyên tử có nhiều điện tử, năng lượng ion hoá lần lượt có các giá trị I1, I2, I3,... tương ứng
với điện tử thứ nhất, thứ hai, thứ ba ... trong đó I1 < I2 < I3... Năng lượng ion hoá biến đổi
có tính chu kỳ và nhìn chung theo quy luật: các nguyên tố đầu chu kỳ có năng lượng ion
hoá thấp, cuối chu kỳ có năng lượng cao.
2.4.2.2. Ái lực electron
ái lực với điện tử e là năng lượng toả ra hay thu vào khi một nguyên tử nhận một
electron. Z + e → Z- ái lực với điện tử có giá trị bằng năng lượng ion hoá nhưng khác
Hóa học đại cương vô cơ | 14
Trường Cao đẳng Dược Sài Gòn
215E, Nơ Trang Long, Phường 12, Quận Bình Thạnh, Tp. Hồ Chí Minh
Website: https://truongcaodangduocsaigon.edu.vn
Chương 2: Cấu tạo nguyên tử và bảng hệ thống tuần hoàn các nguyên tố hoá học
dấu ( dấu âm). ái lực với điện tử biến đổi có tính chất tuần hoàn. Sự tuần hoàn đó phụ thuộc
vào cấu hình điện tử của nguyên tử - số thứ tự Z.
Hình 2.4. Sự biến đổi tuần hoàn I và E theo Z
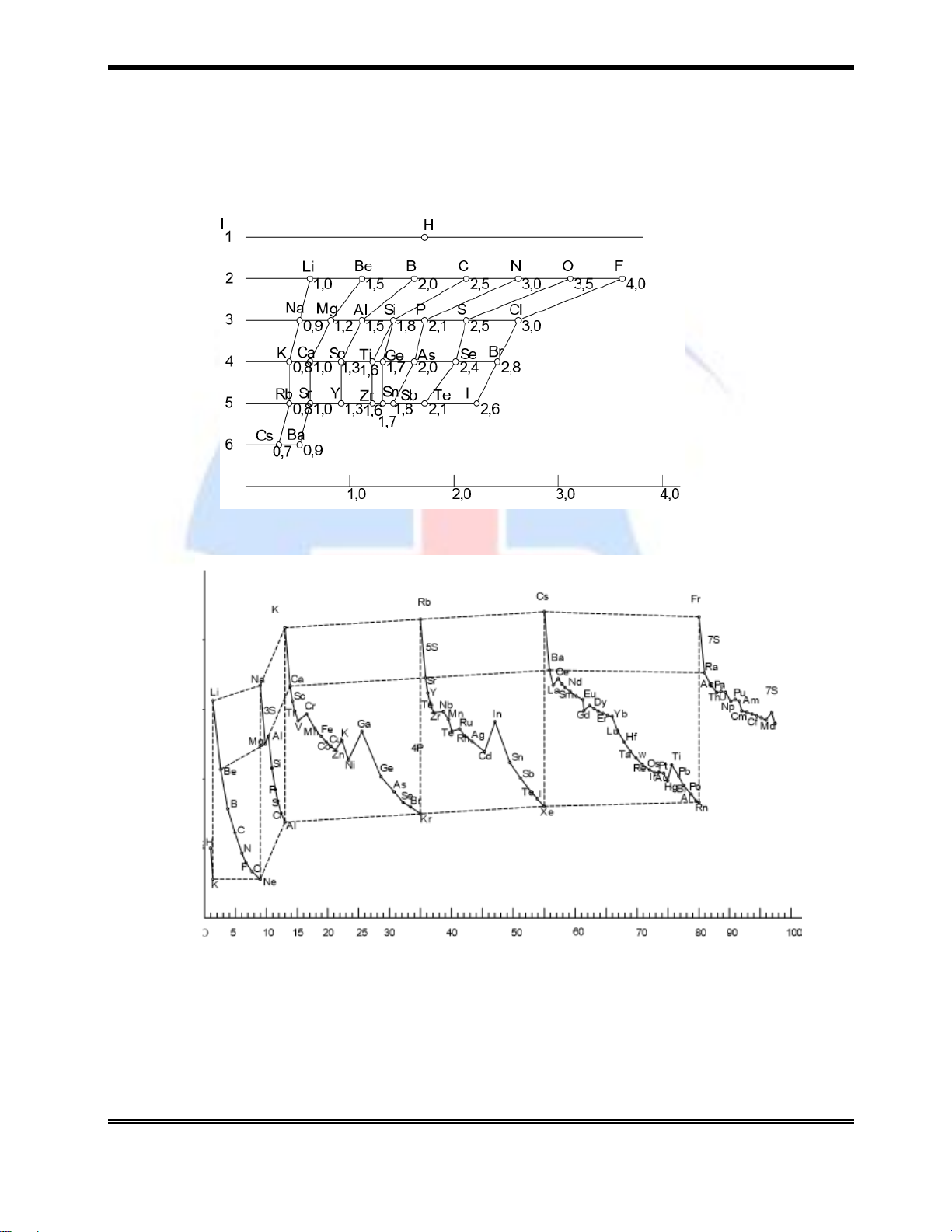
2.4.2.3. Độ âm điện
Độ âm điện là khả năng hút điện tử về phía mình của một nguyên tử này so với nguyên
tử khác trong một phân tử. Theo Mallikel, độ âm điện c có thể được xác định theo công thưc sau:
trong đó - I là năng lượng ion hoá thứ nhất
- E ái lực với điện tử Hiện tại có khá nhiều thang đo độ âm điện khác nhau
(khoảng 20 thang đo) nhưng thang đo theo Flo ( = 4) thường hay được sử dụng. Sự biến
đổi độ âm điện của các nguyên tố theo thang đo này (độ âm điện theo Pauling) được trình bày trên hình 2.4.
Độ âm điện của các nguyên tố tăng từ trái sang phải theo chu kỳ và nhìn chung tăng từ
dưới lên trên theo phân nhóm. Các nguyên tố s của nhóm I có độ âm điện nhỏ nhất, các
nguyên tố p của nhóm VII có độ âm điện lớn nhất.
Hóa học đại cương vô cơ | 15
Trường Cao đẳng Dược Sài Gòn
215E, Nơ Trang Long, Phường 12, Quận Bình Thạnh, Tp. Hồ Chí Minh
Website: https://truongcaodangduocsaigon.edu.vn
Chương 2: Cấu tạo nguyên tử và bảng hệ thống tuần hoàn các nguyên tố hoá học
2.4.2.4. Bán kính nguyên tử
Sự thay đổi bán kính nguyên tử và bán kính ion (rZ) của các nguyên tố theo số thứ tự
Z có tính chất tuần hoàn (hình 2.5): tăng từ trên xuống dưới theo phân nhóm và giảm từ trái sang phải theo chu kỳ.
Hình 2.5. Sự biến đổi độ âm điện theo Pauling
Hình 2.6. Sự thay đổi bán kính nguyên tử theo Z
2.4.2.5. Tính kim loại, tính phi kim
Trong một chu kỳ khi đi từ trái sang phải, theo chiều tăng điện tích hạt nhân, tính kim
loại giảm dần, tính phi kim tăng dần
Hóa học đại cương vô cơ | 16
Trường Cao đẳng Dược Sài Gòn
215E, Nơ Trang Long, Phường 12, Quận Bình Thạnh, Tp. Hồ Chí Minh
Website: https://truongcaodangduocsaigon.edu.vn
Chương 2: Cấu tạo nguyên tử và bảng hệ thống tuần hoàn các nguyên tố hoá học
Trong một nhóm khi đi từ trên xuống theo chiều tăng điện tích hạt nhân, tính kim loại
tăng dần, tính phi kim giảm dần.
Hóa học đại cương vô cơ | 17
Trường Cao đẳng Dược Sài Gòn
215E, Nơ Trang Long, Phường 12, Quận Bình Thạnh, Tp. Hồ Chí Minh
Website: https://truongcaodangduocsaigon.edu.vn



