



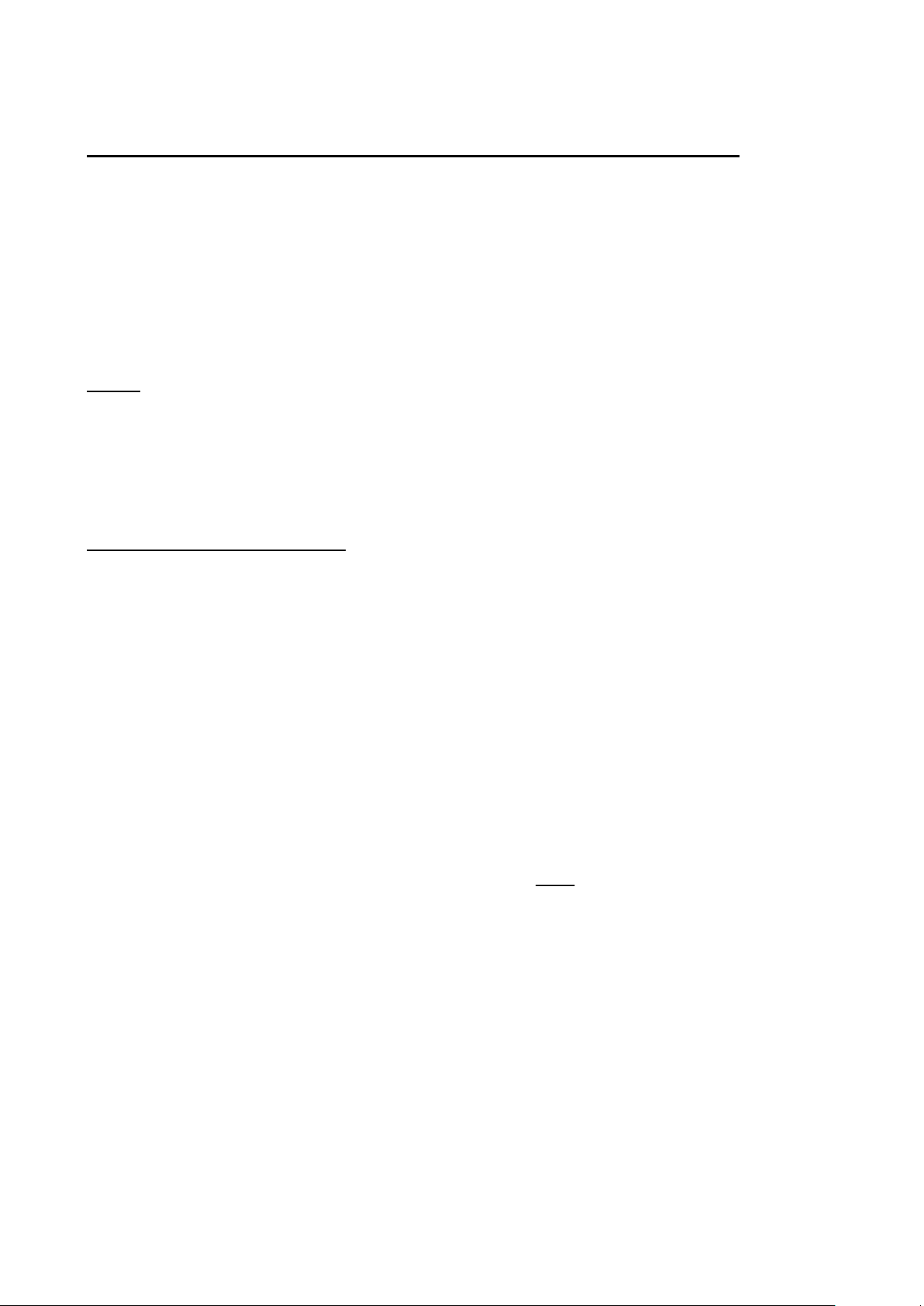






Preview text:
lOMoAR cPSD| 47205411
Ngô Phước Long – M1K73 – 2022
BÀI 3: MỘT SỐ PHƯƠNG PHÁP HÓA LÝ
ỨNG DỤNG TRONG KIỂM NGHIỆM THUỐC Mục tiêu:
1. Trình bày được nguyên tắc và đặc điểm của kỹ thuật: UV-VIS, IR, HPLC, TLC.
2. Trình bày được ứng dụng của bốn kỹ thuật trên để định tính và định lượng trong kiểm nghiệm dược phẩm.
3. Áp dụng kỹ thuật UV-VIS, HPLC, TLC để xây dựng phương pháp định tính và định lượng cho
nguyên liêu và các dạng chế phẩm.
3 nhóm phương pháp hóa lý tập trung cần học:
- Phương pháp quang học: phổ UV-VIS + phổ IR.
- Phương pháp tách: HPLC + TLC.
- Phương pháp điện hóa (tự học).
Dược điển thường sử dụng:
- Dược điển Việt Nam V: làm tiêu chuẩn QG – tiêu chuẩn sàn (tối thiểu cần đạt).
- Dược điển Mỹ USP 43 (2021). - Dược điển Anh. - Dược điển châu Âu.
- Dược điển Trung Quốc.
Ví dụ về chuyên luận Paracetamol:
- Gồm 5 nhóm phương pháp định tính chia làm 2 nhóm lớn:
+ Nhóm 1: phương pháp đo IR và chỉ cần đo thêm điểm chảy để xác định độ tinh khiết là xong.
+ Nhóm 2: ngoài phương pháp đo UV thì cần dùng thêm phương pháp chuẩn độ để định tính tăng độ chính xác.
- Thử tạp chất: dùng sắc ký lỏng hiệu năng cao.
- Định lượng: dùng phương pháp đo quang.
Quang phổ hấp thụ phân tử UV-VIS: định tính, định lượng 1 thành phần, định lượng 2-3 thành phần (không thi).
- Định lượng 2-3 thành phần: phương pháp quang phổ đạo hàm hoặc phương pháp dựa theo tính cộng tính.
Sắc ký lỏng hiệu năng cao HPLC: định tính, định lượng 2 thành phần trở lên.
I. QUANG PHỔ HẤP THỤ PHÂN TỬ (UV-VIS)
1. Sự hấp thụ ánh sáng
- Giữa 3 vùng: UV, VIS, IR thì vùng UV cho năng lượng lớn nhất. Trong vùng VIS thì tia cực tím
có năng lượng lớn nhất. Trong KN chủ yếu dùng tia UV gần, VIS, IR.
- Vùng VIS 380-760nm; vùng UV gần 200-400nm, vùng IR > 760nm.
- QPHTPT dựa trên sự tương tác của bức xạ điện tử đối với phân tử chất phân tích: lOMoAR cPSD| 47205411
Ngô Phước Long – M1K73 – 2022 ℎ.𝑐
+ Ánh sáng có bước sóng càng ngắn thì năng lượng càng lớn, dựa vào công thức: 𝐸 = = ℎ. 𝜈 𝜆
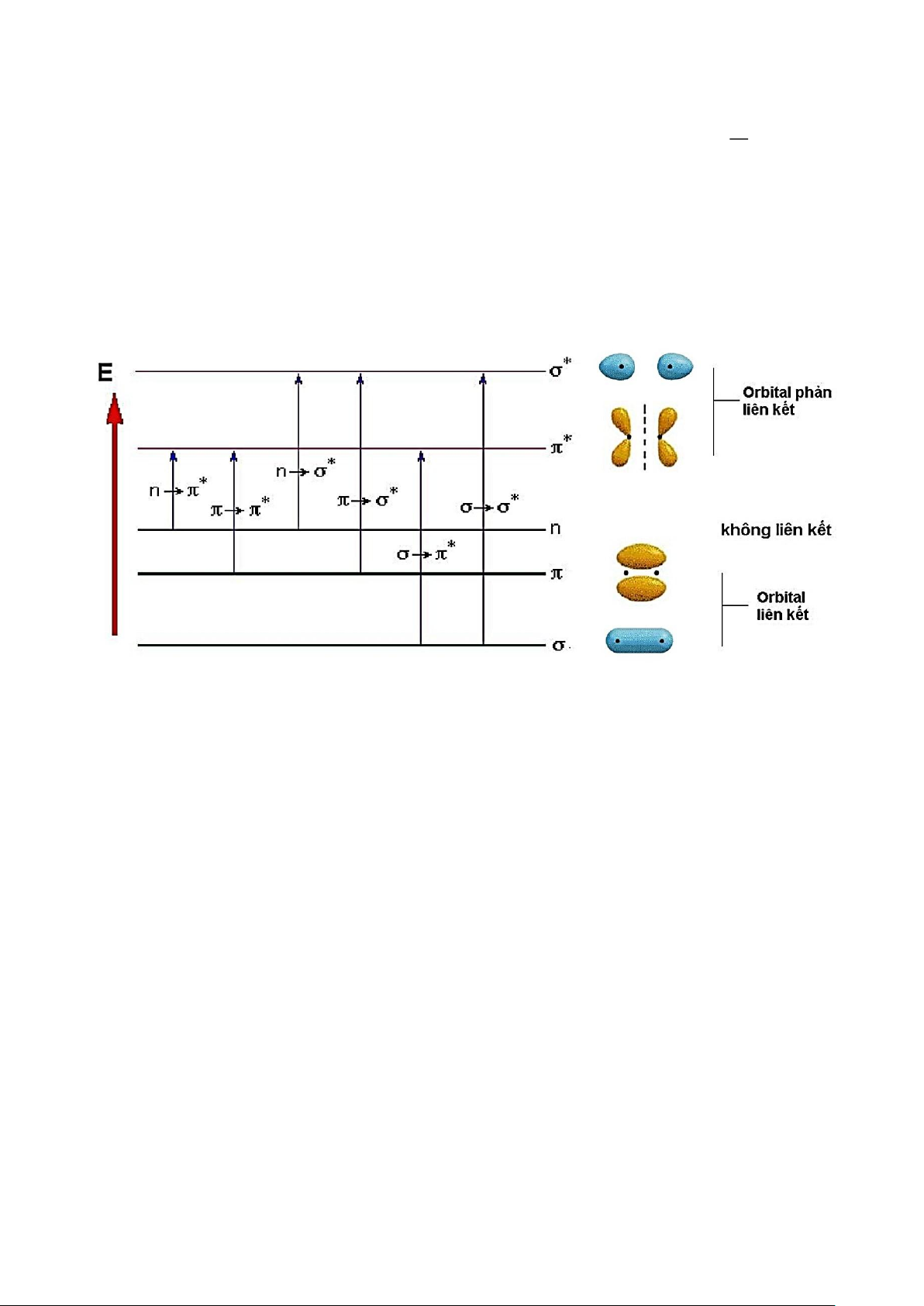
+ Phân tử từ trạng thái cơ bản + nhận năng lượng trạng thái kích thích:
• Chiếu tia UV vào phân tử chất PT: electron của chất PT chuyển từ mức năng lượng E0 lên
mức năng lượng E2 phổ UV là phổ điện tử.
• Chiếu tia VIS vào phân tử chất PT: electron của chất PT chuyển từ mức năng lượng E0 lên
mức năng lượng E1 phổ VIS là phổ điện tử.
• Chiếu tia IR vào phân tử chất PT: electron của chất PT dao động xung quanh vị trí cân bằng
phổ IR = phổ dao động xác định các nhóm chức.
2. Cấu tạo các chất hóa học để hấp thụ UV-VIS
+ Chất HC chứa liên kết đơn không áp dụng: vì liên kết đơn -C-H và -C-C- có trong phân tử các
hydrocarbon no chứa cặp điện tử σ. Để từ trạng thái σ lên σ* cần mức năng lượng lớn nhất của
nguồn sáng có λ<200nm thuộc vùng UV xa (chân không).
+ Áp dụng cho các phân tử:
• Có các liên kết đôi, liên kết ba, vòng thơm, dị vòng -C=C-, -C=O ngưng tụ càng nhiều thì có
nhiều cặp điện tử π. Để từ trạng thái π lên π * cần mức năng lượng thấp hơn.
• Có chứa các dị nguyên tố có đôi điện tử tự do (n π*) như S, N, O, Cl, -OH, -OR, -NH2,…
+ Không dùng vùng bước sóng < 200nm do:
• Năng lượng quá lớn khiến phá vỡ liên kết hóa học khiến chất bị phân hủy.
• Dung môi hòa tan các chất này (methanol, acetonitril,…) lại có thể hấp thụ năng lượng ở vùng ánh sáng <200nm.
• Cuvet thạch anh để đo chất có thể hấp thụ UV < 200nm.
• Bản thân ánh sáng UV < 200nm dễ ảnh hưởng đến người phân tích.
+ Một số chất có cấu trúc phức tạp cần xem xét sự đẩy và hút e để xác định các bước sóng hấp thụ năng lượng phù hợp.
3. Định luật Lambert-Beer
3.1. Điều kiện áp dụng
- Ánh sáng phải đơn sắc. lOMoAR cPSD| 47205411
Ngô Phước Long – M1K73 – 2022
- Khoảng nồng độ phải thích hợp: định luật chỉ đúng trong một giới hạn nhất định của nồng độ,
trong đó khoảng tuyến tính là không quá loãng và quá đặc (và khoảng nồng độ để đo mật độ
quang A trong khoảng từ 0,2 đến 0,8).
- Dung dịch phải trong suốt.
- Chất thử phải bền trong dung dịch, bền dưới tác dụng của ánh sáng UV-VIS. 3.2. Công thức 𝐼 - Độ truyền qua: 𝑇 = 𝑥 100(%) 𝐼𝑜 1 𝐼𝑜 - Độ hấp thụ:
𝐴 = 𝑙𝑔 = −𝑙𝑔𝑇 = 𝑙𝑔 𝑇 𝐼
Độ hấp thụ A còn được gọi là mật độ quang (D) hoặc độ tắt (E). 𝐼𝑜
- Định luật Lambert-Beer: lg
= 𝜀. 𝑙. 𝐶 = 𝐴 Trong đó: C tính theo mol/L. 𝐼
Nếu nồng độ % (g/100mL) 𝐴 = 𝐸11𝑐𝑚% . 𝑙. 𝐶 𝐸11𝑐𝑚% là hệ số thấp thụ riêng, ký hiệu là A(1%,1cm)
4. Cấu tạp máy quang phổ UV-VIS (tự học)
Bao gồm: Hệ quang học cả khả năng tạo ánh sáng đơn sắc trong vùng 200-800nm + thiết bị thích
hợp để đo độ hấp thụ. - Nguồn sáng:
+ Vùng tử ngoại: đèn deuteri/hydro cho ánh sáng có bước sóng < 350nm.
+ Vùng khả kiến: đèn tungsten.
- Bộ phận đơn sắc hóa: dùng kính lọc, lăng kính hoặc cách tử (hay dùng).
- Detector: tiếp nhận tín hiệu bộ phận khuếch đại máy ghi vẽ phổ/máy tính xử lý dữ liệu.
- Buồng đo chứa hai cốc đo (cuvet): chứa dung dịch thử và dung dịch so sánh, có đặc tính quang học như nhau.
+ Cuvet thạch anh (quazt): đo vùng UV và vùng VIS.
+ Cuvet thủy tinh: chỉ đo vùng VIS.
- Với máy 2 chùm tia: cuvet dung môi đặt ở bên có chùm tia so sánh đi qua.
- Áp dụng: đo điểm để định lượng, quét phổ để định tính.
5. Hiệu chuẩn máy quang phổ (tự học)
5.1. Kiểm tra thang độ dài sóng – Độ chính xác bước sóng
- Sử dụng cực đại hấp thụ của dung dịch holmium perchlorat, kính lọc holmium hay vạch cực đại
của đèn D2 và đèn hơi Hg.
- Vạch phổ của đèn nguồn hydro/deuteri/hơi thủy ngân có dung sai cho phép: + Vùng tử ngoại: ± 1nm. + Vùng khả kiến: ± 3nm.
5.2. Kiểm tra độ hấp thụ
- Dùng dung dịch K2Cr2O7/H2SO4 hoặc K2CrO4/KOH. lOMoAR cPSD| 47205411
Ngô Phước Long – M1K73 – 2022
- Đo độ hấp thụ của dung dịch K2Cr2O7/H2SO4 ở độ dài sóng khác nhau sẽ cho giá trị chính xác
𝐸11𝑐𝑚% và các giới hạn cho phép khác nhau.
- Pha chế dung dịch K2Cr2O7/H2SO4: tùy theo dược điển quy định:
Ví dụ DĐVN: hòa tan 57,0 đến 63,0mg K2Cr2O7 đã sấy khô đến khối lượng không đổi ở 130oC
trong H2SO4 0,005M/l với thể tích vừa đủ 100mL.
5.3. Giới hạn ánh sáng lạc (stray light)
- Ánh sáng lạc: ánh sáng không đi vào mẫu thử mà đi thẳng vào detector.
+ Có thể được phát hiện ở độ dài sóng đã cho với kính lọc hoặc các dung dịch thích hợp. - Quy định theo DĐVN:
+ Đo độ hấp thụ của dung dịch KCl (TT) 1,2% trong cuvet 1cm ở λ = 200nm, so sánh với nước cất, phải > 2,0.
+ Độ truyền qua của dung dịch KCl được so sáng với nước cất trong cuvet thạch anh 1cm phải <
0,8% ở λ = 220nm và 380nm.
5.4. Độ phân giải (cho phân tích định tính)
- Ghi phổ của dung dịch toluen (TT) 0,02% trong n-hexan (TT).
- Giá trị tối thiểu của tỷ số giữa cực đại hấp thụ ở 269nm và cực tiểu hấp thụ ở 266nm được quy
định trong chuyên luận riêng.
5.5. Độ rộng giải phổ nguồn (cho phân tích định lượng)
- Độ rộng giải phổ < 1/2 độ rộng băng hấp thụ nhưng phải đủ lớn để có cường độ ánh sáng Io đủ cao.
- Thu hẹp độ rộng giải phổ không làm độ hấp thụ tăng lên. 5.6. Cuvet
- Dung sai của chiều dày lớp dung dịch trong cuvet: ± 0,005cm.
- Khi dùng cùng 1 dung môi: cuvet chứa dung dịch thử và so sáng phải có độ truyền qua như nhau,
nếu không thì phải hiệu chỉnh.
- Làm sạch, chăm sóc cẩn thận tránh xước, có thể bảo quản trong cồn tuyệt đối để tránh mốc.
6. Các yếu tố ảnh hưởng đến khả năng hấp thụ UV – Vis
6.1. Cấu trúc phân tử chất tan
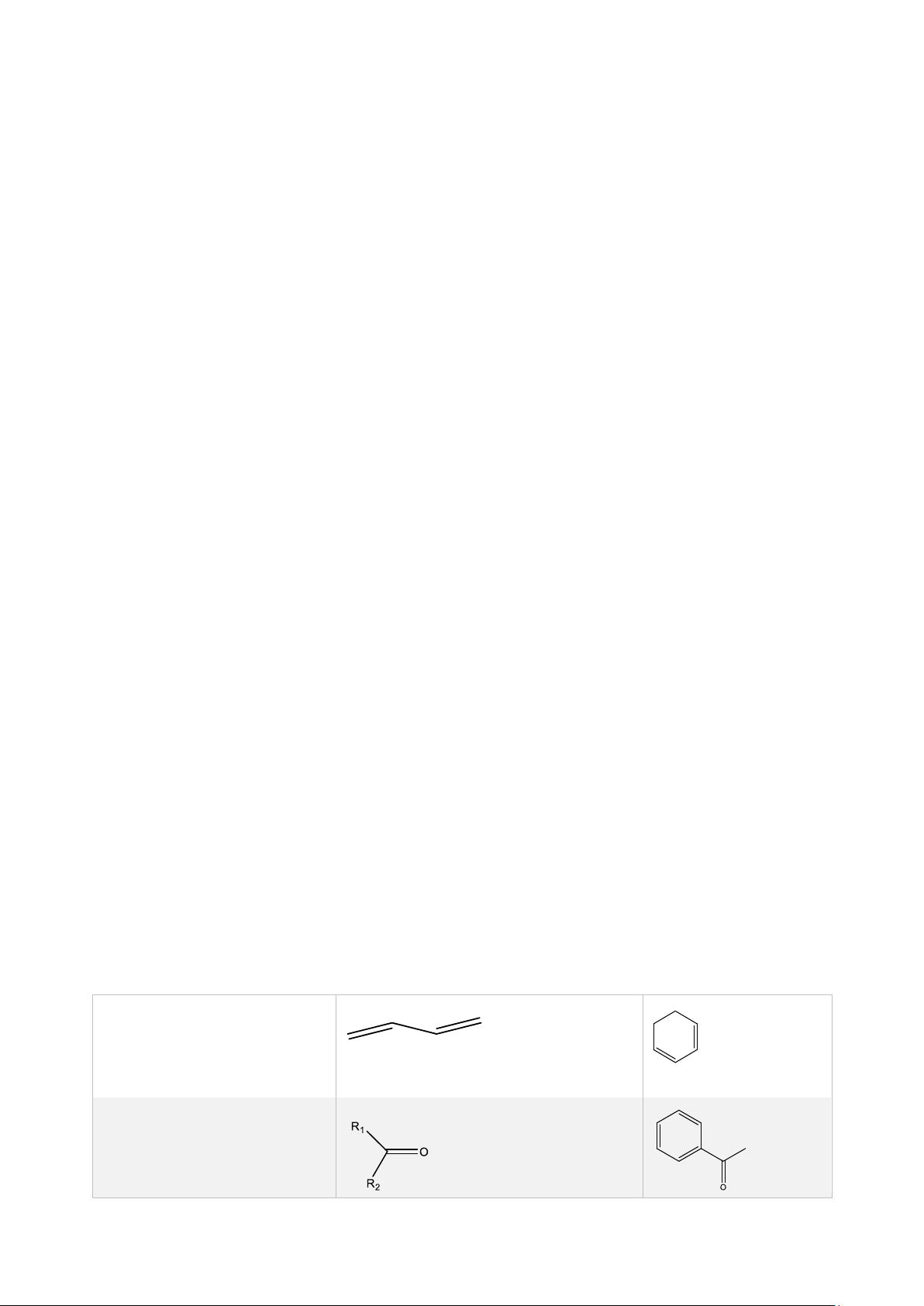
- Nhóm mang màu (chromophore) và nhóm trợ màu (auxochrome):
+ Một số nhóm mang màu đặc trưng: Anken và dien λmax = 214 nm λmax = 253 nm Hợp chất carbonyl lOMoAR cPSD| 47205411
Ngô Phước Long – M1K73 – 2022
Benzen và dẫn chất thế 254 nm 263 nm 266 nm Enon
Hợp chất thơm đa vòng, dị vòng
+ Nhóm trợ màu: bản chất thường là nguyên tử, nhóm có nhiều cặp e tự do (-OH, -OR, -NR2, halogen…). Ảnh hưởng: •
Dịch chuyển cực đại hấp thụ về λ dài hơn (bathochromic) •
Dịch chuyển cực đại hấp thụ về λ ngắn hơn (hypsochromic) •
Tăng cường độ hấp thụ (hyperchromic) •
Giảm cường độ hấp thụ (hypochromic) - Vị trí không gian: λmax = 214 nm λ max = 204 nm λmax = 309 nm λmax = 280 nm (ε = 11000) (ε = 12000) 1.2. Yếu tố MT - Dung môi.
- Tương tác lưỡng cực tăng n – π* hoặc giảm π – π*
- Liên kết hydro tăng n – π* - pH. - Nồng độ.
- Thiết bị: Máy quang phổ.
+ Thích hợp cho việc đo phổ ở vùng UV gần – Vis gồm 1 hệ quang học có khả năng tạo ánh sáng
đơn sắc trong vùng 200 – 800 nm và 1 thiết bị thích hợp để đo độ hấp thụ.
+ Nguồn sáng cho vùng UV: đèn deuteri (D2) hoặc hydro
+ Nguồn sáng cho vùng Vis: đèn vonfram (tungsten) hoặc halogen
+ 2 cốc đo (cuvet) chứa dd thử và dd so sánh phải có đặc tính quang học như nhau. lOMoAR cPSD| 47205411
Ngô Phước Long – M1K73 – 2022
+ Ở máy loại 2 chùm tia: cuvet dung môi được đặt ở bên có chùm tia song song đi qua.
+ Cần được hiệu chuẩn, kiểm tra định kỳ để đảm bảo:
• Độ chính xác bước sóng
• Độ chính xác của độ hấp thụ
• Giới hạn ánh sáng lạc • Độ phân giải
• Độ rộng giải phổ nguồn • Cuvet
7. Ứng dụng UV-VIS trong kiểm nghiệm dược phẩm 7.1. Định tính
- Dựa vào cực đại hấp thụ.
- Dựa vào tỷ số giữa các cực đại hấp thụ.
- Chồng phổ của DD thử và chuẩn, dựa vào hệ số MATCH: (nhân thêm 100% để báo cáo kết quả) +
Match < 0,900: 2 phổ khác nhau.
+ 0,990 > Match > 0,900: 2 phổ có điểm tương đồng, cần cân nhắc khi kết luận.
+ Match > 0,990: 2 phổ tương tự nhau.
+ Match > 0,999: 2 phổ giống nhau hoàn toàn. - Nhược điểm:
+ Không đặc hiệu hoàn toàn như IR, cần phải dùng thêm nhiều phép thử khác.
+ Không định tính được chính xác
7.2. Định lượng dung dịch 1 thành phần
- Áp dụng: các tá dược không được hấp thụ ánh sáng vùng UV-VIS. + Nguyên liệu.
+ Dạng bào chế: viên nén, gói bột, thuốc mỡ, viên đạn.
*Lựa chọn điều kiện phân tích để xây dựng quy trình định lượng:
- Bước sóng đo phổ hoặc kính lọc: bước sóng cực đại.
+ Chọn bước sóng với các cực đại hấp thụ: đường chuẩn có độ dốc lớn nhất cùng một sai số của
mật độ quang thì sai số của nồng độ C và bước sóng là nhỏ nhất.
+ Đối với máy dùng kính lọc (quang kế): màu kính lọc và màu dung dịch phải phụ nhau.
- Khoảng nồng độ thích hợp: dựa vào 𝐴11, có quan hệ tuyết tính với độ hấp thụ.
- Chọn các điều kiện khác:
+ pH và dung môi thích hợp: có khả năng hòa tan mẫu tốt nhất.
• Hòa tan/chiết xuất chất phân tích ra khỏi nền mẫu.
• Loại các tá dược, tạp chất.
+ Loại trừ ảnh hưởng của chất lạ: chiết chất cần ĐL ra khỏi hỗn hợp phức tạp (các dạng bào chế).
Dùng mẫu trắng có các thành phần như dd thử nhưng không có chất cần ĐL.
+ Đối với chất không hấp thụ tia UV: phải làm phản ứng tạo màu. lOMoAR cPSD| 47205411
Ngô Phước Long – M1K73 – 2022 + Thực hiện phản ứng
màu: sự hấp thụ của các chất lạ, thuốc thử cũng có thể ảnh hưởng tới kết quả ĐL → cần chú ý tới điều kiện và thành phần tham gia phản ứng khi làm phản ứng tạo màu.
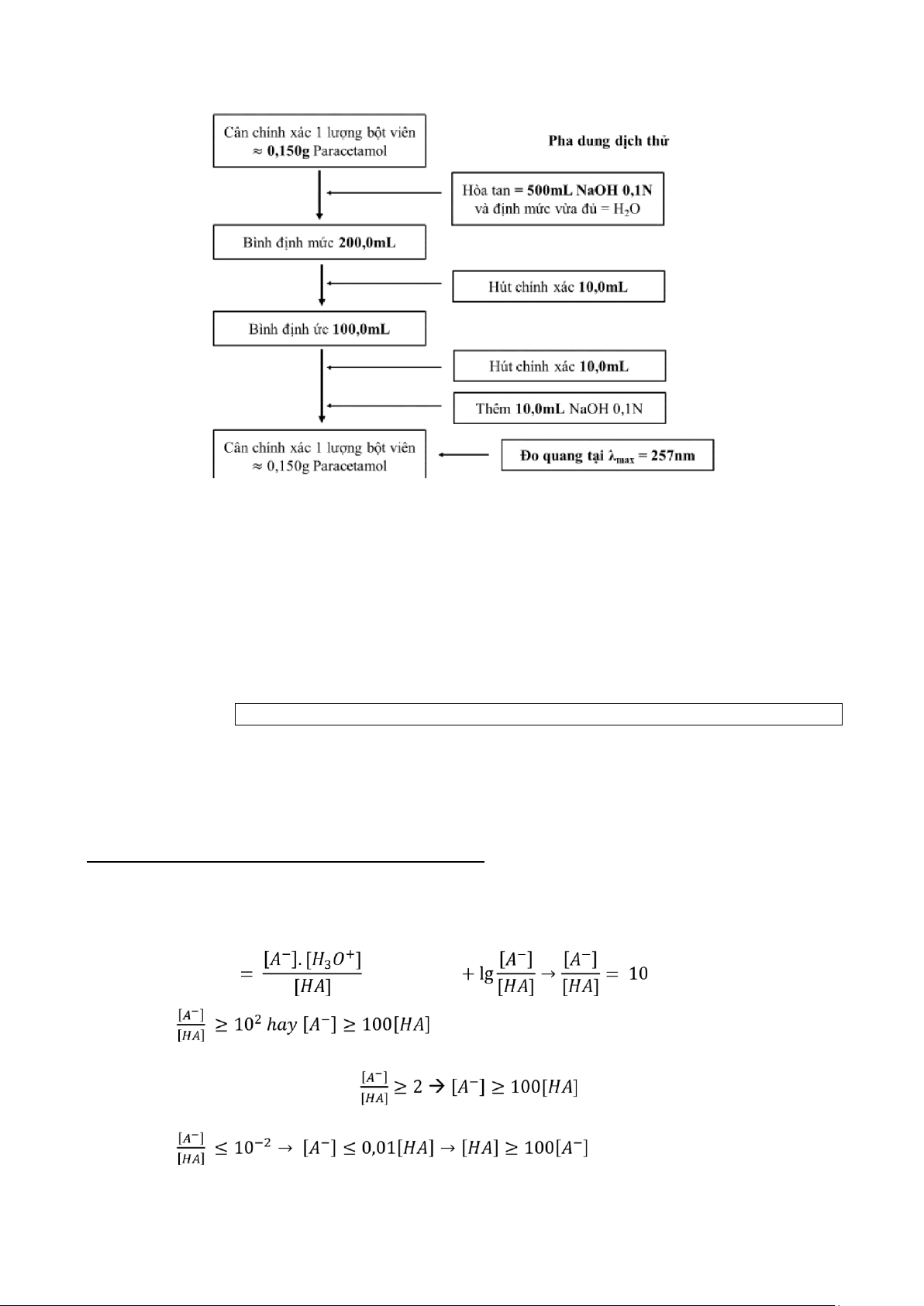
Ví dụ: Phân tích chuyên luận Paracetamol: Cân 20 viên, tính khối lượng trung bình của viên nén và nghiền thành bột mịn. Cân chính xác một lượng bột viên tương ứng với khoảng
0,150g paracetamol cho vào bình định mức 200mL, thêm 50mL dung dịch natri hydroxyd 0,1M,
thêm 100mL nước và lắc kỹ trong 15 phút. Thêm nước đến định mức, lắc đều. Lọc, loại bỏ 20mL
dịch lọc đầu. Pha loãng 10,0mL dịch lọc thành 100,0mL với nước. Lấy chính xác 10,0mL dung
dịch này cho vào bình định mức dung tích 100,0mL, thêm 10,0mL dung dịch natri hydroxyd 0,1M. C% = 0,00075%
Pha loãng với nước đến định mức. Đo độ hấp thụ ánh sáng của dung dịch thu được ở bước sóng
257nm, cốc đo dày 1cm. Dùng dung dịch natri hydroxyd 0,01N làm mẫu trắng. Tính hàm lượng
paracetamol, C8H9NO2 theo A (1%, 1cm). Lấy 715 là giá trị A (1%, 1cm) ở bước sóng 257nm.
Bình định mức 100,0mL
- Cân 20 viên: lấy ngẫu nhiên để đồng nhất hóa rồi sau đó mới cân bột mịn.
- Hòa tan 0,150g hòa tan trong 200mL (trong đó có 50mL dung dịch NaOH0,1M, thêm 100mL, lắc
kỹ 15 phút rồi thêm nước đến định mức). C% = 0,075%.
Dùng 50mL dung dịch NaOH0,1M làm dung môi vì: paracetamol có tính acid do nhóm -OH
phenol cho proton, dễ tan trong kiềm (trong USP38 dùng methanol để hòa tan paracetamol)
paracetamol (pKa = 9,5) sẽ chuyển dạng ion dễ tan trong nước hơn.
+ Dựa vào phương trình đối với một acid/H2O: HA + H2O ⇌ A– + H3O+ 𝑘𝑎 → 𝑝𝐻 = 𝑝𝑘𝑎 𝑝𝐻− 𝑝𝑘𝑎 • Khi
→ 𝑝𝐻 − 𝑝𝑘𝑎 ≥ 2 → pH ≥ pka + 2 thì chất tồn tại
100% ở dạng base liên hợp – dạng ion. Khi pH ≥ pKa + 2: lg
chất tồn tại 100% ở dạng base liên hợp - ion. • Khi
→ 𝑝𝐻 − 𝑝𝑘𝑎 ≤ 2 → pH ≤ pka
− 2 thì chất tồn tại 100% ở dạng acid – phân tử. lOMoAR cPSD| 47205411
Ngô Phước Long – M1K73 – 2022 Khi pH ≤ pKa – 2:
chất tồn tại 100% ở dạng acid - phân tử.
+ Dựa vào phương trình đối với một base/H2O: B + H2O ⇌ BH+ + OH– (tự bổ sung thêm) + Nếu dùng dung môi:
• pH ≤ pKa – 2 = 7,5 thì chất tồn tại ở dạng acid phân tử, không tan trong nước.
• pH ≥ pKa + 2 = 11,5 thì chất tồn tại ở dạng base liên hợp là dạng ion tan trong nước dùng
dung môi kiềm dễ hòa tan chất.
+ Giữa dung dịch kiềm, ethanol, methanol thì chọn dung môi ít hòa tan tá dược nhất.
- Lọc, loại bỏ 20mL dịch lọc đầu cần lưu ý áp dụng trong các mô hình.
- Pha loãng 10,0mL dịch lọc thành 100,0mL với nước pha loãng 10 lần C% = 0,0075%.
- Lấy chính xác 10,0mL dung dịch này cho vào bình định mức dung tích 100,0mL, thêm 10,0mL
dung dịch natri hydroxyd 0,1M. Pha loãng với nước đến định mức C% = 0,00075%.
Cách tính nồng độ cuối cùng: 𝐶% = 𝑥 100 (%) 𝑥 𝑥 = 0,00075%
Chọn C% = 0,00075% vì: 1% . 𝑙. 𝐶 → 𝐶 =
1𝐴% . Mà 𝐴11%𝑐𝑚 =
715. • Dựa vào công thức: 𝐴 = 𝐴1𝑐𝑚 𝐴1𝑐𝑚
• Khoảng nồng độ tuyết tính để
đi paracetamol: C(mg/mL) = 10.C% 103 o Tại cực tiểu 0,2 thì 𝐶1 = = 0,00028% = 0,00028 . 100 = 0,0028𝑚𝑔/𝑚𝐿
o Tại cực đại 0,8 thì 𝐶5 = 715 = 0,0012%
• Chọn C% = 0,00075% nằm trong khoảng nồng độ là 0,00028% - 0,0012%.
• Ngoài ra, có thể chọn 𝐴 = 0,5 rồi tính ra C% ≈ 0,00070% nên chọn C% = 0,00075% để làm nồng độ pha mẫu.
- Đo tại bước sóng 257nm là bước sóng cực đại của paracetamol trong dung dịch NaOH 0,1M
mẫu trắng là dung dịch NaOH 0,01N.
Dùng các bình định mức 200,0mL và 100,0mL vì:
• C% = 0,00075% = 0,0075mg/mL mà m = 0,150g = 150mg nên thể tích dịch pha loãng là
150/0,0075 = 20000mL tức là độ pha loãng 20000 lần nên pha 200x10x10.
• Vậy mới pha vào bình 200,0mL, sau đó hút 10,0mL pha tiếp vào bình 100,0mL rồi lại hút
10,0mL pha tiếp vào bình 100,0mL để pha loãng.
Nếu khối lượng cân m khác (0,2g hoặc 0,3g…) thì độ pha loãng phải khác nên bình định mức cũng phải khác.
Tại sao lại làm 2 lần hút 10,0mL pha tiếp vào bình 100,0mL mà không dùng 1 lần hút 1,0mL pha
tiếp vào bình 100,0mL do liên quan đến sai số của phương pháp vì:
• Dùng pipet 10,00mL thì sai số là khoảng ± 0,03mL thì sai số (%) là 0,3% hay 3o/oo.
• Dùng pipet 1,00mL thì sai số là khoảng ± 0,03mL thì sai số (%) là 3% hay 30o/oo.
Dùng pipet có dung tích càng nhỏ thì sai số thiết bị càng lớn sai số của phương pháp phân tích càng lớn. lOMoAR cPSD| 47205411
Ngô Phước Long – M1K73 – 2022
Phương pháp pha loãng đúng + thiết bị sử dụng đúng Kết quả đúng và giảm thiểu sai số.
Tại sao lại cân một lượng bột viên chính xác tương ứng tối thiểu 0,150g paracetamol:
• Khi tính khối lượng trung bình của 1 viên: 𝑚 1 𝑣 ≈ 0,5𝑔 mà muốn cân 1 lượng bột viên là
0,150g thì cần cân 1 lượng bột viên = 0,15/0,5 = 0,3 𝑚 1 𝑣 .
• Khi cân 0,15g thì trong đó có rất nhiều tá dược nên chúng ta cần cân 1 lượng bột viên > 0,150g.
• Liên quan đến sai số: cân trên cân phân tích 4 số đến 0,0002 mà lượng cân tối thiểu là 0,1 vì
sai số là 0,0002/0,1 = 0,2% hay 2o/oo.
Khi xây dựng phương pháp: phải chọn khoảng khối lượng bột viên cần cân xác định khoảng
nồng độ để mật độ quang A đạt 0,4-0,5 xác định độ pha loãng.
Khi thi: cho một chất với các số liệu về pka, độ tan để chọn dung môi và có thể cho cân một lượng
bột viên với khối lượng cho trước để kiểm soát thể tích mà SV pha.
tìm dung môi, lượng dung môi, nồng độ định lượng từ lượng bột cân sẽ xác định được lượng
dung môi chính xác và độ pha loãng để xây dựng phương pháp.
Tại sao phải cho 2 lần cho NaOH:
• Lần 1: 50mL dung dịch NaOH 0,1M: làm dung môi để hòa tan paracetamol do pH của dung dịch này đang ở 13.
• Lần 2: thêm 10,0mL dung dịch NaOH 0,1M:
o Tuy nhiên, sau lần 1, khi cho vào bình định mức 200,0mL thì NaOH bị pha loãng đi
4 lần nên NaOH chỉ còn 0,025N và pha loãng 10 lần ở bước tiếp theo thì NaOH còn
0,0025N và pha loãng tiếp 10 lần nữa thì NaOH chỉ còn 0,00025N rất loãng hòa
tan pha loãng quá nhiều lần Do đó ở lần 2.
o Mẫu trắng là dung dịch NaOH 0,01N nên thêm ở lần 2 như trên để nồng độ NaOH trong mẫu thử là 0,01N.
o Lần 2 thì dung dịch NaOH 0,1M là môi trường để paracetamol hấp thụ cực đại.
7.2.1. Đo phổ trực tiếp (kỹ thuật cơ bản)
- Chuẩn bị dung dịch thử có nồng độ thích hợp dựa vào mật độ quang trong vùng tuyến tính. Đo quang được Ax. 1% . 𝑙. 𝐶 → 𝐶 =
𝐴𝐴11%𝑐𝑚𝑋 𝐴𝑋 = 𝐴1𝑐𝑚
- Nồng độ C là nồng độ % (g/100mL).
- Cần hiệu chuẩn máy quang phổ về bước sóng và độ hấp thụ (xem mục 5. Hiệu chuẩn máy quang phổ).
- Phương pháp gián tiếp: đo so sánh, đường chuẩn, thêm chuẩn.
7.2.2. Đo so sánh (kỹ thuật cơ bản, so sánh với chuẩn, phương pháp gián tiếp) - Tiến hành:
+ Chuẩn bị mẫu thử và mẫu chuẩn song song cùng điều kiện (Cthử xấp xỉ Cchuẩn).
+ Chọn Cthử xấp xỉ Cchuẩn dựa vào khoảng tuyến tính A = K.l.C
+ Trong đó, hệ số hấp thụ K và bề dày l của cuvet là như nhau nên ta xác định được CX: (CS là CC, AS là AC). lOMoAR cPSD| 47205411
Ngô Phước Long – M1K73 – 2022 𝐴𝑋 𝐶𝑋 𝐴𝑋 = → 𝐶𝑋 = 𝐶𝑆 . 𝐴𝑆 𝐶𝑆 𝐴𝑆
- Ưu điểm: tiến hành nhanh hơn phương pháp đường chuẩn.
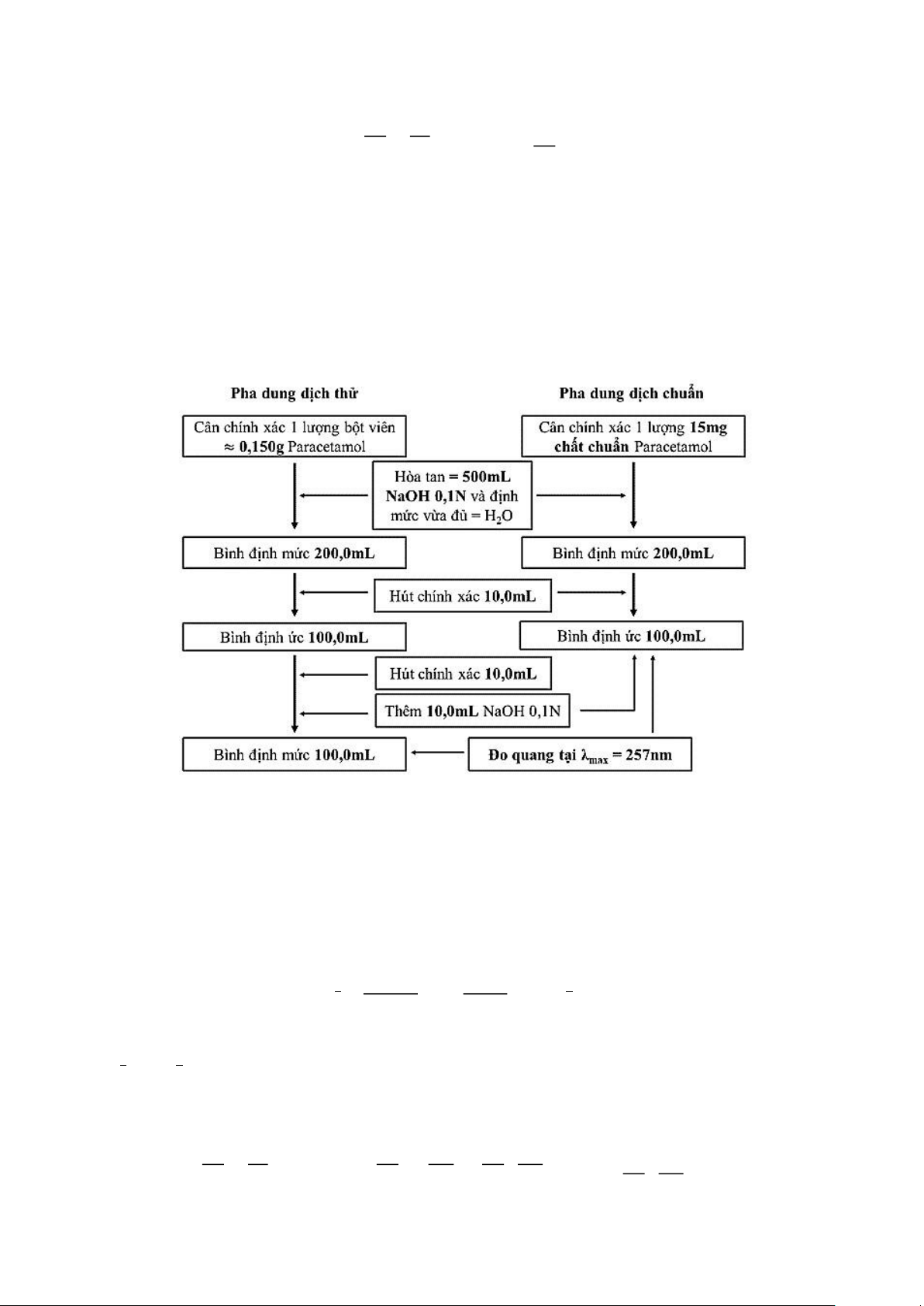
Ví dụ: Xây dựng phương pháp định lượng viên nén paracetamol 500mg theo phương pháp đo so sánh.
- Dung môi hòa tan mẫu: NaOH 0,1N hoặc MeOH.
- Đo độ hấp thụ ở λmax = 257nm. Biết A(1%,1cm) tại 257nm là 715.
- Cân 20 viên, tính khối lượng TB của 1 viên. Cân chính xác lượng bột viên chứa khoảng 0,150g
paracetamol và 15mg chất chuẩn paracetamol. Độ pha loãng: DT = 0,150/200/10/10 = 0,00075%. - Lưu ý:
+ Dùng chất chuẩn với khối lượng vừa phải, đủ để pha vì một lọ chất chuẩn giá thành rất cao. Vì
thế, không bắt buộc phải dùng khối lượng chất chuẩn bằng khối lượng chất cần phân tích.
+ Khi cân, nếu cân phân tích 4 số để cân 0,150g paracetamol chất phân tích thì phải dùng cân phân
tích 5 số để cân 15mg paracetamol chuẩn để giảm thiểu sai số đến 0,1%.
+ Thể tích thử pha loãng chỉ là 20000 lần, còn thể tích chuẩn pha loãng chỉ 2000 lần.
- Hàm lượng % paracetamol trong chế phẩm, so với lượng ghi trên nhãn: (HLGTN = hàm lượng ghi
trên nhãn): Hàm lượng (%) = 𝐴𝑇 . 𝑚
𝐶.𝑃(%) . 𝐷𝑇 . 𝑀𝑉 . 100 𝐴𝐶 𝑚𝑇 𝐷𝐶 𝐻𝐿𝐺𝑇𝑁
+ 𝐷𝐷𝑇𝐶 = 𝑉𝑉𝑉𝑇, trong đó D là độ pha loãng, V là thể tích pha loãng ; MV = 𝑚 1 𝑣 + Xây dựng công thức : 𝐴𝑇 𝐶𝑇 𝐴𝑇 𝑚𝑇 𝐴𝑇 𝑚𝐶 𝐴𝑇 𝑚𝐶 = → 𝐶𝑇 = 𝐶𝐶 . → = . → 𝑚𝑇 = . . 𝑉𝑇 𝐴𝐶 𝐶𝐶 𝐴𝐶 𝑉𝑇 𝐴𝐶 𝑉𝐶 𝐴𝐶 𝑉𝐶 lOMoAR cPSD| 47205411
Ngô Phước Long – M1K73 – 2022
Mặt khác: mT = mbột đem cân = 0,3 𝑚 1 𝑣
Trong công thức tính hàm lượng: trên nhãn chỉ ghi có P(%) paracetamol nên phải nhân thêm P(%) vào cạnh mC.
Tính hàm lượng paracetamol trong 1 viên (trong 𝑚 1 𝑣 ) = 𝐴𝐴𝑇 (%) 𝐶 . 𝑚 𝐶𝑚.𝑃𝑇
. 𝑉𝑉𝑇𝐶 . 𝑚 1 𝑣
Hàm lượng (%) paracetamol trong CP so với lượng ghi trên nhãn: Hàm lượng (%) = 𝐻 à𝑚 𝑙ượ𝑛𝑔
𝑝𝑎𝑟𝑎𝑐𝑒𝑡𝑎𝑚𝑜𝑙 𝑡𝑟𝑜𝑛𝑔 1 𝑣𝑖ê𝑛 (𝑡𝑟𝑜𝑛𝑔 𝑚 1 𝑣 ) 𝑥 100 (%) 𝐻à𝑚
𝑙ượ𝑛𝑔 𝑔ℎ𝑖 𝑡𝑟ê𝑛 𝑛ℎã𝑛
7.2.3. Phương pháp đường chuẩn (kỹ thuật cơ bản, so sánh với chuẩn, phương pháp gián tiếp)
- Pha một dãy dung dịch chuẩn có nồng độ từ C1 – C5 từ dung dịch chuẩn gốc.
- Xác định giá trị A1 – A5 và xây dựng đường chuẩn tuyến tính y = ax + b hay A = aC + b.
- Đo giá trị AX của mẫu thử, thay vào phương trình đường chuẩn để xác định CX.
- Ưu điểm: rất tiện lợi và hiệu quả khi phân tích nhiều mẫu của chất cần PT. - Ứng dụng:
+ Chứng minh tính đúng của phương pháp so sánh khoảng 80-120% theo yêu cầu KN đã trong
khoảng 50-150%, chứng minh khoảng 50-150% là tuyến tính thì áp dụng phương pháp đo so sánh
với C từ 50-150% đều đúng với mọi CX trong khoảng.
+ Trong thẩm định phương pháp có xây dựng khoảng tuyến tính.
+ Định lượng nhiều mẫu phân tích: thử độ hòa tan của viên tác dụng kéo dài,… +
Định lượng mẫu khi chưa biết hàm lượng. - Chú ý:
+ Khi xây dựng đường chuẩn cần khảo sát khoảng tuyến tính của nồng độ với độ hấp thụ.
+ Nếu dãy chuẩn không theo Lambert-Beer (đường chuẩn cong): cần làm thêm một số điểm chuẩn
với các nồng độ gần nhau hơn (khác nhau không quá 10%).
+ Xây dựng đường chuẩn và phương trình hồi quy tuyến tính với hệ số tương quan r ≥ 0,995.
Ví dụ: Xây dựng phương pháp định lượng viên nén paracetamol 500mg theo phương pháp
đường chuẩn.
- Dung môi hòa tan mẫu: NaOH 0,1N hoặc MeOH.
- Đo độ hấp thụ ở λmax = 257nm. Biết A(1%,1cm) tại 257nm là 715.
- Cân 20 viên, tính khối lượng TB của 1 viên. Cân chính xác lượng bột viên chứa khoảng 0,150g
paracetamol và 15mg chất chuẩn paracetamol để pha dung dịch chuẩn gốc và dãy dung dịch
chuẩn. Độ pha loãng: DT = 0,150/200/10/10 = 0,00075%.
- Pha dãy dung dịch chuẩn từ dung dịch chuẩn gốc:
+ Pha dung dịch C3 có nồng độ gần tương đương với nồng độ mẫu thử: hút 2,0mL dung dịch chuẩn
gốc vào BĐM 20,0mL với độ pha loãng là 20/2 = 10 lần
+ Pha dung dịch C1: nồng độ giảm đi 100%/50% = 2 lần nên độ pha loãng tăng lên 2 lần độ pha
loãng là 10x2=20 lần. Vì thế, với độ pha loãng 20 lần = 20/1 thì phải hút 1,0mL dung dịch chuẩn gốc vào BĐM 20,0mL. lOMoAR cPSD| 47205411
Ngô Phước Long – M1K73 – 2022
+ Pha dung dịch C2: nồng độ giảm đi 100%/80% = 1,25 lần nên độ pha loãng tăng lên 1,25 lần
độ pha loãng là 10x1,25=12,5 lần. Vì thế, với độ pha loãng 12,5 lần = 25/2 thì phải hút 2,0mL dung
dịch chuẩn gốc vào BĐM 25,0mL.
+ Pha dung dịch C4: nồng độ tăng lên 120%/100% = 1,2 lần nên độ pha loãng giảm đi 1,2 lần độ
pha loãng là 10/1,2=8,33 lần. Vì thế, với độ pha loãng 8,33 lần = 25/3 thì phải hút 3,0mL dung dịch
chuẩn gốc vào BĐM 25,0mL.
+ Pha dung dịch C5: nồng độ tăng lên 150%/100% = 1,5 lần nên độ pha loãng giảm đi 1,5 lần độ
pha loãng là 10/1,5=6,67 lần. Vì thế, với độ pha loãng 6,67 lần = 20/3 thì phải hút 3,0mL dung dịch
chuẩn gốc vào BĐM 20,0mL.
+ Sau đó, thêm dung môi pha mẫu vào 5 bình trong dãy dung dịch chuẩn: vì dung môi gốc NaOH
0,1N cần pha loãng 10 lần thành 0,01N để đem đi đo quang sau khi pha vào trong các BĐM nên
BĐM 20,0mL thì cần 2,0mL NaOH 0,1N, BĐM 25,0mL cần 2,5mL NaOH 0,1N. (Lưu ý là nồng độ
NaOH ở trong BĐM bắt buộc là 0,01N mới đáp ứng đúng được yêu cầu đo quang tại bước sóng đề
ra trong DĐVN, xem lại phần ví dụ trong Lựa chọn điều kiện).
+ Cuối cùng: thêm nước để định mức đến vạch ở tất cả các bình. - Lưu ý:
+ Dung dịch chuẩn gốc là dung dịch được pha từ 15mg chất chuẩn gốc vào trong bình định mức 200,0mL.
+ Trên nhãn thường ghi giới hạn hàm lượng CP paracetamol là 95% - 105%, tức là trong 500mg này
có thể chứa 475mg đến 525mg paracetamol. Nếu trong khoảng giới hạn này thì mẫu đạt, ngoài khoảng thì không đạt.
+ Khoảng xác định trong KN: 80,0% – 120,0%. Các nhà sản xuất cố gắng để giới hạn nằm trong
khoảng này để tránh bị thu hồi thuốc. Xây dựng dãy đường chuẩn chứa khoảng xác định này. Tránh
trường hợp xây dựng đường chuẩn về một phía, ví dụ 50-100%.
+ Cách xây dựng dãy đường chuẩn:
• Cách 1: Lấy C1 = 80% và C5 =120% và C2 với C4 lần lượt là 90% và 110%.
• Cách 2: Mở rộng đường chuẩn, từ 50-150%.
• Khoảng nồng độ 80-120% hay 50-150% được áp dụng vì khi xác định mật độ quang A thì A trong khoảng từ 0,2-0,8.
7.2.4. Phương pháp thêm chuẩn (kỹ thuật cơ bản, so sánh với chuẩn, phương pháp gián tiếp) - Tiến hành:
+ Chuẩn bị song song 2 mẫu thử với lượng giống nhau.
+ Thêm một lượng chuẩn vào mẫu thử thứ 2 Đo mẫu thử 2: AX+C. + Đo mẫu thử 1: AX.
- Với Cc là nồng độ dung dịch chuẩn, ta tính được nồng độ Ct+C theo phương trình: 𝐴𝑡 𝐶𝑡 𝐴𝑡 = → Ct = Cc. 𝐴𝑡+𝑐 𝐶𝑡 + 𝐶𝑐 𝐴𝑡+𝑐 − 𝐴𝑡
- Yêu cầu: lượng chuẩn thêm vào thành mẫu THÊM CHUẨN có nồng độ nằm trong khoảng tuyến tính.
Ví dụ: Xây dựng phương pháp định lượng viên nén paracetamol 500mg theo phương pháp đo so sánh. lOMoAR cPSD| 47205411
Ngô Phước Long – M1K73 – 2022
- Dung môi hòa tan mẫu: NaOH 0,1N hoặc MeOH.
- Đo độ hấp thụ ở λmax = 257nm. Biết A(1%,1cm) tại 257nm là 715.
- Cân 20 viên, tính khối lượng TB của 1 viên. Cân chính xác 2 lượng bột viên chứa khoảng 0,150g
paracetamol và 15mg chất chuẩn paracetamol để pha vào dung dịch thử thêm chuẩn. Độ pha
loãng: DT = 0,150/200/10/10 = 0,00075%.
- Lưu ý : thêm 15mg chất chuẩn vì so với 0,150g = 150g thì tăng có 10% tăng nồng độ 100% lên
110% và vẫn nằm trong khoảng đường chuẩn từ 80-120%. Do đó, có thể thêm từ 1% đến tối đa
50% để ứng với khoảng đường chuẩn 50-150%. - Tính toán: 𝐴𝑋 𝐶𝑋 𝐴𝑋
𝐴𝐶+𝑋 = 𝐶𝐶 + 𝐶𝑋 → 𝐶𝑋 = 𝐶𝐶 . 𝐴𝐶+𝑋 − 𝐴𝑋 - Ứng dụng:
+ Trong thẩm định phương pháp để xác định độ đúng của phương pháp.
+ Định lượng chất phân tích có thành phần mẫu phức tạp (loại trừ ảnh hưởng của một số yếu tố chưa biết).
7.2.5. Kỹ thuật thêm đường chuẩn 𝑨𝒕 A = a.Cc + At → Ct = 𝒂
- Thêm những thể tích giống nhau của dd thử vào dãy chuẩn chứa những lượng khác nhau và chính xác của chất chuẩn
- Đo độ hấp thụ của cả dãy rồi vẽ đường chuẩn quan hệ giữa mật độ quang và lượng chất chuẩn thêm vào.
- Giao điểm của đường chuẩn với trục hoành (nồng độ) là nồng độ của chất thử. lOMoAR cPSD| 47205411
Ngô Phước Long – M1K73 – 2022 - Chú ý:
+ Khoảng Cc thêm vào phải nằm trong vùng tuyến tính của định luật.
+ Cho phép loại trừ ảnh hưởng của nền mẫu.
7.2.5. Xác định độ hòa tan
BTVN1: Ví dụ chuyên luận paracetamol: xác định độ hòa tan paracetamol.
- Thử độ hòa tan bằng cách cho vào thiết bị đo gồm 6 cốc đo, mỗi cốc cho 900mL dung dịch đêm
(như ở dưới) và 1 viên paracetamol 500mg.
- Thiết bị: kiểu cánh khuấy. Môi trường hòa tan: 900mL đệm phosphat pH 5,8 (TT).
- Tốc độ quay: 50r/min. Thời gian 45 min.
- Cách tiến hành: Sau thời gian hòa tan qui định, lấy một phần dịch hòa tan, lọc. Pha loãng dịch lọc
bằng dung dịch NaOH 0,1M (TT) để được nồng độ paracetamol 7,5μg/mL.
- Đo độ hấp thụ của dung dịch thu được ở bước sóng cực đại 257nm. Mẫu trắng là dung dịch NaOH 0,1M (TT).
- Tính hàm lượng paracetamol hòa tan theo A(1%,1cm). Lấy 715 là giá trị A(1%,1cm) của paracetamol ở bước sóng 257nm.
- Yêu cầu: không ít hơn 75% (Q) lượng paracetamol C8H9NO2, so với lượng ghi trên nhãn được hòa tan trong 45min. Đổi: 7,5μg/mL
= 7,5.10-3mg/mL = 0,0075 mg/mL
= 0,0075x10-3g/10-2.100mL = 0,00075 g/100mL = 0,00075%. - Lưu ý:
+ Viên 500mg pha vào dung dịch đệm 900mL thì nồng độ mg/mL là 0,56 mg/mL nên C (g/100mL) = 0,056%.
+ Tính độ pha loãng 0,056%/0,00075% ⁓ 75 lần không có pipet để pha.
pha loãng thành chẵn là 50mL hoặc 100mL bằng cách hút 1,0mL cho vào BĐM 50,0mL hoặc 100,0mL.
• Dùng BĐM 50,0mL thì pha loãng từ 0,056% thành 0,056%/50 = 0,00112%
A = C%.A(1%,1cm) = 0,00112x715 = 0,8008 > 0,8 nên A của C1 = 50% là ⁓ 0,4 và A của C5 =
150% là ⁓ 1,2 ngoài khoảng 0,2-0,8 không dùng BĐM 50,0mL.
• Dùng BĐM 100,0mL thì pha loãng từ 0,056% thành 0,056%/100 = 0,00056%
A = C%.A(1%,1cm) = 0,00056x715 = 0,4004 trong khoảng 0,2-0,8 nên A của C1 = 50% là ⁓
0,2 và A của C5 = 150% là ⁓ 0,8 trong khoảng 0,2-0,8 dùng BĐM 100,0mL.
pha loãng 100 lần để đem đi đo quang là C% = 0,00056% vì để C% nằm trong khoảng tuyến tính.
Xây dựng phương pháp kiểm nghiệm bằng phương pháp đường chuẩn và phương pháp thêm chuẩn (BTVN).
+ Mẫu trắng là NaOH 0,1 M vì dùng để pha loãng dịch lọc vừa đủ (độ pha loãng là 100 lần) và hút
1,00mL pha vào BĐM 100,0mL, định mức vùa đủ bằng NaOH 0,1M, nên 1,0mL dịch lọc có chứa
đệm phosphat pH=5,8 này chiếm 1/99 so với NaOH, nên có thể coi NaOH 0,1M là chủ yếu.
BTVN2: xây dựng phương pháp định tính, định lượng, thử độ hòa tan của viên nén Metronidazol
400mg với các thông số như sau: lOMoAR cPSD| 47205411
Ngô Phước Long – M1K73 – 2022
- Dung môi hòa tan mẫu: dung dịch HCl 0,1N.
- Đo độ hấp thụ ở bước sóng 277nm. Biết A(1%,1cm) tại 277nm = 377.
- Cân 20 viên, tính khối lượng TB của 1 viên. Cân chính xác lượng bột viên chứa khoảng 25mg
Metronidazol và 25mg chất chuẩn Matronidazol.
(xây dựng phương pháp + kết hợp với phần dạng bào chế liên quan đến tiêu chuẩn của viên nén do
cô Hà dạy để phác thảo nên tiêu chuẩn của Metronidazol theo dược điển). - Lưu ý về metronidazol:
+ Tính chất hóa lý: dễ tan/H2O, aceton, EtOH, methylene clorid. pKa = 2,6.
+ Lựa chọn điều kiện định lượng: dung môi pha mẫu là nước, pH = 1, chọn bước sóng theo λmax và
khoảng nồng độ dựa vào A(1%,1cm).
Phần thi: PPHH là 2-2,5 điểm và PPHL và PP khác là 7-8 điểm.
BTVN3: Thử độ hòa tan của viên nén paracetamol 500mg như sau:
- Môi trường: 900ml dung dịch đệm.
- Thiết bị thử: cánh khuấy.
- Tốc độ quay: 50 vòng/phút
Sau 45’ hút dịch trong cốc ra, lọc. Hút chính xác 1ml, dịch lọc cho vào bình định mức 100ml thêm
dung dịch NaOH 0,1M đến vạch. Đem đo quang ở bước sóng 257nm. Biết A(1%, 1cm) của
paracetamol ở bước sóng này là 715. Làm với 6 viên. Kết quả đo quang như sau: 0,43; 0,45; 0,38;
0,42; 0,43; 0,40. Chế phẩm trên có đạt yêu cầu về độ hòa tan không theo quy định của DĐVN IV không?
- Lưu ý: Thử độ hoà tan là đánh giá khả năng hoà tan của từng viên, nên từ A của từng ống thử hoà
tan tính ra hàm lượng% hoà tan của từng viên (chia 500 mg), tính ra tùng viên, yêu cầu từng viên
không được nhỏ hơn 75% nhé, (KHÔNG ĐƯỢC LẤY TB), kèm thêm yêu cầu RSD% của 6 viên <5%.
BTVN4: Dung dịch thử: Cân 20 viên, tính khối lượng trung bình viên và nghiền thành bột mịn. Cân
chính xác một lượng bột viên tương ứng khoảng 325mg paracetamol cho vào BĐM 100,0mL, thêm
khoảng 80,0mL pha động, lắc siêu âm trong 15min, thêm pha động vừa đủ đến vạch, lắc đều, lọc.
Pha loãng 10,0mL dịch lọc thành 100,0mL bằng pha động. Hút chính xác 10,00mL dung dịch này
vào một BĐM 100,0mL, pha loãng đến vạch bằng pha động, lắc đều. Lọc qua màng lọc 0,45μm.
- Màng lọc 0,45μm, dùng để loc loại tạp chất trước khi vào cột SK để tránh tắc cột.
Thắc mắc: Quy trình định lượng trong đo quang phổ UV-VIS:
Hai ví dụ về định lượng paracetamol và metronidazol. Trong quy trình định lượng paracetamol, DM
hòa tan mẫu là NaOH, sau khi cân mẫu thì hòa tan với 50ml NaOH rồi định mức bằng nước vừa đủ đến vạch.
Với metronidazol, DM hòa tan dược chất là HCl. Tham khảo dược điển: sau khi lấy mẫu thì hòa tan
với HCl và cũng định mức bằng HCl đến vạch và thấy metronidazol cũng tan trong nước.
Liệu có thể thay đổi là hòa tan bằng một lượng HCl để đạt pH phù hợp rồi mới định mức bằng nước
đến vạch được không? Mà A(1%,1cm) của metronidazol đo được là trong môi trường nào vì đo
A(1%,1cm) của pracetamol là trong NaOH 0,01N. Gợi ý:
Theo DĐVN V: độ hấp thụ riêng của metronidazol tại cực đại hấp thụ 277nm là 365 đến 395 trong
điều kiện HCl 0,1M, với metronidazol trong DĐVN ghi là khó tan trong nước, còn EP 10.0 ghi là lOMoAR cPSD| 47205411
Ngô Phước Long – M1K73 – 2022
hơi tan chứ không dễ tan. Do đó, dùng HCl 0,1M để hòa tan mẫu và điều kiện cần cũng là HCl
0,1M nên định mức luôn đến vạch bằng HCl 0,1M là hợp lý.
Về paracetamol: điều kiện cần là NaOH 0,01M nên dung dịch trước khi đo quang đã thêm 10ml
NaOH 0,1M và pha vào bình 100ml và mẫu trắng là NaOH 0,01M.
II. SẮC KÝ LỎNG HIỆU NĂNG CAO (HPLC) Mục tiêu:
1. Phân biệt sắc kí phân bố pha thuận, pha đảo: pha, lựa chọn pha, thứ tự rửa giải…
2. Lựa chọn ĐKSK: lựa chọn các pha, thứ tự rửa giải,…
3. Trình bày ứng dụng HPLC trong phân tích định tính, thử tạp chất và định lượng.
4. Áp dụng HPLC xây dựng phương pháp định tính, định lượng, thử tạp chất.
1. Đại cương về HPLC (tự học)
1.1. Các thông số đặc trưng của quá trình sắc ký
1.1.1. Hệ số dung lượng k’
𝑘′ = 𝐾. 𝑉𝑆 = 𝑄𝑆 = 𝑡′𝑅 = 𝑡𝑅 − 𝑡𝑜 𝑉𝑀 𝑄𝑀 𝑡𝑜 𝑡𝑜
- Trong đó: K: hệ số phân bố
VS, VM: thể tích pha tĩnh, pha động
QS, QM: lượng chất trong pha tĩnh, pha động.
tR, t’R, to: thời gian lưu, thời gian lưu hiệu chỉnh, thời gian chết.
- Chọn cột, pha động sao cho 1 ≤ k’ ≤ 8.
1.1.2. Hệ số chọn lọc α 𝑘′𝐴 𝑡𝑅𝐴 𝛼 = = 𝑘′𝐵 𝑡𝑅𝐵 -
Quy ước B là chất bị lưu giữ mạnh hơn A nên α > 1.
- Để tách riêng 2 chất, thường chọn: 1,05 ≤ α ≤ 2,0.
1.1.3. Hệ số đối xứng của pic F 𝑊 𝐹 = 2𝑎
- Trong đó: W: chiều rộng pic đo ở 1/20 chiều cao pic.
a: khoảng cách từ đường vuông góc hạ từ đỉnh pic đến mép đường cong phía trước tại vị trí 1/20 chiều cao cột.
1.1.4. Số đĩa lý thuyết và hiệu lực cột N 𝑡𝑅2 𝑡𝑅2 lOMoAR cPSD| 47205411
Ngô Phước Long – M1K73 – 2022 𝑁 = 16. 𝑊 2 = 5,54. 𝑊 1/22
- Trong đó: W: chiều rộng đáy pic.
W1/2: chiều rộng pic đo ở nửa chiều ao pic.
1.1.5. Độ phân giải RS
2. (𝑡𝑅𝐵 − 𝑡𝑅𝐴)
1,18 (𝑡𝑅𝐵 − 𝑡𝑅𝐴) 𝑅𝑆 = = 𝑊𝐵 + 𝑊𝐴 𝑊1/2𝐵 + 𝑊1/2𝐴
- Trong đó: 𝑡𝑅𝐴, 𝑡𝑅𝐵: thời gian lưu cua 2 pic liền kề nhau (A và B).
𝑊𝐵, 𝑊𝐴: độ rộng pic đo ở các đáy pic.
𝑊1/2𝐵, 𝑊1/2𝐴: độ rộng pic đo ở nửa chiều cao pic. 1.2. Máy HPLC 1.2.1. Hệ bơm
- Tạo áp suất cao để đẩy pha động từ bình dung môi qua hệ thống sắc ký.
- Yêu cầu: áp suất 250-500atm; lưu lượng bơm 0,1 đến 10mL/phút; không bị ăn mòn với các thành
phần pha động, tốc độ bơm không đổi.
1.2.2. Hệ tiêm mẫu
- Phổ biến: dùng van tiếm có vòng chứa mẫu có dung tích xác định, chính xác, có thể thay đổi vòng
chứa mẫu với các dung tích khác nhau. 1.2.3. Cột
- Phổ biến: thép không gỉ, chiều dài 10-30cm, đường kính tong 2-5mm, hạt chất nạp cỡ 5-10 μm thường là silica gel.
- Được làm nóng để phân tách tốt hơn, nhiệt độ không quá 60oC. 1.2.4. Detector
- Bộ phận phát hiện, đo các tín hiệu sinh ra khi có chất ra khỏi cột, ghi dưới dạng pic trên sắc ký đồ. - Phổ biến:
+ Detector UV-VIS: bước sóng tùy chọn.
+ Detecor dãy diod: tỉ lệ tín hiệu nhiễu thấp hơn so với detector UV-VIS thường.
2. Ứng dụng phân tích bằng HPLC
2.1. Điều kiện áp dụng
- Dạng bào chế có 2-3 APIs.
- Hoạt chất chính (API) có hàm lượng thấp (áp dụng sau khi lấy mẫu trên cơ thể bệnh nhân hoặc
người sử dụng thuốc).
- Dạng bào chế có 1 APIs: nếu chiết chất phân tích còn lẫn tá dược hoặc tạp chất.
2.2. Lựa chọn điều kiện sắc ký - Dung môi pha mẫu. lOMoAR cPSD| 47205411
Ngô Phước Long – M1K73 – 2022
- Tính chất hóa lý của API:
+ Độ tan: dễ tan trong nước, aceton hay n-hexan, octanol,… + λmax
+ pKa của acid/base xác định tính acid/base chuyển dạng phân tử/ion.
+ Độ phân cực, tính theo công thức: lg 𝑃 = lg
xác định chất phân tích là phân cực hay không phân cực.
• [MO]: nồng độ chất phân tích trong pha dung môi không phân cực.
• [MN]: nồng độ chất phân tích trong pha nước. phân cực.
• lgP càng lớn chất phân tích càng không phân cực.
• lgP càng nhỏ chất phân tích càng phân cực.
• Chất có độ phân cực trung bình với lgP = 2-4.
• Các thuốc thường có lgP 0,2-4 (hoặc -1-4) dễ phân bố và dùng dạng đường uống lựa chọn
pha tĩnh có độ phân cực gần giống độ phân cực của chất phân tích lựa chọn cột C8 hoặc
C18 vì các cột này không phân cực.
- Điều kiện sắc ký: + Pha tĩnh:
• Bản chất SP: C8, C18,…
• Chiều dại cột, 2R trong,…
+ Pha động: có độ phân cực ngược lại với pha tĩnh MP thường là các dung môi phân cực.
• Thành phần pha động:
o Methanol, acetolnitril (thường dùng), trong đó MeOH có độ nhớt cao hơn, làm giảm
hiệu lực của cột còn ACN có độ nhớt thấp hơn, thích hợp cho chất không phân cực
hơn. Thời gian lưu ngắn hơn nếu [ACN] = [MeOH].
o Phối hợp với nước, đệm phosphat pH. (dung dịch nước có thể thêm acid, đệm, kiềm
yếu để thay đổi pH để thay đổi thứ tự rửa giải trên SK). • pH pha động. • Tỉ lệ pha động: o Giảm thời gian lưu tR.
o Tăng tỉ lệ dung môi HC.
• Tốc độ dòng pha động.
MP phân cực, SP không phân cực là sắc ký phân bố pha đảo (thường dùng, ít dùng SKPB pha
thuận là MP không phân cực, SP phân cực do các hoạt chất có độ phân cực trung bình với lgP = 1-4
để dễ trao đổi, đi qua HRSH và dễ phân bố trong lớp mỡ đó nhưng đồng thời phải tan được trong
nước để đi được trong máu nhằm phân bố khắp cơ thể).
+ Lựa chọn bước sóng: quét phổ chọn λmax (vì chủ yếu dùng detector đo phổ UV-VIS vì 90% các
dược chất có liên kết đôi, ba, vòng thơm, dị vòng với nhiều liên kết π).
+ Chọn khoảng nồng độ PT. + Khảo sát.
+ Thay đổi thể tích tiêm mẫu: 10-50μL.
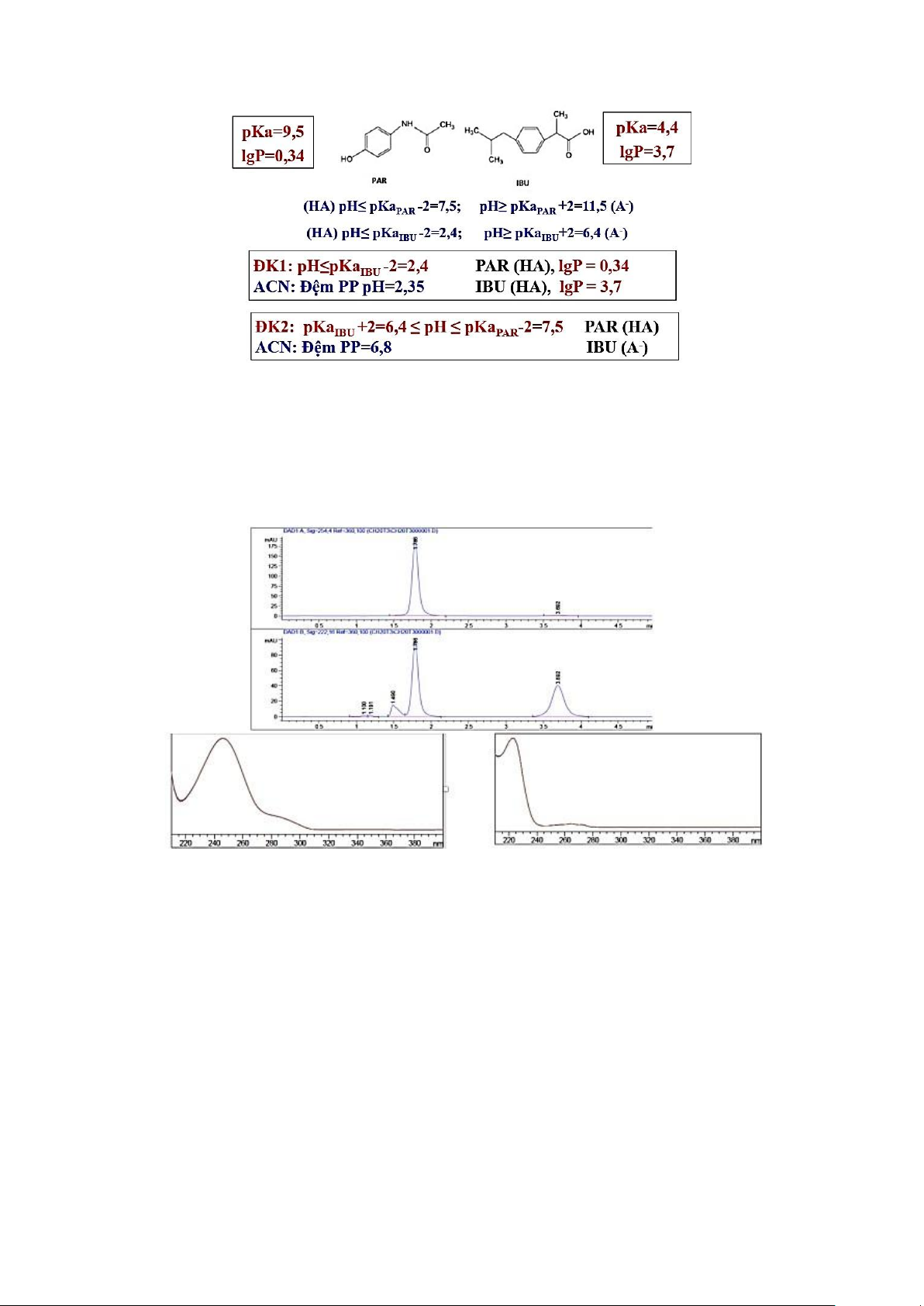
Ví dụ: xây dựng PP định lượng paracetamol và ibuprofen bằng kỹ thuật HPLC. Độ tan Paracetamol Ibuprofen lOMoAR cPSD| 47205411
Ngô Phước Long – M1K73 – 2022 Tan tốt
MetOH, EtOH, dimethylformamid, ethylene trong DM
diclorid, aceton, ethyl acetat Hầu hết các DMHC Kém tan trong DM
Ete dầu hỏa, pentan, benzen pKa 9,5 4,4 lgP 0,34 3,7 - Lưu ý:
+ Hai chất càng giống nhau thì dễ chọn điều kiện sắc ký để cùng phân tích trong một chương trình
sắc ký hơn là hai chất khác nhau.
+ Para và Ibu có lgP rất khác nhau:
• Para: lgP = 0,34 [Mo]/[MN] = 10-0,34 para rất phân cực.
• Ibu: lgP = 3,7 [Mo]/[MN] = 103,7 ibu rất không phân cực.
• Hai chất có độ phân cực rất khác nhau.
• Cột SP tương tác lên para là lực F
1 (P), lên ibu là lực F1 (Ibu) thì lực F1 (Ibu) >> lực F1 (P)
nên para sẽ được rửa rải ra trước.
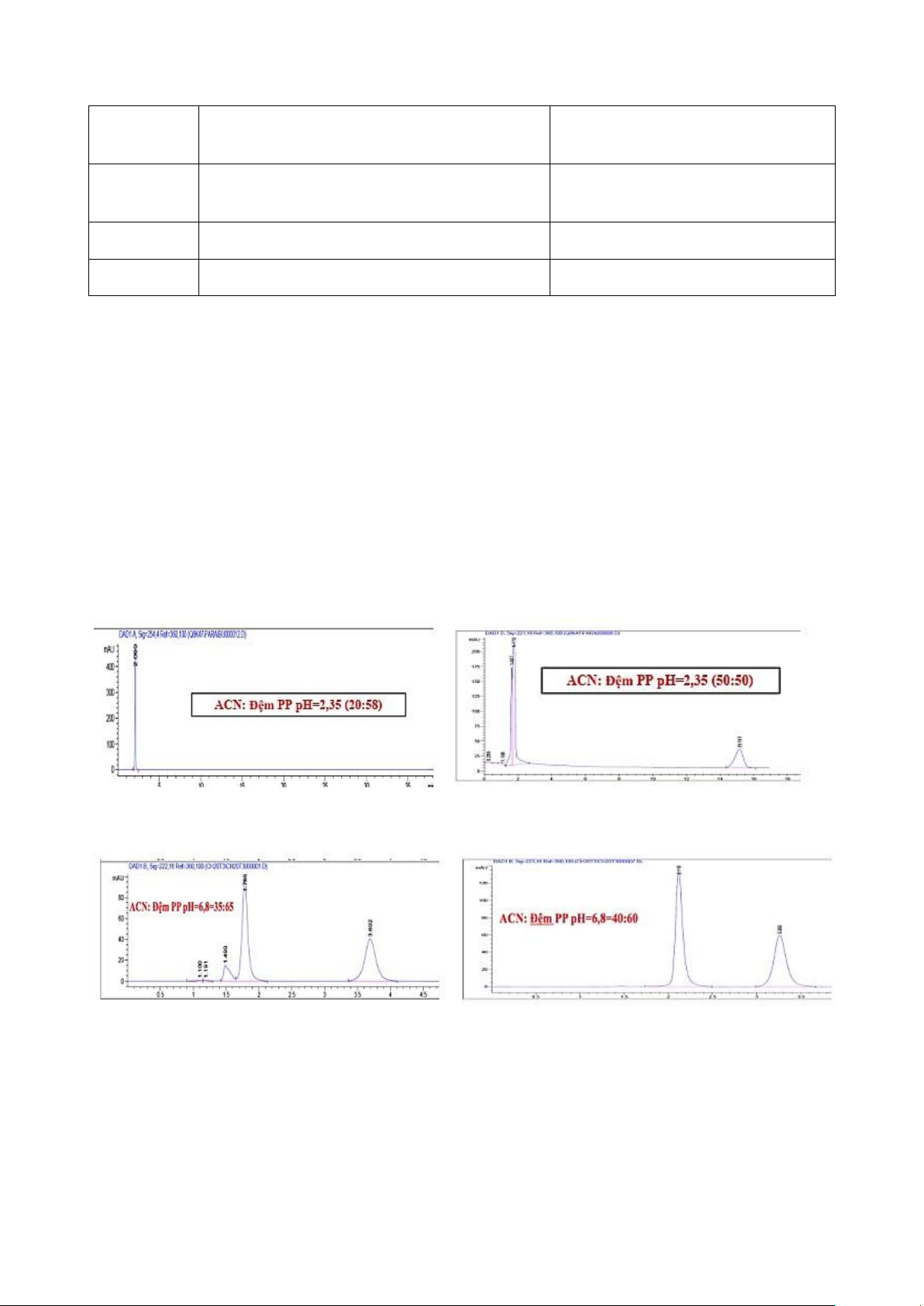
- Lựa chọn thành phần pha động: sử dụng SKPB pha đảo với SP là cột C18.
+ Với Acetonitril : đệm phosphat pH=2,35 thì Tỉ lệ 20:80 chuyển sang tỉ lệ 50:50 đã giảm thời gian lưu của ibu.
+ Với Acetonitril :đệm phosphat pH=6,8 thì tỉ lệ 35:65 chuyển sang tỉ lệ 40:60 thì cũng giảm thời
gian lưu của ibu và giảm không quá nhiều, cả hai tỉ lệ đều giúp tR của ibu thấp.
Để giảm tR của ibu = tăng độ phân cực của ibu lên = thay đổi pH pha động.
Thay đổi pH của SP đạt pH = pKa + 2 (pKa của ibu) để ibu tồn tại ở dạng ion. lOMoAR cPSD| 47205411
Ngô Phước Long – M1K73 – 2022
Ở ĐK1 thì para ở dạng HA phân tử không bị ảnh hưởng do para đã được rửa giải rất nhanh còn
ibu cũng ở dạng HA phân tử bị rửa rải rất chậm.
Lựa chọn ĐK2 để ibu ở dạng ion, tăng độ phân cực nên giảm tương tác với SP không phân cực,
tăng tương tác với MP phân cực nên giảm tR của ibu. Còn para ở dạng HA (phân tử) không bị
ảnh hưởng do para đã được rửa giải rất nhanh.
- Lựa chọn bước sóng phát hiện:
+ Chạy sắc ký đồ của chất chuẩn đơn paracetamol hoặc ibuprofen, sau đó đối chiếu với sắc ký đồ
chạy cả 2 chất trên để xác định pic nào của para, pic nào của ibu.
+ Cực đại hấp thụ của para là 254nm, của ibu là 222nm (do đang pha trong dung môi ACN:đệm
phosphat pH=6,8 với tỷ lệ 35:65). Lựa chọn bước sóng phát hiện:
• Thông thường: lựa chọn bước sóng định lượng = bước sóng cực đại.
• Với định lượng 2 thành phần:
o 2 cực đại sẽ khác nhau.
o Tối ưu: chạy sắc ký đồ có 2 cực đại của 2 chất đó >< khi lấy sắc ký đồ ra thì ĐL của
para tại 254nm, của ibu là 222nm sẽ rất phức tạp.
o Cách khác: lựa chọn cực đại của chất này cũng là cực đại của chất kia.
o Nếu chọn bước sóng 254nm: cực đại của para (đồ thị trái) nhưng lại là cực tiểu của
ibu có giá trị độ hấp thụ rất thấp, khó xác định (đối chiếu vị trí 254nm ở đồ thị phải).
o Nếu chọn bước sóng 222nm: cực đại của ibu (đồ thị phải) thì là cực tiểu của para
có giá trị độ hấp thụ tương đối cao, dễ xác định (đối chiếu vị trí 222nm ở đồ thị trái).
Cực tiểu của para sẽ giảm được sai số khi tính toán.



