














Preview text:
lOMoAR cPSD| 61301459 DUNG DỊCH MỤC TIÊU BÀI HỌC
- Trình bày được khái niệm, phân loại dung dịch để giải thích được các loại
dung dịch có trong cơ thể sống
- Trình bày được tính acid base của dung dịch và giải thích vai trò của hiện
tượng thẩm thấu và dung dịch đệm đối với cơ thể sống 1. CÁC LOẠI DUNG DỊCH
1.1. Khái niệm dung dịch
Nếu trong một chất nào đó người ta phân bố những hạt rất nhỏ của một hay
nhiều chất khác, ta được một hệ phân tán. Chất thứ nhất gọi là môi trường phân tán,
chất thứ hai gọi là chất phân tán.
Dung dịch là một hệ phân tán gồm môi trường phân tán và chất phân tán phải đồng nhất Môi trường ph Mân ụ tán là chất c tiêu và Phân loqu ạ yết đị i Dung dị nh
ch dạng tồn tại của hệ. Trong trường hợp
các chất ở cùng một dạng tồn tại, chất nào có lượng nhỏ hơn sẽ đóng vai trò chất phân
tán, chất nào có lượng lớn hơn sẽ đóng vai trò môi trường phân tán.
Môi trường phân tán là chất lỏng, thường được gọi là dung môi. Dung môi có
thể là dung môi vô cơ (H2O), dung môi hữu cơ (rượu), dung môi phân cực (acid
axetic), dung môi không phân cực (n- Hexan).
1.2. Phân loại dung dịch 1.2.1.Phân loại theo trạng thái của môi trường phân tán
Môi trường phân tán tồn tại dưới ba trạng thái: rắn, lỏng và khí. Như đã quy
định ở trên, môi trường phân tán quyết định dạng tồn tại của dung dịch. Do đó dung
dịch phân loại theo cách này có ba loại : dung dịch khí (khí dung, thuốc xịt), dung
dịch lỏng (dung dịch natri clorid 0,9%...), dung dịch rắn (thuốc ở dạng viên nén,dạng nang hay bột…)
Do khả năng khuyếch tán nhanh nên dung dịch tồn tại dạng khí cho hiệu quả
chữa bệnh nhanh hơn so với dạng lỏng, dạng lỏng nhanh hơn so với dạng rắn. Tuy
nhiên nhược điểm của thuốc dạng khí khó điều chế, khó bảo quản, dụng cụ chứa có
cấu tạo phức tạp chỉ phù hợp với việc điều trị bệnh tức thời, vận chuyển khó khăn.
1.2.2. Phân loại theo kích thước chất tan
Trong trường hợp môi trường phân tán là chất lỏng, tùy theo kích thước của
các tiểu phân phân tán mà dung dịch chia làm 3 loại:
+ Dung dịch thực (dung dịch) : kích thước các tiểu phân phân tán nhỏ hơn 1nm
(cỡ nguyên tử, phân tử hay ion). Chất tan không nhìn thấy được qua kính hiển vi điện
tử, đi qua màng siêu lọc và màng thẩm tích, khuyech tán nhanh. Ví dụ về dung dịch
thực: Dung dịch NaCl, rượu 370. Đây là hệ phân tán đồng thể
+ Dung dịch keo: kích thước tiểu phân phân tán từ 1nm – 100nm. Chất tan
không nhìn thấy được qua kính hiển vi thường, nhìn được qua kính siêu hiển vi, hiển
vi điện tử, đi qua giấy lọc thường, không qua được màng thẩm tích, khuyếch tán rất chậm.
Đây là hệ phân tán vi dị thể.
Ví dụ: dung dịch hồ tinh bột, lòng trắng trứng, hơi nước trong không khí +
Dung dịch thô (hệ thô): kích thước các tiểu phân phân tán lớn hơn 100nm. Chất tan
nhìn thấy được trong các loại kính hiển vi, không qua giấy lọc thường, không qua
được màng thẩm tích, không khuyếch tán. Nếu chất phân tán ở trạng thái rắn gọi là lOMoAR cPSD| 61301459
huyền phù: nước phù sa; nếu chất phân tán ở trạng thái lỏng thì gọi là nhũ tương. Đây
là hệ phân tán dị thể.
Có nhiều loại thành phần cơ thể tồn tại ở nhiều dạng khác nhau hoặc là hỗn
hợp nhiều dạng dung dịch: Ví dụ : Sữa động vật là một dung dịch phức tạp gồm 87 –
89 % nước (dung môi); 2,7 – 4,5 % lipit ở dạng nhũ tương; 2,7 – 3,8% casein ở dạng
dung dịch keo; 4,5 – 4,7 % lactose cùng với các muối khoáng và các vitamin ở dạng
dung dịch thật. Máu người gồm hồng cầu, tiểu cầu và bạch cầu là những tế bào máu,
chiếm 40 – 46% thể tích máu tạo thành hệ phân tán thô trong huyết tương. Huyết
tương chiếm 54 – 60% thể tích máu vừa là dung dịch keo (chứa các đại phân tử như
albumin; protein; phức hợp lipid – protein) vừa là dung dịch thật (chứa các chất hòa
tan là những phân tử nhỏ oxi, glucose...)
Thuốc dưới dạng dung dịch thật hay dùng các dung môi là: nước, cồn hay dầu.
Ưu điểm của dạng thuốc này là thuốc ngấm nhanh, tác dụng nhanh hơn các dạng
thuốc rắn và không gây kích ứng khi tiếp xúc với niêm mạc vì các phân tử chất tan
khuyêch tán được qua màng tế bào vào dịch nội bào thể hiện tác dụng chữa bệnh.
Hơn nữa, dược chất được hoà tan trong dung môi nên có thể bào chế ở dạng thuốc
giọt, rất tiện dùng cho người già và trẻ nhỏ khi dùng qua đường uống. Nhược điểm
của dạng thuốc này là thường kém bền vững, nên không thể bảo quản lâu dài. Việc
chia liều kém chính xác hơn dạng thuốc rắn. Vận chuyển gặp nhiều khó khăn do dung
dịch thuốc được đóng gói cồng kềnh và dễ vỡ.
Một số loại thuốc dạng dung dịch thật hay sử dụng như dung dịch natri clorid
0,9%; dung dịch glucose nồng độ khác nhau dùng để tiêm truyền… Thuốc dạng uống
có một số loại Siro (thuốc là dạng thuốc lỏng, sánh và có chứa tỷ lệ đường cao (56
64%), được điều chế bằng cách hòa tan dược chất, dung dịch dược chất trong đường
siro đơn hoặc hòa tan đường trong dung dich dược chất, dùng để uống); Elixir là dạng
thuốc lỏng, chứa một hay nhiều dược chất, thường chứa một tỉ lệ lớn ethanol và
saccharose hoặc polyalcol (như glycerin) cùng một số chất phụ thích hợp (như chất
bảo quản chống nấm mốc..).Ví dụ như: elixir paracetamol, elixir phenobarbitan,…
Dung dịch cồn thuốc là dạng thuốc dùng trong hoặc dùng ngoài, gồm một hay nhiều
dược chất hòa tan hoàn toàn trong ethanol dùng bôi ngoài da…
Hỗn dịch là dạng thuốc lỏng để uống, tiêm hay dùng ngoài có chứa dược chất
rắn không hòa tan ở dạng hạt rất nhỏ (đường kinh ≥ 0,1μm) (dung dịch thô) được
phân tán đồng đều trong chất lỏng là môi trường phân tán. Môi trường phân tán
thường gặp: nước, nước thơm, dung dịch dược chất...Ưu điểm của thuốc ở dạng hỗn
dịch là hạn chế được nhược điểm của một số dược chất khi hoà tan kém bền vững
hoặc có mùi vị khó uống và gây kích ứng niêm mạc đường tiêu hoá. Đối với thuốc
dạng hỗn dịch cần lắc kỹ trước khi sử dụng. Thuốc tiêm dạng hỗn dịch dùng để tiêm
dưới da (hỗn dịch trong môi trường nước), tiêm bắp (hỗn dịch trong môi trường nước
hoặc dầu); tiêm tĩnh mạch (hỗn dịch nano có đường kính nhỏ hơn 500nm).
Nhũ tương là dạng thuốc lỏng chứa các tiểu phân lỏng phân tán trong một chất
lỏng khác không đồng tan. Có thể dùng để uống, tiêm hay dùng ngoài. Nhũ tương
dạng lỏng dùng để uống gọi là nhũ dịch.Ưu điểm: Che giấu mùi vị khó chịu của
thuốc, giảm tác dụng gây kích ứng niêm mạc đường tiêu hoá của dược chất. Nhũ
tương dùng đường tiêm không gây tắc mạch như các thuốc tiêm dạng dầu. Nhũ tương
dùng để tiêm bắp, tiêm tĩnh mạch hay làm dịch truyền. Cần lắc kỹ trước khi sử dụng. lOMoAR cPSD| 61301459
Quy luật tương tác của các hạt phân tán với môi trường phân tán và của các
hạt tương tác với nhau đã quyết định tới sự khuyêch tán, sự hấp thu và có tác dụng
ngắn – dài hay nhanh – chậm của một dạng thuốc.
Các dạng thuốc phun mù, thuốc xịt dưới dạng khí dung có tác dụng điều trị nhanh
và hiệu quả tại chỗ là do cấu trúc của các thuốc này là hệ keo.
Trong nhóm thuốc tác dụng kéo dài thường là những hệ phân tán dị thể gồm
những hạt tiểu phân hoạt chất phân tán trong các tá dược cao phân tử, nhằm giải
phóng từ từ dược chất. Hệ phân tán này đã góp phần quan trọng trong việc kéo dài
hiệu quả điều trị của thuốc.
1.2.3. Phân loại theo lượng chất tan
Khi cho chất tan rắn vào một dung môi sẽ xảy ra hai quá trình: quá trình tách
các hạt chất tan từ bề mặt tiếp xúc giữa chất tan và dung môi, gọi là quá trình hòa tan,
có tốc độ hòa tan vht (số hạt chất tan chuyển vào dung môi trong một đơn vị thời
gian). Các hạt chất tan đã ở trong dung môi có thể gặp lại bề mặt chất tan rồi bị giữ
lại trong cấu trúc chung, đó gọi là quá trình kết tinh, có tốc độ vkt (số hạt chất tan trở
lại cấu trúc chung trong một đơn vị thời gian). Ban đầu tốc độ hòa tan lớn hơn tốc độ
kết tinh. Nhưng khi dung môi đã có nhiều hạt chất tan (nồng độ chất tan trong dung
dịch lớn) thì tốc độ kết tinh lớn dần, tốc độ hòa tan nhỏ dần
Dựa vào lượng chất tan có trong dung dịch, người ta chia dung dịch làm ba loại:
+ Nếu vht> vkt, dung dịch chứa lượng chất tan nhỏ hơn lượng chất tan tối đa
có thể hòa tan ở nhiệt độ nhất định gọi là dung dịch chưa bão hòa. Dung dịch chưa
bão hòa có khả năng hòa tan thêm chất tan.
+ Nếu vht= vkt, trong một đơn vị thời gian, có bao nhiêu hạt chất tan chuyển
vào dung dịch thì cũng có chừng ấy hạt từ dung dịch trở về cấu trúc ban đầu của chất
tan. Quá trình hòa tan đạt trạng thái cân bằng. Dung dịch chứa lượng chất tan bằng
lượng chất tan tối đa có thể hòa tan ở nhiệt độ nhất định gọi là dung dịch bão hòa.
Dung dịch bão hòa không thể khả năng hòa tan thêm chất tan và có nồng độ không đổi.
+ Nếu vht < vkt, Dung dịch chứa lượng chất tan lớn hơn lượng chất tan tối đa
có thể hòa tan ở nhiệt độ nhất định gọi là dung dịch quá bão hòa. Loại dung dịch
này được tạo thành khi làm nguội chậm và yên tĩnh một dung dịch bão hòa ở nhiệt
độ cao. Dung dịch quá bão hòa không có khả năng hòa tan thêm chất tan, là dung
dịch kém bền vững, dễ tách lượng chất tan ra tạo dung dịch bão hòa.(quá bão hòa để
1 thời gian sẽ chuyển về bão hòa)
1.3. Vai trò của các dung dịch đối với cơ thể sống
Trong cơ thể sống tồn tại nhiều loại dung dịch khác nhau. Có thể liệt kê ra một
số vai trò chủ yếu của các dung dịch trong cơ thể sống là: vận chuyển chất từ nơi này
đến nơi khác của cơ thể (từ ngoài màng tế bào vào trong màng tế bào, vận chuyển từ
cơ quan này đến cơ quan khác trong cơ thể); là môi trường để thực hiện các phản ứng
sinh hóa (các phản ứng chuyển hóa trong cơ thể); bao bọc và bảo vệ các tế bào, các
tổ chức sống (dịch tế bào); là yếu tố không thể thiếu trong quá trình trao đổi vật chất
qua màng; là yếu tố dẫn điện trong quá trình lan truyền xung điện sinh vật; điều hòa
thân nhiệt của cơ thể sống lOMoAR cPSD| 61301459
1.4. Cách biểu thị nồng độ
Nồng độ là cách biểu thị thành phần định lượng của một dung dịch. Nó biểu
thị lượng chất tan (g, mol) có trong một khối lượng xác định (một thể tích xác định)
của dung dịch hoặc dung môi
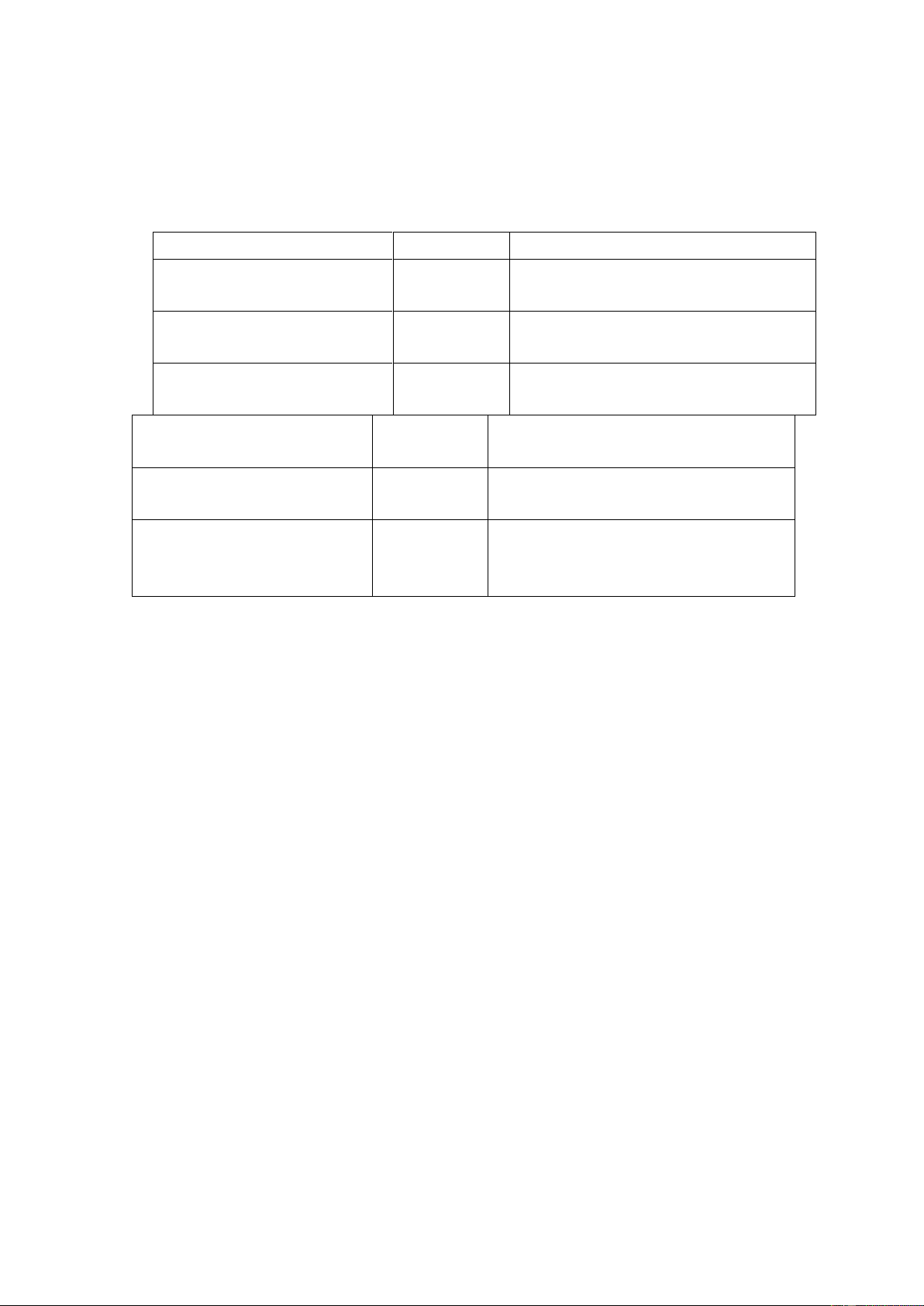
Lượng chất tan càng lớn thì nồng độ càng lớn và ngược lại. Loại nồng độ Kí hiệu Định nghĩa
Phần trăm theo khối lượng
%(KL/KL) Số g chất tan có trong 100 g dung (KL) dịch
Phần trăm theo thể tích (V) %(V/V)
Số ml chât tan trong 100ml dung dịch
Phần trăm theo khối lượng % (KL/V)
Số g (mg) chất tan có trong 100ml – thể tích dung dịch Mol M, mol/l
Số mol chất tan có trong 1 L dung dịch Molan M
Số mol chất tan có trong 1000 g dung môi Phần mol X hoặc Ni
Tỷ số giữa số mol một chất có trong
dung dịch và tổng số mol các chất có trong dung dịch
Loại nồng độ dung dịch hay sử dụng trong y học là nồng độ phần trăm theo khối
lượng – thể tích % (KL/V)
Ví dụ: Thuốc nhỏ mắt natri clorid NaCl 0,9% có nghĩa là có 0,9 g NaCl trong 100 ml dung dịch
Dung dịch glucose 30%, (G 30) nghĩa là 30 gam glucose có trong 100ml dung dịch
Thuốc tiêm phenobarbital 10% nghĩa là 10g phenobarbital trong 100 ml dung dịch (hay 200mg/2ml) 1.5. Độ tan S
Độ tan của một chất trong một dung môi là nồng độ dung dịch bão hòa bền vững
của chất đó ở nhiệt độ và áp suất nhất định.
Như vậy có bao nhiêu cách biểu diễn nồng độ dung dịch thì có bấy nhiêu cách
biểu diễn độ tan. Hay sử dụng độ tan của một chất tan ở nhiệt độ xác định là số gam
chất tan tối đa tan được trong 100 gam dung môi.
Độ tan của một chất phụ thuộc vào: bản chất chất tan, bản chất dung môi và nhiệt độ khi hòa tan. Phân loại khả năng tan: Ở 200C:
+ Chất có độ tan lớn hơn 1g: chất dễ tan
+ Chất có độ tan từ 0,001 – 1 gam: chất ít tan
+ Chất có độ tan nhỏ hơn 0,001 gam: chất không tan lOMoAR cPSD| 61301459
3. HIỆN TƯỢNG THẨM THẤU
3.1. Khái niệm
Có một ống thủy tinh hình chữ U ở giữa được đặt một màng bán thấm (màng
chỉ cho dung môi đi qua mà không cho các phân tử chất tan đi qua). Nhánh A đựng
nước, nhánh B đựng dung dịch glucose.
+ Ban đầu mực nước ở hai nhánh bằng nhau.
+ Một thời gian sau, thấy mực chất lỏng ở nhánh A giảm đi và nhánh B dâng lên
và dâng lên đến độ cao h nào đó thì dừng lại.
+ Hiện tượng này gọi là hiện tượng thẩm thấu của dung dịch.
Hiện tượng thẩm thấu xuất hiện khi: Dung dịch tiếp xúc với dung môi nguyên
chất qua màng bán thấm hoặc hai dung dịch có nồng độ khác nhau tiếp xúc với nhau qua màng bán thấm.
Hiện tượng thẩm thấu không thể hiện ở các dung môi riêng biệt.
3.2. Giải thích hiện tượng thẩm thấu
Do tính chất của màng bán thấm chỉ cho các phân tử nước đi qua, nên các
phân tử nước có thể đi từ nhánh A sang nhánh B và ngược lại.
Lúc đầu lượng nước ở nhánh A lớn hơn ở nhánh B, nên các phân tử nước đi
từ nhánh A sang nhánh B lớn hơn các phân tử nước đi từ nhánh B sang nhánh A. Kết
quả này làm tăng thể tích dung dịch trong nhánh B.
Cột dung dịch trong nhánh B tăng lên làm tăng áp suất thủy tĩnh trong nhánh
B tác dụng lên màng bán thấm, làm tăng tốc độ các phân tử nước từ nhánh B ra nhánh
A, làm giảm tốc độ các phân tử nước từ nhánh A sang nhánh B. Đến một lúc nào đó,
tốc độ các phân tử nước di chuyển qua màng bán thấm bằng nhau, thì thể tích dung
dịch trong nhánh B không tăng thêm nữa. Ta nói hiện tượng thẩm thấu đã dừng lại.
Sự chuyển các phân tử dung môi vào dung dịch gọi là sự thẩm thấu.
Hiện tượng thẩm thấu là hiện tượng di chuyển của dung môi từ nơi có nồng
độ chất tan thấp đến nơi có nồng độ chất tan cao qua màng bán thấm
3.3. Định luật VanHoff
Áp suất thẩm thấu: Áp suất thẩm thấu là áp suất cần thiết đặt lên dung dịch
ngăn cách với dung môi bằng màng bán thấm để làm ngừng sự thẩm thấu.
Áp suất thẩm thấu của dung dịch càng lớn khi nó tiếp xúc với dung dịch có
nồng độ càng thấp hơn nó. Như vậy, áp suất thẩm thấu sẽ là lớn nhất khi nó tiếp xúc
với dung môi nguyên chất.
Định luật Van Hôp: П = C.R.T hay П.V = n.R.T lOMoAR cPSD| 61301459
П: Áp suất thẩm thấu (atm)
C: nồng độ của dung dịch (mol/l) T:
Nhiệt độ dung dịch (K) V: Thể tích dung dịch (l) n: Số mol chất tan
trong dung dịch R: Hằng số khí 0,082 l.atm/mol.K
Áp suất thẩm thấu của dung dịch tỷ lệ với nồng độ mol chất tan và nhiệt độ
tuyệt đối của dung dịch.
Định luật này áp dụng cho những dung dịch loãng, vì chỉ khi đó khoảng cách
giữa các chất tan mới đủ lớn để lực tương tác giữa chúng là không đáng kể.
Nếu hai dung dịch có áp suất thẩm thấu bằng nhau gọi là dung dịch đẳng trương so với nhau.
Nếu hai dung dịch có áp suất thẩm thấu khác nhau, thì dung dịch nào có áp
suất thẩm thấu lớn hơn gọi là dung dịch ưu trương và ngược lại gọi là dung dịch
nhược trương so với nhau.
Áp suất thẩm thấu của các dung dịch điện li thường lớn hơn các giá trị tính
toán theo định luật nói trên. Và các dung dịch này đều dẫn được điện.
Để áp dụng công thức tính П cho các dung dịch điện li ta phải bổ xung thêm
hệ số bổ chính i (hệ số VanHop, hệ số đẳng trương). Khi đó các công thức tính П có dạng: П = i.C.R.T
Giá trị i đo được bằng thực nghiệm. Nó cho biết các giá trị áp suất thẩm thấu
đo được bằng thực nghiệm lớn hơn bao nhiêu lần so với lý thuyết.
Để giải thích hiện tượng trên, Arenius đưa ra thuyết điện li: -
Những chất ở trạng thái nóng chảy hay hòa tan có khả năng dẫn điện được gọilà chất điện li. -
Khi hòa tan vào nước, các chất điện li thành các phần tử mang điện dương
vàcác phần tử mang điện âm.
Nguyên nhân gây ra tính sai lệch của định luật Vanhop và tính dẫn điện của
các dung dịch acid, base, muối là sự điện li thành các ion của các phân tử của chúng khi hòa tan vào nước.
Để đánh giá mức độ phân li của một chất, người ta đưa ra khái niệm độ điện li
α, chính là tỷ số giữa số phân tử đã phân li ra ion và tổng số phân tử chất đem hòa tan. Ta có 0 ≤ α ≤ 1
+ Nếu α = 0, chất tan không phân li thành ion, chất này gọi là chất không điện
li, dung dịch thu được khi hòa tan chất không điện li gọi là dung dịch chất không
điện li (dung dịch lỏng phân tử) và dung dịch này không có khả năng dẫn điện.
+ α < 3%: chất điện li yếu
+ 3% < α < 30%: chất điện ly trung bình
+ α > 30% : chất điện li mạnh
Độ điện li α phụ thuộc vào bản chất dung môi, bản chất chất điện li, nhiệt độ và nồng độ dung dịch.
Mối quan hệ giữa độ điện li α và hệ số bổ chính i:
i chính là tỷ số giữa tiểu phân có trong dung dịch và tổng số phân tử hòa tan: lOMoAR cPSD| 61301459
Giả sử có N phân tử chất A có độ điện li α, mỗi phân tử A phân li ra n ion, thì
tổng số phân tử chưa phân li và số ion trong dung dịch là: N(1-α) +n.N.α
N(1−α)+n.N .α i−1 Ta có i = N
= 1 + α(n – 1) hay α = n−1
Như vậy dung dịch đường và dung dịch muối có cùng nồng độ thì áp suất thẩm
thấu của dung dịch muối cao hơn dung dịch đường
3.4. Vai trò hiện tượng thẩm thấu
Có ý nghĩa lớn đối với quá trình hoạt động sống:
+ Đa số các màng tế bào đều có tính bán thấm. Nhờ hiện tưọng thẩm thấu mà
nước có thể qua màng tế bào, điều hòa nồng độ chất tan và gây ra một sức căng làm
cho cơ thể sinh vật chắc và có tính đàn hồi. Khi tế bào chết, màng tế bào mất tính bán thấm.
+ Đối với cơ thể con người chỉ cần một thay đổi nhỏ về áp suất thẩm thấu
cũng gây ảnh hưởng nghiêm trọng đến quá trình trao đổi chất của cơ thể. Khi cần
tiêm truyền các dung dịch vào máu, cần phải tiêm truyền dung dịch đẳng trương so
với máu (dung dịch glucose 5% hoặc dung dịch NaCl 0,9%). Nếu tiêm truyền vào
máu những dung dịch ưu trương hoặc nhược trương sẽ gây hiện tượng teo hoặc trương
vỡ hồng cầu. Thuốc nhỏ mắt, rửa mắt phải đẳng trương với dịch mắt để không làm
biến đổi các thể tích các tế bào giác mạc (nước muối sinh lý là dung dịch NaCl 0,9%).
Trường hợp tiêm các dung dịch nhược trương như dung dịch natri clorid 0,45 % chỉ
được tiêm bắp, tiêm dưới da, tiêm tĩnh mạch với lượng nhỏ. Khi tiêm hoặc truyền
dung dịch ưu trương chỉ tiêm tĩnh mạch như với tốc độ chậm để thuốc có thể được
pha loãng nhanh, tránh gây ra sự thay đổi đột ngột của áp suất thẩm thấu (gây đau,
gây tổn thương vị trí tiêm)
Nước chiếm khoảng 60% - 80% trọng lượng cơ thể. Nước đóng vai trò quan
trọng trong việc chuyển hóa các chất dinh dưỡng vào máu và truyền đi tới các bộ
phận khác trong cơ thể. Nước di chuyển tự do ở nơi có nồng độ chất hoà tan thấp
sang nơi có nồng độ chất hoà tan cao hơn để bảo đảm cân bằng áp lực thẩm thấu.
Nước cũng giống như chất đạm, vitamin là những chất cần thiết cho sự sinh tồn của
cơ thể, là vật chất để duy trì hoạt động cơ bản nhất của sự sống. Chỉ cần mất 10% số
lượng nước là cơ thể đã đối đầu với nhiều nguy hiểm đến tính mạng.
Đồng hành với nước trong cơ thể là các chất điện giải hay còn gọi là các chất
khoáng. Chất điện giải là những chất phân ly thành các ion khi hòa tan trong nước.
Chất điện giải đóng vai trò quan trọng trong việc duy trì sự hằng định của áp suất
thẩm thấu. Các ion kali, magie, photphat là những thành phần quan trọng của dịch
lỏng trong tế bào. Còn các ion natri, clo là thành phần không thể thiếu được của huyết
tương. Chính vì vậy, tình trạng mất nước và chất điện giải có thể gây ra những hậu
quả nghiêm trọng tới sức khỏe. Rối loạn nước và điện giải xảy ra khi xuất hiện yếu
tố nào đó làm phá vỡ sự cân bằng của nước và các chất điện giải gây nên những thay
đổi có tính bất lợi cho cơ thể. Mất nước và chất điện giải, cơ thể sẽ trong tình trạng
suy kiệt, nặng hơn người bệnh có thể tử vong. Một số bệnh lý gây rối loạn nước và
điện giải như tiêu chảy, tiểu dầm, mồ hôi trộm, có thể dẫn đến tử vong, đặc biệt là ở
trẻ em. Khi cơ thể bị tiêu chảy, ốm sốt, nôn dẫn đến mất nước ở trẻ em thì thường bù
nước và các chất điện giải bằng dung dịch oresol. Oresol là hỗn hợp các muối natri, lOMoAR cPSD| 61301459
kali và đường glucose được đựng trong gói. Oresol được pha đúng, uống đúng sẽ bù
lại lượng nước đã mất giúp trẻ phục hồi. Nếu Oresol được pha đặc hơn so với khuyến
cáo thì khi trẻ uống không khác gì uống một cốc nước muối. Uống Oresol với nồng
độ quá đặc như thế sẽ khiến hàm lượng muối trong máu tăng lên, gây tình trạng ưu
trương (quá nhiều muối trong máu), áp lực thẩm thấu trong máu cao hơn bình thường
(bình thường, hai bên màng tế bào cân bằng nhau). Do nồng độ muối quá cao nên áp
lực thẩm thấu trong máu cao hơn bình thường, “hút” nước từ tế bào ra ngoài, khiến
tế bào bị mất nước nên bị “teo” lại. Lúc này, trẻ có biểu hiện da nhăn, khô, mắt trũng...
Nguy hiểm nhất là khi tế bào não bị “teo”, gây tổn thương não khiến trẻ bị co giật,
sốt cao, vật vã, kích thích nặng hơn nữa thì hôn mê... Nếu không được cấp cứu kịp
thời, trẻ rất dễ bị tử vong. Chính vì vậy khi uống thuốc hay tiêm thuốc để bù nước và
chất điện giải cho cơ thể phải uống và tiêm đúng dung dịch đẳng trường với cơ thể.
Người ta cũng tạo ra môi trường có áp suất thẩm thấu rất lớn để bảo quản các
dược chất được lâu dài (siro), vì trong môi trường này các tế bào, vi khuẩn bào tử
nấm bị hút kiệt nước và chết. Thuốc lợi tiểu do thẩm thấu có cơ chế làm tăng áp suất
thẩm thấu ở ống thận để thu hút nhiều nước về thận rồi bài xuất qua nước tiểu.
Trong đời sống hàng ngày ta cũng gặp nhiều hiện tượng liên quan đến áp suất
thẩm thấu. Nhờ có áp suất thẩm thấu tăng dần từng bậc từ rễ cây lên ngọn mà nước
và dinh dưỡng có thể thấm qua màng có thể lên cao hàng chục mét. Cá nước mặn
thích nghi với áp suất thẩm thấu lớn của nước biển nên không thể sống được trong
nước ngọt có áp suất thẩm thấu thấp. Ướp muối lên thực phẩm để bảo quản thực phẩm.
4. PH CỦA CÁC LOẠI DUNG DỊCH ACID, BASE VÀ MUỐI
4.1. Khái niệm acid – base.
Theo Arenius: acid là những chất khi phân ly tạo ra ion H+, base là những chất khi phân ly tạo ra ion OH-
Ưu điểm của thuyết Arenius: Thuyết Arenius đã hệ thống hóa các acid – base và
giải thích được tính chất chung của acid – base.
Hạn chế của thuyết Arenius: Chỉ xét được trong dung dịch nước, chỉ giới
hạn trong một số chất có chứa ion H+ và OH-. Không giải thích được tính acid, base của nhiều chất.
Thuyết Bronsted và Lauri: Để khắc phục hạn chế của thuyết Arenius,
Bronsted và Lauri đưa ra thuyết Proton:
Acid là những chất có khả năng cho proton trong quá trình tương tác
Base là những chất có khả năng nhận proton trong quá trình tương tác. Khi một acid
cho proton thì chuyển thành base tương ứng và ngược lại, một cặp acid – base tương
ứng như vậy gọi là cặp acid - base liên hợp. Acid ⇋ base + H+ lOMoAR cPSD| 61301459
Đối với một cặp acid – base liên hợp, khi dạng acid càng dễ cho proton (tính
acid càng mạnh) thì dạng base càng khó nhận proton (tính base càng yếu) và ngược lại.
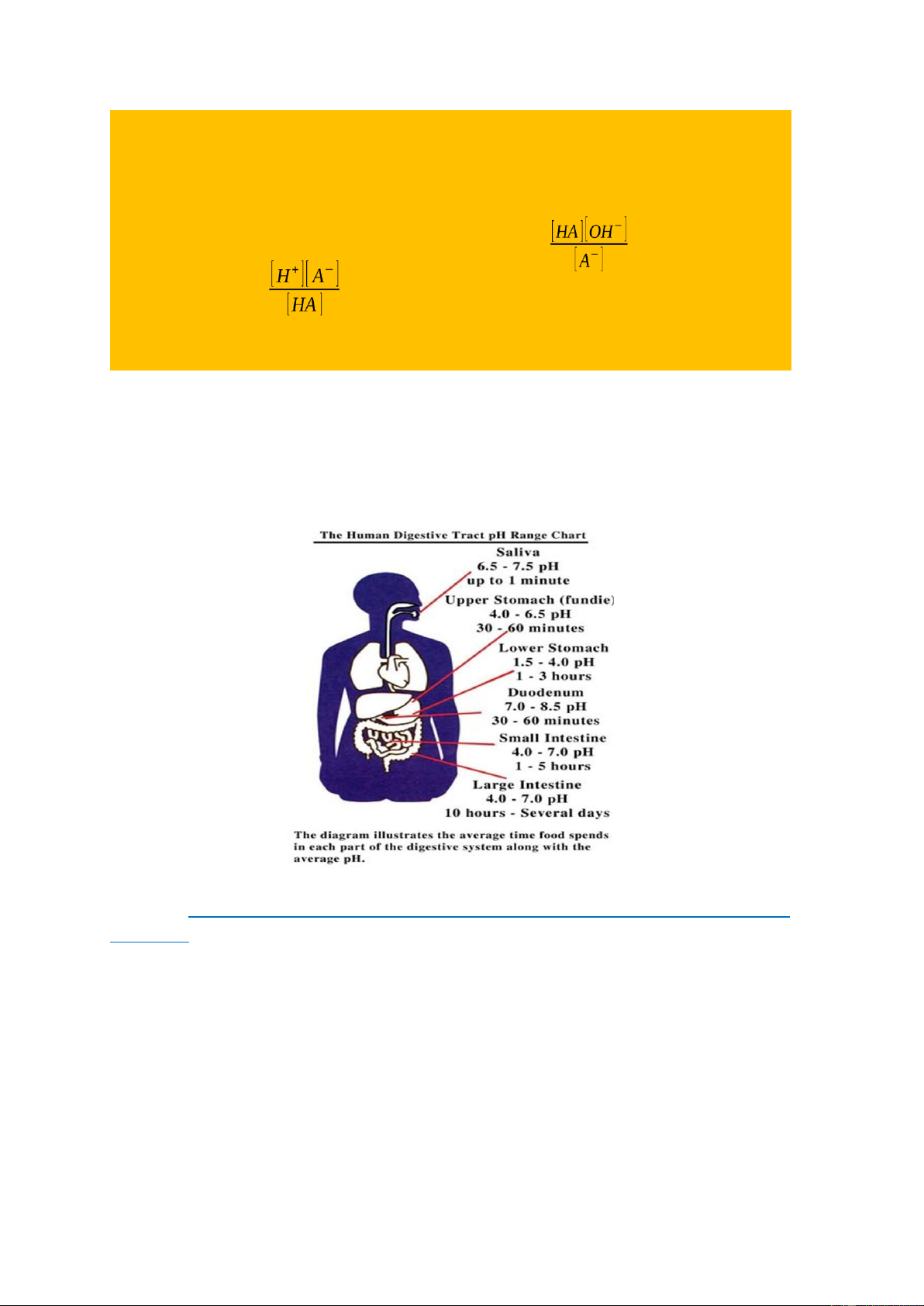
Mối liên hệ giữa hằng số Ka và Kb của một cặp acid – base liên hợp HA/A- trong dung dịch: HA ↔ H+ + A- A- + H2O ↔ HA + OHKa= Kb =
Ta có Ka. Kb = [H+] [OH-] = KN = 10-14 do pKa = - lgKa và pKb = - lgKb Nên: pKa + pKb = 14
Acid càng mạnh (pKa càng nhỏ) thì base liên hợp với nó càng yếu.
Trong cơ thể, pH ở các bộ phận có giá trị khác nhau và thay đổi theo thời gian.
Cơ thể con người chiếm 70% trọng lượng là dịch lỏng chứa Hydro, một người
nặng 50kg thì chứa 35kg dịch acid và kiềm. Vì thế vai trò của kiềm và acid vô cùng
quan trọng. Nguyên tố tạo kiềm di chuyển trong máu, còn nguyên tố tạo acid di chuyển lên não.
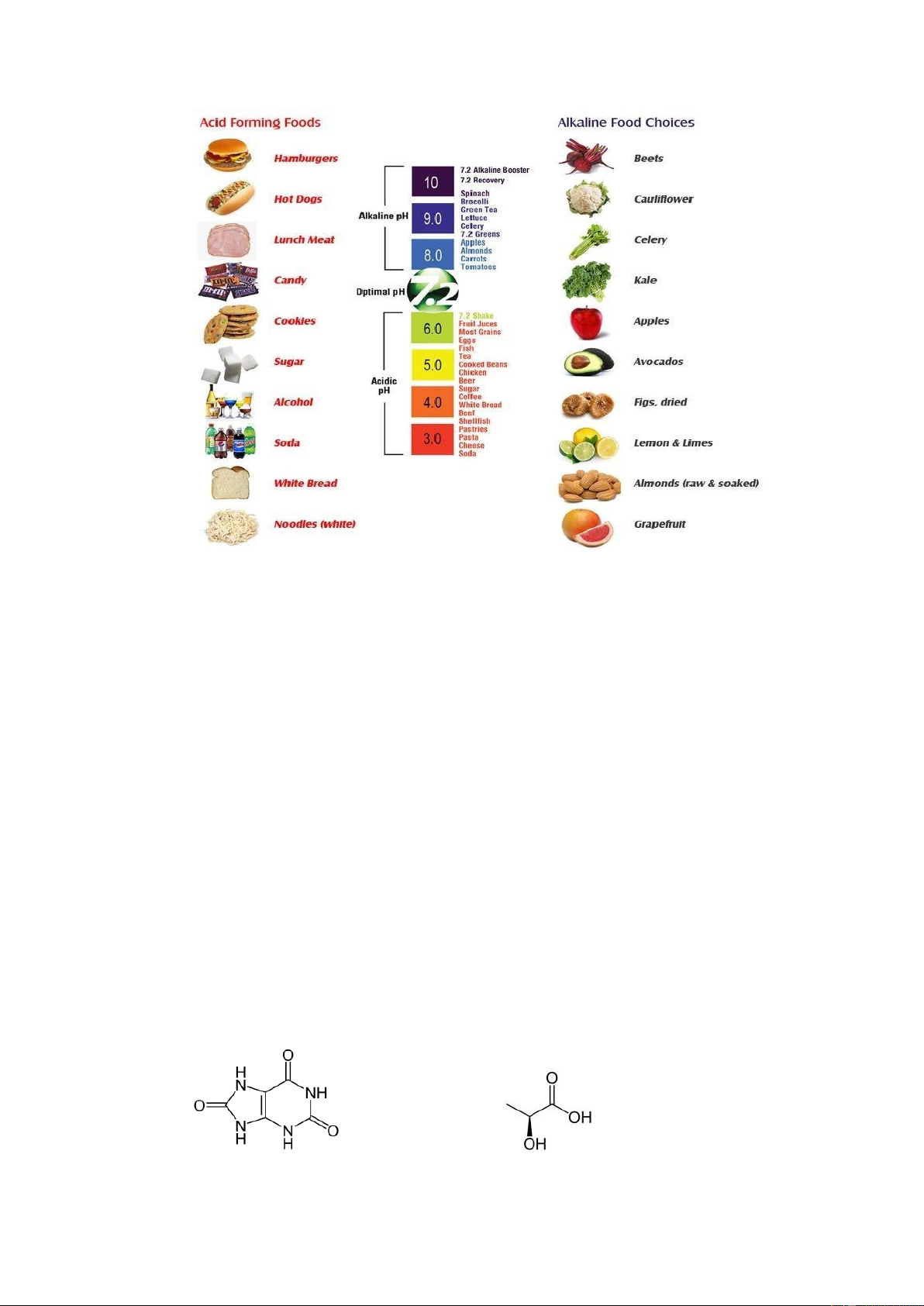
Các loại thực phẩm có chứa acid – base:
NOTE; chỉ số PH chỉ từ 1 đến 14 vì các chất sẽ có nồng độ là 0,1 đến 10^- 14( nước) lOMoAR cPSD| 61301459
Ăn uống dư acid sẽ làm suy yếu hệ thần kinh, gây bệnh về thận, dạ dày và ung
thư. Còn nếu thừa kiềm trong máu sẽ gây kích thích mạnh trong hệ thần kinh dẫn đến
cảm giác bức rứt, khó chịu dẫn đến gây ra co rút đột ngột của cơ bắp. Một chế độ ăn
được gọi là lý tưởng khi thực phẩm tạo kiềm 60- 80% trong thực đơn, còn lại 20-40%
là thực phẩm tạo acid. Dù vậy chúng ta cũng cần một số thực phẩm tạo acid để có
được những chất dinh dưỡng thiết yếu.
Một số loại acid tồn tại trong cơ thể:
Acid uric là một hợp chất dị vòng của cácbon, nitơ, ôxi, và hyđrô với công
thức C5H4N4O3. Nó tạo thành các ion và muối được gọi là urat và acid urat như amoni
acid urate. Acid uric được tạo thành trong cơ thể do quá trình thoái giáng các nhân
purin, sau đó chúng được hòa tan trong máu và đưa đến thận và thải ra ngoài qua
nước tiểu. Acid uric tăng có thể do quá trình tăng cung cấp, tăng tạo hoặc giảm thải
trừ acid uric qua thận hoặc cả hai quá trình này. Khi nồng độ acid uric tăng cao kéo
dài trong máu có thể dẫn đến một dạng viêm khớp được biết đến với tên bệnh gout.
Các hạt lắng đọng trong và xung quanh các khớp dẫn đến hậu quả viêm, sưng và đau
khớp, lắng đọng dưới da tạo nên các hạt tophi, có thể tạo sỏi thận và suy thận. Hàm
lượng acid Uric trong máu bình thường ở nam trưởng thành là 210-420 µmol/l, ở nữ
trưởng thành là 150-350 µmol/l. Khi nồng độ acid uric cao hơn mức bình thường
cảnh báo cơ thể đang tạo ra nhiều acid uric hoặc chức năng thận bị suy giảm có nguy cơ mắc bệnh gout. pKa = 5,8 Acid Uric Acid lactic lOMoAR cPSD| 61301459
Acid lactic: Hầu hết lượng acid lactic được tạo thành từ mô cơ và hồng cầu.
Khi nồng độ oxy trong cơ thể ở mức bình thường, cacbonhidrat phân giải thành nước
và carbon dioxide. Khi nồng độ oxy thấp, cacbonhidrat được phá vỡ tạo năng lượng
và sản sinh ra acid lactic. Nồng độ acid lactic cao lên khi luyện tập gắng sức hoặc các
bệnh lý khác – chẳng hạn như suy tim, nhiễm trùng nặng (nhiễm trùng huyết) hoặc
sốc – giảm lưu lượng máu và oxy toàn cơ thể. Nồng độ acid lactic cũng có thể tăng
cao khi gan bị tổn thương hoặc mắc bệnh nghiêm trọng, bởi vì gan bình thường có
vai trò thoái giáng acid lactic. Nồng độ acid lactic rất cao có thể gây tình trạng nghiêm
trọng, đôi khi đe doạ tính mạng còn được gọi là nhiễm toan lactic. Các triệu chứng
của nhiễm toan lactic bao gồm thở nhanh, vã mồ hôi nhiều, da lạnh ẩm, hơi thở có
mùi mồ hôi, đau bụng, buồn nôn hoặc nôn, lú lẫn và hôn mê. Nhiễm toan lactic cũng
có thể gặp ở người dùng metformin (Glucophage) để điều trị tiểu đường khi có kèm
suy tim, suy thận hoặc nhiễm trùng nặng. Kiểm tra hàm lượng acid lactic trong cơ thể
làm xét nghiệm acid lactic. Xét nghiệm acid lactic thường được thực hiện từ mẫu máu
tĩnh mạch cánh tay nhưng cũng có thể lấy từ máu động mạch.Acid lactic có thể được
đo trong các dịch cơ thể khác ngoài máu, chẳng hạn như dịch não tuỷ. Nồng độ acid
lactic trong các dịch cơ thể thường tăng khi có nhiễm trùng. Bác sĩ cũng có thể đo
lượng acid lactic trong dịch não tuỷ để xác định xem nhiễm trùng não là do vi khuẩn hay virus.
4.2. Sự thủy phân của muối
Một số muối khi hòa tan vào trong nước được dung dịch có pH khác 7. Ta nói
những muối này bị thủy phân.
Hiện tượng các ion của muối kết hợp với nước tạo ra acid yếu hoặc base yếu gọi
là hiện tượng thủy phân.
+ Muối tạo bởi acid yếu và base mạnh: anion gốc acid bị thủy phân cho môi trường base
CH3COONa tạo bởi base mạnh là NaOH và acid yếu là CH3COOH CH3COONa → Na+ + CH3COOCH3COO- + H2O ↔ CH3COOH + OH-
Môi trường có chứa ion OH-, là môi trường base
+ Muối tạo bởi acid mạnh và base yếu: cation kim loại sẽ bị thủy phân cho môi trường acid.
FeCl2 tạo bởi acid mạnh HCl và base yếu Fe(OH)2 FeCl2 → Fe2+ + 2Cl-
Fe2+ + H2O ↔ Fe(OH)+ + H+ Fe(OH)+ + H2O ↔ Fe(OH)2
+ H+ Môi trường có chứa ion H+, là môi trường acid.
+ Muối tạo bởi acid yếu và base yếu: cả cation và anion đều bị thủy phân, tùy
vào tương quan mạnh yếu giữa acid và base mà dung dịch có môi trường acid hay base
(NH4)2CO3 tạo bởi base yếu NH4OH và acid yếu H2CO3 (NH + 2- 4)2CO3 → 2NH4 + CO3 NH + 4 + H2O ↔ NH3 + H3O+ lOMoAR cPSD| 61301459 CO 2- - 3 + H2O ↔ HCO3 + OHHCO - 3 + H2O ↔ CO2 + H3O+
+ Muối tạo bởi acid mạnh và base mạnh, khi hòa tan vào nước chúng không bị
thủy phân nên dung dịch thu được có pH bằng pH của nước.
4.3. pH của một số dung dịch acid, base, muối * Dung dịch acid
+ Acid mạnh: Xét dung dịch acid mạnh HA có nồng độ Ca. Trong dung dịch ta có các quá trình sau: HA ↔ H+ + A- HOH ↔ H+ + OH-
Do tính trung hòa về điện trong dung dịch nên ta có: KN
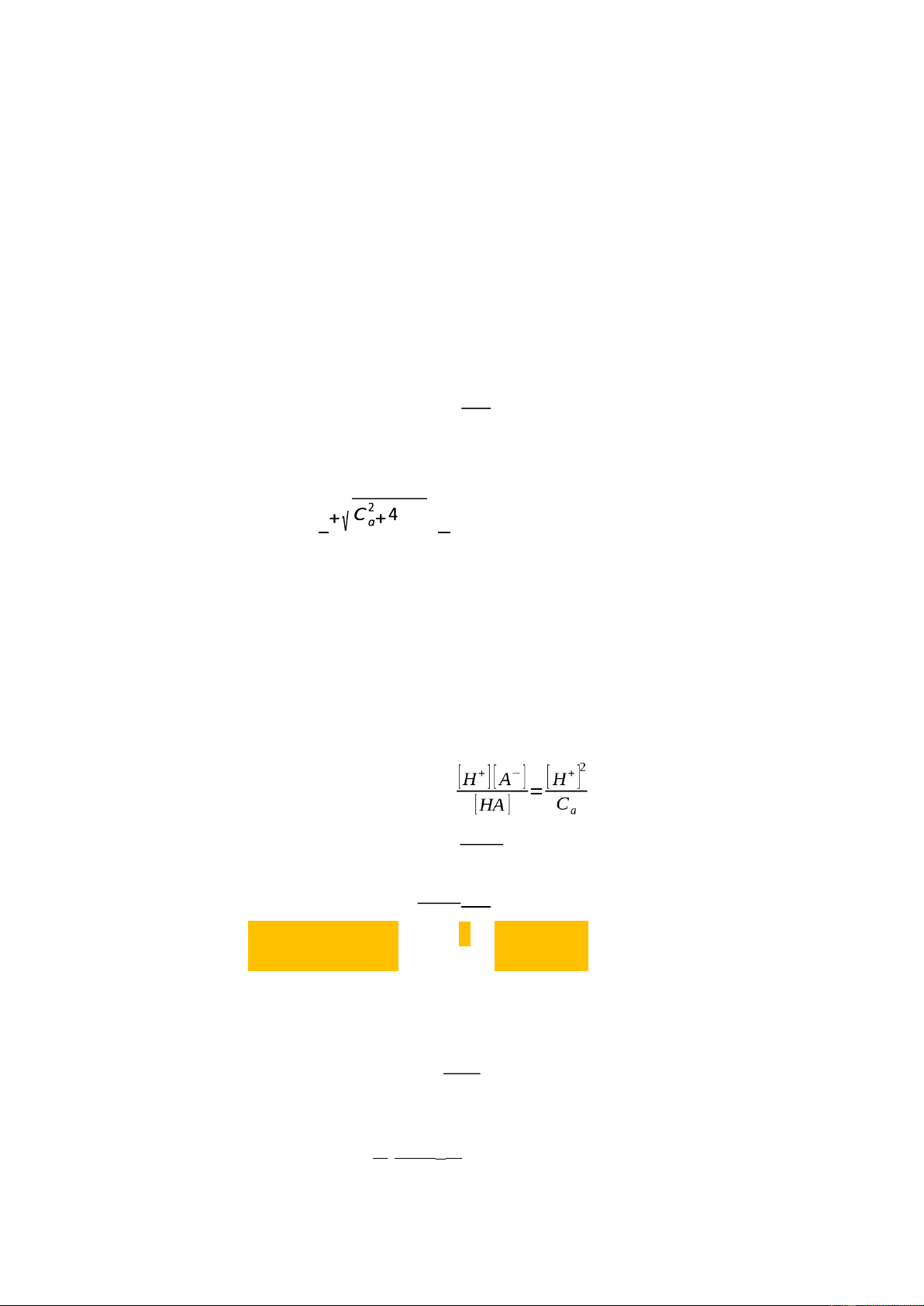
[H+] = [A-] + [OH-] = Ca + [H+] [H+]2 – Ca [H+] – KN = 0
Giải phương trình ta có: Ca KN [H+] = 2
(Vì nồng độ [H+] > 0)
+ Nếu dung dịch acid mạnh không quá loãng thì [H] » [OH-], ta có thể bỏ qua
nồng độ [OH-] trong biểu thức tính. Khi đó nồng độ [H+] = [A-] = Ca pH = - lg [H+] = - lgCa
+ Nếu dung dịch acid rất loãng, không thể bỏ qua nồng độ [OH-] trong biểu thức tính.
- Acid yếu: người ta chỉ tính gần đúng các giá trị pH của các dung dịch. Giả
thiết acid không quá yếu, dung dịch không quá loãng thì bỏ qua sự điện li của nước,
vì acid yếu, độ điện li nhỏ nên coi Ca = [HA] lúc cân bằng. HA ↔ H+ + A- có Ka =
[H+]2 = Ka.Ca hay [H+] = √KaCa hay 1 √K C 2 pH = - lg[H+] = - lg a a = (pKa – * Dung dịch base lgCa) - Base
mạnh: Xét dung dịch base
mạnh BOH, nồng độ Cb. Trong dung dịch ta có các quá trình sau: BOH = B+ + OH- HOH ↔ H+ + OH- KN = + ] + ] Cb+ [ H
Ta có: [OH-] = [B+] + [H+] hay [ H hay [H+]2 + Cb[H+] – KN = 0 lOMoAR cPSD| 61301459 KN [H+] = 2
+ Nếu dung dịch không quá loãng, thì [H+] « [OH-], ta có thể bỏ qua nồng độ
[H+] trong biểu thức tính. =
Khi đó [OH-] ≈ [B+] = Cb hay [KHN Cb
KCNb = 10C−b14 + ] hay [H+] =
Ta có pH = - lg[H+] = 14 + lgCb
+ Nếu dung dịch quá loãng, không thể bỏ qua nồng độ [H+] trong biểu thức tính.
- Base yếu: tính pH gần đúng của các dung dịch base yếu với giả thiết base
không quá yếu, dung dịch không quá loãng, thì bỏ qua sự điện li của nước. [B−][OH−]
Xét ví dụ base yếu BOH có : BOH ↔ B+ + OH- có Kb = [ BOH ]
Lúc cân bằng có: [B-] = [OH-] và [BOH]cb = [BOH] ban đầu = Cb KN 2 2 ( + ] ) 1 [OH−] [ H Kb = Cb = Cb
Từ đó suy ra pH = 14 - 2 ( pKb−lg Cb)
Đối với các acid yếu và base yếu đa bậc, vì sự điện li của nấc thứ nhất là chủ
yếu, nên trong công thức tính gần đúng lấy pK bằng pK1. Dung dịch muối
Các dung dịch muối có pH ≠7, thì đó là dung dịch chứa các muối bị thủy phân,
thực chất đó là acid yếu hoặc base yếu. vì vậy áp dụng công thức tính pH đối với acid yếu hoặc base yếu.
Muối tạo bởi acid yếu và base mạnh sẽ tạo ra môi trường có tính base yếu: 1
pH = 14 - 2 ( pKb−lg Cm) . Muối tạo bởi
base yếu và acid mạnh => môi trường acid yếu: pH = (pKa – lgCm)
Đối với cặp acid – base liên hợp ta luôn có:
Ka. Kb = 10-14 pKa + pKb = 14.
Ví dụ: Xét muối tạo bởi acid yếu và base yếu: CH3COONH4 CH + 3COONH4 = CH3COO- + NH4 CH +
3COO- + NH4 + H2O ↔ CH3COOH + NH4OH lOMoAR cPSD| 61301459 Ta có:
[H+ ] [CH3COO−] [ NH4+] [OH−]
Ka= [CH3COOH ] và Kb = [ NH4OH ] Ka
[H+ ] [CH3COO−] . [ NH4OH ]
Nên Kb = [CH3COOH ] [ NH4+][OH−] Lúc cân bằng ta có : [NH +
4OH] = [CH3COOH] và [NH4 ] = [CH3COO-] Ka
Ta có Kb = [OH−] = [ H+ ] 1 Nên [H+] =
b hay pH = 7+ 2( pKa−pKb)
Như vậy, pH của dung dịch không phụ thuộc vào nồng độ của dung dịch mà chỉ
phụ thuộc vào hằng số điện li của acid – base. 5. DUNG DỊCH ĐỆM
5.1. Định nghĩa và phân loại dung dịch đệm
Dung dịch đệm (hệ đệm) là dung dịch có pH thay đổi không đáng kể khi ta
thêm lượng nhỏ acid mạnh hoặc base mạnh, hay pha loãng dung dịch. Có hai loại dung dịch đệm:
+ Hệ đệm acid: gồm một acid yếu và muối của nó với base mạnh
+ Hệ đệm base: gồm một base yếu và muối của nó với acid mạnh
Như vậy thành phần của
dung dịch đệm gồm một acid và một
base liên hợp với acid đó và acid ↔ base +luôn
tồn tại cân bằng 5.2. pH của dung dịch đệm H+
- Dung dịch đệm acid:
Giả sử có dung dịch đệm gồm một acid yếu HA (Ca) và muối của nó với base
mạnh BA (Cm), ta có phương trình điện li: HA ↔ H+ + A- và BA = B+ + AĐể
tính gần đúng pH, ta bỏ qua sự điện li của nước và sự thủy phân của muối. Lúc các
quá trình đạt cân bằng ta có:
[HA]cb ≈ [HA]đ = Ca và [A-]cb = [BA]đ = Cm
[H+ ] [ A− ] [ H+ ]Cm Ca ơ = Ta có Ka = [ HA ]
Ca [H+] = Ka. Cm Ca Ca Ca pH = -lgK C C
a. Cm hay pH = - lg[H+] = - lg Ka m = pKa - lg m (Ph của hệ đệm acid) lOMoAR cPSD| 61301459
- Dung dịch đệm base: Giả sử dung dịch đệm gồm một base yếu BOH (Cb) và
muối của nó với acid mạnh BA (Cm). Trong dung dịch ta có các phương trình:
BOH ↔ B+ + OH- và BA = B+ + A-
Để tính gần đúng pH bỏ qua sự thủy phân của muối và sự điện li của nước.
Lúc đạt cân bằng ta có:
[BOH]cb ≈ [BOH]đ = Cb và [B+] ≈ [BA] = Cm Cm[ OH− ] 10−14 Cm 10−14 Cm Kb = [ BOH ] = Cb
= [ H+ ] Cb hay [H+] = Kb Cb Cb C
hay pH = 14 – pKb + lg m (PH của hệ đệm base)
5.3. Cơ chế đệm -
Hệ đệm acid:
Ví dụ: Dung dịch đệm axetat: CH3COONa / CH3COOH
Phương trình điện li: CH3COONa = CH3COO- + Na+ và CH3COOH ↔ CH3COO- + H+
+ Khi thêm một lượng nhỏ dung dịch acid mạnh, tức thêm H+ vào dung dịch
đệm, khi đó H+ sẽ kết hợp với ion CH3COO- có trong dung dịch tạo ta CH3COOH là
acid điện li yếu, do đó nồng độ ion H+ thêm vào ở trạng thái tự do tăng lên không đáng kể.
+ Thêm một lượng nhỏ base mạnh, tức thêm OH- vào dung dịch đệm. Khi đó
ion OH- sẽ kết hợp với ion H+ do CH3COOH phân li ra, lượng H+ tự do bị giảm sẽ
được bù lại do CH3COOH có nhiều trong dung dịch phân li ra. Vì vậy lượng H+ bị
giảm đi không đáng kể nên pH của dung dịch không thay đổi.
- Hệ đệm base: cơ chế tương tự như hệ đệm acid.
Ví dụ: Khi pha loãng dung dịch đệm, pH của dung dịch cũng ít bị thay đổi, vì
vậy theo công thức tính pH của dung dịch đệm thì khi pha loãng, tỷ lệ Ca/Cm hoặc
Cb/Cm không thay đổi, nên pH của dung dịch cũng ít thay đổi.
Tuy nhiên không thể pha loãng dung dịch đệm với bất kì tỷ lệ nào, vì khi pha
loãng thì công thức tính pH của dung dịch đệm không còn áp dụng được nữa, do khi
xây dựng công thức tính pH của dung dịch ta bỏ qua sự điện li của nước và sự thủy
phân của muối. Mặt khác khi pha loãng làm tăng độ điện li của acid, base yếu, tăng
độ thủy phân của muối, nên dung dịch đệm mất tác dụng.
Giải thích cơ chế đệm tổng quát: Trong dung dịch đệm tồn tại cân bằng: Acid ↔ Base + H+
Khi thêm acid mạnh, ion H+ do acid mạnh phân li ra sẽ kết hợp với base tạo
ra acid yếu liên hợp, lượng H+ tăng lên không đáng kể, và do đó pH thay đổi không đáng kể.
Khi thêm base mạnh: ion OH- do base mạnh phân li ra sẽ kết hợp với ion H+(do
acid phân li ra), tạo ra nước là chất điện li kém, lượng H+ bị hao hụt được bù lại nhờ lOMoAR cPSD| 61301459
cân bằng chuyển dịch về bên phải, làm cho pH của dung dịch đệm thay đổi không đáng kể.
5.4. Vai trò dung dịch đệm
- Nhiều ứng dụng trong công nghiệp như trong hóa học, cơ thể sinh vật.
+ Trong hóa học: dùng dung dịch đệm để tạo ra môi trường có pH ổn định dùng
để tiến hành trong các phản ứng cần môi trường pH không thay đổi.
+ Các cơ thể sinh vật chỉ tồn tại trong khoảng pH xác định. Đối với các dịch
trong cơ chế, nếu pH chỉ cần thay đổi đi ± 0,2 đơn vị thì đã gây ra những rối loạn trong hoạt động sống.
Acid và độ kiềm đều quan trọng đối với cơ thể. Trong khi dạ dày đòi hỏi mức
acid cao để tiêu hóa thực phẩm thì hệ thống miễn dịch lại vào kiềm là chủ yếu. Hai
yếu tố này luôn cùng tồn tại với sự cân bằng - cân bằng độ pH. Nhưng nếu cơ thể bị
đẩy vào trạng thái có nồng độ acid cao (thừa acid) thì có thể gây ra các hiệu ứng nguy hiểm.
Sự cân bằng độ pH của cơ thể con người có một tầm quan trọng to lớn cho sức
khỏe, nhưng ít người biết về nó và quan tâm đến sự cân bằng này. Độ pH đánh giá
cơ thể của chúng ta đang ở mức nào, trong môi trường kiềm (giàu oxy) hoặc môi
trường acid (thiếu oxy). Khi cơ thể thừa acid gây ra các bệnh như sau:
Thừa cân và không giảm cân được: Khi cân bằng tính kiềm trong cơ thể không
được duy trì, sẽ có những chất thải chứa acid dư thừa được hình thành. Đại tràng,
thận, hệ bạch huyết và da – các bộ phận có chức năng đào thải các chất độc ra khỏi
cơ thể – bây giờ cũng không thể loại bỏ các chất thải này bởi vì chúng đang quá tải
khi xử lý các chất độc hại từ acid dư thừa. Từ đó, cơ thể phải đối phó với lượng acid
dư thừa này bằng cách đẩy chúng vào trong các mô mỡ, nơi mà acid có thể bám vào
các tế bào mỡ. Điều đó là lý do không thể giảm cân khi cơ thể của bạn có quá nhiều acid.
Yếu xương: Xương trở nên yếu đi khi cơ thể rút lượng canxi dự trữ của xương
để trung hòa acid cho cơ thể . Khi cơ thể thừa acid, các khoáng chất quan trọng cho
các cơ quan và mô tế bào hoạt động, đặc biệt là canxi bị tàn phá. Lâu dần điều này
dẫn đến cấu trúc xương giòn, yếu.
Vấn đề răng miệng: Tương tự như xương, lượng canxi trong răng bị giảm đi
khi cơ thể thừa acid. Sức khỏe răng miệng sẽ đi xuống, tạo điều kiện cho vi khuẩn
miệng phát triển, dẫn đến sâu răng và một số vấn đề khác.
Thường xuyên mệt mỏi: môi trường lý tưởng cho các vi sinh vật phát triển đó
là môi trường acid. Các vi khuẩn, nấm, virut… xâm chiếm vào các cơ quan của tiêu
hóa, làm cho chúng ta thêm mệt mỏi, chán ăn. Điều này dẫn đến hệ miễn dịch và làm
cạn kiệt cơ thể, khiến cơ thể mệt mỏi thường xuyên.
Mất ngủ: Không đủ canxi trong cơ thể dẫn đến mất ngủ . Đây là một triệu
chứng điển hình khác khi cơ thể hấp thụ canxi có trong xương và sử dụng nó để trung hòa acid trong cơ thể.
Tích tụ chất nhầy: Sự sản xuất chất nhầy là cơ chế bảo vệ tự nhiên của cơ thể
chống lại sự tích tụ acid trong việc cố gắng để đẩy nó ra khỏi cơ thể thông qua đường
mũi. Nó cũng có thể do sự tích tụ acid trong chính đường mũi. Sự tích tụ dịch nhầy lOMoAR cPSD| 61301459
thường xuyên và sự tiếp xúc liên tục của phổi với dịch nhầy cuối cùng là dẫn đến ho,
thở khò khè, các vấn đề về xoang, các vấn đề về hô hấp và đau ngực.
Các vấn đề về da: Hàm lượng acid cũng có thể gây ra các rối loạn về da và
khiến da trở nên xấu đi. Mụn trứng cá và ban da xuất hiện thường xuyên vì cơ thể
đang cố gắng loại bỏ độc tố qua da.
Vì vậy, cơ thể sinh vật cần có những hệ đệm để điều chỉnh pH vì thức ăn hay
nước uống đưa vào cơ thể sẽ làm thay đổi pH rất nhiều.
Trong máu người có 3 hệ đệm quan trọng giúp duy trì pH của máu người là hệ đệm cacbonat H - - 2-
2CO3/(Na+)HCO3 ; (Na+)H2PO4 /(Na+)2HPO4 và các protein
trong huyết tương; hemoglobin/oxyhemoglobin. Trong huyết tương có 4 hệ đệm:
Na2CO3/NaHCO3; NaH2PO4/Na2HPO4; H- Protein/Na-Protein; acid hữu cơ và muối
natri của nó. Trong hồng cầu có 5 hệ đệm: Na2CO3/KHCO3; KH2PO4/K2HPO4;
HHbO2/KHbO2; HHb/KHb; ; acid hữu cơ và muối kali của nó trong đó hệ đệm
cacbonat là quan trọng nhất vì có pH gần bằng pH của máu người.
Trong máu người có pH ≈ 7,36. Giá trị này xấp xỉ hệ đệm cacbonat trong máu người.
pH của hệ đệm cacbonat trong máu người được tính: [ NaHCO3]
pH = pK H2CO3 + lg [ H2CO3] [ NaHCO Ở 37 C: pK H CO 2
3 =6,1. Tỷ lệ: [ H2CO3] = 1 nên pH = 6,1 + lg= 7,34 TỰ LƯỢNG GIÁ
1. Phát biểu định nghĩa, thành phần và phân loại dung dịch đệm, cho ví dụ?
2. Nêu định nghĩa và phân loại dung dịch, cho ví dụ?
3. Trình bày hiện tượng thẩm thấu. Viết và giải thích các đại lượng của biểu thứcVanhop?
4. Giải thích cơ chế hệ đệm acid – base, cho ví dụ?
5. Trình bày mối liên hệ giữa hằng số acid và hằng số base của một cặp acid – baseliên hợp?
6. Người ta điều chế 1 dung dịch đệm bằng cách hòa tan 0,02 mol acid
propionicvà 0,015 mol natri propionat trong nước để được 1 lít dung dịch đệm
A. a) Tính pH của dung dịch đệm A
b) Tính pH của dung dịch đệm thu được khi thêm vào 1 lít dung dịch A
0,005mol HCl; 0,01 mol NaOH. Cho Ka = 1,34.10-5
7. Độ điện li của ZnSO4 trong dung dịch ZnSO4 0,1M bằng 20%. Tính áp suất
thẩm thấu của dung dịch này ở 200C?
8. a) Tính pH của dung dịch sau khi trộn 50 ml dung dịch CH3COOH 0,01M với
450 ml dung dịch NaOH 0,1M. Biết Ka = 1,76.10-5
b) Tính pH của muối NH4Cl 0,1M biết hằng số base của NH3 là Kb =1,76.10- 5 lOMoAR cPSD| 61301459
9. a) Tính pH của dung dịch sau khi trộn 100 ml dung dịch NH3 0,05M với 400
ml dung dịch HCl 0,01M. Biết Kb = 1,76.10-5.
b) Tính pH của muối CH3COONa 0,2M biết hằng số acid của CH3COOH là Ka = 1,76.10-5
10. Tính pH của muối CH3COONH4 0,5M biết hằng số acid của acid axetic là Ka
= 1,76.10-5 và hằng số base của amoniac là Kb = 1,76.10-5.
11. Các hệ đệm nào có trong hồng cầu: 1) H2CO3/KHCO3 2) KH2PO4/K2HPO4 3) HHbO2/KHbO2
4) CH3COOH/ CH3COONa 5)HHb/KHb 6) NH3/ NH4Cl A: 3,4,5,6 B: 2,3,4,5 C:1,3,4,5 D: 1,2,3,5
12. Thuốc chữa đau dạ dày có thành phần NaHCO3. Tác dụng của NaHCO3 dùng
để chữa đau dạ dày là:
A: Thủy phân cho môi trường kiềm nhẹ để làm dịch tiêm truyền tĩnh mạch để trung hòa acid
B: Thủy phân cho môi trường kiềm nhẹ để tăng dự trữ kiềm ở huyết tương C:
Thủy phân cho môi trường kiềm nhẹ để trung hòa acid sinh ra quá nhiều trong dạ dày
D: Thủy phân cho môi trường kiềm nhẹ để tăng dự trữ kiềm ở dạ dày
13. Cho các loại dung dịch sau: 1) Dung dịch glucose 5% 2) Dung dịch natri clorid 0,9% 3) Dung dịch glucose 10% 4)
Dung dịch natri clorid 1,2% Các dung dịch đẳng trương là? A : 1,2 B : 3,4 C : 1,3 D : 2,4
14. Pepsin là một enzym phân giải protein có mặt trong ống tiêu hóa. Một mẫu
0,500g pepsin đã tinh chế trong 30,0ml dung dịch nước có áp suất thẩm thấu
là 8,92 mmHg ở 27,00C. Khối lượng phân tử của pepsin là: A: 35.000 B: 36.000 C: 34.500 D: 36.500
15.Cocain dùng để gây tê niêm mạc mắt, miệng, niệu đạo là một base yếu có công
thức là C17H21NO4 có hằng số base là Kb = 2,6.10-6. pH của dung dịch này ở
nồng độ 0,0025M có giá trị gần nhất là: A: 9,34 B: 8,67 C: 8,94 D: 9,91
16.Trong cơ thể luôn tồn tại dung dịch đệm. Dung dịch đệm được định nghĩa là dung
dịch có pH thay đổi không đáng kể khi
(1) Thêm một lượng nhỏ acid mạnh
(2) Thêm một lượng nhỏ base mạnh
(3) pha loãng có giới hạn dung dịch
(4) Thêm một lượng rất lớn dung môi
Hãy khoanh vào đáp án đúng khi định nghĩa về dung dịch đệm. A: (1),(2),(4) B: (2),(3),(4) C: (1),(2),(3) D: (1),(3),(4)
17.Thuốc chữa đau dạ dày có thành phần chính là NaHCO3.
Hãy chọn đáp án đúng giải thích tác dụng của NaHCO3 dùng để chữa đau dạ dày. lOMoAR cPSD| 61301459
A: Thủy phân cho môi trường kiềm nhẹ để làm dịch tiêm truyền tĩnh mạch để trung hòa acid
B: Thủy phân cho môi trường kiềm nhẹ để tăng dự trữ kiềm ở huyết tương C:
Thủy phân cho môi trường kiềm nhẹ để trung hòa acid sinh ra quá nhiều trong dạ dày
D: Thủy phân cho môi trường kiềm nhẹ để tăng dự trữ kiềm ở dạ dày 18.Cho các yếu tố sau : (1) Bản chất chất khí (2) Bản chất dung môi (3) Áp suất chất khí
(4) Sự có mặt của chất khí khác (5) Nhiệt độ chất khí
Tổ hợp các yếu tố mà độ tan của chất khí phụ thuộc là gì?: A: (1),(2),(3),(4)
B: (1),(2),(3),(5) C: (2),(3),(4),(5) D: (1),(3),(4),(5) 19.Cho các phát biểu sau:
(1) Muối tạo bởi acid mạnh và base yếu cho môi trường base
(2) Muối tạo bởi base mạnh và acid yếu cho môi trường acid
(3) Muối tạo bởi acid mạnh và base yếu cho môi trường acid(4) Muối tạo bởi
acid yếu và base yếu luôn cho môi trường trung tính Phát biểu nào là đúng ? A: (1) B: (2) C: (3) D: (4)
20.Ancol etylic hòa tan vô hạn trong nước.
Giải thích đúng về khả năng hòa tan trong nước của ancol etylic là gì?
A: Giữa ancol etylic và nước có liên kết hidro
B: Giữa các phân tử ancol etylic có liên kết hidro
C: Giữa các phân tử nước có liên kết hidro
D: Ancol etylic và nước trong phân tử đều có nhóm OH
21.Cho các đặc điểm của chất tan :
(1) Đi qua được mọi loại màng lọc khác nhau
(2) Nhìn thấy được qua kính hiển vi điện tử
(3) Khuyêch tán nhanh từ nơi này đến nơi khác
(4) Phát hiện bằng các phản ứng hóa học
Các đặc điểm nào là của chất tan trong dung dịch thật ?: A: (1),(2),(3) B: (1),(3),(4) C:(1),(2),(4) D :(2),(3),(4)
22.Tác dụng của phèn chua có công thức K2SO4.Al2(SO4)3.24H2O dùng làm trong nước
Phát biểu nào giải thích đúng về tác dụng của phèn chua :
A: Trong nước, Al2(SO4)3 bị thủy phân tạo thành hợp chất Al(OH)3 kết tủa
bông có tác dụng liên kết với các hạt cát thành hạt lớn hơn lắng xuống đáy
B: Khi hòa tan vào trong nước, Al2(SO4)3 kết hợp với K2SO4 tạo phức tinh
thể kéo các hạt cát thành hạt lớn hơn lắng xuống dưới đáy.
C: Hỗn hợp muối Al2(SO4)3 và K2SO4 trong nước kết hợp với nhau tạo thành
muối kép có tác dụng kéo các hạt cát thành hạt lớn hơn lắng xuống dưới đáy. lOMoAR cPSD| 61301459
D: Trong nước, K2SO4, Al2(SO4)3 bị thủy phân tạo thành hợp chất KOH,
Al(OH)3 kết tủa bông có tác dụng liên kết với các hạt cát thành hạt lớn hơn lắng xuống đáy.
23.Cho các hiện tượng sau:
(1) Dung dịch đường 20% tiếp xúc với dung dịch muối ăn 0,9% qua màng bán thấm
(2) Dung dịch muối ăn 0,9% trong màng tế bào và 1% ngoài màng tế bào
(3) Hai dung dịch đường G5 và G30 ở hai cốc riêng biệt (4) Dung dịch glucose
5% tiếp xúc với nước qua màng bán thấm Số trường hợp xảy ra hiện tượng thẩm thấu : A: 1 B: 2 C: 3 D: 4
24. Ka (CH3COOH) = 1,75.10-5; Ka (HNO2) = 4,0.10-4. Nếu hai acid có nồng độ
mol bằng nhau và ở cùng nhiệt độ, khi quá trình điện li ở trạng thái cân bằng,
cho các đánh giá dưới đây:
(1) [H+] của CH3COOH lớn hơn [H+] của HNO2
(2) [H+] của CH3COOH nhỏ hơn [H+] của HNO2
(3) pH của CH3COOH nhỏ hơn pH của HNO2 (4) Nồng độ ion acetat lớn hơn
nồng độ ion nitrit Đánh giá nào là đúng? A: (1) B: (2) C: (3) D: (4)
25.Có bốn dung dịch: natri clorua; ancol etylic, acid acetic , kali sunfat đều có nồng độ 0,1mol/l.
Khả năng dẫn điện của các dung dịch đó tăng dần theo thứ tự nào?
A: NaCl < C2H5OH < CH3COOH < K2SO4
B: C2H5OH < CH3COOH < NaCl < K2SO4
C: C2H5OH < CH3COOH < K2SO4 < NaCl
D: CH3COOH < NaCl < C2H5OH < K2SO4
26.Trong các phản ứng dưới đây:
(1) HCl + H2O → H3O+ + Cl(2)
Ca(HCO3)2 → CaCO3 + H2O + CO2 (3) NH + 3 + H2O ↔ NH4 + OH(4) CuSO4 + 5H2O → CuSO4.5H2O
Phản ứng nào nước đóng vai trò là một acid theo Brosted: A: (1) B: (2) C: (3) D: (4)
27.Dung dịch NaCl 0,15M (có độ điện li α = 100%) tương đương với nồng độ 0,9% là dung dịch rửa mắt.
Áp suất thẩm thấu của dịch mắt người ở 370C là bao nhiêu? A: 7,626 atm B: 3,813atm C: 6,578atm D: 4,567atm

