










Preview text:
Trường THPT Trưng Vương Tổ Hóa
ÔN TẬP GIỮA HỌC KÌ II
A. CÂU TRẮC NGHIỆM NHIỀU PHƯƠNG ÁN LỰA CHỌN
1. Khi pin Galvani Zn-Cu hoạt động thì nồng độ
A. Cu2+ giảm, Zn2+ tăng.
B. Cu2+ giảm, Zn2+giảm.
C. Cu2+ tăng, Zn2+ tăng.
D. Cu2+ tăng, Zn2+ giảm.
2. Phát biểu nào sau đây là đúng khi nói về pin Galvani?
A. Electron di chuyển từ cathode sang anode.
B. Cathode là điện cực âm.
C. Ở điện cực âm xảy ra quá trình oxi hoá.
D. Anode là điện cực dương.
3. Trong quá trình hoạt động của pin điện Zn - Cu, dòng electron di chuyển từ
A. cực kẽm sang cực đồng.
B. cực bên phải sang cực bên trái.
C. cathode sang anode.
D. cực dương sang cực âm.
4. Cho pin điện hóa Fe-Cu. Biết 0 E 0 E 2 = -0,44 V và
= 0,34 V. Sức điện động chuẩn của Fe /Fe 2 Cu /Cu pin điện hóa Fe-Cu là A. 1,66 V. B. 0,1 V. C. 0,78 V. D. 0,92 V. 5. Cho 0 E = 0,59 V và 0 E pin (Ni-Cu) 2
= 0,34 V. Thế điện cực chuẩn của cặp oxi hoá - khử Ni2+/Ni Cu /Cu là A. 0,34 V. B. 0,35 V. C. -0,34 V. D. -0,25 V.
6. Nhận định nào sau đây về pin nhiên liệu là không đúng?
A. Chất phản ứng của pin nhiên liệu phải được cung cấp liên tục từ nguồn bên ngoài.
B. Pin nhiên liệu tạo ra điện năng nhờ năng lượng mặt trời.
C. Pin nhiên liệu biến đổi trực tiếp năng lượng hóa học thành điện năng.
D. Một trong những hạn chế của pin nhiên liệu là sự lưu trữ nhiên liệu.
7. Trong pin nhiên liệu hydrogen, H2 có vai trò tương tự như kim loại mạnh hơn trong pin Galvani.
Phản ứng nào sau đây diễn ra ở điện cực dương khi pin nhiên liệu hydrogen hoạt động? A. 2H2 + O2 → 2H2O.
C. O2 + 4H+ + 4e → 2H2O. B. H2 → 2H+ + 2e. D. 2H+ + 2e → H2.
8. Nhận xét nào sau đây đúng về quá trình điện phân ở hai điện cực?
A. Cation nhường electron ở cathode.
B. Anion nhận electron ở anode.
C. Sự oxi hóa xảy ra ở anode.
D. Sự oxi hóa xảy ra ở cathode.
9. Trong công nghiệp, việc tinh chế đồng từ đồng thô được thực hiện bằng phương pháp điện phân
dung dịch với anode làm bằng A. graphite. B. platinum. C. thép. D. đồng thô.
10. Khi điện phân dung dịch gồm Cu(NO3)2 0,1 M và AgNO3 0,1 M, quá trình khử đầu tiên xảy ra ở cathode là 1 Trường THPT Trưng Vương Tổ Hóa A. Ag+ + 1e → Ag. B. Cu2+ + 2e → Cu. С. 2H O + 2e → Н 2 2 + 2OH-. D. 2H+ + 2e → H2.
11. Việc duy trì điện áp thấp (~ 5 V) trong quá trình điện phân nóng chảy Al2O3 trong 3NaF.AlF3
nhằm ngăn cản quá trình nào sau đây xảy ra ở cathode? A. Al3+ + 3e → Al. B. Na+ + 1e → Na. C. F2 + 2e → 2F-. D. O2 + 4e → 2O2-.
12. Xét quá trình điện phân dung dịch NaCl 20% bằng dòng điện một chiều (với điện cực trơ, có
màng ngăn xốp). Quá trình khử xảy ra ở cathode là A. 2H O + 2e → H 2 2 + 2OH-. B. Cl2 + 2e → 2Cl-. C. 2Cl- → Cl O → 2H+ 2 + 2e. D. H2 + 1 O 2 2 + 2e.
13. Khi điện phân dung dịch (có màng ngăn) gồm NaCl, HCl, CuCl2 và phenolphthalein. Màu của
dung dịch biến đổi như thế nào khi điện phân đến hết NaCl?
A. Đỏ → không màu → xanh.
B. Xanh → không màu → đỏ.
C. Xanh → không màu → hồng.
D. Hồng → không màu → xanh.
14. Điện phân dung dịch CuSO4 với điện cực trơ. Sau một thời gian, ở cathode thu được 1,28 g Cu
và ở anode có V mL khi O2 (25 °C, 1 bar) bay ra. Giá trị của V là A. 495,8. B. 124,0. C. 247,9. D. 743,7.
15. Điện phân 500 mL dung dịch CuSO4 0,2 M (điện cực trơ) cho đến khi ở cathode thu được 3,2
g kim loại thì thể tích khí (đkc) thu được ở anode là A. 1,24 lít. B. 2,48 lít. C. 0,62 lít. D. 3,72 lít.
16. Người ta có thể sử dụng kim loại làm trang sức nhờ vào tính chất nào của chúng? A. Tính dẻo.
B. Tính dẫn điện. C. Ánh kim.
D. Tính dẫn nhiệt.
17. Các tính chất vật lí chung của kim loại gây nên chủ yếu bởi
A. các electron tự do trong mạng tinh thể.
B. các ion kim loại.
C. các electron hóa trị.
D. các kim loại đều là chất rắn.
18. Kim loại X được sử dụng trong nhiệt kế, áp kế và một số thiết bị khác. Ở điều kiện thường, X
là chất lỏng. Kim loại X là A. W. B. Cr. C. Hg. D. Pb.
19. Dây điện cao thế thường được làm bằng nhôm là do nhôm
A. là kim loại dẫn điện tốt và nhẹ.
B. là kim loại dẫn điện tốt nhất.
C. có giá thành rẻ.
D. có tính trơ về mặt hóa học.
20. Khi lựa chọn kim loại để làm vỏ hộp kim loại nhẹ chứa nước ngọt hoặc bia, tính chất nào sau
đây thường không được xét đến? A. Tính độc.
B. Khối lượng riêng.
C. Tính đễ dát mỏng.
D. Nhiệt độ nóng chảy.
21. Liên kết kim loại là liên kết được hình thành giữa
A. các cation kim loại và các electron hóa trị tự do trong tinh thể kim loại.
B. các cation và các anion trong tinh thể kim loại. 2 Trường THPT Trưng Vương Tổ Hóa
C. các electron hóa trị trong tinh thể kim loại.
D. các nguyên tử trong tinh thể kim loại.
22. Những tính chất vật lí chung của kim loại gây nên chủ yếu bởi
A. các electron tự do trong tinh thể kim loại.
B. kiểu cấu tạo mạng tinh thể của kim loại.
C. khối lượng riêng của kim loại.
D. tinh chất của kim loại.
23. Ứng dụng nào dưới đây là ứng dụng phổ biến của đồng?
A. Làm những bộ phận cấy ghép vào cơ thể người.
B. Chế tạo thân máy bay siêu thanh.
C. Làm đồ trang sức.
D. Làm lỗi dây dẫn điện.
24. Trong định nghĩa về liên kết kim loại : "Liên kết kim loại là liên kết hình thành do lực hút tĩnh
điện giữa các electron ...(1)... với các ion ...(2)... kim loại ở các nút mạng. Các từ cần điền vào vị
trí (1), (2) lần lượt là
A. ngoài cùng, dương.
B. hóa trị, lưỡng cực. C. tự do, dương. D. hóa trị, âm.
25. Bạc và vàng thường được dùng để chế tạo thành đồ trang sức chủ yếu là do chúng
A. là các kim loại quý và hiếm.
B. có ánh kim, có tính dẻo và hầu như không bị oxi hóa bởi các chất trong môi trường.
C. là kim loại có ánh kim, có tính dẻo và nhẹ do có khối lượng riêng thấp.
D. dễ dát mỏng, kéo sợi, gia công và chế tác thành đồ trang sức với nhiều hình dạng theo mong muốn.
26. Kim loại có khả năng dẫn điện vì
A. chúng có cầu tạo tinh thể.
B. trong mạng tinh thể kim loại có các cation kim loại.
C. trong nạng tinh thể kim loại, các anion chuyển động tự do.
D. trong tinh thể kim loại, các electron liên kết yếu với hạt nhân, chuyển động tự do trong toàn bộ mạng tinh thể.
27. Cho các phát biểu sau về tinh thể kim loại M:
(1) Trong tinh thể kim loại M có các cation Mn+ và các electron hóa trị tự do.
(2) Trong tinh thể kim loại M có các electron hóa trị tự do chuyển động.
(3) Các cation Mn+ chuyển động tự do trong mạng tinh thể kim loại.
(4) Lực hút giữa cation Mn+ và electron hóa trị tự do trong tinh thể kim loại M phụ thuộc vào độ
âm điện của kim loại M.
(5) Tinh thể kim loại M trung hòa về điện.
(6) Trong tinh thể kim loại M, các cation Mn+ và electron hóa trị tự do được phân bố theo trật tự nhất định. Số phát biểu đúng là A. 2. B. 3. C. 4. D. 1.
28. Cho các phát biểu sau đây về vị trí và cấu tạo của kim loại: 3 Trường THPT Trưng Vương Tổ Hóa
(1) Hầu hết các kim loại chỉ có từ 1 electron đến 3 electron lớp ngoài cùng.
(2) Tất các các nguyên tố phân nhóm B (phân nhóm phụ) đều là kim loại.
(3) Ở trạng thái rắn, đơn chất kim loại có cấu tạo tinh thể.
(4) Các kim loại đều có bán kính nhỏ hơn các phi kim thuộc cùng một chu kì.
(5) Liên kết kim loại là liên kết được hình thành giữa các nguyên tử và ion dương kim loại trong
mạng tinh thể do sự tham gia của các electron tự do.
Những phát biểu đúng là
A. (1), (2), (3), (5). C. (1), (2), (3). B. (1), (2), (3), (4). D. (1), (3), (5).
29. Kim loại nào sau đây được điều chế bằng phương pháp điện phân nóng chảy? A. Fe. B. Na. C. Cu. D. Ag.
30. Trong công nghiệp, kim loại nào sau đây được điều chế bằng phương pháp nhiệt luyện? A. Mg. B. Fe. C. Na. D. Al.
31. Kim loại nào sau đây có thể được điều chế bằng phương pháp thủy luyện? A. Au. B. Mg. C. Ca. D. Na.
32. Trong vỏ Trái Đất, những kim loại nào sau đây tồn tại chủ yếu dưới dạng đơn chất? A. Ag, Au. B. Zn, Fe. C. Mg, Al. D. Na, Ba.
33. So với nhiệt độ cần nung chảy phế liệu thép thì nhiệt độ cần nung chảy phế liệu nhôm A. cao hơn. B. thấp hơn. C. xấp xỉ bằng. D. cao hơn nhiều.
34. Trong quá trình tái chế kim loại, ở công đoạn phân loại phế liệu, có thể dùng nam châm lớn để tách riêng phế liệu A. nhôm. B. thép. C. đồng. D. kẽm.
35. Phương pháp nào sau đây có thể tách được sodium kim loại?
A. Nung nóng mạnh quặng sodium trong không khí.
B. Nung nóng quặng sodium với carbon.
C. Điện phân nước muối.
D. Điện phân muối sodium choride nóng chảy.
36. Cho: (1) nước ngầm; (2) nước biển; (3) đất đá; (4) cây xanh có hoa. Trong tự nhiên, nguyên tố
kim loại có thể được tìm thấy ở đâu? A. (1), (2) và (3). B. (2) và (3). C. (1) và (3). D. (1), (2), (3), (4).
37. Nguyên tắc tách kim loại ra khỏi hợp chất của chúng là
A. khử ion kim loại trong hợp chất thành nguyên tử.
B. oxi hóa ion kim loại trong hợp chất thành nguyên tử.
C. hòa tan các khoáng vật có trong quặng để thu được kim loại.
D. đựa trên tính chất của kim loại như từ tính, khối lượng riêng lớn để tách chúng ra khỏi quặng.
38. Với quá trình tách sodium bằng phương pháp điện phân sodium chloride nóng chảy, phát biểu nào sau đây là đúng?
A. Tại anode xảy ra quá trình khử ion Na+.
B. Tại cathode xảy ra quá trình khử ion Cl-.
C. Tại cathode xảy ra quá trình khử ion Na+.
D. Tại anode xảy ra quá trình khử ion Cl-. 4 Trường THPT Trưng Vương Tổ Hóa
39. Cho các kim loại sau: K, Ba, Cu và Ag. Số kim loại có thể được điều chế bằng phương pháp
điện phân dung dịch (với điện cực trơ) là A. 1. B. 2. C. 3. D. 4.
40. Trong công nghiệp, Mg có thể được điều chế bằng cách nào dưới đây?
A. Điện phân nóng chảy MgCl2.
B. Cho kim loại Zn vào dung dịch MgCl2.
C. Cho kim loại Na vào dung dịch Mg(NO3)2. D. Điện phân dung dịch MgSO4.
41. Cho luồng khí CO dư qua hỗn hợp các oxide CuO, Fe2O3, Al2O3, MgO nung nóng ở nhiệt độ
cao. Sau phản ứng, hỗn hợp chất rắn thu được gồm A. Cu, Fe, Al, Mg.
B. Cu, FeO, Al2O3, MgO.
C. Cu, Fe, Al2O3, MgO. D. Cu, Fe, Al, MgO.
42. Xỉ xuất hiện trong quá trình tách kim loại, luyện kim và tinh luyện để tái chế kim loại. Xỉ là
hỗn hợp nhiều chất, hỗn hợp này thường
A. có khối lượng riêng nhỏ hơn so với khối lượng riêng của kim loại cần tách hoặc cần tái chế.
B. dễ chảy lỏng. C. dễ bay hơi.
D. có nhiều độc tính nên cần phải được chôn lấp sau khi được tháo ra khỏi lò.
43. Cho ba kim loại được tách từ quặng của chúng theo các cách tương ứng sau. Kim loại
Phương pháp tách thông dụng X Điện phân Y
Nhiệt phân, nung nóng trực tiếp Z Nung nóng với carbon
Khả năng hoạt động hóa học của các kim loại giàm dẫn theo thứ tự nào sau đây? A. X, Z, Y. B. Y, Z, X. C. X, Y, Z. D. Z, Y, X.
44. Để khử hoàn toàn một lượng oxide kim loại thành kim loại cần vừa đủ V lít khí H2. Hòa tan
lượng kim loại tạo thành bằng H2SO4 loãng, dư thu được V lít H2 (các khí đo cùng điều kiện). Oxide kim loại đó là A. MgO. B. Fe2O3. C. FeO. D. CuO.
45. Tiến hành các thí nghiệm sau:
(1) Cho Zn vào dung dịch AgNO3.
(2) Cho Fe vào dung dịch Fe2(SO4)3.
(3) Cho Na vào dung dịch CuSO4.
(4) Dẫn khí CO (dư) qua ống nghiệm có bột CuO, nung nóng.
Các thí nghiệm tạo thành đơn chất kim loại sau phản ứng là A. (3) và (4). B. (1) và (2). C. (2) và (3). D. (1) và (4).
46. Cho các phát biểu về tách kim loại:
(1) Đồng có thể được tách từ copper(II) oxide bằng cách nung nóng.
(2) Trong phương pháp điện phân nóng chảy aluminium oxide, có thể thu được nhôm nóng chảy
ở điện cực âm của bình điện phân. 5 Trường THPT Trưng Vương Tổ Hóa
(3) Kẽm có thể được tách từ zin oxide bằng cách nung nóng zinc oxide với carbon. Các phát biểu đúng là A. (1) và (2). B. (1) và (3). C. (2) và (3). D. (1), (2) và (3).
47. Cho khí CO (dư) đi qua ống sứ nung nóng đựng hỗn hợp X gồm Al2O3, MgO, Fe3O4 và CuO,
thu được chất rắn Y. Cho Y vào dung dịch NaOH dư, khuấy kĩ, thấy còn lại phần không tan Z. Giả
sử các phản ứng xảy ra hoàn toàn. Phần không tan Z gồm A. MgO, Fe, Cu. B. Mg, Fe, Cu. C. MgO, Fe3O4, Cu. D. Mg, Al, Fe, Cu.
48. Cho 14 g bột Fe vào 400 mL dung dịch X gồm AgNO3 0,5 M và Cu(NO3)2 x M. Khuấy nhẹ
cho tới khi phản ứng kết thúc thu được dung dịch Y và 30,4 g chất rắn Z. Giá trị của x là A. 0,15. B. 0,125. C. 0,2. D. 0,1.
49. Thành phần quan trọng của inox là
A. sắt, chromium, carbon. B. đồng, kẽm. C. nhôm, magnesium.
D. sắt, magnesium, carbon.
50. Chất hay hỗn hợp chất nào sau đây không phải là hợp kim? A. Thép. B. Đồng. C. Đồng thau. D. Đồng thiếc.
51. Thêm chromium vào thép thì tính chất nào sau đây được tăng cường? A. Chống ăn mòn.
B. Tính dẫn điện. C. Tính chất từ.
D. Tính dễ kéo sợi.
52. Duralumin là hợp kim của nhôm có thành phần chính là A. nhôm và đồng.
B. nhôm và thuỷ ngân. C. nhôm và carbon. D. nhôm và sắt.
53. Gang là vật liệu kim loại có thành phần chính là
A. nhôm và magnesium. B. sắt và carbon. C. đồng và kẽm.
D. đồng và thiếc.
54. Hợp kim nào sau đây được sử dụng để làm cấu trúc thân vỏ máy bay? A. Duralumin.
B. Đồng thau (Brass).
C. Đồng thiếc (Bronze). D. Manganin.
55. "Thép 304" là một loại thép không gỉ được dùng phổ biến trong đời sống. Các kim loại chủ
yếu tạo nên loại thớp này bao gồm: A. Fe, C, Cr. B. Fe, Cu, Cr. C. Fe, Cr, Ni. D. Fe, C, Cr, Ni.
56. Hiện tượng nào sau đây không phải là hiện tượng ăn mòn kim loại?
A. Ống thép bị gỉ sắt màu nâu đỏ.
B. Vòng bạc bị xỉn màu.
C. Công trình bằng đá bị ăn mòn bởi mưa acid. D. Chuông đồng bị gỉ đồng màu xanh.
57. Để bảo vệ vỏ tàu biển làm bằng thép người ta thường gắn vào vỏ tàu (phần ngâm dưới nước)
những tấm kim loại nào sau đây? A. Sn. B. Pb. C. Zn. D. Cu.
58. Ngâm các mẫu sau vào dung dịch acid rồi để ngoài không khí, mẫu nào không xảy ra ăn mòn điện hóa? A. Miếng gang. B. Lá đồng. C. Miếng tôn. D. Đinh sắt.
59. Điều kiện nào sau đây là điều kiện cần thiết để xảy ra hiện tượng gỉ sắt? 6 Trường THPT Trưng Vương Tổ Hóa
A. Môi trường có oxygen và nước.
B. Môi trường có oxygen và nhiệt độ cao.
C. Môi trường có nước và nhiệt độ cao.
D. Môi trường có oxygen, nước và nhiệt độ cao.
60. Lần lượt nối thanh Zn với mỗi kim loại sau đây và cho vào dung dịch HCl. Quá trình ăn mòn
thanh Zn xảy ra nhanh nhất khi nối với A. Mg. B. Pb. C. Ag. D. Cu.
61. “Ăn mòn hóa học là quá trình …(1)…, trong đó các electron của …(2) ... chuyển trực tiếp đến
các chất trong môi trường”. Nôi dung phù hợp trong các ô trống (1), (2) lần lượt là
A. oxi hóa - khử, kim loại. B. khử, kim loại.
C. oxi hoá, ion kim loại.
D. oxi hóa - khử, ion kim loại.
62. Đồng thau là hợp kim chứa khoảng 70% đồng và 30% kẽm. Ứng dụng nào sau đây không phải
là ứng dụng của đồng thau?
A. Làm thiết bị dẫn điện.
B. Làm dụng cụ nấu ăn.
C. Làm thân vỏ máy bay. D. Làm nhạc cụ.
63. Dural là một loại hợp kim quan trọng của nhôm, có đặc điểm là nhẹ, cứng, bền cơ học phù hợp
với các ứng dụng nào sau đây?
(1) Chế tạo cánh máy bay;
(2) Áo giáp, khiên bảo vệ;
(3) Làm ống dẫn đầu, mỏ neo. A. (1), (2). B. (1). C. (1), (2), (3). D. (1), (3).
64. Khi một vật bằng sắt tây (sắt tráng thiếc) bị xây sát sâu tới lớp sắt bên trong để lâu trong không
khí ẩm sẽ xảy ra quá trình nào sau đây?
A. Sn bị ăn mòn điện hoá.
B. Fe bị ăn mòn điện hóa.
C. Fe bị ăn mòn hóa học.
D. Sn bị ăn mòn hóa học.
65. Để bảo vệ khung xe đạp khỏi bị ăn mòn có thể dùng cách nào sau đây?
A. Ngâm trong dung dịch acid
B. Rọc dây đồng quanh khung xe.
C. Phủ kín bề mặt bằng lớp sơn.
D. Để trong không khí ẩm.
66. Cho một thanh Fe tiếp xúc với một thanh Cu, sau đó nhúng vào dung dịch HCl, hiện tượng sẽ quan sát được là
A. thanh Fe tan và bọt khí chi thoát ra từ thanh Cu.
B. cả 2 thanh tan đồng thời và khí thoát ra từ 2 thanh.
C. thanh Fe tan trước và bọt khí thoát ra trên thanh Fe.
D. thanh Fe tan và bọt khí thoát ra từ cả thanh Fe và thanh Cu.
67. Cho 4 dung dịch riêng biệt: (1) HCl, (2) CuCl2, (3) FeCl3, (4) hỗn hợp HCl, CuCl2. Nhúng một
thanh sắt nguyên chất vào mỗi dung dịch nếu trên. Số trường hợp xuất hiện ăn mòn điện hóa là A. 0. В. 1. C. 2. D. 3.
68. Cho các cặp kim loại nguyên chất tiếp xúc trực tiếp với nhau: Fe và Pb; Fe và Zn; Fe và Sn; Fe
và Ni. Khi nhung các cặp kim loại trên vào dung dịch acid, số cặp kim loại trong đó Fe bị phá huỷ trước là 7 Trường THPT Trưng Vương Tổ Hóa A. 1. B. 3. C. 2. D. 4.
69. Để lợp nhà, các tấm tôn (thép mỏng mạ kẽm) được gắn với nhau bởi các đinh thép. Theo thời
gian, các tấm tôn bị ăn mòn. Những nhận định nào sau đây là đúng?
(1) Vị trí đóng đinh thép đễ xảy ra ăn mòn hơn các vị trí khác.
(2) Tấm tôn bị ăn mòn từ trong ra ngoài do thép bị ăn mòn trước kẽm.
(3) Sắt trong tấm tôn không bị ăn mòn theo thời gian.
(4) Lớp tráng kẽm bị ăn mòn trước. A. (1), (2). B. (1), (4). C. (2), (3). D. (1), (3), (4).
70. Thực hiện các thí nghiệm sau:
(1) Ngâm lá đồng trong dung dịch AgNO3.
(2) Ngâm lá kẽm trong dung dịch HCl loãng.
(4) Ngâm lá sắt được cuộn dây đồng trong dung dịch HCl.
(5) Đặt một vật làm bằng gang ngoài không khí ẩm trong nhiều ngày.
(6) Ngâm một miếng đồng vào dung dịch Fe2(SO4)3.
Số thí nghiệm xảy ra ăn mòn điện hóa là A. 1. B. 2. С. 3. D. 4.
B. CÂU TRẮC NGHIỆM ĐÚNG SAI
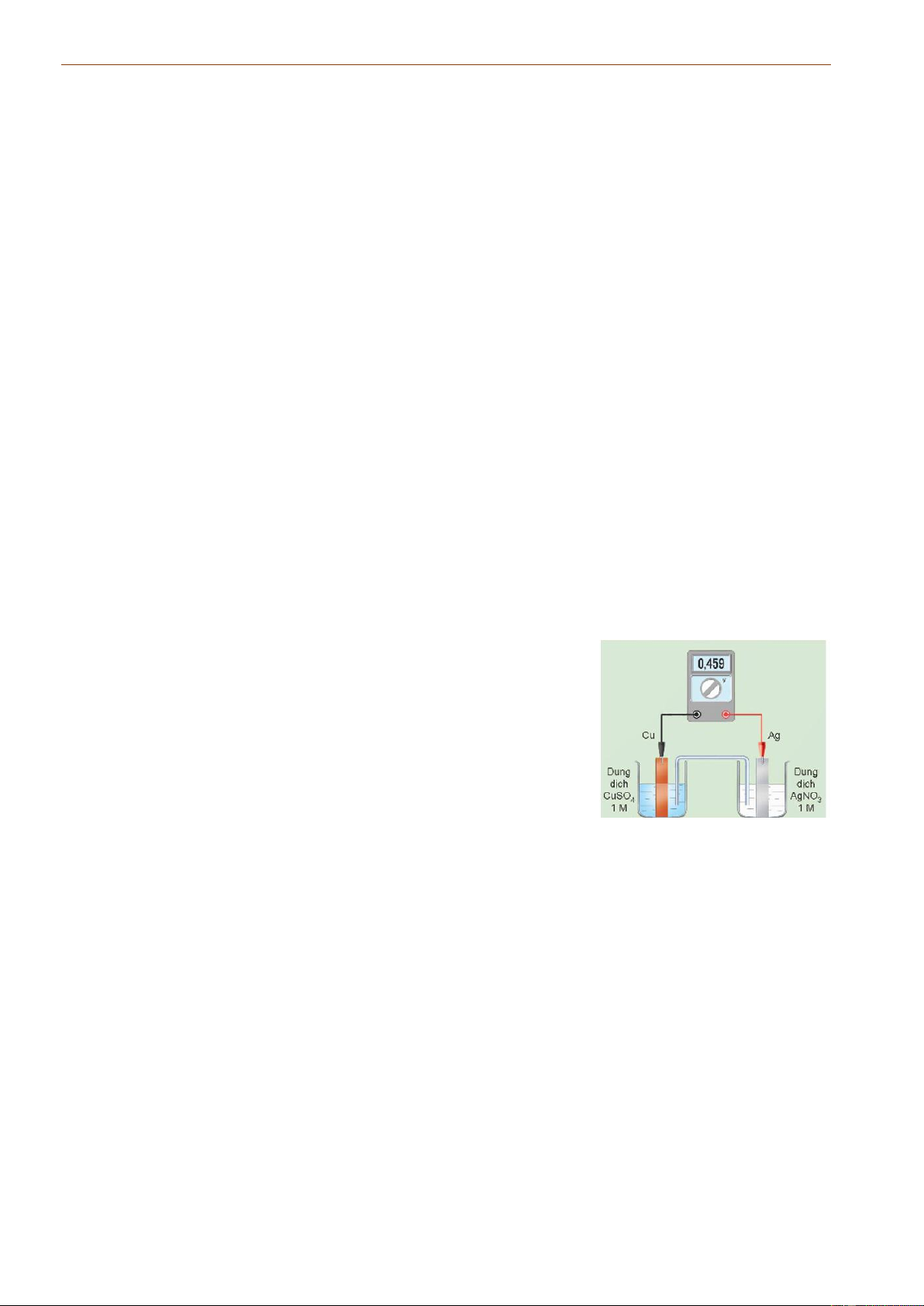
71. Xét quá trình hoạt động của một pin điện hóa Cu - Ag, được thiết lập ở các điều kiện
như hình vẽ bên. Cho thế điện cực chuẩn của các cặp Cu2+/Cu và
Ag+/Ag lần lượt là +0,340 V và +0,799 V. Hãy chọn đúng hoặc sai cho mỗi ý sau.
a) Giá trị sức điện động chuẩn của pin điện hóa trên là 0,459 V.
b) Ở anode xảy ra quá trình oxi hóa Cu.
c) Điện cực Cu tăng khổi lượng, điện cực Ag giảm khối lượng.
d) Phản ứng hóa học xảy ra trong pin: Cu + 2Ag+→ Cu2+ + 2Ag.
72. Xét pin Galvani hoạt động với phương trình tương ứng:
Zn(s) + Cu2+(aq) → Cu(s) + Zn2+(aq). Những phương án nào sau đây là đúng?
a) Điện cực đồng giảm khổi lượng và điện cực đồng là cực âm.
b) Điện cực đồng tăng khối lượng và điện cực đồng là cực dương.
c) Điện cực kẽm giảm khối lượng và điện cực kẽm là cực âm.
d) Điện cực kẽm tăng khổi lượng và điện cực kẽm lả cực dương.
73. Những phát biểu nào sau đây về pin nhiên liệu, hãy chọn đúng hoặc sai cho mỗi ý sau.
a) Cho hiệu suất chuyển hóa điện năng cao.
b) Biến đổi trực tiếp hóa năng thành điện năng nhờ quá trình oxi hóa trực tiếp nhiên liệu.
c) Gây ô nhiễm môi trường khi hoạt động.
d) Hoạt động liên tục không nghỉ nếu nhiên liệu được cung cấp liên tục. 8 Trường THPT Trưng Vương Tổ Hóa
74. Một pin điện hóa có điện cực kẽm nhúng trong dung dịch ZnSO và điệ 4 n cực đồng nhúng trong
dung dịch CuSO4. Em hãy cho biết các phát biểu sau đúng hay sai về biến thiên khối lượng của
điện cực sau một thời gian pin đó phóng điện.
a) Cả hai điện cực kẽm và đồng đều giảm.
b) Điện cực kẽm tăng còn khối lượng điện cực đồng giảm.
c) Điện cực kẽm giăm còn khối lượng điện cực đồng tăng.
d) Cả hai điện cực kẽm và đồng đều tăng.
75. Điện phân dung dịch NaCl bão hòa (với điện cực trơ, màng ngăn xốp) đến khi nồng độ NaCl
giảm đi một nửa thì dừng điện phân. Hãy chọn đúng hoặc sai cho mỗi ý a, b, c, d
a) Dung dịch sau điện phân làm phenolphthalein chuyển màu hồng.
b) Ở cathode chi xảy ra quá trình khử ion Na+.
c) Số mol khí Cl2 thoát ra ở anode bằng số mol H2 thoát ra ở cathode.
d) Thứ tự điện phân ở anode là H2O, Cl-.
76. Mỗi phát biểu sau đây là đúng hay sai?
a) Kim loại đẻo là nhờ lực hút tĩnh điện giữa các cation kim loại và các electron hóa trị tự do.
b) Ở điều kiện thường, thủy ngân không có cấu trúc tinh thể nên không dẫn điện.
c) Nhôm là kim loại vừa dẫn điện tốt vừa dẫn nhiệt tốt.
d) Kim loại có vẻ sáng lấp lánh là do các cation trong tinh thể phân xạ phần lớn các tia sáng nhìn thấy được.
77. Mỗi phát biểu sau đây là đúng hay sai?
a) Chromium thường được mạ bên ngoài một số đồ vật là đo kim loại này cứng và có khả năng chống mài mòn tốt.
b) Nhôm được sử dụng nhiều trong sản xuất máy bay là do nhôm có ánh kim phản xạ các tia cực tím từ mặt trởi.
c) Bạc được dùng phổ biến làm dây dẫn điện vì là kim loại có độ dẫn điện tốt nhất.
d) Bạc được dùng để tráng gương là do bạc là kim loại dẫn nhiệt rất tốt.
78. Thả một đinh sắt nặng m1 gam đã được đánh sạch bề mặt vào cốc chứa dụng dịch copper(II)
sulfate màu xanh. Sau một thời gian thấy toàn bộ lượng đồng sinh ra đã bám vào "đinh sắt" (thực
chất là phần đinh sắt chưa phản ứng). Lấy "đinh sắt" ra khỏi cốc dung dịch, sây khô, đem cân được
m2 gam. Mỗi phát biểu sau đây là đúng hay sai?
a) Phản ứng diễn ra là: 2Fe(s) + 3Cu2+(aq) → 2Fe3+(ag) + 3Cu(s)
b) Màu xanh của dung dịch copper (II) sulfate nhạt dần.
c) So sánh, thu được kết quả m2 < m1.
d) Nếu thay đinh sắt ban đầu bằng thanh kẽm thì màu xanh của dung dịch không thay đổi.
79. Cho 3 thí nghiệm sau:
- Thí nghiệm 1: Cho một mẩu sodium vào nước đã thêm vài giọt dung dịch phenolphthalein.
- Thí nghiệm 2: Cho một mẫu kẽm vào dung dịch hydrochloric acid loãng.
- Thí nghiệm 3: Cho một mẫu đồng vào dung dịch sulfuric acid đặc. 9 Trường THPT Trưng Vương Tổ Hóa
Mỗi phát biểu đưới đây là đúng hay sai?
a) Các kim loại bị oxi hoá trong cả ba thí nghiệm trên.
b) Cả ba dung dịch đều đổi màu trong quá trình phản ứng.
c) Thí nghiệm 3 có sinh ra khí Z. Tỉ khối hơi của khí Z so với khí X thoát ra ở thí nghiệm 1 là 32.
d) Tổng hệ số tối giản của các chất trong phương trình hóa học ở thí nghiệm 3 là 6.
80. Cho 4,958 lít khí CO (ở đkc) từ từ đi qua ống sứ nung nóng dựng 8 g một oxide sắt đến khi
phản ứng xảy ra hoàn toàn. Khí thu được sau phản ứng có tỉ khối so với H2 bằng 20. Hãy chọn
đúng hoặc sai cho mỗi ý a, b, c, d
a) Công thức của oxide sắt là Fe2O3.
b) Phần trăm thể tích CO2 trong hỗn hợp khí sau phản ứng là 75%.
c) Hỗn hợp khí sau phản ứng có thể tích 4,958 lít (ở đkc).
d) Khối lượng chất rắn thu được là 5,6 g.
81. Một nhóm học sinh tìm hiểu quá trình thu hồi kim loại đồng (copper) bằng phương pháp điện
phân từ một đồng xu làm bằng hợp kim Cu – Zn chứa khoảng 95% đồng về khối lượng. Giả thuyết
của nhóm học sinh là “khi điện phân, chỉ có tạp chất trong đồng xu tan hết vào trong dung dịch,
còn lại sẽ là đồng tinh khiết”. Để kiểm tra giả thuyết này, nhóm học sinh đã thực hiện thí nghiệm như sau:
- Cân để xác định khối lượng ban đầu của đồng xu (2,23 gam) và thanh đồng tinh khiết (2,55 gam).
- Nối đồng xu với một điện cực và thanh đồng tinh khiết với điện cực còn lại của nguồn điện một
chiều, rồi nhúng vào bình điện phân chứa dung dịch copper(II) sulfate.
- Điện phân ở hiệu điện thế phù hợp.
- Sau một thời gian điện phân, làm khô, rồi cân để xác định lại khối lượng của đồng xu và thanh
đồng tinh khiết, thấy khối lượng đồng xu là 1,94 g và khối lượng thanh đồng là m₁ gam.
a) Trong thí nghiệm trên, đồng xu được nối với cực dương, thanh đồng tinh khiết được nối với
cực âm của nguồn điện.
b) Giá trị của m₁ lớn hơn 2,55.
c) Ở cực dương xảy ra quá trình khử.
d) Do khối lượng của đồng xu giảm, nên giả thuyết ban đầu của nhóm học sinh là đúng.
82. Hãy chọn đúng hoặc sai cho mỗi ý a, b, c, d
a) Đồng là kim loại dẫn điện tốt nhất nên thường được dùng làm dây dẫn điện.
b) Duralumin thường được dùng để chế tạo vỏ máy bay.
c) Nhôm thường được điều chế bằng phương pháp thủy luyện.
d) Có thể bảo vệ sắt thép khỏi bị ăn mòn bằng cách gắn thêm magnesium.
83. Kim loại magnesium có khối lượng riêng là 1,74 g cm-3. Kim loại này phản ứng chậm với
nước ở nhiệt độ thường tạo ra anion OH- và khí H2, phản ứng nhanh với sulfuric acid loãng và làm
nhạt màu dung dịch copper(Il) sulfate. Mỗi phát biểu sau đây là đúng hay sai?
a) Những hợp kim mà magnesium đóng vai trò kim loại cơ bản là những hợp kim nặng 10 Trường THPT Trưng Vương Tổ Hóa
b) Giá trị thế điện cực chuẩn của Mg2+/Mg lớn hơn 0 V.
c) Trong môi trường trung tính, có: 2H 0 2O + 2e → H2 + 2OH- với E = -0,413 V. 2H O/2OH H 2 2
d) Giá trị thế điện cực chuẩn của Cu2+/Cu lớn hơn giá trị thế điện cực chuẩn của Mg2+/Mg.
84. Cho lá kim loại kẽm (zinc) và ống nghiệm chứa lượng dư dung dịch copper (II) sulfate màu xanh, thấy:
- Màu xanh của dung dịch nhạt dần.
- Có hiện tượng sủi bọt khí quanh lá kim loại.
Mỗi phát biểu sau đây là đúng hay sai?
a) Tính oxi hóa của Zn2+ mạnh hơn tính oxi hóa của Cu2+.
b) Trong ống nghiệm có diễn ra quá trình ăn mòn điện hoá.
c) Muối ZnSO4 không tan trong nước.
d) Trong ống nghiệm có diễn ra quá trình các ion H+ nhận electron.
85. Mỗi phát biểu sau đây là đúng hay sai?
a) Hợp kim được sử dụng trong đời sống và sản xuất phổ biến hơn so với kim loại.
b) Kim loại A có nhiệt độ nóng chảy cao hơn kim loại B, nhiệt độ nóng chảy của hợp kim A-B
luôn cao hơn nhiệt độ nóng chảy của B.
c) Tính chất hóa học của hợp kim thường tương tự tính chất của các kim loại thành phần.
d) Hợp kim có thể cứng hơn rất nhiều các kim loại tạo nên nó.
C. CÂU TRẮC NGHIỆM YÊU CẦU TRẢ LỜI NGẮN
86. Lắp ráp pin điện hóa Sn - Cu ở điều kiện chuẩn. Cho biết các giá trị thế điện cực chuẩn: 0 E 0 E 2 = -0,137 V và
= +0,340 V. Sức điện động chuẩn của pin điện hóa trên là bao nhiêu Sn /Sn 2 Cu /Cu
vôn? (Làm tròn kết quả đến phần trăm.)
87. Một pin điện hóa được thiết lập từ hai điện cực tạo bởi hai cặp oxi hóa - khử là M2+/M và Ag+/Ag. Cho biết: Cặp oxi hóa - khử Fe2+/Fe Ni2+/Ni Sn2+/Sn Cu2+/Cu Ag+/Ag
Thế điện cực chuẩn (V) -0,44 -0,257 -0,137 +0,340 +0,799
Nếu M là một trong số các kim loại: Fe, Ni, Sn, Cu thì sức điện động chuẩn lớn nhất của pin bằng
bao nhiêu vôn? (Làm tròn kết quả đến phần trăm.)
88. Cho một pin Galvani với điện cực Zn và Cu có sức điện động chuẩn là 1,34 V. Sử dụng pin này
để thắp sáng một bóng đèn nhỏ với cường độ dòng điện chạy qua là I = 0,02 A. Nếu điện cực kẽm
hao mòn 0,1 mol do pin phóng điện thì thời gian tối đa mà pin thắp sáng được bóng đèn là bao
nhiêu giờ? Cho biết các công thức: Q= n.F = I.t, trong đó: Q là điện lượng (C), n là số mol electron
đi qua dây dẫn, I là cường độ dòng điện (A), t là thời gian (giây), F là hằng số Faraday (96 500 C/mol).
89. Cho các kim loại Ag, Al, Au, Cu, Cr, Fe, Mg, Pt, Zn. Có bao nhiêu kim loại phản ứng được với
dung dịch sulfuric acid đặc, nguội? 11 Trường THPT Trưng Vương Tổ Hóa
90. Cho các cặp oxi hóa - khử: Ag+/Ag, Al3+/Al, Au3+/Au, Cu2+/Cu, Fe2+/Fe, K+/K, Mg2+/Mg,
Na+/Na, Pt2+/Pt, Zn2+/Zn và Pb2+/Pb. Có bao nhiêu cặp oxi hóa - khử có giá trị thế điện cực chuẩn lớn hơn 0 V?
91. Cho các kim loại sau: Na, Ca, Cu, Ag, Au. Có bao nhiêu kim loại phản ứng được với dung dịch HCl?
92. Cho các kim loại sau: Li, Ba, Ni, Pb, Hg. Có bao nhiêu kim loại phản ứng được với nước
nguyên chất (pH = 7) ở điều kiện thường?
93. Nung nóng hỗn hợp X gồm 3,36 g bột sắt và 1,28 g bột lưu huỳnh (không có không khí), thu
được hỗn hợp Y. Hòa tan Y vào dung dịch HCl dư, thu được hỗn hợp khí Z. Đốt cháy Z cần a mol
oxygen. Giá trị của a là bao nhiêu?
94. Cho m gam hỗn hợp X gồm Mg và Zn vào dung dịch H2SO4 loãng, dư thu được 0,7437 lít H2
(đkc). Khi cho m gam hỗn hợp X vào 200 mL dung dịch chứa CuSO4 0,2 M thì thu được bao nhiêu gam kết tủa?
95. Cho quá trình sau: 4Al(s) + 3O (g) → 2Al 2 2O3(s) 0 H = -3351,4 kJ r 298
Lượng nhiệt tỏa ra khi 1 gam nhôm bị oxi hóa hoàn toàn ở điều kiện chuẩn là bao nhiêu kJ? Làm
tròn kết quả đến hàng phần mười.
96. Hòa tan hoàn toàn hỗn hợp A gồm CuO, Fe2O3, Mg vào dung dịch HCl dư thu được dung dịch
X. Cho dung dịch NaOH đến dư vào dung dịch X, thu được kết tủa Y. Lọc để lấy kết tủa Y, nung
trong không khí đến khi phần ứng xảy ra hoàn toàn, thu được chất rắn Z. Dẫn khí CO dư qua chất
rắn Z (nung nóng). Sau khi phản ứng hoàn toàn, chất rắn thu được gồm những chất nào?
97. Trong công nghiệp, kim loại nhôm (aluminium, Al) được sản xuất bằng phương pháp điện
phân nóng chảy aluminium oxide. Biết hiệu suất của quá trình chuyển hóa Al2O3 thành Al là
95,4%. Để sản xuất 5,4 tấn Al cần sử dụng bao nhiêu tấn nguyên liệu Al2O3 (làm tròn đến hàng phần mười)?
98. Khi 100,0 kg sắt lên gỉ sắt hoàn toàn thì tạo thành bao nhiêu kg gỉ sắt? (Giả thiết công thức hóa
học của gỉ sắt là Fe2O3.3H2O) (Làm tròn kết quả đến phần nguyên).
99. Ngâm một đinh sắt vào 200 mL dung dịch CuSO4 có nồng độ x M. Sau khi phản ứng kết thúc,
lấy đinh ra khỏi dung dịch, rửa nhẹ, làm khô thấy khối lượng đinh sắt tăng thêm 0,8 g. Giá trị của x là bao nhiêu?
100. Trong công nghiệp, nhôm được sản xuất bằng phương pháp điện phân nóng chảy aluminium
oxide với các điện cực làm bằng than chì, sử dụng cryolite (Na3AIF6) nóng chảy làm xúc tác. Tính
lượng quặng bauxite (chứa 80% Al ) và lượ 2O3
ng than chì cần dùng để sản xuất 2,7 tấn nhôm. Giả
sử hiệu suất chế biến quặng và quá trình điện phân là 100%; khí thoát ra tại anode gồm 10% O2,
10% CO và 80% CO2 về thể tích. 12



