












Preview text:
lOMoAR cPSD| 22014077
ÔN TẬP HỌC PHẦN CƠ SỞ LÍ THUYẾT HOÁ HỌC
BÀI TẬP CHƯƠNG 4. NHIỆT HOÁ HỌC
Bài 4.1. Cho các giá trị enthalpy của các phản ứng sau:
Tính biến thiên enthalpy của phản ứng:
Bài 4.2. Cho các giá trị enthalpy của các phản ứng sau:
Tính biến thiên enthalpy của phản ứng:
Bài 4.3. Cho các giá trị enthalpy của các phản ứng sau:
Tính biến thiên enthalpy của phản ứng:
Bài 4.4. Tên lửa đẩy của tàu con thoi có thể được tái sử dụng bằng cách sử dụng nhiệt sinh ra từ
phản ứng giữa aluminium và ammonium perchlorate để làm nhiên liệu. Phản ứng xảy ra như sau:
Dựa vào các dữ liệu nhiệt động ở bảng bên dưới tại 298 K và áp suất 1 bar: NH4ClO4(s) Al2O3(l) AlCl3(g) NO(g) H2O(g) lOMoAR cPSD| 22014077 ΔH o f (kJ/mol) - 295 -1676 -704 90 -242 So (J/mol.K) 186 51 111 211 189
a/ Hãy tính biến thiên enthalpy chuẩn của phản ứng trên tại 298 K. Từ đó cho biết phản ứng là tỏa nhiệt hay thu nhiệt?
b/ Tính biến thiên năng lượng tự do Gibbs của phản ứng trên và dự đoán về mặt nhiệt động phản
ứng trên có thể xảy xa tại điều kiện nhiệt độ 298 K hay không?
Bài 4.5. Tàu con thoi là một hệ thống tàu vũ trụ nằm ở vị trí quỹ đạo thấp của Trái Đất. Chúng có
thể hoạt động bằng sức đẩy được tạo ra từ quá trình oxi hoá nhiên liệu Methyl hydrazine (N2H3CH3)
bởi Dinitrogen tetroxide (N2O4) theo phản ứng sau:
5N2O4(l) + 4N2H3CH3(l) → 9N2(g) + 4CO2(g) + 12H2O(g) Dựa
vào các dữ liệu nhiệt động ở bảng bên dưới tại 298 K và áp suất 1 bar: N2O4(l) N2H3CH3(l) CO2(g) H2O(g) N2(g) ΔH o f (kJ/mol) - 19,6 54,1 -393,5 - 241,8 0 So (J/mol.K) 209,2 166,2 213,7 188,7 191,6
a/ Hãy tính biến thiên enthalpy chuẩn của phản ứng trên tại 298 K. Từ đó cho biết phản ứng là tỏa nhiệt hay thu nhiệt?
b/ Tính biến thiên năng lượng tự do Gibbs của phản ứng trên và dự đoán về mặt nhiệt động phản
ứng trên có thể xảy xa tại điều kiện nhiệt độ 298 K hay không?
Bài 4.6. Hãy xác định biến thiên enthalpy của phản ứng sau:
N2H4(l) + O2(g) N2(g) + 2H2O(l) Biết
Bài 4.7. Mặt trời cung cấp năng lượng tổng cộng với tốc độ khoảng 1 kW trên mỗi mét vuông diện
tích bề mặt (biết 1 W = 1 J/s). Một loại cây trồng tạo ra 20 kg đường sucrose (C12H22O11) trong 1
giờ trên 1 hecta đất trồng (1 ha = 10.000 m2). Giả sử rằng đường sucrose được tạo ra theo phản ứng sau: lOMoAR cPSD| 22014077
12CO2(g) + 11H2O(l) C12H22O11(s) + 12O2(g) ΔH = 5640 kJ Hãy tính
phần trăm lượng ánh sáng mặt trời dùng cho quá trình tạo ra đường sucrose trên.
Bài 4.8. Hãy xác định biến thiên enthalpy chuẩn của phản ứng sau:
FeO(s) + CO(g) Fe(s) + CO2(g) Biết
Bài 4.9. Trong công nghiệp, Ammonia (NH3) được sản suất theo chu trình Harber: 3H2(g) + N2(g) 2NH3(g) Dựa
vào bảng số liệu sau tại 298 K và áp suất 1 bar: H2 N2 NH3 ΔfHo298 (kJ/mol) 0 0 -46 So298 (J/mol.K) 131 192 193 -
Hãy tính biến thiến năng lượng tự do Gibbs chuẩn của phản ứng trên. Cho biết phản ứng
trên có tự phát xảy ra tại điều kiện chuẩn hay không? -
Tại nhiệt độ nào phản ứng trên sẽ tự phát xảy ra tại điều kiện chuẩn. Biết rằng ΔrHo và ΔrSo
không phụ thuộc vào nhiệt độ. Bài 4.10. Xét phản ứng sau: C6F6(g) 3C2F2(g) Sử
dụng bảng số liệu sau ở 298 K: Hãy tính:
a/ Tính biến thiên entropy chuẩn của phản ứng ở 298 K. b/ Tính hằng số cân bằng của phản
ứng trên tại 298 K. c/ Giả sử biến thiên enthalpy chuẩn và entropy chuẩn của phản ứng trên
không phụ thuộc vào nhiệt độ, hãy tính hằng số cân bằng của phản ứng ở 3000 K.
Bài 4.11. Xác định biến thiên enthalpy (
o ) của phản ứng đốt cháy butane theo sơ đồ sau: rH298
C4H10(g) + O2(g) ⎯⎯→ CO2(g) + H2O(g)
Biết năng lượng liên kết trong các hợp chất cho trong bảng sau: lOMoAR cPSD| 22014077 Liên kết Phân tử E Liên kết Phân tử b Eb (kJ/mol) (kJ/mol) C – C C4H10 346 C = O CO2 799 C – H C4H10 418 O – H H2O 467 O = O O2 495
Bài 4.12. Thực nghiệm cho biết năng lượng liên kết, kí hiệu là Eb (theo kJ.mol-1) của một số liên kết như sau: Liên kết O – H (alcohol) C = O (RCHO) C – H (alkane) C – C (alkane) Eb 437,6 705,2 412,6 331,5 Liên kết C – O (alcohol) C – C (RCHO) C – H (RCHO) H – H Eb 332,8 350,3 415,5 430,5 Tính o
rH298 của phản ứng: CH2(CHO)2 + 2H2 → CH2(CH2OH)2 Bài
4.13. Tính biến thiên entropy chuẩn tại 298 K của phản ứng sau: Biết:
Bài 4.15. Xét phản ứng: 4Fe(s) + 3O2(g) 2Fe2O3(s) Sử
dụng bảng số liệu sau, tại 298 K và p = 1 bar: Hãy tính: lOMoAR cPSD| 22014077
a/ Hằng số cân bằng của phản ứng trên tại 298 K.
b/ Giả sử biến thiên enthalpy chuẩn và entropy chuẩn của phản ứng trên không phụ thuộc vào nhiệt
độ, hãy tính hằng số cân bằng của phản ứng ở 350 K.
Bài 4.16. Tế bào đã sử dụng nguồn năng lượng từ quá trình thủy phân Adenosine Triphosphate,
viết tắt như ATP. Phản ứng này có thể được biểu diễn như sau:
Ở đây, ADP là viết tắt của hợp chất Adenosine Diphosphate. Biết biến thiên năng lượng tự do Gibbs
chuẩn của phản ứng trên bằng -30,5 kJ/mol. a/ Tính hằng số cân bằng của phản ứng trên tại 25 oC.
b/ Giả sử tất cả năng lượng tự do Gibbs sinh ra từ phản ứng:
được dùng cho quá trình tạo thành ATP từ ADP. Hãy cho biết có bao nhiêu phân tử ATP được tạo
thành từ phản ứng oxi hoá 1 phân tử glucose ở trên. Biết C6H12O6(s) O2(g) CO2(g) H2O(g) ΔfGo (kJ/mol) - 911 0 -394 - 229
BÀI TẬP CHƯƠNG 5. ĐỘNG HOÁ HỌC
Bài 5.1. Xét phản ứng phân hủy của Sulfuryl chloride (SO2Cl2) ở 373 K: SO2Cl2(g) → SO2(g) + Cl2(g)
Áp suất chung của hệ phản ứng được đo lường theo thời gian và thể hiện rõ ở bảng bên dưới: Thời gian (phút) 0 180 360 540 720 Pchung (Pa) 11070 15790 17260 18900 19000
a/ Hãy chứng minh phản ứng trên là bậc 1? Viết phương trình động học của phản ứng.
b/ Tính hằng số tốc độ trung bình của phản ứng trên với đơn vị thời gian là giây.
Bài 5.2. Phản ứng: A → B + C
tuân theo phương trình động học bậc 0 có hằng số tốc độ là 5.10-2 mol L-1 tại 298 K với nồng độ
đầu của chất A là 10-3 mol L-1.
a/ Viết phương trình động học dạng tích phân và biểu thức tốc độ phản ứng của phản ứng trên. b/
Tính thời gian bán hủy của phản ứng trên. c/ Xác định nồng độ của sản phẩm B sau thời gian
5.10-3 s. Giả sử nồng độ ban đầu của B bằng 0. lOMoAR cPSD| 22014077
Bài 5.3. Lượng chất phóng xạ Poloni sau 14 ngày giảm đi 6,85% so với ban đầu. Xác định hằng số
tốc độ phóng xạ và chu kỳ bán hủy của Poloni. Cho biết phản ứng là bậc 1.
Bài 5.4. Cho phản ứng: CH3COCH3 → C2H4 + CO + H2
Áp suất tổng biến đổi như sau: Thời gian (phút) 0 6,5 13 19,9 Ptổng (N/m2)
41589,6 54386,6 65050,4 74914,6
Xác định bậc phản ứng và tính giá trị hằng số tốc độ phản ứng.
Bài 5.5. Trong 10 phút, phản ứng giữa hai chất A và B xảy ra hết 25% lượng ban đầu. Tính chu kỳ
bán hủy của phản ứng nếu nồng độ ban đầu hai chất trong phản ứng bậc hai là như nhau.
Bài 5.6. Cho phản ứng: A + B → AB, thu được tốc độ theo nồng độ đầu các chất là: CoA (M) 1,0 0,1 1,0 CoB (M) 1,0 1,0 0,1 vo (M/s) 0,025 0,0025 0,00025
Hãy viết phương trình động học biểu diễn tốc độ của phản ứng trên.
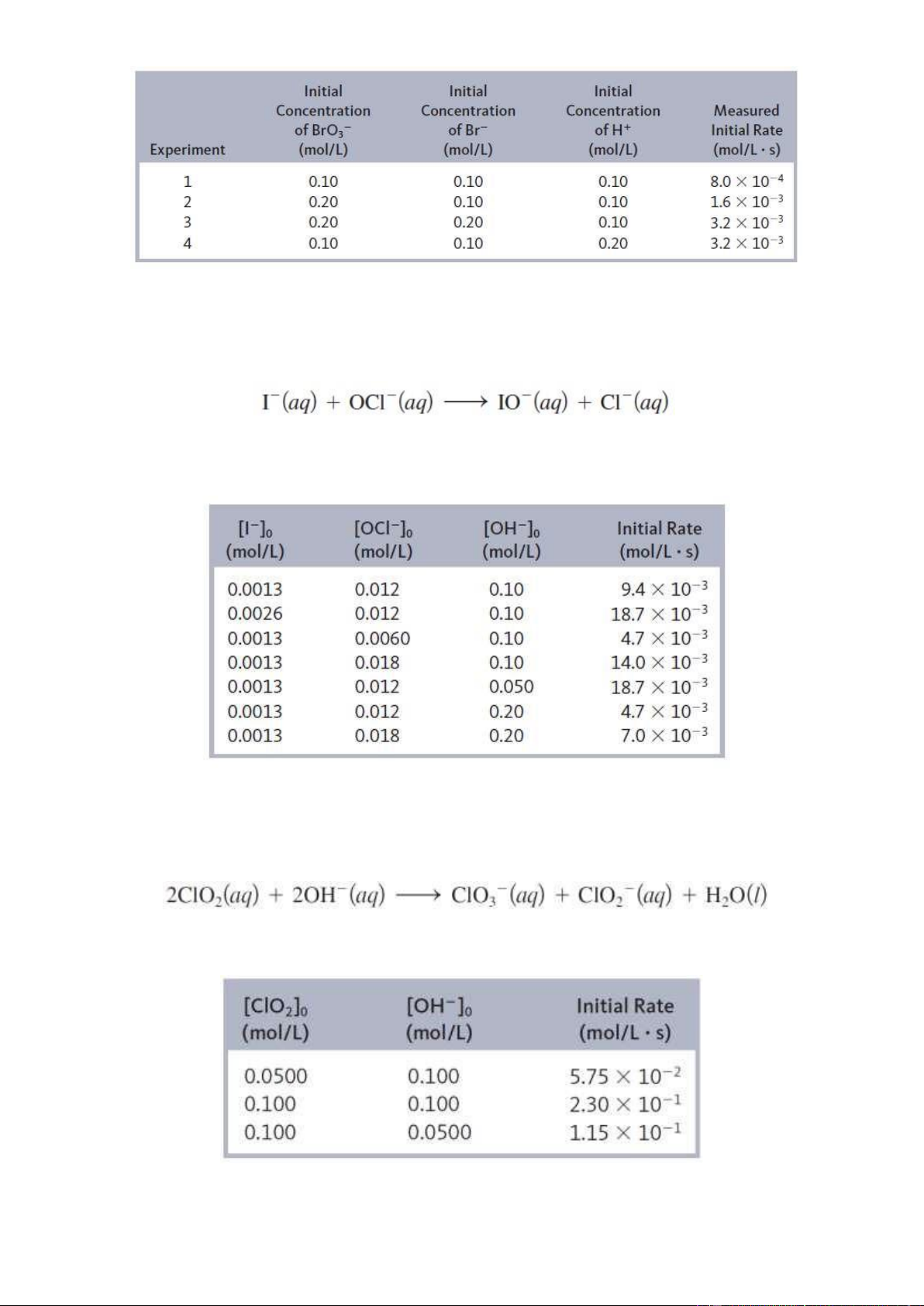
Bài 5.7. Người ta đo tốc độ đầu hình thành Z đối với phản ứng: X + Y → Z
và thu được kết quả sau: Số TN CoX (M) CoY (M) vo (M.phút-1) 1 0,1 0,1 2,0.10-3 2 0,2 0,2 8,0.10-3 3 0,1 0,2 8,0.10-3
a/ Xác định bậc phản ứng riêng phần đối với X, Y và bậc phản ứng tổng cộng.
b/ Tính hằng số tốc độ của phản ứng trên c/ Tính vo khi
nồng độ đầu của X và Y đều bằng 0,5M.
Bài 5.8. Xét phản ứng sau:
Dựa vào bảng dữ liệu thực nghiệm với nồng độ đầu của các tác chất và tương ứng với tốc độ đầu của 4 thí nghiệm: lOMoAR cPSD| 22014077
Hãy xác định bậc riêng phần của các tác chất, bậc phản ứng tổng cộng, hằng số tốc độ và viết biểu
thức tốc độ của phản ứng trên?
Bài 5.9. Xét phản ứng sau:
Tốc độ phản ứng trên phụ thuộc vào nồng độ ion OH-. Dựa vào bảng dữ liệu thực nghiệm với nồng
độ đầu của các tác chất và tương ứng với tốc độ đầu của 7 thí nghiệm:
Hãy xác định bậc riêng phần của các tác chất, bậc phản ứng tổng cộng, hằng số tốc độ và viết biểu
thức tốc độ của phản ứng trên?
Bài 5.10. Xét phản ứng sau:
Dựa vào bảng dữ liệu thực nghiệm với nồng độ đầu của các tác chất và tương ứng với tốc độ đầu của 3 thí nghiệm: lOMoAR cPSD| 22014077
a/ Hãy xác định bậc riêng phần của các tác chất, bậc phản ứng tổng cộng, hằng số tốc độ và viết
biểu thức tốc độ của phản ứng trên?
b/ Xác định tốc độ đầu của phản ứng trên khi nồng độ đầu của ClO2 và OH- lần lượt là 0,175 M và 0,0844 M.
Bài 5.11. DDT (M = 354,49 g/mol) là một loại thuốc trừ sâu được sử dụng rộng rãi nhưng đã bị
cấm sử dụng ở Hoa Kỳ vào năm 1973. Lệnh cấm này được đưa ra do sự tồn tại dai dẳng của DDT
trong các hệ sinh thái khác nhau, dẫn đến sự tích tụ cao của chất này ở nhiều loài chim săn mồi.
Thuốc trừ sâu có thể làm mỏng vỏ trứng và làm tiệc chủng nhiều loài chim. Nếu một thùng DDT
với thể tích 20 L bị phun hết vào một cái ao với nồng độ DDT là 8,75.10-5 M, thì sẽ mất bao lâu để
DDT có nồng độ là 1,41.10-7 M (mức này được giả định là an toàn với các loài động vật)? Giả sử
sự phân hủy DDT là bậc nhất với chu kỳ bán rã 56 ngày.
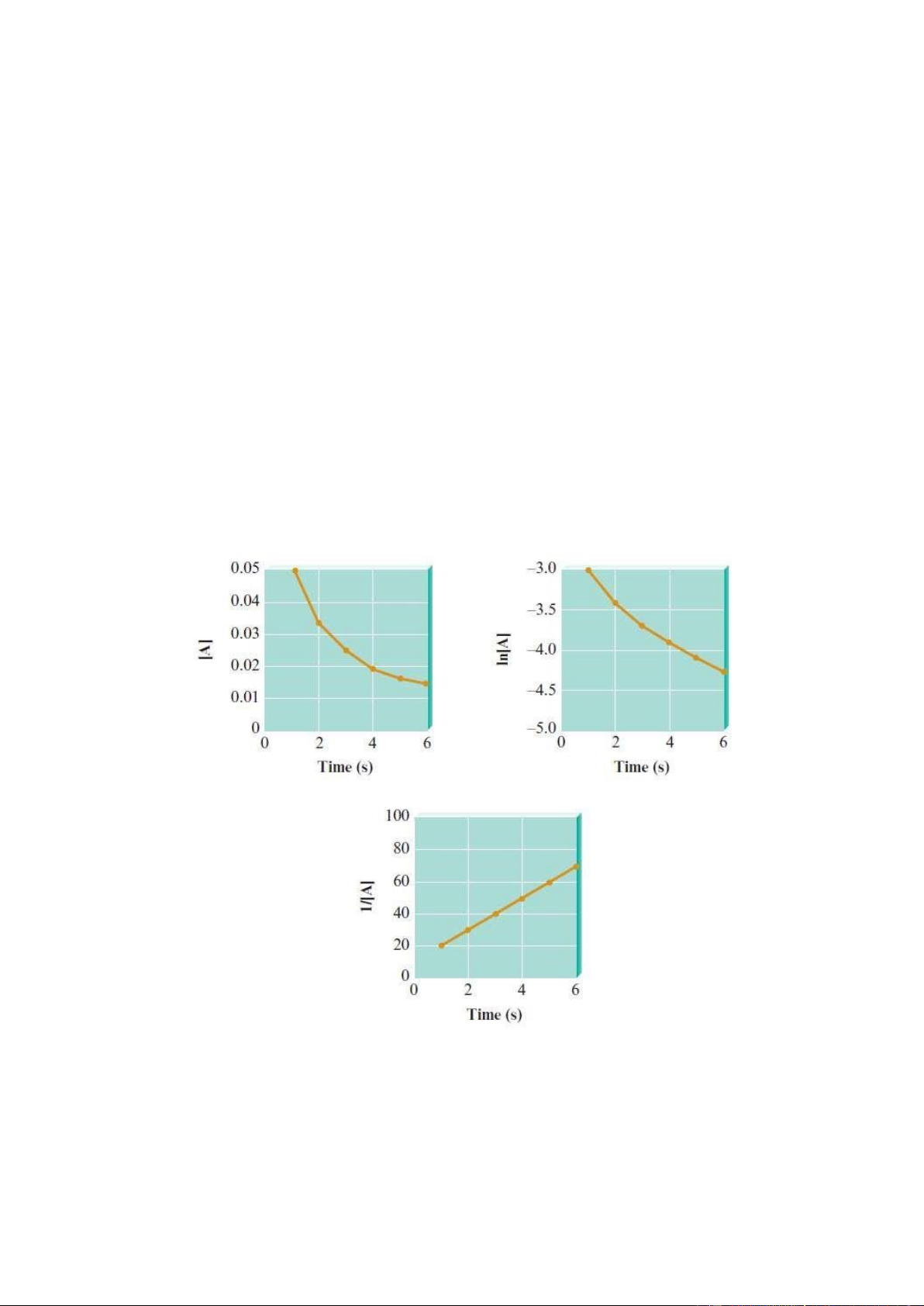
Bài 5.12. Xét một phản ứng sau: A → 2B + C
Dựa vào các đồ thị bên dưới. Hãy xác định bậc của phản ứng trên và nồng độ ban đầu của chất A?
BÀI TẬP CHƯƠNG 6. CÂN BẰNG HOÁ HỌC VÀ CÂN BẰNG TRONG DUNG DỊCH
Bài 6.1. Phản ứng thuận nghịch sau có hằng số cân bằng Kc = 278. lOMoAR cPSD| 22014077
Tính giá trị hằng số cân bằng trong trường hợp a, b và c.
Bài 6.2. Ở 298 K, phản ứng thuận nghịch sau có hằng số cân bằng Kc = 0.09.
Cho biết chiều hướng phản ứng trong các trường hợp sau:
Bài 6.3. Formalin là dung dịch chứa aldehyde formic có nồng độ khoảng 40% trong nước. Formalin
được sử dụng để ngâm xác động vật, diệt côn trùng, tẩy uế,… Dung dịch aldehyde formic (HCHO)
có thể được tạo ra từ phản ứng phân hủy methanol (CH3OH) với sự có mặt của xúc tác Cu tại nhiệt độ 700 oC:
CH3OH(aq) ⎯⎯⎯⎯⎯⎯→700CuoC HCHO(aq) + H2(aq) KC = 3,2.10-10
a/ Hãy tính nồng độ mol/l của các chất tại trạng thái cân bằng. Biết nồng độ ban đầu của methanol
bằng 1,4 M. b/ Cân bằng của phản ứng trên sẽ chuyển dịch theo chiều nào? Khi:
- Thêm xúc tác Cu vào hệ. - Thêm methanol vào hệ.
- Lấy bớt aldehyde formic ra khỏi hệ.
- Thành phần của hệ: [CH3OH] = 0,5 M; [HCHO] = 0,01 M và [H2] = 0,01 M.
Bài 6.4. Hydrogen sử dụng cho quá trình tổng hợp NH3 được điều chế bằng phản ứng sau: CH4(g) + H2O(g) CO(g) + 3H2(g) Hãy
cho biết cân bằng trên sẽ chuyển dịch theo chiều nào, khi:
- H2O(g) được cho thêm vào phản ứng.
- Nhiệt độ của hệ giảm xuống. Biết phản ứng trên là phản ứng thu nhiệt.
- Giảm áp suất của hệ.
- CO được lấy ra khỏi phản ứng. lOMoAR cPSD| 22014077
Bài 6.5. Hằng số cân bằng của phản ứng: PCl3(g) + Cl2(g) PCl5(g) ở 500K là KP = 3.
a. Tính độ phân ly của PCl5 ở 1atm và 8 atm.
b. Ở áp suất nào, độ phân ly là 10%.
c. Phải thêm bao nhiêu mol Cl2 vào 1mol PCl5 để độ phân ly của PCl5 ở 8 atm là 10%.
Bài 6.6. Ở 200 0C hằng số cân bằng Kp của phản ứng dehydrogen alcohol isopropylic trong pha khí: CH3CH(OH)CH3(g) H3CCOCH3(g) + H2(g)
bằng 6,92.104. Tính độ phân ly của alcohol ở 200 oC và dưới áp suất 9,7.104 Pa. (Khi tính chấp
nhận hỗn hợp khí tuân theo định luật khí lý tưởng). Bài 6.7. Có thể điều chế khí Cl2 bằng phản ứng: 4HCl(g) + O2(g) 2H2O(g) + 2Cl2(g)
Xác định HSCB KP của phản ứng ở 386 oC, biết rằng ở nhiệt độ đó và áp suất 1 atm, khi cho một
mol HCl tác dụng với 0,48 mol O2 thì khi phản ứng đạt trạng thái cân bằng sẽ thu được 0,402 mol Cl2.
Bài 6.8. Ở 1000K hằng số cân bằng của phản ứng: C(graphite, s) + CO2(g) 2CO(g)
là Kp =1,85 và hiệu ứng nhiệt (biến thiên enthalpy) trung bình là 41130 cal. Xác định thành phần
pha khí ở cân bằng tại 1000K và 1200K biết áp suất tổng cộng của hệ cân bằng là 1atm.
Bài 6.9. Tính pH của các dung dịch sau:
a/ Sau khi trộn 50 mL dung dịch HBr 0,05M với 150 mL dung dịch HCl 0,1M. b/ Dung dịch gồm
HF 1M và C6H5OH 1M. Biết Ka của acid HF và C6H5OH lần lượt là 7,2.10-4 và 1,6.10-10.
c/ Sau khi trộn 50 mL dung dịch CH3COOH 0,2M với 50 mL dung dịch HCl 10-3M. Biết Ka (hằng
số phân li acid) của CH3COOH là 1,8.10-5.
Bài 6.10. Trichloroacetic acid (CCl3CO2H) là một acid ăn mòn được dùng để kết tủa protein. Giá
trị pH của dung dịch 0,050 M trichloroacetic acid bằng với pH của dung dịch 0,040 M HClO4. Tính
Ka của trichloroacetic acid . Bài 6.11.
a/ Tính pH của dung dịch 0,1 M H2SO4 (dung dịch A) (pKa = 2.00). b/ Dung dịch B được tạo thành
khi thêm 10 mL dung dịch 0,15 M NaOH vào 10 mL dung dịch A. lOMoAR cPSD| 22014077
Tính pH dung dịch B và độ điện ly của sulfuric acid trong dung dịch B. Bài 6.12.
a/ Tính pH của dung dịch 0,1 M CH3COONa + 0,1 M CH3COOH (dung dịch X) (pKa = 4.76). b/
Dung dịch Y được tạo thành khi thêm 10 mL dung dịch 0,1 M HCl vào 10 mL dung dịch X.
Tính pH dung dịch Y. Bài 6.13.
a/ Tính độ tan (mol/l) của Fe(OH)3 (Ksp = 2.10-39) trong nước. b/ Tính độ tan của
SrF2 trong nước, bỏ qua tính base của ion F- (biết Ksp = 7,9.10-10).
+ Độ tan của SrF2 trên thực tế sẽ lớn hơn hay nhỏ hơn giá trị tính được ở câu a? Giải thích.
+ Tính độ tan của SrF2 trong dung dịch đệm có pH = 2,00 (Ka của HF bằng 7,2.10-4).
Bài 6.14. Một dung dịch chứa 10-4 M các muối NaF, Na2S, and Na3PO4. Dự đoán thứ tự kết tủa khi
Pb2+ được thêm từ từ vào dung dịch? Biết Ksp(PbF2) = 4.10-8, Ksp(PbS) = 7.10-29, and Ksp[Pb3(PO4)2] = 1.10-54.
Bài 6.15. Tính độ tan (mol/l) của các chất sau đây:
a/ Ag3PO4 (Ksp = 1,8.10-18); b/ CaCO3 (Ksp = 8,7.10-9); c/ Hg 2+
2Cl2 (Ksp = 1,1,.10-18) (Biết dạng cation là Hg2 ).
Giả sử bỏ qua phản ứng thuỷ phân của các ion trong nước. Bài
6.16. Tính tích số tan (Ksp) của các dung dịch bão hoà sau: a/
Dung dịch bão hoà PbBr2 với nồng độ Pb2+ là 2,14.10-2 M. b/
Dung dịch bão hoà Ag2C2O4 với nồng độ Ag+ là 2,2.10-4 M.
c/ Một dung dịch bão hoà chứa một hợp chất ion M2X3 (M = 288 g/mol) có độ tan 3,6.10-7 g/L.
Bài 6.17. Cream of tartar là tên gọi khác của Kali bitartrat (KBT) với công thức hóa học là
KC4H5O6. Trong làm bánh, cream of tartar (KBT) thường được dùng để giúp lòng trắng trứng khi
đánh dễ đông cứng hơn và giúp bọt khí không bị vỡ. Ngoài ra, KBT là một loại bột có màu trắng,
mịn, nó cũng chính là sản phẩm phụ trong quá trình sản xuất rượu vang khi hợp chất của kim loại
potassium kết hợp với acid tartaric tạo nên. Do đó, chúng ta có thể nhìn thấy được sự kết tinh của
cream of tartar trong các hầm rượu vang, trên các chai rượu lâu năm và trong các thùng đựng rượu.
Hãy tính khối lượng tối đa của KBT có thể hòa tan trong 250 mL dung dịch để tạo thành dung dịch
bão hòa. Biết Ksp của KBT là 3,8.10-4. lOMoAR cPSD| 22014077
Bài 6.18. Hãy tính độ tan của PbI2 (Ksp = 1,4.10-8) trong các trường hợp sau:
a/ Trong nước b/ Trong dung dịch Pb(NO3)2 0,1 M c/ Trong dung dịch NaI 0,01 M. Bài 6.19.
a/ Kết tủa PbF2(s) có xuất hiện hay không? Sau khi trộn 100 mL dung dịch Pb(NO3)2 0,01 M với
100 mL dung dịch NaF 0,001 M. Biết Ksp của PbF2 là 4.10-8. b/ Một dung dịch sau khi trộn chứa Ce3+ 2.10-3 M và IO -
3 10-2M thì có kết tủa Ce(IO3)3(s) xuất hiện không? Biết Ksp của Ce(IO3)3 là 3,2.10-10.
Bài 6.20. Một dung dịch chứa 0,25 M Ni(NO3)2 và 0,25 M Cu(NO3)2. Có thể tách các ion kim loại
bằng cách thêm từ từ Na2CO3 vào dung dịch trên không? Giả sử để tách thành công kim loại thì
phải có 99% ion kim loại kết tủa trước khi ion kim loại còn lại bắt đầu kết tủa và giả sử thể tích
không thay đổi khi thêm Na2CO3.
BÀI TẬP CHƯƠNG 7. ĐIỆN HOÁ HỌC
Bài 7.1. Cân bằng các phản ứng oxi hoá – khử sau theo phương pháp ion – electron:
7.1.1 Trong môi trường acid:
7.1.2 Trong môi trường base:
Bài 7.2. a/ Xét 1 phản ứng xảy ra trong pin Galvani: Biết: lOMoAR cPSD| 22014077
Hãy cân bằng phản ứng tổng cộng xảy ra trong pin Galvani ở trên và tính sức điện động chuẩn của pin.
b/ Xét 1 phản ứng xảy ra trong pin Galvani: Biết:
Hãy cân bằng phản ứng tổng cộng xảy ra trong pin Galvani ở trên và tính sức điện động chuẩn của pin
Bài 7.3. Xét 1 phản ứng tổng cộng xảy ra trong pin như sau:
a/ Viết các bán phản ứng xảy ra ở các điện cực anode và cathode trong pin. Biết Eo = Cu Cu2+/ 0,34V và E =− oFe2+/Fe 0,44V
b/ Tính biến thiên năng lượng tự do Gibbs chuẩn của phản ứng và nhận xét phản ứng trên có tự
phát xảy ra tại điều kiện trên không?
Bài 7.4. Hãy dự đoán có thể dùng dung dịch HNO3 1M để hoà tan chiếc nhẫn bằng vàng để tạo
thành dung dịch chứa Au3+ với nồng độ 1 M hay không? Biết: Eo = 0,96 V Au3+ + 3e → Au Eo = 1,5 V
Bài 7.5. Cho các bán phản ứng sau: lOMoAR cPSD| 22014077
a/ Viết các bán phản ứng xảy ra tại anode và cathode và phản ứng tổng cộng của pin được thiết lập
từ 2 bán phản ứng (1) và (2).
b/ Tính sức điện động của pin ở điều kiện sau:
Bài 7.6. Cho các bán phản ứng sau:
a/ Viết các bán phản ứng xảy ra tại anode và cathode và phản ứng tổng cộng của pin được thiết lập
từ 2 bán phản ứng (1) và (2). b/ Tính sức điện chuẩn của pin và hằng số cân bằng của phản ứng tổng cộng tại 25 oC.
Bài 7.7. Pin Galvani được thiết từ các bán phản ứng bên dưới:
Viết các bán phản ứng xảy ra tại anode và cathode và phản ứng tổng cộng của pin. Từ đó xác định
sức điện động chuẩn của các pin Galvani trên.
Bài 7.8. Biết phản ứng tổng cộng xảy ra trong pin chì như sau:
Hãy xác định sức điện động của pin tại 25 oC. Khi [HSO -4] = [H+] = 4,5 M; Eo = 2,04 V tại 25 oC.
Bài 7.9. Cho phản ứng tổng cộng xảy ra trong pin như sau: a/ Viết các bán
phản ứng xảy ra ở cathode và anode.
b/ Tính pH của dung dịch ở điện cực cathode. Biết sức điện động của pin là 3,01 V; [Cr3+] = 0,15 M; [Al3+] = 0,3 M; [Cr 2- 2O7 ] = 0,55 M. Và: Eo = 1,33 V lOMoAR cPSD| 22014077
Al3+ + 3e → Al Eo = -1,66 V Bài
7.10. Cho các bán phản ứng sau:
a/ Viết phản ứng tổng cộng xảy ra trong pin Galvani và tính sức điện chuẩn của pin.
b/ Tính biến thiên năng lượng tự do Gibbs và hằng số cân bằng của phản ứng tổng cộng xảy ra
trong pin trên tại 25 oC. c/ Tính sức điện động của pin tại 25 oC, biết [Zn2+] = 0,1 M và [Fe2+] = 10- 5 M.
Bài 7.11. Cho các bán phản ứng sau:
a/ Viết phản ứng tổng cộng xảy ra trong pin Galvani và tính sức điện động chuẩn của pin. b/ Tính
biến thiên năng lượng tự do Gibbs và hằng số cân bằng của phản ứng tổng cộng xảy ra trong pin
trên tại 25 oC. c/ Tính sức điện động của pin tại 25 oC, biết [Au3+] = 0,01 M và [Tl+] = 10-4 M.

