

Preview text:
lOMoARcPSD|45316467 lOMoARcPSD|45316467
Ôn tập Thực hành hóa đại cương 2 0. Dụ ng cụ PTN _Ống nghiệm _Ống đong _Erlen _Becher lOMoARcPSD|45316467 _Pipet _Buret _Fiol 1. P
hương pháp thể tích – Xác định tỷ trọng của chất lỏng
_ Đơn vị: g/cm3 hoặc g/mL _
_Buret và Pipet có độ tin cậy cao
nhất. _Tiến hành đo tỷ trọng:
Cân 10,00mL dung dịch → Tính tỷ trọng lOMoARcPSD|45316467
_Cần đo nhiệt độ của dung dịch để chọn đúng đường chuẩn liên hệ giữa tỷ trọng (D)
và nồng độ % muối NaCl (theo khối lượng).
_Cần lặp lại nhiều lần (3 lần) và lấy kết quả trung bình giữa các lần đo để có độ chính xác cao.
_Khi tăng nhiệt độ thì tỷ trọng giảm do khi tăng nhiệt độ thì thể tích của dung dịch
tăng lên (nở ra khi tăng nhiệt độ) trong khi khối lượng của dung dịch không đổi. 2. Xác
định nồng độ acetic acid trong giấm ăn
_Giấm ăn là dung dịch acetic acid 2% đến 5% _
_Tiến hành: Chuẩn hóa dung dịch NaOH (bằng KHP) để biết nồng độ chính xác của
dung dịch NaOH → Chuẩn độ dung dịch giấm ăn (bằng dung dịch NaOH đã chuẩn
hóa) để xác định lượng acetic acid trong mẫu giấm ăn → Biết được lượng acetic acid
trong giấm ăn thì tính được nồng độ
_Cần phải chuẩn hóa NaOH vì NaOH không phải là base chuẩn sơ cấp, khó pha chính
xác nồng độ (CM), dễ bị nhiễm tạp (CO2 và hơi nước trong không khí) → nồng độ dễ
bị thay đổi theo thời gian
+Acid và base chuẩn sơ cấp có một số đặc tính:
Độ tính chất ít nhất 99,9%
Có phân tử lượng lớn để giảm sai số khi cân
Chỉ cho 1 loại phản ứng Bền khi đun nóng
Hòa tan được trong dung môi
+Acid chuẩn sơ cấp thường dùng là Kali Hydro Phtalat (1 nhóm chức acid -COOH)
và oxalic acid (2 nhóm chức acid -COOH)
+Base chuẩn sơ cấp thường dùng là Na2CO3
_Tráng buret (2 lần) bằng dung dịch chuẩn độ (dung dịch NaOH) để tránh nhiễm tạp
dẫn đến kết quả chuẩn độ sai
_Loại bỏ bọt khí ở vòi buret để thể tích đọc được không bị sai
_Chất chỉ thị màu để xác định điểm tương đương là phenolphtalein lOMoARcPSD|45316467
_Đổ bỏ dung dịch sau khi chuẩn độ, tráng lại erlen bằng nước khử ion để mẫu sau
không bị nhiễm tạp, tránh sai kết quả cho lần chuẩn độ sau.
_Thêm dung dịch NaOH vào buret về vạch 0mL để thể tích đo được chính xác. _Cách tính: +Chuẩn hóa NaOH
Pha 3 mẫu dung dịch KHP, xác định số mol KHP trong mẫu
Số mol NaOH = số mol KHP (tỉ lệ phản ứng là 1:1) Lấy trung bình kết quả
+Chuẩn độ mẫu giấm ăn và xác định nồng độ acetic acid
Cân khối lượng của 3 mẫu giấm ăn
Số mol acetic acid = số mol NaOH
Số mol NaOH = Nồng độ dd NaOH (đã chuẩn hóa) . Thể tích dd NaOH đã chuẩn độ
Khối lượng Acetic acid = Số mol Acetic acid . Khối lượng mol Acetic acid Lấy trung bình kết quả
_Sử dụng KHP ẩm để chuẩn độ thì khối lượng KHP thực sẽ ít hơn khối lượng KHP
cân được (do trong khối lượng cân được có cả nước) → số mol KHP thực tế sẽ bé hơn
số mol KHP tính được → Nồng độ dd NaOH thực tế bé hơn nồng độ dd NaOH tính
được → Khối lượng acetic acid thực tế bé hơn khối lượng acetic acid tính được →
Nồng độ acetic acid trong giấm ăn xác định được cao hơn giá trị thực (Nồng độ %
acetic acid thực tế bé hơn nồng độ % acetic acid tính được)
_NaOH (s) chưa hòa tan hoàn toàn khi chuẩn độ KHP mà khi chuẩn độ giấm ăn thì
NaOH (s) lại tan hoàn toàn thì số mol NaOH thực tế lớn hơn số mol NaOH tính được
→ Nồng độ dd NaOH thực tế lớn hơn nồng độ dd NaOH tính được → Khối lượng
acetic acid thực tế lớn hơn khối lượng acetic acid tính được → Nồng độ acetic acid
trong giấm ăn xác định được thấp hơn giá trị thực (Nồng độ % acetic acid thực tế lớn
hơn nồng độ % acetic acid tính được)
_Thể tích nước để hòa tan KHP có thể không cần chính xác do lượng nước này chỉ để
hòa tan KHP (để dễ phản ứng với NaOH) và các phép tính chỉ cần tính trên số mol
KHP (yêu cầu chính xác về khối lượng KHP) chứ không tính trên nồng độ KHP lOMoARcPSD|45316467
_Trong quá trình chuẩn độ cho lố NaOH khiến màu hồng quá đậm thì lượng NaOH
đã vượt quá điểm tương đương → số mol NaOH đo được lớn hơn số mol KHP rất
nhiều → Thể tích NaOH đo được lớn hơn thể tích NaOH cần thiết để trung hòa KHP
→ Nồng độ NaOH thực tế lớn hơn nồng độ NaOH tính được → Khối lượng acetic
acid thực tế lớn hơn khối lượng acetic acid tính được → Nồng độ acetic acid trong
giấm ăn xác định được thấp hơn giá trị thực (Nồng độ % acetic acid thực tế lớn hơn
nồng độ % acetic acid tính được)
_Trong quá trình chuẩn độ, để đọng vài giọt NaOH trên thành erlen thì thể tích dd
NaOH ghi nhận được lớn hơn thể tích dd NaOH phản ứng → Nồng độ NaOH thực tế
lớn hơn nồng độ NaOH tính được → Khối lượng acetic acid thực tế lớn hơn khối
lượng acetic acid tính được → Nồng độ acetic acid trong giấm ăn xác định được thấp
hơn giá trị thực (Nồng độ % acetic acid thực tế lớn hơn nồng độ % acetic acid tính được) 3. T
ác chất có lượng giới hạn
_Mục tiêu: xác định tác chất có lượng giới hạn (chất không dư) _Hóa chất sử dụng: _Phương trình phản ứng: _Tiến hành:
Tạo kết tủa → Xác định tác chất có lượng giới hạn → Phân tích số liệu
_Trong quá trình tạo kết tủa điều chỉnh dung dịch hơi kiềm, do dung dịch toan sẽ tạo
thành ion không tạo kết tủa với ion
_Làm muồi kết tủa tức là làm kết tủa nhỏ ra rồi để lắng để kết tủa có thể kết tinh thành tinh thể lớn hơn
_Xác định tác chất có lượng giới hạn: Chiết dịch còn lại sau khi lọc ra 2 ống nghiệm,
thêm vào mỗi ống nghiệm 1 hóa chất, ống nghiệm nào kết tủa thì chứng tỏ chất còn lại là chất dư.
_Mẫu sấy khô khi thấy có vết nứt chân chim
_Chất rắn + giấy lọc chưa khô hẳn → giá trị cân được sẽ cao hơn → % các muối sẽ cao hơn thực tế. 4. Ac id, base, muối lOMoARcPSD|45316467
_Biết cách viết phương trình thủy phân của các acid, base, muối trong nước (cho thấy tính acid/base) +Vd: +Vd: +Vd: +Vd:
_Xác định tính acid, base hay trung tính của các dung dịch _Tính pH:
_Nồng độ HCl càng cao thì khả năng phản ứng với Mg càng cao do khả năng tiếp xúc giữa HCl và Mg tăng lên
_Nồng độ CH3COOH càng cao thì khả năng phản ứng với Mg càng cao do khả năng
tiếp xúc giữa CH3COOH và Mg tăng lên
_HCl phản ứng với Mg dữ dội hơn so với CH3COOH phản ứng với Mg
KL: Nồng độ càng cao thì phản ứng xảy ra càng nhanh
_ Hòa tan NaOH trong nước có tỏa nhiệt do tổng năng lượng của thấp NaOH(s)
_Hòa tan trong nước thì có bọt khí và tỏa nhiệt nhẹ (giải thích tương tự NaOH) vì
_Nước sinh hoạt có pH < 7 do nước sinh hoạt được sục Clo để khử trùng:
_Phản ứng giữa natri cacbonat và đồng (II) sulfate:
Hiện tượng: có kết tủa xanh nhạt ngay khi trộn 2 dung dịch và có bọt khí bay
lên _Phương trình hòa tan kết tủa bằng HCl:
_Muối kali phosphate có môi trường base vì: lOMoARcPSD|45316467
_Phản ứng của bê tông khi đông cứng (phản ứng của canxi oxit với khi cacbonic và nước):
_Cu không tan trong dung dịch HCl: Cu + HCl → không phản
ứng _Các ion mạnh không làm ảnh hưởng pH 5. Xác
định lượng phospho trong phân bón NPK _Tiến hành:
Pha dung dịch MgSO4 10% từ MgSO4.7H2O (s) → Tạo kết tủa NH4MgPO4.6H2O →
Định lượng và thử tính chất sản phẩm.
_Cách pha x mL dung dịch MgSO4 10% từ MgSO4.7H2O (s):
Tính khối lượng dung dịch cần pha (khối lượng = thể tích . tỷ khối) → tính ra lượng
MgSO4 khan cần có → tính MgSO4.7H2O (s) cần có → Cân lượng MgSO4.7H2O (s)
đã tính cho vào becher → thêm nước đến khối lượng dung dịch đã tính
_Tạo kết tủa NH4MgPO4.6H2O:
+Hòa tan phân NPK thì P sẽ tồn tại dưới dạng các anion của phosphoric acid, bổ sung
thêm ion Mg2+ và môi trường kiềm yếu (dd amoniac) để tạo kết tủa +Phương trình phản ứng:
+Không sử dụng môi trường kiềm mạnh để tạo kết tủa do ở môi trường kiềm mạnh sẽ
tạo kết tủa Mg(OH)2 (ở pH khoảng 10)
+Nhận biết dung dịch MgSO4 10% đã dư khi nhỏ vào mà dung dịch vẫn trong suốt và không tạo kết tủa nữa
+Không được dùng tủ sấy để làm khô kết tủa do muối này khử nước ở 40, nếu dùng tủ
sấy thì sẽ sinh ra các muối khác ngậm ít nước hơn hoặc muối bị nhiệt phân → kết quả định lượng bị sai.
+Phải dùng phễu áp suất kém để rút nước kết hợp với isopropyl ancol để chất rắn khô
nhanh hơn, do isopropyl ancol bay hơi nhanh kéo theo nước cùng bay hơi. Có thể sử
dụng ancol khác như etanol để làm khô nhanh hơn. lOMoARcPSD|45316467
_Định lượng phospho (tính khối lượng P2O5):
Cân khối lượng muối NH4MgPO4.6H2O → Tính số mol muối → Bảo toàn nguyên tố
P để tính ra số mol P2O5 → Tính khối lượng P2O5 → Tính % P2O5 trong mẫu = +Độ lệch chuẩn:
+Nếu muối thu được có chứa các muối ngậm ít hơn 6 nước thì số mol P tính được bé
hơn số mol P thực tế (do vẫn dùng khối lượng mol của NH4MgPO4.6H2O để tính
trong khi khối lượng muối không đổi) → Khối lượng P2O5 tính được bé hơn khối
lượng P2O5 thực tế → % P2O5 trong mẫu tính được thấp hơn thực tế
_Thử tính chất của sản phẩm: +Đốt mẫu kết tủa: Phương trình
Hiện tượng: quỳ tím ở trên thành ống nghiệm hóa xanh, pH > 7, khí có mùi khai
nhẹ, có hơi nước bám lên thành ống nghiệm
% khối lượng so với ban đầu = , có sự khác biệt giữa lý thuyết và thực tế (lý thuyết
thấp hơn thực tế) do mẫu chưa đốt hoàn toàn 6. T
ổng hợp phèn chua
_Công thức chung của phèn:
+M3+ được hydrat mạnh hơn tại sao ? _Các bước tiến hành:
+Chuẩn bị mấu nhôm: chà sạch nhãn in → rửa sạch → làm khô => để tránh lẫn tạp chất
+Hòa tan nhôm bằng dd KOH 4M Phương trình phản ứng:
Phản ứng tỏa nhiệt, sinh nhiều bọt khí hydro nên cần khuấy để phá bọt khí, chống
trào ra ngoài và không cần đun nóng
Chú ý cần duy trì ½ đến ¾ thể tích ban đầu bằng nước khử ion. Phản ứng kết thúc khi không thấy bọt khí nữa lOMoARcPSD|45316467
Dùng mảnh nhôm lớn làm thời gian hoàn thành thí nghiệm lâu hơn do diện tích tiếp
xúc của mảnh nhôm lớn với KOH ít hơn so với mảnh nhôm nhỏ. Việc sử dụng mảnh
nhôm lớn không làm ảnh hưởng đến hiệu suất của phản ứng
+Lọc hỗn hợp để loại bỏ tạp chất
+Tạo thành nhôm hydroxit bằng cách cho thêm H2SO4 6M Phương trình phản ứng:
Phản ứng tỏa nhiệt, có kết tủa keo nhôm hydroxit
+Hòa tan nhôm hydroxit bằng cách cho hết lượng H2SO4 6M còn
lại Phương trình phản ứng: ( vẫn còn tồn tại trong dung dịch)
Nếu tính cả lượng từ đầu:
Khuấy kỹ để hệ lỏng trở lại (không còn tủa keo nhôm
hydroxit) +Kết tinh phèn: ngừng đun → làm nguội → làm lạnh hoặc
Có thể thêm mầm tinh thể để quá trình kết tinh nhanh
hơn +Cô lập và rửa tinh thể phèn:
Rửa tinh thể phèn bằng etanol 96% thể tích chứ không được rửa bằng nước khử ion vì
tinh thể tan trong nước nhưng không tan trong etanol nên khi rửa bằng nước khử ion
sẽ khiến tinh thể bị tan một phần, rửa bằng etanol 96% thể tích vừa giúp tinh thể
không tan lại mau khô do etanol bay hơi nhanh. +Cân và tính hiệu suất
Tính cả 12 phân tử nước khi tính hiệu suất phản ứng do sản phẩm của phản ứng là tinh thể hydrat. lOMoARcPSD|45316467
_Việc sử dụng HCl 6M thay cho H2SO4 6M không tạo được phèn do không có gốc
sulfat trong dung dịch phản ứng nên sản phẩm tạo ra không có phèn
_Dùng quá nhiều H2SO4 6M sẽ khiến quá trình hòa tan tủa nhôm hydroxit được đẩy
nhanh nhưng sẽ làm ưu tiên hình thành các muối khan khiến hiệu suất tạo phèn giảm.
_Hiệu suất cao hơn 100% có thể do phèn có lẫn tạp chất, các muối khác hoặc phèn chưa khô đã mang đi cân
_Xác định lượng nước hydrat trong phèn: Nhiệt phân mẫu phèn:
Khối lượng nước = Khối lượng mẫu trước khi đốt – Khối lượng mẫu sau khi đốt
% khối lượng còn lại sau khi đốt nóng của thực tế có thể lớn hơn tính theo lý thuyết do đốt chưa hoàn toàn 7. T
ính chất của các nhóm chức hữu cơ A.Hydrocacbon _Tính chất vật lý:
+không tan trong dung môi phân cực như nước, tan trong dung môi không phân cực
+ D < 1 nên nổi trên lớp
nước _Tính chất hóa học
+Các hydrocacbon có tỉ lệ C/H cao (như có vòng thơm) khi cháy thường để lại muội
than do các hạt C chưa cháy hết
+Phản ứng cộng ở các hydrocacbon không bão hòa (có nối đôi, nối ba) Mất màu nước brom
+Phản ứng thế brom trên vòng thơm lOMoARcPSD|45316467 Mất màu nước brom
+Phản ứng với kali penmanganat (của anken): sản phẩm sinh ra có 2 nhóm ancol hoặc
acid gắn với 2C (có nối đôi trước đó) và MnO2
mất màu thuốc tím, xuất hiện kết tủa nâu B. Ancol – Phenol
_Tính chất vật lý: độ tan trong nước cao hơn so với các hydrocacbon do nhóm -OH có
khả năng tạo liên hết hydro với nước. Gốc R càng lớn thì độ tan càng giảm _Tính chất hóa học
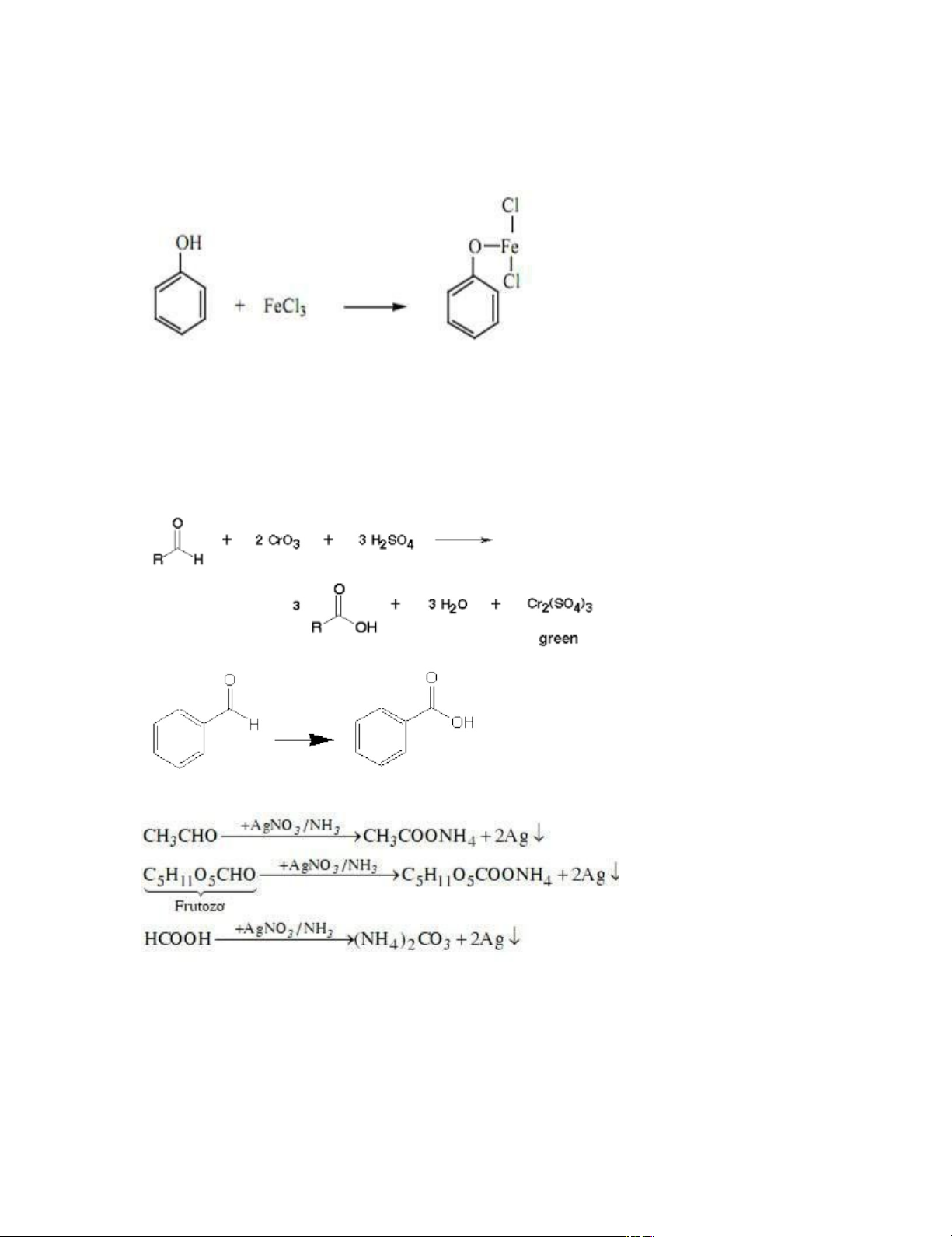
+Phản ứng với Chromic acid: sản phẩm có acid (đối với ancol bậc 1) và ketone (đối
với ancol bậc 2), ancol bậc 3 không có phản ứng còn phenol thì bị oxi hóa thành nhựa màu nâu
Màu cam/nâu đỏ của chrome 6+ chuyển thành màu xanh lục của chrome 3+
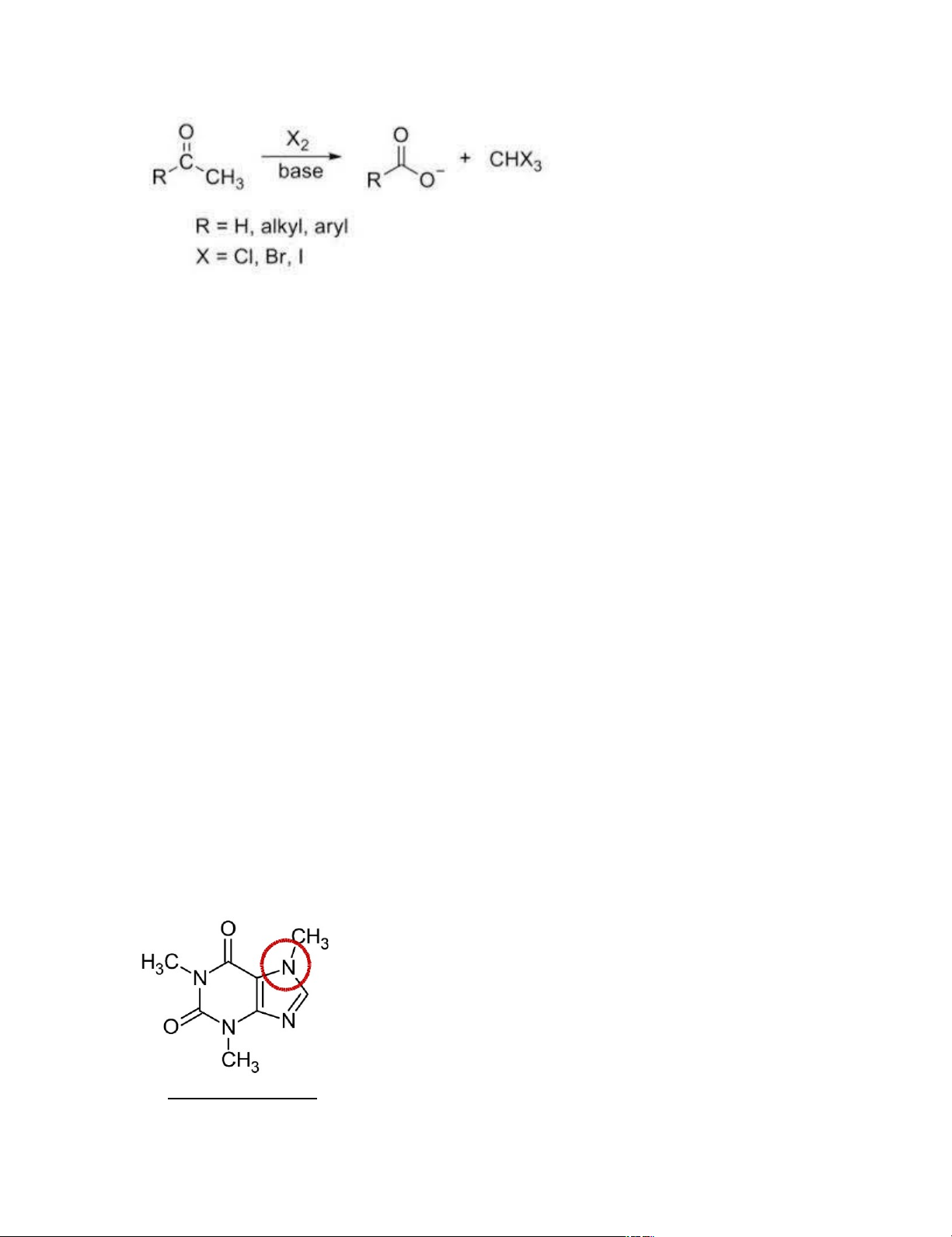
+Phản ứng tạo iodoform: chỉ ancol có nhóm RCH(CH3)OH mới có phản ứng
Iodoform có màu vàng đặc trưng lOMoARcPSD|45316467
+Phản ứng của phenol với dd sắt (III): phản ứng đặc trưng để nhận diện phenol
Phenol có tính acid mạnh hơn ancol + HCl
màu vàng nhạt của Fe (III) thay bằng màu tím của hợp chất C. Aldehyde – Ketone
+Aldehyde có phản ứng với chromic acid còn ketone thì không
Aldehyde có phản ứng tráng gương (với thuốc thử Tollen)
+Phản ứng tạo iodoform của metylketone lOMoARcPSD|45316467 D.Cacboxylic acid – Ester
_Cacboxylic acid là các hợp chất có dạng RCOOH, là acid yếu, phân ly một phần
trong nước, độ tan tùy thuộc vào gốc R. Có phản ứng trung hòa với các base, dạng
muối tan tốt trong nước.
_Ester có dạng RCOOR’ sinh ra khi cacboxylic acid tác dụng với ancol dưới xúc tác
acid. Thường có mùi thơm: +Etyl butyrate có mùi dứa
+Metyl salyxylate có mùi salonpas (mùi khuynh diệp) E.Amine
_Được coi là dẫn xuất của amoniac, có mùi tanh. Amine nhỏ tan tốt trong nước làm
dung dịch có tính kiềm, nếu amine không tan trong nước thì dạng muối của nó tan tốt
trong nước => amine làm thuốc chữa bệnh thường dùng dưới dạng muối Câu hỏi
_Tách naphtalen và benzoic acid:
Cho tác dụng với NaOH → đưa benzoic acid về dạng muối Natri benzoate tan trong
nước → thêm nước vào thì naphtalen không tan trong nước sẽ được tách ra → cho
natri benzoate tác dụng với HCl để trả về benzoic acid (+ NaCl)
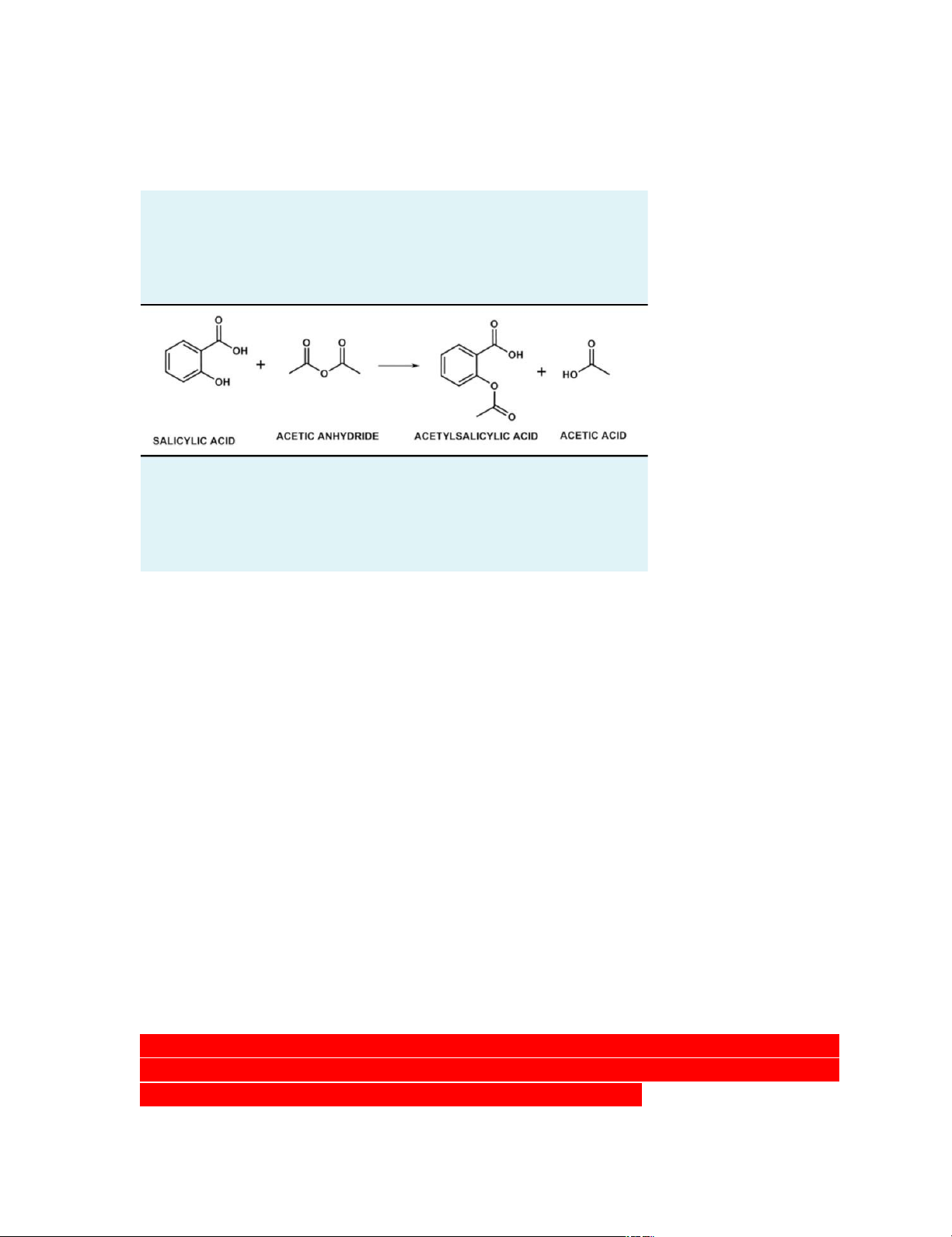
_Nitơ trong cấu trúc của caffein gây tính kiềm: 8. T ổng hợp aspirin lOMoARcPSD|45316467 _Tiến hành: +Thực hiện phản ứng:
Xúc tác H2SO4 đậm đặc: hút nước, tạo môi trường acid cho phản ứng xảy ra
+Thủy phân tác chất còn dư: dùng nước khử ion để phản ứng với acetic anhydride dư
do acetic anhydride + nước → acetic acid
+Tách aspirin rắn từ dung dịch: dùng hệ thống lọc áp suất thường (đồng thời loại bỏ
các chất tan trong nước như acetic acid)
+Kết tinh lại aspirin: cho thêm etanol vào tinh thể còn ướt để hòa tan → cho thêm
nước khử ion để dễ tinh thể dễ kết tinh (do aspirin tan tốt trong etanol nhưng tan kém
trong nước) → sẽ thấy dd đục lại khi cho thêm nước → làm lạnh
Salicylic acid dư cũng tan tốt trong etanol nên dùng etanol hòa tan và loại bỏ salixylic acid dư.
+Lọc và làm khô tinh thể aspirin
+Kiểm tra độ tinh chất của tinh thể aspirin: dùng dd sắt (III)
Nếu còn gốc phenol → màu tím
Nếu không còn gốc phenol → màu vàng nhạt (của dd sắt (III))
_Nếu sử dụng acetic anhydride để trong kho quá lâu, không đậy kín thì acetic
anhydride sẽ phản ứng với hơi nước trong không khí tạo thành acetic acid, làm giảm
độ tinh khiết của acetic anhydride → giảm hiệu suất phản ứng lOMoARcPSD|45316467 9. Xà
phòng và chất tẩy rửa
_Xà phòng là muối Natri (rắn) hoặc Kali (lỏng) của acid béo
_Xà phòng thường có tính base do gốc (là base liên hợp của acid yếu: RCOOH) có tính base _Tiến hành:
+Trộn dầu thực vật, etanol và dung dịch NaOH
6M +Đưa lên bếp đun và khuấy đều Phương trình
Etanol không tham gia vào phản ứng nhưng nó là môi trường giúp hòa tan NaOH và
dầu → giúp dầu và NaOH gặp nhau và phản ứng (dầu không phân cực còn NaOH
phân cực nên không có etanol thì sẽ bị phân lớp, không trộn lẫn vào nhau → khó phản
ứng) → giúp phản ứng diễn ra nhanh hơn.
+Để nguội → Cho thêm dd NaCl bão hòa để tách xà phòng → Làm lạnh
Xà phòng ít tan trong dd NaCl bão hòa → dễ kết tinh
Cho dd NaCl bão hòa vào làm tăng tỉ trọng của hỗn hợp → xà phòng dễ nổi lên
Giúp tách xà phòng ra khỏi nước và glycerol (glycerol tạo liên kết Hydro với nước nên tan trong nước)
+Lọc áp suất kém - Rửa xà phòng bằng nước lạnh
Rửa xà phòng bằng nước lạnh để loại bỏ NaOH còn dư do NaOH tan tốt trong nước lạnh +Để khô trong không khí
_Xà phòng dễ bị kết tủa trong nước cứng (chứa các ion như )
_Chất tẩy rửa tổng hợp (syndet) không bị kết tủa trong nước cứng lOMoARcPSD|45316467
Alkyl và aryl sunfonate (RSO3H) không tạo các muối không tan với các ion