Preview text:
Phương trình điện li là gì? Phương trình điện li nào sau đây không đúng?
1. Hiện tượng điện li
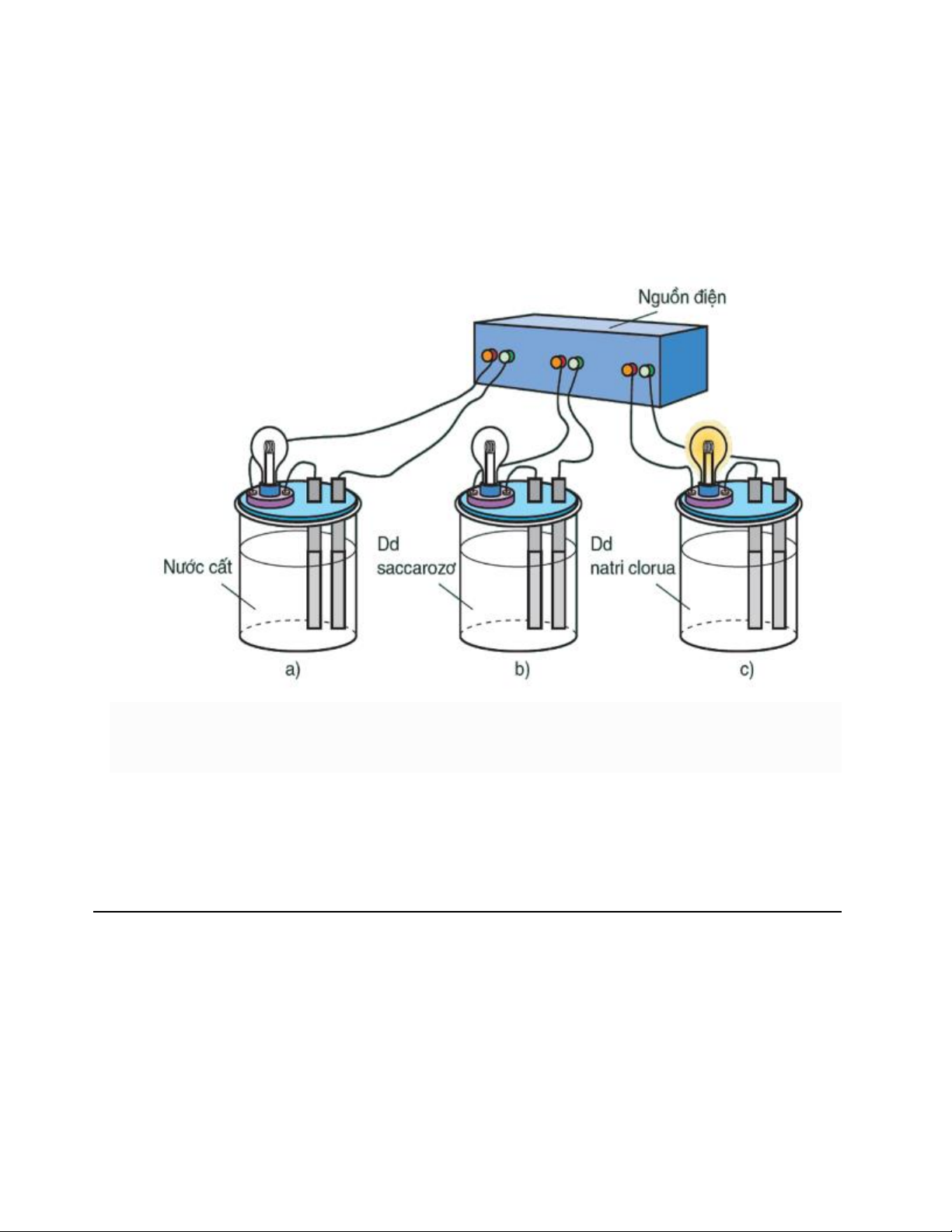
Khi nối các đầu dây dẫn điện với cùng một nguồn điện, ta chỉ thấy bóng đèn ở cốc đựng dung dịch
NaCl bật sáng. Vậy dung dịch NaCl dẫn điện, còn nước cất và dung dịch saccarozơ không dẫn điện.
Nếu làm các thí nghiệm tương tự, người ta thấy: NaCl rắn, khan; NaOH rắn, khan; các dung dịch
ancol etylic C2H5OH , glixerol C2H5(OH)3 không dẫn điện.
Ngược lại, các dung dịch axit, bazơ và muối đều dẫn điện. Nguyên nhân:
– Ngay từ năm 1887, A-rê-ni-ut (S.Arrhenius) đã giả thiết và sau này thực nghiệm đã xác nhận rằng:
– Tính dẫn điện của các dung dịch axit, bazơ và muối là do trong dung dịch của chúng có các tiểu
phân mang điện tích chuyển động tự do được gọi là các ion
– Quá trình phân li các chất trong nước ra ion là sự điện li. Những chất tan trong nước phân li ra
ion được gọi là những chất điện li .
2. Chất điện li, sự điện li và phương trình điện li
Có thể đưa ra một số khái niệm như sau:
- Chất điện li là những chất tan trong nước tạo thành dung dịch có tính dẫn điện.
- Sự điện li là sự phân li thành ion dương và ion âm của phân tử chất đện li khi tan trong nước.
- Chất không điện li khi tan trong nước tạo thành dung dịch không dẫn điện.
- Sự điện li có thể minh họa thành một phương trình phản ứng gọi là phương trình điện li hay phương trình ion hóa. Phương trình điện li:
AXIT → Cation H+ + Anion gốc axit
BAZƠ → Cation KL + Anion OH-
MUỐI → Cation KL (hoặc NH4+) + Anion gốc axit
3. Tính thuận nghịch của sự điện li - Chất điện li mạnh, chất điện li yếu
3.1. Tính thuận nghịch của sự điện li
Khái niệm: Các cation và anion chuyển động hỗn lọan nên có thể va chạm vào nhau để tái hợp
thành phân tử do đó ta nói sự điện li có tính thuận nghịch và phương trình điện li có thể là phương
trình phản ứng thuận nghịch.
3.2. Chất điện li mạnh - chất điện li yếu
a. Chất điện li mạnh:
Là chất khi tan trong nước, các phân tử hòa tan đều phân li ra ion. Ví dụ:
- axit mạnh như HCl, HNO3, H2SO4...
- bazơ mạnh như NaOH, KOH, Ba(OH)2, Ca(OH)2 …
- các muối của axit mạnh và bazơ mạnh như NaCl, KNO3, KCl, K2SO4
Khi được pha loãng thì chúng điện li hầu như hoàn toàn ta nói chúng là những chất điện li mạnh
và phương trình điện li của chúng không thuận nghịch.
b. Chất điện li yếu:
Là chất khi tan trong nước chỉ có một phần số phân tử hòa tan phân li ra ion, phần còn lại vẫn tồn
tại dưới dạng phân tử trong dung dịch. Ví dụ:
- Các axit yếu như axit hữu cơ, axit HF, axit HCN, cation NH4+…
- bazơ yếu như NH3, các amin R-NH2…
phương trình điện li của chúng là là những phương trình phản ứng thuận nghịch
4. Cân bằng điện li
Tất nhiên các phương trình phản ứng thuận nghịch như trên là một hệ cân bằng và được gọi là cân bằng điện li.
- Cân bằng điện li cũng thuộc loại cân bằng động nên theo Le Chatelier, cân bằng sẽ chuyển dời
theo chiều chống lại các nguyên nhân làm thay đổi cân bằng.
- Sự phân li càng hoàn toàn khi cân bằng càng chuyển dời theo chiều thuận, và sự dịch chuyển cân
bằng phụ thuộc vào nhiệt độ, nồng độ mol/lít của chất tan.
- Khi nhiệt độ càng tăng hay dung dịch càng loãng thì sự phân li càng hoàn toàn, cân bằng càng
chuyển dời theo chiều thuận. Vì thế ta phải so sánh độ mạnh của các chất điện li ở cùng một điều
kiện nhiệt độ và nồng độ.
Ở cùng một nhiệt độ và cùng một nồng độ mol/ lít chất điện li càng mạnh thì sự phân li càng hoàn
toàn tức là cân bằng càng chuyển dời theo chiều thuận và ngược lại chất điện li càng yếu thì sự
phân li càng không hoàn toàn, cân bằng càng chuyển dời theo chiều nghịch. 5. Độ điện li
Định lượng sức mạnh của chất điện li: Độ điện li α
Khái niệm: độ điện li α là tỉ số giữa số mol phân tử bị phân li thành ion trên tổng số mol phân tử tan trong dung dịch.
Ta có 0 ≤ α ≤ 1 Hay 0% ≤ α ≤ 100%
Chất không điện li tức là không bị phân li: α = 0
Chất điện li mạnh thì sự phân li hoàn toàn: α = 1 hay 100%
Chất điện li yếu thì sự phân li không hoàn toàn 0 < α < 1
Vậy ta có thể phát biểu cách khác: Ở cùng một nhiệt độ và cùng nồng độ mol/lít chất điện li càng
mạnh thì độ điện li α càng lớn.
Hằng số phân li của axit và bazơ yếu
- Với những axit và bazơ yếu thì sự điện li không hoàn toàn, phương trình điện li thuận nghịch.
+ Hằng số cân bằng của dung dịch axit yếu:
Vì Ka <<1, được viết dưới dạng hàm số mũ âm cơ số 10 rất bất tiện nên người ta chuyển hàm mũ
âm thành hàm logarit cơ số 10 với mệnh đề định nghĩa: pKa = - logKa
+ Hằng số cân bằng của dung dịch bazơ yếu
Vì Kb <<1 và được viết dưới dạng hàm mũ âm cơ số 10 nên ta có thể chuyển hàm mũ âm cơ số
10 qua hàm logarit cơ số 10 với định nghĩa pKb = -logKb
6. Phương trình điện li nào sau đây không đúng? A. KClO3 → K+ + ClO3- B. H3PO4 → 3H+ + PO43- C. H2S ⇄ 2H+ + S2-. D. CH3COOH ⇄ CH3COO- + H+. Đáp án đúng A.
Phương trình điện li không đúng KClO3 → K+ + ClO3-
Lý giải việc chọn đáp án đúng A là do:
– Chất điện li mạnh: Chất điện li mạnh là chất mà khi tan trong nước, các phân tử hòa tan đều phân
li ra ion. Chúng ta cùng tìm hiểu một số phương trình điện li của các chất điện li mạnh đặc trưng dưới đây: +) Axit: HCl, H2SO4, HNO3 … HCl → H+ + Cl- H2SO4 → 2H+ + SO4 +) Bazo: NaOH, Ca(OH)2 … NaOH → Na+ + OH- Ca(OH)2 → Ca2+ + 2OH- +) Muối: NaCl, CaCl2,….. NaCl → Na+ + Cl- CaCl2 → Ca2+ + 2Cl-
– Chất điện li yếu: Ngược lại với chất điện li mạnh thì chất điện li yếu là chất mà khi chúng được
hòa tan trong nước, sẽ có một số ít phần từ hòa tan phân li ra ion, phần còn lại vẫn tồn tại dưới
dạng phần tử trong dung dịch.
Các chất điê ̣n li yếu thường gặp là: axit yếu, bazo yếu, các muố i không tan, muố i dễ bị phân hủy,..
Ví dụ: HF, H2S, H2CO3, CH3COOH, NH3, Fe(OH)2, Fe(OH)3, AgCl, PbSO4…
Và đặc biệt H2O là mô ̣t chất điê ̣n li yếu H3PO4 ⇄ 3H+ + PO43- H2S ⇄ 2H+ + S2-. CH3COOH ⇄ CH3COO- + H+.
7. Một số bài tập về chất điện li, viết phương trình điện li Hướng dẫn giải: Bài 1: * Về lý thuyết:
+ Những chất tan trong nước (hoặc nóng chảy) phân li ra ion được gọi là những chất điện li. Axit,
bazơ và muối là các chất điện li.
+ Chất điện li mạnh là chất khi tan trong nước, các phân tử hoà tan đều phân li ra ion, gồm:
Các axit mạnh: HCl, HNO3, H2SO4, HBr, HI, HClO4, HClO3,…
Các dung dịch bazơ: NaOH, KOH, Ca(OH)2, Ba(OH)2,… Hầu hết các muối.
Phương trình điện li của chất điện li mạnh sử dụng mũi tên 1 chiều (→).
+ Chất điện li yếu là chất khi tan trong nước chỉ có một số phân tử hoà tan phân li thành ion, phần
còn lại vẫn tồn tại dưới dạng phân tử trong dung dịch, gồm:
Các axit trung bình và yếu như: H2S, H2CO3, H3PO4, CH3COOH…
Các bazơ không tan như: Mg(OH)2, Fe(OH)2, Fe(OH)3…
Phương trình điện li của chất điện li yếu sử dụng mũi tên 2 chiều ().
* Áp dụng giải bài tập:
– Các chất điện li mạnh: Ca(OH)2, CH3COONa, H2SO4, MgSO4, HI, NaClO3, NaHCO3, KNO3,
NH4Cl, HNO3, Na2S, HClO4, HCl, KMnO4, KHSO4, KAl(SO4)2.12H2O. Phương trình điện li:
– Các chất điện li yếu: CH3COOH, HClO, H2S, H2SO3, HNO2, H3PO4, H3PO3, HF. Phương trình điện li:
Bài 2: Dựa vào định luật bảo toàn điện tích: Tổng điện tích dương bằng tổng điện tích âm.
a) K2CrO4 b) Fe(NO3)3 c) Mg(MnO4)2 d) Al2(SO4)3
e) Na2S f) Ba(OH)2 g) NH4Cl h) CH3COONa Bài 3:
– Lí thuyết: Axit làm cho quỳ tím hoá đỏ, bazơ làm cho quỳ tím hoá xanh. Riêng với muối, còn
tuỳ vào cấu tạo mà cho các muôi trường khác nhau. Ta có bảng sau: Muối Môi trường
Tạo bới axit mạnh, bazơ mạnh Trung tính (NaCl, K2SO4,..)
Tạo bới axit mạnh, bazơ yếu Axit (AlCl3, FeSO4,…)
Tạo bới axit yếu, bazơ mạnh Bazơ (Na2CO3, K2SO3,…)
Tạo bới axit yếu, bazơ yếu
Còn tuỳ vào gốc cụ thể
– Quỳ tím hóa đỏ: NH4Cl, FeCl3, Al2(SO4)3.
– Quỳ tím hóa xanh: CH3COONa, K2CO3, Na2S, Na2CO3,
– Quỳ tím hóa không đổi màu: Ba(NO3)2 NaCl.