

















Preview text:
Chương I
THỤ TINH TRONG ỐNG NGHIỆM I. KHÁI NIỆM
Ở loài động vật có vú,sự thụ tinh (fertilization) là quá trình kết hợ của tế bào tinh
trùng còn gọi tắt là tinh trùng, tinh bào (spermatocyte) ở con đực với tế bào trứng còn gọi
tắt là trứng (noãn bào) (oocyte) ở con cái trong cơ thể mẹ (tại 1/3 phía trên của ống dẫn
trứng) để tạo ra 1 tế bào mới gọi là hợp tử (zygote) và hợp tử sẽ phát triển thành cơ thể
mới. Qúa trình này bao gồm hàng loạt biến đổi sinh lí, sinh hóa phức tạp ở tinh trùng và
ở tế bào trứng trước, trọng và sau khi chúng kết hợp với nhau, cùng với những tác động
của môi trường trong đường sinh dục của cơ thể mẹ.
Thụ tinh trong ống nghiệm (in vitro fertilization-ivf) là quá trình kết hợp giữa tinh
trùng hay còn gọi là giao tử đực với trứng hay còn gọi là giao tử cái để tạo ra hợp tử ở
ngoài cơ thể mẹ - trong phòng thí nghiệm - với môi trường sinh học nhân tạo với các điều
kiện thích hợp như: nhiệt độ, độ ẩm, độ nhớt, độ ph, áp suất thẩm thấu các chất dinh
dưỡng, các chất kích thích, các ion.v.v… cùng với các chỉ tiêu sinh học khác gần giống
như trong cơ thể mẹ (tại ống dẫn trứng ).
Ngày nay với công nghệ sản xuất phôi trong ống nghiệm (in vitro produced-IVP),
không chỉ có thụ tinh mà từ thu trứng ,nuôi trứng lớn và chín (in vitro-matured-IVM) đến
nuôi hợp tử phát triển (in vitro cultured-IVC) thành phôi dâu (morula) hoặc phôi nang
(blastocyte) cũng thực hiện trong thí nghiệm trên hầu hết các loài có vú. Tuy nhiên để
phôi tiếp tục phát triển và sinh ra cơ thể mới, người ta phải tiếp tục cấy truyền phôi
(embryo transfer-ET) vào tử cung của con cái nhận phôi, phôi được nuôi dưỡng, phát triển
thành thai và được mẹ sinh ra. Toàn bộ quá trình trên gọi là công nghệ sản xuất phôi trong
ống nghiệm-cấy phôi (hình 3)
Thụ tinh trong ống nghiệm được tiến hành nghiên cứu đầu tiên trền thỏ và là động
vật có vú đầu tiên ra đời vào năm 1954 do Dauzier và cộng tác viên tiến hành. Đến năm
1959 do Chang thực hiện và sau đó đã có nhiều động vât có vú khác sinh ra bằng phương
pháp này (bảng 1). Ở người em bé đầu tiên ra đời vào năm 1978 ở do các nhà khoa học
Steptoc và Edward, đến nay đã có hơn 10.000 em bé được ra đời trên nhiều nước bằng kĩ
thuật thụ tinh trong ống nghiệm (TTTON).
Ở Viê t Nam, ngay 30/4/1998, ba em be trao đơi tư k t
ê qua thu tinh trong ông nghiê m.
Đây la nhưng thanh công đâu tiên cua Viê t Nam. Tư đo đên nay, con sô nay đa lên đên hang trăm em. 1
Nhóm 5 Đặng Thị Nguyên 596417
Bảng 1. Một số động vật có vú ra đời bằng thụ tinh trong ống nghiệm Tác giả Loài động vật Chang, 1959 Thỏ Whittingham Chuột Toyodia và Chang, 1974 Chuột cống Steptoe và Edwards, 1978 Người Brackell và cs, 1992 Bò Hanada, 1985 Dê Shiba Hanada, 1985 Cừu Cheng và cs, 1986 Lợn
Nhiều báo cáo về kết quả đầu tiên của sự thụ tinh trong ống nghiệm ở động vật có
vú hầu hết là ở giai đoạn tinh trùng xâm nhập vào tế bào trứng hình thành tiền nhân và bắt
đầu phân chia tế bào. Ở giai đoạn đầu của sự thụ tinh tế bào trứng bắt đầu phân chia, người
ta gọi tế bào này là tế bào phôi hay phôi bào (blastomere) (bảng 2)
Hiện nay thụ tinh trong ống nghiệm đã đạt nhiều thành tựu cao hơn trên nhiều lĩnh
vực ở nhiều loài động vật có vú từ chuột, thỏ đến các gia súc lớn có sừng và nhiều động vật quý hiếm.v.v... 2
Nhóm 5 Bùi Thị Hòa 596399
Bảng 2. Những kết quả đầu tiên về thụ tinh trong ở động vật có vú Tác giả Loài động vật Kết quả đạt được Chang, 1959 Thỏ Đẻ con Dauzier & Cừu Tiền nhân Thibault, 1959 Yanagimachi &
Chuột đồng Trung Quốc Thâm nhập, tiền nhân và phân Chang, 1964 chia tế bào Whittingham, 1958 Chuột Phân chia tế bào và thai
Pikworth & Chang, Chuột đồng Trung Quốc Thâm nhập và tiền nhân 1969 Edward & cs, 1969 Người Thâm nhập và tiền nhân Hamner và cs, Mèo Phân chia tế bào 1970 Yanaghimachi, Chuột lang
Thâm nhập tiền nhân và phân 1972 chia tế bào Gould & cs, 1973 Khỉ Rhesus
Tiền nhân và phân chia tế bào Miyamoto và Chuột Thâm nhập Chang, 1973 Iritani & cs, 1975 Lợn
Thâm nhập, tiền nhân, phân chia Mahi & Yanagimachi, 1976 Chó
Thâm nhập, mở rộng đầu Iritani & Niwa, Bò Thâm nhập và tiền nhân 1977 Hanada và Chang, Hươu chuột Thâm nhập và tiền nhân 1978 Hanada và Dê Thâm nhập Isutsumi 3
Nhóm 5 Bùi Thị Hòa 596399 II. Ý NGHĨA
Thụ tinh trong ống nghiệm có rất nhiều ý nghĩa thực tiễn trong đời sống:
1. Khai thác được rất nhiều tiềm năng và sinh sản của con cái nhất là ở
những động vật quý hiếm có nguy cơ bị tiêu diệt và những gia súc cao sản. Việc khai thác
và sử dụng được tế bào trứng ở những nang trứng non trên buồng trứng của con cái đã
tăng hiệu suất sinh sản của chúng, nhất là đối với những động vật đơn thai.
2. Con vật đầu tiên ra đời bằng kĩ thuật này đã chứng tỏ con người có thể làm chủ
công nghệ sinh học sinh sản của động vật. Trải qua nhiều thập niên, những nghiên cứu về
sinh lý tế bào trứng, sinh lý của sự thụ tinh, tìm hiểu siêu cấu trúc những biến đổi tế bào
trong quá trình chín, thụ tinh cũng như tác nhân nội tại và ngoại lai thúc đẩy, ức chế các
quá trình này.v.v... Nhiều nhà khoa học không chỉ thành công trên lĩnh vực này mà trên
nhiều động vật có vú mà còn tạo nên nhiều ý tưởng tiền đề khác cao hơn, sâu hơn về bản
chất và mục tiêu của công nghệ sinh sản và công nghệ gen ở động vật. Trong nghiên cứu,
thí nghiệm về sự thụ tinh trong ống nghiệm, về tế bào trứng, tế bào phôi, nhiều nghiên
cứu, thí nghiệm khác về nhân phôi, lai ghép phôi, nhân bản vô tính, cấy ghép nhân-
gen.v.v... cũng đan xen, mắc nối và dựa vào nhận xét ban đầu, vật liệu ban đầu, bước đi
ban đầu của kỹ thuật sản xuất phôi trong ống nghiệm mà một thành tựu có ý nghĩa lịch sử
làm chấn động dư luận thế giới đó là sự ra đời của cừu Dolly. Con cừa Dolly ra đời năm
1997 đã tạo nên một cuộc cách mạng trong công nghệ sinh học vào cuối thế kỷ XX, đến
nay đã nhân bản thành công năm loài động vật.
3. Trong chăn nuôi gia súc, sản xuất phôi trong ống nghiệm cùng với cấy truyền phôi
(IVP-ET) đã góp phần tham gia vào quá trình chọn lọc, nhân giống lai tạo giống, nhanh
chóng đạt được năng suất cao về sữa, thịt, tăng hiệu quả công tác giông do tạo được nhiều
phôi của các cặp đực cái cao sản mà có nhiều đời sau để kiểm tra, giúp cho việc đánh giá
con vật sớm hơn, rút ngắn khoảng cách giữa các thế hệ, nhất là ở gia súc có vòng đời và
chu kì sinh sản dài như trâu, bò, ngựa v.v... Sự thụ tinh trong ống nghiệm cùng với những
phương pháp kỹ thuật xác đinh giới tính và nhân phôi, người ta có thể tạo đàn gia súc đực-
cái theo ý muốn như trong chăn nuôi lấy sữa có thể tạo đàn bò cái cho sữa có số lượng và
chất lượng theo yêu cầu. Với kỹ thuật đông lạnh, các sản phẩm sinh học ngày càng hiện
đại, người ta có thể xây dựng ngân hàng gen thông qua việc bảo quản đông lạnh tế bào
trứng cũng như tế bào phôi v.v... tạo điều kiện thuận lợi cho việc trao đổi vật liệu sinh học
sinh sản, vật liệu di truyền phục vụ cho công tác giống, sinh sản trên phạm vi rộng lớn. 4
Nhóm 5 Bùi Thị Hòa 596399
4. Sự thụ tinh trong ống nghiệm giúp cho người làm công tác kỹ thuật đánh giá nhanh
được khả năng thụ tinh các con đực giống khác nhau.
5. Sự làm chủ về nuôi trứng chín (in vitro maturation –IVM) là sự thụ tinh trong ống
nghiệm (IVF) đã cho phép cung cấp được cho các nhà nghiên cứu một số lượng lớn các
phôi với giá thành hạ (Louis-Marie Houdebine, 1992).
6. Ở người thụ tinh trong ống nghiệm đã giúp cho những vợ chồng không có khả năng
sinh đẻ do ống dẫn trứng không có khả năng đảm bảo các điều kiện thụ tinh hoặc trúng
không gặp được tinh trùng do viêm tắc chai cứng v.v... trong buồng trứng vẫn hoạt động
bình thường và tử cung có đầy đủ điều kiện tiếp nhận và nuôi dưỡng phôi - thai và đẻ con.
Nguyên nhân vô sinh có thể do người chồng như khả năng sinh tinh kém, số lượng hoạt
động quá thấp v.v... không đảm bảo số lượng tinh trùng/trứng (khoảng 50000 tinh
trùng/trứng), người ta có thể tiến hành công nghệ vi tiêm tinh trùng vào tế bào trứng
(intracytoplasmic sperm injection-ICSI).
7.Sự thụ tinh trong ống nghiệm có thể thực hiện bất cứ lúc nào nếu có trứng và tinh
trùng đủ điều kiện kết hợp với nhau đẻ hình thành hợp tử. Đến nay, ở người có tỉ lệ sinh
con ra còn sống do thụ tinh trong ống nghiệm đạt từ 15-17% số ca điều trị, những bệnh
viện có thiết bị hoàn hảo và có nhiều kinh nhiệm có thể đạt đến 25%.
III. SO SÁNH SỰ THỤ TINH THÔNG THƯỜNG, TỰ NHIÊN VÀ SỰ THỤ TINH
TRONG ỐNG NGHIỆM.
Sự thụ tinh ở động vật cái đã được nghiên cứu trên nhiều mặt của nhiều loài khá kĩ
lưỡng về sự biến đổi của các tế bào sinh dục trong quá trình thụ tinh với điều kiện thích hợp của chúng.
Sau khi rụng, tế bào trừng và dịch nang trứng được hút vào loa kèn rồi vận chuyển
nhanh đến chỗ phình của ống trứng. Ở một số loài động vật có vú như trâu, bò, dê, lợn,
cừu,ngựa v.v... khi rụng, trứng ở trạng thái phân bào giảm nhiễm thứ II, đang hình thành
thoi nhiễm sắc (thể cực I của phân bào giảm nhiễm I đã ở bên ngoài chất nguyên sinh). Ở
chó, mèo, thỏ, chuột v.v... trứng rụng ở trạng thái sớm howncuar phân bào giảm nhiễm
thứ I như chó cái, mèo cái. Trong thời gian di chuyển, dịch ống phấn có tác động nhất
định đối với tế bào trứng về cơ chế hóa học, lớp tế bào vành phóng xạ của trứng cũng mất
đi một phần, bởi tế bào hình trụ trên niêm mạc ống dẫn trứng bào mòn.
Sau khi phối giống hay dẫn tinh, tế bào tinh trùng dẫn nhanh qua tử cung đến 1/3 phía
trên của ống dẫn trứng trong vòng 5-15 giờ, tùy theo loài, nhờ nhu động của tử cung, ống
dẫn trứng và hoạt lực tiến thẳng của tinh trùng. 5 Nhóm 5 Lê Thị Hà 591313
Trong quá trình di chuyển này,dịch cổ tử cung và cổ tử cung, dịch ống dẫn trứng với
nồng độ các chất hòa tan, các ion v.v.. cao đã “hoạt hóa” tinh trùng, mặt khác số lượng
tinh trùng giảm đi rất nhiều tùy theo loài từ hàng 100 triệu, thậm chí một tỷ khi đến chỗ
thắt, chỗ phình của ống dẫn chúng chỉ còn hàng trăm, hàng chục và khi thụ tinh chỉ có
một tinh trùng chui được vào tế bào trứng. Có một số thay đổi ở đầu tinh trùng (sau khi
được hoạt hóa) ngay trước lúc thâm nhập vào tế bào trứng và được gọi là phản ứng
acrosome. Sự xâm nhập ban đầu do nhiều tinh trùng chui qua lớp tế bào vành phóng xạ
bằng độ cứng của đầu và các phản ứng acrosome để giải phóng ra các enzim hyaluroisidae.
Như vậy sự thụ tinh cần có số lượng tinh trùng tăng hơn và sự chọn lọc của sự thụ tinh là
rất cao. Ở bò, mèo, chuột, tinh trùng xâm nhập vào toàn bộ tế bào trứng. Ở các gia súc
khác chỉ có đầu, cổ tinh trùng còn phần đuôi tinh trùng bị đứt ở ngoài và bị thoái hóa.
Thực chất của sự thoái hóa là kích thích tế bào trứng phân chia giảm phân II hoàn thành
quá trình chia của trứng. Sau khi xâm nhập vào chất nguyên sinh của tế bào trứng, đầu
tinh trùng biến hình, tăng thể tích và hình thành các nhân nguyên chui qua màng nhân của
tế bào trứng. Trong các nhân nguyên đực (của tinh trùng)
Xuất hiện các nhân nguyên cái (cầu trứng ) cũng đồng thời xuất hiện (buộc muộn hơn).
Sau đó chúng đồng hóa lẫn nhau, thực hiện AND của cha và mẹ hình thành cơ thể di
truyền của cơ thể mới mà hợp tử là tế bào đầu tiên (hình 5)
Như vậy là giữa sự thụ tinh thông thường tự nhiên và sự thụ tinh trong ống nghiệm
(Invitro), trên thực tế hiện nay về những điều kiện chung như nhiệt độ, độ pH, áp suất của
O2 và của CO2, áp suất thẩm thấu, sự cân bằng v,v,…trong môi trường nuôi là rất gần
với điều kiện vốn có trong ống dẫn trứng của con cái ở mỗi loài. Tuy nhiên một số vấn đề
khác biệt của thụ tinh trong ống nghiệm với thụ tinh thông thường cần được quan tâm là
số lượng tinh trùng được sử dụng, sự thiếu vắng của cường độ chọn lọc tự nhiên, sự kéo
dài thời gian cần thiết cho sự tiếp xúc giữa tinh trùng với trứng trước khi tinh trùng xâm
nhập vào trứng, sự cải biến 1 cách sâu sắc những điều kiện thụ tinh ở gần bên tế bào trứng,
kết quả ngay cả sự thụ tinh cũng không thể thực hiện được hoặc làm hạn chế sự phát triển
tiếp theo của phôi, thai hoặc cả đến khi sinh đẻ
1. Tăng số lượng tinh trùng cần thiết
Sự khác biệt quan trọng nhất là số lượng tinh trùng cần thiết kề sát với tế bào trứng để
thụ tinh trong ống nghiệm được thực hiện phải tăng lên nhiều lần.
Trong quá trình thụ tinh của con cái ,tất cả những nghiên cứu cho rằng số lượng tinh
trùng có mặt ở chỗ phình của ống dẫn trứng lúc trứng rụng của hầu hết các loại là khoảng
vài chục. Điều đó được xác nhận ở loài rụng trứng nhiều bởi có những trứng không còn
thụ tinh ở giữa những trúng đã được thụ tinh sau rụng trứng. Kiểm tra trên kính hiểm vi
vì lứa trứng thô trong giờ tiếp tục rụng thì tất cả trứng không còn thụ tinh cũng không có 6 Nhóm 5 Lê Thị Hà 591313
1 tinh trùng nào ở vành phóng xạ co rút lại sát tế bào trứng. Sự thụ tinh xảy ra bình thường
ở lúc dẫn tinh là 1\10.000 hay ít hơn và chỉ cho phép rất ít tinh trùng trong ống dẫn trứng,
với 375.000 tinh trùng sống bằng dẫn tinh tỉ lệ thụ thai xấp sỉ 60% (57% của 521 bò cái)
và số tinh trùng tối đa tìm thấy ở chỗ nối sừng tử cung với ống dẫn trứng là 130, ở chỗ
thắt ống dẫn trứng là 25 là ở chỗ phình của ống dẫn trứng là vài tinh trùng (Jondet, 1973) (bảng 3)
Bảng 3 : Số lượng tinh trùng ống dẫn trứng gần lúc rụng trứng ở một số loài động vật
Loài động Số
Chỗ thắt Chỗ phình Số Sự Tác giả vật giờ
của ống của ống lượng thụ sau dẫn
dẫn trứng tinh tinh khi trứng trùng phối /trứng hay dẫn trứn g Chuột >12 <1 Shalgi, Kraicer Chuột 3 5-16,X=25 1978 Chuột 8 0- Takeuchi, CS, Chuột 134,X=24 1970 Nhắt 2- Braden,Austin,19 Chuột 4-8 75,X=16,9 <1 <50% 54 Ghine 25-50 Braden,Austin,19 Chuột 9-10 1-25 100% 54 Đồng Bladau,1969 12 X=11.20 Cumin,yanagica- Chuột 0 chi,1982 Đồng 1- 4 1/2 Cumin,yanagica- 172,X=17 (50% chi,1982 Thỏ 12- ) Overstreet,cooper 16 2500- 4-10 1978 Dơi 18 4500 15 Mori,uchida,1982 12 1400- 121-135 13,4 100% Bò 10 2500 >10 100% Dauzier,1958 Bò 36 Thibault và cs Cừu 8-14 1973 Cừu 24 Thibault và Cừu 24 480-1650 17-25 cs,1967 Cừu 30 3-432 4-25 109 Hunter,1980 Lợn 5800 72% Lang,oh,1970 7
Nhóm 5 Nguyễn Thị Hương Anh 591307 Lợn 1- 1037 Dauzier ,1958 Lợn 20x10^4 Dursel và cs,1978 Lợn 4300 Rigby, 1966 Dumesdy và cs, 1955 Hunter,1972
Ngươc la i thu tinh trong ông nghiê m sô lương tinh trung so vơi thu tinh thông thương
trong tư nhiên noi chung tăng hơn nhiêu ơ đô ng vâ t co tâm voc lơn (bang 4).
Bang 4. Sô lương tinh trung thich hơp vơi ty lê thu tinh trong n ô g nghiê m Loai đông Số tinh Sô tinh Thu tinh,% Tac gia vâ t trùng/ml trung/trưn g Bo 0,25×106 1×10 - 4 105 15/75=20% Brackett,cs,1980 Bo 0,20×106 510/575=89% Fulka,Pavlok,1982 (bo cai vung Cưu 3× 106 3× 105 lạnh) Bodioli,Wright,1980 Lơn 0,5-1× 106 25-40× > 14% Inritani,Niwa,Imai,1 Chuô t 0,15-0,5× 103 10/116=8% 978 Chuô t 106 268/304=94% Niwa,Chang,1973 nhăt 0,1-0,6× 106 2-54× 103 212/273=78% Tsunoda,Chang,197 Tho 0,11× 106 18-44% 5 Tho 0,25× 106
234/620=38% Reyes va cs,1978 Chuô t 2-3× 105 32/32=100% Brackett Ghine 2-10× 106 1× 103 99/116=84% Oliphant,1975 Chuô t 1-5× 106 1 13/31=42% Yanagimachi,1972 hang Niwa,1980 Chuô t Bvister,1979 hang
Nhưng sô liê u ơ ph n
â lơn cac loai đươc nghiên cưu trong bang 4 đa chi ra răng, đê thu đươ c k t
ê qua ty lê thu tinh (%) trong n
ô g nghiê m xâp xi vơi thu tinh trong tư nhiên, mâ t
đô tinh trung không the giam dươi 1× 105 -1× 106/ml hoă c 104-105 tinh trung/trưng trong
điêu kiê n nuôi cây thông thương. Ro rang la sô lương tinh trung vơi thu tinh trong ông nghiê m tăng la c n
â thiêt. Đê tiên hanh thu tinh, vươt qua mang trong suôt tinh trung cân
phai co sư hoa t đông trao đôi ch t
â ma nh me va tang vâ n đông. Sư tăng chuyên đô ng nay 8
Nhóm 5 Nguyễn Thị Hương Anh 591307 xu t
â hiê n mô t cach tư đô ng invitro sau khi đươc san sinh ra sư hoa t hoa tinh trung nhưng
chi khi nao mât đô cua tinh trung con la i tăng lên. Trong con cai, nhưng y u ê tô ch n ô g hoa t
hóa đa bi loa i bo trong qua trinh tinh trung đi qua cô, thân va sưng tư cung. Trong ông nghiê m, ngươi ta b t
ă buô c phai loa i bo cac y u ê tô trên b n
ă g ly tâm va rưa nhưng đông thơi
cung lam ngheo tinh trung b n ă g nhưng y u
ê tô vân đô ng ma tư lâu ngươi ta đa bi t ê r n ă g,
pha loang môi trương keo theo sư mât mat nhanh chong sưc hoa t đông cua tinh trung. Như
vâ y la thu tinh trong ông nghiê m co nông đô tinh trung tăng tương ưng nêu không nhưng
yêu tô cua sư vâ n đông se không tăng lên trong môi trương thu tinh. Điêu đo chi đa t đươc trong n
ô g nghiê m khi cai ti n
ê sư pha loang môi trương hoa t hoa mô t cach hơp ly nhât, đo la lam tăng cac y u ê t
ô tăng vâ n đô ng.v.v.. giông như trong tư nhiên (in vivo).
2. Sư thiêu văng cương đô cho n lo c tư nhiên
Đa giai thich sư cân thiêt co sô lương tinh trung tăng đê thu tinh trong ông nghiê m,
điêu ma thương đươc tiên hanh trong qua trinh tinh trung di chuyên tư âm đa o hay tư cung
đên ông dân trưng hoă c chô phinh cua n
ô g dân trưng, Cohen va Ne Naughton (1974) đa
thi nghiê m dân tinh cho tho b n
ă g tinh trung cua sư phong tinh đê sinh ra mô t tho con phai
co 1,6× 107 tinh trung, tinh trung ơ tư cung la 2,7× 105 va tinh trung ơ n
ô g dân trư ng chi
co 1,04× 102. Điêu nay chi ra răng, thu tinh trong tư nhiên (in vivo) đa co sư cho n lo c rât
ma nh. Sư cho n lo c nay co vai tro v
ê chuyê hoa hinh thai va v
ê sưc hoa t đông, no cung co
nhưng đă c tinh cua khang nguyên, chi nhưng tinh trung đơi ơ n
ô g dân trưng không ki p cô
đi nh nhanh chong vơi lgG đê ba ch c u
â không nhâ n ra la vâ t la va nhơ đo ma tinh trung
cua mô t sô loai như tho co thê ơ chô phinh va loa ken 54 ngay sau khi giao phôi (theo
Gerad, Levasseur va Thibault). Ơ bo cai tơ, bo cai, dê cai va chuô t hang, sư co mă t cua
tinh trung đa kich đô ng ba ch c u
â lan tran trong tư cung nhưng không say ra ơ ông dân
trưng. Ơ bo cai, ba ch câu đa co mă t ơ tuy n
ê tư cung va thưc bao tinh trung nhưng không co ba ch c u
â nao trong cac nêp g p â cua chô n i
ô tư cung – ông dân trưng hay trong chô
tharwstneen ơ đo đa tư thiêt lâ p dư trư tinh trung.
3. Keo dai thơi gian gă p nhau giưa tinh trung vơi trưng
Sư thu tinh in vitro (trong n
ô g nghiê m) cung la mô t khac biê t so vơi in vivo (trong cơ
thê me hay trong tư nhiên). Ơ bôn loai đô ng vâ t co vu (cưu cai, bo cai, lơn cai, tho cai)
co thơi gian dai khac thương đê tinh trung gă p trưng vơi thu tinh in vitro (bang 5).
Trong thơi gian nay, mô t ph n
â quan tro ng cua tinh trung đa giai phong ra cac enzyme
ưng acrosomic hay la chêt) đang trông qua trinh phân huy t
ê bao hoă c sinh san vô tinh cua
trưng. Ngươc la i, ơ nhưng loai gă m nhâm nho, thơi gian gă p nhau cua cac t ê bao sinh du c
đên khi thu tinh in vitro la binh thương.
Như vâ y la nhưng khac biê t trên, đă c trưng nhât la mâ t đô cao, tinh trung la i r t â hoa t
đô ng trong mô t môi trương “giam ham”.v.v…cua thu tinh in vitro (so vơi in vivo), cu i ô 9
Nhóm 5 Đào Thị Minh Nguyệt 591328
cung la cơ chê tư điêu chinh sư cân băng giưa cac phân tư trong môi trương đa gây nên
hang loa t rôi loa n va đê cuôi cung co vai tinh trung may măn do nhi u
ê tinh trung khac ta o
nên thưc hiê n nhưng điêu kiê n cho phep xâm nhâ p qua mang trong suôt (zona pellucida)
va kêt hơp vơi trưng ta o nên mâm cua mô t cơ thê mơi trong phong thi nghiê m.
Bảng 5. Thời gian các tế bào sinh sản gặp nhau đến khi thụ tinh in vivo và in vitro Phương Thời Tác pháp gian giả Loài Hoạt thụ tinh kiểm động vật hóa tra Trạng thái thụ (giờ ) tinh Phương thời gian pháp (giờ) 10
Nhóm 5 Đào Thị Minh Nguyệt 591328 Lợn In vitro 5 In vitro 17 Trong kì II sớm 1 trong tử nhiều tiền nhân cung Lợn 3-5.7
In vitro 3-5.7 Tiền nhân sớm 2,3 In vitro Bò 4-6 In vitro 20- Tiền nhân -> 4 4 In vitro 24 tế bào Bò (HIS) 5 In vitro Trung kì II -> 5 18- tiền In vitro 21 nhân sớm Bò trong tử 12-18 In vitro 6 cung Tiền nhân đực Cừu 3 In vitro 1-3 sớm 7 In vitro 48 Đầu tinh trùng Cừu In vitro 12-24 In vitro phình ra -> lớn 8 hơn 2 tế bào Thỏ 14 In vitro 2,25 Đầu tinh trùng 9 10 In vitro phình ra Thỏ 13 In vitro 3-5 Trạng thái sớm 11 In vitro Thỏ <5
In vitro 0.5-1 Trạng thái sớm 12-13 In vitro Chuột 0.5-1.5 In vitro 10- Trạng thái sớm 14 hang In vitro 12 Tinh trùng ở In vitro 5 In vitro 2-4 trong chất 15 Chuột nguyên sinh của hang trứng In vitro 0.3- Tinh trùng đag 0.6 xâm nhập hoặc ở trong chất nguyên sinh của trứng
Ghi chú : (1) Iritani, Niwa, Imai, 1978; (2) Hunter, 1974; (3) Thibault, 1959; (4) Brackett
và cs 1980; (5) Iritani, Niwa, 1978; (6) Thibault tài liệu không công bố; (7) Bondioli,
wright, 1980; (8) Dauzier, Thibault, 1959; (9) Hosui và cs, 1981; (10) Soupart, Chhibault,
1967; không công bố (11) Thibault, Dauzier, 1961; (12) Thibault, 1967, (13) Brackett,
1979; (14) Yanagimachi, 1972; (15) Tsunoda, Chang, 1977. 11
Nhóm 5 Đào Thị Minh Nguyệt 591328
IV. PHƯƠNG PHÁP
Nguyên tắc chung của các phương pháp thụ tinh trong ống nghiệm là khai thác thu
nhặt buồng trứng từ con cái, tinh hoàn con đực, sau đó những tế bào trứng và tinh trùng
được xử lí, chọn lọc, phân loại, hoạt hóa, nuôi lớn, nuôi chín.v.v…rồi tạo điều kiện
cho chúng gặp nhau trong môi trường tối ưu để thụ tinh xảy ra, hợp tử được hình thành,
sau đó hợp tử phát triển thành phôi.
1. Khai thác thu thập tế bào trứng
Để có được tế bào trứng còn gọi là giao tử cái, người ta thu thập từ ống dẫn trứng sau
khi trứng rụng, từ nang trứng của buồng trứng bằng nội soi - siêu âm hoặc bằng giải phẫu
những con vật đang còn sống, từ nang trứng ở buồng trứng những con vật đã bị giết (ở lò mổ). 1.1.
Thu trứng từ ống dẫn trứng của con cái
Sau khi trứng rụng tự nhiên hoặc sau khi sử dụng các hoocmon kích thích trứng phát
triển chín và rụng, trứng thu được bằng cách này có tỷ lệ chín (phân chia giảm nhiễm,
chuẩn bị thụ tinh) cao hơn ( hình 5a). Tuy nhiên việc xác định chính xác thời gian thu
trứng ở ống dẫn trứng có ý nghĩa quan trọng, nếu muộn quá trứng đã qua thời điểm thụ
tinh thích hợp và hoàn toàn phụ thuộc vào thời gian rụng trứng ở mỗi loài. Ở bò cái sinh
sản, rụng trứng sau kết thúc động đực 10 - 14 giờ, ở cái tơ là 9 - 10 giờ. Ở ngựa rụng trứng
vào khoảng 24 giờ trước khi kết thúc động đực, ở lợn từ giữa đến cuối động đực, ở dê,
cừu vào lúc cao điểm của động đực (Lubos Holy, 1980). Để thu được trứng người ta phải
phẫu thuật để bộc lộ ống dẫn trứng và sử dụng ống thông để bơm dung dịch PBS vào ống
dẫn trứng dội rửa vài lần, sau đó tìm trứng ở dung dịch rửa và phân loại các trứng thu
được. Cách thu trứng này thường được sử dụng ở các động vật thí nghiệm. 1.2.
Thu trứng từ các nang trứng của buồng trứng
Ở động vật đang sống, thường được khai thác trứng nhiều lần để tận dụng triệt để tiềm
năng sinh sản của buồng trứng nhất là những con vật có giá trị di truyền cần được bảo tồn
hoặc ở những động vật có chu kì sinh sản dài. Những con gia súc có năng suất cao và
những tế bào trứng này bao giờ cũng có nguồn gốc của con mẹ. Sau khi chọn con cái theo
yêu cầu, người ta tiêm các hoocmon kích thích nhiều nang trứng chín và thường trứng thu
được ở trạng thái thứ cấp. Bằng kĩ thuật nội soi - siêu âm, người ta sử dụng kim dài xuyên
qua thành âm đạo chọc và tìm nang trứng chín để hút tế bào trứng. Đây là phương pháp
được sử dụng rộng rãi ở người, gia súc lớn, trên nhiều nước hoặc nội soi qua thành bụng
đối với động vật nhỏ cũng như giải phẫu bộc lộ buồng trứng giống như cách thu trứng ở
ống dẫn trứng đối với động vật thí nghiệm. 12
Nhóm 6 Phạm Thị Tuyến 581060
Đối với những động vật sắp chết hoặc gia súc ở lò mổ, người ta thu buồng trứng ngay
sau khi mổ trong điều kiện vệ sinh vô trùng và bảo quản trong môi trường thích hợp, vận
chuyển nhanh về phòng thí nghiệm và tiến hành thu trứng. Ở phương pháp này, trứng thu
được từ nang trứng còn non cần được nuôi chín đến khi đạt trạng thái có thể thụ tinh. Vì
vậy, tận thu được số lượng lớn tế bào trứng hơn các phương pháp khác, nhưng đa số trứng
không rõ nguồn gốc con mẹ. Tỷ lệ nuôi chín và thụ tinh trong ống nghiệm cao hay thấp
phụ thuộc nhiều vào chất lượng và trạng thái của trứng trong nang trứng. Những nang
trứng có đường kính lớn nên thu trứng, ở bò kích thước nang trứng 2 - 6mm trở lên, ở
người > 17mm.v.v… Phương pháp thu trứng từ buồng trứng bò hiện đang được sử dụng là:
a. Phương pháp chọc hút (follicle puncturing): dùng kim 18G và sơ ranh 5ml chọc vào
nang trứng rồi hút trứng ra.
b. Phương pháp rạch - múc (follicle dissection): dùng dao phẫu thuật rạch nang trứng
rồi múc trứng ra (dụng cụ nhỏ giống chiếc thìa).
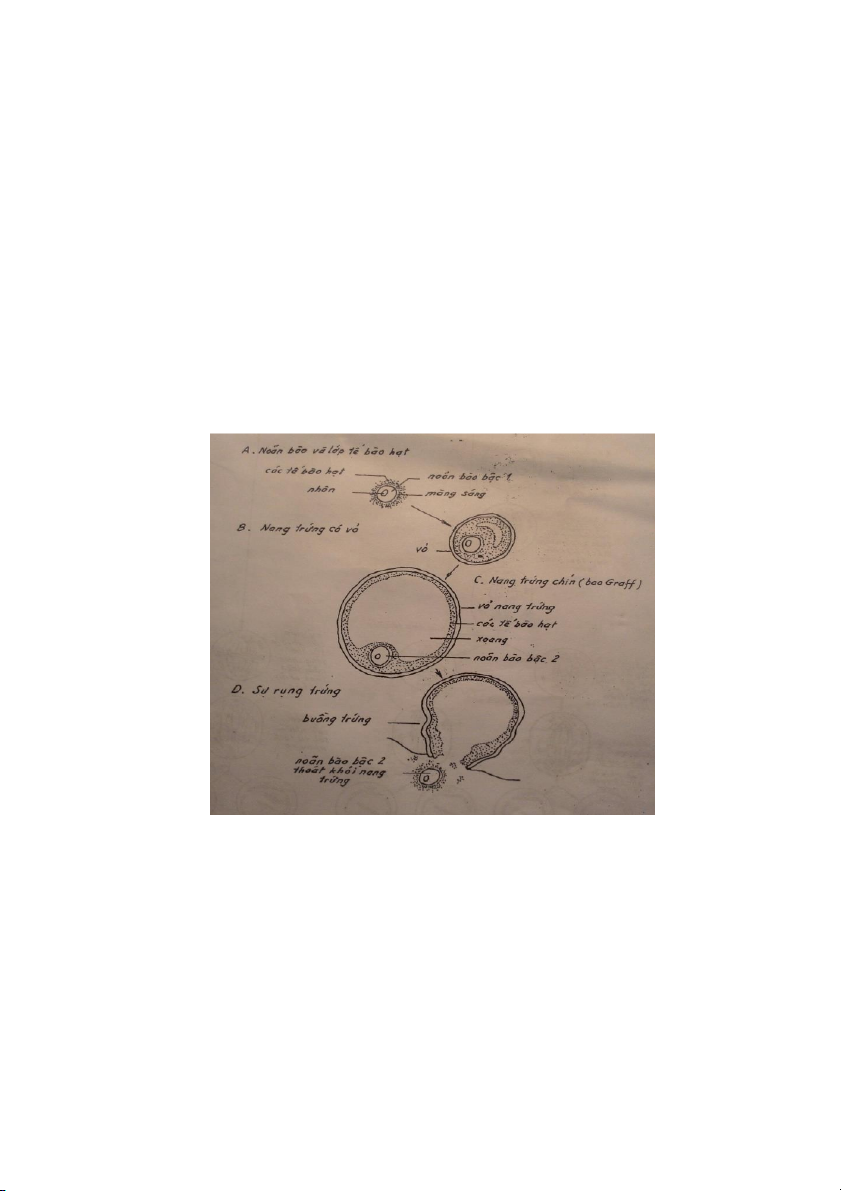
Hình 5a. Sự phát triển của nang trứng
c. Phương pháp cắt-nghiền buồng trứng (ovary slicing) 13
Nhóm 6 Phạm Thị Tuyến 581060
Trong ba phương pháp trên phương pháp rạch múc số trứng thu được nhiều hơn, tỷ lệ
thụ tinh và hợp tử phân chia cao hơn (bảng 6).
Bảng 6. Phương pháp thu trứng từ nang trứng trên buồng trứng bò
Phương pháp chọc-hút
Phương pháp rạch-múc
Số lượng bò
Số trứng IVF/bò
Số lượng bò
Số trứng IVF/bò 11 11,4 10 19,1 28 6,5 15 10,8 25 6,9 9 9,7 14 7,1 4 17.3 8 7,2 11 13,6 ∑86 7,2 49 13,4
2. Phân loại và chọn lọc tế bào trứng
Sau khi thu thập xong, tế bào trứng được phân loại và chọn lọc để nuôi chín và thụ
tinh theo hình dáng, kích thước trứng, độ dày của lớp tế bào cumulus còn gọi là tế bào gờ
trứng (cumulus cell) bao quanh trứng. Phân loại tế bào trứng theo đặc điển lớp tế bào
cumulus bao quanh trứng là thực tế và hiệu quả. Tế bào trứng được thu nhận từ buồng
trứng của bò được phân loại như sau:
- Loại A: Tế bào trứng hoàn hảo, trứng có đám tế bào cumulus chắc, dày đặc bao quanh
vòng trong suất tròn rõ, chất nguyên sinh hoan hảo.
- Loại B: Tế bào trứng có các tế bào cumulus bao bọc một phần quanh trứng.
- Loại B’: Tế bào trứng gần như trần trụi với một lớp mỏng hoặc chỉ còn dấu vết của tế bào cumulus.
- Loại C: Không có tế bào cumulus bao quanh tế bào trứng mà chỉ có các sợi huyết (fibrin).
Thông thường chỉ dùng tế bào trứng loại A và B để nuôi tới chín, sau đó thụ tinh thành
hợp tử để phát triển thành phôi (bảng 7). Đối với các phương pháp thu tế bào trứng khác
và trên các loại gia súc khác nhau sẽ có tiêu chuẩn phân loại tương ứng. 14
Nhóm 6 Nguyễn Thị Thu 581042
Bảng 7. Sự phân chia tế bào sau khi thụ tinh ở các loại tế bào trứng của bò theo tính
chất của lớp tế bào cumulus (Shioya, Y, và cs, 1988)
Loại tế bào
Số tế bào trứng nuôi cấy
Số tế bào trứng phân chia trứng
sau khi thụ tinh, % A,B 364 232 (63.7) B’ 122 36 (29.5) C 158 28 (17.7)
3. Nuôi chín tế bào trứng
Khi sử dụng tế bào trứng đã rụng đang ở ống dẫn trứng hoặc sắp rụng ở nang trứng
chín (giai đoạn phân chia chín thứ cấp) quá trình thụ tinh xảy ra bình thường. Nhưng đối
với tế bào trứng khai thác từ nang trứng non, để có thể thụ tinh được phải nuôi lớn và đạt
đến kịch thước cuối cùng, chín đến metaphase II (hình 6 và 7). Chẳng hạn, trứng chuột từ
đường kính 15-20µm bằng môi trường nhân tạo có thể nuôi lớn đến kích thước cuối cùng
70-75µm (Pedersen T, peter H, 1968) trứng lợn và bò từ 30µm đến 120-125µm (Motlik
J, và cs, 1984; Hyttel P; Fairt và cs, 1997). Ngày nay người ta còn có thể nuôi lớn và chín
tế bào nang-trứng từ buồng trứng không chỉ ở chuột mà còn ở bò…trong phòng thí nghiệm
với hệ thống nuôi hai bước. Ở quá trình lớn-chín này, tế bào trứng phải nhận được những
thông tin và vật chất cần thiết chính trong quần thể các tế bào nang trứng, môi trường nuôi
để tiến hành chín trong nhân và trong tế bào chất nhằm đảm bảo quá trình thụ tinh phân
chia tế bào, hợp tử phát triển thành phôi-thai. Vì vậy trong những kĩ thuật nuôi lớn-chín
hiện nay, tế bào trứng cùng nuôi (co-cultrure) với các tế bào trong nang trứng .v.v…đã
đem lại hiểu quả cao về chín, thụ tinh và phân chia tế bào sau thụ tinh.
4. Thu thập và hoạt hóa tinh trùng
Tinh trùng sử dụng trong thụ tinh ống nghiệm có thể được khai thác từ tinh hoàn, phó
dịch hoàn (dịch hoàn phụ) của con đực qua con đường phóng tinh hoặc bằng phẫu thuật.
Bằng đường phóng tinh, tinh trùng hòa vào các dịch của các tuyến phụ rồi vào bộ máy
sinh dục cái được lấy dịch và kiểm tra pha chế bảo tồn như với đa số gia súc. Tinh trùng
từ nguồn nào và khai thác bằng cách nào sẽ không có khả năng thụ tinh nếu như không
được hoạt hóa trong đường sinh dục cái hoặc trong phòng thí nghiệm bằng hàng loạt
những biến đổi hóa sinh học, tế bào học.v.v…trước khi xâm nhập qua màng trong suốt để
kết hợp với nhân của tế bào trứng 15
Nhóm 6 Nguyễn Thị Thu 581042
Hình 6. So sánh sự phân chia tế bào giữa giảm phân (meiosis) và nguyên phân (mitosis) 16
Nhóm 6 Nguyễn Thị Hoa 580996
Hình 7. So sánh quá trình tạo giao tử (quá trình tạo trứng và quá trình tạo tinh trùng).
Có nhiều giả thiết về hoạt hóa tinh trùng. Thuyết về màng sinh học cho rằng, màng
của tế bào tinh trùng khi chưa hoạt hóa rất vững chắc để bảo vệ tinh trùng và chống lại
tất cả các ảnh hưởng xấu trong đường sinh dục cái; còn tinh trùng đã hoạt hóa thì tính
bền vững của màng thì ngược lại. Giả thiết khác lại cho rằng, hoạt hóa tinh trùng là
quá trình xóa bỏ enzyme ức chế của acrosome. Ở mỗi loài hoạt hóa tinh trùng hoàn
thành vào lúc phần lớn tinh trùng gặp tế bào trứng. Có ý kiến khác đề cập đến màng
tinh trùng và cho rằng hoạt hóa đòi hỏi loại trừ các yếu tố ức chế đã được hình thành
ở dịch hoàn phụ, tuyến phụ của con đực và đã phủ xung quanh màng tinh trùng.
Tinh trùng đã hoạt hóa in vivo có thể thu được ở đường sinh dục con cái sau khi
phối (tử cung, ống dẫn trứng) với phương pháp bơm, rửa bằng môi trường thích hợp;
đường sinh dục con cái có thể cùng loại hoặc khác loài với tinh trùng (bò, thỏ, dê, cừu).
Trong phòng thí nghiệm với chuột nhắt, chuột cống, thỏ, người tinh trùng có thể được 17
Nhóm 6 Nguyễn Thị Hoa 580996
hoạt hóa bằng cách rửa vài lần để loại bỏ tinh thanh và nuôi cấy một thời gian trong
môi trường nuôi. Ở bò, tế bào tinh trùng được hoạt hóa bằng nhiều phương pháp khác
nhau: cho tinh trùng vào trong dung dịch chứa nồng độ ion cao đó là HIS có áp suất
thẩm thấu khoảng 380 mOsm/kg trong 5 phút rồi rửa và nuôi tiếp trong 45 phút đến 5
giờ (Brackett và ctv, 1982); bổ sung vào môi trường nuôi cấy tổng hợp cafein và Ca++
giúp cho tinh trùng tăng cường phản ứng acrosome (Hanada và ctv, 1986) hoặc heparin
(Parrish, 1986) có điều chỉnh độ pH đạt 7,4. Ở ngựa, người ta sử dụng môi trường tyrod
cải tiến (PALP) với albumin huyết thanh bò có bổ sung heparin hoặc cafein hoặc
calcium ionophore để rửa và hoạt hóa tinh trùng.v.v…
Trong công nghệ sản xuất phôi bằng thụ tinh ống nghiệm ở một số loài gia súc, việc
sử dụng tinh dịch đã qua bảo quản đông lạnh - giải đông đề hoạt hóa tinh trùng đã trở
thành phổ biến nhất là đối với bò.Vì vậy, các phương pháp hoạt hóa cần được quan
tâm hơn về mối quan hệ khả năng thụ tinh và đông lạnh tinh trùng.
5. Thụ tinh và sự phát triển sau thụ tinh
Tế bào trứng chín và tinh trùng hoạt hóa được chuyển sang môi trường thụ tinh để
thực hiện quá trình xâm nhập, hình thành tiền nhân, kết hợp hai tiền nhân tạo thành
hợp tử. Để thực hiện quá trình này cần phải có số lượng tinh trùng , thời gian tiếp xúc
và một môi trường thích hợp cho từng loài để đạt được hiệu quả thụ tinh thành hợp tử.
Sau thụ tinh, hợp tử phát triển thành phôi với tỷ lệ cao.
Nồng độ tinh trùng hoạt hóa để thụ tinh ở động vật có vú vào khoảng 105-106 tinh
trùng/ml. Tuy nhiên, tùy theo loài mà nồng độ tinh trùng hoạt hóa có thể thay đổi như sau: Bò: 5-100 x 10 /
5 ml, trung bình > 50 x 105/ml Ngựa: 5 x 106/ml, 25 x 10 / 4 trứng Lợn: 4-5 x 108-10 / 9 ml Người: 5 x 10 / 4 trứng Dê: 105-10 / 6 ml
Cũng như thụ tinh in vivo, tỷ lệ thụ tinh in vitro còn phụ thuộc cá thể con đực, có
cá thể này sản xuất ra tinh trùng khả năng thụ tinh cao hơn cá thể kia. 18
Nhóm 6 Đặng Thị Nga 581021
Bảng 8. Ảnh hưởng của cá thể bò đực giống với tỷ lệ thụ tinh đối với các
nồng độ heparin khác nhau trong môi trường BO-BSA Heparin trong
Tỷ lệ thụ tinh (số trứng có tinh trùng sâm nhập/số môi trường
trứng kiểm tra), % (µl/ml) Bò đực Oo Bò đực atsu Bò đực satu 0 13,0 (3/23) 100,0 (11/11) 54,5 (12/22) 5 100,0 (21/21) 100,0 (14/14) 94,4 (17/18) 10 90,5 (19/21) 100,0 (13/13) 100 (10/10) 20 90,9 (20/22) 100,0 (14/14) 95,2 (20/21) 50 91,3 (21/23) 100,0 (14/14) 94.1 (16/17)
Vì vậy, phát hiện ưu điểm này cùng với những điều kiện cần thiết khác sẽ mang lại
lợi ích kinh tế của công nghệ sản xuất phôi trong ống nghiệm trên động vật chăn nuôi. Bò
đực Atsu cho tinh trùng để IVF có tỷ lệ thụ tinh cao mà không cần hoạt hóa (bảng 8).
Thời gian tiếp xúc giữa tinh trùng và trứng (thời gian ủ) phụ thuộc vào thời gian và
phương thức hoạt hóa, chất lượng trứng khi nuôi chín.v.v…thông thường đạt tỷ lệ thụ tinh
cao khi chất lượng trứng chín cao, phương pháp hoạt hóa tốt hoặc thời gian hoạt hóa dài.
Chẳng hạn, ở tinh dịch bò sau giải đông được rửa và ly tâm với môi trường BO có cafein
và tinh trùng được tách ra và hoạt hóa trong môi trường BO-BSA-heparin thì thời gian ủ
trứng là 6-8 giờ; ở ngựa tinh trùng được pha loãng và ủ trong môi trường TALP-BSA-
calcium ionophore với trứng 12 giờ.v.v…
Kết quả của thụ tinh được nâng lên khi công ghệ tiêm tinh trùng vào tế bào trứng
(intracytoplasmic sperm injection - ICSI) đạt được thành công đáng kể. Phương pháp này
còn được gọi là kĩ thuật vi tiêm (microinjection). Những con vật nuôi ra đời không chỉ ở
bò, dê, cừu mà cả ở người. Trong nhiều trường hợp tinh trùng không có đủ số lượng, chất
lượng để tự xâm nhập vào trứng thì có thể áp dụng kĩ thuật này. Chẳng hạn ở người, để
giải quyết trường hợp vô sinh có nguyên nhân do người chồng, tinh trùng ít và kém hoạt
động, có thể chọn tinh trùng để tiêm vào trứng của người vợ. Ngoài ra, phương pháp ICSI
còn được thực hiện ở trường hợp do tinh trùng ít (dưới 500.000/ml). Những đôi vợ chồng
đã áp dụng kĩ thuật TTTON bình thường từ một đến hai lần nhưng thất bại cũng được áp
dụng phương thức này. Khả năng thụ tinh của ISCI cao hơn thụ TTTON bình thường ở người.
Sau khi thụ tinh, tế bào trứng được chuyển sang môi trường nuôi để hợp tử tiếp tục
phát triển. Môi trường nuôi hiện nay ở nhiều loại động vật có vú là TCM-199 bổ xung
huyết thanh bê và lọc vô trùng bằng màng lọc có kích thước 20-22 µm, trong điều kiện 19
Nhóm 6 Đặng Thị Nga 581021
thích hợp của tủ ấm CO2 v.v… Nhiều thí nghiệm đạt kết quả, phôi phát triển tốt khi tách
tế bào cumulus ra khỏi tế bào trứng trong 20-24 giờ sau thụ tinh và nếu cùng nuôi với tế
bào hạt (granulosa) đến chu kì phân bào thứ 4 là thích hợp cho khả năng phát triển thành
phôi dâu-phôi nang. Tuy nhiên, thời gian nuôi hợp tử phát triển dài hay ngắn tùy thuộc
theo loài và theo yêu cầu kĩ thuật. Chẳng hạn ở trâu, bò, dê, cừu, ngựa đến trạng thái phôi
dâu phôi nang với 32-64 tế bào để đông lạnh hoặc cấy phôi; ở người, phôi có từ 4-8 tế bào
để cấy vào tử cung v.v…
Một số chỉ tiêu đánh giá TTTON như sau:
1. Sự sâm nhập của tinh trùng vào trứng
2. Sự hình thành tiền nhân ở trong trứng
3. Sự phân chia hợp tử thành từ hai đến bốn hoặc tám tế bào
4. Sự hình thành phôi nang
5. Có thể nhiễm sắc Y trong một số phôi biểu hiện thụ tinh đa tinh trùng
6. Có đuôi tinh trùng ở xoang tế bào chất
Trong các chỉ tiêu trên, chỉ tiêu có ý nghĩa hơn cả là sự phân chia tế bào và hình
thành phôi nang, đối với công nghệ sản xuât phôi cũng như công nghệ gen, phôi dâu, phôi
nang sẽ mang lại hiệu quả cao, đem lại đầy đủ ý nghĩa của lợi ích thụ tinh trong ống
nghiệm. Và để đánh giá kết quả chọn vẹn, nhất là cấy phôi để con non ra đời là chỉ tiêu
cao nhất và có sức thuyết phục mạnh mẽ nhất.
Sơ đồ tổng quát quá trình thụ tinh trong ống nghiệm như sau:
SƠ ĐỒ QUY TRÌNH THỤ TINH TRONG ỐNG NGHIỆM 20
Nhóm 6 Đặng Thị Nga 581021