















Preview text:
HÓA HỌC ĐẠI CƯƠNG 2 Phần II
PGS.TS. Phạm Chiến Thắng Bộ môn Hóa Vô cơ CÂN BẰNG HÓA HỌC Nội dung 1. Trạng thái cân bằng 2. Hằng số cân bằng
3. Cân bằng hóa học & Năng lượng tự do Gibbs 4. Nguyên lý Le Châtelier Trạng thái cân bằng
• Trong tính toán hóa học, thường giả sử phản ứng hoàn toàn & phản ứng dừng lại khi
một trong các chất ầu phản ứng hết.
• Khi phản ứng hoàn toàn, các chất phản ứng ược cho là chuyển hóa ịnh lượng thành các
sản phẩm & lượng chất ầu quyết ịnh iểm dừng của phản ứng còn lại rất nhỏ (bằng 0).
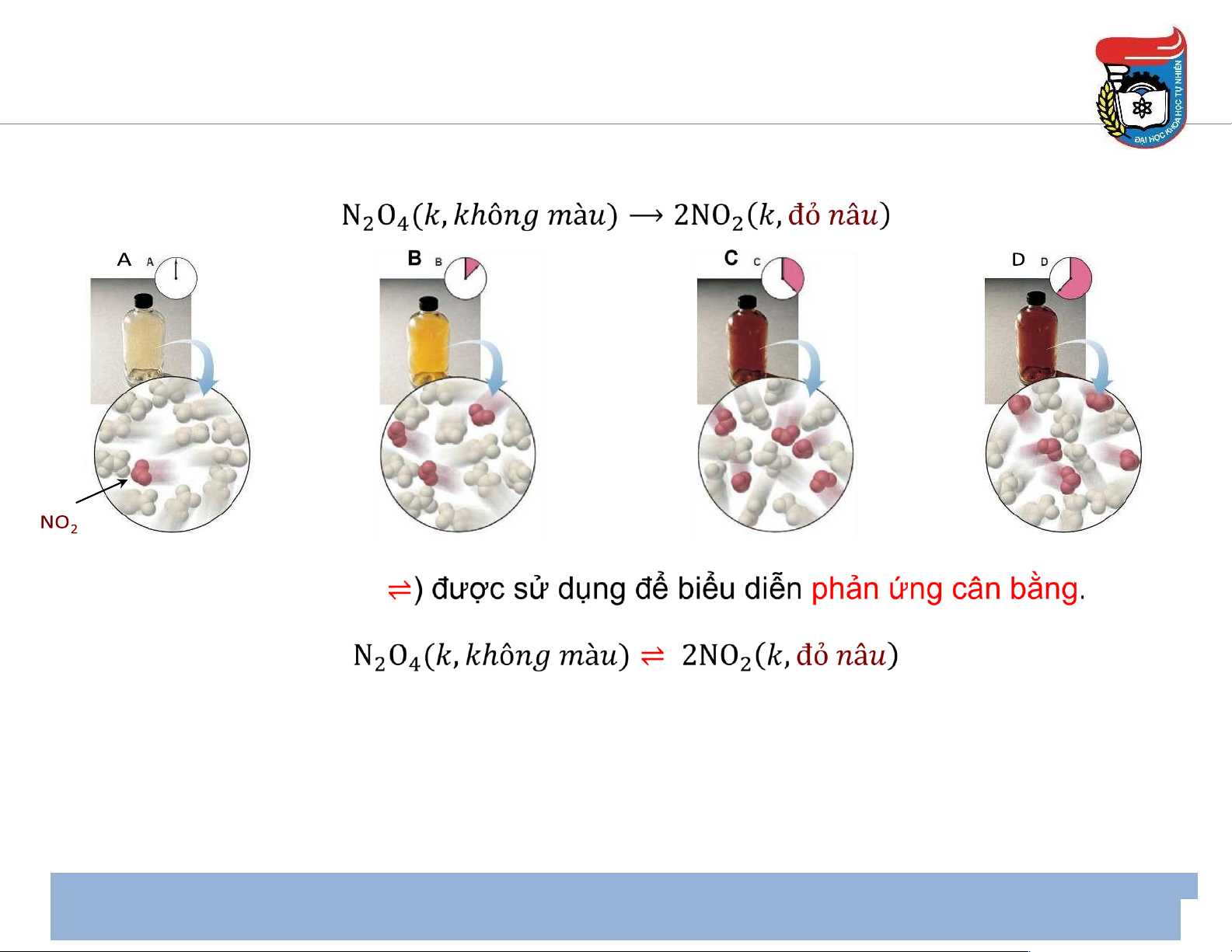
• Dấu mũi tên 1 chiều ( → )
ược sử dụng ể biểu diễn phản ứng hoàn toàn.
• Trên thực tế, nhiều phản ứng ҅không hoàn toàn՚ 3 Trạng thái cân bằng trạng thái cân bằng
• Dấu mũi tên 2 chiều (
• Khi ạt ến trạng thái cân bằng, nồng ộ chất ầu & chất sản phẩm không ổi theo thời gian,
nhưng phản ứng không dừng lại, mà phản ứng thuận & nghịch xảy ra với cùng mức ộ -- ---> cân bằng ộng. 4 Trạng thái cân bằng
• Tính chất của cân bằng hóa học:
Cân bằng hóa học là cân bằng ộng.
Cân bằng hóa học thiết lập trong hệ kín. 5 Trạng thái cân bằng
Trong cùng iều kiện (nhiệt ộ, áp suất, tổng lượng chất ...), trạng thái cân
bằng không phụ thuộc vào trạng thái ầu.
• Đại lượng ộ chuyển hóa (α) ược sử dụng ể xác ịnh ộ tiến triển của phản ứng cân bằng: 6 Trạng thái cân bằng
• Bất kỳ phản ứng nào xảy ra trong bình kín, cũng
ều ặt ến trạng thái cân bằng
1. Với phản ứng hoàn toàn, vị trí cân bằng nằm chủ yếu về phía sản phẩm, khi ó .
2. Với phản ứng hầu như không xảy ra, vị trí cân bằng nằm chủ yếu về phía chất ầu, khi ó .
3. Với phản ứng cân bằng, vị trí cân bằng nằm ở giữa, khi ó . 7 Nội dung 1. Trạng thái cân bằng 2. Hằng số cân bằng
3. Cân bằng hóa học & năng lượng tự do Gibbs 4. Nguyên lý Le Châtelier 8 Hằng số cân bằng
• Định luật tác dụng khối lượng mô tả iều kiện cân bằng: năm 1864, do 2 nhà hóa học, Cato
Maximilian Guldberg (1836–1902) & Peter Waage (1833–1900) 9 Guldberg & Waage 10 Hằng số cân bằng
• Định luật tác dụng khối lượng Xét phản ứng tổng quát:
(trong ó A, B là chất ầu; C, D là sản phẩm; j, k, l, m là hệ số tương ứng của chúng trong
phương trình ã ược cân bằng)
Tại mỗi nhiệt ộ, trạng thái cân bằng ược ặc trưng bởi một hằng số K (hằng số cân bằng) [...]: nồng
ộ (mol/L) tại trạng thái cân bằng 11
Hằng số cân bằng – Pha khí ồng thể
• Đối với hệ cân bằng ồng thể trong pha khí
Hằng số cân bằng có thể ược biểu diễn dưới dạng áp suất riêng phần tại trạng thái cân bằng
P: áp suất riêng phần (atm) tại trạng thái cân bằng
• Mối liên hệ giữa KP & KC ∆𝒏𝐤𝐡í với 12
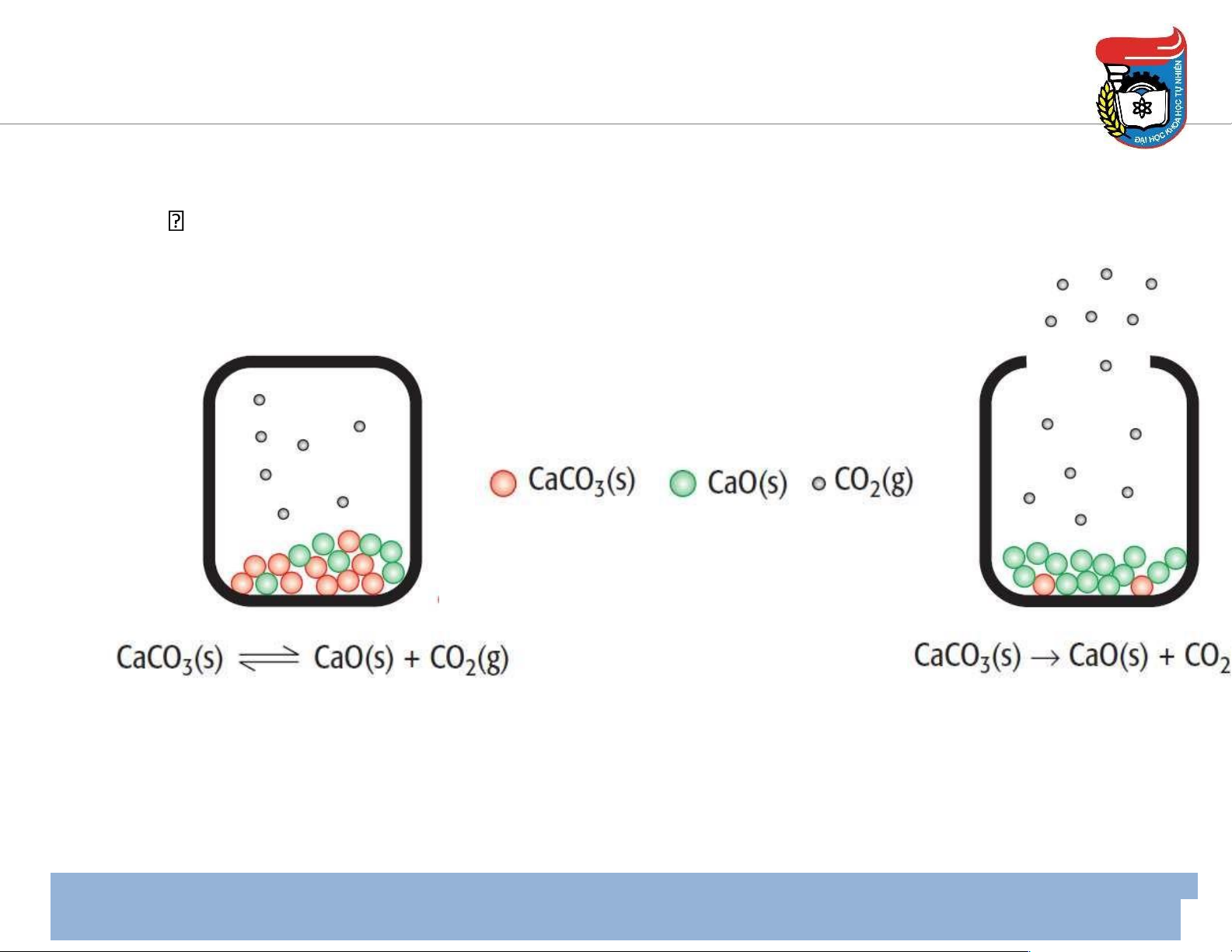
Hằng số cân bằng – Hệ dị thể
• Đối với hệ cân bằng dị thể: nồng ộ của chất rắn & chất lỏng tinh khiết không ổi → nồng
ộ của chúng không xuất hiện ( ược lược bỏ) trong biểu thức của hằng số cân bằng.
Ví dụ Viết biểu thức các hằng số cân bằng KC, KP cho các phản ứng sau 𝐏 13
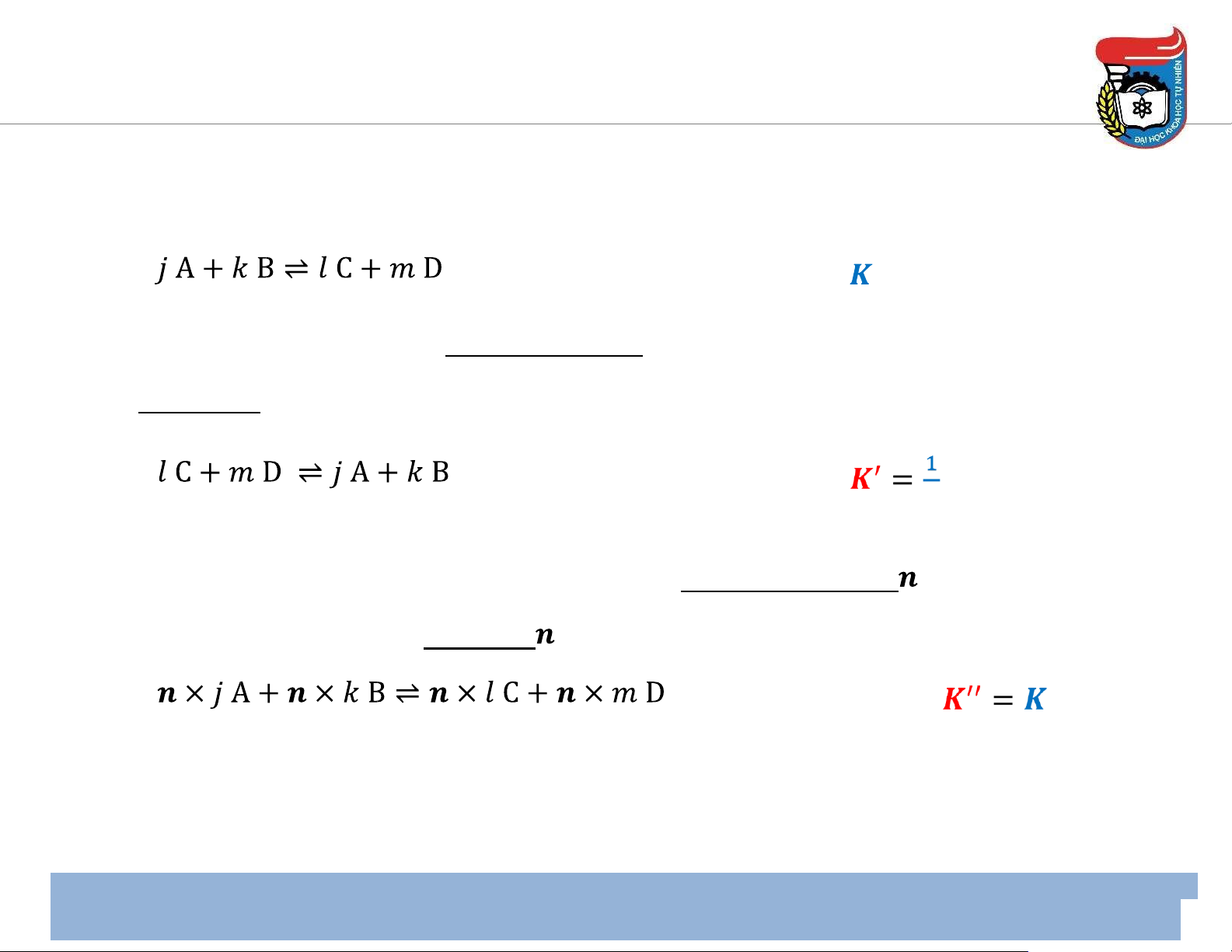
Hằng số cân bằng – Tính chất của biểu thức
• Một số tính chất của biểu thức biểu diễn hằng số cân bằng hằng số cân bằng
1. Khi phản ứng ược viết theo chiều ngược lại thì hằng số cân bằng mới bằng hằng số ban ầu nghịch ảo. hằng số cân bằng 𝑲
2. Khi hệ số của phương trình phản ứng ược ược nhân với thừa số thì hằng số cân bằng
mới bằng hằng số ban ầu lũy thừa . hằng số cân bằng 𝒏 14
Hằng số cân bằng – Tính chất
• Hằng số cân bằng K phụ thuộc:
i. Bản chất phản ứng ii. Nhiệt ộ 15
Hằng số cân bằng – Tính chất • Hằng số cân bằng K ặc trưng cho mức
ộ tiến triển của phản ứng thuận
i. Khi K lớn, tại trạng thái cân bằng hệ chứa phần lớn sản phẩm, ộ chuyển hóa cao. Đặc
biệt, khi K rất lớn, phản ứng ược coi xảy ra hoàn toàn.
ii. Khi K bé, tại trạng thái cân bằng hệ chứa phần lớn chất ầu, ộ chuyển hóa thấp. Đặc
biệt, khi K rất bé, phản ứng ược coi như không xảy ra.
iii.Khi K trung bình, tại trạng thái cân bằng hệ chứa cả chất ầu & sản phẩm với nồng ộ áng kể. 16 K lớn K bé K trung bình Thừa số phản ứng Q
• Thừa số phản ứng Q cho phép xác ịnh chiều chuyển dịch của hỗn hợp phản ứng ể ạt trạng thái cân bằng.
• Thừa số phản ứng Q ược xác ịnh bằng cách sử dụng ịnh luật tác dụng khối lượng với
nồng ộ ầu (thay vì nồng ộ cân bằng khi xác ịnh K) 17 Thừa số phản ứng Q
• Xét phản ứng tổng quát:
• Xác ịnh chiều chuyển dịch của hỗn hợp phản ứng về trạng thái cân bằng
i. Khi Q = K, hệ tại trạng thái cân bằng, không chuyển dịch.
ii. Khi Q > K, hệ chuyển dịch theo chiều nghịch tới trạng thái cân bằng. iii.Khi Q < K, hệ
chuyển dịch theo chiều thuận tới trạng thái cân bằng. 18
Giải bài toán liên quan tới hằng số cân bằng • Phương pháp giải:
1. Viết & cân bằng phương trình phản ứng.
2. Viết biểu thức hằng số cân bằng K.
3. Liệt kê các nồng ộ (áp suất) ban ầu.
4. Xác ịnh sự thay ổi cần thiết ề ạt tới cân bằng & xác ịnh nồng ộ (áp suất) cân bằng theo
nồng ộ (áp suất) ban ầu. 5. Thay thế nồng
ộ (áp suất) cân bằng vào biểu thức tính hằng số cân bằng K.
6. Kiểm tra nồng ộ cân bằng bằng cách tính hằng số cân bằng & so sánh với giá trị hằng số cân bằng K ã biết. 19 Nội dung 1. Trạng thái cân bằng 2. Hằng số cân bằng
3. Cân bằng hóa học & Năng lượng tự do Gibbs 4. Nguyên lý Le Châtelier
Cân bằng hóa học & Năng lượng tự do Gibbs
• Năng lượng tự do Gibbs hay thế ẳng nhiệt, ẳng áp (G): 20




