






Preview text:
Trùng roi ký sinh ở mô (Leishmania sp.)
TRÙNG ROI KÝ SINH MÔ Leishmania sp.
Mục tiêu học tập
1. Mô tả được đặc điểm hình thể của trùng roi ký sinh ở mô Leishmania.
2. Trình bày được chu kỳ của ký sinh trùng và đặc điểm dịch tễ của trùng roi ký sinh ở mô.
3. Phân tích được đáp ứng miễn dịch trong nhiễm trùng roi mô liên quan đến tác
hại của ký sinh trùng,
4. Trình bày các phương pháp chẩn đoán, nguyên tắc điều trị và cách phòng ngừa. 1. ĐẠI CƯƠNG
Leishmania là ký sinh trùng ký sinh nội bào và bệnh do KST này lây truyền bởi
muỗi cát (sandfly) Phlebotomus và Lutzomyia. Đây là bệnh gặp ở vùng khí hậu nhiệt
đới và cận nhiệt đới (Bắc Phi, Trung Đông, Châu Á, Nam Mỹ, Châu Âu). Theo Tổ
chức Y tế Thế giới, đây là một trong nhóm 7 bệnh nhiệt đới quan trọng và ảnh hưởng
sức khỏe quan trọng trên toàn thế giới với các biểu hiện lâm sàng đa dạng và có khả
năng gây tử vong. Bệnh gặp phổ biến khắp nơi trên thế giới trừ châu Úc, lưu hành ở 89
quốc gia với khoảng 12- 15 triệu người nhiễm và 350 triệu người có nguy cơ. Người ta
cũng ước tính rằng có 1,2 - 2 triệu ca bệnh nhiễm mới mỗi năm và KST này gây tử
vong 70.000 người mỗi năm.
Ngoài người thì động vật cũng nhiễm KST này và vì sự phổ biến của KST trong
các vật nuôi và động vật hoang dã nên Leishmaniasis được xếp vào nhóm bệnh động
vật (zoonosis). Các vùng dịch tễ của bệnh lưu hành ở Đông bắc Châu Phi, Nam Châu
Âu, Trung Đông, Châu Á, Trung và Nam Mỹ. Các thể bệnh lâm sàng đa dạng phụ
thuộc vào loài KST gây bệnh và miễn dịch của vật chủ.
Về mặt lịch sử, các thương tổn ngoài da do Leishmania được ghi nhận ở Trung
Á vào thế kỷ thứ nhất sau Công nguyên. Năm 400 - 900 sau Công nguyên, các thương
tổn ở niêm mạc do ký sinh trùng này được ghi nhận ở Ecuador và Peru. Ký sinh trùng
này lần đầu tiên được mô tả về hình thể vào năm 1885 do Cunnigham mô tả thể
Amastigote khi sinh thiết thương tổn ở da của bệnh nhân ở Ấn Độ: Cunnigham cho
rằng đây là vi nấm. Năm 1898, Borovsky bác sỹ quân y của Nga cũng quan sát thể
Amastigote khi sinh thiết thương tổn ở da và xác định ký sinh trùng này thuộc ngành
đơn bào (Protozoa). Năm 1900-1903: William Boog Leishman và Charles Donovan
phát hiện ký sinh trùng nằm trong đại thực bào của tiêu bản nhuộm Giemsa ở bệnh
nhân người Ấn Độ bị bệnh Kala – azar. 1904: Rogers nuôi cấy thành công ký sinh
trùng này trên môi trường nhân tạo và đặt tên ký sinh trùng này là Leishmania
donovani vào năm 1904. Vào năm 1924: Napei và Smith phân lập được ký sinh trùng 204
Trùng roi ký sinh ở mô (Leishmania sp.)
ở dạ dày muỗi cát (Phlebotomus) và gây bệnh thực nghiệm cho muỗi cát rồi cho muỗi
đốt chuột thì chuột bị bệnh, vì vậy vai trò vecteur truyền bệnh Leishmania của muỗi
cát được khẳng định.
2. PHÂN LOẠI, HÌNH THỂ 2.1. Phân loại
Leishmania gây bệnh ở người thuộc:
- Ngành đơn bào (Protozoa)
- Lớp trùng roi (Mastigophora) - Họ Trypanosomidae - Giống Leishmania
Giống Leishmania gồm nhiều loài (khoảng 20 loài). Về mặt hình thái học,
không thể phân biệt được các loài với nhau. Người ta phân biệt và định danh chúng
dựa vào isoenzyme, sinh học phân tử, kháng thể đơn dòng. Ngoài ra các loài khác
nhau thì gây bệnh cảnh lâm sàng khác nhau và có phân bố dịch tễ theo vùng.
- Bệnh Leishmania nội tạng: do nhóm L. donovani complex gồm: L. donovani,
L. infantum, và L. chagasi.
- Bệnh Leishmania ở da: do Leishmania major, L. tropica, L. aethiopica, nhóm
L. mexicana complex (L. mexicana, L. amazonensis, và L. venezuelensis), Leishmania
braziliensis, L. panamensis, L. peruviana, L. guyanensis, L. infantum, L. chagasi.
- Bệnh Leishmania ở da và niêm mạc: do Leishmania braziliensis, Leishmania
panamensis, L. guyanensis, hiếm gặp hơn có thể do L. infantum và L. donovani. 2.2. Hình thể
Giống Leishmania có đặc điểm là trong chu trình phát triển của nó, KST ở dưới
2 dạng khác nhau về hình thái học.
2.2.1. Dạng amastigote: gặp trong tế bào của hệ võng mô, trong các đơn bào, tổ chức
bào ở da, niêm mạc, hoặc ở trong các cơ quan nội tạng (gan, lách, tủy xương) của ký
chủ có xương sống (bao gồm người) và trong nuôi cấy tế bào. Dạng amastigote có
hình tròn hoặc bầu dục, kích thước 2-3µm.
Hình 1. Thể Amastigote trong đại thực bào
2.2.2. Dạng promastigote: gặp ở trung gian truyền bệnh và là dạng gây nhiễm. Trong
môi trường nuôi cấy, KST cũng ở dưới dạng này. Dạng promastigote có dạng hình bầu
dục, có roi, kích thước (1,5-3) µm x 15 µm. 205
Trùng roi ký sinh ở mô (Leishmania sp.)
Hình 2. Thể Promastigote từ môi trường nuôi cấy
3. CHU TRÌNH PHÁT TRIỂN
Chu trình phát triển của KST này phải qua 2 vật chủ: vật chủ vĩnh viễn là
người, vật chủ trung gian (trung gian truyền bệnh) là muỗi cát Phlebotomus. Ngoài
người là ký chủ vĩnh viễn, Leishmania còn tồn tại trên nhiều loại động vật khác hoặc
hoang dã, hoặc sống gần người (các loài gặm nhấm, chó) tuỳ theo từng nơi và từng loài Leishmania.
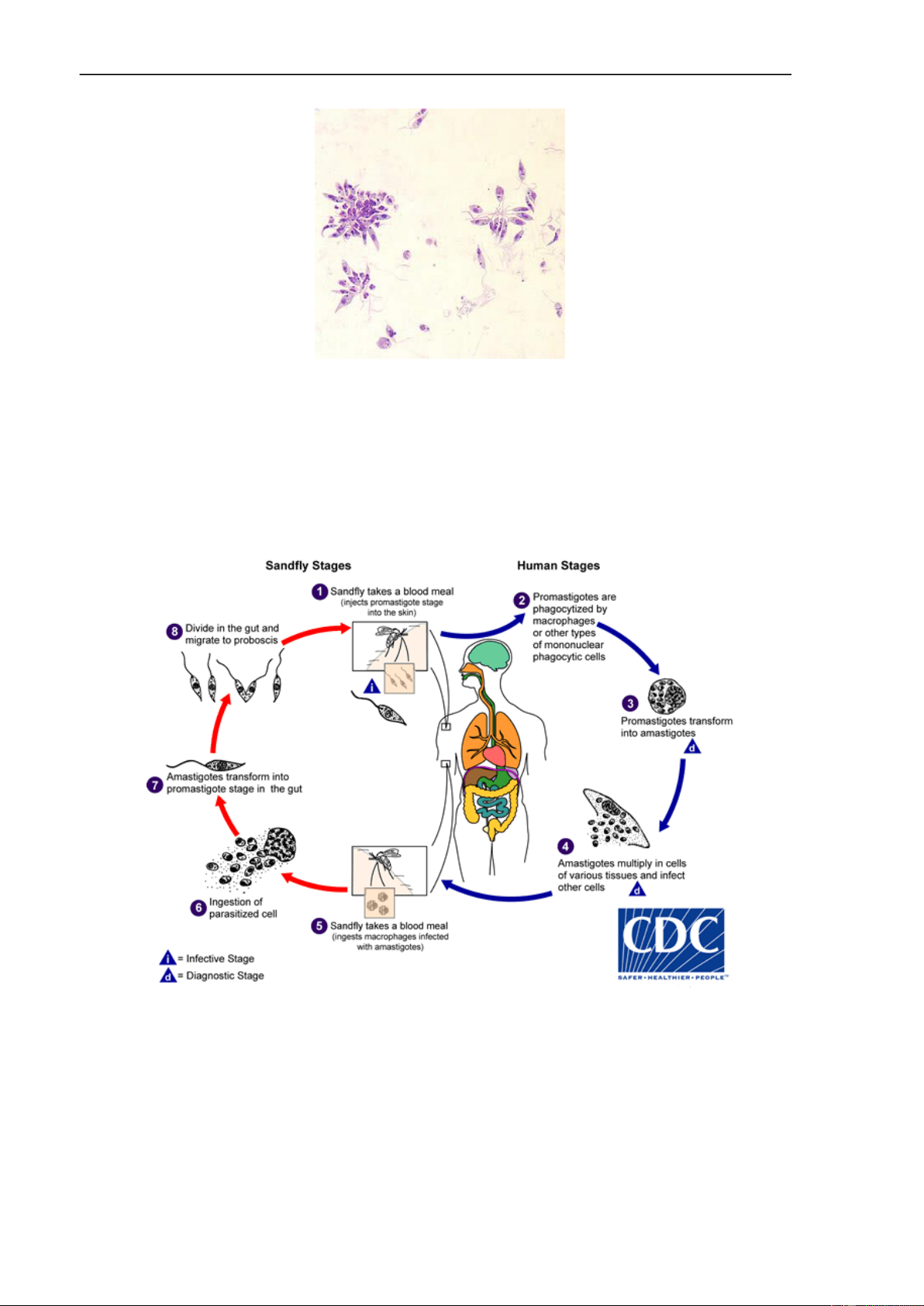
Hình 3. Chu kỳ Leishmania
(1). Khi muỗi cát cái nhiễm ký sinh trùng đốt người để hút máu sẽ truyền thể
promastigote từ vòi của chúng vào da của người.
(2). Tại vùng da xâm nhập, thể promastigote bị thực bào bởi đại thực bào và các bạch cầu đơn nhân khác.
(3). Trong bạch cầu ký sinh trùng chuyển từ dạng có roi là promastigote thành dạng không roi amastigote 206
Trùng roi ký sinh ở mô (Leishmania sp.)
(4). Thể amastigote nhân lên trong tế bào, phá vỡ tế bào và giải phòng KST lây nhiễm tế bào khác.
(5). Khi muỗi cát cái đốt người mang ký sinh trùng sẽ hút vào dạ dày muỗi máu có
chứa bạch cầu thực bào có chứa thể amastigotes.
(6). Trong dạ dày muỗi sự tiêu hóa của máu làm bạch cầu vỡ và phòng thích amastigote.
(7). Thể amastigote chuyển dạng thành promastigote trong dạ dày muỗi
(8). KST nhân lên trong dạ dày và di chuyển tập trung đến vòi muỗi, không xâm nhập
vào tuyến nước bọt. Trong vòng từ 8 đến 15 ngày, dạng này sẽ có khả năng gây nhiễm. 4. DỊCH TỄ
- Bệnh lưu hành rộng rãi khắp các châu lục (trừ châu Úc và Nam Cực), đặc biệt
là ở vùng nhiệt đới và cận nhiệt đới, có 89 quốc gia báo cáo có bệnh. Theo thông báo
của tổ chức Y tế Thế giới (WHO) có khoảng 350 triệu người sống trong vùng có nguy
cơ cao, 1 triệu người nhiễm bệnh và 600.000 trường hợp nhiễm bệnh mỗi năm. Hơn
90% ca bệnh Leishmania nội tạng gặp ở các quốc gia như: Ấn Độ, Bangladesh, Nepal, Sudan, Brazil.
- Bệnh nội tạng do KST này được xem là bệnh nhiễm trùng mới nổi và
Leishmania được đánh giá là tác nhân gây nhiễm trùng cơ hội quan trọng ở bệnh nhân
AIDS và bệnh suy giảm miễn dịch mắc phải khác có liên quan đến suy giảm đáp ứng
của tế bào lympho T, và tình trạng tái phát sau điều trị cũng gặp phổ biến ở bệnh nhân AIDS.
- Vật chủ chính của Leishmania ngoài người còn có thể là các động vật có
xương sống khác như: chó, chồn, cáo, chuột, sóc, hải ly... trừ L. donovani vật chủ
chính duy nhất là người, vì vậy yếu tố quan trọng trong dịch tễ học của bệnh
Leishmania là bệnh từ các loài động vật nói trên lây sang người.
- Bệnh lây truyền do muỗi cát, đây một loại muỗi cát rất nhỏ, kích thước
khoảng 3mm. Giống Lutzomyia gặp ở Châu Mỹ và giống Phlebotomus gặp nhiều nơi
trên thế giới. Côn trùng này hoạt động vào lúc chiều xuống đến nữa đêm. Chỉ có con
cái mới hút máu ký chủ và đốt rất đau. Ngoài ra, thể Amastigote có thể lây truyền khi truyền máu.
- Ở Việt Nam muỗi cát được phát hiện nhiều nơi như Quảng Ninh, Ninh Bình,
Vĩnh Phúc, Bắc Giang, Khánh Hòa, Quảng Ngãi. Loài Phlebotomus sergenti được
xem là vector truyền bệnh, tuy nhiên rất ít có bệnh Leishmania được ghi nhận ở Việt
Nam. Năm 1978, trường hợp Leishmania nội tạng đầu tiên được chẩn đoán ở một nữ
bệnh nhân làm việc ở Lục Nam, Bắc Giang. Năm 1984, Ở bệnh viện nhi Thuỵ Điển,
một bệnh nhi 6 tuổi được chẩn đoán leishmaniasis nội tạng. Năm 2001, 3 ca bệnh
Leishmania nội tạng được báo cáo ở bệnh viện Việt Nam – Thụy Điển, tại Uông Bí,
Quảng Ninh trên bệnh nhân HIV (+). Năm 2018, 2 ca bệnh Leishmania nội tạng được 207
Trùng roi ký sinh ở mô (Leishmania sp.)
báo cáo tại Bệnh viện Trung ương Huế và Bệnh viện Trường Đại học Y Dược Huế
trên bệnh nhân HIV đều đến từ Lệ Thủy, Quảng Bình.
5. MIỄN DỊCH TRONG NHIỄM LEISHMANIA
Biểu hiện bệnh của Leishmania phụ thuộc vào loài KST gây bệnh, phản ứng
miễn dịch của vật chủ, trong đó miễn dịch tế bào có vai trò quan trọng. Việc tương tác
giữa miễn dịch bẩm sinh và miễn dịch thu được góp phần vào đáp ứng miễn dịch
thành công trong trường hợp nhiễm Leishmania với IFNγ kích hoạt đại thực bào tiêu
diệt thể amastigote nội bào bằng cách sản xuất oxit nitric và chất oxy phản ứng trung
gian (reactive oxygen intermediates). Bên cạnh đó có một số cơ chế giúp KST tồn tại
lâu dài và trốn tránh miễn dịch.
5.1. Miễn dịch bẩm sinh
Các tế bào thực bào sẽ nhận diện KST ban đầu bởi các thụ thể Toll-like
receptors (TLRs). TLRs hiện diện trên các đại thực bào, bạch cầu đa nhân, tế bào hình
sao, tế bào giết tự nhiên (NK). Trong đó bạch cầu hạt trung tính (neutrophils) là những
tế bào đầu tiên đến vị trí muỗi cát đốt trong vòng vài phút, và có vai trò quyết định
thúc đẩy sự biệt hóa các đại thực bào thành trạng thái gây viêm hoặc chống viêm để có
thể nhận diện, thực bào và tiêu diệt KST thông qua sự tạo ra các chất chuyển hóa oxy
và giải phóng các phân tử ly giải từ hạt tế bào chất của chúng. Điều này là do
Leishmania giải phóng các yếu tố thu hút bạch cầu trung tính và kích hoạt bài tiết
chemokine / cytokine bởi bạch cầu trung tính, từ đó thu hút và kích hoạt các loại tế bào
thực bào khác. Đại thực bào có vai trò quan trọng trong miễn dịch bẩm sinh của nhiễm
Leishmania. Ngoài sự kích hoạt đại thực bào do bạch cầu hạt trung tính nói ở trên thì
protein tuyến nước bọt của muỗi cát có vai trò kích hoạt tiết IFN-γ and IL-12 bởi đại
thực bào. Các cytokin sản xuất bởi đại thực bào có vai trò quan trọng trong giai đoạn
đầu của nhiễm trùng, cụ thể là: IL-12 có vai trò chính yếu trong sự kích hoạt quá trình
biệt hóa tế bào T CD4 + đặc hiệu kháng nguyên thành các tế bào Th1 sản xuất IFNγ và
TNF , IL-12 kích hoạt tế bào giết tự nhiên và chúng lại sản xuất IFN-γ. Thí nghiệm ở
chuột cho thấy sự tiết IFN-γ có liên quan đến hiệu quả bảo vệ của tế bào gây độc T
CD8+. Mặt khác đại thực bào có vai trò giữ cân bằng IL-10 và yếu tố chuyển dạng β
(TGF-β). Điều này có tác dụng ức chế sự phát triển của tế bào Th1 và kích hoạt sự
tăng sinh của tế bào Th2 đặc hiệu với KST, vì vậy có ý nghĩa điều hòa đáp ứng miễn
dịch trong nhiễm Leishmania nhưng mặt khác lại giúp KST tồn tại trong cơ thể vật chủ.
5.2. Miễn dịch thu được
Trong tất cả các thể bệnh Leishmania, miễn dịch được kiểm soát chủ yếu bởi
các tế bào lympho T. Trong đó các tế bào lympho TCD4 dòng Th1 góp phần hiệu quả
trong việc kiểm soát ký sinh trùng bằng cách thúc đẩy khả năng của đại thực bào tiêu
diệt Leishmania nội bào thông qua việc tạo ra oxit nitric (NO). Đáp ứng miễn dịch thể 208
Trùng roi ký sinh ở mô (Leishmania sp.)
dịch với kháng thể xuất hiện trong huyết thanh bệnh nhân nhiễm Leishmania nhưng
không có ý nghĩa bảo vệ và chống tái nhiễm.
Nghiên cứu đáp ứng miễn dịch ở động vật bằng cách gây nhiễm L. donovani ghi nhận như sau:
- Đáp ứng miễn dịch thu được khi nhiễm L. donovani không triệu chứng.
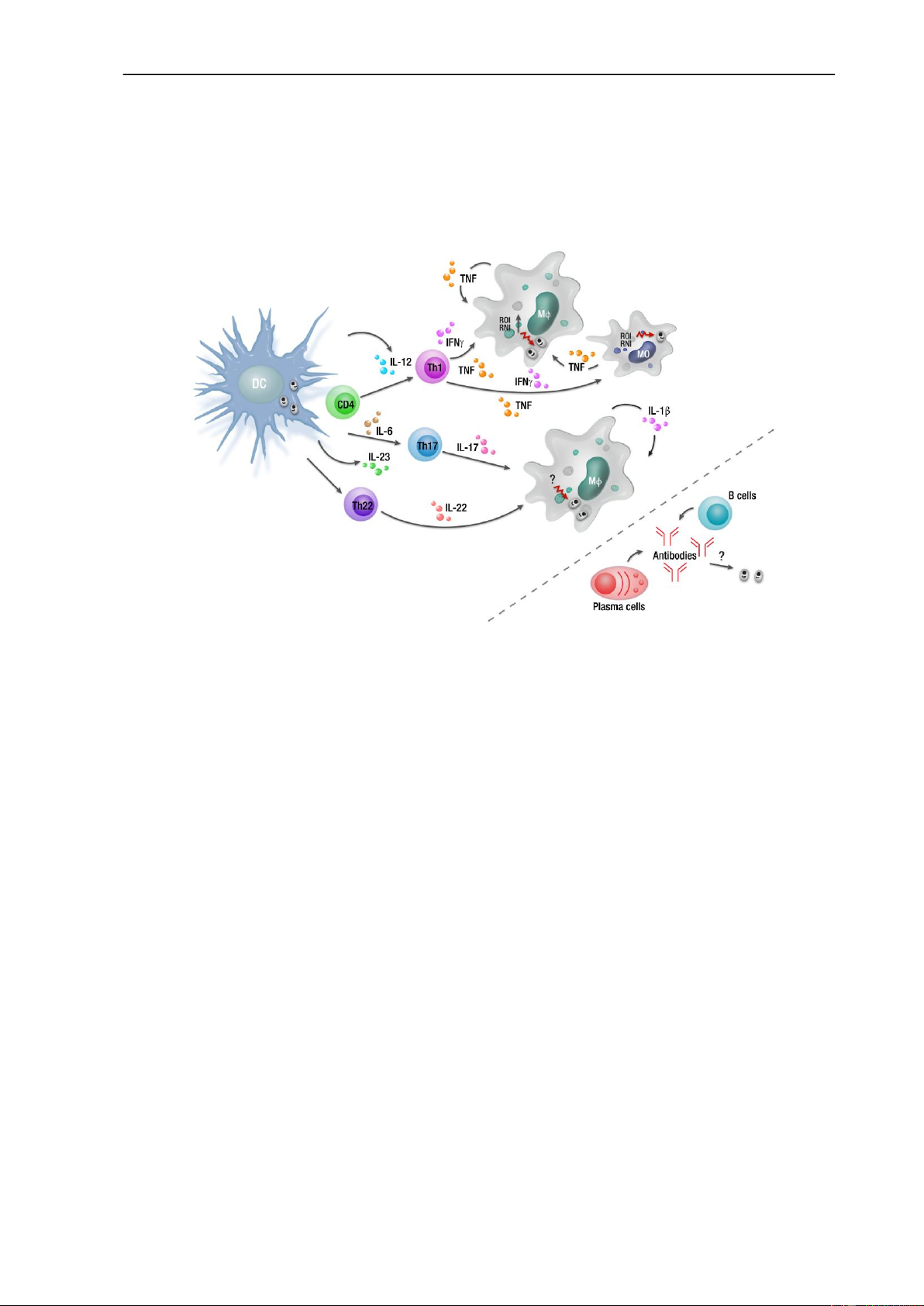
Hình 4. Đáp ứng miễn dịch thu được trong nhiễm L. donovani không triệu chứng
Các đại thực bào (Mφ) bị nhiễm KST có thể tạo ra TNF và IL-1β để đáp ứng
với nhiễm trùng L. donovani như là một phần của phản ứng miễn dịch bẩm sinh. Tuy
nhiên, việc sản xuất IL-12 từ các tế bào hình sao (Dendritic Cell-DC) cũng thúc đẩy
quá trình biệt hóa tế bào T CD4 + đặc hiệu kháng nguyên thành các tế bào Th1 sản
xuất IFNγ và TNF. Tế bào Th1 kích hoạt các đại thực bào và bạch cầu đơn nhân (MO)
bị nhiễm KST tạo ra ROI và RNI để tiêu diệt ký sinh trùng nội bào. Bên cạnh đó người
ta cũng ghi nhận vai trò của IL-23 và IL-6 do tế bào hình sao sản xuất có thể thúc đẩy
các tế bào Th17 và Th22 phát triển ở những người nhiễm bệnh không có triệu chứng,
tuy nhiên cơ chế chống ký sinh trùng qua các tập hợp tế bào này liên quan tới khi
nhiễm L. donovani vẫn chưa được biết rõ. 209
Trùng roi ký sinh ở mô (Leishmania sp.)
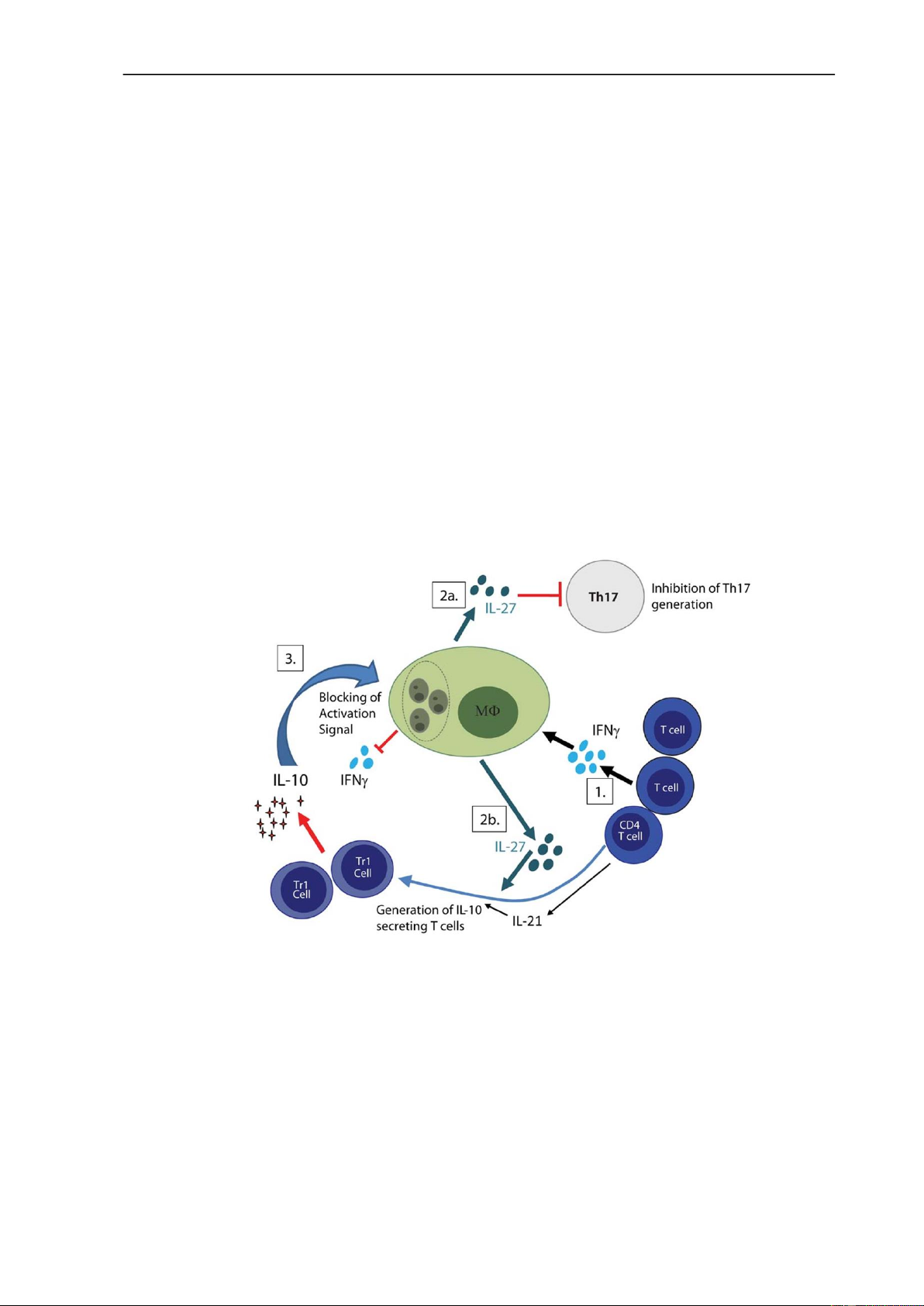
- Đáp ứng miễn dịch thu được khi nhiễm L. donovani mạn tính.
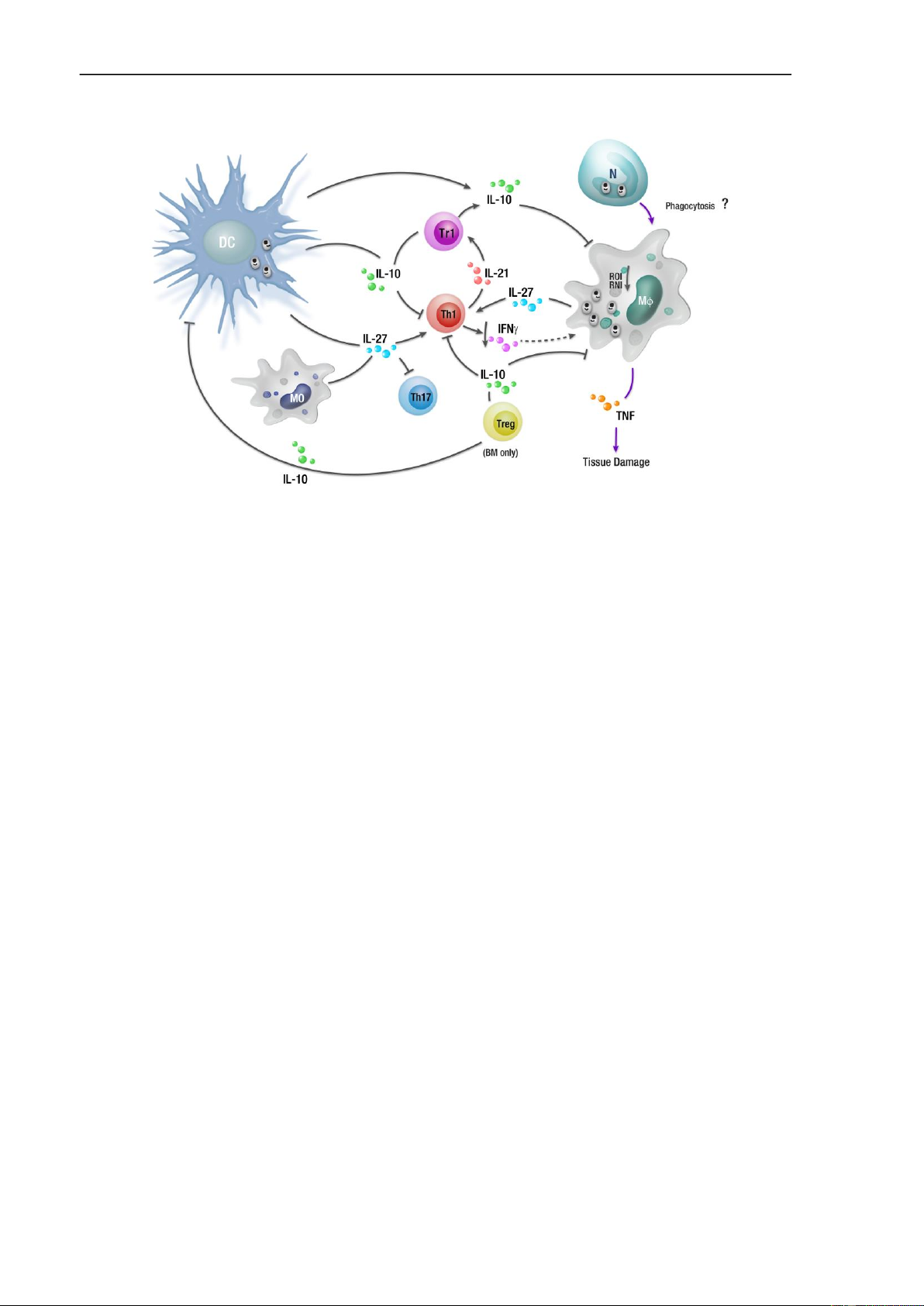
Hình 5. Đáp ứng miễn dịch thu được trong nhiễm L. donovani mạn tính
Trong quá trình nhiễm L. donovani mạn tính, các tế bào hình sao (DC) điều hòa
miễn dịch trong lách có thể tạo ra IL-10, thúc đẩy sự tăng sinh của các tế bào T điều
hòa (Tr1) tiết IL-10, cũng như ức chế các cơ chế kháng KST trong các đại thực bào và
các tế bào thực bào khác (bao gồm cả việc giảm giải phóng reactive oxygen
intermediates: ROI, và reactive nitrogen intermediates: RNI). IL-27 được sản xuất bởi
các tế bào DC điều hòa và đại thực bào, cùng với IL-21 có nguồn gốc từ tế bào T, có
thể điều khiển sự biệt hóa của các tế bào Th1 thành các tế bào Tr1, cũng như ức chế sự
phát triển của Th17. IL-10 được sản xuất bởi các tế bào Tr1 có thể ngăn chặn sự trình
diện kháng nguyên, góp phần gây rối loạn chức năng tế bào T, cũng như giảm sản xuất
IFNγ từ tế bào T CD4 +. Đã có báo cáo rằng IL-10 cũng có thể được sản xuất bởi các
tế bào Treg trong tủy xương của bệnh nhân Leishmania nội tạng.
- Vai trò của tế bào lympho T CD8: Cho đến hiện nay, người ta cho rằng không
có vai trò bảo vệ nào đối với các tế bào T CD8 + trong việc kiểm soát nhiễm trùng
Leishmania nguyên phát thể dưới da trong thí nghiệm ở chuột với liều cao ký sinh
trùng. Tuy nhiên, với nhiễm KST liều thấp, TCD8+ có vai trò trong sinh bệnh học và
miễn dịch ở nhiễm trùng tiên phát. Do đó, vai trò của các tế bào T CD8 + trong khả
năng miễn dịch với Leishmania dường như phụ thuộc vào liều ký sinh trùng được tiêm
vào, điều này có thể rất phù hợp ở người do nhiễm trùng từ vết cắn của muỗi chứa số lượng ít ký sinh trùng.
- Vai trò của tế bào T nhớ: Các tế bào T nhớ có thể được tách thành ít nhất hai
loại: các tế bào T nhớ trung tâm (Central Memory-CM), sẽ di chuyển đến bạch huyết
và giới hạn khả năng bảo vệ; và các tế bào T nhớ đáp ứng (Effector Memory-EM), di
chuyển đến các mô và thực hiện các chức năng tiêu diệt ký sinh trùng. Sau khi kích
hoạt và biệt hóa, các tế bào T nhớ trung tâm có thể biệt hóa để trở thành các tế bào T 210
Trùng roi ký sinh ở mô (Leishmania sp.)
đáp ứng và cung cấp sự bảo vệ chống lại sự tái nhiễm. Sự tồn tại của tế bào T nhớ
trung tâm không phụ thuộc vào sự hiện diện của ký sinh trùng Leishmania sống.
Những phát hiện này có liên quan rất lớn đến sự phát triển của vắc-xin chống lại bệnh
leishmania, vì việc tái kích hoạt các tế bào T nhớ trung tâm có thể là mục tiêu để vắc-
xin bất hoạt để tạo ra miễn dịch qua trung gian tế bào.
5.3. Cơ chế giúp ký sinh trùng tồn tại và trốn tránh miễn dịch
Cho đến nay một số cơ chế giúp Leishmania tồn tại lâu dài trong vật chủ và trốn
tránh miễn dịch được đề cập đến bao gồm:
5.3.1. Cơ chế điều hòa miễn dịch
Tế bào lympho T-CD4 được hoạt hóa tạo ra IFNγ. IFNγ kết hợp với IL-1β thúc
đẩy sản xuất IL-27 bởi đại thực bào. IL-27 ức chế sự sản xuất các tế bào Th17 có khả
năng bảo vệ, và IL-27 cùng với IL-21 thúc đẩy sự giải phóng các tế bào lympho T tiết
IL-10. IL-10 gây ra sự giảm sản xuất IL-12, MHC lớp II cũng như các phân tử đồng
kích thích trên các đại thực bào và khiến đại thực bào không phản ứng với các tín hiệu
hoạt hóa như IFNγ, vì vậy có ý nghĩa tạo điều kiện cho sự nhân lên của ký sinh trùng và tiến triển bệnh.
Hình 6. Cơ chế điều hòa miễn dịch giúp KST tồn tại lâu dài
5.3.2. Trốn tránh trong bạch cầu đa nhân trung tính
Leishmania có thể kéo dài thời gian lưu lại trong bạch cầu hạt trung tính bằng
cách trì hoãn sự chết tế bào được lập trình (apoptosis), mặc dù bạch cầu trung tính
chứa ký sinh trùng cuối cùng sẽ trải qua quá trình apoptosis được thực hiện bởi đại
thực bào (tế bào chủ chính của ký sinh trùng Leishmania). Tuy nhiên điều này vẫn có
lợi cho ký sinh trùng vì cho phép sự xâm nhập im lặng của Leishmania vào đại thực
bào. Đây được cho là một cơ chế trốn tránh miễn dịch góp phần vào giai đoạn đầu của
bệnh khi các phản ứng miễn dịch bảo vệ không được tạo ra. Do đó, bạch cầu hạt trung 211
Trùng roi ký sinh ở mô (Leishmania sp.)
tính cung cấp một nơi trú ẩn an toàn và tạm thời cho Leishmania và là cầu nối trung
gian để chuyển ký sinh trùng đến các đại thực bào là nơi mà chúng sẽ nhân lên.
5.3.3. Các sản phẩm hình thành trong quá trình phát triển của KST trong vector
Muỗi cát mang KST truyền thể promastigotes và gel giàu mucin gọi là
promastigote secretory gel (PSG) chứa trong nước bọt của muỗi vào da của người.
Thành phần có hiệu lực của PSG là proteophosphoglycan dạng sợi được tiết ra trong
quá trình nhân lên của promastigotes khi phát triển ở muỗi. PSG được tiết ở nồng độ
cao làm giảm số lượng máu hút vì vậy tăng cường tần suất hút máu của muỗi cát nên
tăng cường khả năng truyền bệnh của muỗi. PSG làm tăng cường các đại thực bào của
vật chủ đến vị trí muỗi đốt truyền promastigote. Bên cạnh đó PSG đảm bảo tăng tổng
hợp chất dinh dưỡng cho ký sinh trùng bằng cách tăng cường sự biểu hiện của
arginase, một loại enzyme thủy phân arginine thành ornithine (thành phần đầu tiên để
tổng hợp polyamines là một thành phần quan trọng cho sự tăng trưởng tế bào nhân
thật). Ký sinh trùng lợi dụng sự gia tăng của polyamines hiện diện trong các đại thực
bào để lấy dinh dưỡng và tăng trưởng trong giai đoạn đầu. Do đó, Leishmania đã tiến
hóa để tận dụng các đáp ứng miễn dịch làm lành vết thương tại chỗ để sinh tồn ở giai
đoạn đầu trong vật chủ. 6. TÁC HẠI
Bệnh do Leishmania ở người có biểu hiện các hội chứng lâm sàng đa dạng,
gồm thể nội tạng, thể ở da và thể niêm mạc. Các loài KST khác nhau có liên quan đến
biểu hiện lâm sàng đa dạng khác nhau và di chứng của bệnh. Ngoài ra biểu hiện lâm
sàng còn phụ thuộc vào đáp ứng miễn dịch của vật chủ. Vì vậy định danh loài gây
bệnh có thể hữu ích cho việc kiểm soát lâm sàng cũng như quyết định điều trị liên
quan đến loài, phân bố địa lý và đáp ứng miễn dịch của vật chủ.
6.1. Bệnh Leishmania ở da (cutaneous leishmaniasis)
Biểu hiện của thể bệnh này phụ thuộc vào loài ký sinh trùng gây bệnh và đáp
ứng miễn dịch của vật chủ. Thể bệnh ở da đơn thuần thường do hai loài là L. major và
L. tropica. Trong đó L. tropica có nguồn bệnh chính là người và L. major có nguồn
bệnh chính là động vật. L. major có nguồn bệnh là các loài gặm nhấm sa mạc và
truyền bệnh do Phlebotomus papatasi. L. tropica có nguồn bệnh người là chính, ngoài
ra có thể là chuột Procavia capensis, truyền bệnh do P. sergenti. Thể bệnh do 2 loài
KST này có vùng dịch tễ ở vùng Bắc Phi, Trung Đông, Trung Á, các quốc gia tiểu lục
địa Ấn Độ (Ấn Độ, Pakistan, Bangladesh). Thể bệnh ở da đơn thuần còn do các loài
khác gặp ở Nam mỹ như: L. mexicana, L. amazonensis, L. guyanensis, L. peruviana, L.
venezuelensis, L. colombiensis.
Thể bệnh ở da lan tỏa thường do L. amazonensis và L. aethiopica gặp ở Nam
Mỹ và châu Phi (Ethiopia và Kenya). Thương tổn da hậu Kala- azar cũng là thể bệnh
của Leishmania da, đây là một biểu hiện ở da của Leishmania nội tạng đặc trưng với
hoàng điểm, dát và nốt sẩn phục hồi từ thể bệnh nội tạng. 212
Trùng roi ký sinh ở mô (Leishmania sp.)
Bệnh Leishmania ở da thường đặc trưng với một hoặc nhiều vết loét ở da vùng
bị muỗi đốt: tổn thương dạng loét da tại vị trí vết cắn của muỗi cát (bệnh Leishmania
tại chỗ localized cutaneous Leishmaniasis) và nhiều nốt sẩn loét lan tỏa (diffuse cutaneous leishmaniasis).
Sau thời gian ủ bệnh, thường dưới 2 tháng với L. tropica và trên 2 tháng với
L. major. Leishmania da thường bắt đầu bằng một sẩn ở vị trí của muỗi cát đốt trên lớp
biểu bì của da. Các sẩn sau đó tăng kích thước và tiến triển loét với 2 thể: thể khô hoặc
thể ướt. Thông thường chúng có hình ảnh trông giống núi lửa với bờ 2 bên cao và lõm
ở giữa. Thể khô thường do L. tropica, với biểu hiện một mụn cứng, không đau, thường
không viêm, không nổi hạch, không đáp ứng với kháng sinh. Ở giữa có một vảy dày,
gỡ lớp vảy này lên, ở dưới là một ổ loét, không có mủ, chỉ có dịch huyết thanh, trong
đó chứa nhiều KST. Sau 8-12 tháng, mụn khô đi, vảy bong ra, để lại một vết sẹo. Thể
bệnh này để lại một trạng thái miễn dịch khá bền. Thể ướt thường do L. major, ổ loét
ướt có mủ và thường bị bội nhiễm và có thể kèm theo sưng hạch gần vết loét, sẽ khỏi
trong vòng 2-6 tháng và để lại sẹo.
6.2. Bệnh Leishmania ở da niêm mạc (Muco-cutaneous leishmaniasis, cutaneous-
mucosal, American cutaneous, or “Espundia”)
Đặc trưng của thể bệnh này hiện tượng viêm phá hủy niêm mạc (bệnh
Leishmania niêm mạc: mucosal leishmaniasis). Thời gian ủ bệnh là 1-4 tháng và các
tổn thương từ da rồi lan đến vùng niêm mạc mũi, khoang miệng và hầu họng. Dạng
bệnh này thường dẫn đến đến khó khăn trong hô hấp và ăn uống và có nguy cơ tử vong
đáng kể. Thể bệnh đáng sợ nhất là loét Espundia. Bệnh thường được gặp ở vùng nhiệt
đới của châu Mỹ và do L. brasiliensis, L. panamensis, và L. guyanensis. Nguồn chứa
mầm bệnh là những động vật hoang dã sống trong rừng rậm: các loài gặm nhấm, chồn,
con lười, và cũng có thể là chó nhà, con lừa, vector là muỗi giống Lutzomyia.
6.3. Bệnh Leishmania nội tạng
Thể bệnh này còn được gọi là Kala azar, bệnh sốt đen (black fever). Nếu không
được điều trị, bệnh này sẽ gây tử vong cao (90%). Đây là một bệnh lan tỏa của hệ
võng-mô của KST. Bệnh gặp ở nhiều vùng thuộc Châu Phi, vùng Nam và Đông của
châu Á (chủ yếu ở Ấn Độ và Trung Quốc), các quốc gia vùng Địa Trung Hải (gặp ở cả
trẻ em và người lớn), ở Nam Mỹ (gặp ở trẻ em). Các loài gây bệnh gồm: L. donovani
gặp ở Ấn Độ và Đông Phi, loài L. infantum gặp ở Địa Trung Hải, loài L. chagasi gặp ở
Nam Mỹ. Thời gian ủ bệnh từ 2-8 tháng. Các đối tượng nguy cơ bao gồm: người suy
giảm miễn dịch mắc phải, trẻ em trước tuổi đi học, và bệnh nhân suy dinh dưỡng.
Bệnh nhân ở thể bệnh nội tạng thường có triệu chứng sốt, gầy sút, gan lách to
(thường lách to hơn gan), có thể có sưng hạch. Xét nghiệm về huyết học có kết quả bất
thường: giảm 3 dòng tế bào máu (hồng cầu, bạch cầu, tiểu cầu). Thể bệnh Leishmania
nội tạng hiện đang trở thành nhiễm trùng cơ hội quan trọng ở bệnh nhân nhiễm HIV.
Cần lưu ý rằng biểu hiện lâm sàng của bệnh Leishmania ở bệnh nhân suy giảm miễn 213
Trùng roi ký sinh ở mô (Leishmania sp.)
dịch đặc biệt là những người nhiễm HIV có thể không điển hình, do đó, nhiễm trùng ở
đường tiêu hóa và các hệ thống cơ quan có liên quan khác có thể dễ dàng bị chẩn đoán
nhầm là sự bùng phát của bệnh tiềm ẩn khác vì vậy bệnh nhân không được chẩn đoán
sớm và tiên lượng xấu.
Bệnh Leishmania nội tạng được chia làm nhiều thể bệnh khác nhau:
6.3.1. Thể Kala azar vùng Địa Trung Hải
Thể này phổ biến ở các nước vùng Địa Trung Hải: từ Bồ Đào Nha đến Biển
Đen, Trung, Cận Đông và Bắc Phi. Thể này có đặc tính là xảy ra ở trẻ em, hiện nay,
thể này còn gặp ở người lớn và người già.
Tác nhân gây bệnh là L. infantum, nguồn chứa mầm bệnh là chó. Bệnh xảy ra
với 3 triệu chứng chính: sốt, thiếu máu, lách to. Lúc đầu, sốt có dạng của thương hàn,
sau đó sốt không đều. Thiếu máu: bệnh nhân xanh xao, da tái vàng. Lách rất to, có khi
to quá rốn, không đau, di động, sờ thấy nhẵn, chắc. Nếu bệnh tiến triển trong trường
hợp không điều trị, suy nhược và suy đa hệ thống, xuất huyết do giảm tiểu cầu và
nhiễm trùng bội nhiễm có thể gây tử vong.
6.3.2. Thể Kala azar Ấn Độ
Gặp ở mọi lứa tuổi, người là nguồn chứa mầm bệnh chính, ngoài vùng Ấn Độ,
ở những nơi khác, nguồn chứa mầm bệnh còn có thể là chó. Trung gian truyền bệnh
chủ yếu là P. argentipes, một loài muỗi cát sống gần nhà.
Vào thời kỳ toàn phát, bệnh có triệu chứng cổ điển: sốt cao và rất dao động,
thiếu máu (hồng cầu, bạch cầu đều giảm), lách to dần, trước mềm rồi sau cứng dần.
Tổng trạng người bệnh suy sụp nhanh, nếu không chẩn đoán ra và điều trị kịp thời,
bệnh sẽ tiến đến trạng thái suy kiệt, chảy máu và bệnh nhân chết trong vòng vài tháng.
6.3.3. Bệnh Leishmania và HIV/AIDS
Các dữ liệu đầu tiên về nhiễm Leishmania ở bệnh nhân HIV (+) ở nam Châu
Âu trên các bệnh nhân dùng chung bơm kim tiêm khi chích ma túy dẫn đến giảm số
lượng lympho TCD4. Ở 90% các bệnh nhân này, nhiễm trùng là do sự tái hoạt động
của ký sinh trùng nhiễm trong thời gian trước đó mà không biểu hiện triệu chứng hoặc
thể nhiễm trùng tiềm ẩn. Kết quả suy giảm miễn dịch này dẫn đến đáp ứng điều trị
kém và tái phát thường xuyên.
Các triệu chứng biểu hiện gồm sưng hạch bạch huyết, gan to, lách to, xanh xao,
thiếu máu, giảm bạch cầu, giảm tiểu cầu, sốt, đổ mồ hôi đêm, suy nhược, chán ăn, suy
nhược, giảm cân. Ngoài ra, ở trẻ em có thể biểu hiện tiêu chảy mãn tính và chậm phát
triển. Biểu hiện cận lâm sàng kinh điển là giảm tiểu cầu và tăng gamma globulin huyết
thanh. Trong trường hợp không điều trị bệnh có thể tiến triển nặng nhanh chóng trong
vài tuần với suy nhược và suy đa phủ tạng, xuất huyết do giảm tiểu cầu và nhiễm trùng
bội nhiễm có thể gây tử vong. 214
Trùng roi ký sinh ở mô (Leishmania sp.) 7. CHẨN ĐOÁN
Chẩn đoán dựa vào các biểu hiện lâm sàng và các yếu tố về vùng dịch tễ của
bệnh và của vector. Các xét nghiệm chẩn đoán xác định ký sinh trùng gồm: xét nghiệm
tìm ký sinh trùng từ bệnh phẩm và nuôi cấy, chẩn đoán huyết thanh học và sinh học
phân tử. Ngoài ra một số xét nghiệm có ý nghĩa định hướng bệnh cũng cần được chú ý đến.
7.1. Các xét nghiệm định hướng: các thay đổi về huyết học và sinh hóa:
- Tốc độ lắng máu thường tăng (từ 80 đến 100 mm ở giờ đầu), CRP tăng.
- Tăng tỷ lệ globulin, điều này làm cho tỷ lệ albumin/globulin dưới 1.
- Công thức máu: thiếu máu đẳng sắc và bất sản.
- Bạch cầu giảm, chủ yếu là bạch cầu hạt trung tính. - Giảm tiểu cầu.
7.2. Chẩn đoán xác định
7.2.1. Xét nghiệm trực tiếp tìm thể amastigote của KST từ bệnh phẩm
+ Ở thể da và niêm mạc, lấy bệnh phẩm ở rìa thương tổn ổ loét (hoặc lấy dịch
tiết, hoặc làm sinh thiết) làm phết mỏng và nhuộm bằng May - Grunwald - Giemsa.
+ Ở thể nội tạng, chọc dò tủy xương ức hoặc chọc dò lách để tìm KST, cũng có
thể tìm thấy KST khi kéo máu.
7.2.2. Nuôi cấy KST: Trong trường hợp soi trực tiếp không thấy KST thì nên cấy bệnh
phẩm trong môi trường NNN (Novy – MacNeal – Nicolle), Leishmania sẽ xuất hiện
dưới dạng có roi (promastigote).
7.3. Chẩn đoán gián tiếp đặc hiệu
- Tìm kháng thể IgG kháng Leishmania trong máu bệnh nhân và kháng thể
kháng K39 có độ nhạy 90-100% và độ đặc hiệu khác nhau tùy theo vùng địa lý. Tìm
kháng nguyên KST trong nước tiểu bệnh nhân trong thể bệnh nội tạng cũng được đề
cập đến. Các kỹ thuật được đề cập bao gồm: ELISA, phản ứng cố định bổ thể, ngưng
kết trực tiếp, miễn dịch huỳnh quang,
- Các kỹ thuật sinh học phân tử: PCR giúp chẩn đoán đặc hiệu loài, đầu dò hoặc
kháng thể đơn dòng tỏ ra có nhiều triển vọng. 8. ĐIỀU TRỊ
Các thuốc được nói đến là dẫn chất của stibium (Sb): Glucantime,
Pentostam.Với thể da và niêm mạc dùng Amphotericin B và Diamine (Pentacarinat).
- Thể bệnh nội tạng: Amphotericin B dạng huyền dịch truyền (liposomal
amphotericin B) là thuốc tốt nhất được lựa chọn theo khuyến cáo của FDA, Mỹ. Với
người miễn dịch bình thường liều là 3.0 mg/kg/ngày vào ngày 1 đến ngày 5, sau đó
nhắc lại vào thứ 14 và 21. Ở người suy giảm miễn dịch liều 4.0 mg/kg/ngày x ngày 1
đến ngày thứ 5, lặp lại vào ngày 10, 17, 24, 31, và 38. Amphotericin B deoxycholate
hiệu quả không tốt bằng, liều 0.5–1.0 mg/kg/ngày x 8 tuần. 215
Trùng roi ký sinh ở mô (Leishmania sp.)
Một số thuốc khác như: sodium stibogluconate (Pentostam) và meglumine
antimonate (Glucantime) liều 20 mg/kg/ngày x 20-28 ngày, Miltefosine 100 mg/ngày
x 4 tuần ở người lớn, với trẻ em liều là 2,5mg/kg/ngày x 4 tuần.
Các thuốc kháng nấm như ketoconazole và itraconazole có hiệu quả không ổn
định nên không phải là lựa chọn để điều trị thể bệnh nội tạng.
- Thể bệnh ở da: các thuốc uống bao gồm: dẫn chất của stibium (Sb) 20
mg/kg/ngày x 20–28 ngày, thuốc kháng nấm nhóm imidazole (ketoconazole,
itraconazole, và fluconazole): ketoconazole 400–600 mg/ngày x 4–8 ngày, fluconazole
200 mg/ngày x 6 tuần, tuy nhiên hiệu quả còn tùy thuộc loài KST, Miltefosine 50–100
mg/ngày x 21 ngày. Ngoài ra có thể kết hợp thuốc bôi tại vết loét như paromomycin
15% và methylbenzethonium 12%.
- Thể bệnh da, niêm mạc: dẫn chất của stibium (Sb) 20 mg/kg x 28 ngày,
Amphotericin B 2–4 mg/kg/lần x 1-2 lần/tuần đến khi lành vết loét. 9. DỰ PHÒNG
- Kiểm soát vector: diệt muỗi cát Phlebotomus bằng nhiều biện pháp: phun
thuốc diệt côn trùng, diệt nơi đẻ trứng của muỗi bằng cách lấp ao tù vũng đọng. Điều
tra về sự phân bố dịch tễ của vector ở các quốc gia có báo cáo bệnh để định hướng cho
chẩn đoán bệnh ở bệnh nhân suy giảm miễn dịch mắc phải nếu bệnh nhân sống trong
vùng có lưu hành của vector.
- Bảo vệ người lành bằng quần áo, đeo ủng, đeo găng chống muỗi đốt. 216