


Preview text:
CÂU HỎI & BÀI TẬP CHƯƠNG 1-4 HỌC PHẦN: CH3322 CÂU HỎI: UV-Vis
1. Biểu thức của định luật Beer? Ý nghĩa vật lý của hệ số hấp thụ mol?
2. Độ truyền quang (T %), độ hấp thụ quang (A), quan hệ giữa T % và A?
3. Tại sao trong phân tích định lượng bằng phổ UV-Vis người ta thường đo độ hấp thụ quang ở
bước sóng ứng với cực đại hấp thụ của chất nghiên cứu?
4. Tính cộng tính về độ hấp thụ? Dung dịch so sánh (mẫu trắng hay blank)? Tại sao để đo độ hấp
thụ của một dung dịch cần sử dụng dung dịch so sánh?
5. Tại sao khi phân tích mẫu có thành phần phức tạp thường sử dụng phương pháp thêm chuẩn? AES-AAS
1. Bản chất sự xuất hiện phổ AES? Tại sao phổ AES là phổ vạch?
2. Nêu các trang bị cần thiết trong phép ghi phổ AES và AAS.
3. Nêu các kỹ thuật nguyên tử hóa trong phương pháp AES và AAS.
4. Trong hai phương pháp hấp thụ nguyên tử và phát xạ nguyên tử, phương pháp nào cho phép
định tính toàn diện mẫu nghiên cứu? Tại sao?
5. Các nguyên tố Ag, Au, Cu có thể được xác định bằng phương pháp hấp thụ nguyên tử và phát
xạ nguyên tử. Giải thích tại sao phương pháp phổ hấp thụ nguyên tử có độ nhạy cao hơn?
6. So sánh phương pháp phân tích phổ AES và AAS. Chỉ ra ít nhất một nhược điểm của mỗi phương pháp. BÀI TẬP: UV-Vis
1. Độ hấp thụ quang của dung dịch phức FeSCN2+ 1,04 10-4 M (= 580 nm, b = 1cm) là A = 0,726, hãy tính:
a. Độ truyền quang T % của dung dịch trên. ĐS: 18,79%
b. Hệ số hấp thụ mol của phức ở bước sóng 580 nm (580). 580 = 6980,77 M-1cm-1.
Nguyễn Xuân Trường - ANACHEM/SCE/HUST
c. Bề dày cuvet để dung dịch phức FeSCN2+ 4,16 10-5 M cũng có cùng độ hấp thụ như trên. ĐS: 2,5 cm
d. Tính khoảng nồng độ Fe(III) để phức tạo thành có độ hấp thụ quang trong khoảng: d1. A = 0,2 – 0,8
(ĐS: 2,8710-5 1,1510-4 M) d2. A = 0 – 2 (ĐS: 0 2,8710-4 M)
2. Độ hấp thụ của dung dịch chuẩn chứa 50 ppm NO -
3 đo ở = 220 nm (b = 1cm) là A = 0,570. Hãy tính nồng độ NO -
3 (ppm) trong một mẫu nước biển biết rằng độ hấp thụ của dung dịch này đo
cùng điều kiện như trên là A = 0,540. ĐS: 47,37 ppm.
3. Để định lượng Pb trong thực phẩm, tiến hành cân 5,000-g mẫu, hòa tan hoàn toàn thành dung
dịch, sau đó thêm thuốc thử dithizone, dạng phức Pb(II)-dithizonat được chiết bằng CHCl3, dung
dịch sau khi chiết được định mức thành 25-mL. Hãy tính hàm lượng Pb trong mẫu thực phẩm nếu:
Dung dịch chuẩn được chuẩn bị tương tự như mẫu, chứa 10 g Pb2+ trong thể tích dung dịch đem
đo là 20-mL. Độ hấp thụ quang (max = 545 nm, b = 1 cm) của dung dịch chuẩn và mẫu lần lượt là Ac = 0,320 và Am = 0,225.
ĐS: 8,79 g hay 1,7610-4 %.
4. Lấy 5,00 ml một mẫu nước biển cho tạo phức với thuốc thử Dithizone. Phức Pb(II)-dithizonat
tạo thành được chiết sang dung môi CCl4 và định mức lên 25,00 ml cho giá trị độ hấp thụ quang
A = 0,193 (= 520 nm, b = 1cm).
Mặt khác, nếu thêm 1,00 ml dung dịch chuẩn Pb2+ có nồng độ 1560 ppb vào 5,00 ml mẫu nước
biển trên, sau đó tạo phức, chiết bằng CCl4 và định mức lên 25,00 ml như trên thì độ hấp thụ
quang của dung dịch thu được là A = 0,419. Tính nồng độ Pb2+ có trong mẫu nước biển (ppm). ĐS: 0,2664 ppm.
5. Tính nồng độ ppm của dung dịch mẫu chứa Fe3+ theo cách tiến hành sau:
- Lấy 20,00 mL dung dịch mẫu có chứa Fe3+ cho tạo phức với thuốc thử axit sunfosalixilic rồi pha
loãng thành 50,00 mL dung dịch đo. Đo độ hấp thụ quang (max = 425 nm, b = 1 cm) được giá trị Am1 = 0,225.
- Lấy 20,00 mL dung dịch mẫu có chứa Fe3+ khác thêm vào 4,00 mL dung dịch Fe3+ chuẩn 10-mg/L,
cho tạo phức với thuốc thử axit sunfosalixilic rồi pha loãng thành 50,00 mL dung dịch đo. Đo độ
hấp thụ quang (max = 425 nm, b = 1 cm) được giá trị Am2 = 0,358. ĐS: 3,383 ppm.
Nguyễn Xuân Trường - ANACHEM/SCE/HUST
6. Nồng độ của Fe3+ và Cu2+ trong hỗn hợp được xác định bằng thuốc thử hexacyanoruthenate(II), Ru(CN) 4- 4-
6 , theo phương pháp phổ UV-Vis. Ru(CN)6 tạo phức với Fe3+ màu xanh tím (max = 550 nm); Ru(CN) 4-
6 tạo phức với Cu2+ màu xanh nhạt (max = 396 nm). Độ hấp thụ quang và số hấp
thụ mol của phức Fe và Cu với thuốc thử như sau:
550 (M-1cm-1)
396 (M-1cm-1) Phức Fe 9970 84 Phức Cu 34 856 Ahh 0,183 0,109
Tính nồng độ CM của từng ion trong hỗn hợp. Cho Fe =56; Cu = 64.
ĐS: CFe3+ = 1,7910-5 M và CCu2+ = 1,2610-4 M
7. Cân 0,425g hợp kim chứa Co và Ni đem hòa tan và pha loãng đến 50,0 ml. Lấy 25,0 ml dung
dịch, thêm các chất để loại ion cản sau đó thêm thuốc thử và pha loãng đến 50,0 ml. Đo độ hấp
thụ quang của dung dịch này với cuvet 1cm ở bước sóng 510 nm được A = 0,446 và ở bước sóng
656 nm có A bằng 0,326. Tính nồng độ Co và Ni trong mẫu hợp kim theo ppm, biết rằng hệ số
hấp thụ mol của phức Co và Ni với thuốc thử như sau:
510 (M-1cm-1)
656 (M-1cm-1) Phức Co 36400 1240 Phức Ni 5520 17500 Ahh 0,446 0,326 Cho Ni =58,7; Co = 58,9 .
ĐS: Co 132, 07 ppm ; Ni 248,61 ppm
8. Cho biết kết quả xác định nồng độ dung dịch Cu2+ (dung dịch X - Cx) với thuốc thử NH3 như sau: Thể tích (ml) Dung dịch Dung dịch so Dung dịch X chuẩn 0,061M sánh 0,022M Cu2+ 5,0 5,0 5,0 NH3, 10% 5,0 5,0 5,0 nước cất
Thêm đến vạch định mức 25,0 ml; lắc đều độ hấp thụ quang A 0,468 0,000 0,234 (λmax = 620 nm) Tính Cx. ĐS: Cx = 0,0415 M
Nguyễn Xuân Trường - ANACHEM/SCE/HUST AES
Cho biết các hằng số: h = 6.62 x 10-34 J.s; c = 3 x 108 m/s; k = 1.38 x 10-23 J/K.
1. Tính tỷ lệ số nguyên tử Na ở trạng thái kích thích và trạng thái cơ bản (Nm/N0) nếu nhiệt độ của
nguồn nguyên tử hóa là: a. 1700 K (ĐS: 3,0210-7) b. 2000 K (ĐS: 3,3810-6) c. 2300 K (ĐS: 2,0210-5)
Cho biết: gm/g0 = 6/2; em = 589.00 nm.
2. Tính tỷ lệ số nguyên tử Cd ở trạng thái kích thích và trạng thái cơ bản (Nm/N0) nếu nhiệt độ của
nguồn nguyên tử hóa là: a. 2300 K (ĐS: 3,9810-12) b. 4500 K (ĐS: 2,5510-6) c. 8000 K (ĐS: 1,1510-3)
Cho biết: gm/g0 = 6/2; em = 228.80 nm.
3. Kết quả xác định hàm lượng Li bằng AES theo phương pháp điểm thêm chuẩn như sau:
Thể tích mẫu Thể tích thêm Thể tích cuối Cường độ phát lấy (mL) chuẩn (mL) cùng (mL) xạ (a.u) 10.0 0.0 100.0 309 10.0 5.0 100.0 452
Tính hàm lượng Li, cho biết dung dịch Li thêm chuẩn có nồng độ 1.62 g/mL ĐS: Cx = 1,75 g/mL AAS
1. Xác định hàm lượng Pb trong máu bằng phương pháp F-AAS được tiến hành như sau:
+ 5.0-mL mẫu máu được thêm axit tricloaxetic nhằm tách protein;
+ Tiến hành ly tâm, thu phần dung dịch;
+ Axit hóa phần dung dịch thu được tới pH = 3;
+ Pb được chiết ra bằng dung dịch metyl isobutyl xeton có chứa chất tạo phức APDC, mỗi lần 5- mL;
+ Mẫu chiết sau đó được đưa tới bộ phận nguyên tử hóa;
+ Độ hấp thu đo được tại bước sóng 283.3 nm là 0.502.
Nguyễn Xuân Trường - ANACHEM/SCE/HUST
+ 5-mL dung dịch chuẩn Pb thực hiện theo quy trình trên, kết quả thu được: A = 0.396 với Pb
0.400 ppm và A = 0.599 với Pb 0.600 ppm.
Tính hàm lượng Pb trong mẫu máu giả sử độ hấp thụ A tuân theo biểu thức của định luật Beer.
2. Hàm lượng Pb trong mẫu phân tích được xác định bằng kỹ thuật AAS. Quy trình thực nghiệm như sau:
Hòa tan hoàn toàn 2.0-g mẫu bằng axit thích hợp, sau đó pha loãng và định mức đến 50.0-mL.
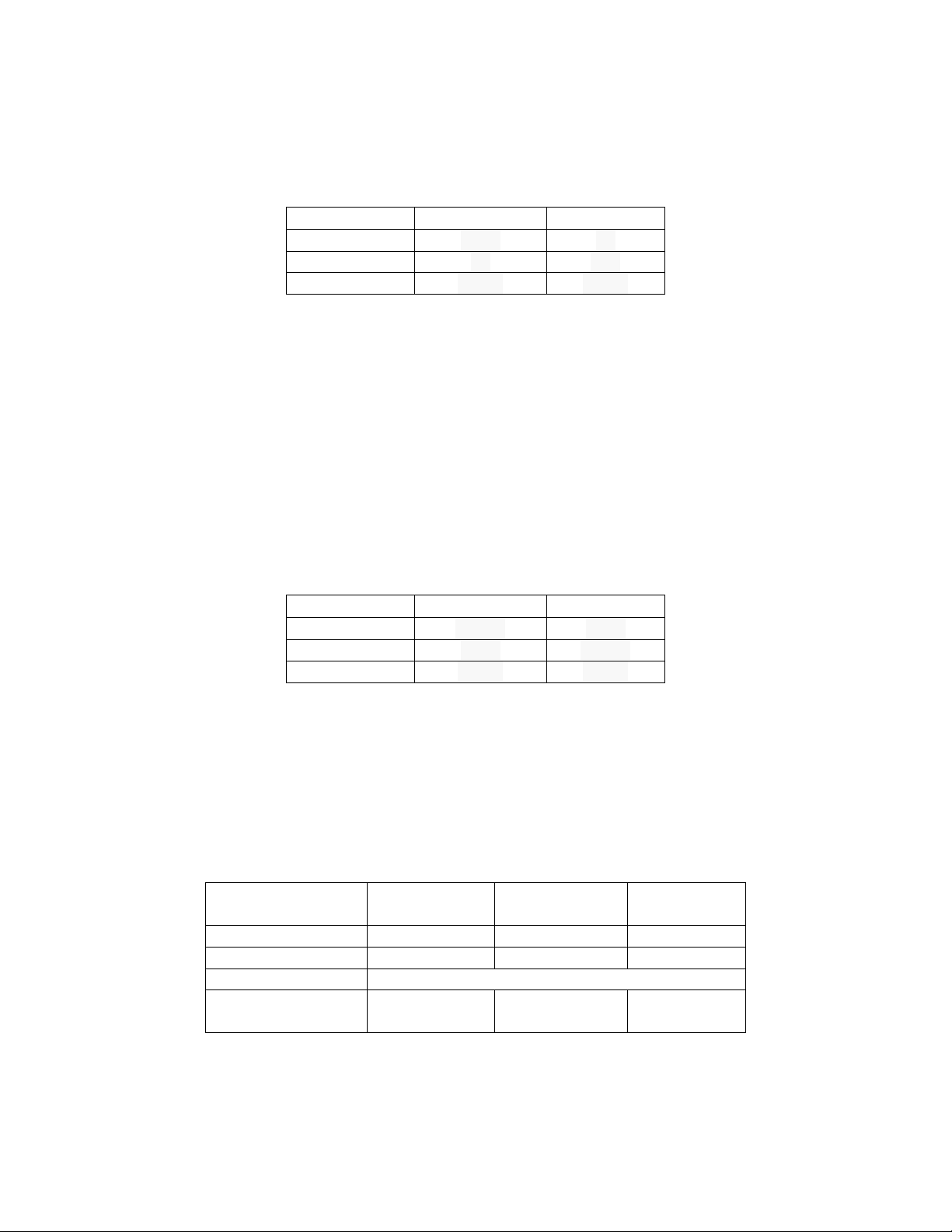
Độ hấp hấp thụ của dung dịch này đo tại bước sóng 218-nm là 0.20. Tính % Pb theo khối lượng.
Cho biết kết quả xây dựng đường chuẩn như hình dưới.
3. Thiếc tributyl clorua (TBT) là một loại thuốc trừ sâu có trong sơn (hiện nay đã bị cấm sử dụng)
để tránh sự phát triển của vi sinh vật trên vỏ tàu biển. Quy trình xác định hàm lượng TBT trong
mẫu trầm tích theo kỹ thuật GF-AAS tiến hành như sau:
Hòa tan 0.5004-g mẫu trầm tích biển bằng 5-mL axit axetic ở 900C trong 15 phút; ly tâm trong 10
phút với tốc độ 2500 vòng/phút. Sau đó lấy ra 2.00-mL dung dịch, thêm tiếp 3-mL dung dịch đệm
amoni citrat, pha loãng bằng nước cất, định mức đến 10.00-mL. Mẫu dung dịch (20 L) sau đó
được phân tích trên thiết bị GF-AAS.
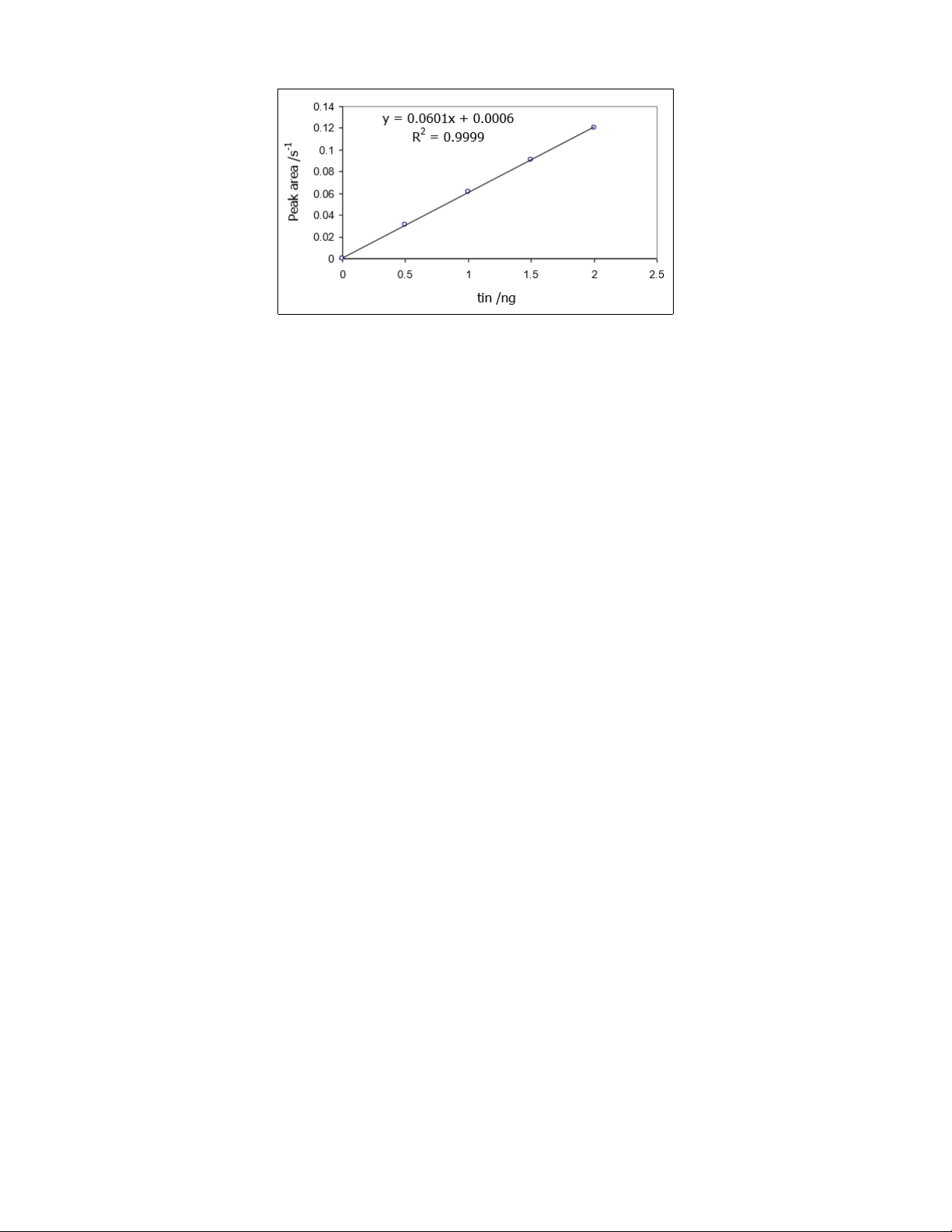
Xây dựng đường chuẩn:
Thể tích dung dịch Diện tích pic
chuẩn gốc Sn 100 ppb 5 L 0.0310 10 L 0.0611 15 L 0.0909 20 L 0.1203
Nguyễn Xuân Trường - ANACHEM/SCE/HUST
Hỏi: nếu tín hiệu diện tích của mẫu đo là 0.0541 thì hàm lượng của TBT trong mẫu trầm tích là bao nhiêu?
Nguyễn Xuân Trường - ANACHEM/SCE/HUST




