



Preview text:
Bài 2 ĐỘ DẪN ĐIỆN
I.Độ dẫn điện riêng - xác định hằng số điện ly của chất điện ly yếu
☺ Pha dd CH3COOH 0,05N & 0,02N từ dd CH3COOH 0,1N, nước cất vđ 100 ml
Áp dụng công thức V1C1 = V2C2
→ Tính toán để pha chế: DD CH3COOH 0,02N 0,05N 0,1N DD CH 𝑽 𝟏𝟎𝟎𝒙𝟎,𝟎𝟐 𝑽 𝟏𝟎𝟎𝒙𝟎,𝟎𝟓 3COOH 0,1N V 𝟐𝑪𝟐 𝟐𝑪𝟐 1 = = = 20ml V1 = = = 50ml 100ml 𝑪𝟏 𝟎,𝟏 𝑪𝟏 𝟎,𝟏
Lấy pha rồi trả lại
Nước cất vừa đủ 100ml 100ml →Pha chế:
1. 100ml dd CH3COOH 0,02N :
➢ Cho 20ml CH3COOH 0,1N vào bình định mức 100ml
➢ Thêm nước cất vừa đủ 100ml, lắc đều→ cho ra cốc có mỏ
2. 100ml dd CH3COOH 0,05N :
➢ Cho 50ml CH3COOH 0,1N vào bình định mức 100ml
➢ Thêm nước cất vừa đủ 100ml, lắc đều→ cho ra cốc có mỏ
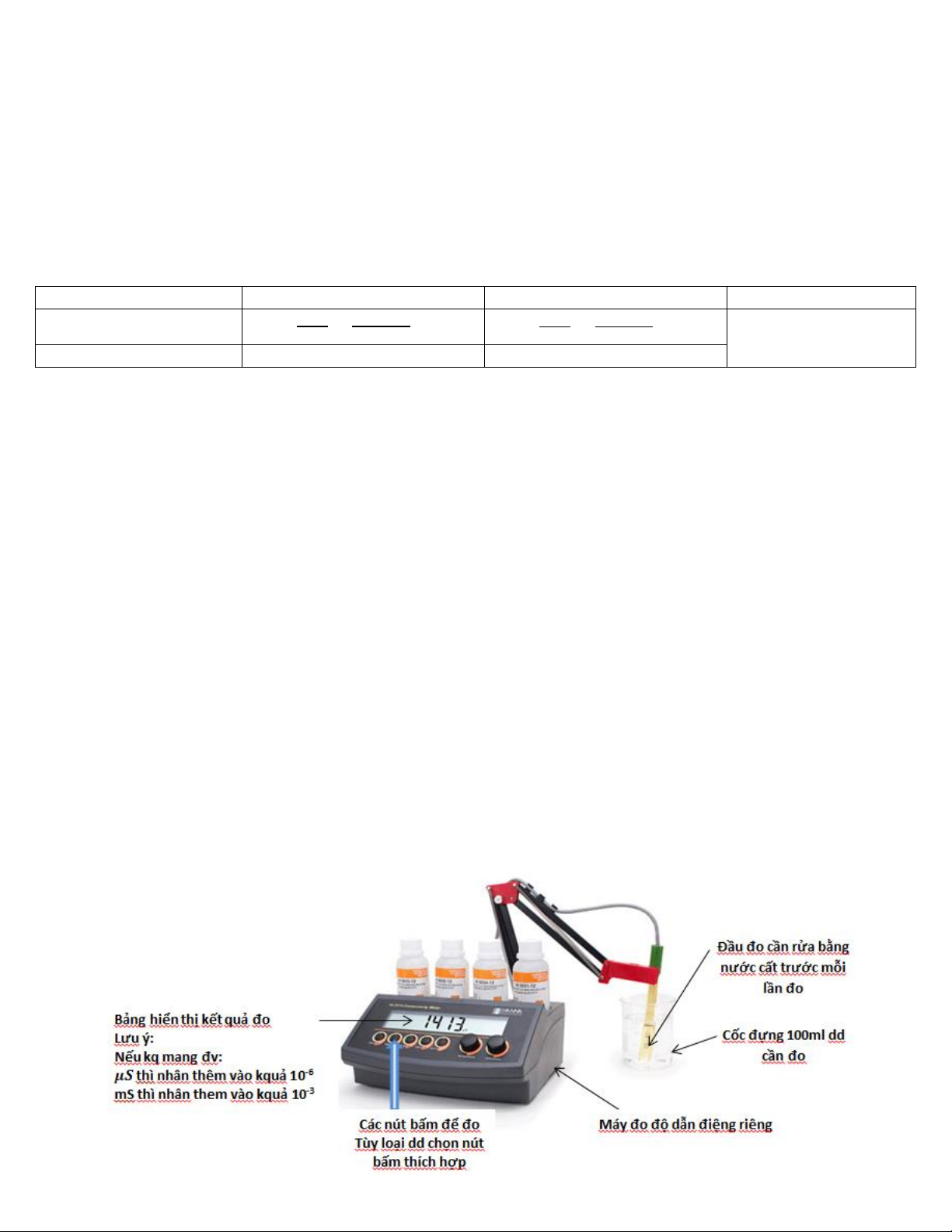
→ Sử dụng máy đo dẫn điện để đo độ dẫn điện riêng của các dd (K) Lưu ý:
- Trước khi đo mỗi nồng độ phải tráng kỹ đầu đo bằng nước cất ( dùng bình tia
xịt vào trong từ đáy & xịt xung quanh, hứng vào cốc đổ đi)
- Đo dd loãng trước, dd đậm đặc sau:
Bảng kết quả theo thứ tự dd loãng trước, đậm đặc sau: Độ dẫn điện Độ dẫn điện Độ điện li Hằng số điệnli riêng ( KS) đương lượng 𝝀 𝜶 = 𝝂 ∝𝟐𝒙 𝑪 K 𝑴 điện ly =
K(𝛀−𝟏𝒄𝒎−𝟏) 𝝀 𝝀
𝝂 (𝛀−𝟏𝒄𝒎𝟐) ∞ 𝟏−∝ Đo từ máy 𝑲 𝒙 𝟏𝟎𝟎𝟎 𝝀𝝂 = 𝑪𝑵 DD CH3COOH 0,02 277𝜇𝑆 13,85 0,0354 2,5983 x 10-5 DD CH3COOH 0,05N 428 𝜇𝑆 8,56 0,0219 2,4517 x 10-5 DD CH3COOH 0,1N 573 𝜇𝑆 5,73 0,0147 2,1931 x 10-5
KL: Nồng độ dd tăng :
➢ K ( độ dẫn điện riêng) tăng ➢ 𝑲 𝒙 𝟏𝟎𝟎𝟎
Khả năng phân li giảm → độ dẫn điện giảm 𝝀 = (Ω−1𝑐𝑚2) 𝑪𝑵 ➢ 𝜆
Độ điện li giảm 𝛼 = 𝜈 𝜆∞
Tính KTB điện ly. Biết rằng: K:
Độ dẫn điện riêng (Ω−1𝑐𝑚−1) CN:
Nồng độ đương lượng ( đương lượng gam/ lít) 𝐾 𝑥 1000 𝜆𝜈 = :
Độ dẫn điện đương lượng (Ω−1𝑐𝑚2) 𝐶𝑁
𝜆∞𝐶𝐻3𝐶𝑂𝑂𝐻 = 390,7 Độ dẫn điện đương lượng khi phân li hoàn toàn (Ω−1𝑐𝑚2) 𝜆 𝛼 = 𝜈 Độ điện li 𝜆∞ ∝2𝑥 𝐶 K 𝑀 điện ly = Hằng số điện li; C 1−∝
M: nồng độ phân tử ( mol/lít)
Tính độ dẫn điện đương lượng of dd điện ly yếu CH3COOH ở 3 nồng độ trên: 𝐾 𝑥 1000 277 x 10−6𝑥 1000 𝝀𝝂 = = = 13,85 Ω−1𝑐𝑚2
𝒅𝒅 𝑪𝑯𝟑𝑪𝑶𝑶𝑯𝟎,𝟎𝟐𝑵 𝐶 0,02 𝐾 𝑥 1000 428 x 10−6𝑥 1000 𝝀𝝂 = = = 8,56 Ω−1𝑐𝑚2
𝒅𝒅 𝑪𝑯𝟑𝑪𝑶𝑶𝑯𝟎,𝟎𝟓𝑵 𝐶 0,05 𝐾 𝑥 1000 573 x 10−6𝑥 1000 𝝀𝝂 = = = 5,73 Ω−1𝑐𝑚2
𝒅𝒅 𝑪𝑯𝟑𝑪𝑶𝑶𝑯𝟎,𝟏𝑵 𝐶 0,1
( Lưu ý: kết quả tính được ghi vào bảng bên trên)
Tính độ điện ly of dd điện ly yếu CH3COOH ở 3 nồng độ trên
Với 𝝀∞= 390,7Ω−1𝑐𝑚2 𝝀 13,85 ∝ 𝝂 𝒅𝒅 𝑪𝑯 = = = 0,0354
𝟑𝑪𝑶𝑶𝑯𝟎,𝟎𝟐𝑵 𝝀∞ 390,7 𝝀 8,56 ∝ 𝝂 𝒅𝒅 𝑪𝑯 = = = 0,0219
𝟑𝑪𝑶𝑶𝑯𝟎,𝟎𝟓𝑵 𝝀∞ 390,7 𝝀 5,73 ∝ 𝝂 𝒅𝒅 𝑪𝑯 = = = 0,0147
𝟑𝑪𝑶𝑶𝑯𝟎,𝟏𝑵 𝝀∞ 390,7
( Lưu ý: kết quả tính được ghi vào bảng bên trên)
Tính hằng số điện ly of dd điện ly yếu CH3COOH ở 3 nồng độ trên ∝2𝑥 𝐶 0,03542 𝑥 0,02 𝑲 𝑀
đ𝒊ệ𝒏 𝒍𝒊 𝒄ủ𝒂 𝒅𝒅 𝑪𝑯 = = = 2,5983 x 10-5
𝟑𝑪𝑶𝑶𝑯𝟎,𝟎𝟐𝑵 1−∝ 1 − 0,0354 ∝2𝑥 𝐶 0,02192 𝑥 0,05 𝑲 𝑀
đ𝒊ệ𝒏 𝒍𝒊 𝒄ủ𝒂 𝒅𝒅 𝑪𝑯 = = = 2,4517 x 10-5
𝟑𝑪𝑶𝑶𝑯𝟎,𝟎𝟓𝑵 1−∝ 1 − 0,0219 ∝2𝑥 𝐶 0,01472 𝑥 0,1 𝑲 𝑀
đ𝒊ệ𝒏 𝒍𝒊 𝒄ủ𝒂 𝒅𝒅 𝑪𝑯 = = = 2,1931 x 10-5
𝟑𝑪𝑶𝑶𝑯𝟎,𝟏𝑵 1−∝ 1 − 0,0147
( Lưu ý: kết quả tính được ghi vào bảng bên trên) →
2,5983 𝑥 10−5+2,4517 𝑥 10−5+2,1931 𝑥 10−5 𝑲 ̅̅̅̅̅̅̅̅̅̅̅̅̅
đ𝒊ệ𝒏 𝒍𝒚 𝑻𝑩 =
= 2,414 x 10-5 3
II.Đo độ dẫn điện of dd điện ly mạnh:
1.Đo độ dẫn điện của dd HCl 0,1 N & 0,01N Bảng pha chế: 0,01N 0,1N Dd HCl 𝐂
𝟎,𝟎𝟏 𝐱 𝟏𝟎𝟎 C 𝟐𝐕𝟐 1V1 = C2V2 →V1 = = = 10ml 100 ml 𝐂𝟏 𝟎,𝟏 Nước cất vđ 100 ml
Dùng pipep bầu hút chính xác 10 ml dd HCl 0,1N cho vào bình định mức (100ml) →
thêm nước cất vđ 100ml: ta có dd HCl 0,01N → cho vào cốc, cắm điện cực & đo độ
dẫn điện → ghi kết quả
Dùng 100ml dd HCl 0,1N → cho vào cốc, cắm điện cực & đo độ dẫn điện → ghi kết
quả ( trả hoác chất về chai đã lấy)
Bảng kết quả theo thứ tự dd loãng trước, đậm đặc sau:
Độ dẫn điện riêng ( KS)
Độ dẫn điện đương lượng
K(𝛀−𝟏𝒄𝒎−𝟏)
𝝀𝝂 (𝛀−𝟏𝒄𝒎𝟐) Đo từ máy 𝑲 𝒙 𝟏𝟎𝟎𝟎 𝝀𝝂 = 𝑪𝑵 DD HCl 0,01 2,17𝑚𝑆 217 DD HCl 0,1N 21,5 𝑚𝑆 215
Nhận xét giá trị 𝝀𝝂 : 𝝀𝝂 𝒅𝒅 𝑯𝑪𝒍 > 𝝀 𝟎.𝟎𝟏
𝝂 𝒅𝒅 𝑯𝑪𝒍𝟎.𝟏 Giải thích:
Ở cùng nhiệt độ → khả năng phân ly thành ion của dd phụ thuộc vào nồng độ: Nồng
độ càng loãng → khả năng phân li càng cao
2.Đo độ dẫn điện của dd NaCl 0,1 N & 0,01N Bảng pha chế: 0,01N 0,1N Dd NaCl 𝐂
𝟎,𝟎𝟏 𝐱 𝟏𝟎𝟎 C 𝟐𝐕𝟐 1V1 = C2V2 →V1 = = = 10ml 100 ml 𝐂𝟏 𝟎,𝟏 Nước cất vđ 100 ml
Dùng pipep bầu hút chính xác 10 ml dd NaCl 0,1N cho vào bình định mức (100ml) →
thêm nước cất vđ 100ml: ta có dd NaCl 0,01N → cho vào cốc, cắm điện cực & đo độ
dẫn điện → ghi kết quả
Dùng 100ml dd NaCl 0,1N → cho vào cốc, cắm điện cực & đo độ dẫn điện → ghi kết
quả ( trả hoác chất về chai đã lấy)
Bảng kết quả theo thứ tự dd loãng trước, đậm đặc sau:
Độ dẫn điện riêng ( KS)
Độ dẫn điện đương lượng
K(𝛀−𝟏𝒄𝒎−𝟏)
𝝀𝝂 (𝛀−𝟏𝒄𝒎𝟐) Đo từ máy 𝑲 𝒙 𝟏𝟎𝟎𝟎 𝝀𝝂 = 𝑪𝑵 DD NaCl 0,01 1635𝑚𝑆 163,5 DD NaCl 0,1N 15,40 𝑚𝑆 154
Nhận xét giá trị 𝝀𝝂 :
𝝀𝝂 𝒅𝒅 𝑵𝒂𝑪𝒍 > 𝝀 𝟎.𝟎𝟏
𝝂 𝒅𝒅 𝑵𝒂𝑪𝒍𝟎.𝟏 Giải thích:
Đối với chất điện li mạnh → phân li hoàn toàn thành ion ở mọi nồng độ → cường độ
càng cao thì mật độ ion trong 1 thể tích chứa đựng 1 đương lượng gam chất hòa tan
càng cao → 𝜆𝜈 càng ↓
III.Xác định độ tan của CaSO4 bằng pp đo độ dẫn điện
CT: Độ tan CaSO4 (gam/lít) = CM x Đương lượng gam CaSO4
Đo độ dẫn điện riêng CaSO4:
Lấy 100 ml nước cất cho vào cốc → dùng máy đo độ dẫn điện riêng của nước cất →
ghi nhận giá trị K’ = 18 x 10-6 S
Lấy 100 ml dd CaSO4 bão hòa trong nước → dùng máy đo độ dẫn điện riêng của
CaSO4 bão hòa trong nước → ghi nhận giá trị K = 1,9 x 10-3 S Có 𝐾 ′ 𝐶𝑎𝑆𝑂 = 𝐾 - 𝐾
= 1,9 x 10-3 – 18 x 10-6 = 1,882 x 10-3S. 4
𝐶𝑎𝑆𝑂4 𝑏ã𝑜 ℎò𝑎 𝑡𝑟𝑜𝑛𝑔 𝑛ướ𝑐 𝑛ướ𝑐 𝐾 𝑥 1000
Ta có: 𝐶 = 𝐶𝑎𝑆𝑂4 với 𝝀 𝜆
∞ = 119,5 ( 𝛀−𝟏𝒄𝒎−𝟏 ) cho biết ∞ → 1,882 𝑥 10−3𝑥 1000 𝐶 = = 0,01575 (N) 119,5
Vậy độ tan của CaSO
4 = C x 𝐄𝐂𝐚𝐒𝐎 (C x đương lượng gam CaSO ) 𝟒 4 Vì CaSO 2− 4 → 2Ca+ + 𝑆𝑂4 SO4 → số Z = 2 𝑚 40+32+64
Độ 𝒕𝒂𝒏 𝑪𝒂𝑺𝑶 = C x 𝐸 = C x = 0,01575 x ( ) = 1,071 gam/lít 𝟒 𝐶𝑎𝑆𝑂4 𝑧 2 Câu hỏi:
2. Máy đo đo được độ dẫn điện gì:
➢ Độ dẫn điện riêng
3. Độ dẫn điện đương lượng ➢ 𝐾 𝑥 1000
Tính được chứ không đo được. CT: 𝜆𝜈 = 𝐶
4. Đơn vị tính dộ dẫn điện đương lượng là:
➢ (Ω−1𝑐𝑚2)
5. Độ dẫn điện đương lượng là:
➢ Khả năng dẫn điện của tất cả các ion trong dd chứa 1 đương lượng gam chất
điện ly hòa tan
6. Nồng độ đương lượng
➢ CN = CM x Z ( hệ số đương lượng)
7. Đương lượng gam ký hiệu E ➢
𝑴 ( 𝒑𝒉â𝒏 𝒕ử 𝒍ượ𝒏𝒈 𝒄𝒉ấ𝒕 𝑨) E =
𝒁 ( 𝒔ố 𝒏𝒉ó𝒎 𝑶𝑯 𝒐𝒓 𝑯+ ( đố𝒊 𝒗ớ𝒊 𝒂𝒄𝒊𝒅 𝒐𝒓 𝒃𝒂𝒔𝒆, 𝒎𝒖ố𝒊:𝒕ổ𝒏𝒈 𝒔ố 𝒉ó𝒂 𝒕𝒓ị 𝑲𝑳 𝒕𝒓𝒐𝒏𝒈 𝒎𝒖ố𝒊 )
➢ VD: H2SO4 có nồng độ 3M thì nồng độ đương lượng là 6N ( số Z = 2):
• Do 1 phân tử H2SO4 cho 2H+
➢ VD: HCl có nồng độ 0,1 thì nồng độ đương lượng là 0,1 ( số Z = 1)
• Do 1 phân tử HCl cho 1 H+
8. Dòng điện là:
➢ Dòng chuyển dịch có hướng của các hạt mang điện
9. Độ dẫn điện là:
➢ Đại lượng đặc trưng cho khả năng vận chuyển các hạt mang điện dưới tác
dụng của điện trường ngoài 10.
Độ dẫn điện riêng là
➢ Độ dẫn điện của tất cả các ion chứa trong 1cm3 dd có nồng độ đã cho 11.
Nồng độ dd tăng ➢ K tăng ➢ 𝑲 𝒙 𝟏𝟎𝟎𝟎
Khả năng phân li giảm → độ dẫn điện giảm 𝝀 = (Ω−1𝑐𝑚2) 𝑪𝑵 ➢ 𝜆
Độ điện li giảm 𝛼 = 𝜈 𝜆∞ 12.
𝜴−𝟏𝒄𝒎−𝟏 bằng
➢ S ( đơn vị đo độ dẫn điện riêng) 13.
Đơn vị đo độ dẫn điện riêng: ➢ Ω−1cm−1 = S 14.
Các yếu tố ảnh hưởng đến độ dẫn điện của dd
➢ Bản chất của chất tan, dung môi, K giảm dần theo chiều:
• Acid mạnh > kiềm mạnh> muối > chất điện ly yếu ( liên kết H+ dễ xảy
ra chuyển dịch dịch điện tử, H+ chuyển dịch điện tử mạnh hơn Na)
• HCl > NaCl > CH3COOH
➢ Nồng độ tăng:
• K tăng, sau đó giảm CN = CM x Z
➢ Nhiệt độ tăng • K tăng




