














Preview text:
BÀI TẬP BỒI DƯỠNG HÈ 2016-2017 HãA HäC PH¢N TÝCH
CHUẨN ĐỘ AXIT – BAZƠ
A – ĐỊNH NGHĨA VÀ CÁC KHÁI NIỆM CƠ BẢN
– Phương pháp chuẩn độ axit – bazơ là phương pháp chuẩn độ thể tích dựa trên sự tương tác giữa các axit, bazơ,
tức là dựa trên sự đo thể tích dung dịch thuốc thử là axit (hoặc bazơ) có nồng độ đã biết phản ứng với một thể tích xác
định dung dịch bazơ (hoặc axit) có nồng độ chưa biết cần xác định. Hay nói cách khác phản ứng chuẩn độ axit –bazơ
chính là phản ứng trung hòa.
– Dung dịch cần chuẩn (dung dịch phân tích) là dung dịch cần xác định nồng độ.
– Dung dịch đã biết nồng độ chính xác và được dùng để xác định nồng độ các dung dịch khác gọi là dung dịch
chuẩn (dung dịch thuốc thử).
– Quá trình chuẩn độ là quá trình thêm dần dung dịch chuẩn vào dung dịch cần chuẩn.
– Điểm tương đương (ĐTĐ) là thời điểm tại đó lượng chất chuẩn cho vào phản ứng vừa hết với lượng chất cần chuẩn.
– Trong quá trình chuẩn độ cần thiết phải dựa vào một tín hiệu nào đó để dừng phép chuẩn độ. Chất có khả năng
thay đổi tín hiệu khi chuẩn độ gọi là chất chỉ thị.
– Thời điểm tại đó chất chỉ thị thay đổi tín hiệu gọi là điểm kết thúc chuẩn độ (điểm dừng chuẩn độ hay điểm cuối chuẩn độ (ĐCCĐ)).
– Khoảng pH tại đó chất chỉ thị đổi màu gọi là khoảng chuyển màu của chất chỉ thị.
– Chỉ số chuẩn độ pT của chất chỉ thị là giá trị pH (thuộc khoảng pH chuyển màu) tại đó màu chỉ thị thay đổi rõ
nhất. Chỉ số chuẩn độ phụ thuộc vào chất chỉ thị và thứ tự chuẩn độ, phụ thuộc vào nhiệt độ, dung môi, lực ion và môi trường của dung dịch.
– Đường chuẩn độ trong phép chuẩn độ axit –bazơ là đường biểu diễn sự phụ thuộc của pH theo lượng thuốc thử cho vào.
– Sự biến thiên đột ngột pH tương ứng với sự biến thiên một lượng không đáng kể chất chuẩn (trong phạm vi sai số
cho phép) ở gần điểm tương đương tạo thành bước nhảy chuẩn độ (BNCĐ) trên đường cong chuẩn độ.
– Nguyên tắc phải chọn chất chỉ thị có chỉ số chuẩn độ pT gần với pH tại điểm tương đương của phép chuẩn độ (pT
≈ pHTĐ). Hoặc có thể chọn bất kì chất chỉ thị nào có chỉ số chuẩn độ nằm trong bước nhảy chuẩn độ tương ứng với sai số cho phép.
– Sự sai lệch giữa điểm cuối chuẩn độ và điểm tương đương gây nên sai số chuẩn độ. Sai số chuẩn độ chính là tỉ số
% lượng thuốc thử đã cho dư hoặc còn thiếu so với lượng cần thiết để chuẩn độ đến điểm tương đương.
B – CÁC PHÉP CHUẨN ĐỘ AXIT –BAZƠ
1/ Chuẩn độ axit mạnh, bazơ mạnh.
2/ Chuẩn độ axit yếu, bazơ yếu.
3/ Chuẩn độ hỗn hợp axit mạnh và đơn axit yếu; hỗn hợp bazơ mạnh và đơn bazơ yếu.
4/ Chuẩn độ hỗn hợp 2 đơn axit yếu; hỗn hợp 2 đơn bazơ yếu.
5/ Chuẩn độ đa axit, đa bazơ.
6/ Chuẩn độ hỗn hợp axit mạnh và đa axit; hỗn hợp bazơ mạnh và đa bazơ.
C – CÁC DẠNG BÀI TẬP VỀ CHUẨN ĐỘ AXIT –BAZƠ
1/ Tính pH của dung dịch tại các thời điểm dừng chuẩn độ.
2/ Tính nồng độ, thể tích,… của các chất tham gia phản ứng.
3/ Chọn chỉ thị thích hợp cho phép chuẩn độ.
4/ Xác định bước nhảy chuẩn độ.
5/ Tính sai số chuẩn độ
6/ Vẽ dạng đường cong chuẩn độ.
7/ Chọn hỗn hợp chuẩn độ.
CÁC VÍ DỤ ÁP DỤNG
I. Dạng bài toán tính pH tại các thời điểm chuẩn độ Ví dụ 1[4]
Chuẩn độ 10,00 ml dung dịch axit fomic HCOOH bằng dung dịch NaOH 0,100 M, hết 12,50 ml NaOH. Tính pH
của dung dịch HCOOH trước khi chuẩn độ và sau khi thêm NaOH với thể tích: 1/ 10,00 ml; 2/ 12,45 ml; 3/ 12,50 ml và 4/ 13,00 ml Phân tích:
Trước hết, từ phương trình phản ứng chuẩn độ, HS cần phải tính được nồng độ gốc Co của HCOOH. Ở đây cần lưu
ý rằng: bài ra không đề cập đến chất chỉ thị phải dùng trong phép chuẩn độ, nên chúng ta phải ngầm hiểu rằng phép
chuẩn độ dừng đúng điểm tương đương, nghĩa là thể tích thuốc thử tiêu thụ chính là thể tích tương đương (VTĐ).
HCOOH + OH – → HCOO – + H2O Co = = 0,125 (M).
Để tính được các giá trị pH ứng với từng lượng thể tích thuốc thử cho vào, nếu người học đã được trang bị về kiến Ka K C[C w 0 (h )] CV Ka h h C V K 0 0 C w 0 [C (h )]
thức Hóa học Phân tích, khi đó có thể sử dụng phương trình đường chuẩn độ: P = h ,
hoặc phương trình sai số: q = = – (h – Kw/h)
để tính h = [H+], từ đó tính được pH tương ứng. Tuy nhiên với cách giải này không phù hợp với học sinh phổ thông
(HSPT), vì các em chưa được trang bị đầy đủ kiến thức trên và nếu chỉ áp dụng thuần túy các công thức, các phương
trình, các em sẽ không hình dung được các quá trình xảy ra trong dung dịch.
Chính vì vậy GV cần hướng dẫn HS so sánh thể tích thuốc thử đã dùng trong từng trường hợp với VTĐ, để các em
sẽ xác định được điểm dừng chuẩn độ, từ đó xác định được thành phần của hệ và dễ dàng tính được pH của hệ.
Ví dụ: tại các thời điểm kết thúc chuẩn độ trước ĐTĐ (Vc < VTĐ), thành phần thu được gồm axit dư và bazơ liên
hợp tạo thành. Bài toán đưa về dạng bài tính pH của dung dịch đệm. Ngược lại nếu Vc > VTĐ, hệ thu được gồm bazơ
mạnh và đơn bazơ yếu. Nếu dừng chuẩn độ đúng ĐTĐ, bài toán đưa về dạng tính pH của dung dịch đơn bazơ.
Cụ thể với trường hợp thể tích NaOH thêm vào là 10,00 ml, ta có: V1 = 10,00 ml < VTĐ = 12,50 ml, dư axit:
HCOOH + OH – → HCOO – + H2O (mmol) 0,125.10,00 0,100.10,00 (mmol) 0,250 – 1,00
Thành phần giới hạn (TPGH) của hệ thu được: HCOOH 0,125 M và HCOO – 0,500 M
pH = 3,75 + log(0,500/0,125) = 4,35 (điều kiện áp dụng thỏa mãn)
Tương tự, các em có thể tính pH cho các trường hợp còn lại. Ví dụ 2.
Chuẩn độ 50 ml dung dịch KCN 0,100 M và HCOONa 0,090M bằng dung dịch HCl 0,100 M. Tính pH tại điểm
tương đương. Cho biết pKa (HCN) = 9,35; pKa(HCOOH) = 3,75. Phân tích
Đây là phép chuẩn độ hỗn hợp đơn bazơ yếu bằng axit mạnh vì thế GV hướng dẫn HS xét tỉ số hằng số phân li của axit liên hợp
→ có thể chuẩn độ riêng từng bazơ. Đầu tiên KCN bị chuẩn độ trước. Đến khi
gần như hết KCN thì HCOONa mới bị chuẩn độ và như vậy phép chuẩn độ này có hai ĐTĐ và cần tính pH tại hai thời điểm này.
Tại ĐTĐ1 thành phần gồm có HCN và HCOO –. Bài toán đưa về dạng tính cân bằng của dung dịch gồm một axit
yếu và một bazơ yếu. Sử dụng ĐKP các em sẽ tính được [H+]TĐ1.
Trong trường hợp này, tùy vào trình độ của HS mà GV yêu cầu HS tính gần đúng (chấp nhận [HCN] = CHCN, [HCOO –] = C –
HCOO ) hoặc phải tính chính xác bằng cách tính lặp. Nhưng nếu cần tính lặp, GV phải lựa chọn bài toán chỉ
cần lặp một lần, không đi quá sâu về tính toán.
– Tại ĐTĐ2: lúc này cả hai bazơ đã bị chuẩn độ hết, thành phần gồm có hai axit HCN và HCOOH. Việc tính pH
tại ĐTĐ2 chính là tính pH của dung dịch gồm hai đơn axit yếu có hằng số cân bằng chênh lệch nhau.
Ví dụ 3 (Bài tập chuẩn bị Olympic Quốc tế lần thứ 31 – Thái Lan 1999)[1]
Axit photphoric, H3PO4, là một axit ba chức. Chuẩn độ dung dịch H3PO4 0,100 M bằng NaOH. Hãy đánh giá pH tại các thời điểm sau:
1/ Giữa điểm bắt đầu và điểm tương đương thứ nhất.
2/ Tại điểm tương đương thứ hai.
3/ Tại sao rất khó xác định đường cong chuẩn độ sau điểm tương đương thứ hai?
Cho Ka1 = 7,1.10 –3; Ka2 = 6,2.10 –8; Ka3 = 4,4.10 –13. Phân tích:
Đây là phép chuẩn độ đa axit bằng bazơ mạnh. H3PO4 là axit có tỉ số các hằng số phân li từng nấc
do đó có thể chuẩn độ riêng từng nấc. Phương trình phản ứng chuẩn độ: Nấc 1: H – 3PO4 + OH – → H2PO4 + H2O Nấc 2: H – 2 – 2PO4 + OH – → HPO4 + H2O Nấc 3: HPO 2 – 3 – 4 + OH – → PO4 + H2O
Để tính pH của dung dịch tại thời điểm giữa điểm bắt đầu và điểm tương đương thứ nhất, nghĩa là mới chuẩn độ
được 50% nấc 1 của axit H –
3PO4. Dung dịch thu được là một hỗn hợp đệm gồm H3PO4 dư và H2PO4 tạo thành, có nồng
độ bằng nhau, do đó pH1 = pKa1.
pH tại điểm tương đương thứ hai chính là pH của dung dịch muối axit HPO 2 – 4 , nên pH2 =
Vì hằng số phân li nấc 3 rất nhỏ (Ka3 = 4,4.10 –13), do đó không có khả năng chuẩn độ được nấc 3, trên đường cong
không có BNCĐ, nên không thể chuẩn độ chính xác được.
II. Dạng bài toán tính nồng độ, thể tích,… của các chất tham gia phản ứng Ví dụ 4
Chuẩn độ 100,00 ml dung dịch NaOH đến mất màu chỉ thị phenolphtalein thì tiêu thụ hết 48,00 ml dung dịch HCl
5,00.10 –3M. Tính chính xác nồng độ dung dịch NaOH. Phân tích:
Đây là phép chuẩn độ bazơ mạnh bằng axit mạnh, nên pHTĐ = 7,00
So với ví dụ 1 thì bài toán này phức tạp hơn ở chỗ: VHCl = 48,00 ml không phải là thể tích tương đương (VTĐ). Do
dừng chuẩn độ tại thời điểm mất màu phenolphtalein, tức là phép chuẩn độ kết thúc ở pH = pT = 8,00 > pHTĐ = 7,00
(dừng trước điểm TĐ), lượng axit cho vào chưa trung hòa hết 100,00 ml NaOH. Nếu có kiến thức sâu về chuẩn độ axit
– bazơ thì chúng ta có thể tính chính xác CNaOH một cách dễ dàng thông qua sai số của phép chuẩn độ hoặc theo phương
trình ĐKP hay phương trình bảo toàn điện tích:
Ví dụ nếu dùng phương pháp hiệu chỉnh bằng sai số chuẩn độ thì trước hết chúng ta phải tính được nồng độ gần
đúng của NaOH (Cgđ,NaOH) theo qui tắc đương lượng.
Sau đó áp dụng phương trình sai số của phép chuẩn độ bazơ mạnh bằng axit mạnh để tính sai số của phép chuẩn độ
theo công thức, rồi hiệu chỉnh tính lại VTĐ và tính được chính xác giá trị nồng độ của NaOH.
Hoặc các em có thể áp dụng phương trình bảo toàn điện tích hay phương trình bảo toàn proton (ĐKP) để tính được
nồng độ chính xác của NaOH khi biết pH.
Tuy nhiên đối với học sinh phổ thông chưa được học để thiết lập được phương trình sai số chuẩn độ axit – bazơ , vì
vậy GV cần vận dụng kiến thức về chuẩn độ axit – bazơ một cách hợp lí để hướng dẫn các em giải bài toán này mà
không cần phải sử dụng đến phương trình sai số (quá nặng đối với các em) và cũng không nên dùng phương trình bảo
toàn điện tích (thiên về ý nghĩa vật lí hơn là tư duy hóa học).
Trước hết giáo viên cần hướng dẫn cho các em xác định được giá trị pH tại thời điểm chỉ thị đổi màu (dựa vào
khoảng chuyển màu của chỉ thị và dựa vào thứ tự chuẩn độ, HS biết được trong trường hợp này giá trị pH tại điểm kết
thúc chuẩn độ bằng 8,00. Với pH = 8,00 > 7,00, do đó còn dư NaOH theo phản ứng: H+ + OH – H2O C C’ _
pH = 8,00→ [OH –] = 10 –6 >> [H+] = 10 –8 → có thể coi COH – dư = [OH –] = 10 –6 → Co
Như vậy với cách giải này các em hiểu được bản chất của các quá trình xảy ra trong dung dịch, nắm được hiện
tượng hóa học, giúp phát triển tư duy hóa học.
Cũng cần lưu ý rằng: với [OH –] = 10 –6
(ta không thể nói 10 –6 >>10 –7) khó có thể thuyết phục để các em
chấp nhận COH(dư) = [OH –], nhưng nếu so sánh [OH –] = 10 –6 >> [H+] = 10 –8, có nghĩa là sự phân li của H2O có thể bỏ
qua, do đó sự chấp nhận COH(dư) = [OH –] là hợp lí.
Như vậy từ giá trị pH chuyển màu của chỉ thị cho phép đánh giá được nồng độ của chất tham gia phản ứng. Trên cơ
sở này giáo viên có thể nâng mức độ phức tạp của bài toán nếu sử dụng hai chỉ thị sẽ cho phép xác định nồng độ của cả
chất phân tích và chất chuẩn. Ví dụ 5 [4]
Chuẩn độ 50,00 ml dung dịch HCl bằng dung dịch NaOH đến đổi màu phenolphtalein (pT = 9,00) thì phải dùng
25,00 ml NaOH. Nếu chuẩn độ đến xuất hiện màu vàng của metyl da cam (pT = 4,4) thì cần dùng 24,50 ml NaOH. Tính nồng độ HCl và NaOH. Phân tích:
Với bài toán này, nếu sử dụng phương trình bảo toàn điện tích các em chỉ cần thiết lập hệ 2 phương trình 2 ẩn số là
CHCl và CNaOH ở hai giá trị pH khác nhau, từ đó sẽ tính được nồng độ các chất tham gia phản ứng. Nhưng với cách giải
như vậy chỉ thiên về công cụ tính toán, nặng về ý nghĩa vật lí mà không chú ý đến tư duy hóa học. Chính vì vậy giáo
viên nên hướng dẫn cho các em phân tích bản chất các quá trình xảy ra trong dung dịch. Khi chuẩn độ đến pH = 9,00 >
7,00 → dư NaOH. Vì [OH –] = 10 –5 >> [H+] = 10 –9 do đó: COH –(dư) = = [OH –] = 10 –5 (1)
Nếu chuẩn độ đến pH = 4,4 < 7,00 → dư HCl (M) Vì pH = 4,4 → C + H (dư) = = [H+] = 10 –4,4 (2)
Từ (1) và (2) → CHCl = Co = 3,70.10 –3(M) và CNaOH = C = 7,43.10 –3(M)
Từ ví dụ 4 và 5 ta thấy các bài toán đều giới hạn trong phạm vi là phép chuẩn độ đều kết thúc ở các giá trị pH mà
tại đó có thể bỏ qua quá trình phân li của H2O (pH = 8,0; 9,0; 4,4). Nhưng trên thực tế có thể trung hòa đến giá trị pH
bất kì, do đó giáo viên cần khai thác thêm trường hợp nâng cao này. Ví dụ 6
Chuẩn độ 100,00 ml dung dịch HCl bằng dung dịch NaOH 1,00.10 –2M đến đổi màu metyl đỏ (pT = 6,2) thì hết 45,00 ml NaOH. Tính CHCl. Phân tích:
Đây cũng là dạng bài toán cơ bản giống như ví dụ 5, tuy nhiên tại giá trị pH đổi màu của chỉ thị metyl đỏ, pH = 6,2
(dư axit) thì sự phân li của nước là đáng kể, do đó trong trường hợp này để tính chính xác CHCl, HS cần tính đến cân
bằng phân li của nước. Điều này giúp cho các em, nhất là HS trường chuyên có tư duy hóa học đúng đắn.
Trên cơ sở các bài toán tính nồng độ các chất phản ứng, giáo viên có thể thay bằng các bài toán tính thể tích của
dung dịch thuốc thử, tính hằng số cân bằng v.v.. từ giá trị pH đổi màu của chỉ thị. Ví dụ 7
Chuẩn độ 25,00 ml dung dịch axit benzoic đến đổi màu chỉ thị metyl đỏ
(pT = 6,2) thì hết 20,70 ml dung dịch NaOH 0,100 M. Tính chính xác nồng độ dung dịch axit benzoic. Phân tích
Cũng tương tự như trên GV cần hướng dẫn các em xét các quá trình xảy ra trong hệ. Khác với phép chuẩn độ axit
mạnh, bazơ mạnh, trong bài toán này các em không cần phải đánh giá gần đúng pHTĐ vẫn có thể xác định được phép
chuẩn độ kết thúc trước ĐTĐ vì khi chuẩn độ axit yếu bằng bazơ mạnh thì pHTĐ > 7,0 do đó pHcuối = 6,2 < 7,0. Do đó tại
điểm cuối chuẩn độ dư axit:
C6H5COOH + OH – → C6H5COO – + H2O n (số mmol) 25Co 20,7.0,1
n’ 25Co –01.20,7 – 0,1.20,7 TPGH: C6H5COOH: M; C6H5COO –: M
Do pH = 6,2 ≈ 7,0 cho nên phải kể đến cân bằng phân li của nước, tức là phải tính theo ĐKP với mức không là C6H5COOH để tính được .
Như vậy với bài này, ngoài ĐKP, các em cần phải biết đến khái niệm phân số nồng độ , cho
nên ví dụ này chỉ nên dành cho đối tượng là HS các trường chuyên. Ví dụ 8 [2]
Cân 1,250 g axit yếu HA, hòa tan thành 50,00 ml dung dịch. Dùng dung dịch chuẩn NaOH 0,090 M để chuẩn độ
dung dịch HA. Biết rằng khi thêm 8,240 ml NaOH vào dung dịch phân tích thì pH = 4,30. Nếu thêm 41,20 ml NaOH
vào hỗn hợp chuẩn độ thì đạt được điểm tương đương.
1/ Tính khối lượng mol phân tử HA.
2/ Tính hằng số axit của HA. Phân tích:
Để tính được khối lượng mol phân tử của axit HA, cần phải biết nồng độ gốc Co của axit. Giá trị này HS có thể tính
được ngay vì từ thể tích NaOH cho vào để đạt đến ĐTĐ → VTĐ = 41,20 ml. Từ đó các em tính được Co và tính được MHA.
Để tính hằng số phân li axit của axit HA, GV cần dẫn dắt cho HS xác định được điểm kết thúc chuẩn độ là trước
điểm tương đương do tại thời điểm thêm 8,24 ml NaOH thì pHc = 4,30 < 7,00 < pHTĐ → dư HA, nghĩa là thành phần
của hệ tại điểm cuối chuẩn độ gồm hệ đệm HA 0,051 M và A– 0,0127 M. Từ đó sẽ tính được pKa theo phương trình: pKa = pH –log → Ka = 1,25.10 –5
Ở đây điều kiện sử dụng phương trình pH = pKa + lg hoàn toàn thỏa mãn. Ví dụ 9 [8]
Tính thể tích dung dịch HCl 0,71 M cần tiêu thụ khi chuẩn độ 100 ml dung dịch chứa KCN 0,120 M và NH3 0,15
M đến pH = 9,24. Cho biết pK +
a (HCN) = 9,35; pKa(NH4 ) = 9,24. Phân tích
Đây là phép chuẩn độ hỗn hợp hai đơn bazơ yếu bằng axit mạnh, nhưng hai bazơ này có hằng số phân li axit của
axit liên hợp rất gần nhau vì thế phải chuẩn độ tổng hai bazơ. Cũng tương tự bài trên, nếu có kiến thức về chuẩn độ axit
bazơ thì có thể tính VHCl bằng cách hiệu chỉnh thể tích thông qua sai số chuẩn độ. Tuy nhiên với đối tượng là học sinh
phổ thông chưa được trang bị kiến thức về phương trình sai số, nên giáo viên cần hướng dẫn các em giải theo cách xác
định % mỗi bazơ đã bị chuẩn độ tại pH = 9,24:
tức là tại pH = 9,24 có 50% lượng NH3 và 56,3% CN – đã bị chuẩn độ, từ đó các em dễ dàng tính được VHCl.
Cách giải này đơn giản lại phù hợp với trình độ nhận thức của các em. Để củng cố thêm cho học sinh giáo viên có
thể ra thêm bài tập bằng cách thay hỗn hợp đơn bazơ bằng hỗn hợp đơn axit hoặc có thể thêm vào đó một đơn axit
(bazơ), thay đổi yêu cầu tính toán v.v..
III. Dạng bài toán xác định bước nhảy chuẩn độ (BNCĐ), chọn chỉ thị cho phép chuẩn độ, tính sai số chuẩn độ
Trong chuẩn độ thể tích nói chung, chuẩn độ axit – bazơ nói riêng 3 nội dung này có quan hệ mật thiết và liên
hoàn, vấn đề quan trọng đầu tiên là phải chọn được chỉ thị thích hợp sao cho điểm kết thúc chuẩn độ càng gần với ĐTĐ
càng tốt, tức là pH chuyển màu của chỉ thị phải gần với pHTĐ. Tuy vậy, do sự xuất hiện BNCĐ trên đường cong chuẩn
độ nên không nhất thiết phải chọn chất chỉ thị có pT ≈ pHTĐ mà có thể chọn bất kì chất chỉ thị nào có chỉ số chuẩn độ
nằm trong BNCĐ tương ứng với sai số cho phép. Như vậy để có được kết quả chuẩn độ chính xác, cần thiết phải chọn
được chỉ thị thích hợp. Nếu HS đã được trang bị đầy đủ kiến thức về chuẩn độ axit –bazơ như sinh viên đại học thì các
em có thể tính sai số đối với từng chỉ thị hoặc tính BNCĐ theo phương trình sai số từ đó cho phép chọn chỉ thị một cách
hợp lí. Tuy nhiên đối với HSPT, kiến thức về chuẩn độ được trang bị hết sức sơ lược, vì vậy GV cần vận dụng lí thuyết
về chuẩn độ để có thể hướng dẫn các em giải quyết vấn đề một cách linh hoạt tùy thuộc vào từng bài cụ thể.
Ví dụ 10 (Đề thi Quốc gia ITALIA)[2]
Để chuẩn độ CH3COOH bằng NaOH thì trong các chất chỉ thị sau đây, chất nào là tốt nhất? A. Metyl da cam pKa=3,7. B. Metyl đỏ pKa = 5,1. C. Bromthymol xanh pKa = 7,0. D. Phenolphtalein pKa = 9,4. Phân tích:
Đây là phép chuẩn độ một đơn axit yếu bằng bazơ mạnh, do đó tại ĐTĐ thành phần của hệ là một đơn bazơ yếu → pHTĐ >7.
Để chọn chỉ thị thích hợp cho một phép chuẩn độ có thể căn cứ vào pHTĐ, vào VTĐ (thể tích thuốc thử tiêu thụ để
đạt đến ĐTĐ) hoặc căn cứ vào BNCĐ. Muốn tính được VTĐ hoặc BNCĐ các em phải có số liệu về nồng độ các chất
phản ứng và thể tích chất phân tích. Nhưng ở đây bài ra chỉ hỏi chung chung, vì vậy HS chỉ cần chọn chỉ thị nào có pT
mà cụ thể ở bài này là giá trị pKa > 7 là được. Ví dụ 11
Tính bước nhảy pH (BNCĐ) của phép chuẩn độ 100 ml dung dịch HCl 0,100 M bằng dung dịch NaOH 0,100 M nếu
chấp nhận sai số chuẩn độ không vượt quá 0,1%. Phân tích:
Mặc dù chưa được học về phương trình sai số, nhưng GV có thể giải thích để các em nắm được khái niệm rất đơn
giản về BNCĐ (hay bước nhảy pH) là khoảng pH thay đổi đột ngột xung quanh ĐTĐ [9].
Ở đây để xác định được BNCĐ ứng với sai số không vượt quá 0,1%, GV chỉ cần hướng dẫn HS tính các giá trị pH
ứng với thể tích NaOH cho vào thiếu (Vđ: thể tích đầu bước nhảy) và thừa (Vc: thể tích cuối bước nhảy) 0,1% so với thể
tích NaOH cần thiết để đạt đến ĐTĐ (VTĐ): VTĐ = = 100 ml, suy ra: Vđ = VTĐ.99,99% = 99,9 ml Vc = VTĐ.100,1% = 100,1 ml.
Từ các giá trị Vđ và Vc các em dễ dàng tính được pH tương ứng là 4,30 và 9,70. Điều đó có nghĩa là với sai số
không vượt quá 0,1% thì BNCĐ trong phép chuẩn độ trên là 4,3 – 9,7. Ví dụ 12
Chuẩn độ 100 ml dung dịch HCl 0,100 M bằng dung dịch chuẩn NaOH 0,100 M. Có thể dùng chất nào trong 3 chất
sau: metyl da cam, metyl đỏ, phenolphtalein làm chỉ thị thích hợp cho phép chuẩn độ trên với sai số không vượt quá 0,1%. Phân tích:
Đây là phép chuẩn độ axit mạnh bằng bazơ mạnh, pHTĐ =7,00. Theo nguyên tắc chúng ta chỉ chọn chỉ thị nào có
chỉ số chuẩn độ pT ≈ pHTĐ (chất có sự đổi màu rõ nhất tại giá trị pH≈ pHTĐ ). Như vậy trong số 3 chỉ thị trên cùng lắm
chúng ta chỉ “dám” chọn chỉ thị metyl đỏ có pT = 6,2 ≈ 7,00 = pHTĐ cho phép chuẩn độ này. Nhưng với kiến thức về
chuẩn độ axit bazơ, chúng ta đã biết là sự xuất hiện BNCĐ trên đường cong chuẩn độ cho phép mở rộng phạm vi chọn
chỉ thị: có thể chọn bất kì chỉ thị nào có chỉ số chuẩn độ pT (hay có pH tại điểm chuyển màu rõ nhất) nằm trong BNCĐ
ứng với sai số cho phép. Chính vì vậy để chọn được chỉ thị thích hợp chúng ta có thể tính BNCĐ ứng với sai số cho
trước. Với BNCĐ đã tính được là 4,3 đến 9,7 thì đối với phép chuẩn độ trên hoàn toàn có thể dùng được cả 3 chất chỉ thị. Ví dụ 13 [5]
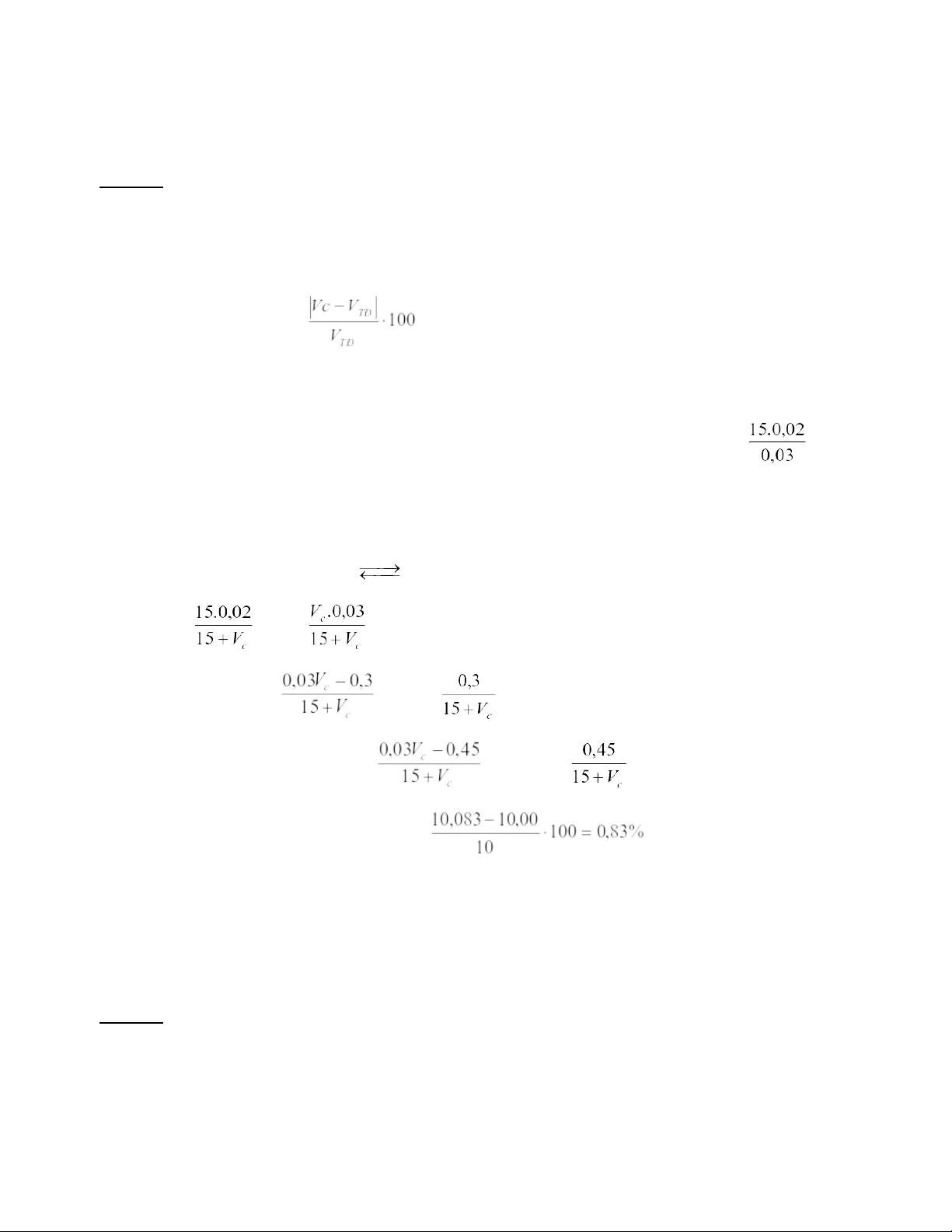
Đánh giá sai số khi chuẩn độ 15,00 ml dung dịch NH3 0,020 M bằng dung dịch HCl 0,030 M đến xuất hiện màu đỏ của metyl da cam (pT = 4,0). Phân tích
Việc đánh giá sai số của phép chuẩn độ rất quan trọng vì từ đó biết được việc chọn chỉ thị đã phù hợp chưa, kết quả
thu được từ phép chuẩn độ có đáng tin cậy, tin cậy ở mức độ nào để có cách xử lí số liệu.
Để tính được sai số chuẩn độ, GV cần hướng dẫn để các em hiểu khái niệm về sai số: Sai số chuẩn độ là tỉ số %
giữa lượng thuốc thử đã cho dư hoặc còn thiếu so với lượng cần thiết để chuẩn độ đến điểm tương đương. Như vậy: q =
trong đó Vc: là thể tích thuốc thử tại điểm cuối chuẩn độ
VTĐ: là thể tích thuốc thử tại điểm tương đương
Như vậy để tính được q, các em phải tính được VTĐ từ phương trình phản ứng chuẩn độ: VTĐ = = 10 ml
Để tính Vc cần phải xác định được thành phần của hệ tại thời điểm chỉ thị đổi màu. Muốn thế cần phải tính được pH +
TĐ theo quá trình phân ly của NH4 . Từ giá trị pHTĐ = 5,58 > pHc = 4,0 → dừng chuẩn độ sau điểm tương đương → dư H+ theo phản ứng: NH + 3 + H+ NH4 C C’ _
Từ thành phần của hệ tại ĐCCĐ gồm: H+ M và NH +4 M
Các em sẽ dễ dàng tính được Vc = 10,083 → q =
Như vậy mặc dù cách giải dài hơn nhưng phù hợp với trình độ của HSPT, giúp các em phát triển được tư duy hóa học. Ví dụ 14
Có thể dùng phenolphtalein làm chỉ thị cho phép chuẩn độ 25,00 ml dung dịch axit benzoic 0,1 M bằng dung dịch
NaOH 0,2 M được không, nếu sai số cho phép không vượt quá 0,1%? Phân tích
Cũng giống như dạng bài chọn chỉ thị thích hợp cho phép chuẩn độ axit mạnh, bazơ mạnh. Để giải quyết bài toán
này, hoặc phải tính được pHTĐ để so sánh với giá trị pT của chỉ thị, hoặc phải tính BNCĐ và xem giá trị pT có nằm
trong BNCĐ không? Đối với HS trường chuyên, việc xác định pHTĐ là hoàn toàn có thể thực hiện được và các em dễ
dàng tính được pHTĐ = 8,5 ≈ 9,00 = pT của chỉ thị phenolphtalein. Do đó có thể chọn được phenolphtalein làm chỉ thị cho phép chuẩn độ trên.
Tuy nhiên không phải lúc nào cũng chọn được chỉ thị có pT xấp xỉ pHTĐ, vì vậy để đánh giá chính xác hơn cần phải
tính được BNCĐ từ các giá trị thể tích NaOH cho vào thiếu hoặc thừa so với VTĐ là 0,1%. Từ hai giá trị thể tích này các
em sẽ tính được giá trị pHđ = 7,2 và pHc = 9,8. Mặc dù pHđ = 7,2 ≈ 7,00 lẽ ra cần phải đánh giá chính xác theo ĐKP vì
phải kể đến cân bằng phân li của H2O. Nhưng nếu chỉ cần so sánh với pTphenolphtalein = 9,00 thì có thể chấp nhận được giá trị gần đúng này.
Vậy BNCĐ = 7,2 – 9,8 → có thể chọn được phenolphtalein làm chỉ thị cho phép chuẩn độ trên vì pTphenolphtalein thuộc BNCĐ. Ví dụ 15
Tính pH của dung dịch NaOH 0,01 M và CH3COONa 0,02 M. Có khả năng chuẩn độ riêng NaOH trong hỗn hợp
trên dùng phenolphtalein làm chỉ thị (pT = 8,0) được không? (dùng chất chuẩn là HCl 0,100 M). Phân tích
Để trả lời câu hỏi có thể chuẩn độ riêng NaOH trong hỗn hợp trên khi dùng phenolphtalein làm chỉ thị được
không, đối với HS trường chuyên, hoặc với đội tuyển quốc gia, GV có thể hướng dẫn theo hai cách sau:
Cách 1: Xét xem tại điểm dừng chuẩn độ ứng với giá trị pH = 8 thì phần trăm lượng CH3COO – đã bị chuẩn độ là
bao nhiêu, bằng cách tính tỉ số: hay 0,0575%.
Như vậy khi dừng chuẩn độ tại pH = 8 lượng CH3COO – bị chuẩn độ khá nhỏ, nên có thể coi chuẩn độ riêng được NaOH trong hỗn hợp trên.
Cách 2: Hoặc GV có thể hướng dẫn các em tính pH của dung dịch khi vừa chuẩn độ hết NaOH tức là tính pH của
dung dịch CH3COO – rồi so sánh với giá trị pH dừng chuẩn độ (pH = 8) để rút ra kết luận. Nhưng để tính được pH của
dung dịch CH3COO – thì bài ra phải cho thêm thể tích của hỗn hợp để HS tính lại nồng độ của CH3COO – tại thời điểm
chuẩn độ hết NaOH. Giả sử bài ra cho thể tích của dung dịch chuẩn độ là 50 ml → thể tích dung dịch cần để chuẩn độ hết NaOH là V1 = . Khi đó
và HS dễ dàng tính được pH của dung dịch CH3COO –.
0,0182 M bằng 8,5 trong khi pH dừng chuẩn độ là 8. Như vậy CH3COO – cũng bị chuẩn độ một lượng nhỏ, do đó
có thể chuẩn độ riêng được NaOH trong hỗn hợp khi dùng chất chỉ thị là phenolphtalein với chất chuẩn là HCl 0,1M.
IV. Dạng bài toán vẽ đường cong chuẩn độ, xác định thành phần của hệ chuẩn độ Ví dụ 16
Chuẩn độ 100 ml dung dịch HCl 0,100 M bằng dung dịch NaOH 0,100 M. Hãy vẽ dạng đường cong chuẩn độ của phép chuẩn độ trên. Phân tích:
Trước hết GV cần giải thích cho HS hiểu được khái niệm về đường cong chuẩn độ chính là đường biểu diễn sự
biến thiên pH của dung dịch theo VNaOH thêm vào trong quá trình chuẩn độ. Từ đó GV cần hướng dẫn cho các em thiết
lập sự phụ thuộc của pH theo thể tích của thuốc thử ở từng thời điểm. Ví dụ: * Trước ĐTĐ → dư axit: H+ + OH – H2O C C’ _
Chấp nhận [H+] = CHCl(dư) =
* Sau ĐTĐ → dư OH – với CNaOH(dư) = * Tại ĐTĐ: pH = 7,00.
Như vậy biết thể tích thuốc thử (V), chúng ta sẽ tính được pH, từ đó sẽ vẽ được đường chuẩn độ. Vì ở đây chỉ yêu
cầu HS vẽ dạng đường cong nên không yêu cầu các em phải kể đến sự phân li của nước và GV nên hướng dẫn để các
em có thể chú ý xác định một số điểm đặc biệt như khi chưa chuẩn độ (V = 0 ml), điểm đầu và cuối bước nhảy (pH đ,
pHc) tùy theo sai số chọn và ĐTĐ (pHTĐ), v.v….
Ví dụ, đối với phép chuẩn độ đã cho, các em tính được các giá trị pH tương ứng theo VNaOH và ghi số liệu thu được theo bảng sau: VNaOH 0 10 50 90 99 99,9 100 100,1 101 110 pH 1 1,1 1,48 2,28 3,30 4,30 7,0 9,70 10,7 11,68
Từ các số liệu thu được, HS vẽ đồ thị biểu diễn sự phụ thuộc pH = f(V), từ đó HS có thể nhận xét khoảng bước nhảy pH.
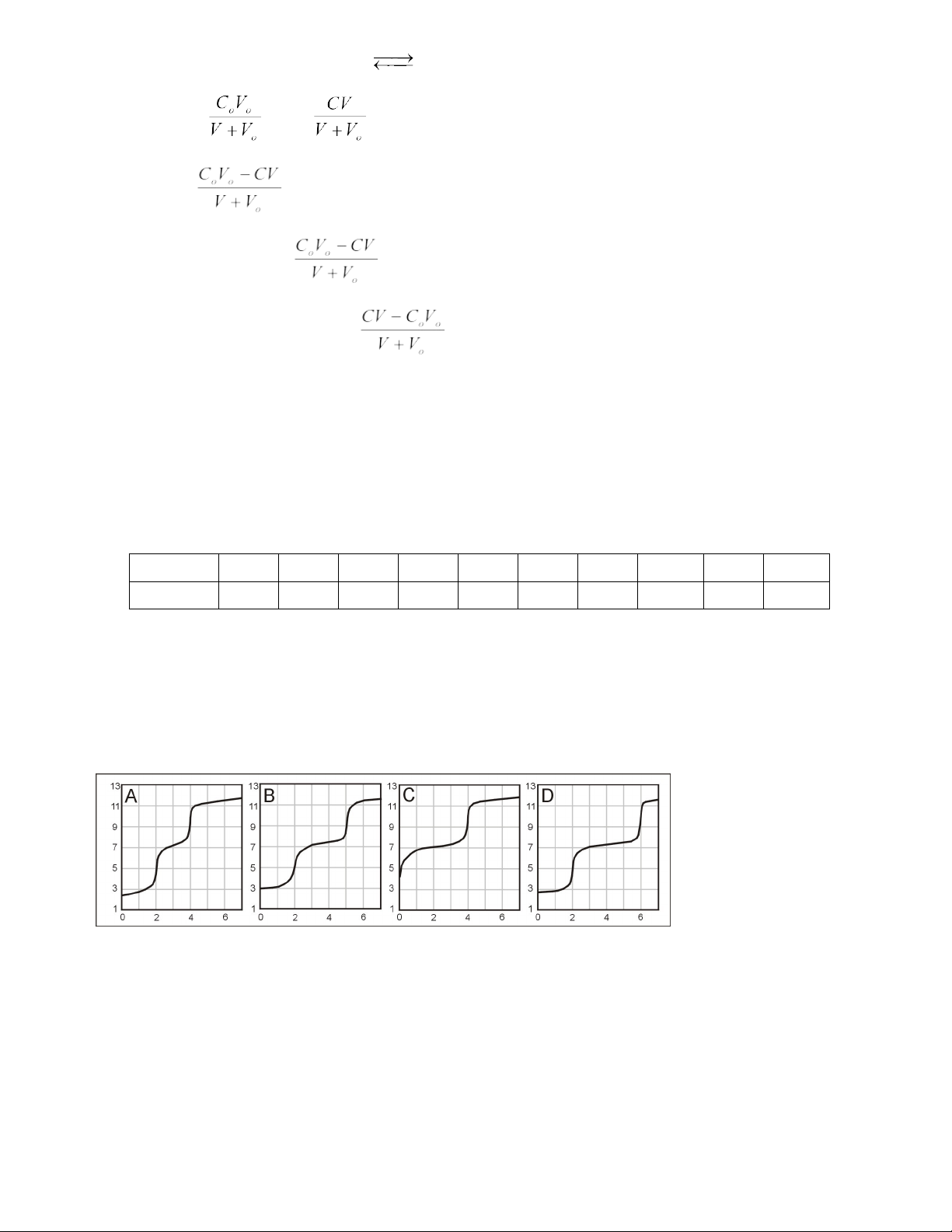
Ví dụ 17 (Đề thi Olympic Quốc tế 2003 – Hy Lạp) [6]
Dung dịch H3PO4 và/hoặc NaH2PO4 được chuẩn độ với dung dịch chuẩn bazơ mạnh. Kết hợp thành phần các dung
dịch này với các đường cong chuẩn độ (pH theo thể tích dung dịch chuẩn độ) nêu trong hình (với H3PO4: pK1 = 2,15; pK2 = 7,2; pK3 = 12,0). pH
Thể tích dung dịch chuẩn độ (mL) Cho biết: a) Mẫu chỉ chứa H3PO4.
b) Mẫu chứa cả hai theo tỉ lệ mol H3PO4: NaH2PO4 là 2:1.
c) Mẫu chứa cả hai theo tỉ lệ mol H3PO4: NaH2PO4 là 1:1. Phân tích
Đây là dạng bài phân tích dạng đường cong chuẩn độ để xác định thành phần của dung dịch phân tích. Như vậy để
làm được bài tập này, HS phải hiểu được cách xây dựng đường cong chuẩn độ, phải phân tích được từng giai đoạn
chuẩn độ trên đường cong chuẩn độ, phải nắm được khái niệm BNCĐ và khả năng chuẩn độ riêng từng nấc cũng như
điều kiện để một phép chuẩn độ có thể thực hiện được. Đây là một yêu cầu rất cao đối với HS, vì dạng này rất ít gặp đối
với các em. Trước hết GV cần hướng dẫn để các em xác định được đối với axit 3 chức H3PO4 có tỉ lệ > 104;
> 104 nhưng vì Ka3 =10 –12,0 (rất nhỏ), nên có khả năng chuẩn độ riêng nấc 1 và nấc
2, nhưng không chuẩn độ được nấc 3. Và đây là phép chuẩn độ một axit ba chức (hoặc hỗn hợp) nên trên trục hoành của
cả 4 hình vẽ đều có 3 điểm ứng với các thể tích của các thuốc thử là
2 ml, 4 ml, 6 ml ứng với 3 điểm tương đương. Và tùy thuộc vào thành phần của mẫu phân tích sẽ có các ĐTĐ ứng với các thể tích khác nhau.
Tiếp theo GV cần phân tích dạng đường cong để các em hiểu được những đoạn gần như thẳng đứng trên đường
cong chuẩn độ đặc trưng cho BNCĐ và ứng với các ĐTĐ để suy ra thành phần của hệ phân tích.
Như vậy căn cứ vào thể tích tiêu thụ V1 (ứng với ĐTĐ1), V2 (ứng với ĐTĐ2), HS sẽ tìm được các dạng đường cong
tương ứng với từng mẫu phân tích: Đối với mẫu phân tích chứa H –
3PO4 và H2PO4 có tỉ lệ 1:1 ứng với đường cong D;
mẫu phân tích chứa cả 2 chất theo tỉ lệ mol là H –
3PO4: H2PO4 = 2:1 ứng với đường cong B và mẫu chỉ gồm H3PO4 ứng với đường cong A.
Ví dụ 18 (Đề thi vòng 3 Olympic Đức 2000)[6]
Cho hai hỗn hợp A và B. Hỗn hợp A chứa Na2CO3 và NaHCO3. Hỗn hợp B chứa Na2CO3 và NaOH. Hòa tan một
trong hai hỗn hợp này vào nước, và pha thành 100 ml dung dịch. Chuẩn độ 20,00 ml dung dịch thu được bằng dung dịch
HCl 0,200 M với chất chỉ thị phenolphtalein, hết 36,15 ml HCl. Nếu sử dụng chất chỉ thị metyl da cam thì thể tích HCl tiêu thụ là 43,8 ml.
1/ Hãy cho biết phản ứng nào xảy ra hoàn toàn khi dung dịch chuyển màu.
2/ Hãy cho biết (có giải thích) hỗn hợp phân tích là hỗn hợp A hay B.
3/ Hãy xác định thành phần phần trăm khối lượng của hỗn hợp đã phân tích. Cho biết: khoảng chuyển màu của
phenolphtalein: pH = 8,3 – 10; của metyl da cam: pH = 3,1 – 4,4. Phân tích
Để giải được bài này, học sinh cần phải xác định được giá trị pH mà tại đó mỗi chỉ thị chuyển màu trong từng phép
chuẩn độ và các em phải viết được phản ứng xảy ra khi chỉ thị thay đổi tính hiệu.
Do thành phần của cả hai hỗn hợp A và B đều chứa CO 2 – 3
, do đó GV cần hướng dẫn để HS xác định được khả
năng chuẩn độ riêng từng nấc của đa bazơ từ việc xét tỉ lệ giữa
. Sau đó các em phải liên hệ giữa giá trị pH chuyển
màu của phenolphtalein (pT = 8,3) với các giá trị pKa1, pKa2 để thấy rằng khi chất chỉ thị phenolphtalein mất màu, phép
chuẩn độ dừng ở nấc 1 tạo thành HCO –
3 . Và tại giá trị pH chuyển màu của metyl da cam (pT = 4,0), phép chuẩn độ dừng ở nấc 2.
Để xác định hỗn hợp phân tích là A hay B, các em phải căn cứ vào quan hệ thể tích tiêu thụ của thuốc thử (HCl) tại
hai điểm dừng chuẩn độ là V1 (khi dùng phenolphtalein) và V2 (khi dùng metyl da cam):
Nếu mẫu phân tích chỉ có CO 2 – 3 thì V2 ≈ 2V1.
Nếu trong mẫu chứa CO 2 – – 3 và HCO3 thì V2 > 2V1.
Và nếu mẫu phân tích gồm CO 2 – 3 và OH – thì V2 < 2V1.
Theo bài ra ta thấy V2 < 2 V1. Vậy hỗn hợp phân tích là hỗn hợp B.
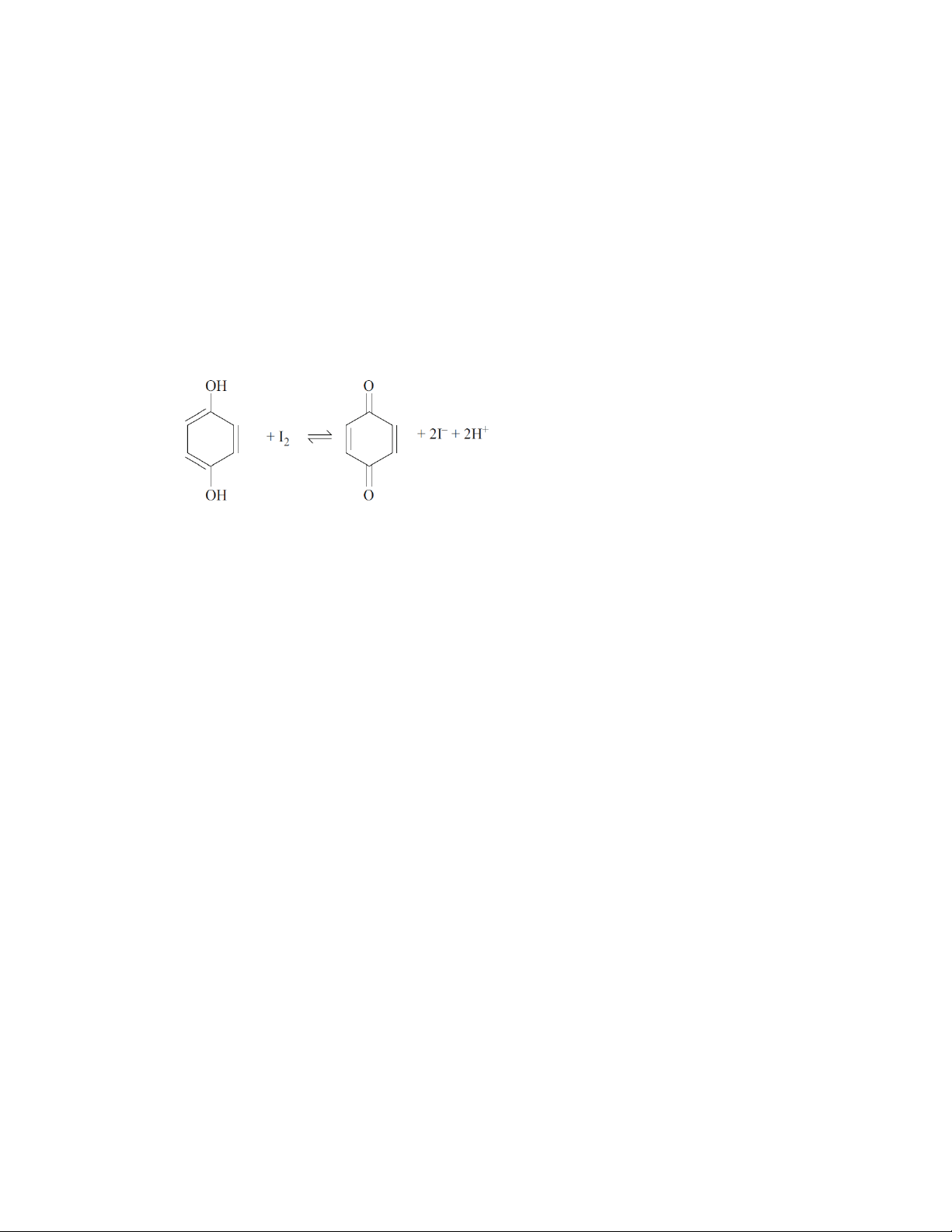
PHƯƠNG PHÁP CHUẨN ĐỘ IOT- THIOSUNFAT
Phương pháp chuẩn độ iot- thiosunfat dựa trên bán phản ứng oxi hoá khử: I2 + 2 e 2 I-
và phản ứng chuẩn độ iot: 2 S 2- 2- 2O3 + I2 S4O6 + 2 I-
thiosunfat tetrathionat
với chất chỉ thị là hồ tinh bột.
*Điều kiện tiến hành phản ứng chuẩn độ:
Phải tiến hành chuẩn độ trong môi trường axit yếu (2 < pH < 5) vì:
Trong môi trường kiềm: S 2- 2-
2O3 + 10 OH- + 4 I2 2 SO4 + 8 I- + 5 H2O 3 I -
2 + 6 OH- 5 I- + IO3 + 3 H2O
Trong môi trường axit mạnh (pH < 2): 2 H+ + S 2- 2O3 SO2 + S + H2O
Chuẩn độ nguội vì I2 là chất dễ bay hơi và hồ tinh bột kém phản ứng với I2 khi đun nóng.
Sử dụng KI dư để phản ứng hoàn toàn và hoà tan I - 2 sinh ra (I2 + I- I3 ).
Phải để yên dung dịch cho phản ứng hoàn toàn và để trong bóng tối để tránh phản ứng phụ. 4 H+ + 4 I- + O2 2 I2 + 2 H2O
*Phạm vi ứng dụng: Hệ I2/2I- có thế khử vừa phải (0,54V) do đó I- có thể là chất khử đối với nhiều chất oxi hóa và
I2 có thể là chất oxi hóa đối với một số chất khử, vì vậy có thể dùng phương pháp iot-thiosunfat để xác định các chất
khử và các chất oxi hóa.
1 Xác định các chất oxi hóa
Phương pháp iot- thiosunfat cho phép xác định các chất oxi hóa như Cr 2- - -
2O7 , MnO4 , MnO2, NO2 , O2, O3, H2O2, IO - - 2-
3 , BrO3 , ClO-, S2O8 , Cl2, Br2, Fe3+, Cu2+ ... Nguyên tắc chung: Ox + I- I2 + Kh 2 S 2- 2- 2O3 + I2 S4O6 + 2 I- Một số phản ứng:
IO -3 + 5 I- + 6 H+ 3 I2 + 3 H2O
2 HNO2 + 2 I− + 2 H+ 2 NO + 2 H2O + I2 Cr 2–
2O7 + 6 I– + 14 H+ 2 Cr3+ + 3 I2 + 7 H2O 2 Cu2+ + 4 I- 2 CuI + I2 (có mặt SCN-)
2 Ce4+ + 2 I− 2 Ce3+ + I2
2 Fe3+ + 2 I− 2 Fe2+ + I2
H2O2 + 2 H+ + 2 I− I2 + 2 H2O
PbO2 + 4 H+ + 2 I− Pb2+ + 2 H2O + I2 2 Fe(CN) 3- 4- 6 + 2 I- 2 Fe(CN)6 + I2 2 Fe(CN) 4-
6 + 2 K+ + 3 Zn2+ K2Zn3[Fe(CN)6]2
Thí dụ 1: Để xác định nồng độ của Na2S2O3 người ta tiến hành như sau: Hoà tan 0,2940 gam K2Cr2O7 thành 200,00 ml
dung dịch. Lấy 25,00 ml dung dịch thu được axit hoá bằng H2SO4, thêm KI dư và để trong bóng tối 10 phút. Chuẩn độ I2
giải phóng ra hết 10 ml Na2S2O3.
(a) Tại sao không dùng dung dịch chuẩn I2 để chuẩn Na2S2O3 mà phải điều chế I2 tại chỗ.
(b) Tại sao không chuẩn độ trực tiếp Na2S2O3 bằng dung dịch K2Cr2O7 mà phải thông qua I2.
(c) Tính nồng độ mol/l của dung dịch Na2S2O3.
(a. Vì I2 dễ thăng hoa;
b. Vì phản ứng của K2Cr2O7 với Na2S2O3 xảy ra phức tạp, không biểu diễn được bằng một phản ứng đơn giản; c. 0,075M)
Thí dụ 2: Quy trình phân tích Cu trong mẫu đồng thau được tiến hành như sau: Hòa tan 2,8 g hợp kim đồng thau trong
dung dịch HNO3 đặc, nóng. Chuyển dung dịch thu được vào bình định mức 250,0 ml và định mức bằng nước cất đến
vạch. Lấy 25,0 ml dung dịch, thêm Na2CO3 để trung hòa axit dư đến thoáng xuất hiện kết tủa, hòa tan kết tủa bằng
dung dịch CH3COOH vừa đủ. Thêm KI dư và chuẩn độ I2 sinh ra bằng dung dịch Na2S2O3 0,100M thấy hết 29,8 mL.
(a) Viết các phương trình phản ứng xảy ra.
(b) Tính % khối lượng Cu trong hợp kim đồng thau (Cu= 63,45). (a.
Cu + 4 H+ + 2 NO -3 Cu2+ + 2 NO2 + 2 H2O x x CO 2-
3 + 2 H+ H2O + CO2
2 Cu2+ + 4 I- 2 CuI + I2 x/10 x/20 I 2- 2-
2 + 2 S2O3 2 I- + S4O6 x/20 x/10
MR: Tại sao phải trung hòa axit trước khi tiến hành chuẩn độ? b. Có: => x = 0,0298 mol => )
2 Xác định các chất khử
Phương pháp iot- thiosunfat cho phép xác định các chất khử như axit ascorbic, N 2- 3-
2H4, PbEt4, SO3 , S2-, Sn2+, AsO3 ... Kh + I2 2 I- + Ox 2 S 2- 2- 2O3 + I2 (dư) S4O6 + 2 I-
2 I2 + N2H4 4 I- + N2 + 4 H+ PbEt4 + I2 PbEt3I + EtI 5 CO + I2O5 I2 (k) + 5 CO2 SO 2-
2 + I2 + 2 H2O SO4 + 2 I- + 4 H+ H2S + I2 2 H+ + 2 I- + S CN- + I2 ICN- + I-
(phương pháp Fordos và Gelis) SCN− + 4 I 2−
2 + 4 H2O SO4 + 7 I− + ICN + 8 H+ SO 2- 2-
3 + I2 + H2O SO4 + 2 I- + 2 H+
2 SbO+ + 3 H2O + 2 I2 Sb2O5 + 4 I− + 6 H+ Sn2+ + I2 Sn4+ + 2 I−
H2C6H6O6 + I2 C6H6O6 + 2 HI axit ascorbic
C6H5-NH-NH2 + 2 I2 N2 + C6H5I + 3 H+ + 3 I− phenylhidrazin NH +
2-NH-CO-NH2 + 2 I2 + H2O N2 + CO2 + NH4 + 3 H+ + 4 I− semicacbazit
RCHO + I2 + 3 OH− RCOO− + 2 I− + 2 H2O
Thí dụ 1: Mức tối đa cho phép của H2S trong không khí là 0,01 mg/L. Phương pháp chuẩn độ điện lượng được dùng để
đánh giá sự ô nhiễm không khí của nhà máy. Phương pháp được tiến hành như sau: iot được điều chế bằng cách điện
phân dung dịch KI trong khoảng thời gian 2 phút bằng dòng điện 2 mA. Sau đó cho 2L khí thải lội từ từ qua dung dịch
điện phân làm cho iot hoàn toàn mất mầu. Sau đó thêm hồ tinh bột vào và lại tiếp tục điện phân thêm 35 giây nữa với
cùng cường độ dòng thì dung dịch bắt đầu xuất hiện mầu xanh. Hiệu suất dòng là 100%, F= 96500 C/mol.
(a) Viết các ptpư điều chế iot và phản ứng chuẩn độ.
(b) Hãy cho biết vai trò của hồ tinh bột?
(c) Điện lượng tiêu tốn tổng cộng để điều chế iot là bao nhiêu?
(d) Hàm lượng H2S trong khí thải của nhà máy là bao nhiêu? (tính theo mg/L).
(e) Sự nhiễm bẩn nằm trên hay dưới mức cho phép? (c. q = It= 0,31C d. 0,027 mg/L
e. vượt mức cho phép)
3 Xác định các chất không có tính oxi hóa- khử
Phương pháp iot- thiosunfat cho phép xác định các chất không có tính oxi hóa - khử như Pb2+, SO 2- 4 ...
Pb2+ PbCrO4 H2Cr2O7 I2 SO 2- 2- 2-
4 + BaCrO4 BaSO4 + CrO4 (chuẩn CrO4 sinh ra bằng phương pháp iot-thiosunfat)
Thí dụ 1: Để định lượng chì trong quặng người ta phân huỷ 1,1050 gam mẫu quặng thành dung dịch. Từ dung dịch đó
thực hiện quy trình để kết tủa định lượng chì trong mẫu thành PbCrO4. Hoà tan PbCrO4 bằng dung dịch hỗn hợp HCl
và NaCl dư. Thêm vào dung dịch thu được một lượng dư KI và chuẩn độ lượng I2 thoát ra bằng dung dịch chuẩn
Na2S2O3 0,0962M thấy vừa hết 24,20 ml. Tính hàm lượng chì trong quặng theo % khối lượng. (Pb = 207,2).
(Các phản ứng xảy ra: 2PbCrO 2- 2-
4 + 2H+ + 8Cl- 2PbCl4 + Cr2O7 + H2O Cr 2-
2O7 + 6I- + 14H+ 2Cr3+ + 3I2 + 7H2O I 2- 2-
2 + 2S2O3 2I- + S4O6
Sơ đồ hợp thức: 2Pb 2PbCrO 2- 2-
4 Cr2O7 3I2 6S2O3 => => )
Thí dụ 2: Quy trình phân tích chì bằng phương pháp chuẩn độ thể tích: Xử lý dung dịch Pb2+ với lượng dư dung dịch CrO 2-
4 . Lọc, rửa kết tủa và hoà tan kết tủa bằng dung dịch HCl dư thu được PbCl 2 và H2Cr2O7. Trong môi trường axit, Cr 2-
2O7 oxi hoá iođua thành I2 và giải phóng Cr3+. Chuẩn độ I2 sinh ra bằng dung dịch chuẩn Na2S2O3.
(a) Hãy viết các phương trình phản ứng xảy ra trong quy trình.
(b) Chứng minh rằng từ 1 mol Pb2+ ban đầu sẽ sinh ra 1,5 mol I2.
(c) 1,0 gam mẫu PbO (có chứa tạp chất trơ) được phân tích theo quy trình trên thu được 200,0 mL dung dịch H2Cr2O7
(dung dịch A). Lấy 25,0 mL dung dịch A cho phản ứng với lượng dư KI. Lượng I2 giải phóng được chuẩn độ bằng dung
dịch Na2S2O3 0,1050M thấy vừa hết 15,57 mL. Hãy tính % khối lượng PbO trong mẫu ban đầu (Pb = 207,2).
(d) Hãy cho biết chất chỉ thị được sử dụng để xác định điểm tương đương trong phép chuẩn độ trên.
(e) Hãy cho biết nguyên tố nào nếu có mặt trong mẫu sẽ gây sai số cho phép phân tích? (a. Pb2+ + CrO 2- 4 PbCrO4 (r)
2 PbCrO4 + 4 HCl 2 PbCl2 + H2Cr2O7 + H2O Cr 2-
2O7 + 6 I- + 14 H+ 2 Cr3+ + 3 I2 + 7 H2O I 2- 2-
2 + 2 S2O3 2 I- + S4O6
b. Sơ đồ hợp thức:
Pb2+ PbCrO4 0,5 H2Cr2O7 1,5 I2 c. 97,3%; d. Hồ tinh bột
e. Các nguyên tố kết tủa được với cromat: Ca2+, Ag+, Ba2+) ---***---
Document Outline
- PHƯƠNG PHÁP CHUẨN ĐỘ IOT- THIOSUNFAT




