Preview text:
Mai Phước Đạt
MỘT SỐ LÝ THUYẾT HÓA 9
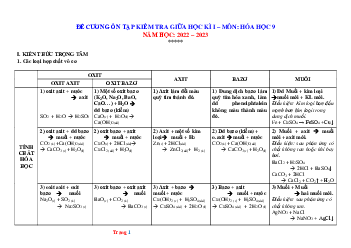
1) Tính chất hóa học của các chất vô cơ
Tính chất hóa học đặc trưng
+ H2O (CaO, Na2O, K2O, BaO, Li2O) → dung dịch bazo. Ví dụ: Na2O + H2O → 2NaOH Oxit axit + Oxit axit → muối Ví dụ: K2O + CO2 → K2CO3 + dd axit → muối + H2O
Ví dụ: BaO + 2HCl → BaCl2 + H2O. + H2O → dung dịch axit Ví dụ: SO3 + H2O → H2SO4 Oxit bazo + Oxit bazo → muối
Ví dụ: Na2O + CO2 → Na2CO3 + dd bazo → muối + H2O
Ví dụ: CO2 + 2NaOH → Na2CO3 + H2O. Axit
+ Quỳ tím → quỳ tím hóa đỏ
(HCl, H2SO4 loãng) + Kim loại → muối + H2
Ví dụ: Fe + 2HCl → FeCl2 + H2 + bazo → muối + H2O
Ví dụ: Fe(OH)2 + 2HCl → FeCl2 + 2H2O + oxit bazo → muối + H2O
Ví dụ: CuO + 2HCl → CuCl2 + H2O Axit H
Khi pha loãng axit đặc, nóng cần đổ từ từ axit vào nước rồi khuấy 2SO4 đặc đề.
+ Nóng: phản ứng hầu hết kim loại tạo muối + SO2 (thường) + H2O.
Ví dụ: Cu + 2H2SO4 đặc t ° CuSO → 4 + SO2 + 2H2O + Tính háo nước:
C6H12O6 H2 SO4đặc 12C + 11H → 2O
+ Nguội: Không hòa tan được Al, Fe,…
+ Quỳ tím → quỳ tím hóa xanh
+ Oxit axit → muối + H2O (phản ứng chỉ xảy ra trong dung dịch) Ví dụ: + Axit → muối + H2O Bazo Ví dụ:
+ Bazo không tan bị nhiệt phân → oxit tương ứng + H2O
Ví dụ: 2Fe(OH)3 t ° Fe → 2O3 + 3H2O
Lưu ý: 4Fe(OH)2 + O2 → 2Fe2O3 + 4H2O 1
Mai Phước Đạt
+ Axit → Muối mới + axit mới (trừ H2CO3, H2SO3,…)
Ví dụ: AgNO3 + HCl → AgCl↓ + HNO3
BaCO3 + 2HCl → BaCl2 + CO2↑ + H2O
+ Dung dịch bazo → muối mới + bazo mới (muối dùng phải tan).
Ví dụ: MgCl2 + 2NaOH → Mg(OH)2 ↓ + 2NaCl
+ Dung dịch muối → muối mới (muối dùng phải tan) Muối
Ví dụ: Na2CO3 + BaCl2 → BaCO3 ↓ + 2NaCl
+ Kim loại → Kim loại mới + muối mới (kim loại không tan
trong nước và mạnh hơn kim loại trong muối, muối dùng phải tan)
Ví dụ: Fe + CuSO4 → FeSO4 + Cu ↓ + Phản ứng nhiệt phân.
Ví dụ: 2KClO3 → 2KCl + 3O2
*Tính tan của 1 số chất trong nước:
- Hợp chất có chứa Na, K, NH + −¿¿ 4 , NO3 đều tan.
- Bazo: hầu hết không tan trừ NaOH, Ba(OH)2, KOH, Ca(OH)2, LiOH. - Muối:
–Cl : AgCl không tan, PbCl2 ít tan.
=CO3, =SO3: Hầu hết không tan.
=SO4: BaSO4 không tan, CaSO4 ít tan.
≡PO4: Hầu hết không tan *Phân loại oxit
- Oxit bazo: là những oxit tác dụng với dung dịch axit tạo thành muối và nước.
- Oxit axit: là những oxit tác dụng với dung dịch bazo tạo thành muối và nước.
- Oxit lưỡng tính: là những oxit tác dụng với dung dịch axit và dung dịch bazo tạo
thành muối và nước. Ví dụ: Al2O3, ZnO,…
- Oxit trung tính: là những oxit không tác dụng với axit, bazo, nước. Ví dụ: CO, NO,…
*Phản ứng trao đổi là phản ứng hóa học, trong đó 2 hợp chất tham gia phản ứng trao đổi
với nhau những thành phần cấu tạo của chúng để tạo ra những hợp chất mới. Điều kiện:
sản phẩm có chất không tan, chất khí hoặc nước. 2
Mai Phước Đạt
Ví dụ: NaOH + HCl → NaCl + H2O
BaCl2 + Na2CO3 → BaCO3 ↓+ 2NaCl
MgCO3 + H2SO4 → MgSO4 + CO2 ↑ + H2O *Phân bón hóa học
- Phân bón đơn: Là phân bón chỉ chứa một trong ba nguyên tố dinh dưỡng chính là đạm (N), Lân (P), Kali (K).
+ Phân đạm: Urê CO(NH2)2, Amoni nitrat NH4NO3, Amoni sunfat (NH4)2SO4.
+ Phân lân: Ca3(PO4)2 không tan trong nước, Supephotphat Ca(H2PO4)2 tan được trong nước. + Phân kali: KCl, K2SO4.
- Phân bón kép: là phân bón có chứa 2 hoặc 3 nguyên tố dinh dưỡng N, P, K. Ví dụ: (NH4)2HPO4, KNO3,…
- Phân bón vi lượng: là phân bón chứa một số nguyên tố hóa học (như bo, kẽm, mangan,
…dưới dạng hợp chất) mà cây cần rất ít nhưng lại cần thiết cho sự phát triển của cây trồng. 2) Kim loại:
a) Tính chất vật lí: dẫn điện, dẫn nhiệt, tính dẻo, ánh kim. b) Tính chất hóa học: - Tác dụng với phim kim: + O2 → oxit
Ví dụ: 4Al + 3O2 t ° 2Al → 2O3 + Phi kim khác (S, Cl2,…)
Ví dụ: Mg + Cl2 t ° MgCl → 2
- Tác dụng với dung dịch axit → muối + H2
Ví dụ: Fe + 2HCl → FeCl2 + H2 3
Mai Phước Đạt
- Tác dụng với dung dịch muối → muối mới + kim loại mới (trừ các kim
loại tan trong nước như Na, Ba, Ca, Li, K).
Ví dụ: Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
*Dãy hoạt động của kim loại: K Na Mg Al Zn Fe Pb (H) Cu Ag Au
Cách nhớ: “Khi Nào May Áo Kẽm Sắt Phải Hỏi Cụ Á Âu”.
*Ý nghĩa dãy hoạt động hóa học:
- Độ hoạt động kim loại giảm dần từ trái qua phải.
- Kim loại (trước Mg) + H2O điều kiệnthường dung dịch bazo + H → 2
- Kim loại đứng trước H phản ứng được với dung dịch axit như HCl, H2SO4 loãng, …
- Kim loại đứng trước (trừ K, Na…) đẩy kim loại đứng sau ra khỏi dung dịch muối. *Nhôm:
- Tính chất hóa học giống tính chất hóa học của kim loại (nhưng không phản ứng
được với H2SO4 đặc, nguội).
- Ngoài ra, nhôm còn phản ứng được với dung dịch bazo.
2NaOH + 2Al + 2H2O → 2NaAlO2 + H2
- Điều chế: Điện phân nóng chảy Al2O3 2Al
điện phân nóngchảy ,criolit 2O3 4Al → + 3O2
*Sắt: Giống tính chất hóa học của kim loại (nhưng không phản ứng được với H2SO4 đặc, nguội).
- Sắt thể hiện hóa trị II khi phản ứng với: S, HCl, H2SO4 loãng, dung dịch muối (CuSO4, AgNO3,…).
- Sắt thể hiện hóa trị III khi phản ứng với: Cl2, O2, H2SO4 đặc nóng, HNO3. - Hợp kim của sắt 4
Mai Phước Đạt + Gang:
Là hợp của sắt với cacbon, trong đó hàm lượng cacbon chiếm từ 2-5%. Có
2 loại gang: gang trắng và gang xám.
Sản xuất: Dùng cacbon oxit khử oxit sắt ở nhiệt độ cao trong lò luyện kim(lò cao).
Fe2O3 + 3CO t ° cao 2Fe + 3CO → 2 + Thép:
Là hợp kim của sắt với cacbon và một số nguyên tố khác, trong đó hàm
lượng cacbon chiếm dưới 2%.
Sản xuất: Thổi khí oxi vào lọ đựng gang nóng chảy ở nhiệt độ cao. Khi oxi
oxi hóa các nguyên tố trong gang như C, Mn, S, P sản phẩm thu được là thép.
Ví dụ: C + O2 t ° CO → 2 *Ăn mòn kim loại:
- Định nghĩa: Ăn mòn kim loại là sự phá hủy kim loại, hợp kim trong môi trường tự nhiên.
- Nguyên nhân: Do kim loại tác dụng với những chất mà nó tiếp xúc trong môi
trường (nước, không khí, đất,…)
- Những yếu tố ảnh hưởng đến sự ăn mòn kim loại: Nhiệt độ môi trường, thành
phần môi trường, thành phần của kim loại.
- Biện pháp chống ăn mòn kim loại: Ngăn không cho kim loại tiếp xúc với các
chất gây ăn mòn hoặc chế tạo hợp kim không bị ăn mòn. 5