




Preview text:
Câu hỏi ôn tập
Phân tích bằng công cụ (CH3320) học kỳ 20132
1. Trình bày định luật Lambert-Beer, định luật cơ bản về hấp thụ bức xạ điện từ, trong
phương pháp phổ hấp thụ phân tử UV-VIS. (Nêu biểu thức toán học, chứng minh định luật, ý
nghĩa vật lý của độ hấp thụ mol, nêu điều kiện để hệ thức của định luật đúng)
2. Nêu biểu thức toán học định luật Lambert- Beer trong phương pháp phổ hấp thụ phân tử
UV-VIS. Phổ UV-VIS là kỹ thuật phổ được áp dụng khi phân tích các hợp chất có nồng độ
thấp, ở đó môi tương quan giữa tín hiệu đo được và nồng độ của chất phân tích là mối quan
hệ tuyến tính. Hãy nêu cách sử dụng kỹ thuật này cho phân tích định lượng (phương pháp
đường chuẩn, thêm chuẩn và phương pháp tính, vẽ đồ thị minh họa).
3. Trình bày cơ sở lý thuyết và thực nghiệm tiến hành xác định thành phần phức Cu-Nitrozo
R theo phương pháp dãy đồng phân tử gam (phương pháp biến thiên liên tục).
Hãy giải thích vai trò của Na2SO4, H2SO4 pH = 4,0 khi pha dãy đồng phân tử gam.
4. Trình bày phương pháp phân tích định lượng Cu2+ sử dụng NH3 để tạo phức bằng phương
pháp đo quang vi sai theo phương pháp đường chuẩn và phương pháp tính (phương pháp một điểm chuẩn).
5. Trình bày cơ sở phương pháp và thực nghiệm tiến hành xác định Fe3+ sử dụng thuốc thử
axit sunfosalixylic theo phương pháp đo quang (Khảo sát phổ hấp thụ của Fe3+ và thuốc thử
axit sunfosalixilic ở các miền pH 1-2; 5-6; 9-10; xây dựng đường chuẩn để xác định hệ số
góc K, xác định Fe3+ trong mẫu kiểm tra).
6. Trình bày phương pháp điện phân với hai điện cực bạch kim (Pt) xác định Cu2+. Hãy giải
thích vai trò của axit HNO3, H2SO4 trong quá trình điện phân. Tại sao điện áp đặt vào quá
trình điện phân là 2,00V? Trong quá trình điện phân thế catot thay đổi như thế nào? Điều này
ảnh hưởng thế nào đến độ chọn lọc của quá trình phân tích? Làm thế nào để xác định Cu2+ đã
được điện phân hết hay chưa?
7. Trình bày cơ sở và cách tiến hành chuẩn độ điện thế xác định HCl bằng dung dịch chuẩn
NaOH sử dụng điện cực tổ hợp thủy tinh. Nêu các cách xác định điểm tương trong pháp này
(vẽ đồ thị tích phân và vi sai để minh họa).
8. Trình bày sự xuất hiện của phổ phát xạ nguyên tử AES.
9. Trình bày phương trình Schaibe-Lomakin phát biểu mối liên hệ giữa cường độ vạch
phổ phát xạ nguyên tử với nồng độ chất có trong plasma.
10. Trình bày các phương pháp phân tích định lượng trong phương pháp quang phổ phát xạ nguyên tử.
11. Trình bày phương trình Lambert-Beer phát biều cường độ vạch phổ hấp thụ
nguyên tử phụ thuộc vào nồng độ chất phân tích. 1
12. Trình bày cấu tạo và cơ chế hoạt động của đèn catot rỗng HCL khi đóng vai trò bức
xạ đơn sắc của phổ hấp thụ nguyên tử.
13. Tại sao phương pháp AES lại có độ nhạy cao hơn khi thay đổi nhiệt độ của ngọn lửa so với phương pháp AAS?
14. Trình bày sự điện phân và các quá trình hóa học xảy ra trong quá trình điện phân.
15. Trình bày các yếu tố ảnh hưởng đến điện áp cần thiết đặt vào bình điện phân để
phản ứng điện phân xảy ra.
16. Trình bày phương pháp điện phân với hai điện cực và nêu các ưu nhược điểm.
17. Trình bày phương pháp điện phân với việc kiểm tra thế điện cực. 18. –
Tại sao khi xác định nồng độ ion F bằng phương pháp đo điện thế sử dụng điện cực
màng rắn chọn lọc ion, người ta thường dùng dung dịch đệm có lực ion lớn chứa axetic axit,
natri citrat, NaCl và NaOH để pha loãng và điều chỉnh pH đến 5,5?
19. Nguyên nhân nào làm xuất hiện thế tiếp xúc trong phương pháp đo điện thế? Giá trị điện
thế tiếp xúc ảnh hưởng như thế nào đến việc phân tích? Làm thế nào để làm giảm điện thế tiếp xúc?
20. Viết hệ thức Nernst cho điện cực màng thủy tinh? Tại sao phải chuẩn hóa điện cực thủy
tinh trước khi đo pH. Hãy giải thích các sai số gây ra khi sử dụng điện cực thủy tinh trong
môi trường pH quá cao và quá thấp.
21. Ý nghĩa khi sự phản hồi điện cực chỉ thị tuân theo hệ thức Nernst là gì?
22. Nêu định nghĩa điện cực chỉ thị, điện cực so sánh, điện cực kim loại. Lấy ví dụ cho mỗi
loại điện cực và nêu yêu cầu đòi hỏi với các điện cực này.
23. Với điện cực bạc-bạc clorua, chúng ta có E° = 0,222V, E(KCl bão hòa) = 0,197V. Hãy dự
đoán giá trị E của điện cực calomen nếu E° của nó là E° = 0,268V.
24. Sử dụng các giá trị điện thế cho dưới đây tính hoạt độ của Cl- trong KCl 1M
E° (điện cực calomen) = 0,268 V, E (điện cực calomen, KCl 1M) = 0,280V
25. Trình bày sự hình thành sóng cực phổ của một ion kim loại trên điện cực giọt Hg
26. Trình bày phương trình Inkovich biểu diễn sự phụ thuộc cường độ dòng khuếch tán vào
nồng độ chất phân tích.
27. Tại sao phải đuổi oxy khi phân tích bằng phương pháp cực phổ?
28. Chất nền cực phổ là gì? Nêu vai trò của chất nền cực phổ.
29. Trình bày cơ sở phân tích định tính và định lượng bằng phương pháp cực phổ. Trình bày
thủ tục đường chuẩn và thêm tiêu chuẩn trong phân tích định lượng bằng phương pháp cực phổ. 2
30. Trình bày nguyên tắc hai phương pháp tăng độ nhạy của cực phổ xung thường và cực phổ
xung vi phân. So sánh hai phương pháp.
31. Trình bày nguyên tắc của phương pháp vôn-ampe hòa tan. Tính ưu việt của phương pháp
này so với phương pháp cực phổ thường.
32. Khi chiết axit axetic vào dung môi hexan, hiệu quả chiết khi điều chỉnh pH ở pha nước ở pH = 3 hay 8?
33. Nêu các yếu tố ảnh hưởng đến độ phân giải và chiều cao đĩa lý thuyết trong sắc ký.
34. Mn được sử dụng như một chất nội chuẩn trong xác định Fe bằng phương pháp phổ
hấp thụ nguyên tử. Một hỗn hợp chuẩn chứa 2,00 μg Mn/ml và 2,50 μg Fe/ml cho tỉ số
tín hiệu (Tín hiệu Fe /tín hiệu Mn) = 1,05/1,00. Một hỗn hợp với thể tích là 6,00 mL
được chuẩn bị bằng cách trộn 5,00 ml dung dịch phân tích chứa Fe với 1.00 ml chứa
13,5 μg Mn/ml. Độ hấp thụ của hỗn hợp ở bước sóng của Mn là 0,128, và độ hấp thụ ở
bước sóng của Fe là 0,185. Tính nồng độ mol/l của dung dịch Fe cần phân tích. ĐS: 8,33×10-5 M
35. Một dung dịch được chuẩn bị bằng cách trộn 10,00 ml dung dịch cần phân tích (X)
với 5,00 ml dung dịch chuẩn (S) chứa 8,24 μg S/ml và pha loãng hỗn hợp này tới thể tích
bằng 50,0 ml. Tỉ số tín hiệu đo được là (tín hiệu X/ tín hiệu S) = 1,690/1,000.
(a) Nếu làm một thí nghiệm riêng lẻ với nồng độ X và Y là bằng nhau, tỉ số tín hiệu đo
được là (tín hiệu X/ tín hiệu S) = 0,930/1,000. Hãy xác định nồng độ của X
(b) Hãy xác định nồng độ của X nếu làm một thí nghiệm riêng khác với nồng độ của X
lớn hơn nồng độ của S là 3,42 lần, tỉ số tín hiệu đo được là (tín hiệu X/ tín hiệu S) = 0,930/1,000.
ĐS: (a) 7,49 μg X/ml; (b) 25,6 μg X/ml
36. Độ hấp thụ A của dung dịch X và Y nguyên chất và hỗn hợp X+Y với cuvet có bề dày
1,00 cm tại hai bước sóng 400 nm và 565 nm có các giá trị như ở bảng dưới đây Chất Nồng độ A (tại 400 nm) A(tại 565 nm) X 1,50×10-4M 0,942 0,201 Y 3,00×10-4M 0,226 1,162 X+Y (Cx+Cy) 0,680 0,858
Tính nồng độ X và Y trong hỗn hợp
ĐS. X= 8,85×10-5M; Y = 1,93×10-4M;
37. Cho một cột sắc ký có chiều dài 120cm, tiến hành phân tích hai chất A và B thu được kết quả sau: 3
Chất Thời gian lưu tr(s) Độ rộng chân pic w(s) A trA = 250 wA =15 (s) B trB = 270 wA =17 (s)
Cho biết thời gian lưu của pha động tm = 30s. Tính
(a) Số đĩa lý thuyết của cột tách N =?
(b) Chiều cao đĩa lý thuyết H = ?
(c) Độ phân giải của cột tách R = ? Hai chất A và B có tách khỏi nhau không? (d) Sự lưu tương đối?
(e) Để tách hai chất hoàn toàn ra khỏi nhau thì cột sắc ký phải có chiều dài tối thiểu bằng bao nhiêu?
ĐS. (a) NA = 4445; NB = 4036 (b) HA = 0.270mm; HB = 0.297mm; (c) R = 1,25 (không thể
tách hoàn toàn A và B ra khỏi nhau); (d) α = 1,1; (e) R ≥1,5 → N = 5625 → L = 1670 mm;
38. Một pin gồm điện cực so sánh calomen và điện cực chọn lọc ion Pb2+ có điện thế –
0,4706V khi nhúng vào 50,00 ml dung dịch mẫu kiểm tra. Khi thêm 5,00 ml dung dịch
chuẩn Pb2+ thế của dung dịch thay đổi thành – 0,4490 V. Tính nồng độ Pb2+ trong mẫu
kiểm tra. Giả sử rằng hoạt độ của Pb2+ xấp xỉ bằng nồng độ của nó. ĐS. 4,03.10-4M
39. Axit butanoic có hằng số phân bố giữa pha nước và benzen là 3,0 (Kpb = 3,0). Tính nồng
độ của axit này ở trong benzen khi 100 ml dung dịch axit butanoic 0,10M được chiết với 25
ml benzen ở pH bằng 4,00 và 10,00. Ka = 1,52×10-5 (pKa = 4,818) ĐS. 0,16M và 2.10-6M
40. (a). Tính giá trị của độ hấp thụ tương ứng với độ truyền quang T = 45,0%?
(b). Nếu một dung dịch 0,010M có độ truyền quang T = 45,0% ở một bước sóng xác định.
Tính phần trăm truyền quang ở bước sóng đó khi nồng độ dung dịch này tăng lên 0,0200M.
ĐS. (a) A = 0,347; (b) %T = 20,2% –
41. (a). Một dung dịch của hợp chất X có nồng độ 3,96 ×10 4 M có độ hấp thụ A = 0,624 ở
238 nm trong cuvet 1,000 cm. Một dung dịch trống (chỉ chứa dung môi) có độ hấp thụ là
0,029 ở cùng bước sóng. Tìm hấp thụ phân tử của hợp chất X.
(b). Độ hấp thụ của dung dịch hợp chất X chưa biết nồng độ trong cùng dung môi và cuvet là
0,375 ở 238 nm. Xác định nồng độ của X trong dung dịch này.
(c). 2,00 ml dung dịch của hợp chất X được pha loãng đến thể tích cuối cùng là 25,00 ml. Độ
hấp thụ của dung dịch sau khi pha loãng là 0,733. Hãy xác định nồng độ của dung dịch của
hợp chất X trước khi pha loãng. ĐS. – – – –
(a) ε = 1,50 ×103 M 1cm 1; (b) C = 2,31 ×10 4 M; (b) C = 7,87 ×10 3 M; 4
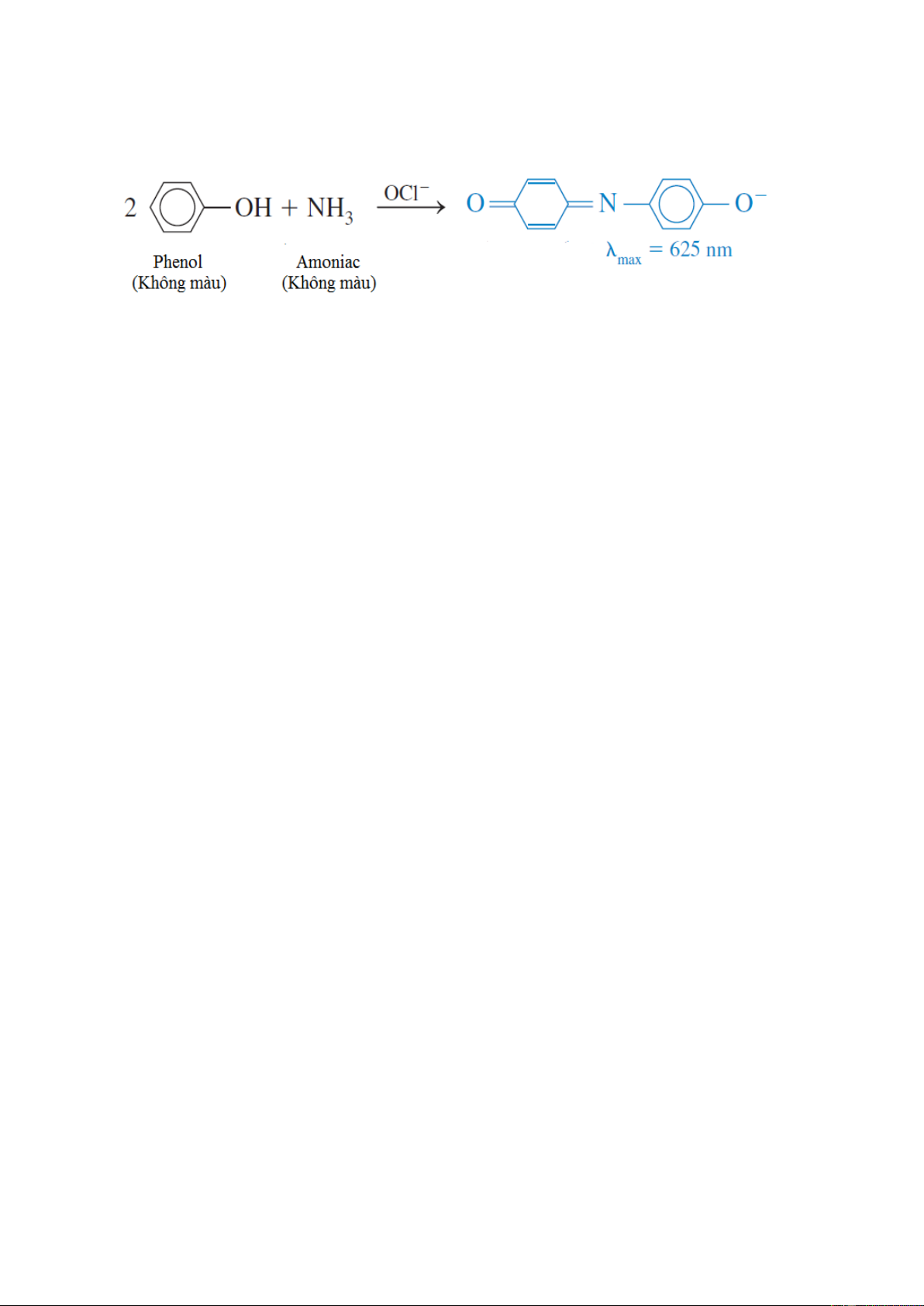
42. Ammoniac có thể được xác định bằng phương pháp đo quang bằng cách cho phản ứng –
với phenol có mặt hypochlorua (OCl )
Một mẫu chứa 4,37 mg protein được chuyển hóa hóa học để chuyển đổi nitơ thành amoniac
và sau đó pha loãng thành 100,0 ml. Sau đó lấy 10,0 ml dung dịch cho vào một bình định
mức 50 ml, thêm 5 ml dung dịch phenol cộng với 2 ml natri hypoclorua. Mẫu được pha loãng
thành 50,0 ml bằng nước cất. Độ hấp thụ đo ở 625 nm sử dụng cuvet 1,00 cm sau 30 phút. Để
so sánh, một dung dịch chuẩn đã được chuẩn bị từ 0,010 0 g NH4Cl (M = 53,49 g/mol) hòa
tan trong 1.00 lít nước. Sau đó lấy 10,0 ml của dung dịch chuẩn này cho vào bình định mức
thể tích 50 ml và phân tích trong cùng một cách thức như dung dịch cần xác định. Mẫu trống
được sử dụng là nước cất.
Độ hấp thụ ở 625 nm Mẫu trống 0,140 Mẫu chuẩn 0,308
Mẫu phân tích 0,592
(a). Tính độ hấp thụ mol của sản phẩm phản ứng giữa phenol và amoniac (sản phẩm xanh)
(b). Tính phần trăm khối lượng của nitơ trong protein ĐS. – –
(a) ε = 4,49 ×103 M 1cm 1; (b) %N = 16,1%
43. Cu+ phản ứng với neocuproine để tạo thành phức hợp màu (neocuproine)2Cu+, với cực đại
hấp thụ ở 454 nm. Neocuproine đặc biệt hữu ích vì nó phản ứng với các kim loại khác. Phức
đồng hòa tan trong 3-methyl-1-butanol (rượu isoamyl). Đây là một dung môi hữu cơ không
hòa tan đáng kể trong nước. Nói cách khác, khi rượu isoamyl được thêm vào nước, hỗn hợp
rượu nước được phân ra làm hai lớp, với lớp nước có tỉ trọng lớn hơn ở phía dưới. Nếu
(neocuproine)2Cu+ có mặt, nó hầu như đi hết vào pha hữu cơ. Giả sử rằng rượu isoamyl
không hòa tan trong nước và tất cả phức màu sẽ đi vào pha hữu cơ. Giả sử rằng thủ tục sau đây được thực hiện:
1, Một tảng đá có chứa đồng được nghiền thành bột, và tất cả các kim loại được chiết tách ra
với axit mạnh. Dung dịch axit được trung hòa với bazơ và pha loãng đến 250,0 ml trong bình định mức A.
2, Tiếp theo, 10,00 ml dung dịch A được chuyển vào bình B, thêm 10,00 ml dung dịch chất
khử để khử tất cả Cu2+ về Cu+. Sau đó thêm 10.00 mL dung dịch đệm để mang lại độ pH
thích hợp cho sự hình thành phức Cu+ với neocuproine.
3, Sau đó, 15,00 ml dung dịch này được lấy ra cho vào bình C. Thêm vào 10,00 ml dung dịch
chứa neocuproine và 20,00 ml rượu isoamyl vào bình C. Sau khi hỗn hợp đã được lắc đều,
các pha được tách ra khỏi nhau, tất cả (neocuproine)2Cu+ trong pha hữu cơ. 5
4, Một vài ml lớp trên được lấy ra. Đo độ hấp thụ ở 454 nm sử dụng cuvet có bề dày 1,00
cm. Mẫu trống thực hiện thông qua các thủ tục tương tự cho một hấp thụ là 0.056.
(a) Giả sử rằng đá chứa 1,00 mg Cu. Nồng độ của Cu (mol/l) trong rượu isoamyl là bao nhiêu?
(b) Nếu hấp thụ phân tử của – – (neocuproine) 1 1. Độ 2Cu+ là 7,90 ×103 M cm
hấp thụ đo được sẽ
là bao nhiêu? Lưu ý rằng một trống thực hiện thông qua các thủ tục tương tự đã đưa ra một hấp thụ là 0,056.
(c) Một tảng đá được phân tích và đo được độ hấp thụ là 0.874 (chưa được hiệu chỉnh với
dung dịch trống). Hãy xác định có bao nhiêu mg Cu là trong đá? ĐS. (a) –
C = 1,57 ×10 5 M; (b) A = 0,180; (c) 6,60 mg Cu;
44. Một chất tan có hệ số phân bố giữa pha nước và pha hữu cơ là 4,0. 10 ml dung dịch chứa
chất tan được chiết bằng dung môi hữu cơ.
a. Hãy tính thể tích của dung môi hữu cơ cần thiết để độ chiết đạt được là 99% (phần chất tan
đi vào pha hữu cơ là 99%).
b. Hãy tính tổng thể tích dung môi cần thiết để độ chiết đạt được là 99% nếu chiết làm ba lần
và mỗi lần dùng lượng dung môi như nhau. ĐS. a, 248 ml; b, 27,3 ml
45. Tính thế catot cần thiết để khử 99,99% Cu2+ 0,1M thành Cu. Có thể tách hoàn toàn Cu2+
0.1M và Sn2+ 0.1M hay không? Cho biết: Cu2+ + 2e– ⇋ Cu↓ E° = 0,339V Sn2+ + 2e– ⇋ Sn↓ E° = –0,141V
ĐS. Ecatot = 0,19V; Quá trình khử Sn2+ là không xảy ra 6




