








Preview text:
HÓA HỌC ĐẠI CƯƠNG Ths. Nguyễn Văn Kiên
GV. Bộ môn Hóa – Sinh hóa đại cương
Phó Trưởng phòng Công tác Sinh viên
Email: kiennv@pnt.edu.vn HÓA HỌC
VÀ KHOA HỌC SỨC KHỎE 2
Giới thiệu môn học
Hóa học, một nhánh của khoa học tự nhiên, là
ngành nghiên cứu về thành phần, cấu trúc, tính
chất, và sự thay đổi của vật chất. Hóa học nói
về các nguyên tố, hợp chất, nguyên tử, phân tử
, và các phản ứng hóa học xảy ra giữa những thành phần đó. 3
Hóa học có thể coi là "khoa học trung tâm" vì nó là cầu nối các ngành khoa học tự nhiên
khác như vật lý học, địa chất học và sinh học. VẬT LÝ HỌC SINH HỌC HÓA HỌC ĐỊA CHẤT HỌC 4 5 6
Bệnh là quá trình hoạt động không bình thường của cơ thể sinh vật từ nguyên
nhân khởi phát đến hậu quả cuối cùng. Bệnh có thể gặp ở người, động vật hay thực
vật. Có rất nhiều nguyên nhân sinh ra bệnh, nhưng có thể chia thành ba loại chính: Bệnh do bản thân cơ
thể sinh vật có khuyết tật
như di truyền bẩm sinh hay rối loạn sinh lý. Bệnh do hoàn cảnh
sống của sinh vật khắc nghiệt
như quá lạnh, quá nóng, bị
ngộ độc, không đủ chất dinh dưỡng. Bệnh do bị các sinh
vật khác (nhất là các vi sinh vật) ký sinh. 7 8 Tóm tắt nội dung TT TÊN BÀI GIẢNG Số tiết CÁN BỘ GIẢNG 1
Khái niệm cơ bản. Cơ học lượng tử. Bài tập 2 ThS. Kiên 2
Hệ thống tuần hoàn các nguyên tố hoá học. Bài tập 2 ThS. Kiên 3
Các loại liên kết hoá học. Bài tập 4 ThS. Kiên 4
Nhiệt động hoá học. Nguyên lý thứ nhất. 2 TS. Lương 5
Nhiệt động hoá học. Nguyên lý thứ hai. 2 TS. Lương 6 Cân bằng hóa học 2 TS. Lương 7 Dung dịch 2 TS. Lương 8
Cân bằng acid - base. Chuẩn độ acid base 2 TS. Lương 9 Khái niệm về Hữu cơ. 10 Hydrocarbon 2 ThS. Yến 11 Alcol 2 ThS. Yến 12 Aldehyd - Ceton 2 ThS. Yến 13 Acid carbocylic 2 TS. Lương 14 Amin 2 TS. Lương 9 Tài liệu tham khảo 10
CÁC KHÁI NIỆM MỞ ĐẦU 11
1. Các khái niệm mở đầu
1.1. Nguyên tử và phân tử
“atom” xuất phát từ tiếng Hy Lạp
“átomos”, có nghĩa là “không thể
cắt được” hay “hạt vô hình nhỏ nhất của vật chất”. Democritos
(khoảng 460 - 370 TCN) Leucippe
Nguyên tử là phần tử nhỏ nhất
(khoảng 490 - 370 TCN) của nguyên tố tham gia vào thành
phần phân tử của chất, không thể
chia nhỏ hơn nữa bằng các
phương pháp hóa học. (1808) John Dalton (1766 – 1844) 12
Phân tử: là phần tử nhỏ nhất của một chất, có khả năng tồn tại độc lập, có tất
cả các tính chất hóa học của chất đó.
Phân tử cấu tạo từ các nguyên tử. Ví dụ:
NaCl, H2O, C6H12O6, C12H22O11, C2H5OH, (C6H10O5)n, H2SO4, C8H9O2N, …
Nguyên tố hóa học: là những nguyên tử có hạt điện tích hạt nhân giống nhau. Ví dụ:
hidro (Z = 1), nito (Z = 7), cacbon (Z = 6), oxi (Z = 8), … 13
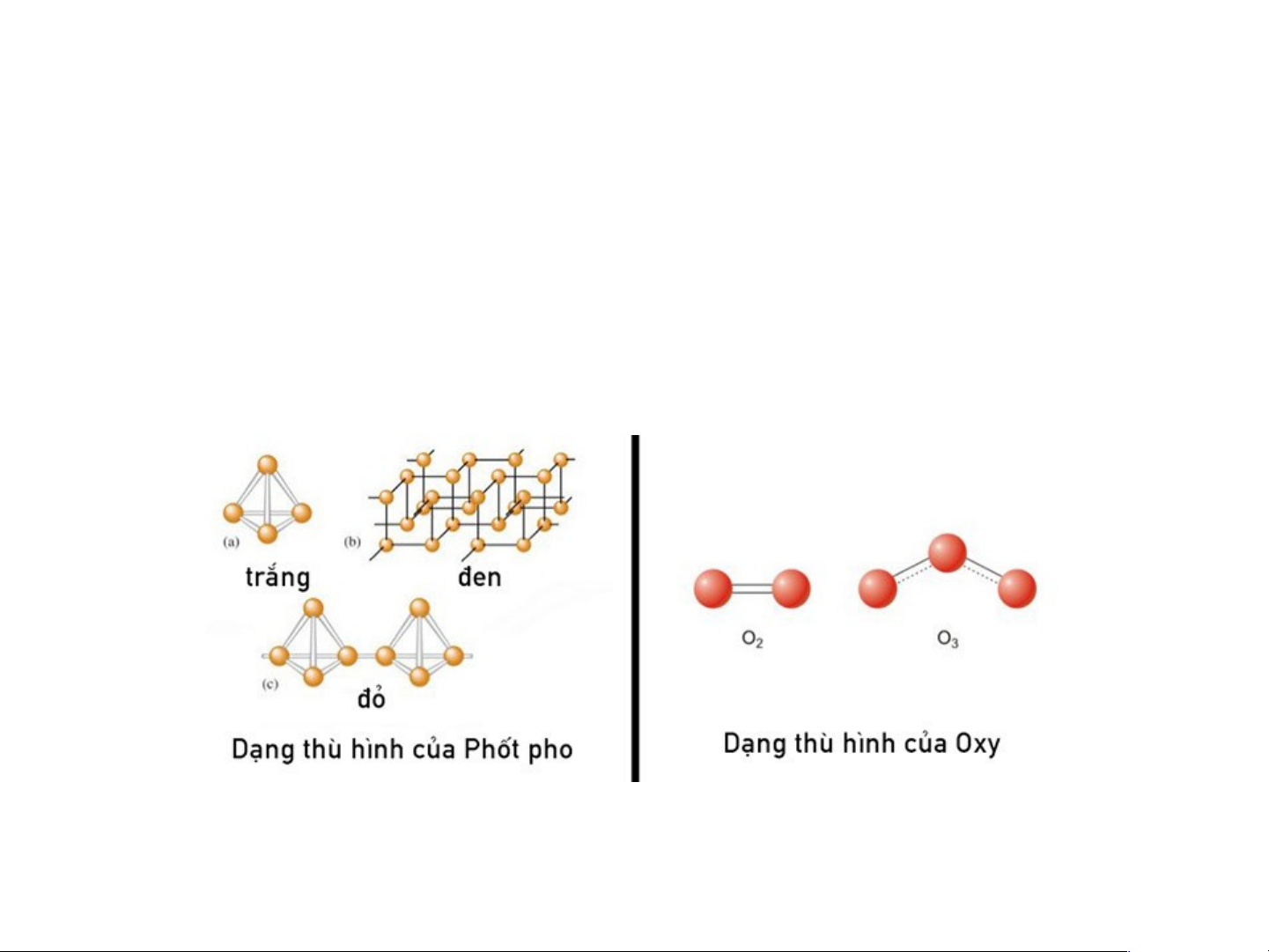
Thù hình: là hiện tượng một nguyên tố tồn tại ở một số dạng đơn chất khác nhau.
Những dạng đơn chất khác nhau đó của một nguyên tố được gọi là dạng thù hình Ví dụ:
Nguyên tố Oxi có các dạng thù hình là O2 và O3 (ozon);
Nguyên tố C có các dạng thù hình như là graphit, kim cương, nanotube,… 14 a) Kim cương, b) Graphit, c) Lonsdaleit,
d) C60 (Buckminsterfullerene hay buckyball), e) C540, f) C70, g) Amorphous carbon,
h) carbon nanotube hay buckytube. 15
1.2. Khối lượng nguyên tử và phân tử
Khối lượng nguyên tử (phân tử) là khối lượng tính bằng đơn vị quy ước của một
nguyên tử (phân tử) chất đó.
Nguyên tử gam (phân tử gam) là khối lượng tính bằng gam của nguyên tử (phân tử)
có giá trị bằng khối lượng nguyên tử (phân tử).
Khối lượng nguyên tử tương đối của một nguyên tố là tỉ số khối lượng nguyên tử
của nó với 1/12 phần khối lượng nguyên tử 12C (1 đvC).
1 đvC = 1,66 x 10-24 gam = 1 u. (1 amu)
Mol là lượng chất có chứa số tiểu phân bằng số nguyên tử 12C chứa trong 12 gam đồng vị 12C.
Số tiểu phân chứa trong 1 mol: N = 6,0221367 x 1022 mol-1 (Số Avôgađrô, NA) 16
1.3. Kí hiệu hóa học – Công thức hóa học – Phương trình hóa học
Kí hiệu hóa học: Dùng để biểu thị các nguyên tố hóa học. Ví dụ:
hidro (H), nito (N), cacbon (C), oxi (O), …
Công thức hóc học: Dùng để biểu thị phân tử các chất. Ví dụ:
khí oxi (O2), khí hidro (H2), nước (H2O), amoniac (NH3), axit clohidric (HCl), đường
glucose (C6H12O6), rượu etylic (C2H5OH), …
Phương trình hóa học: dùng để biểu diễn một phản ứng hóa học. Ví dụ: NaOH + HCl → NaCl + H O 2 Ca(OH) + CO → CaCO ↓ + H O 2 2 3 2 17
1.4. Hóa trị và số oxi hóa
Hóa trị: Hóa trị của một nguyên tố là đại lượng đặc trưng cho khả năng của một
nguyên tử của nguyên tố đó kết hợp (hay thay thế) với một số xác định nguyên tử nguyên tố khác.
Các nguyên tố có hóa trị không đổi: H, Ag, kim loại kiềm (nhó IA): 1; O, Zn, kim
loại kiềm thổ (IIA): 2; Al: 3; Khí hiếm: 0;
Các nguyên tố có nhiều hóa trị: Fe: 2, 3; Cu: 1, 2; N: 1, 2, 3, 4, 5; S: 2, 4, 6; Cr: 2, 3, 6; Sn, Pb: 2, 4;
Số oxi hóa: Số oxi hóa là điện tích dương hay âm của nguyên tử nguyên tố đó trong
hợp chất với giả thiết hợp chất được tạo thành từ các ion. (xem như có sự chuyển dịch
hoàn toàn các electron liên kết về phía nguyên tử có độ âm điện lớn hơn) 18
Quy tắc tính số oxi hóa:
Số oxi hóa của đơn chất bằng 0.
Số oxi hóa của kim loại phân nhóm A bằng số thứ tự nhóm.
Ví dụ: Na+ (+1), Ca2+ (+2), Al3+ (+3), …
Số oxi hóa của F luôn bằng – 1, của H thường bằng + 1 (trừ hợp chất với
hidrua kim loại), của O thường bằng – 2 (trừ H2O2 và OF2).
Tổng số oxi hóa của các nguyên tử trong phân tử trung hòa về điện bằng 0.
Số oxi hóa của các ion bằng điện tích ion.
Ví dụ: Fe2+: +2, Ag+: +1, Al3+: +3, SO 2-: -2, NO -: -1, … 4 3
Trong ion đa nguyên tử, tổng số oxi hóa của các nguyên tử bằng điện tích ion của. 19
1.5. Phản ứng hóa học
Phản ứng hóa học: là quá trình biến đổi từ một tập hợp các chất này thành một tập hợp các chất khác.
Theo cách cổ điển, các phản ứng hóa học bao gồm toàn bộ các trao đổi chỉ liên quan
đến vị trí của các nguyên tử, electron trong nguyên tử, không có sự thay đổi nào đối với
nhân (không có sự thay đổi các nguyên tố tham gia phản ứng).
Hóa học hạt nhân: là một ngành con của hóa học, liên quan đến các phản ứng hóa học
của các nguyên tổ phóng xạ và không bền, trong đó cả sự chuyển điện tử và chuyến đổi
hạt nhân đều có thể diễn ra. 20