




















































Preview text:
Bài 2 : PHẢN ỨNG HÓA HỌC
GV: Nguyễn Thị Thanh Thảo
Hoạt động 1: Mở đầu Hoạt động 1. MỞ ĐẦU
Khi đốt nến, một phần nến chảy lỏng, một phần nến bị
cháy. Cây nến ngắn dần. Vậy phần nến nào đã bị biến đổi thành chất mới?
Hoạt động 2: Hình thành kiến thức
I Biến đổi vật lý và biến đổi hóa học II
Phản ứng hóa học III
Năng lượng của phản ứng hóa III học I.
Tìm hiểu về biến đổi vật lý và biến đổi hóa học 1
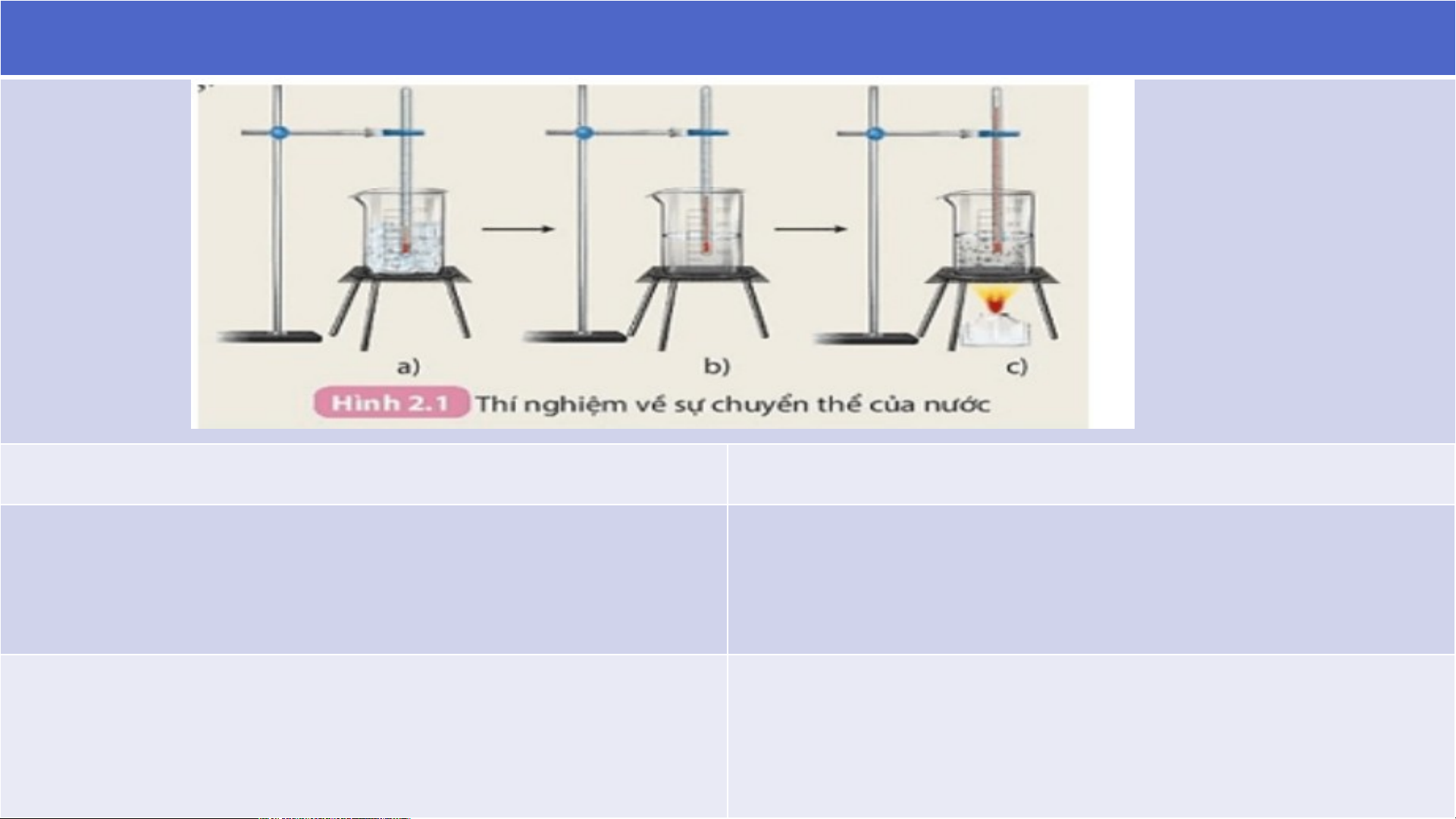
Thí nghiệm về biến đổi vật lý :
Hoạt động 1: Mở đầu
HS quan sát thí nghiệm, thảo luận cặp đôi, hoàn thành phiếu học tập 1
PHIẾU HỌC TẬP SỐ 1 Câu hỏi Trả lời
1. Em hãy xác định các giá trị nhiệt độ
tương ứng với các bước thí nghiệm mô tả trong hình 2.1
2. Ở quá trình ngược lại hơi nước ngưng tụ
thành nước lỏng, nước lỏng đông đặc thành
nước đá. Vậy trong quá trình chuyển thể, nước
có biến đổi thành chất khác không? Báo cáo, thảo luận
PHIẾU HỌC TẬP SỐ 1 Câu hỏi Trả lời
1. Em hãy xác định các giá trị nhiệt độ tương
ứng với các bước thí nghiệm mô tả trong hình 1. Bước a: 00C, 2.1
Bước b: 250C hoặc nhiệt độ khác Bước c: 1000C.
2. Ở quá trình ngược lại hơi nước ngưng tụ
thành nước lỏng, nước lỏng đông đặc thành
2. Trong quá trình chuyển thể nước
nước đá. Vậy trong quá trình chuyển thể, nước
không biến đổi thành chất khác.
có biến đổi thành chất khác không?
Hoạt động 1: Mở đầu Các quá trình : hòa tan, đông đặc, nóng
chảy,...các chất chỉ BIẾN
chuyển từ trạng thái ĐỔI
này sang trạng thái VẬT LÝ khác, không tạo thành chất mới KẾT LUẬN
I. BIẾN ĐỔI VẬT LÝ VÀ BIẾN ĐỔI HÓA HỌC * Biế Bi n đổi n đ ổi vậ v t l ậ ý: ý không kh có s c ự tạ t o ạ thành c thà hất hấ mới mớ
2. Thí nghiệm về biến đổi hóa học Góc phâ Lớp ch i ch a t hàn à h h 3 g óc, n m ỗ m i n i hó h m m đ ược ợc chọ ch n n tích góc óc xu x ất ấ phá h t. Kh K i hế h t Góc Góc thời gian ia 8 ’ tại m i ỗ m i góc c thì h ph p ải ch c uy u ển áp qua san a g g óc c kh k á h c. M c. ỗi dụn n nhó h m m s ẽ có nh n óm óm g sát trưở rư ng n ch c ỉ đ ỉ ạo cách cá ch thực ự là c m m v iệc n c hóm óm và à có c 1 t hư k í k ghi h lại ho h ạt ạ độ đ ng g nh n óm. óm Góc phân tích: Nghiên cứu thông tin SGK, hoàn thành nội dung 1 trong phiếu học tập Góc áp số 2 Góc quan sát: dụng: Quan sát Tiến hành thí video thí nghiệm,hoà nghiệm, hoàn n thành nội thành nội dung 3- dung 2- Phiếu Phiếu học học tập 2 tập 2 Video thí nghiệm Thí nghiệm:
- Trộn đều hỗn hợp bột sắt và bột
lưu huỳnh. Lần lượt cho vào 2 ống
nghiệm (1) và (2) mỗi ống 3 thìa hỗn hợp
- Đưa nam châm lại gần ống nghiệm (1)
- Đun nóng mạnh đáy ống nghiệm
(2) khoảng 30 giây rồi ngừng đun.
Để nguội rồi đưa nam châm lại gần ống nghiệm (2)
PHIẾU HỌC TẬP SỐ 2 Nội dung Trả lời
ND1:Chuẩn bị: (dụng cụ, hóa chất) ND2: Cách tiến hành ND3. Hiện tượng:
1. Sau khi trộn bột Fe và bột S, hỗn hợp thu
được có bị nam châm hút không?
2. Chất trong ống nghiệm (2) sau khi được
đun nóng và để nguội có bị nam châm hút không?
3. Sau khi trộn bột Fe và bột S có chất mới
được tạo thành không? Giải thích.
4. Sau khi đun nóng hỗn hợp Fe và bột S có
chất mới được tạo thành không? Giải thích. Báo cáo, thảo luận
PHIẾU HỌC TẬP SỐ 2 Nội dung Trả lời
ND1:Chuẩn bị: (dụng cụ, hóa chất)
Bột Fe và bột S theo tỉ lệ 7:4 về khối lượng. ống
nghiệm chịu nhiệt, đèn cồn, đũa thủy tinh, thìa thủy tinh. ND2: Cách tiến hành
- Trộn đều hỗn hợp bột Fe và bột S. lần lượt cho vào
hai ống nghiệm (1) và (2) mỗi ống 3 thìa hỗn hợp.
- Đưa nam châm lại gần ống nghiệm 1, quan sát
.- Đun nóng mạnh ống nghiệm (2) khoảng 30s rồi
ngừng đun. Để nguội rồi đưa nam châm lại gần ống nghiệm (2). Quan sát. ND3. Hiện tượng:
1. Khi trộn bột sắt với bột lưu huỳnh, hỗn hợp thu
1. Sau khi trộn bột Fe và bột S, hỗn hợp thu
được có một phẩn bị nam chầm hút, phần này là sắt.
được có bị nam châm hút không?
2. Chất trong ống nghiệm (2) sau khi được đun nóng
2. Chất trong ống nghiệm (2) sau khi được
và để nguội không bị nam chầm hút.
đun nóng và để nguội có bị nam châm hút
3. Sau khi trộn bột sắt với bột lưu huỳnh, không có không?
chất mới được tạo thành vì khi tách chất ra khỏi hỗn
3. Sau khi trộn bột Fe và bột S có chất mới
hợp ta lại thu được các chất ban đầu (H).
được tạo thành không? Giải thích.
4. Sau khi đun nóng hỗn hợp bột sắt với bột lưu huỳnh
4. Sau khi đun nóng hỗn hợp Fe và bột S có có chất mới tạo thành, sản phẩm có màu xám và
chất mới được tạo thành không? Giải thích.
không bị nam châm hút (H). Hòa tan đường, muối vào nướ nước Lấy 1 số ví dụ HIỆN trong đời sống TƯỢN Băng về các quá tan G trình xảy ra sự VẬT biến đổi vật lí, LÝ biến đổi hóa học. Cồn bay hơi Đốt cháy cồn Lấy 1 số ví dụ trong đời sống về HIỆN các quá trình xảy TƯỢN ra sự biến đổi vật G lí, biến đổi hóa HÓA học. HỌC Sắt bị gỉ
Hoạt động 1: Mở đầu Các quá trình : đốt cháy nhiên liệu, phân hủy BIẾN chất, tổng hợp ĐỔI chất... có sự HÓA tạo thành chất HỌC mới KẾT LUẬN
I. BIẾN ĐỔI VẬT LÝ VÀ BIẾN ĐỔI HÓA HỌC * Biến Bi đ ến ổi ổ ivậ v t ậ lý l : ý không hô ng có c ó s ự ự tạo t ạo thành chất chấ mới mớ * * Biến Bi đ ến ổi ổ hó i a hó học: họ có c ó sự s ự tạo t ạo t hà h nh n chất hấ mới Tr Hoạ ong cơ t độn thể ngư g 1: ời Mở đầu
và động vật, sự trao đổi chất là 1 loạt các quá trình sinh hóa, đó là những quá trình phức tạp, bao gồm cả biến đổi vật lí và biến đổi hóa học. II. Phản ứng hóa học 1 Khái niệm :
Phản ứng hoá học là quá trình biến đổi từ chất này thành chất khác.
+ Chất ban đầu bị biến đổi trong phản ứng gọi là gì?
+ Chất mới sinh ra gọi là gì?
+ Trong quá trình phản ứng, lượng chất nào tăng dần, lượng chất nào giảm dần? II. Phản ứng hóa học 1 Khái niệm :
Phản ứng hoá học là quá trình biến đổi từ chất này thành chất khác. Chất ban đầu Chất phản ứng bị biến đổi (Chất tham gia) Chất mới sinh Sản phẩm ra
Trong quá trình phản ứng, lượng sản phẩm tăng dần, lượng chất phản ứng
Trong quá trình phản ứng, lượng chất nào tăng dần, lượng chất nào giảm dần? giảm dần Phương trình chữ:
Tên các chất phản ứng Tên các sản phẩm
• Ví dụ: Iron + Sulfur Iron(II)sulfide. Chất phản ứng Sản phẩm Đọc
Đọc là: Iron tác dụng với Sulfur tạo ra Iron(II)sulfide. phương trình chữ trên
Hoạt động 1: Mở đầu Hoạt động cá nhân 5 phút, hoàn thành phiếu học tập 3:
PHIẾU HỌC TẬP SỐ 3 Câu hỏi Trả lời
1.Than (thành phần chính là carbon) cháy
trong không khí tạo thành khí carbon dioxide.
a. Hãy viết PTPƯ dạng chữ của PƯ này.
Chất nào là chất PƯ? Chất nào là sản phẩm?
b. Trong quá trình phản ứng, Lượng chất
nào giảm dần, lượng chất nào tăng dần?
2. : Đánh dấu (X) vào ô ứng với hiện tượng
hóa học hay hiện tượng vật lý. Viết
phương trình chữ của phản ứng hóa học? Báo cáo, thảo luận PHIẾU HỌC TẬP SỐ 3 Câu hỏi Trả lời
1.Than (thành phần chính là carbon) cháy
trong không khí tạo thành khí carbon 1. dioxide.
a) Carbon + Oxygen —> Carbon dioxide
a. Hãy viết PTPƯ dạng chữ của PƯ này.
Chất phản ứng: carbon, oxygen; sản phẩm: carbon dioxide.
Chất nào là chất PƯ? Chất nào là sản phẩm?
b) Trong quá trình phản ứng, lượng carbon và oxygen giảm dần;
b. Trong quá trình phản ứng, Lượng chất
lượng carbon dioxide tăng dần.
nào giảm dần, lượng chất nào tăng dần?
2. : Đánh dấu (X) vào ô ứng với hiện tượng Hiện tượng
hóa học hay hiện tượng vật lý. Viết phương Các quá trình
Phương trình chữ của phản ứng Hoá
trình chữ của phản ứng hóa học? hoá học học Vật lí
a. Dây sắt cắt nhỏ tán thành đinh x sắt
b. Khi đốt nếncháy (tác dụng với x
Nến+oxygen → carbon dioxide +
oxygen) tạo ra khí carbon dioxide nước và hơi nước
c. Khi than cháy (tác dụng với x Than + oxygen → carbon
oxygen) tạo ra carbon dioxide dioxide
d.Hydrochloric acid tác dụng với x Hydrochloric acid+ calcium
calcium carbonatetạo ra calcium
carbonate → calcium chloride+
chloride, nướcvà carbon dioxide nước + carbon dioxide II. Phản ứng hóa học 1 Khái niệm :
Diễn biến của phản ứng hóa 2 học :
Hoạt động 1: Mở đầu Hoạt động nhóm đôi, quan sát hình sau rồi trả lời câu hỏi:
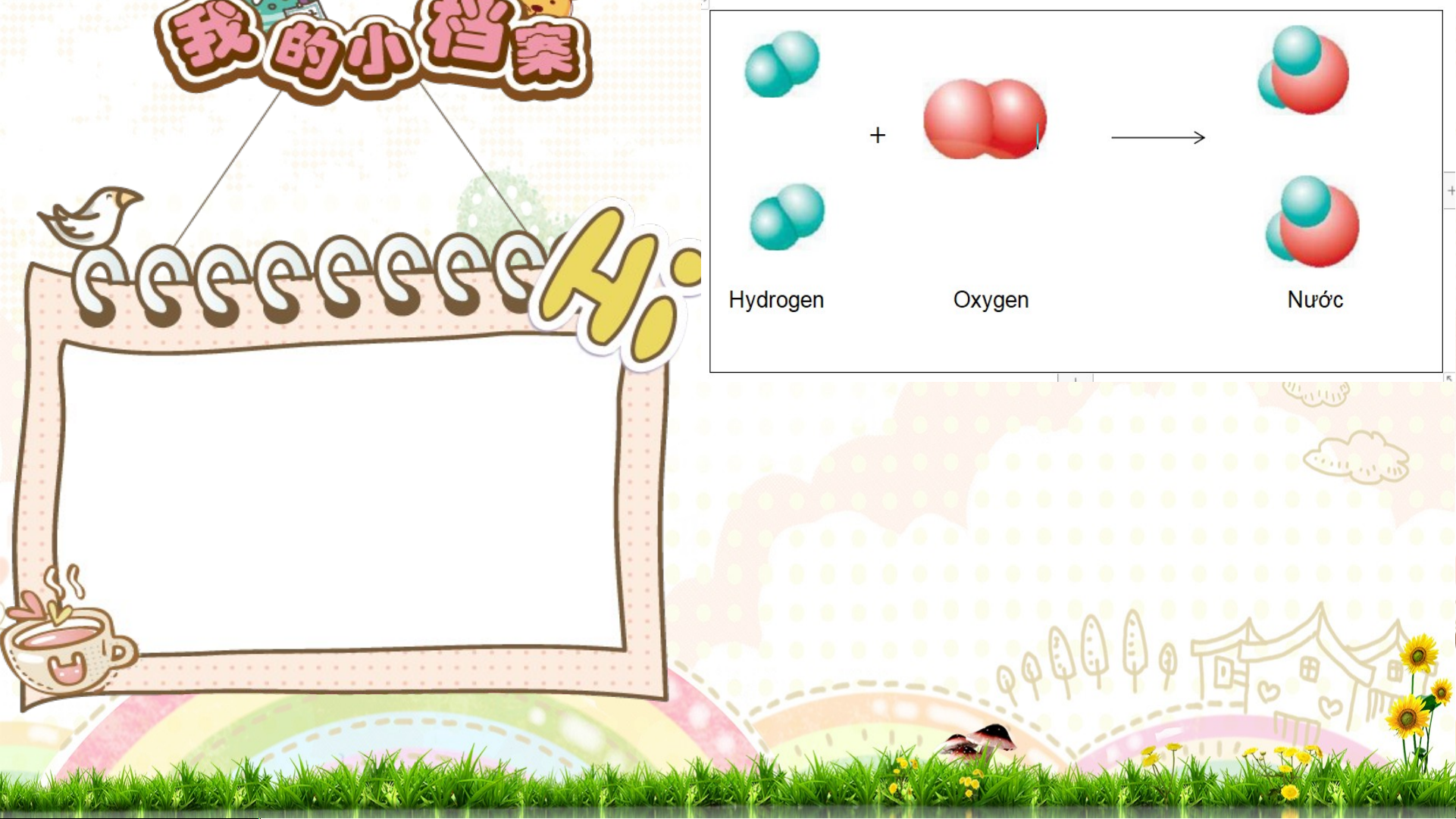
Hình 2.3. Sơ đồ mô tả phản ứng hóa học giữa hydrogen với oxygen tạo thành nước
1.Trước phản ứng: nguyên tử H liên kết với nguyên tử H; nguyên tử O liên kết với n Báo cáo, 1.T guyrư ênớc t ửv à
O .sau phản ứng, những nguyên tử nào liên kết với nhau? 2. S th Tr ảoo au n p g lu quá hản ứ ận trì ng:nh n phản guyê n ứ t n ử g, H s li ố ê ngu n kế y t ê v n ới t ử H ngu v y à ên s ố t ửn gu
O. yên tử O có thay đổi 2. k h Tr ô o n n g?
g quá trình phản ứng, số nguyên tử H và số nguyên tử O không thay đổi. KẾT LUẬN * Biế Bi n n đổ đ i v ậ v t ậ t lý l : :kh k ô h ng n c ó c sự ự tạo t th t àn h h àn h ch c ấ h t ấ t mới
I. BIẾN ĐỔI VẬT LÝ VÀ BIẾN ĐỔI HÓA HỌC II. PHẢN ỨNG HÓA HỌC 1. Khái niệm :
2. Diễn biến của phản ứng hóa học :
Trong phản ứng hóa học, liên kết giữa các nguyên tử thay đổi, làm phân tử
này biến đổi thành phân tử khác. Kết quả là chất này biến đổi thành chất khác. II. Phản ứng hóa học 1 Khái niệm :
Diễn biến của phản ứng hóa 2 học : 3
Hiện tượng kèm theo các phản ứng hóa học : Hoạ Phả t độn n ứng hóg 1: a Mở đầu thay đổi màu học xảy ra khi sắc có chất mới được tạo thành với những tính xuất hiện chất chất mới, khác khí biệt với chất ban đầ u. Những d ấu d hiệu ấu nh hiệu ận ậ ra ra có có chấ t chấ t m ới ớ tạ i o tạ o thà t n hà h: xuất hiện kết tủa tỏa nhiệt và phát sáng
Hoạt động 1: Mở đầu
Cho khoảng 3ml dung dịch hydrochloric
acid (HCl) vào ống nghiệm (1) chứa
kẽm viên và ống nghiệm (2) chứa 2ml Hoạt động
dung dịch barium chloride (BaCl ) 2 nhóm, làm thí nghiệm, hoàn thành phiếu học
Cho khoảng 3ml dung dịch sodium tập 4.
hydroxide (NaOH) vào ống nghiệm
(3) chứa 2ml dung dịch copper (II) sulfate (CuSO ). 4 PHIẾU HỌC TẬP 4 Cách tiến hành Hiện tượng Có xảy ra phản Giải thích ứng không 1. Cho khoảng 3ml dung
dịch hydrochloric acid (HCl)
vào ống nghiệm (1) chứa
kẽm viên và ống nghiệm (2) chứa 2ml dung dịch barium chloride (BaCl ) 2 2. Cho khoảng 3ml dung dịch sodium hydroxide
(NaOH) vào ống nghiệm (3) chứa 2ml dung dịch copper (II) sulfate (CuSO ). 4
Hoạt động 1: Mở đầu Báo cáo, thảo luận: PHIẾU HỌC TẬP 4 Cách tiến hành Hiện tượng Có xảy ra phản Giải thích ứng không 1. Cho khoảng 3ml dung - Ống nghiệm (1) - Có - Có chất mới tạo
dịch hydrochloric acid (HCl) có bọt khí thoát ra thành
vào ống nghiệm (1) chứa
kẽm viên và ống nghiệm (2) - Ống nghiệm (2) - Không - Không có chất mới
chứa 2ml dung dịch barium không có hiện tạo thành chloride (BaCl ) tượng 2 2. Cho khoảng 3ml dung Ống nghiệm (3) Có Có chất mới tạo dịch sodium hydroxide xuất hiện kết tủa thành
(NaOH) vào ống nghiệm (3) xanh chứa 2ml dung dịch copper (II) sulfate (CuSO ). 4 T ro T ng ro p ng hản ph ứn ản ứ g g ng iữa giữa Ox Oygen xyg và en hyd và h rog ydro en, gennếu , nế u oxyg o en h xyge ết n( thì ho pư ặc có hyd xảy rog ra en) hết ntữa hì khô pư s n ẽ g? dừng lại Nh N ỏ hỏ gi g ấm iấm ăn ăn vào
vào vviiêên n đ đá á v vôi ôi, .
thấy bề mặt đá vôi sủi các bọt
Dấu hiệu nào cho biết đã có
khí, đây là dấu hiệu cho biết có phản P ứngư h hh oá xảy học xra ảy ra, tạo khí carbon dioxide. KẾT LUẬN * Biế Bi n n đổ đ i v ậ v t ậ t lý l : :kh k ô h ng n c ó c sự ự tạo t th t àn h h àn h ch c ấ h t ấ t mới
I. BIẾN ĐỔI VẬT LÝ VÀ BIẾN ĐỔI HÓA HỌC II. PHẢN ỨNG HÓA HỌC 1. Khái niệm :
2. Diễn biến của phản ứng hóa học :
3. Hiện tượng kèm theo các phản ứng hóa học :
Để nhận biết PƯHH xảy ra có thể dựa vào một trong các dấu hiệu sau: sự
tạo thành chất khí; chất kết tủa; sự thay đổi màu sắc; sự thay đổi về nhiệt độ của môi trường… III.
Năng lượng của phản ứng hóa học 1
Phản ứng tỏa nhiệt, phản ứng thu nhiệt :
Hoạt động 1: Mở đầu
Phản ứng đốt cháy cồn là phản 1 ứng gì? Hoạt động cá nhân, nghiên cứu thông tin
Phản ứng phân hủy copper (II) SGK, trả lời câu 2 hỏi:
hydroxide là phản ứng gì?
Thế nào là phản ứng tỏa 3
nhiệt, phản ứng thu nhiệt?
Hoạt động 1: Mở đầu Báo cáo, thảo luận:
Hoạt động 1: Mở đầu
Phản ứng đốt cháy cồn là phản 1
Phản ứng đốt cháy cồn là phản ứng gì? ứng tỏa nhiệt Hoạt động cá nhân, nghiên cứu thông tin
Phản ứng phân hủy copper (II) SGK, trả lời câu 2 hỏi: hydro r x o ide là phản ứng g ì? thu nhiệt
PƯ tỏa nhiệt là giải phóng năng lượng Th (dạ ế n n g n à hi o ệt l ) rà a p m h ôi ả trn ư ứ ờn n g g x t un ỏ g a q uanh. 3 n P h Ư tiệ hut , n p hi h ệt ảln à ứ PƯ n n g h th ận n u ă n n g lhưiợệnt? g (dạng
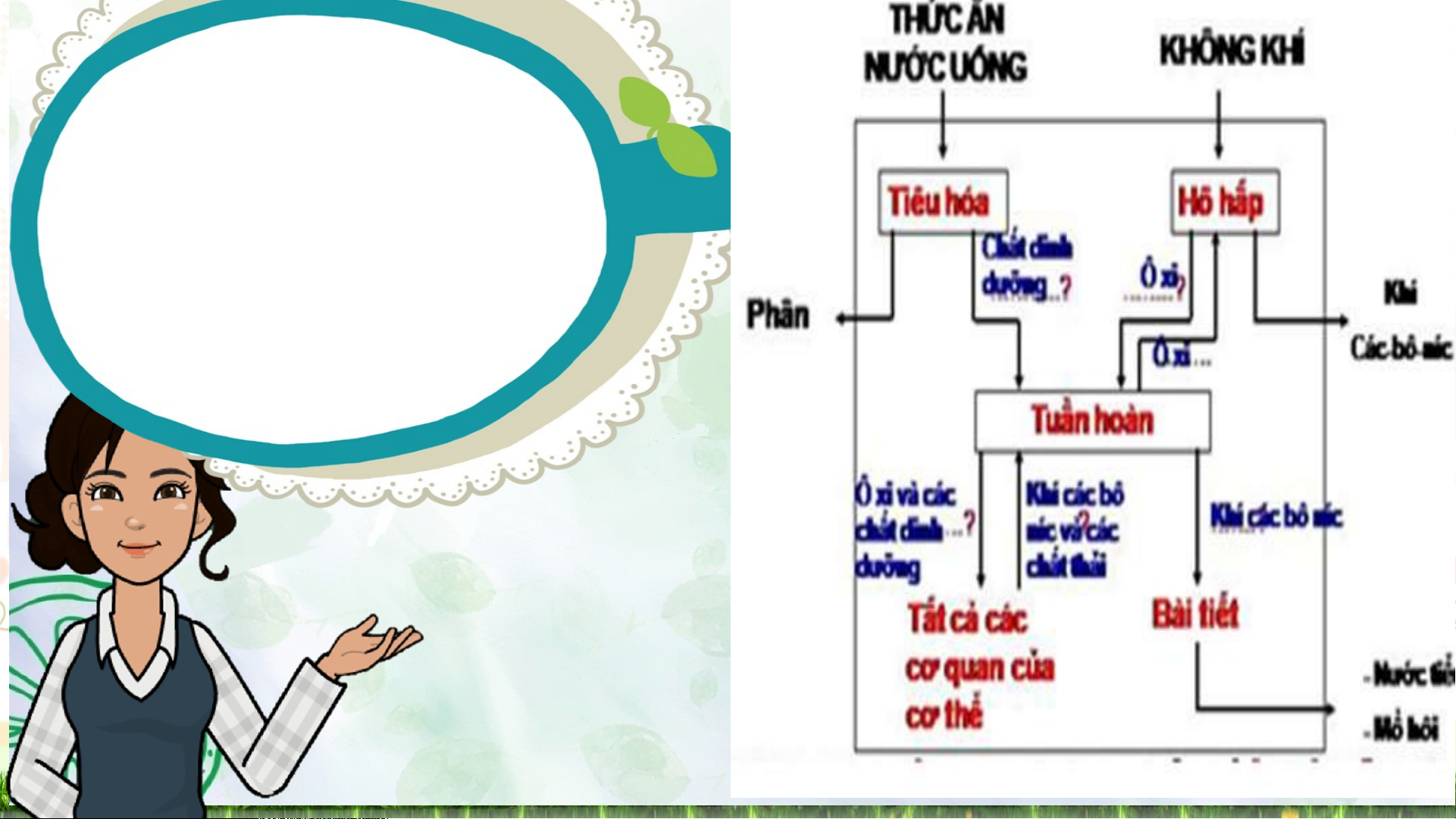
nhiệt) trong suốt quá trình PƯ xảy ra. Hoạt động 1: Thức ă n Mở được đ tiêuầu
hóa chuyển thành các chất
dinh dưỡng. Phản ứng hóa học giữa chất dinh 1
dưỡng với oxygen cung cấp năng lượng cho cơ
thể hoạt động là pư tỏa nhiệt hay thu nhiệt?
Lấy thêm ví dụ về loại phản ứng này
Qúa trình nung đá vôi (thành phần chính là 2
CaCO ) thành vôi sống (CaO) và khí carbon 3
dioxide (CO ) cần cung cấp năng lượng (dạng 2
nhiệt). Đây là phản ứng tỏa nhiệt hay thu nhiệt?
Hoạt động 1: Mở đầu
Quá trình tiêu hoá thức ăn cung cấp năng
lượng cho cơ thể hoạt động là phản ứng 1 toả nhiệt.
Ví dụ khác vê phản ứng toả nhiệt: đốt cháy than, cồn, gas,...
Quá trình nung đá vôi là phản ứng thu
nhiệt vì cần cung cấp năng lượng từ phản 2
ứng đốt cháy nhiên liệu là than đá.
Ví dụ về phản ứng thu nhiệt: phản ứng
phân huỷ potassium permanganate,
ammonium chloride, aluminium hydroxide,... KẾT LUẬN
I. BIẾN ĐỔI VẬT LÝ VÀ BIẾN ĐỔI * Biế Bi n n đổ đ i v ậ v t ậ t lý l : :kh k ô h ng n c ó c sự ự tạo t th t àn h h àn h ch c ấ h t ấ t mới HÓA HỌC II. PHẢN ỨNG HÓA HỌC
III. NĂNG LƯỢNG CỦA PHẢN ỨNG HÓA 1. HỌC
Phản ứng tỏa nhiệt, phản ứng thu nhiệt :
- Phản ứng tỏa nhiệt giải phóng năng lượng (dạng nhiệt) ra môi trường
- Phản ứng thu nhiệt nhận năng lượng (dạng nhiệt) từ môi trường trong suốt quá trình phản ứng. III.
Năng lượng của phản ứng hóa học 1
Phản ứng tỏa nhiệt, phản ứng thu nhiệt : 2
Ứng dụng của phản ứng tỏa nhiệt : Hoạt động 1: Than, xă Mở ng, dầ đ u…. ầu
là nhiên liệu hóa thạch, được sử
dụng chủ yếu cho các ngành sản xuất và cho các 1
hoạt động nào của con người?
Em hãy trình bày hình ảnh đã sưu tầm về ứng dụng Lớp chia thành 6 nhóm
của các nhiên liệu này trong đời sống. hoạt động 6’: Nhóm 1,3,5:
Các nguồn nhiêu liệu hóa thạch có phải là vô câu 1
tận không? Đốt cháy nhiên liệu hóa thạch Nhóm 2,4,6: 2
ảnh hưởng đến môi trường như thế nào? Hãy câu 2
nêu ví dụ về việc tăng cường sử dụng các
nguồn năng lượng thay thế để giảm việc sử
dụng các nhiên liệu hóa thạch
Hoạt động 1: Mở đầu
Các nhóm trưng bày sản phẩm của
nhóm mình(treo lên tường), mỗi
nhóm cử một chuyên gia ở lại thuyết
trình, các HS còn lại di chuyển đến
các sản phẩm của nhóm khác theo sơ đồ sau: NHÓM XUẤT PHÁT Hoạt động 1: Than, Mở xăng, dầ đ u ầu
chủ yếu dùng làm chất đốt cung
cấp năng lượng cho sinh hoạt và sản xuất của con 1
người, vận hành động cơ thiết bị máy công nghiệp,
phương tiện giao thông và làm nguyên liệu cho THẢO LUẬN CHUNG
nhiêu ngành công nghiệp khác như hoá mĩ phẩm, dược phẩm,...
- Nguồn nhiên liệu hoá thạch không phải vô tận mà
đang ngày càng cạn kiệt.
-Ảnh hưởng tới môi trường của việc đốt cháy nhiên 2
liệu hoá thạch: tạo lượng lớn khí carbon dioxide gây
hiệu ứng nhà kính và các chất gây ô nhiễm không khí
khác như các oxide của nitrogen, lưu huỳnh (gây mưa
acid), hợp chất hữu cơ dễ bay hơi và các kim loại nặng,... KẾT LUẬN
I. BIẾN ĐỔI VẬT LÝ VÀ BIẾN ĐỔI * Biế Bi n n đổ đ i v ậ v t ậ t lý l : :kh k ô h ng n c ó c sự ự tạo t th t àn h h àn h ch c ấ h t ấ t mới HÓA HỌC II. PHẢN ỨNG HÓA HỌC
III. NĂNG LƯỢNG CỦA PHẢN ỨNG HÓA 1. HỌC
Phản ứng tỏa nhiệt, phản ứng thu nhiệt :
2. Ứng dụng của phản ứng tỏa nhiệt :
Các nhiên liệu như than, xăng, dầu… được sử dụng trong các ngành sản xuất, phục vụ sinh hoạt… Hoạt động: LUYỆN TẬP
- Phần luyện tập có 05 câu TRÒ CHƠI hỏi. “AI NHANH
- Mỗi học sinh có 1 bảng thẻ
có mã tương ứng, 4 cạnh là 4 HƠN”
đáp án A, B, C, D. Học sinh
đọc câu hỏi trên màn hình và
chọn đáp án nào thì giơ cạnh
có chữ cái đó lên trên. BỘ CÂU HỎI SỐ 1 Câ C u 1 : Hòa t a t n đ ường v g à v o à nướ ư c l à A . P hản ả ứng h g óa h ọc. B. Phản ả ứn ứ g tỏ t a a nhiệt iệ . t C. P hản ứ ng t g hu n hiệt ệ . D. D Sự ự biến đ ổi vậ v t ậ t lí. Câ C u 2 : Đốt phosphorus tr t o r ng o g x o yg y e g n e thu đ ược chất ấ t diphosphoru r s pen e t n o t x o ide. P hương t g rình c hữ nào à sau a đây â y biểu d iễn ễ đúng p g hản ứ ng h g oá h ọc trê r n: A.Phosphorus + d iphosphorus pen e t n o t x o ide→ → o xy o g xy e g n B.Phosphorus→oxy o g xy e g n + diphosphorus pent n o t x o ide C. C Phosphorus + o xy o g xy e
g n → diphosphorus pent n o t xi o de e Câ C u 3 : Cho s ơ đồ đ phản ả ứng g hóa a học sau a : Hy d Hy ro r ge g n + O xy O g xy e g n e → → N ước Tr T o r ng q g uá t rình phản ả ứn ứ g, số ngu g yê y n t ử ử H và v à số nguyê y n tử t O có c thay a đổi không? g A. Thay a đ ổi t heo c hiều tă t n ă g dần ầ . B . Thay a đ ổi t heo c hiều giảm giả dần ầ . C. C Kh K ông t g hay a đ ổi. D. D H t H ă t n ă g c g ò c n O O giảm giả . Câ C u 4 : Dấu h iệu n ào giú p ta t c ó c th t ể nhận ậ biết iế t có c p hản ứ ng h g oá h ọc xả x y ả ra r ? A. Có C chất ấ k ế k t ế t ủa a (c ( hất ấ t không g ta t n). ) B . Có C chất ấ kh í thoát á t ra r ( sủi bọt) t . C. C Có C sự th t ay a đ ổi m àu à sắc ắ . D. D Một t tro r ng s g ố c á c c d ấu h iệu tr t ê r n. Câ C u 5 . Ch C o cá c c á phản ả ứn ứ g sau: ( 1) ) Điểu chế ế ox o yg y e g n e bằn ằ g cá c c á h đ un nóng t g huốc tím ( KMn K O4 O ), ,ngừn gừ g cung c g ấ c p ấ nhiệt iệ , t phản ả ứn ứ g dừn ừ g lại lạ ; (2 ( ) ) Nung đ g á v ô v i (Ca ( C Ca O C 3 O ); ) (3 ( ) ) Tô T i v i ô v i (Ca ( O Ca v ớ v i nướ ư c); (4 ( ) ) Cho d ung dịch HCl tá t c á dụng vớ v i dung d g ịch c NaOH, O ố ng ngh g iệm ệ n óng lên. (5 ( ) ) Quan a g hợp của a câ c y â xa x nh. Cá C c p hản ứ ng t g hu n hiệt ệ l à A. (1 ( ); ) ( 2) ) và v ( 5). ) B.(l); l) ( 3) ) và v à (4 ( ). C. C. (2 ( ); (3 ( ) ) và v à (5 ( ). ) D. D (2 ( ); ) ( 4) ) và v à (5 ( ). BỘ CÂU HỎI SỐ 2 Câu â u 1 : : Ph ả Ph n ả ứ n ng ứ s a s u a là u là ph ả ph n ả ứ n n ứ g n g ì? g Phả Ph n ả ứ n ng ứ p hâ p n hâ h n ủy h co ủy pp co e pp r ( r II I ) h ) y h d y r d o r xid o e xid t hà t nh hà nh co pp co e pp r ( r I ( I) o ) x o ide x v ide à v h à ơi n h ư ơi n ớc t ư hì ớc t c hì ầ c n ầ c n ung u ng c ấ c p ấ năn nă g n lư ợn lư g ợn dư ới d dư ạ ới d ng ạ ng nhiệ t nhiệ b t ằ b ng ằ ng cá ch cá đu ch n đu nó n ng nó . ng K . hi K ng hi ừ ng n ừ g n cun g cun c ấ c p ấ nh p iệ nh t iệ , t p hả p n hả ứ n ng ứ cũ ng ng cũ d ừ d n ừ g n lại lạ A. Phả . n Phả n ứ n ứ g n t ỏ t a ỏ a nh iệ nh t iệ . t B. P . hả P n hả n ứ ng ứ ng t hu t hu nh iệ nh t iệ . t B. P . hả P n hả n ứ ng ứ ng ph â ph n â hủ n y hủ . y . C. P . h P ả h n ả ứ n n ứ g n t r t a r o a o đ ổ đ i. ổ Câu â u 2 : : Tha n Tha ( n t ( h t à h nh à p nh hầ p n hầ chín n h chín là h là c a c rbo a n rbo ) n chá y chá t r t o r n o g n k hô k n hô g n k hí k t hí ạ t o ạ o t hà t n hà h n k h hí c h a í c rb a o rb n o d n io d xide io . xide Tr T o r ng o q uá q uá t rìn t h rìn ph h ả ph n ả ứ n n ứ g n , lư , ợng lư chấ ợng t chấ t nà o nà t o ă t ng ă ng dầ n dầ ? n A. C . arbo a n rbo d n io d x io ide x t ide ă t n ă g n dầ n dầ . n . B . O . xy O g xy e g n e t n ă t n ă g n dầ n dầ n C . C C . arbo a n rbo t n ă t ng ă ng dầ n. dầ n. D . D T . ấ T t ấ t c ả c ả đề u đề t u ă t ng ă Câu â u 3 : : Ph ả Ph n ả ứ n ng ứ h ó h a ó a họ c họ là là g ì g ? A. Q . uá u á t rình t b rình iế b n iế đổ n i đổ t i ừ t ừ c hấ h t ấ t r ắ r n ắ s n a s ng a chấ t chấ t k hí h í B . Quá . Quá t rình t b rình iế b n n đổ i đổ t i ừ t ừ c hấ h t ấ t k hí s h a í s ng a ng c hấ h t ấ t lỏ n lỏ g n C. Qu . á Qu á t rình t rình biế n biế đổ n i đổ t i ừ t ừ c hấ h t ấ t n à n y à t y hà t n hà h n chấ h t chấ k t há k c há c D . D T . ấ T t ấ t c ả c ả cá c cá ý c t r t ê r n ê Câu â u 4 : : T r T o r ng o p hả p n hả ứ n ng ứ g ng iữ g a iữ o a x o y x g y e g n v n à v h à y h d y r d o r g o e g n, n, nế u nế o u xy o g xy e g n e h n ế h t ế t t hì t p hì hả p n hả ứ n ng ứ c ng ó c x ó ả x y ả r a r a nữ a nữ a khô h n ô g n ? A. Phả . n Phả n ứ n ứ g n v ẫ v n ẫ ti n ế ti p p t ục. t ục. B . Ph . ả Ph n ả ứ n n ứ g n ti ế ti p p t ục t g ục iữ i a ữ a h y h dr y o dr g o e g n e v n à v à s ản ả p n hẩ p m. hẩ m. C. P . h P ả h n ả ứ n n ứ g n tiế p tiế t p ục n t ế ục n u ế dù u ng dù n ng hiệ n t hiệ t độ độ xúc t xúc á t c. á c. D . D P . hả P n hả ứ n ng ứ d ng ừ d n ừ g n lạ i. lạ Câu â u 5 : : T r T o r ng o p ng hả p n hả ứ n ng ứ ng hó a hó a h ọ h c, ọ liê n liê k n ế k t ế t g iữ g a iữ a n g n uy u ê y n t n ử t ử t r t o r ng o ng c á c c á ph â ph n â t n ử t ử như như t hế t hế nà o nà ? o A. K . hô K ng hô t ng ha t y ha đổ i. đổ B . Tha . y Tha đổ i. đổ C. C C . ó C ó t h t ể h t h t a h y a đổ y i đổ ho i ặ ho c ặ k hô k n hô g n . . D . D Đ . áp á á p n á n k hác. há BÀI TẬP TỰ LUẬN Hoạt động
1. Giải thích tại sao ở các trạm bơm xăng dầu lại có nhóm đôi biển báo cấm lửa.
2. Quét nước vôi tôi lên tường, sau 1 thời gian thấy
có lớp chất rắn khô cứng lại.
a) Nêu dấu hiệu phản ứng.
b) Viết PT chữ của phản ứng biết vôi tôi tác dụng
với khí carbon dioxide trong không khí và chất rắn
khô lại là calcium carbonate. Ngoài ra còn có nước
sinh ra trong phản ứng.
Hoạt động 1: Mở đầu
Do xăng, dầu là chất dễ bay hơi, dễ bắt lửa, dễ 1
cháy do đó ở các cây xăng, kho chứa xăng dầu
thường treo các biển cấm lửa, cấm hút thuốc.
a) Sau khi quét nước vôi 1 thời gian thấy khô lại
và có chất rắn không tan chứng tỏ đã có phản
ứng hóa học xảy ra làm cho nước vôi (Calcium 2
hydroxide) chuyển thành chất rắn là canxi cacbonat. →
b) Calcium hydroxide + carbon dioxide calcium carbonate + Nước. KẾT QUẢ
Hoạt động 1: Mở đầu
HOẠT ĐỘNG 4: VẬN DỤNG (VỀ NHÀ)
- Tìm hiểu từ Internet hay tài liệu sách, báo:
+ Nhận biết được các biến đổi hóa học xảy ra trong
cuộc sống hàng ngày
+ Biết sử dụng nhiệt của các phản ứng đốt cháy
nhiên liệu để đun nấu, sưởi ấm.
- Nộp bài báo cáo vào tiết sau THANK YOU
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Thí nghiệm:
- Slide 15
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- Slide 22
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38
- Slide 39
- Slide 40
- Slide 41
- Slide 42
- Slide 43
- Slide 44
- Slide 45
- Slide 46
- Slide 47
- Slide 48
- Slide 49
- Slide 50
- Slide 51
- Slide 52
- Slide 53
- Slide 54
- Slide 55
- Slide 56
- Slide 57
- Slide 58
- Slide 59
- Slide 60
- Slide 61
- Slide 62




