























Preview text:
Bài 9 : BASE. THANG PH
GV: Nguyễn Thị Thanh Thảo Hoạt độn Nê H u o g 1: ạt cách độ để Mở ng 1 nhận bi . ết m đ Một ầu ở đầ chất l u à axit trong thực tế Kể H tên S t các hảo l acid uận có cặ t p rong đôi, trcơ ả l tờhể i: động thực
vật hoặc thực phẩm mà em biết
1 Trong nọc độc của ong, kiến có axit gì? 2 3 Hoạt độn C H á o ch g 1: ạt độ nhận biết Mở ng 1
một .ch ất đ Ml ầu ở à đ
axiầt turong thực
tế: có vị chua, dd axit làm quỳ tím hóa đỏ Báo cáo, thảo luận:
acetic acid trong giấm ăn, citric acid trong
quả chanh, maleic acid trong quả táo… 1
Trong nọc độc Ong, kiến, muỗi… có acid
fomic (HCOOH). Ngoài ra, còn có acid
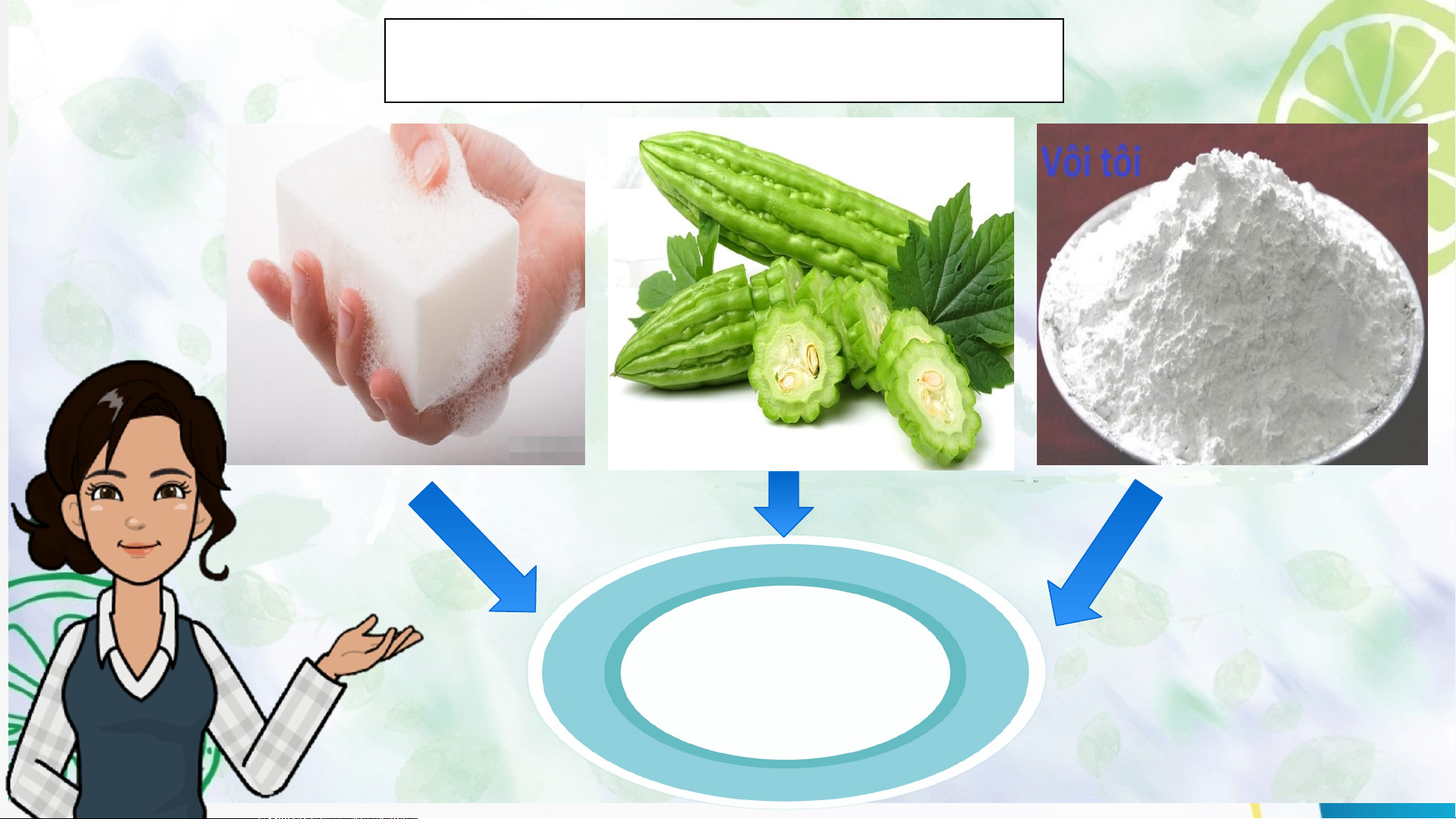
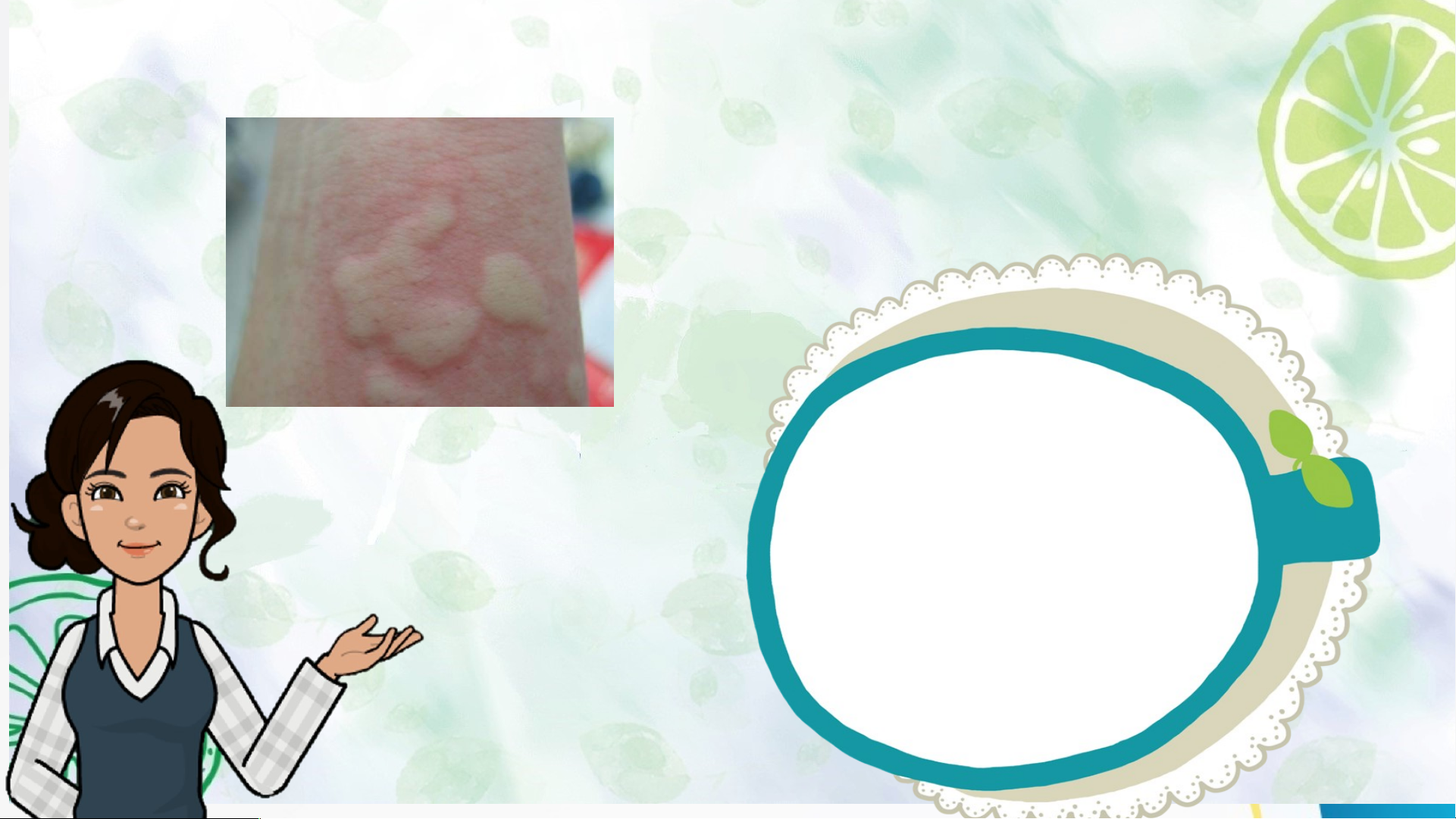
2 chlohydric (HCl), acid phosphoric (H PO4). 3 3 Hoạt độn Ho g 1: ạt độ Mở ng 1. đ M ầu ở đầu BASE Hoạt độn Ho g 1: ạt độ Mở ng 1. đ M ầu ở đầu Tại sao khi bị ong hoặc kiến đốt, người ta thường bôi vôi vào vết đốt? Hoạt độn Ho g 1: ạt độ Mở ng 1. đ M ầu ở đầu ACID BASE
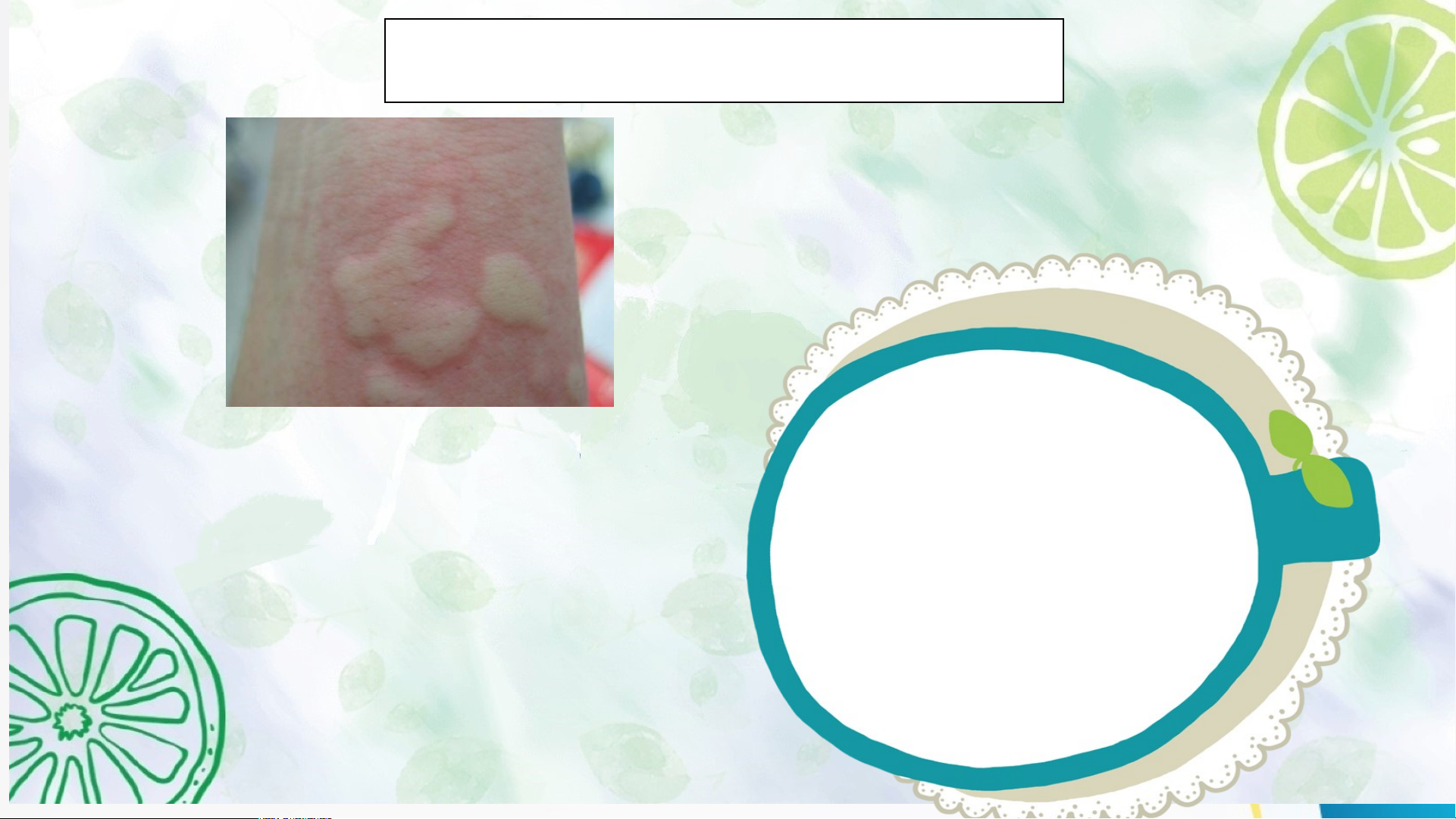
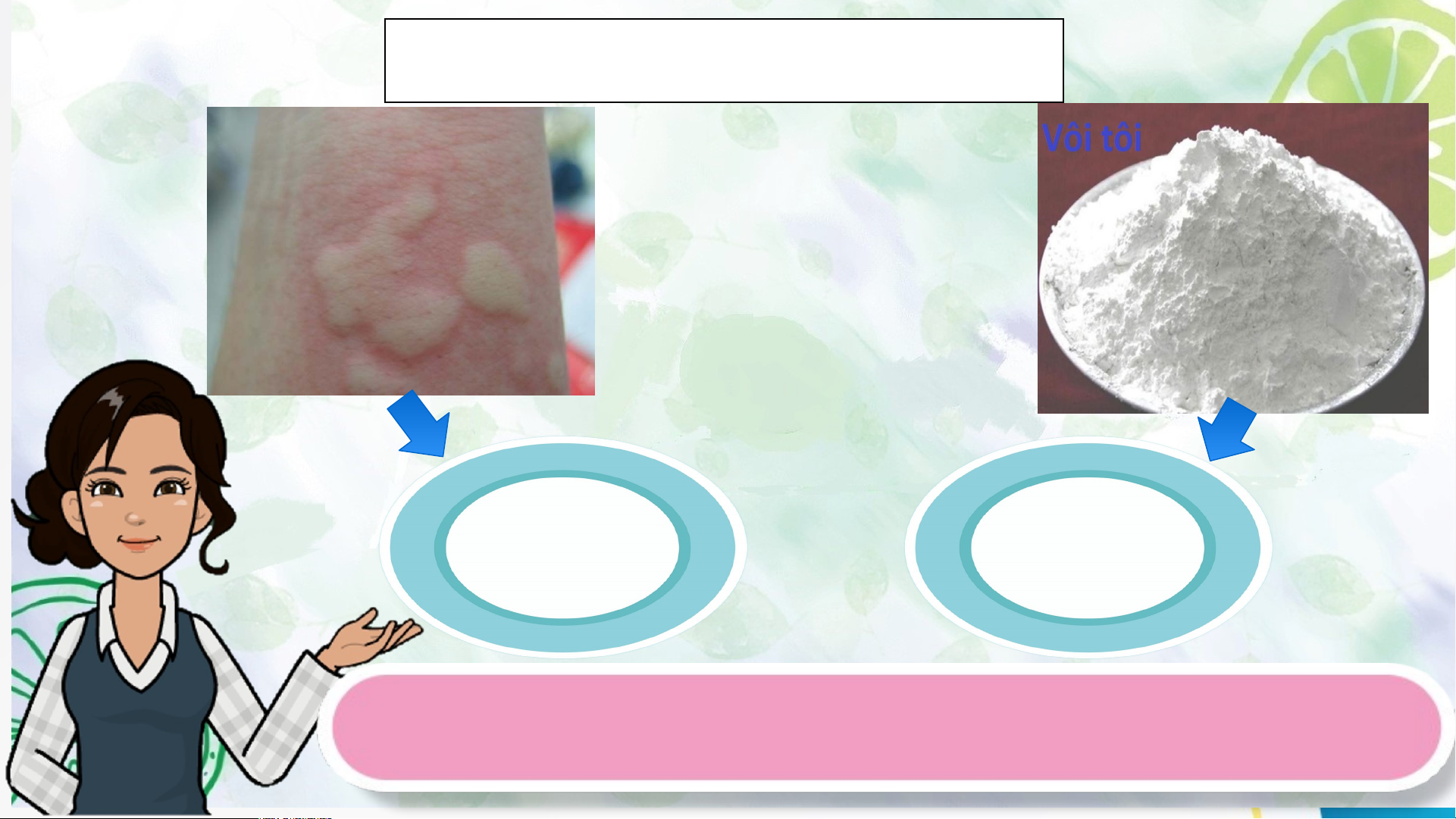
Tại sao bôi vôi vào vết cắn có thể làm cho vết phồng
xẹp xuống và không còn cảm giác rát ngứa nữa? HoHoạ ạt t độn động 2: g 1: Hìn h t Mở hà nh đkầu iến thức mới I. KHÁI NIỆM BASE
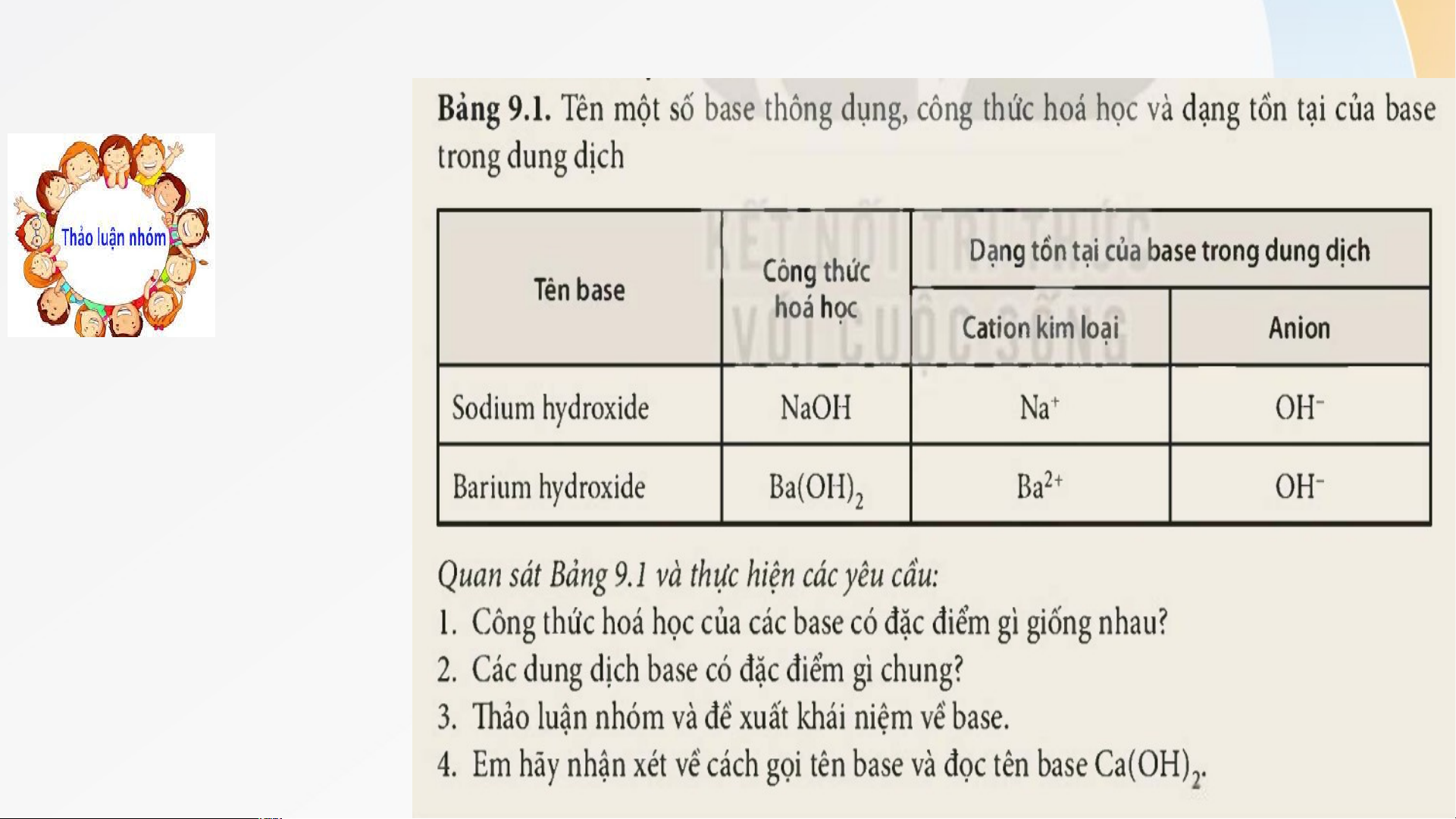
Vòng 1: Nhóm chuyên gia Quan sát bảng 9.1 Thảo luận nhóm (5 phút): Nhóm 1: CH1 Nhóm 2: CH2 Nhóm 3: CH3 Nhóm 4: CH4
Vòng 2: Nhóm mảnh ghép:
NV1: Thảo luận nhóm (5 phút), trả lời 4 câu hỏi:
1.Công thức hoá học của các base đều có nhóm OH Báo
2. Dạng tồn tại của base trong dung dịch có chứa
anion OH- và cation kim loại cáo, thảo
3. Base là những hợp chất trong phân tử có luận
nguyên tử kim loại liên kết với nhóm hydroxide. Khi
tan trong nước, base tạo ra ion OH-
Tên Base = tên kim loại + hóa trị (nếu KL có nhiều hóa trị) + hydroxide Ca(OH)2 : calcium hydroxide KẾT LUẬN I. KHÁI NIỆM BASE * * Khái K ni n ệm base b : Base B là nh n ững h ững hợ h p p chất chấ trong ro ng phân ph ân tử có có ngu ng yên u tử t kim loại l liên ên kết với nhó n m hó m hydroxi hyd de. d Kh K i h tan an trong ron g nước, base b tạo ạo ra ion on OH O - H . - * Cô C ng ô ng thức h phân p hân tử của ử base b - Gồ G m ồ 1 ngu n yên gu yên tử kim m loại o liên i kết vớ v i 1 hay h nhi nh ều ều nhó nh m ó hydrox h i ydrox de (- ( OH O ) H . ) - Dạng D ạng tổng ổ ng quát q : uát M( M O ( H) H n + + n: n: là hóa hó trị của củ kim loại o M * Tên Tê gọi g : Tên T Ba B s a e = e tên t kim m loại o + + hóa h óa trị (nếu n KL K L có có nhi nh ều ều hóa hó trị) + + hydrox h i ydrox de
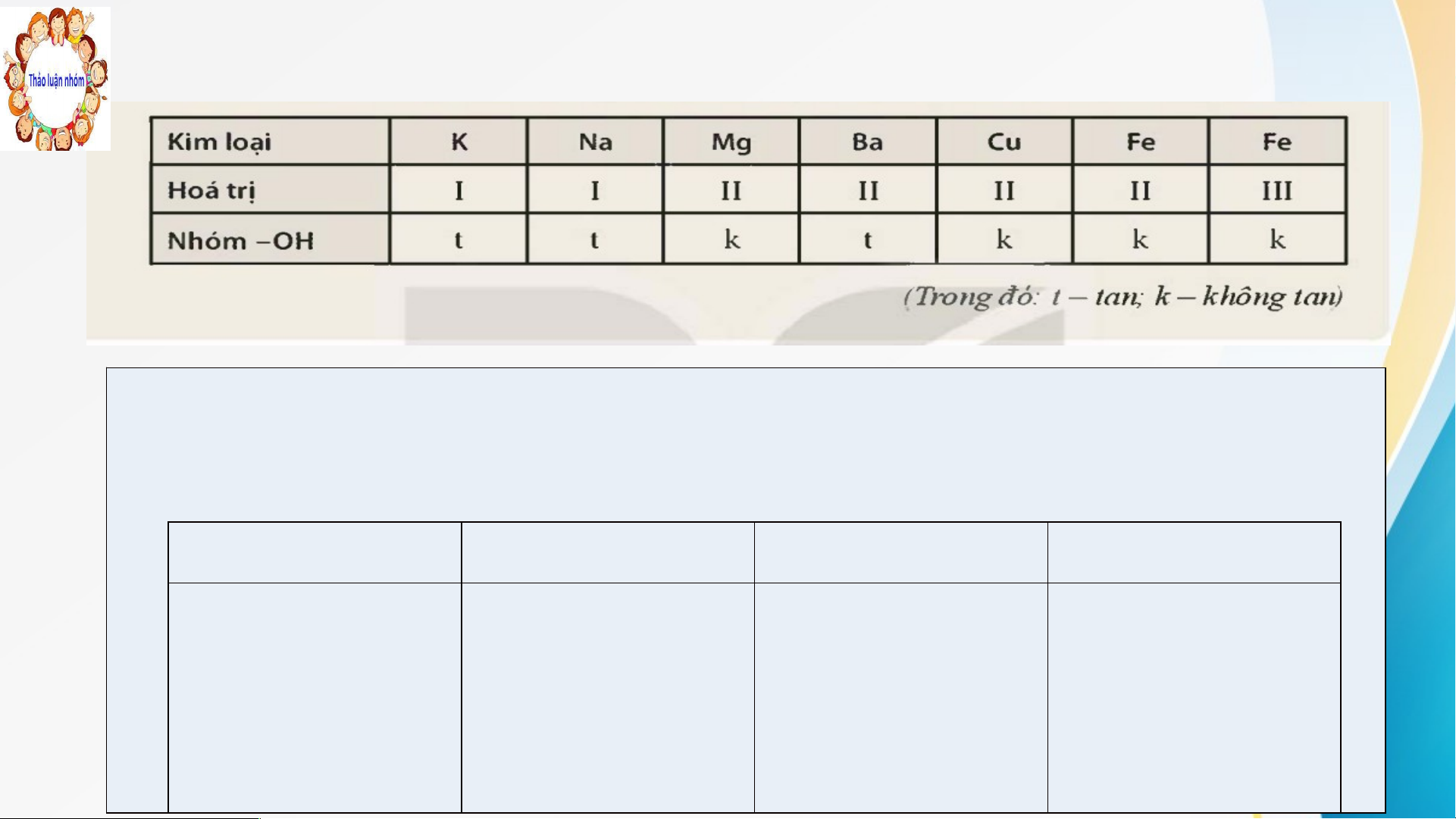
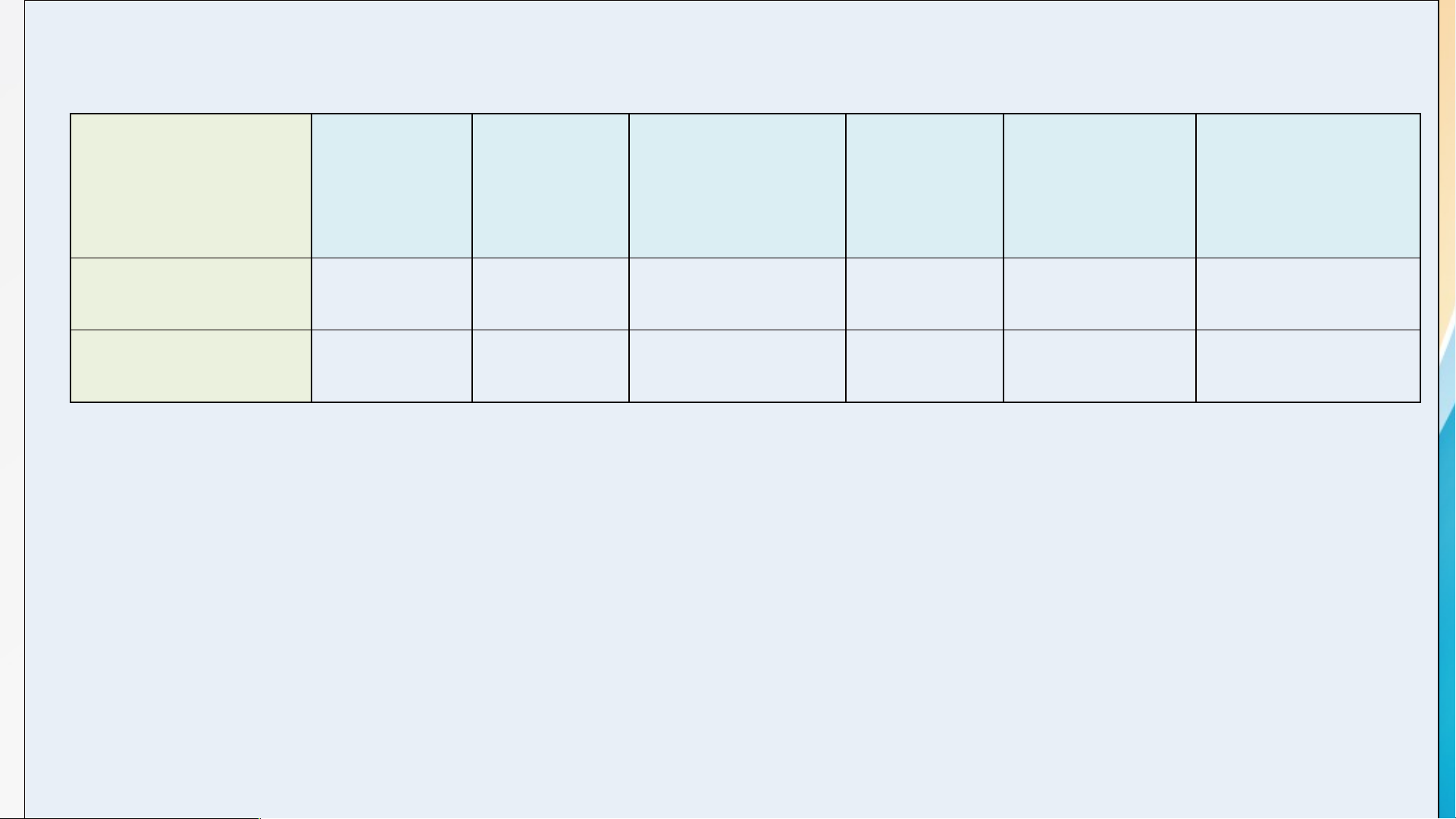
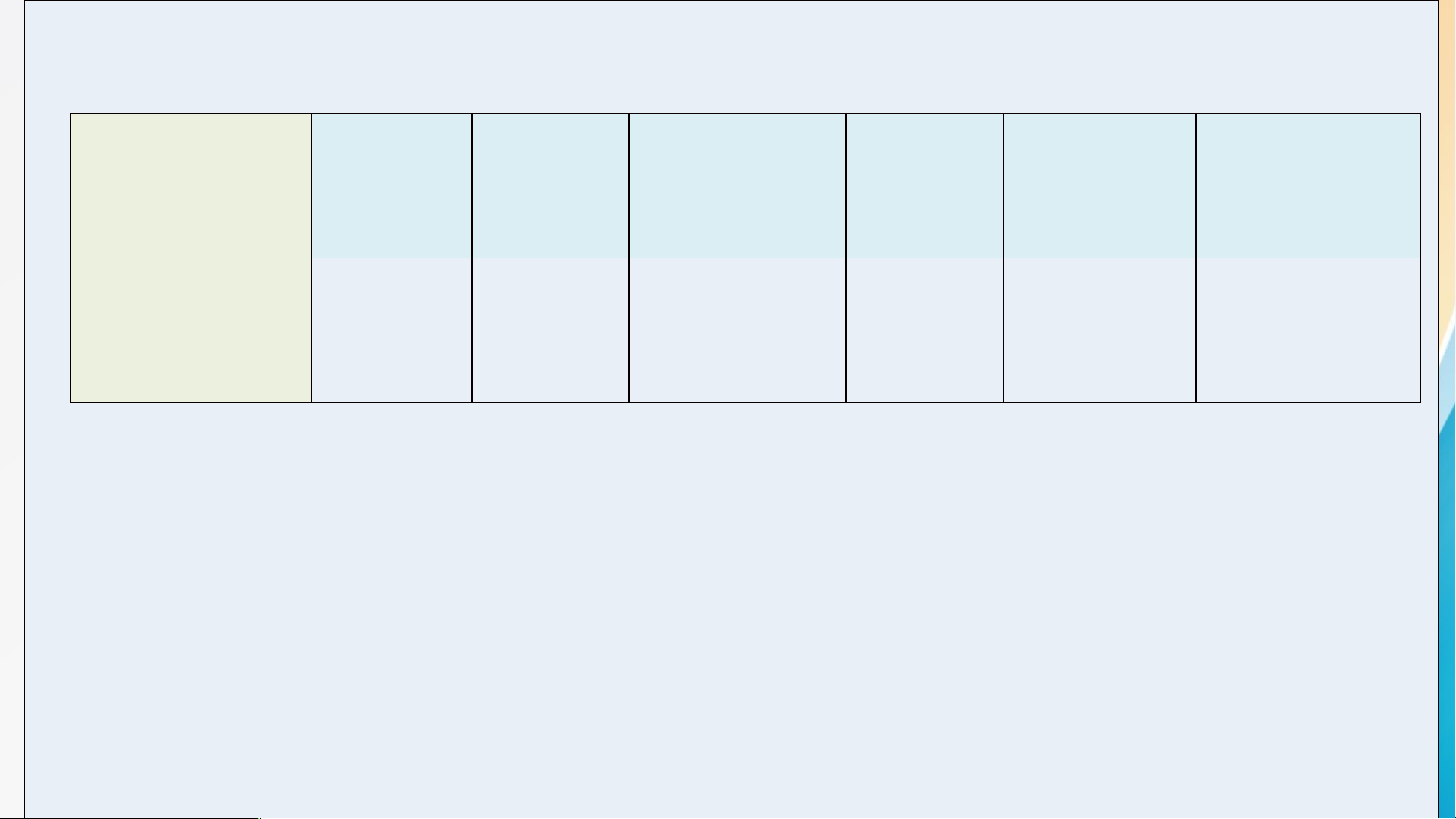
NV2: Quan sát bảng tính tan dưới đây, hoàn thành phiếu học tập : Phiếu học tập 1
Dựa vào bảng tính tan, em hãy viết công thức hóa học của các base có trong
bảng, sau đó xếp các base vào cột thích hợp và gọi tên Base không tan Tên gọi Base kiềm Tên gọi
Báo cáo, thảo luận Phiếu học tập 1
Dựa vào bảng tính tan, em hãy viết công thức hóa học của các base có
trong bảng, sau đó xếp các base vào cột thích hợp và gọi tên Base Tên gọi Base Tên gọi không tan kiềm Mg(OH) Magnesiumhydroxide KOH Potassium hydroxide 2 Cu(OH) Copper (II) hydroxide NaOH Sodium hydroxide 2 Fe(OH) Iron (II) hydroxide Ba(OH) . Barium hydroxide 2 2 Fe(OH) Iron (III) hydroxide 3 KẾT LUẬN I. KHÁI NIỆM BASE * Kh K á h i á ni n ệm m bas a e s : Ba B s a e s e là à nhữn h g g hợp ợ p chấ h t trong n g ph p â h n â tử ử có ó ngu g y u ên ê tử ki k m m loạ o i ạ liên ê kế k t ế vớ v i ớ nh n óm ó hy h dr d ox o i x de. e Kh K i h tan a n tro r ng n g nướ n c, c ba b se s e tạo ạ o ra a ion o n OH-. H * Cô C n ô g g thức h ức phâ h n â tử củ c a ủ a bas a e s - Gồm m 1 1 ng n u g yê y n ê tử ki k m m loạ o i ạ liên n kế k t ế vớ v i 1 1 hay a y nhi h ều u nhó h m ó hyd y r d ox o i x de d e (-OH). H - Dạ D ng n tổn tổ g g quá u t: M(OH) H n n n: là à hóa ó a trị r củ c a ủ ki k m loại ạ M * Tê T n ê gọ g i: Tê T n n Ba B s a e s = tên tê ki k m loại ạ + hó h a a trị (nế n u ế KL K L có c ó nhi h ều u hóa ó a trị) + hy h dr d ox o i x de * Ph P ân â loạ o i: Cá C c á c ba b s a e e đượ đ c c ch c ia a làm à m hai a loạ o i ạ tùy tù theo e o tính n tan: n + Ba B s a e s e tan a n đượ đ c ượ tron o g g nước ướ c gọi ọ là à ki k ềm ề m Ví V dụ d : Na N O a H, H KO K H, H Ca C (O a H) H 2, 2 ... + Ba B s a e s e khô h ng n g tan ta tro tr ng n nướ n c Ví V dụ d : Fe(O e H) H 3, 3 Cu C (OH)2 H ,….. II. TÍNH CHẤT HÓA HỌC:
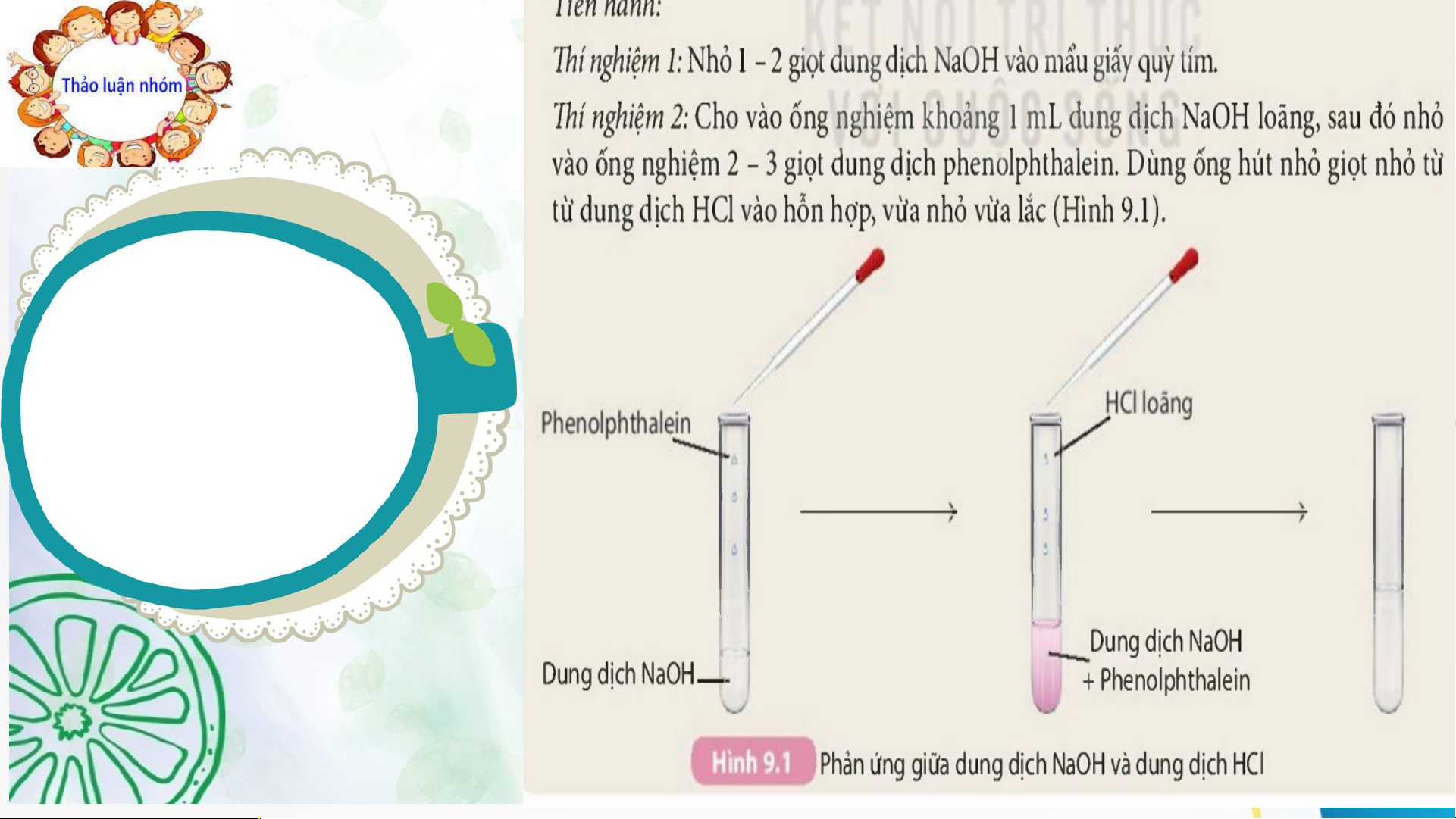
Hoạt động 1: Mở đầu Tiến hành thí nghiệm, ghi kết quả vào Câu 1- Phiếu học tập 2 Phiếu học tập 2
Câu 1:Tiến hành thí nghiệm tìm hiểu tính chất của base và hoàn thành bảng sau: STT Thí nghiệm Hiện tượng
Phương trình phản ứng 1 Nhỏ 1-2 giọt dd NaOH Quỳ tím thành màu và mẩu giấy quỳ tím xanh. 2 -Cho vào ống nghiệm - Dung dịch
- Các dung dịch base (kiềm) khoảng 1ml dung dịch
phenolphtalein không làm đổi màu chất chỉ thị: NaOH, sau đó nhỏ vài
màu thành màu hồng. + Quỳ tím thành màu xanh. giọt dd phenolphthalein +Dung dịch phenolphtalein
không màu thành màu hồng. - Ống nghiệm nóng - Nhỏ từ từ dung dịch dần, dung dịch màu - NaOH + HCl → NaCl + H2O HCl vào hỗn hợp
Sodium hydroxide sodium chloride hồng chuyển sang không màu KẾT LUẬN
II. TÍNH CHẤT HÓA HỌC: - Cá C c c dun u g g dịch c h bas a e s e (ki k ềm) m làm à đổ đ i màu à ch c ấ h t ấ ch c ỉ thị: + Quỳ u ỳ tím thàn à h n màu à u xa x nh n . + Du D ng n g dị d ch h phe h n e ol o phta h lei e n kh k ôn ô g n màu à u thà h n à h h màu à u hồ h n ồ g. g - Ba B s a e s e tác tá dụ d ng n g ac a i c d d tạo tạ thàn à h n muố u i ố và v à nước ướ . c Ph P ản ả n ứng g này à y được ượ gọ g i là à ph p ản ả n ứng ứn trun u g g hòa ò
Hoạt động 1: Mở đầu Tại sao khi bị ong hoặc kiến đốt, người ta thường bôi vôi vào vết đốt?
Thảo luận nhóm, trả lời Câu 2, 3 - Phiếu học tập 2 Phiếu học tập 2
Câu 2: Có 2 ống nghiệm không nhãn đựng dung dịch NaOH và HCl. Hãy nêu cách nhận biết 2 dung dịch trên:
Dùng chất chỉ thị màu như: quỳ tím, phenolphthalein, giấy PH.
VD: dùng quỳ tím: dung dịch làm quỳ tím chuyển sang màu đỏ là HCl
dung dịch làm quỳ tím chuyển sang màu xanh là NaOH
Câu 3: Ở nông thôn, người ta thường dùng vôi bột rắc lên ruộng để khử chua cho đất .
Biết rằng thành phần chính của vôi bột là CaO, CaO tác dụng với H O tạo thành 2
Ca(OH) theo phương trình hóa học: CaO + H O →Ca(OH) . Hãy giải thích tác dụng 2 2 2 của vôi bột
Vôi bột tan trong nước tạo dung dịch base( nước vôi trong) dùng để khử chua
đất do xảy ra phản ứng trung hòa Ca(OH) + 2HCl → CaCl + 2H O 2 2 2 III. THANG PH:
Hoạt động 1: Mở đầu Tiến hành thí nghiệm, ghi kết quả vào Câu 1- Phiếu học tập 3 Phiếu học tập 3
Câu 1:Nhỏ lên mỗi mẩu giấy PH một loại dung dịch rồi ghi kết quả vào cột thích hợp: Dung dịch Nước lọc Nước
Nước ngọt có nước xà Giấm ăn Dung dịch chanh gas phòng baking soda Màu giấy PH Giá trị PH
a. Từ kết quả trên, kết luận:
Dung dịch có tính axit là:………………………………………………………..
Dung dịch có tính base là: ………………………………………………………. b.
Dung dịch các chất có giá trị PH<7 có tính chất……………………
Dung dịch các chất có giá trị PH>7 có tính chất…………………… Phiếu học tập 3
Câu 1:Nhỏ lên mỗi mẩu giấy PH một loại dung dịch rồi ghi kết quả vào cột thích hợp: Dung dịch Nước lọc Nước
Nước ngọt có nước xà Giấm ăn Dung dịch chanh gas phòng baking soda Màu giấy PH Không đổi Đỏ Đỏ Xanh Đỏ Xanh Giá trị PH 7 2 3 10 4 9
a. Từ kết quả trên, kết luận:
Dung dịch có tính acid là:………………………………………………………..
Nước chanh, nước ngọt có gas, Giấm ăn
Dung dịch có tính base là: ……………………………………………………….
Nước xà phòng, dung dịch Baking soda b.
Dung dịch các chất có giá trị PH<7 có tính chất……………………
Dung dịch các chất có giá trị PH>7 có tính chất……… Aci…… d ……… Base KẾT LUẬN III. THANG PH: Th T an a g n PH PH đượ đ c c dù d ng n để đ ể biểu ể thị độ ộ ac a i c d, d ba b s a e s củ c a a du d n u g g dịch c . + PH P H < 7 7 : Môi trườn ườ g g aci c d; pH H cà c n à g n nh n ỏ ỏ thì h độ đ ộ ac a i c d d củ c a ủ du d ng n g dị d ch c cà c ng n g lớn ớ + PH P H = 7: 7 Môi Mô trườn ườ g g tru r ng n tính h (kh k ô h ng n có c ó tính n ac a id d và v kh k ôn ô g g có c ó tính h bas a e s ) e . + PH P H > 7: 7 Môi Mô trườn ườ g g bas a e s ; pH p H cà c ng n lớn ớ thì h độ ộ bas a e s e củ c a a dun u g g dịch c cà c n à g n lớn
Thảo luận nhóm, trả lời Câu 2, 3 - Phiếu học tập 3 Phiếu học tập 3
Câu 2: Em hãy nêu cách để kiểm tra đất trồng có bị chua hay không?
Lấy mẫu đất hòa vào cốc nước cất rồi dùng giấy PH hoặc thiết bị đo PH. Nếu giá trị PH đo được
là <7 thì đất trồng bị chua
Câu 3: Em hãy tìm hiểu và cho biết giá trị PH trong máu, trong dịch dạ dày của người, trong nước mưa,
trong đất. Nếu giá trị PH trong máu và trong dịch dạ dày của người ngoài khoảng chuẩn sẽ gây nguy
hiểm cho sức khỏe của người như thế nào?
- PH bình thường của máu nằm trong khoảng 7,35-7,45 có nghĩa là máu có tính base yếu. KHi PH< 7,35 có
thể bị các bệnh: đau đầu, lú lẫn, mệt mỏi, ho và khó thở ; nhịp tim không đều, đau bụng, co giật; hôn
mê….Khi PH> 7,45 có thể bị các bệnh: lú lẫn và chóng mặt; run tay; tê ngứa bàn chân, mặt; co thắt cơ; buồn nôn; hôn mê;…
- Dịch ở dạ dày thường có PH khoảng 3-5,5. PH thấp sẽ giúp việc tiêu hóa thức ăn và tiêu diệt vi khuẩn trong
dạ dày dễ dàng hơn. PH>5,5 có thể do cơ thể mắc các bệnh: ung thư dạ dày, nhiễm trùng dạ dày tái phát, ;
hội chứng kém hấp thu; sự phát triển quá mức vi khuẩn đường ruột;…PH<3 ( lượng các chất tiết dạ dày cao
hơn bình thường): viêm dạ dày; loét dạ dày; hội chứng kém hấp thu; trào ngược dạ dày..
- PH của đất và nước mưa tùy thuộc từng vùng, nước mưa bình thường mà chúng ta hay sử dụng có giá trị
pH rơi vào khoảng 5,6. Cụ thể hơn, tại thành phố, giá trị pH nước mưa dao động từ 4,67 – 7,5. Và tại các khu
công nghiệp, nước mưa có giá trị pH trung bình khoảng 4,72, thường dao động từ 3,8 – 5,3.
Hoạt động 1: Mở đầu
HOẠT ĐỘNG 3: LUYỆN TẬP 单 M 击此处添加文字标题
Mỗi nhóm đều phải vượt qua 4 trạm, ở mỗi trạm sẽ có 1 gói câu hỏi
tương ứng, trả lời hết câu hỏi ở trạm này mới được sang trạm tiếp
theo, nhóm về đích trước nhất và có số câu trả lời đúng nhiều nhất là thắng TRẠM 1 TRẠM 2 TRẠM 3 TRẠM 4 ĐÍC H T Hoạ
RẠM 1 t động 1: Mở đầu
1. Dãy các base làm phenolphtalein hoá hồng A. NaOH; Ca(OH) ; KOH 2 B. NaOH; Ca(OH) ; Zn(OH) 2 2 ; KOH; Al(OH) C. Ba(OH)2 3 ; Ca(OH) ; Fe(OH) D. Ba(OH)2 2 3
2. Trong các base dưới đây, base nào tan tốt trong nước? A. Fe(OH) . 3 B. KOH B. KOH. C. Fe(OH) . 2 D. Cu(OH) . 2 3.D A u . ng N a d Oịch H, nào KO Hsa , u C a đ ( â O y H l)à.m
quỳ tím chuyển sang màu xanh? 2 A. NaOH, KOH, Ca(OH) . 2 B. HCl, NaCl, NaOH C. HNO , Ba(OH) , NaOH 3 2 D. H SO , Ca(OH) , KOH. 2 4 2 Hoạ TRẠM t độn 2
4. Sodium hydroxide công thức là g 1: A. NO H Mở B.N ađ O ầu B.NaOH H C.Ba(OH) 2 D.KOH.
5.Tên gọi của Mg(OH) 2 A. Potassium hydroxide C . Ma B. g n C e al s ciiu u m m h hyy ddr ro o xix did e e C. Magnesium hydroxide D. Aluminium hydroxide 6 . A. Đ diề u u n kh g d ẳ ị n chg đ cóị nh môđ i ú t ng rư ờlà n : g base thì pH > 7.
A. dung dịch có môi trường base thì pH > 7.
B. dung dịch có môi trường trung tính thì pH < 7.
C. dung dịch có môi trường acid thì pH = 7.
D. dung dịch có môi trường trung tính thì pH > 7. Hoạ TRẠM t độn 3 7. g 1: Dung dịch Mở
nào sau đây có pH = 7 A. NaOH. B . B .N a N Cl C đ .l ầu C. H2SO4. D. HCl.
8. Dung dịch nào sau đây có pH < 7
A. NaOH. B. KCl. C.H SO . 2 4 D. KOH. 2 4
9. Ở những vùng đất phèn người ta bón vôi để làm
A. Giảm khoáng chất cho đất B. Tăng khoáng chất cho đất.
C. Giảm PH của đất. D D.. Đ Đểể ttrung rung hòa hòa đđộ ộ PPH H..
10. Dịch vị dạ dày thường có pH trong khoảng từ 2-3. Những người bị
mắc bệnh viêm loét dạ dày, tá tràng thường có pH < 2. Để chữa căn bệnh
này, người bệnh thường uống trước bữa ăn chất nào sau đây?
A. Nước đường saccharozo. B . B .D u D ng un dị g d cịh ch N aHCO .3 NaHCO . 3
C. Nước đun sôi để nguội.
D. Một ít giấm ăn. TRẠM 4
Câu 2: Một loại thuốc dành cho bệnh nhân đau dạ dày có chứa
Al(OH)3 và Mg(OH)2. Viết phương trình hoá học xảy ra giữa acid HCl có
trong dạ dày với các chất trên.
Câu 2: Các phương trình hoá học xảy ra:
Al(OH) + 3HCl → AlCl + 3H O 3 3 2
Mg(OH) + 2HCl → MgCl + 2H O. 2 2 2 1 2 KẾT QUẢ 3 4
Hoạt động 1: Mở đầu HOẠT ĐỘNG 4: - L VẬ ớp chi N a th D ành Ụ 8 n NG hóm
- Tìm hiểu sự thay đổi màu PH các loại nước ngọt
hay sử dụng, từ đó kết luận ảnh hưởng của các loại
nước ngọt đó đến sức khỏe nếu sử dụng quá nhiều.
- Chụp hình và thực hiện bài báo cáo dưới dạng
Power Point vào tiết sau
Hoạt động 1: Mở đầu HOẠT ĐỘNG 4: VẬN DỤNG
BÁO CÁO, THẢO LUẬN KẾT LUẬN Cá C c á c loạ o i ạ thức ức uố u ng n tron o g g thị h trườ r ng n , gầ g n n gũi ũ với ớ cá c c c em e phầ h n ầ lớn ớ đề đ u u có c mô m i trườ r ng n g ax a i x t. Nế N u ế u uốn ố g g nhi h ều ề sẽ s kh k ô h ng n g tốt ch c o o sức ức kh k ỏ h e e nếu ế kh k ô h n ô g g biết ế sử s dụ d ng n mộ m t cá c c á h c đi đ ều ề độ đ ch c ưa ưa kể k đế đ n ế cò c n n ảnh n h hưở h n ưở g n đế đ n n kinh n tế tế và à nạp ạ p vào à o cơ c thể ể một ộ hà h m à lượng n đườ đ n ườ g g khá h ca c o a o có c ó thể h ể gây â y ra r a tiểu u đườ ư ng n . g 1 5 2 6 KẾT QUẢ 3 7 4 8
Document Outline
- Slide 1
- Slide 2
- Slide 3
- Slide 4
- Slide 5
- Slide 6
- Slide 7
- Slide 8
- Slide 9
- Slide 10
- Slide 11
- Slide 12
- Slide 13
- Slide 14
- II. TÍNH CHẤT HÓA HỌC:
- Slide 16
- Slide 17
- Slide 18
- Slide 19
- Slide 20
- Slide 21
- III. THANG PH:
- Slide 23
- Slide 24
- Slide 25
- Slide 26
- Slide 27
- Slide 28
- Slide 29
- Slide 30
- Slide 31
- Slide 32
- Slide 33
- Slide 34
- Slide 35
- Slide 36
- Slide 37
- Slide 38




