Preview text:
Họ và tên: Đỗ Hoài Sang GVHD: Hồ Văn Tài MSSV: 21065091 Điểm Lời phê DHHO17A-Nhóm 4
BÁO CÁO THỰC HÀNH HÓA PHÂN TÍCH
Bài 2. PHƯƠNG PHÁP PEMANGANAT XÁC ĐỊNH Fe2+, H2O2 CÔNG NGHIỆP 1. Mục tiêu
- Rèn luyện kĩ năng chuẩn độ, sử dụng chỉ thị, nhận biết điểm dừng chuẩn độ.
- Rèn luyện kĩ năng lấy mẫu và xử lí mẫu, xác định hàm lượng sắt, H2O2.
- Xử lí kết quả thí nghiệm và trình bày báo cáo.
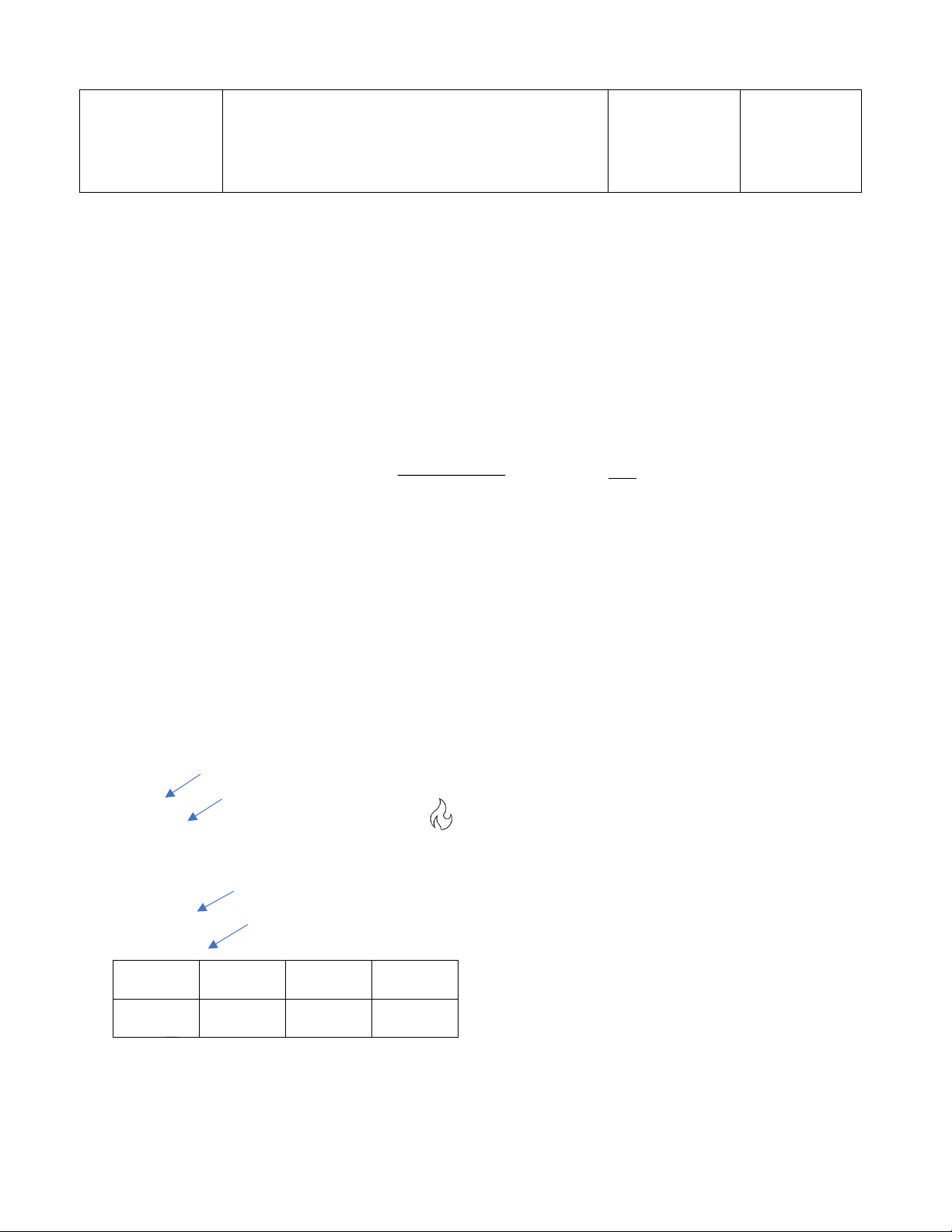
2. Hóa chất & cách pha hóa chất Tên hóa chất Cách pha Vai trò Giải thích KMnO4 0,05N mKMnO 4 ¿ CN ×V pha× M 10× p×z Chất chuẩn,
0,05×250×158,03 Chất tự chỉ = 10×99,5×5 = 0,397 (g) thị
→mcân= 0,4 (g) →CNKMnO(thực4)=¿ 0,0504N H 0,05N Chất 2C2O4
mH2C2O4 ¿ CN ×V pha× M 10× p×z chuẩn gốc = =1,5838(g)
→mcân= 1,5868(g) →CNH(2thựcC2O)4=0,0501 N Chất môi H2SO4 CM = 2M trường H3PO4 đđ Tạo phức Dễ quan sát không màu nhận biết với Fe3+ điểm dừng chuẩn độ FeSO4 mFeSO 4 ¿ CN ×V pha× M 10× p×z
0,03×500×392,13 ¿ = 3(g) 10×98×2 3. Thực nghiệm
3.1 Pha chế hóa chất
3.1.1 Pha chế dung dịch chuẩn gốc acid oxalic để xác định dd chuẩn KMnO4 3.1.1.1 Nguyên tắc 3.1.1.2 Cách tiến hành
3.1.2 Pha 250mL dd KMnO4 ≈ 0,05N từ dd
KMnO4 + 2H2O⇋ 4MnO2 + 3O2 + 4H2O →mKMnO4 ¿ CN ×V pha× M ×100 1000×z p
3.2 Xác định nồng độ dung dịch chuẩn KMnO4 theo chất gốc 3.2.1 Nguyên tắc Phản ứng chuẩn độ + 5 2 MnO−4
C2O24−+16 H+¿⇋2Mn2+¿+10CO2↑+8H2O¿¿
Điểm dừng: không màu ⟶hồngnhạt 3.2.2 Cách tiến hành dd KMnO4 60-80℃ 5mL H2SO4 2M 10mL H2O
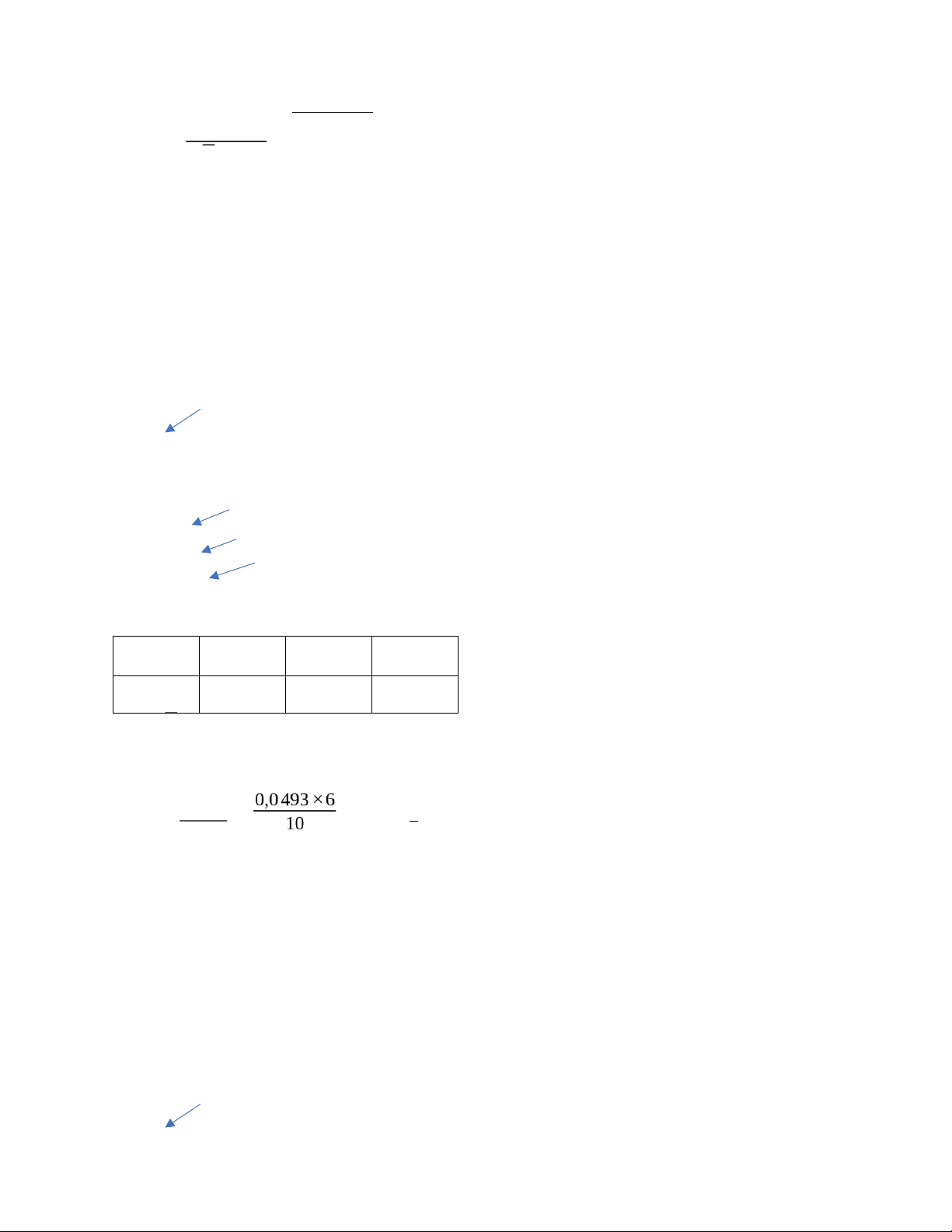
10mL dd H2C2O4 0,0501N * Kết quả thí nghiệm: Lần 1 Lần 2 Lần 3 V KMnO 10,2 mL 10,3 mL 10 mL 4
⟹ V KMnO = 10,167 mL 4
Điểm dừng: Không màu ⟶ Hồng nhạt thực =
4 (CV)H2C2O4 0,0501×10 = 0,0493N ⟶CKMnO = V KMnO4 10,167
3.3 Phân tích định lượng Fe2+ 3.3.1 Nguyên tắc Phản ứng chuẩn độ
2 MnO−4 + 5Fe2++8 H+¿⇋Mn2+¿+5Fe3+¿+4H2O¿¿¿
Điểm dừng: không màu ⟶hồngnhạt 3.3.2 Cách tiến hành dd KMnO4 5mL H2SO4 2M, 1ml H3PO4 đđ 10mL H2O 10mL dd Fe2+ * Kết quả thí nghiệm: Lần 1 Lần 2 Lần 3 V KMnO 6,1 mL 6 mL 5,9 mL 4 ⟹ V KMnO = 6 mL 4
Điểm dừng: Không màu ⟶ Hồng nhạt ⟶CFe = = 0,0296N ¿=(CV )KMnO4 ¿ V Fe2+¿ ¿
3.4 Xác định hàm lượng H2O2 trong công nghiệp 3.4.1 Nguyên tắc Phản ứng chuẩn độ 2 MnO− + H 4
2O2+6 H+¿⇋2Mn2+¿+5O2↑+8H2O¿¿
Điểm dừng: không màu ⟶hồngnhạt 3.3.2 Cách tiến hành dd KMnO4 5mL H2SO4 2M 10mL H2O 10mL dd H2O2 * Kết quả thí nghiệm: Lần 1 Lần 2 Lần 3 V KMnO 18,5 mL 18,8mL 18,4 mL 4
⟹ V KMnO = 18,567 mL 4
Điểm dừng: Không màu ⟶ Hồng nhạt
thực2 2 (CV )KMnO4 =0,0493×18,567 = 0,0915N ⟶CH O = V H2O2 10 3.5 Câu hỏi
a) Tại sao khi chuẩn độ H bằng KMnO 2C2O4
4 người ta phải đun nóng?
- Vì lúc đầu phản ứng trên xảy ra chậm do ion C 2−
– cùng dấu nên khó tương 2O4 vàionMnO4
tác phải đun nóng dung dịch H2C2O4 đến 60÷80oC để tăng tốc độ. Vì phản ứng sinh ra khí
khó chuẩn độ nên cần đun đuổi khí. Tuy nhiên không đun sôi vì acid oxalic dễ phân hủy.
b) Tại sao khi chuẩn độ Fe2+ bằng dd chuẩn KMnO4, người ta không phải đun nóng? -
Do ion Fe2+¿vàionMnO ¿
–4 khác dấu dễ tương tác, phản ứng nhanh nên không phải đun nóng.
c) Giải thích vi trò của dd H2SO4 2M trong thí nghiệm trên.
- Ngăn ngừa quá trình thủy phân của sắt, tạo môi trường cho phản ứng.