









Preview text:
Họ và tên SV – MSSV
Tên môn thi: HÓA PHÂN TÍCH
Đỗ Ngọc Bích – 2005208328
HÌNH THỨC THI: BÀI TẬP LỚN
Đào Trọng Nguyên – 2005208343
Thời gian làm bài: Từ ngày 5 đến hết ngày 18/9 BÀI LÀM a = 3; b = 3; c = 6
Câu 1: Phương pháp chuẩn độ tạo phức
a. Biết phản ứng tạo phức giữa ion kim loại M và Y4-là phản ứng chính, M còn tham
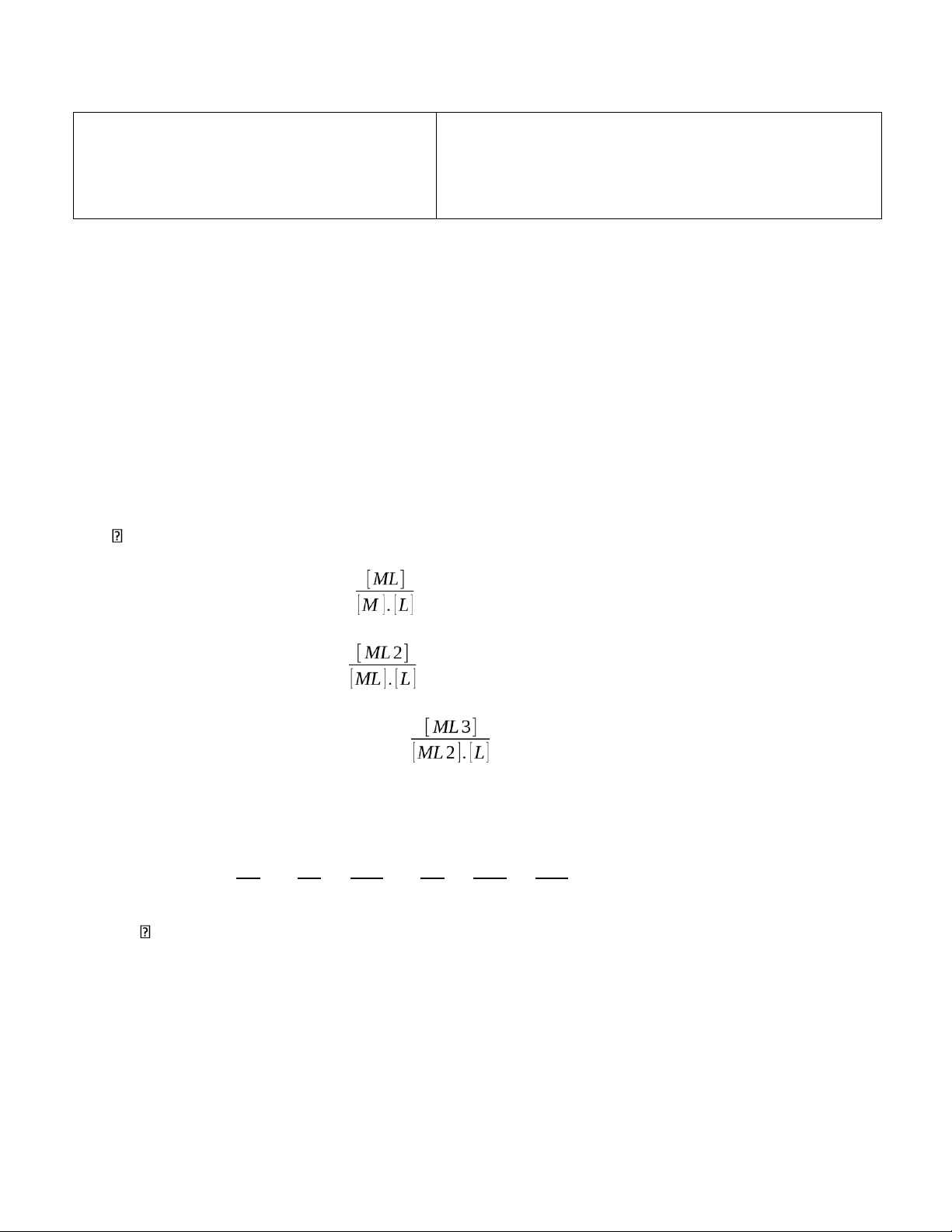
gia tạo phức ML3với L, Y4-kết hợp với H+tạo H4Y. Viết biểu thức hệ số ảnh hưởng
của L đến M (α-1M(L)) và biểu thức hệ số ảnh hưởng của H+đến Y4-(α-1Y(H+)) Mn+ + Y4- ⇌ MYn-4 M + L ⇌ ML → β1 =
ML + L ⇌ ML2 → β2 = ML2 + L ⇌ ML3 → β3 = α− 1
( M ( L)) = 1 + β1[L] + β1β2[L]2 + β1β2β3[L]3
= 1 + [ ML] + [ ML] . [ ML2] + [ ML] . [ ML2] . [ ML3] [ M ] [ M ] [ ML]
[ M ] [ ML] [ ML2 ] Y4- + H+ ⇌ HY3- → K4 = ¿¿¿ HY3- + H+ ⇌ H2Y2- → K3 = ¿¿¿ H2Y2- + H+ ⇌ H3Y- → K2 = ¿¿¿ H3Y- + H+ ⇌ H4Y →K1 = ¿¿¿ α = 1 + ¿¿ ¿¿+ ¿¿¿+¿¿¿+¿¿¿ b.
Vẽ mô hình tóm tắt điều kiện tiến hành phương pháp chuẩn độ tạo phức
(Chấtchuẩn, chất xác định, chất chỉ thị, môi trường (pH)). Trình bày ứng dụng cụ thể
của phương pháp tương ứng với mô hình trên, viết phương trình phản ứng, xác định
phản ứng chỉ thị và phản ứng chuẩn độ và dấu hiệu nhận biết điểm tương đương.
Ứng dụng: Xác định độ cứng tổng hợp trong nước cấp
• Chất xác định: mẫu nước • Chất chuẩn: EDTA • Môi trường: pH=10 • Chỉ thị: ETOO Phản ứng: Mg2+ + Ind ⇌ MgInd
H2Y2- + Ca2+ →CaY2- + 2H+
H2Y2- + Mg2+ →MgY2- +2H+
Định điểm cuối: H2Y2- + MgIndm-2 (đỏ nho) →MgY2- + Indm- (xanh) +2H+
Dung dịch chuyển từ màu đỏ nho sang xanh. c.
Có thể định lượng được ion kim loại M2+và N2+ở pH = 10 không? Biết
lgβMY=7,ab; lgβNY= 13,ab. Ảnh hưởng của OH-không đáng kể. H4Y có pKa1= 2;
pKa2= 2,67; pKa3= 6,27; pKa3= 10,95. Tóm tắt:
lgβMY = 7,33 → βMY = 107,33
lgβNY = 13,33 → βNY = 1013,33
pKa1 = 2 →Ka1 = 10-2 pKa2
= 2,67 →Ka2 = 10-2,67 pKa3 =
6,27 → Ka3 = 10-6,27 pKa4 =
10,95 →Ka4 = 10-10,95 pH=10 →[H+] = 10-10 Các cân bằng:
M2+ + Y4- ⇌ MY2- → βMY = 107,33
Y4- + H+ ⇌ HY3- →K4
HY3- + H+ ⇌ H2Y2- →K3
H2Y2- + H+ ⇌ H3Y- →K2
H3Y- + H+ ⇌ H4Y →K1
Cho nồng độ của M2+ tự do trong dung dịch là 10-1M và EDTA 10-1M α-
1Y(H) = 1 +¿¿ + ¿¿¿+¿¿¿+¿¿¿ = 1 + 100,95 = 9,91 Với kim loại M2+ β'MY
= βMY . α-1Y(H) = 108,31 (Do ảnh hưởng của OH- không đáng kể)
Gọi x là nồng độ của [M2+]’ tại thời điểm cân bằng, xét cân bằng: M2+ + Y4- ⇌ MY2- Ban đầu: 0,1 0,1 0
Phản ứng: 0,1-x 0,1-x 0,1-x Cân bằng: x x 0,1-x 0,1−x → β'MY = 2 x
Vì β' rất lớn nên [M2+]’ rất bé so với 0,1 (nồng độ muối M ban đầu) nên: 0,1 β'MY = =108,31 2
→x = 2,21.10-5 (M) x
mà [M]’ = [M] .α-1M(L) →¿M2+]’ = [M2+] = 2,21.10-5 (M) (Do OH- không ảnh hưởng )
%M còn lại sau khi tác dụng với EDTA: 2,21.10−5 %M = .100 = 0,0221% −1 10
Như vậy có thể định lượng M2+ ở pH=10 do sau phản ứng hàm lượng của M2+ còn lại
vô cùng bé, phản ứng khá hoàn toàn Với kim loại N2+ β'NY = βNY . α-1Y(H) =
1014,32 (Do ảnh hưởng của OH- không đáng kể) [N2+] = 10-7,66 (M)
%N còn lại trong dung dịch: 0,000022%
Như vậy có thể định lượng N2+
d. Xử lý 1,abc(g) mẫu đất, định mức thành 200mL (dd1), rút 10mL dd1 xác định hàm
lượng kim loại Q bằng phương pháp chuẩn độ tạo phức. Thể tích dung dịch chuẩn
EDTA 0,025 Ntiêu tốn trung bình là 12,ab mL. Biết MQ= 56g/mol.
-Tính sốmgQ/Ltrong dung dịch 1;
-Tính % khối lượng Q trong mẫu đất. N EDTA ×V EDTA×ĐQ Q (mg/l) =
×1000×f =¿17,262 Vm
Câu 2: Phương pháp chuẩn độ tạo tủa
a. Trình bày các yếu tố ảnh hưởng đến độ tan của tủa. Giải thích. Biết quá trình hòa tan là
quá trình tỏa nhiệt, vậy nếu giảm nhiệt độ của hệ, độ tan sẽ tăng hay giảm?
Có 4 yếu tố ảnh hưởng đến độ tan của tủa:
1. Ảnh hưởng của ion chung: Nếu thêm ion chung vào dung dịch bão hòa của kết tủa, tíchsố
ion sẽ lớn hơn tích số tan nên cân bằng sẽ chuyển dịch về phía tạo thêm kết tủa, do đó
làm giảm độ tan của nó.
2. Bản chất chất tan và bản chất dung môi:
Qui luật kinh nghiệm về độ tan: “Các chất có cùng tính phân cực thì hòa tan tốt vào nhau”.
Ví dụ: Khi hòa tan NaCl vào nước, quá trình hòa tan có thể chia làm 3 bước: -
Bước 1: Phá vỡ cấu trúc tinh thể của chất tan để tạo thành tiểu phân riêng biệt. -
Bước 2: Phá vỡ lực liên kết liên phân tử giữa các phân tử dung môi để tạo ra
cáckhoảng trống cho các tiểu phân của các chất tan xâm nhập. -
Bước 3: Xảy ra tương tác giữa các tiểu phân của chất tan và các phân tử của
dungmôi để tạo thành dung dịch, tức xảy ra quá trình solvat hóa.
3. Ảnh hưởng của nhiệt độ: -
Đối với những chất thu nhiệt, độ tan tăng khi nhiệt độ tăng.
Ví dụ: Độ tan của AgCl ở 100oC gấp 25 lần độ tan của nó ở 10oC. -
Đối với những chất tỏa nhiệt, độ tan giảm khi nhiệt độ tăng
Ví dụ: Độ tan của CaSO4.0,5H2O ở 60oC gấp 3 lần độ tan của nó ở 100oC
4. Kết tủa phân đoạn: Nếu trong dung dịch chứa 2 hay nhiều ion có khả năng tạo được
kếttủa với cùng một ion khác, nhưng các kết tủa hình thành có độ tan khác nhau nhiều
thì khi thêm chất tạo kết tủa với dung dịch, các kết tủa sẽ lần lượt tạo thành. Hiện tượng
hình thành lần lượt các kết tủa trong dung dịch khi cho cùng một tác nhân gây kết tủa
vào gọi là kết tủa phân đoạn.
5. Sự làm bẩn kết tủa do cộng kết: Cộng kết là hiện tượng tạp chất kết tủa đồng thời cùngvới
kết tủa chính. Nguyên nhân của hiện tượng cộng kết thường gặp nhất là hiện tượng hấp
thụ ion nào đó lên bề mặt của hạt kết tủa. Các kết tủa có cấu tạo ion thường hấp phụ đặc
biệt mạnh các ion của bản thân chúng. b.
Vẽ mô hình tóm tắt các điều kiện tiến hành phương pháp Volhard (chất chuẩn, chất
xácđịnh, chất chỉ thị, môi trường (pH), phương trình phản ứng, dấu hiệu nhận biết điểm
tương đương). Có thể tạo môi trường pH bằng H2SO4hay HCl không? Tại sao? Cần lưu ý
gì khi xác định Cl- bằng phương pháp này? Tại sao? c.
Cho dung dịch chứa đồng thời ion X-có nồng độ 0,01Mvà ion Y2-có nồng độ
0,1M.Ion nào tủa trước nếu cho từ từ dung dịch Ag+vào dung dịch trên. Tại sao? Biết
KAgX= 10-9,ab và KAg2Y = 10-12,ab. Khi ion thứ 2 bắt đầu tạo tủa thì ion thứ nhất còn lại
bao nhiêu (CM) trong dung dịch? Giải:
Cân bằng tạo kết tủa: KAgX = 10-9,33 Ag+ + X- → AgX KAg2Y = 10-12,33 Ag+ + Y2- → Ag2Y [X-] = 0,01M
Khi dung dịch đạt tới bão hòa để chuẩn bị tạo kết tủa AgX thì:
KAgX = [Ag+][X-] → [Ag+] = K AgX = 10-7,33M ¿¿
Khi dung dịch đạt tới bão hòa chuẩn bị tạo kết tủa Ag2Y thì: KAg2Y
= [Ag+]2[Y2-] → [Ag+] =
K Ag2Y = 10-11,33 M ¿¿
Khi [Ag+] = 10-11,33 thì Ag2Y đạt kết tủa. Đến khi dung dịch đạt [Ag+] = 10-7,33 thì
AgX mới kết tủa. Vậy ion Y2- kết tủa trước.
Khi trong dung dịch có đồng thời 2 cân bằng tạo tủa thì ta có đẳng thức: K AgX ¿¿
Vậy tại thời điểm AgX bắt đầu kết tủa thì ¿ = 0,01M thì [Y2-] trong dung dịch là: [Y2-] = −26,66 √ =√10
K2 Ag2Y .¿¿¿ T AgX
Vậy nồng độ [Y2-] còn lại là √10−26,66 M T AgX
d. Cân 5,abc(g) mẫu thực phẩm, tiến hành vô cơ hóa và định mức thành 100mL (dd1). Rút
10mL xác định độ mặn bằng phương pháp Volhard. Thể tích dung dịch AgNO30,05Nsử
dụng là 25mL, thể tích dung dịch KSCN 0,05N chuẩn lại lượng dư
AgNO3là 1a,bc mL. Tính độ mặn qui về %NaCl trong mẫu ban đầu và nồng độ qui về
(mg/L) NaCl trong dung dịch 1. Giải:
Ag+dư + Cl- ⇌ AgCl↓
Phản ứng chuẩn độ: Ag+dư + SCN- ⇌ AgSCN↓
Định điểm cuối: Fe3+ + SCN- = FeSCN2+
Độ mặn = %NaCl = ¿¿¿ = 6,38% Trong đó : mNaCl = 5,336g 0,05N AgNO3 25ml 0,05N KSCN 13,36ml f hàm lượng = =10
Câu 3: Phương pháp chuẩn độ oxi hóa khử
a. Viết các bán phản ứng khử của các cặp oxi hóa khử liên hợp sau.
b. Tra thế khử chuẩn Eo của các cặp oxi hóa khử liên hợp trong câu (a) và 2 phương
trìnhphản ứng có thể xảy ra giữa các cặp oxi hóa khử liên hợp trong câu (a) dựa vào thế khử chuẩn Eo.
MnO2, H+/Mn2+, H2O: MnO2 + 4H+ + 2e ⇌ Mn2+ + 2H2O E0 = +1,23 V
HClO, H+/Cl2, H2O: 2HClO + 2H+ + 2e- ⇌ Cl2 + 2H2O E0 = +1,63 V Hg2Cl2/Hg, Cl-: Hg2Cl2 + 2e- ⇌ 2Hg + 2Cl- E0 = +0,788 V
NO3-, H2O/NO2-, OH-: NO3- + H2O + 2e- ⇌ NO2- + 2OH- E0 = +0,94 V
2 phương trình phản ứng có thể xảy ra giữa các cặp oxi hóa khử liên hợp:
4HClO + MnCl2 → MnO2 + 3Cl2 + 2H2O
10HNO3 + Cl2 → HClO3 + 10NO2 + 4H2O c.
(CLO1.2) Vẽ mô hình tóm tắt các điều kiện tiến hành phương
pháppermanganate (chất chuẩn, chất xác định, chất chỉ thị, môi trường (pH), phương
trình phản ứng, dấu hiệu nhận biết điểm tương đương.
Ứng dụng của phương pháp là chuẩn độ muối mohr
MnO4- + 5Fe2+ + 8H+ → Mn2+ +5Fe3+ + 4H2O
Dấu hiệu nhận biết điểm tương đương: dung dịch xuất hiện màu tím nhạt (màu của KMnO4
dư khi đi qua khỏi điểm tương đương. d.
Cân chính xác 0,1ab (g) một mẫu đồng sunfat, hòa tan, định mức đến 100,00
mL(dd1). Hút 10 mL dd1 đem chuẩn độ bằng phương pháp iod gián tiếp thì thể tích
dung dịch Na2S2O3 0,01N tiêu tốn trung bình là 5,ab mL.
- Viết các phương trình phản ứng xảy ra
- Tính % khối lượng của CuSO4 trong mẫu ban đầu. Giải: Các phản ứng xảy ra:
Cu2+ + 3I- → CuI↓ + I2 I2 + I- →I3-
I3- + S2O32- →I- + S4O62-
Nồng độ muối đồng trong dung dịch:
N Na 2S2O 3.V Na 2S2O3.mĐmuối CuSO4 (g/l) = .1000 = 0,8528 V mẫu
→mCuSO4 = N Na2S2O3 .V Na2S2O3 .mĐmuối = 8,528.10-3g %mCuSO4 mẫu ban đầu = .100=6,41%
e. Hòa tan 0,1ab (g) dây sắt trong H2SO4 thành dung dịch FeSO4 và định mức thành
50,0mL; chuẩn độ 10,0mL dung dịch FeSO4 thu được cần 2,ab mL dung dịch KMnO4
0,100N. Viết các phương trình phản ứng xảy ra. Tính hàm lượng phần trăm sắt (Fe) trong dây sắt Giải: Các phản ứng xảy ra: Fe + H2SO4 → FeSO4
MnO4- + 5Fe2+ + 8H+ = Mn2+ + 5Fe3+ + 4H2O
Nồng độ Fe2+ trong dung dịch mẫu ban đầu là:
N KMnO 4 ×V KMnO4 ×mĐFe Fe2+(g/l) = .1000=1,3048 Vm
→mFe2+ = NKMnO4×V KMnO4×mĐFe=1,3048×10-5
%mFe mẫu ban đầu = 1,3048.10−5 .100=9.81.10-3% 0,133
Câu 4: Phương pháp phân tích khối lượng a.
Trình bày và giải thích điều kiện tạo tủa tinh thể (nồng độ thuốc thử, môi trường tạo
tủa, tốc độ tạo tủa) và cách lọc rửa tủa. Kết tủa tinh thể Kết tủa vô định hình Nồng độ
Nồng độ loãng từ 1 ÷ 5%
Dung dịch thuốc thử đặc, nóng thuốc thử nồng độ 10 ÷20% Môi trường
Dung dịch phải đun nóng 60 ÷ Dung dịch phải đun nóng 60 ÷ tạo tủa
70oC, vừa cho thuốc thử vừa 70oC, cho thuốc thử vào nhanh
khuấy đến khi có kết tủa thì dừng một lượt và khuấy đều đến khi kết
lại để yên (20 ÷ 30’ hoặc 1 ÷ 6h) để tủa thì pha loãng dung dịch bằng làm muồi kết tủa.
nước nóng để giảm sự hấp phụ tạp
chất lên bề mặt kết tủa và lọc ngay
tránh để lâu kết tủa sẽ đóng bánh
rất khó rửa sạch tạp chất. Tốc độ tạo 20 ÷ 30’ hoặc 1 ÷ 6h
Nhanh, ngay sau khi cho thuốc thử tủa
vào dung dịch và pha loãng với
chất điện ly mạnh và khuấy đều
Cách lọc rửa _ Kỹ thuật lọc rửa gạn
_ Kỹ thuật lọc rửa đồng thời _ Rửa tủa
_ Rửa bằng dung dịch thuốc thử bằng dung dịch thuốc thử loãng có
loãng và nước cất nóng
bổ sung chất điện li và
_ Rửa nhiều lần, mỗi lần với một nước cất nóng
lượng nhỏ dung dịch rửa
_ Rửa nhiều lần, mỗi lần với một
lượng nhỏ dung dịch rửa b.
Giải thích tại sao chén sấy (hoặc chén nung) dùng chứa tủa phải xử lý cùng
vớiđiều kiện xử lý tủa? Thời gian sấy (hoặc nung) bắt đầu tính từ thời điểm nào? Giai
đoạn sấy (hoặc nung) sau quá trình tạo tủa được gọi là giai đoạn gì? Sản phẩm của
giai đoạn này được xử lý bước tiếp theo là gì trước khi thực hiện phép cân? Mục đích
của bước xử lý này là gì?
Chén sấy (hoặc chén nung) dùng chứa tủa phải xử lý cùng với
điều kiện xử lý tủa vì để tránh sai số nên ta phải xử lí nó do trong mỗi chén sấy hoặc nung
sẽ có một độ ẩm nhất định.
Thời gian sấy hoặc nung bắt đầu từ thời điểm:
Thời gian: Thời điểm tính thời gian khi nhiệt độ ta cài đặt trùng với nhiệt độ hiển
thị. Thời gian nung theo lí thuyết đến khi 2 lần cân liên tiếp không lệch nhau quá ±
0,002g, thường thì nung khoảng 45’÷90’.
Giai đoạn sấy hoặc nung sau quá trình tạo tủa được gọi là giai đoạn chuyển từ dạng tủa sạng dạng cân.
Sản phẩm của giai đoạn này được xử lí bước tiếp theo trước khi thực hiện phép cân:
• Chén nung hay chén sấy phải được nung hoặc sấy dùng trong điều kiện với dạng
kết tủa, để nguộc trong bình hút ẩm rồi cân chính xác khối lượng chén m0 Không
được mở lò nung tùy tiện, chỉ được mở cửa lò nung sau khi tắt bếp 10-15’ Sau khi
sấy hoặc nung, để nguội vật chứa tủa trong bình hút ẩm rồi mới cân.
Mục đích của bước xử lí này:
• Than hóa: oxy hóa phần lớn chất hữu cơ do giấy lọc gây ra đê giảm tốc độ cháy
trong quá trình nung, tránh thất thoát mẫu.
• Tro hóa: loại trừ triệt để các thành phần hợp chất hữu cơ có trong giấy lọc, loại trừ
hết lượng nước kết tinh trong cấu trúc tinh thể. c.
Tính hệ số chuyển F trong các trường hợp sau: Dạng cân Fe2O3, dạng tính
Fe3O4;Dạng cân CaC2O4, dạng tính CaSO4; Dạng cân BaSO4, dạng tính Na2SO4; Dạng
cân Mg2P2O7, dạng tính P2O5. Dạng cân Phân tử Dạng tính Phân tử khối Hệ số chuyển F khối dạng dạng tính cân Fe2O3 160 Fe3O4 232 MFe3O4 .2 29 F = MFe2O3 .3 = 30 CaC2O4 128 CaSO4 136 MCaSO 4 F = MCaC = 2O4 1,0625 BaSO4, 233 Na2SO4 142 MNa2S O4 142 = F = MBaSO4 233 Mg2P2O7 222 P2O5 142 M P2O5 71 F = MMg = 2P2O7 111 d.
Khi thực hiện phép cân trên cân phân tích (có 4 số lẻ sau dấu phẩy), khối
lượngcân thối thiểu để không mắc sai số phép cân là bao nhiêu? Biết hàm lượng của
chất M trong mẫu là 3a%, khối lượng mẫu cần cân là bao nhiêu để khi tách chất M
ra khỏi nền mẫu ban đầu và thực hiện phép cân chất M bằng loại cân nêu trên thì
không mắc sai số phép cân?
Khi thực hiện phép cân trên cân phân tích (có 4 số lẻ sau dấu phẩy), khối lượng cân tối
thiểu để không mất sai số phép cân là ±0,001