










Preview text:
TRƯỜNG ĐẠI HỌC KIẾN TRÚC HÀ NỘI
CHƯƠNG 1: NHIỆT ĐỘNG LỰC HỌC BỘ MÔN HÓA
A. HIỆU ỨNG NHIỆT CỦA QUÁ TRÌNH MÔN HỌC
I. Khái niệm về hệ, trạng thái, quá trình: “HÓA ĐẠI CƯƠNG".
1. Hệ: Là đối tượng cần nghiên cứu, giữa hệ với môi
trường xung quanh được ngăn cách bằng một mặt Thời lượng: 2 tín chỉ thực hay tưởng tượng.
Hình thức đánh giá môn học: - Điểm quá trình: 30% Phân loại:
- Điểm thi kết thúc môn học: 70% (thi trắc nghiệm)
- Hệ hở: Có trao đổi chất và năng lượng. Tài liệu tham khảo:
- Hệ kín: Không trao đổi chất, có trao đổi năng lượng.
- Bài giảng cơ sở lí thuyết các quá trình hóa học – Trường
- Hệ cô lập: Không trao đổi chất và năng lượng. ĐHKT HN.
- Hệ đồng thể: Không có bề mặt phân chia giữa các
- Cơ sở lí thuyết các quá trình hóa học – Nhà xuất bản GD. chất. 1 3
- Hệ dị thể: Có bề mặt phân chia giữa các chất. NHIỆM VỤ CỦA SINH VIÊN
- Phải có ý thức tự học, tự nghiên cứu bài trước
2. Trạng thái: Trạng thái của hệ được xác định bởi
một tập hợp các thông số trạng thái như: Nhiệt độ, khi đến lớp.
áp suất, số mol của mỗi chất…
- Tham dự đầy đủ các buổi lên lớp, thảo luận
Các thông số trạng thái liên hệ với nhau bằng theo quy định.
các phương trình trạng thái.
Phương trình trạng thái có đặc điểm là chỉ phụ
thuộc vào trạng thái đầu và cuối của hệ, không phụ
thuộc cách thức tiến hành. 2 4 1
3. Quá trình: Là khi hệ chuyển từ trạng thái này sang III. Enthalpy: trạng thái khác.
Khi hệ chuyển từ trạng thái 1 sang trạng thái 2,
Quá trình thuận nghịch nếu nó có thể xảy ra
biến thiên nội năng của hệ:U = U2 – U1. theo 2 chiều ngược nhau.
Năng lượng này sẽ chuyển thành công hoặc
Quá trình bất thuận nghịch nếu nó chỉ có thể
thành nhiệt hoặc đồng thời cả hai. Do vậy theo định
xảy ra theo 1 chiều nhất định.
luật bảo toàn năng lượng ta có: U = A + Q
Trong hệ hóa học, A là công dãn nở. U = -PV + Q.
(Dấu trừ vì khi sinh công nội năng của hệ giảm) Q = U + PV 5 7 II. Nội năng: III. Enthalpy:
Định nghĩa: Là tổng năng lượng có sẵn trong
+) Đối với quá trình đẳng tích: V =0
hệ,bao gồm: động năng của các phân tử, năng lượng Qv = U
dao động, năng lượng quay, năng lượng liên kết hóa
Nghĩa là năng lượng nhiệt trao đổi chỉ làm thay đổi
học, năng lượng hạt nhân… nội năng của hệ. Kí hiệu: U
+) Đối với quá trình đẳng áp, có sự biến đổi về thể
Nội năng là một hàm trạng thái. tích khí: V 0
Khi hệ chuyển từ trạng thái 1 sang trạng thái 2,
Qp = U + PV = (U2 – U1) + P(V2 – V1)
thì biến thiên nội năng của hệ: Qp = (U2 + PV2) – (U1+ PV1) U = U2 – U1. Đặt H = U + PV: Entanpi Qp = H2 – H1 = H 6 8 2
IV. Hiệu ứng nhiệt của quá trình:
1) Khái niệm: Là lượng nhiệt trao đổi trong một phản ứng hóa học,
c) Nhiệt phân hủy: Là năng lượng cần thiết để phân
quy ước tính cho 1 mol chất.
hủy 1 mol chất (ở thể khí) thành các nguyên tử (ở Kí hiệu: thể khí). rH H2(k) 2H(k) rH0298 = 104,2 kcal/mol
rHo298 :Hiệu ứng nhiệt tiêu chuẩn (điều kiện xác định:
d) Nhiệt chuyển pha: là năng lượng cần cung cấp cho
Nhiệt độ 25oC (hay 298K), áp suất 1 bar (đối với chất khí), nồng độ 1 mol/L (đối
1mol chất để nó chuyển từ trạng thái tập hợp này
với chất tan trong dung dịch)).
sang trạng thái tập hợp khác. Quy ước về dấu: H
- Nếu phản ứng tỏa nhiệt: 2O(rắn) H2O(lỏng) rH0298 = 10,52 kcal/mol rH < 0
- Nếu phản ứng thu nhiệt: rH > 0
Chú ý: rH của quá trình có phụ thuộc nhiệt độ nhưng rất nhỏ, có
thể bỏ qua trong nhiều trường hợp. 9 11
2) Các loại hiệu ứng nhiệt: V. Định luật Hess:
a) Sinh nhiệt (Nhiệt tạo thành): Là hiệu ứng nhiệt của phản ứng
1) Nội dung định luật: Hiệu ứng nhiệt của một phản
tạo thành 1 mol chất nào đó từ các đơn chất bền. Kí hiệu: fH.
ứng hóa học chỉ phụ thuộc vào bản chất và trạng thái C + O2 CO2
fH0298 (CO2)= -94,05 kcal/mol
của chất phản ứng và chất sản phẩm, không phụ
Chú ý: Sinh nhiệt của các đơn chất bằng 0.
thuộc vào cách tiến hành phản ứng.
b) Thiêu nhiệt (Nhiệt cháy): Là hiệu ứng nhiệt của phản ứng đốt rH1 A B
cháy 1 mol chất bằng oxi để tạo thành các oxit bền. Kí hiệu: cH. CH rH1 = rH2 + rH3. 4 + 2O2 CO2 + 2H2O
rH0298= cH0298 (CH4) =-212,7 kcal/mol rH2 rH3 C Ví dụ: + 3/2O S 2 SO3 + O 10 2 + 1/2O2 12 SO2 3 2) Hệ quả:
Xét hệ gồm 2 chất khí lí tưởng A và B không tương
Giả sử có phản ứng: nA + mB pC + qD
tác hóa học với nhau trong một bình kín:
(n,m,p,q: Hệ số cân bằng của các chất) (1) A B A A (2) B B
a) Hệ quả 1: rHthuận = -(rHnghịch) Nhận xét: b) Hệ quả 2:
- Mức độ hỗn loạn của trạng thái (2) lớn hơn trạng
rH = (p.fHC + q.fHD) – (n.fHA + m.fHB). thái (1). c) Hệ quả 3:
- Quá trình hệ chuyển từ trạng thái (1) sang trạng
Hp.ư = (n.cHA +m. cHB) – (p.cHC + q.cHD).
thái (2) là quá trình tự diễn biến.
Như vậy trong một hệ có năng lượng không đổi,
quá trình tự diễn biến theo hướng làm tăng mức độ 13 15 hỗn loạn của hệ.
B. CHIỀU TỰ DIỄN BIẾN CỦA QUÁ TRÌNH
I. Xác suất nhiệt động học (xác suất trạng thái): II. Entropi:
Khái niệm: Là đại lượng đặc trưng cho số trạng thái
Định nghĩa: Là đại lượng đặc trưng cho mức độ hỗn vi mô của hệ. loạn của hệ. Kí hiệu: S
Một hệ có độ hỗn độn càng cao thì số trạng thái
Mối liên hệ giữa entropi và xác suất trạng thái:
vi mô càng lớn hay xác suất trạng thái càng lớn. S = R.lnW Kí hiệu: W
Đơn vị của S tùy thuộc vào đơn vị năng lương của R.
Đặc điểm: - Có giá trị rất lớn
Có thể là: J/mol.K hoặc cal/mol.K - Không có đơn vị. S = S2 – S1 = Rln(W2/W1)
Trong điều kiện năng lượng của hệ không đổi, quá
trình tự diễn biến có W2 > W1, do vậy: S > 0 14 16 4 Entropi chuẩn: So298 .
G là một hàm trạng thái:
(Điều kiện xác định: Nhiệt độ 25oC (hay 298K), áp suất 1 bar (đối G
với chất khí), nồng độ 1 mol/L (đối với chất tan trong dung dịch)).
phản ứng = n.Gchất sản phẩm – m.Gchất phản ứng.
Biến thiên Entropi của một phản ứng hóa học:
(n, m là hệ số cân bằng của các chất tương ứng) S = n.S G (s/p) - m.S(p/ư) thuận = - Gnghịch
(Trong đó: n, m là các hệ số cân bằng của các chất trong phản
Đối với quá trình tự xảy ra: G < 0. ứng hóa học).
Đối với quá trình không tự xảy ra: G > 0.
Entropi là một hàm trạng thái, phụ thuộc:
Khi hệ đạt trạng thái cân bằng: G = 0.
-Trạng thái tập hợp của các chất.
-Nhiệt độ (ảnh hưởng không đáng kể, có thể bỏ qua trong nhiều trường hợp). 17 19
III. Thế đẳng nhiệt – đẳng áp và chiều hướng của
2) Biểu thức của thế đẳng nhiệt – đẳng áp: quá trình: G = H – TS
1) Khái niệm về thế đẳng nhiệt – đẳng áp (thế đẳng áp): Gp/ư = rH – T.S
Trong hóa học và hóa lí, để xét chiều hướng tự
xảy ra của một quá trình, người ta dùng một loại thế
(năng lượng) tương tự như thế năng trong cơ học,
gọi là thế đẳng nhiệt – đẳng áp (đo ở điều kiện nhiệt
độ và áp suất không đổi). Kí hiệu: G (Thế Gip)
Thế đẳng nhiệt – đẳng áp chuẩn: Go298 18 20 5
IV. Các yếu tố ảnh hưởng đến G
3. Ảnh hưởng của thành phần các chất
1) Ảnh hưởng của nhiệt độ: G = G (T, P, n1, n2,…,nk) G = rH - T S
(n: Số mol của mỗi chất trong hệ)
(H và S có thể coi không phụ thuộc nhiệt độ)
Nếu thay đổi thành phần số mol của các chất có
a) ở nhiệt độ rất thấp: T S 0 G = rH, nên dấu
trong hệ phản ứng thì G của các chất cũng thay đổi.
của G phụ thuộc dấu của rH.
Do đó Gp/ư cũng thay đổi.
b) Ở nhiệt độ rất cao: T S >> rH dấu của G
phụ thuộc dấu của S.
c) Ở nhiệt độ không quá thấp, không quá cao, G
phụ thuộc cả vào rH và S. 21 23
CHƯƠNG 2: ĐỘNG HỌC PHẢN ỨNG
2) Ảnh hưởng của áp suất: CÂN BẰNG HÓA HỌC G = rH - T S A. ĐỘNG HỌC PHẢN ỨNG G = U + P V - T S
I. Vận tốc phản ứng: Xét phản ứng: aA + bB → cC + dD
Lấy đạo hàm riêng bậc 1 của G theo biến P: 1 C 1 C 1 C 1 C A B C D G . . . . V a t b t c t d t P Trong đó: T
v: Vận tốc trung bình của phản ứng
Đối với hệ có V =0, G không phụ thuộc áp suất.
C: Biến thiên nồng độ các chất.
Đối với hệ có V>0, P tăng thì G cũng tăng và
(Dấu (+): chất sản phẩm, (-): chất phản ứng). ngược lại.
t: Khoảng đơn vị thời gian.
Đối với hệ có V<0, P giảm thì G tăng và ngược lại. 22 24 6
II. Phản ứng đồng thể - dị thể:
2) Phân tử hoạt động - Năng lượng hoạt hóa:
1) Phản ứng đồng thể: Là phản ứng diễn ra trong
Để có va chạm hiệu quả, thì các phân tử va toàn bộ hệ.
chạm với nhau phải là phân tử hoạt động (phân tử có Ví dụ:
HCl(dd) + NaOH(dd) NaCl + H2O
động năng chuyển động nhiệt lớn hơn động năng 3H2(k) + N2(k) 2NH3.
2) Phản ứng dị thể: Là phản ứng diễn ra trên bề mặt
trung bình của các phân tử).
tiếp xúc giữa các chất tham gia phản ứng. Ví dụ:
Fe(rắn) + 2HCl(dd) FeCl2 + H2. C(rắn) + O2(k) CO2. 25 27
III. Điều kiện động học để xảy ra phản ứng:
Xét hệ có chứa 1 mol chất:
1. Va chạm và va chạm có hiệu quả:
Gọi E: Động năng trung bình của các phân tử
Muốn phản ứng giữa các chất xảy ra, thì giữa
E*: Động năng của các phân tử hoạt động.
các phân tử phải có sự tiếp xúc va chạm để phá vỡ
E* = E* - E: Năng lượng hoạt hóa
liên kết cũ và hình thành liên kết mới.
Tuy nhiên, không phải mọi va chạm nào cũng
Năng lượng hoạt hóa: Là năng lượng cần thiết
hình thành được sản phẩm mà chỉ có một số ít các va
cung cấp cho các phân tử để chuyển các phân tử từ
chạm trong số đó, số va chạm này được gọi là va
trạng thái trung bình lên trạng thái hoạt động. chạm có hiệu quả. Ví dụ: NOCl + NOCl 2NO + Cl2.
Cứ 1012 va chạm thì chỉ có 8 va chạm có hiệu quả. 26 28 7
Câu hỏi: Mối liên hệ giữa E* và vận tốc phản ứng 3) Yếu tố không gian:
theo tỉ lệ thuận hay nghịch? Tại sao?
Giữa các phân tử hoạt động, để va chạm có
Trả lời: Mối liên hệ tỉ lệ nghịch.
hiệu quả xảy ra, thì giữa các phân tử còn phải có sự
Khi E* càng nhỏ, thì quá trình chuyển các phân tử
định hướng thuận lợi về năng lượng. Yếu tố này được
lên trạng thái hoạt động càng dễ, do đó số phân tử
gọi là yếu tố không gian.
hoạt động càng nhiều số va chạm hiệu quả càng lớn vận tốc nhanh. Mức hoạt động E* E* Mức TB 29 31
IV. Các yếu tố ảnh hưởng đến vận tốc phản ứng:
Gọi N: Tổng số phân tử của hệ
1) Ảnh hưởng của nồng độ các chất phản ứng:
N*: Tổng số phân tử hoạt động Xét phản ứng: nA + mB sản phẩm
Tại một nhiệt độ xác định:
(n, m: Hệ số cân bằng của các chất trong p/ư) E v N * *
+) Đối với phản ứng đơn giản: RT e v N n m v k C . C . max A B
(Định luật phân bố Bolzmant)
(Phương trình định luật tác dụng khối lượng) Trong đó:
C: Nồng độ chất phản ứng tại thời điểm xác định v.
k:Hằng số tốc độ (phụ thuộc vào bản chất hệ phản 30 32 ứng). 8
Biểu thức của quy tắc Van Hop:
+) Đối với phản ứng phức tạp: T 2 T 1 a b v t v k C . C . 2 1 10 A B v t Trong đó: 1 2
a,b: Hệ số được xác định bằng thực nghiệm.
v1, v2: Vận tốc phản ứng ở nhiệt độ T1, T2.
C: Nồng độ chất phản ứng tại thời điểm xác định v.
t1, t2: Thời gian phản ứng ở nhiệt độ T1, T2
k:Hằng số tốc độ (phụ thuộc vào bản chất hệ phản
T = T2 – T1: Biến thiên nhiệt độ ứng).
: Hệ số nhiệt độ (nhận giá trị từ 2 4) 33 35
2) Ảnh hưởng của nhiệt độ: b) Phương trình Areniuyt:
a) Quy tắc Van-Hop (được đưa ra bằng thực nghiệm):
Từ nghiên cứu thực nghiệm:
Đối với đa số các phản ứng hóa học, trong E *
khoảng nhiệt độ không quá lớn, khi tăng nhiệt độ lên RT v A .e 0
10oC thì tốc độ phản ứng tăng từ 2 đến 4 lần.
A0: Hằng số không phụ thuộc nhiệt độ
E*: Năng lượng hoạt hóa của phản ứng Nhận xét: T: Nhiệt độ K
- Quy tắc Van Hop chỉ đúng trong một khoảng nhiệt R: Hằng số độ không quá lớn.
R = 8,314 J/(mol.K) hoặc 1,987 cal/(mol.K)
- Độ chính xác không cao.
Chú ý: Đơn vị năng lượng của E* và R phải giống nhau 34 36 9 Tại nhiệt độ T E *
3) Ảnh hưởng của chất xúc tác: 1: 1 v A . RT e (1)
a) Chất xúc tác là chất: 1 0
- Làm thay đổi tốc độ của phản ứng bằng cách tham gia Tại nhiệt độ T2: E *
vào một giai đoạn của phản ứng. 2 v A . RT e (2) 2 0
- Được phục hồi và tách ra khỏi sản phẩm.
- Không bị biến đổi về tính chất hóa học và khối lượng. 37 39
Chia (2) cho (1) và biến đổi ta được:
b) Phân loại chất xúc tác: v E * 1 1
+) Xúc tác đồng thể: Chất xúc tác và chất tham gia 2 ln v R T T 1 2 1
phản ứng ở cùng trạng thái tập hợp (lỏng, khí). Phản (Phương trình Areniuyt)
ứng xảy ra trong toàn bộ thể tích của hệ phản ứng.
Lưu ý: Khi thay số tính toán, giá trị của R thay vào
phải cùng với đơn vị năng lượng của E*.
+) Xúc tác dị thể: Chất xúc tác và chất tham gia
phản ứng không cùng trạng thái tập hợp. Phản ứng
xảy ra trên bề mặt của chất xúc tác. 38 40 10
c) Đặc điểm của chất xúc tác: B. CÂN BẰNG HÓA HỌC - Có tính chọn lọc.
I. Phản ứng thuận nghịch:
Là phản ứng có thể xảy ra theo 2 chiều ngược nhau.
- Không có khả năng làm đổi chiều phản ứng. Ví dụ: N2 +3H2 2NH3
Đặc điểm: Hiệu suất phản ứng luôn nhỏ hơn 100%. d) Cơ chế xúc tác:
Tác dụng làm tăng tốc độ phản ứng của chất xúc
II. Trạng thái cân bằng hóa học:
tác là do đã làm giảm năng lượng hoạt hóa của
Định nghĩa: Là trạng thái mà tại đó phản ứng vẫn hệ.
diễn ra nhưng với tốc độ phản ứng thuận bằng tốc độ
phản ứng nghịch, khi đó nồng độ các chất trong hệ
phản ứng là không đổi. 41 43
Ở trạng thái cân bằng: (T, P, C)=hằng số. A + B C E1* (E1* > E A + B Xúc tác K C E 2*)
Do vậy, tại trạng thái cân bằng của mỗi hệ phản ứng 2*
đều có một hằng số đặc trưng riêng gọi là “hằng số A + K AK
EAK* (E2*= EAK *+EC*) cân bằng hóa học”. AK + B C + K EC*
III. Phương trình đẳng nhiệt Van Hop: E* G = H – TS = U + PV – TS E1* / G G V P E P AK* EC* Xét 1 mol khí lí tưởng: A+B C RT V P 42 44 11 Khi cân bằng: G = 0 / G RT G P P P G0 RT ln KP Trong đó: 1 P 1 P RT dG dP d P . c P P D(cb) C (cb) K 2 P 2 P p a b P P .P A(cb) B(cb) 2 (G G ) RT ln 2 P 1 P P1
Kp: hằng số cân bằng tính theo áp suất riêng phần Đặt P1=1atm GP1 = G0.
P(cb): Áp suất riêng phần ở trạng thái cân bằng. G = G0 + RTln P 45 47
Xét phản ứng tổng quát: aA + bB dD + cC
Phương trình đẳng nhiệt Van Hop:
G (dG cG ) (aG bG ) d P . c P D C D c A B G RT ln K RT ln p a P . b P A B 0 0 G d(G RT ln P ) ( c G RT ln P ) D D C C d C . c C Hoặc: G
RT ln K RT ln D C 0 0 ( a G RT ln P ) ( b G RT ln P ) c a C . b C A B A A B B d c d C C (hằng số cân bằng tính D . C P . c P Trong đó: 0 0 0 0 K G
(dG cG aG bG ) RT ln D C C a b theo nồng độ) D C A B C C A . B a P . b P A B
[C]: Nồng độ chất ở trạng thái cân bằng. d P . c P
Lưu ý: Bỏ qua sự có mặt của chất rắn và chất lỏng 0 G G RT ln D C a b 46 P .P 48 trong hệ chất khí. A B 12
Xét phản ứng tổng quát: aA + bB dD + cC
+) Chứng minh mối liên hệ giữa Kp và T: 0 0 0 d G RT ln K H T . S (1) P . c P C C 1 P 1 1 D d . C c D(cb) C (cb) K K 0 0 0 p (2) a G RT ln K H T . S P . b P C C C 2 P 2 2 A a . B b A(cb) B(cb)
Chia cả 2 vế của (1) và (2) cho - RT tương ứng:
Kp: Hằng số cân bằng tính theo áp suất K 0 0 0 0
c: Hằng số cân bằng tính theo nồng độ) H S riêng phần H S
[C]: Nồng độ chất ở trạng thái cân bằng. ln K ln K P P P 1 2
(cb): Áp suất riêng phần ở trạng thái cân RT R RT R 1 2 bằng. (1’) (2’)
Lưu ý: Bỏ qua sự có mặt của chất rắn và chất lỏng trong hệ chất khí.
Lấy (2’) – (1’) ta được: Kp H 1 1 2 ln 49 51 Kp R T T 1 2 1
+) Chứng minh mối liên hệ giữa Kp và Kc: +) Mối liên hệ giữa K d e p và T: P . P D ( cb ) E ( cb K ) p a b (1) Kp H 1 1 P . P 2 ln A ( cb ) B ( cb ) Kp R T T 1 2 1 n Ta có: PV nRT P RT CRT (2) K V
p1,Kp2: Hằng số cân bằng ở nhiệt độ T1, T2 T1, T2: Nhiệt độ K d e (C .RT ) .(C .RT )
H: Hiệu ứng nhiệt của phản ứng Thay (2) vào (1) ta được: D E K p a b (C .RT ) .(C .RT )
R = 8,314 J/mol.K (hoặc 1,987 cal/mol.K) A B +) Mối liên hệ giữa K d e c và Kp: C C D . E (ed )(ab) K (RT) P n a b K K .(RT ) C C A . B P C (d e)(ab) 50
Trong đó: n: Biến thiên số mol khí 52 K K .(RT ) P C 13
IV. Sự chuyển dịch cân bằng hóa học:
1) Định nghĩa: Là sự chuyển dịch từ trạng thái cân
V. Các yếu tố ảnh hưởng đến cân bằng hóa học:
1) Ảnh hưởng của nhiệt độ:
bằng cũ sang trạng thái cân bằng mới khi thay đổi G = H – T.S (*)
một trong các thông số trạng thái là: T, P hoặc C.
Ở trạng thái cân bằng: H = T.S S = H/T
Lấy đạo hàm (*) theo T ta có:
2) Nguyên lí chuyển dịch cân bằng Le Chatelier: G H
Trong một hệ đang ở trạng thái cân bằng, nếu S T T
ta thay đổi một trong các điều kiện cân bằng (T,P,C), P,C
thì cân bằng sẽ chuyển dịch theo chiều chống lại sự
thay đổi đó cho tới khi hệ đạt đến một trạng thái cân 53 bằng mới. 55
+) Nếu quá trình thuận là tỏa nhiệt H <0: Cho phản ứng: A
Khi đó hàm G đồng biến với nhiệt độ.
(k) + 3B(r) 2C(k) (rH <0)
Do vậy khi giảm nhiệt độ G <0 cân bằng
Hỏi phản ứng trên chuyển dịch theo chiều nào, nếu:
chuyển dịch theo chiều thuận là chiều tỏa nhiệt - Tăng nhiệt độ?
làm tăng nhiệt độ hệ phản ứng lên. - Giảm áp suất?
(Tương tự với trường hợp khi tăng nhiệt độ)
- Tăng nồng độ của A lên 2 lần?
+) Nếu quá trình thuận là thu nhiệt H >0:
Khi đó hàm G nghịch biến với nhiệt độ.
Do vậy khi giảm nhiệt độ G >0 cân bằng
chuyển dịch theo chiều nghịch là chiều tỏa nhiệt
làm tăng nhiệt độ hệ phản ứng lên. 54 56
(Tương tự với trường hợp khi tăng nhiệt độ) 14 Chương 3: DUNG DỊCH
2) Ảnh hưởng của áp suất:
A. ĐẠI CƯƠNG VỀ DUNG DịCH G = H – T.S I. Hệ phân tán: G = U + P.V –T.S
1. Khái niệm: Hệ phân tán là hệ gồm 2 hay
Lấy đạo hàm theo P ta được:
nhiều chất được phân bố trộn lẫn đều vào nhau. G LOẠI HỆ VÍ DỤ V Khí - Khí Không khí P T ,C Khí – Lỏng Khí trong nước
+) Nếu V = 0 thì P không ảnh hưởng đến G Khí – Rắn H2 trên điện cực Pt Lỏng – Lỏng Xăng Lỏng – Rắn Đất trong nước Rắn – Rắn Hợp kim của Fe 57
+) Nếu quá trình thuận làm tăng số mol khí (V Môi trường phân tán
>0).Khi đó hàm G đồng biến với áp suất: Hệ phân tán gồm:
Khi tăng P G>0 cân bằng chuyển dịch Chất phân tán
theo chiều nghịch (giảm số mol khí) giảm P.
- Môi trường phân tán (MTPT): Là chất quyết định
Khi giảm P G<0 cân bằng chuyển dịch
theo chiều thuận (tăng số mol khí) tăng P.
trạng thái tập hợp của hệ hoặc là chất chiếm
phần khối lượng lớn hơn.
+) Nếu quá trình thuận làm giảm số mol khí (V
- Chất phân tán (CPT): Là các chất còn lại.
<0). Khi đó hàm G nghịch biến với áp suất : (Làm tương tự như trên) 58 Slide 60 of 48 15 II. Dung dịch: Ví dụ:
1. Khái niệm: Dung dịch là hệ một pha nhiều cấu
- Dung dịch NaOH có MTPT là nước, CPT là NaOH.
tử mà thành phần của nó có thể biến đổi trong
- Không khí có MTPT là N2, CPT là các khí như:
một giới hạn nhất định. O2, H2, CO2…
2. Các loại dung dịch: Tùy thuộc vào trạng thái
- Thép có MTPT là Fe, CPT là C. tập hơp chia ra 3 loại:
+ Dung dịch khí : Ví dụ như không khí
+ Dung dịch rắn: ví dụ như các hợp kim
+Dung dịch lỏng: phổ biến nhất, ví dụ như dung Slide 61 of 48
dịch các axit, bazơ, muối…
2. Phân loại hệ phân tán
3. CÁC CÁCH BIỂU DIỄN THÀNH PHẦN DUNG DỊCH
Dựa vào kích thước các hạt người ta chia
a. Nồng độ % khối lượng (C%) :Là số gam thành:
chất tan trong 100g dung dịch. -
Hệ thô: CPT > 10-5 cm. m - Hệ keo: 10-7 cm< ct CPT < 10-5 cm. C% .100% m -
Hệ dung dịch thật: CPT < 10-7 cm. dd
Trong hệ dung dịch thật gọi: (mdd = mdm + mct)
MTPT = dung môi; CPT = chất tan.
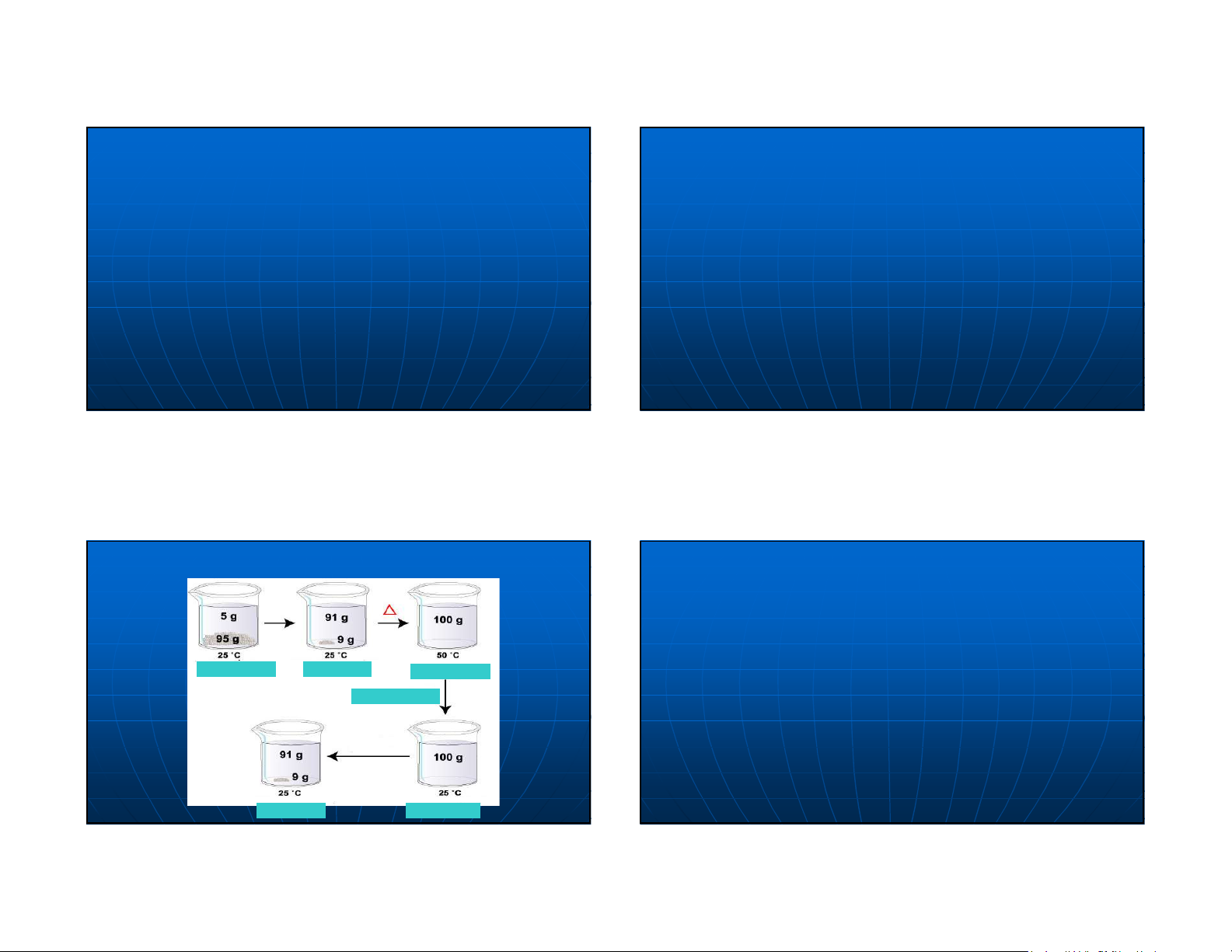
Ví dụ : Cần bao nhiêu gam tinh thể NaOH (độ
tinh khiết P=97%) để pha thành 2000g dung dịch NaOH 5%. 16
b.Nồng độ mol (CM): Là số mol chất tan có trong 1 lít dung dịch.
d. Nồng độ molan ( Cmolan ): Là số mol
chất tan có trong 1000 gam dung môi n n: Số mol chất tan C n m n = m C 1 . 000 ct 1 . 000 M V ct/M molan
V: Thể tích dung dịch (lít). m M.m dm dm
Ví dụ 1 : Cần bao nhiêu gam tinh thể NaOH
Ví dụ: Hòa tan 8 gam NaOH vào nước thu được
(độ tinh khiết 97%) để pha thành 1 lít dung
100 gam dung dịch (d = 1,1g/ml). dịch NaOH 1M.
Hãy tính: C%, CM, CN, Cmolan của dung dịch
Ví dụ 2 : Cho dung dịch KMnO4 0,2 M, khi trên?
pha loãng 0.1 l dung dịch trên thành 0,5 l, (Na = 23, O =16, H =1)
cho biết nồng độ dung dịch KMnO4 mới?
c. Nồng độ đương lượng (CN):
Là số đương lượng gam chất tan có trong
e. Nồng độ phần mol ( phân số mol)
1 lít dung dịch. (đơn vị=đlg/l) () hoặc Ni : N N: Số đương lượng gam. C N = m
Là tỉ số giữa số mol của chất đó chia cho N ct/D V
V: Thể tích dung dịch (lít).
tổng số mol các chất có trong dung dịch
Câu hỏi: Thiết lập mối liên hệ giữa CM và CN ? (kể cả dung môi).
Ví dụ : Cần bao nhiêu gam tinh thể n Ca(OH) i 2
(độ tinh khiết 100%) để pha i k
thành 2 lít dung dịch Ca(OH) n 2 1N. k 1 17
III. Quá trình hòa tan một chất vào dung IV. ĐỘ TAN Hòa tan môi lỏng: 1. Khái niệm: Chất rắn Chất tan Gồm 2 giai đoạn: (dd) Kết tinh
+) Giai đoạn phá vỡ cấu trúc của chất tan (đặc Bão hòa
biệt là của chất rắn) để tạo thành phân tử,
nguyên tử hay ion. Đây là quá trình vật lí, có Hpha >0 (thu nhiệt).
+) Giai đoạn kết hợp các phần tử của chất tan
với các phân tử của dung môi (quá trình solvat
Dung dịch ở trạng thái khi quá trình hòa tan và kết
hóa). Đây là quá trình hóa học, có H
tinh đạt cân bằng gọi là dung dịch bão hòa sol <0 (tỏa nhiệt). 69
Hhòa tan = Hpha + Hsol.
Nồng độ của chất tan trong dung dịch H
bão hòa ở những điều kiện xác định
hòa tan của chất rắn, lỏng > 0 (thu nhiệt).
được gọi là độ tan của chất đó
Hhòa tan của chất khí < 0 (tỏa nhiệt).
Thông thường những chất có độ tan trong nước:
Câu hỏi: Hãy giải thích tại sao Hhòa tan của chất
+) Trên 10g/100g nước là chất dễ tan.
khí lại là quá trình tỏa nhiệt?
+) Dưới 1 g/100 g nước là chất khó tan.
+) Dưới 0,1 g /100g nước coi như không tan. 70 18
2. Dung dịch chưa bão hòa và quá bão hòa:
3. Các yếu tố ảnh hưởng đến độ tan:
a. Ảnh hưởng của bản chất chất tan và dung
Dung dịch có lượng chất tan thấp hơn lượng chất môi:
tan chứa trong dung dịch bão hòa gọi dung dịch Quy luật chung:
chưa bão hòa, còn dung dịch chứa chất tan lớn
Chất tan phân cực tan tốt trong dung môi phân cực.
hơn lượng chất tan trong dung dịch bão hòa gọi
Chất tan không cực tan tốt trong dung môi không cực.
là dung dịch quá bão hòa.
Ví dụ: Rượu tan tốt trong nước Dầu không tan trong nước
Iot tan ít trong nước, tan tốt trong benzen. Dung dịch quá bão hòa
b) Ảnh hưởng của nhiệt độ: -
Khi nhiệt độ tăng: độ tan của chất rắn, lỏng
tăng; độ tan của chất khí giảm. -
Khi nhiệt độ giảm: độ tan của chất rắn, lỏng chưa bão hòa Bão hòa chưa bão hòa
giảm; độ tan của chất khí tăng. Làm lạnh chậm
Hãy giải thích tại sao? bão hòa Quá bão hòa 19
3. Ảnh hưởng của áp suất tới độ tan của chất khí:
Lượng hơi trên bề mặt chất lỏng khi trạng thái
Định luật Henry: Ở nhiệt độ không đổi, độ tan
cân bằng LỎNG – HƠI được thiết lập được gọi là
của chất khí tỷ lệ thuận với áp suất khí. lượng hơi bão hòa. Định luật Dalton: Độ tan của chất khí
Áp suất do lượng hơi bão hòa của dung môi gây vào chất lỏng tỉ lệ
ra trên bề mặt chất lỏng gọi là áp suất hơi bão thuận với áp suất riêng phần của khí hòa. đó C = k Pkhí (C là nồng độ khí trong dd bão hòa,k là hằng số. P là áp suất riêng phần) 79
B. Tính chất của dung dịch phân tử (chứa
chất tan không điện li, không bay hơi).
I. Áp suất hơi bão hòa của dung dịch:
Câu hỏi: So sánh Pb/h của dung môi nguyên chất
và Pb/h của hệ dung dịch chứa chất tan? Pb/h(dm) > Pb/h(dd) : Bay hơi
Giải thích: Do trong dung dịch có các phân tử chất : Ngưng tụ
tan kết hợp với các phân tử dung môi ở dạng solvat
hóa, do vậy cản trở quá trình bay hơi của dung môi, Bay hơi (H>0)
nên lượng hơi dung môi trên bề mặt dung dịch ít hơn Lỏng Hơi → Pb/h nhỏ hơn. Ngưng tụ (H<0) 80 20



