










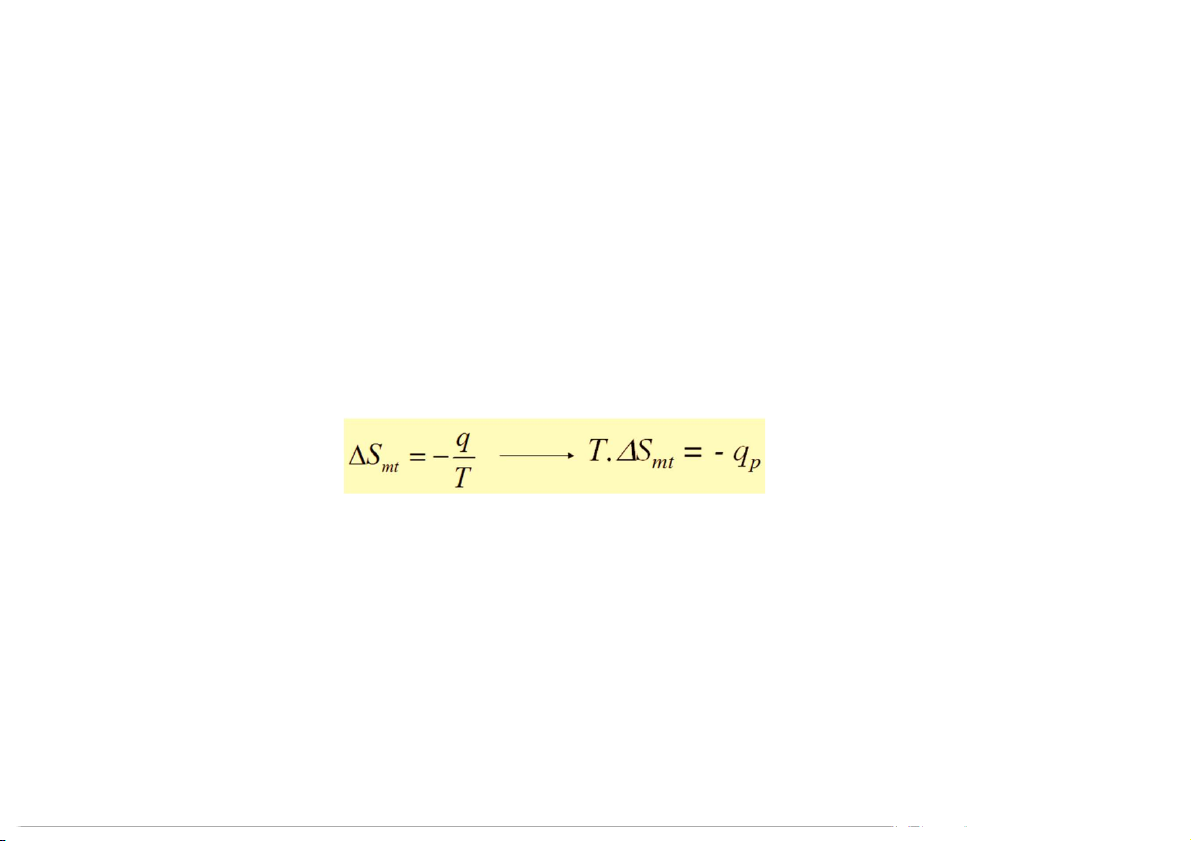








Preview text:
CHƯƠNG 2
1. Biến đổi tự xảy ra. Độ mất trật tự của hệ. NGUYÊN LÝ II
Khái niệm về Entropy (S).
2. Entropy và Nguyên lý II NĐLH.
NHIỆT ĐỘNG LỰC HÓA HỌC 3. Biến đổi entropy của phản ứng.
4. Hàm năng lượng tự do Gibbs (G). 1
1. Biến đổi tự xảy ra Xét hệ sau: (1) U (2) 1 Zn + dd CuSO Cu + dd ZnSO 4 4 X U2
Xét một số quá trình tự xảy ra ở nhiệt độ phòng: Du D n u g n dị d ch c Ion Io n hydr d at thó h a ó Ti T nh n h th t ể h ể ion o 2
1. Biến đổi tự xảy ra
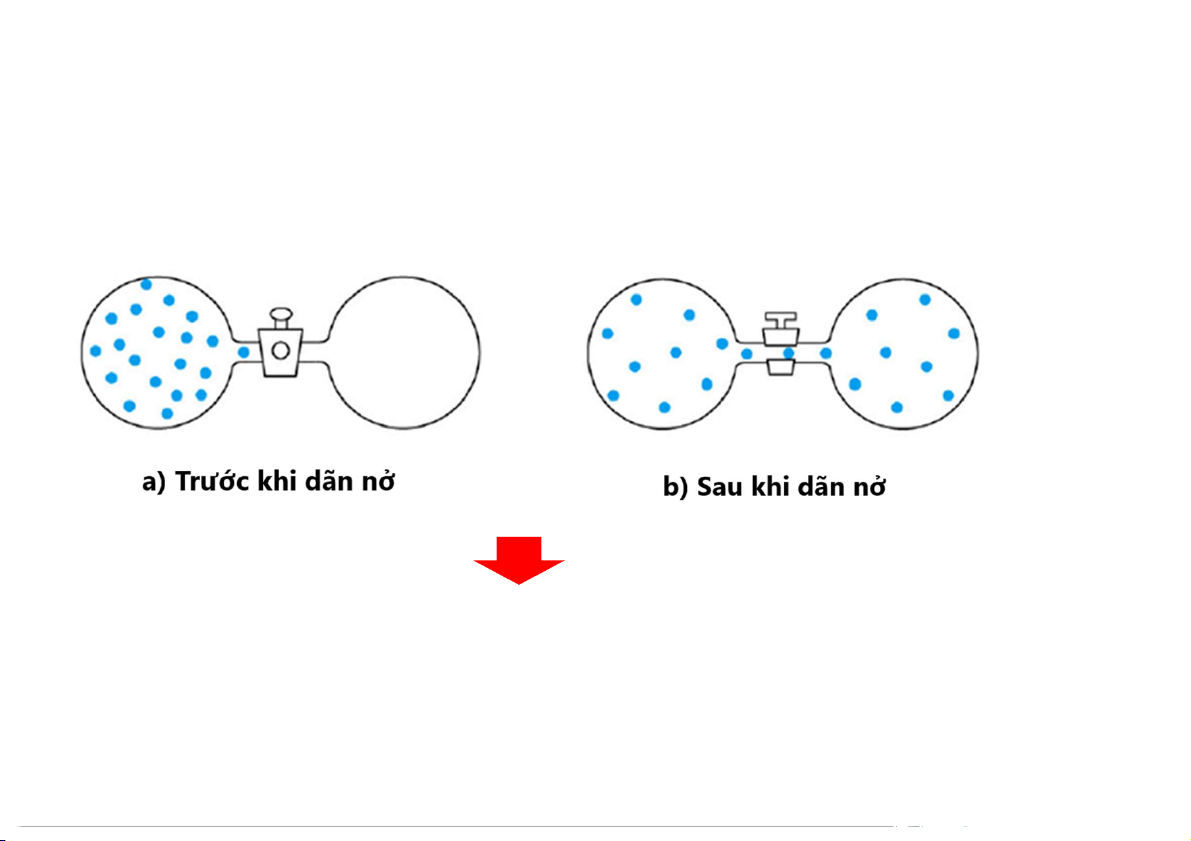
Vi trạng thái (Microstate) và Entropy, S
Ví dụ: dự đoán các trạng thái tồn tại của 4 quả cầu khí trong 2 bình sau khi van được mở 4 và 0 = 2 microstates
Độ trật tự cao → giảm Entropy 3 và 1 = 8 microstates
Độ trật tự thấp → tăng Entropy 2 và 2 = 12 microstates Total microstates = 22 3
1. Biến đổi tự xảy ra Entropy, S
Quá trình hay phản ứng hóa học tự xảy ra là
biến đổi trong đó có sự tăng độ mất trật tự.
Entropy, S – thước đo độ mất trật tự của hệ. S = k.lnW
W (số vi trạng thái - mul plicity): số
cách sắp xếp của các microstate của
hệ tại một trạng thái nào đó. k: hằng số Boltzmann k = R/NA = 1,38.10-23 J/K.mol
1. Biến đổi tự xảy ra S = k.lnW Entropy, S
Ví dụ: Tính entropy của 1 mol chất tinh thể phân tử:
Nếu phân tử chỉ có một cách định hướng duy nhất: W = 1 S = 0
Nếu mỗi phân tử có thể định hướng theo 1 trong hai cách, thì đối với 1 mol chất (tức 6,02.1022 phân tử) sẽ có
cách sắp xếp khác nhau của các phân tử. Hay 22 6,0 . 2 10 W 2 S 3 , 1 8 1 . 02 .3 22 ln 26,02 1.0 S 3 , 1 8 0 , 6 . 2 1 . 0 .1ln 2 5 , 0 73 J / mol.K 5
1. Biến đổi tự xảy ra Entropy, S Tự xảy ra
Độ mất trật tự tăng, S > 0 6
1. Biến đổi tự xảy ra Entropy, S
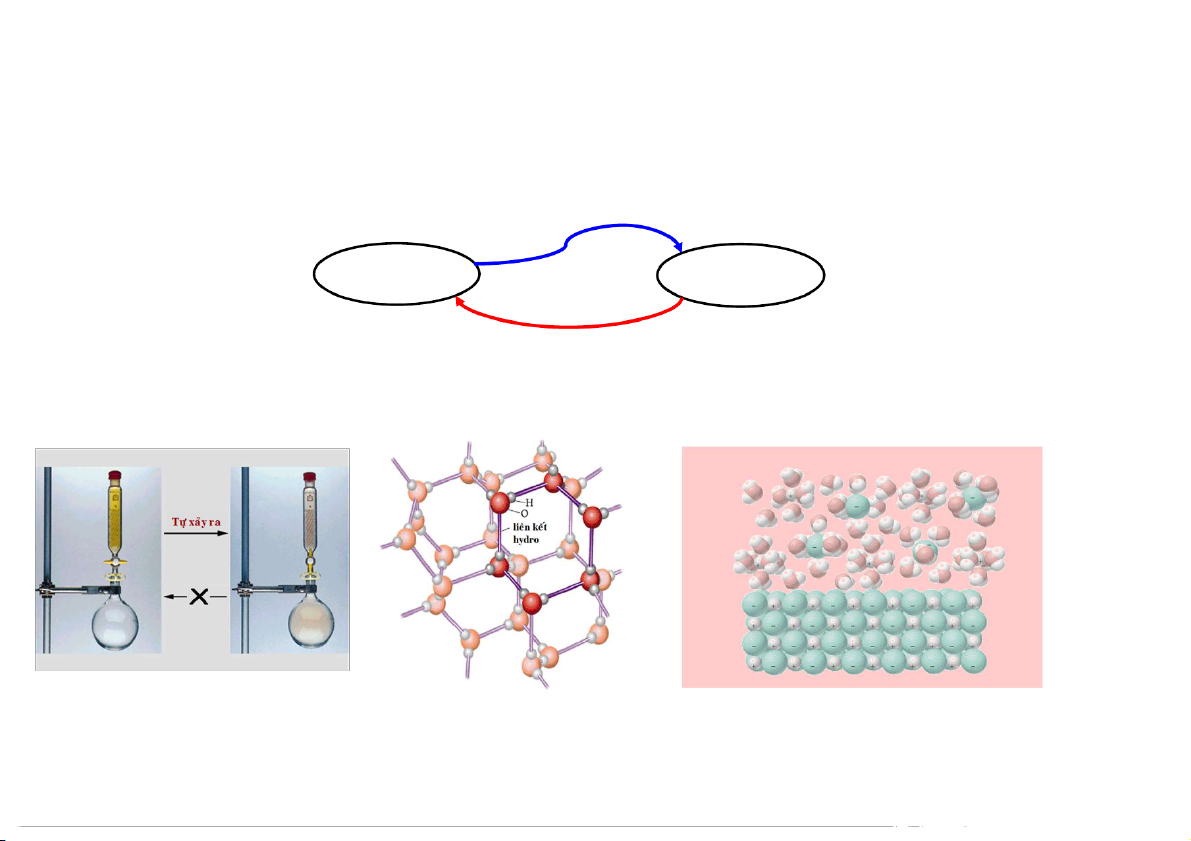
Quá trình hòa tan: H O 2
Khi một hợp chất ion tan vào nước sẽ có 2 Ion Io n hydr d at thó h a ó
quá trình xảy ra đồng thời: Tinh thể bị phá vỡ entropy tăng
Các ion tác dụng với các phân tử nước Hợp H ợp ch c ấ h t ấ tion o (hydrat hóa) entropy giảm
Thông thường, nếu một quá trình tăng entropy đi kèm một quá trình giảm entropy thì
quá trình tăng entropy sẽ trội hơn. 7
2. Entropy và nguyên lý II NĐLH
Biến thiên Entropy (∆S) đo nh không thuận nghịch của quá trình trong hệ cô lập và đặc
trưng cho chiều diễn biến của quá trình.
Trong điều kiện hệ không trao đổi năng lượng (hệ cô lập): hệ có khuynh hướng chuyển từ
trạng thái có độ tự do thấp sang trạng thái có độ tự do cao hơn một cách tự nhiên.
Hệ cô lập (vũ trụ) = (hệ thống + mtxq)
Entropy là một hàm trạng thái
Biến thiên entropy phụ thuộc vào lượng nhiệt trao đổi và nhiệt độ của hệ
S > 0 : độ mất trật tự tăng
S < 0 : độ mất trật tự giảm 8
2. Entropy và nguyên lý II NĐLH
Biến đổi thuận nghịch, đẳng nhiệt q
là năng lượng cung cấp thuận tn nghịch cho hệ thống.
Ở T không đổi: biến thiên entropy tỉ
lệ thuận với năng lượng cung cấp qtn vào hệ thống. S qtn 9
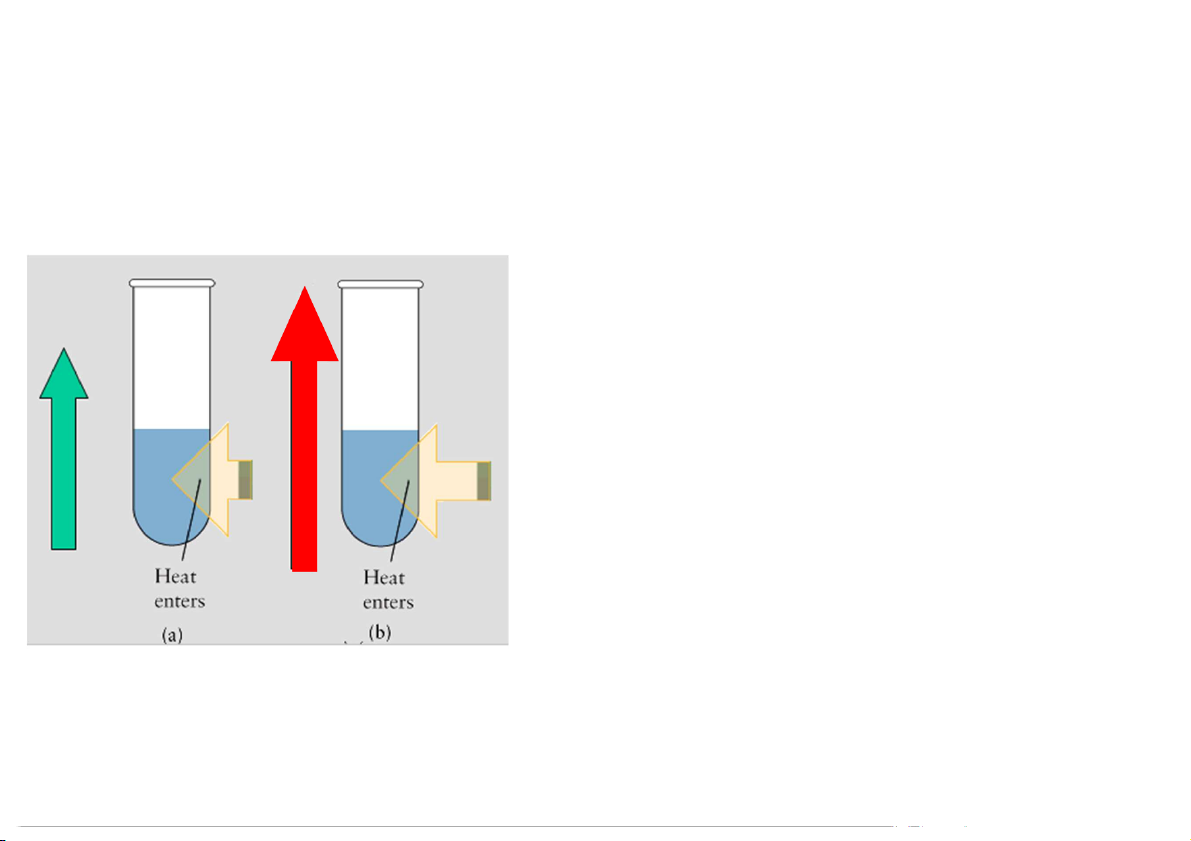
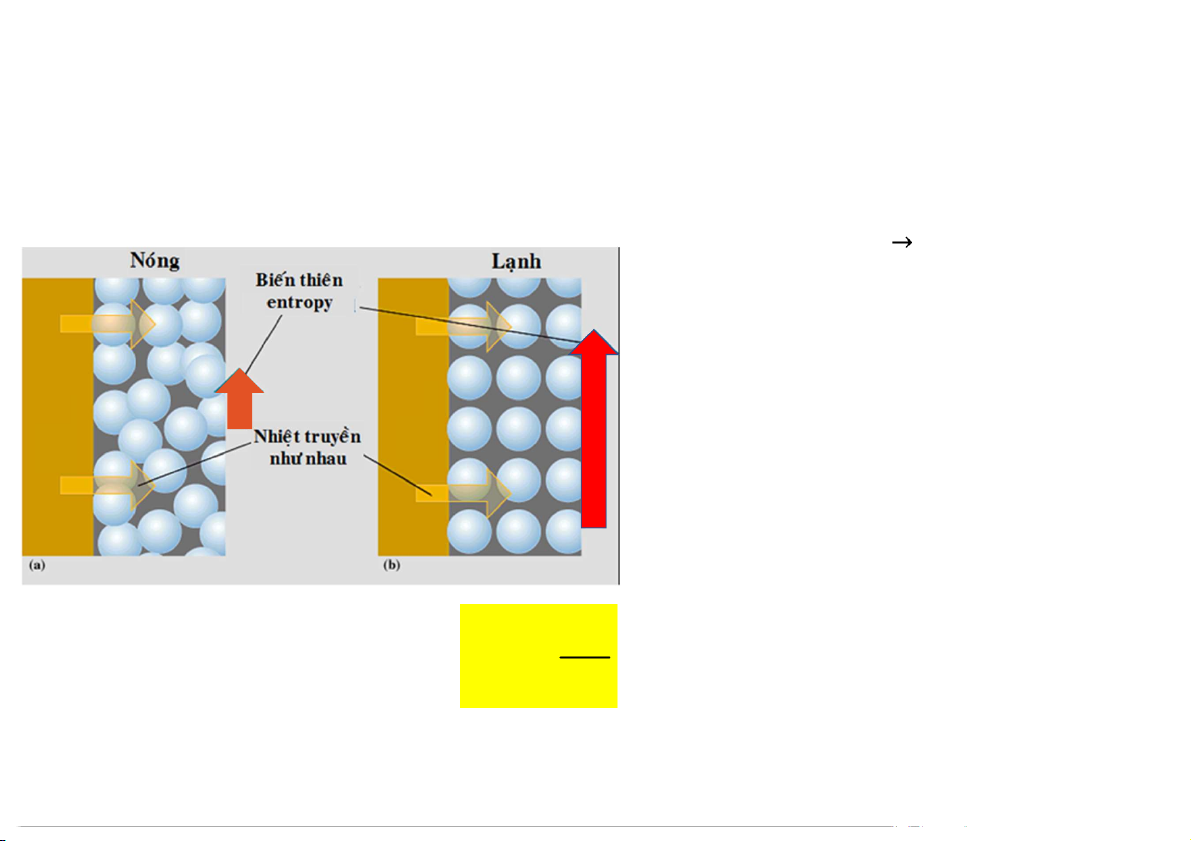
2. Entropy và nguyên lý II NĐLH
Biến đổi thuận nghịch, đẳng nhiệt Nhiệt độ càng cao độ mất trật tự càng lớn
Nếu hệ đang ở T cao thì độ mất
trật tự thay đổi ít hơn so với hệ
có T thấp khi nhận năng lượng (q ) tn
Biến thiên entropy tỉ lệ nghịch với nhiệt độ q S tn T 10
2. Entropy và nguyên lý II NĐLH
Biến đổi thuận nghịch, đẳng nhiệt 11
2. Entropy và nguyên lý II NĐLH
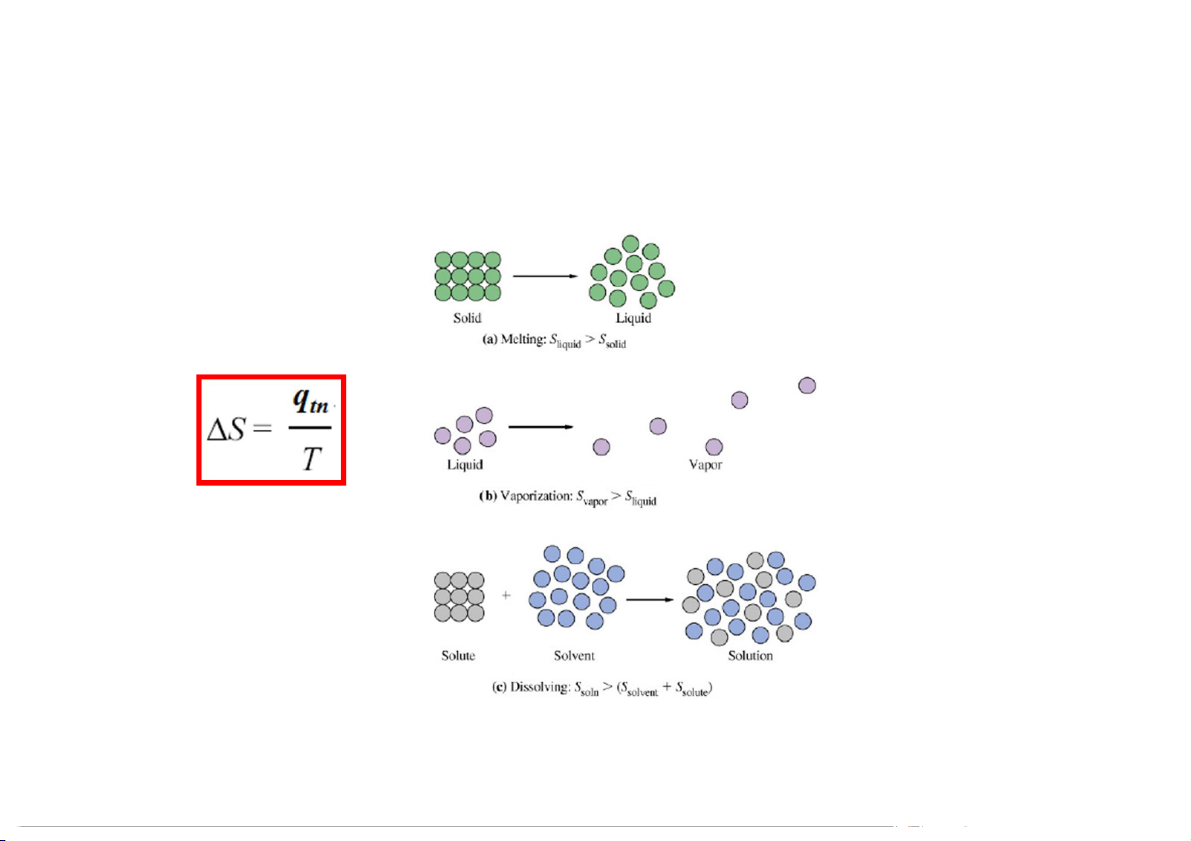
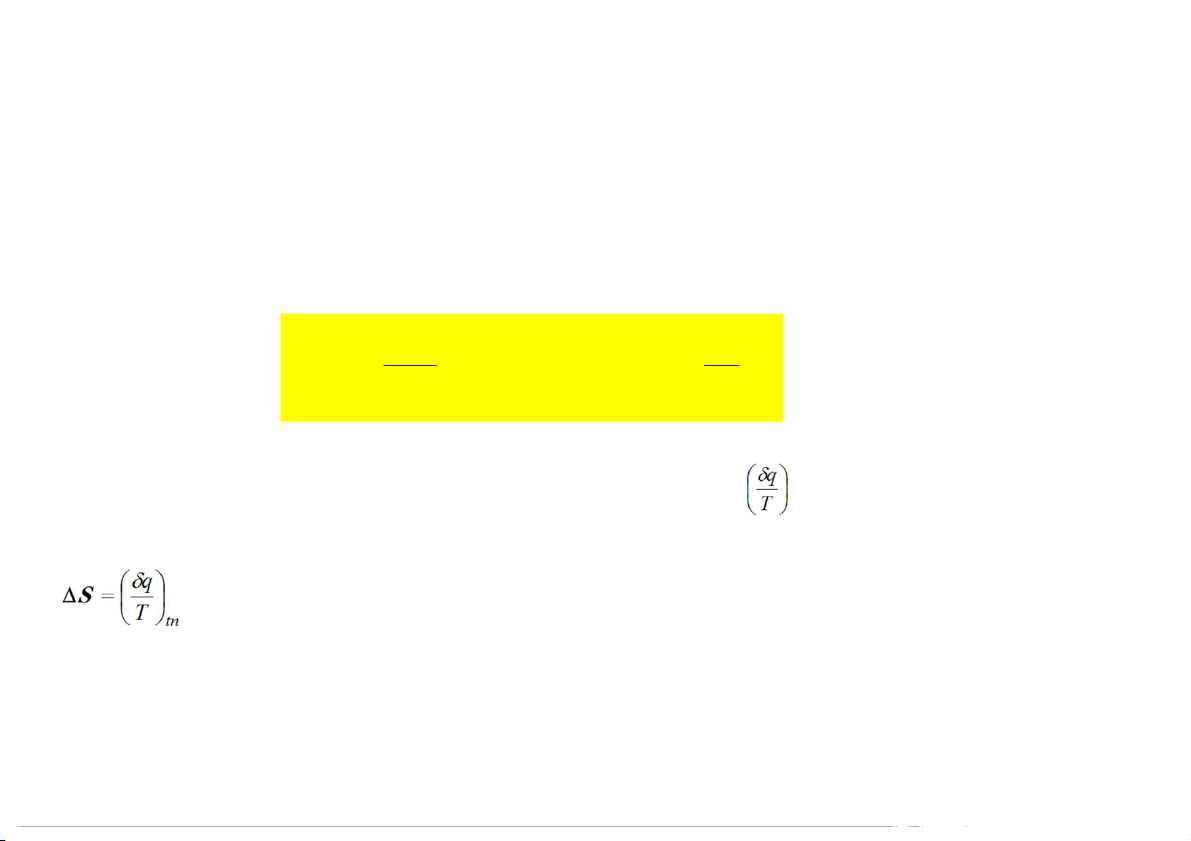
Biến thiên Entropy của quá trình thuận nghịch
Biến thiên entropy được định nghĩa từ biểu thức toán học (Clausius – 1851): (2) q q S tn hay dS T T ) 1 ( tn
S là hàm trạng thái, S không phụ thuộc vào đường đi, nhưng thì phụ thuộc vào cách thức ến hành quá trình
khi biến đổi được ến hành một cách thuận nghịch 12
2. Entropy và nguyên lý II NĐLH
Biến thiên Entropy của quá trình thuận nghịch
Biến đổi chuyển pha:
Quá trình trao đổi nhiệt có thể trao đổi thuận nghịch
Ví dụ: hiện tượng tan chảy cũng như đóng rắn của nước đá 13
2. Entropy và nguyên lý II NĐLH
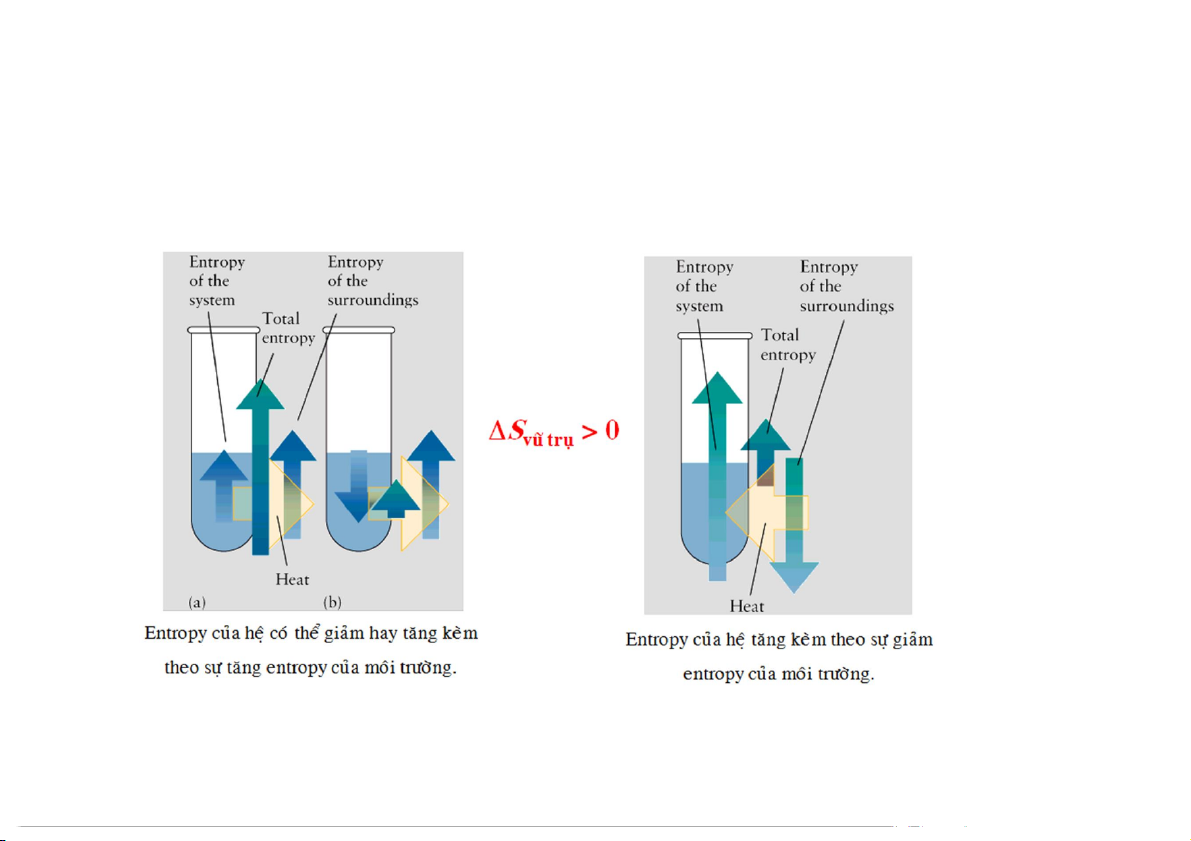
Nguyên lý II của NĐLH
Trong quá trình thuận nghịch, entropy của vũ trụ không đổi (Svũ trụ = 0).
Trong quá trình bất thuận nghịch, entropy của vũ trụ tăng lên: Svũ trụ = S – S cuối đầu
Mỗi quá trình tự xảy ra đều làm tăng entropy của vũ trụ Sv = + > vũ v = = S + + S > 0 0 vũ v ũ trụ t rụ Shệ h ệ Smtxq x q
Với một biến đổi được xác định từ trạng thái 1 2. Ta có: (2) S S S q tn ( ) 2 ) 1 ( T)1( 14
2. Entropy và nguyên lý II NĐLH
Nguyên lý II của NĐLH 15
2. Entropy và nguyên lý II NĐLH
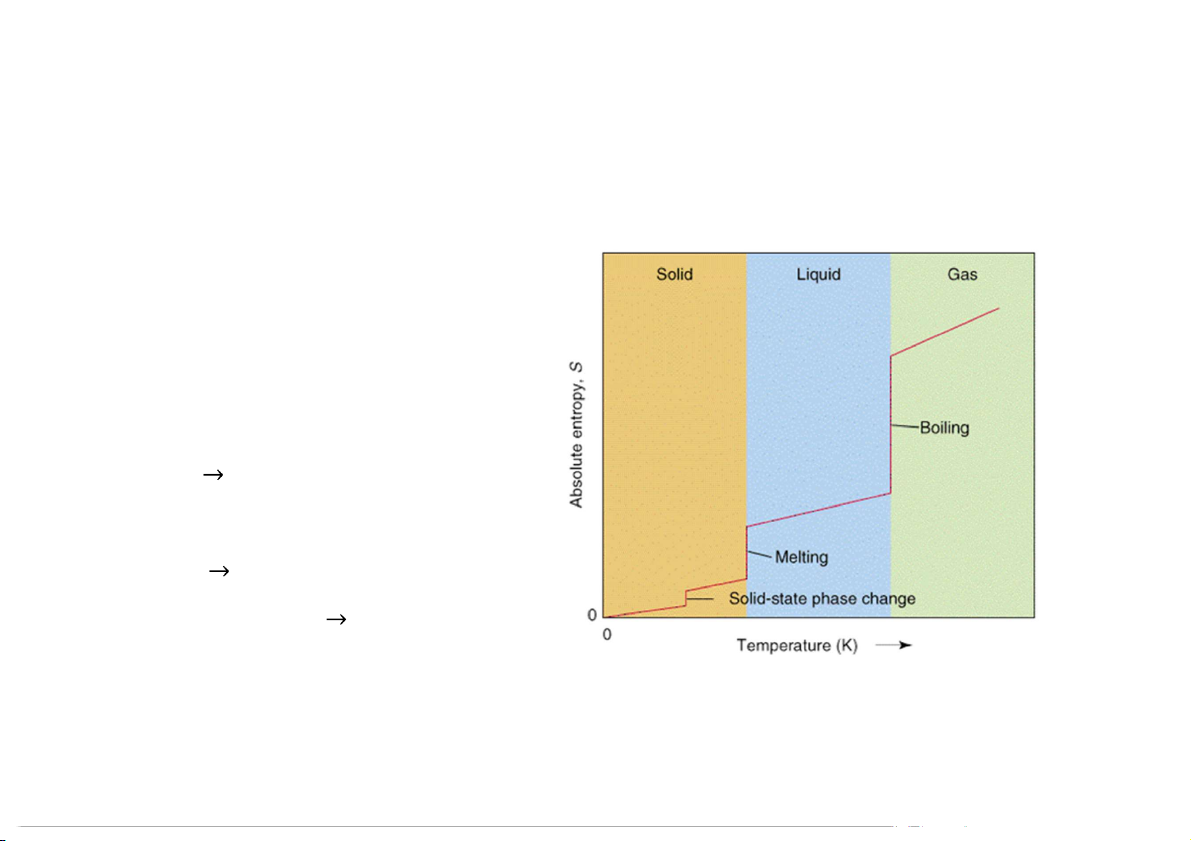
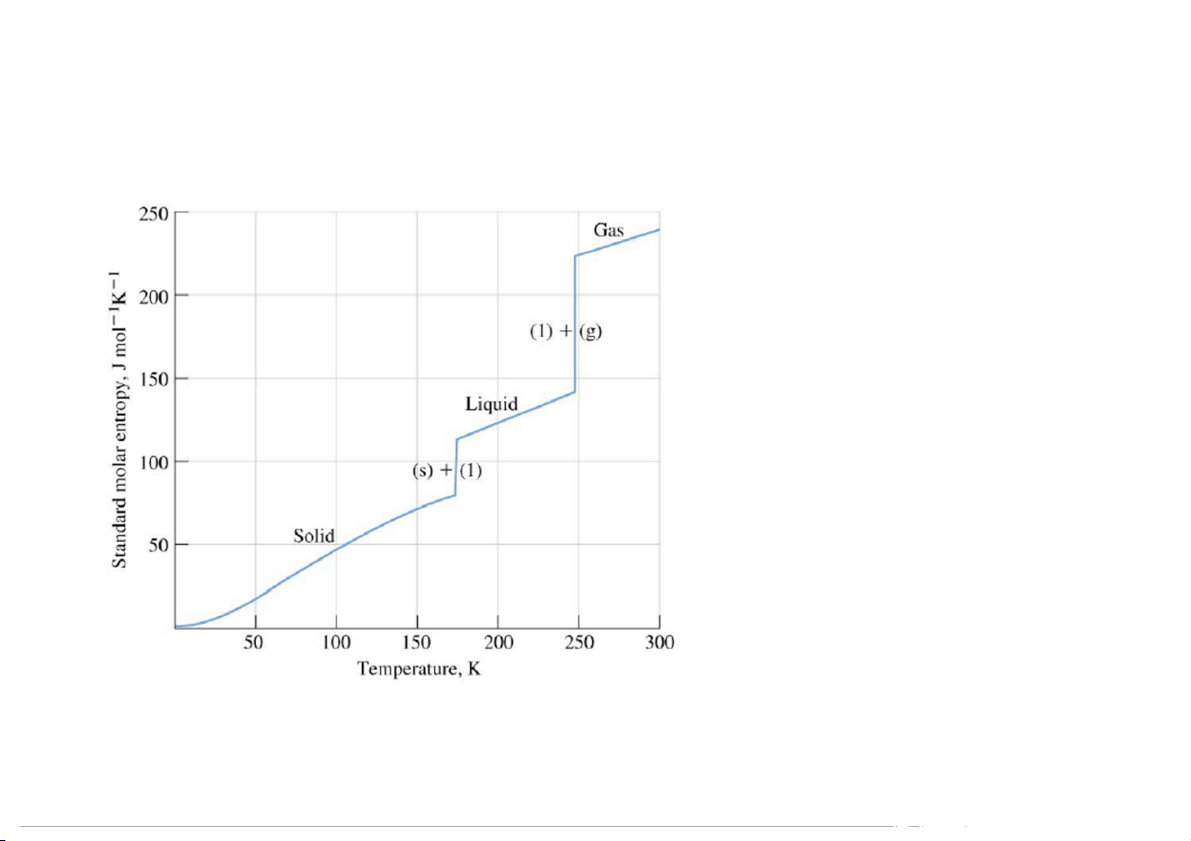
Entropy của quá trình chuyển pha và phản ứng hóa học Chuyển pha: Sr < S < S l k
Phản ứng hóa học:
Quá trình kèm theo sự tăng số phân tử khí tăng entropy
Quá trình kèm theo sự giảm số phân tử khí entropy giảm 2NO (k) + O (k) 2NO 2 2 (k)
2. Entropy và nguyên lý II NĐLH
Entropy nhìn từ góc độ phân tử Tịnh ến Dao động (làm thay đổi độ dài liên kết và góc tạo liên kết) Quay 17
3. Entropy mol chuẩn thức và biến thiên entropy của phản ứng
Entropy mol chuẩn thức _ S: entropy của 1 mol chất ở trạng thái chuẩn. Đơn vị: J/mol.K
Entropy mol chuẩn thức của đơn chất không bằng 0.
Entropy mol chuẩn thức phụ thuộc vào nhiệt độ, áp suất, trạng thái của hợp chất và dạng thù hình.
SCO (25oC , 1 at) > SCO (25o 2 C , 3 at) 2 SHe (100oC , 1 at) > S C , 1 at) He (25o SBr (l) < SBr k) ; S > S 2 ( 2 C (graphite) C (kim cương) 18
3. Entropy mol chuẩn thức và biến thiên entropy của phản ứng S o o o r < Sl < Sk 19
3. Entropy mol chuẩn thức và biến thiên entropy của phản ứng
Entropy của phản ứng
Xét phản ứng tổng quát: mA + nB pC + qD So = (p.So + . o o . o (C)
q S (D)) – (m.S (A) + n S (B))
Sopứ = Sosản phẩm- Sotác chất 20
4. Năng lượng tự do Gibbs
Xét về mặt năng lượng: hệ có khuynh hướng biến đổi theo chiều làm giảm năng lượng hệ thống (H < 0).
Xét về độ tự do: hệ thống có khuynh hướng biến đổi theo chiều tăng độ tự do (S > 0).
Biến đổi ở T và P không đổi thì yếu tố H < 0 và S > 0 là yếu tố ở đó hệ biến đổi xảy ra tự
nhiên. Tuy nhiên một số biến đổi có H > 0 hoặc S < 0 vẫn có thể xảy ra được.
Biểu thức liên hệ giữa H và S ? 21
4. Năng lượng tự do Gibbs
Xét quá trình với các giả thiết:
Chỉ có công dãn ép, ở T và P không đổi
Uvũ trụ = 0 qmtxq = - qp = - Hhệ
Thực hiện biến đổi enthalpy thuận nghịch:
T.Svũ trụ = T.Shệ + T.Smt = T.Shệ + (- q ) p - T.S – vũ trụ = Hhệ T.Shệ Suy ra: H –
< 0 phản ứng sẽ tự xảy ra hệ T.Shệ 22
4. Năng lượng tự do Gibbs T.S H – T.S vũ trụ = hệ hệ
Công thức của năng lượng tự do G (Gibbs): G = H – TS
Với các quá trình đẳng nhiệt: G = H - TS Suy ra: G = -T. hệ Svũ trụ Khi S > 0 hay < 0 – vũ trụ Ghệ phản ứng tự xảy ra 23
Hãy nh ∆Go298 (kJ) cho phản ứng sau tại 25oC: 2 N2(k) + 3 O (k) → 2 N 2 2O3(k) ∆Hof (kJ/mol) 83,72 So (J/mol.K) 191,5 205,0 312,2 A. +540,0 B. +278,8 C. +56,1 D. –540,0 E. –56,1
Hãy nh biến thiên entropy cho quá trình hóa hơi 1 mol metanol tại nhiệt độ
sôi của metanol. Biết nhiệt hóa hơi của metanol ∆Hvap = +35,20 kJ/mol và nhiệt
độ sôi của metanol là 64,6 oC. A. –17,0 J/K B. 17,0 J/K C. 104 J/K D. 543 J/K E. 3,25 J/K
4. Năng lượng tự do Gibbs
Kết hợp nguyên lý I và II: “Ở nhiệt độ và áp suất không đổi, biến đổi tự nhiên sẽ xảy ra theo
khuynh hướng làm giảm năng lượng tự do (G < 0)”
Nếu G < 0 phản ứng tự xảy ra.
Nếu G = 0 phản ứng đạt cân bằng.
Nếu G > 0 phản ứng thuận không tự xảy ra.
Nếu G > 0 thì môi trường cần tác động lên hệ (thực hiện công) để phản ứng xảy ra 25
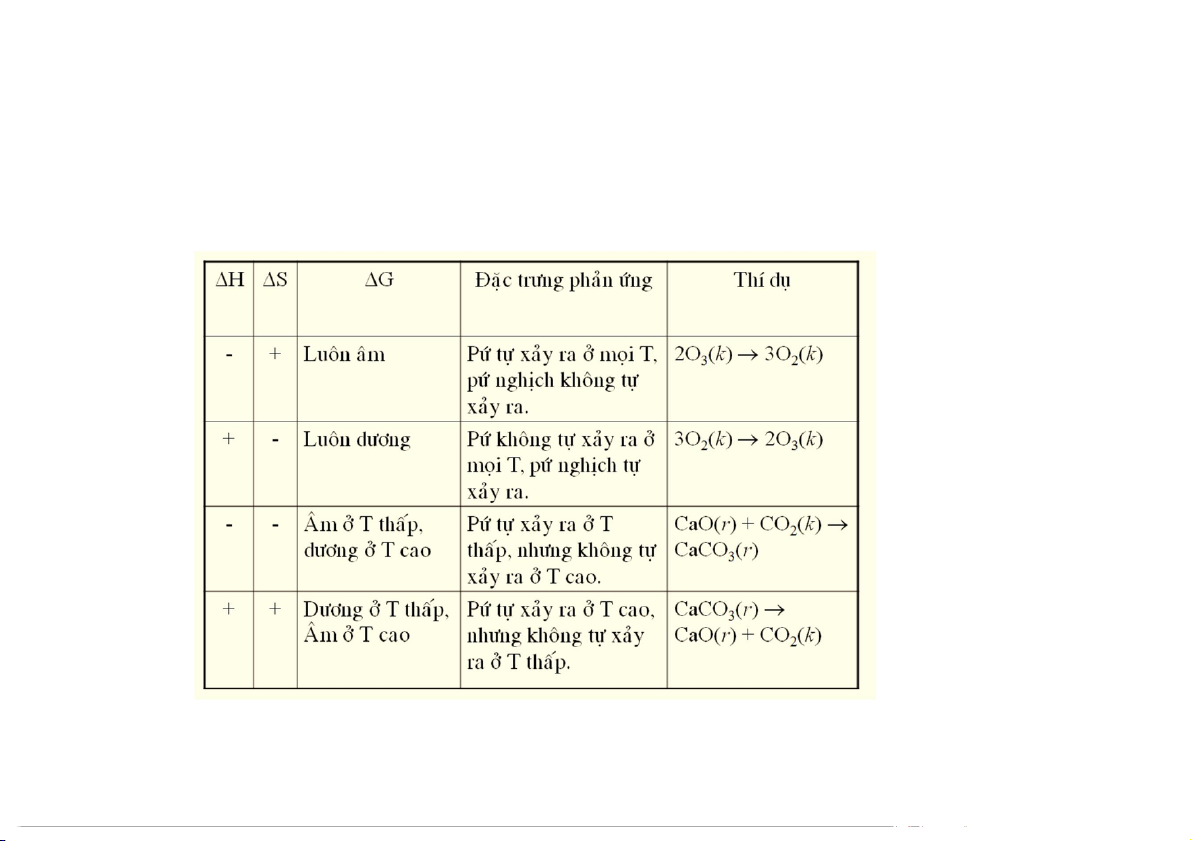
4. Năng lượng tự do Gibbs G = H - TS
Mối liên hệ giữa năng lượng tự do và nhiệt độ
Nếu H < 0 và S > 0, thì G luôn âm.
Nếu H > 0 và S < 0, thì G luôn dương
Nếu H < 0 và S < 0, thì G sẽ âm ở nhiệt độ thấp.
Nếu H > 0 và S > 0, thì G sẽ âm ở nhiệt độ cao.
Ngay cả khi G âm, quá trình vẫn có thể xảy ra rất chậm.
Nhiệt động học cho biết hướng của quá
trình nhưng không cho biết tốc độ của nó. 26
4. Năng lượng tự do Gibbs
Mối liên hệ giữa năng lượng tự do và nhiệt độ 27
Joseph Priestley điều chế oxygen bằng cách nung oxid thủy ngân (II). Hợp chất HgO bền ở
nhiệt độ phòng nhưng bị phân hủy thành các nguyên tố thành phần (Hg và O ) tại nhiệt độ 2
cao. Kết luận nào liên quan đến ∆H và ∆S có thể rút ra từ quá trình phân hủy này?
A. ∆H dương và ∆S dương
B. ∆H dương và ∆S âm
C. ∆H âm và ∆S dương
D. ∆H âm và ∆S âm
E. ∆H trở nên âm tại nhiệt độ cao Chọn phát biểu SAI A. hệ khi hệ đạt cân bằng
B. Quá trình tự xảy ra chỉ khi Svũ trụ > 0
C. Quá trình tự xảy ra chỉ khi Shệ > 0
D. Entropy mol chuẩn thức của đơn chất không bằng 0
E. Entropy của nh thể hoàn hảo ở 0 K bằng 0 Cho phản ứng sau: 2 SO + O → 2 SO
ở 298K. Biết phản ứng tại 298K 2(k) 2(k) 3(k)
có Ho = –198,4 kJ; và So = –187,9 J/K. Hãy cho biết giá trị của Go thay đổi
như thế nào khi tăng nhiệt độ và ở nhiệt độ nào thì phản ứng không tự xảy ra nữa?
A. G ít âm hơn khi tăng nhiệt độ; T>783 oC
B. G âm hơn khi tăng nhiệt độ; T>783 oC
C. G ít âm hơn khi tăng nhiệt độ; T<783 oC
D. G âm hơn khi tăng nhiệt độ; T<783 oC
E. Không thể xác định được
4. Năng lượng tự do Gibbs
Năng lượng tự do mol chuẩn thức
Định nghĩa: là biến thiên năng lượng tự do khi 1 mol hóa chất được tổng hợp từ các đơn
chất ở điều kiện chuẩn. Ký hiệu Go (H O, f 2
l ): năng lượng tự do mol chuẩn thức của H2O lỏng.
Quy ước Go của đơn chất = 0 f
Trạng thái chuẩn: rắn, lỏng, khí (1 bar), dung dịch 1M
Có thể nh biến thiên năng lượng tự do của phản ứng từ Gf 30
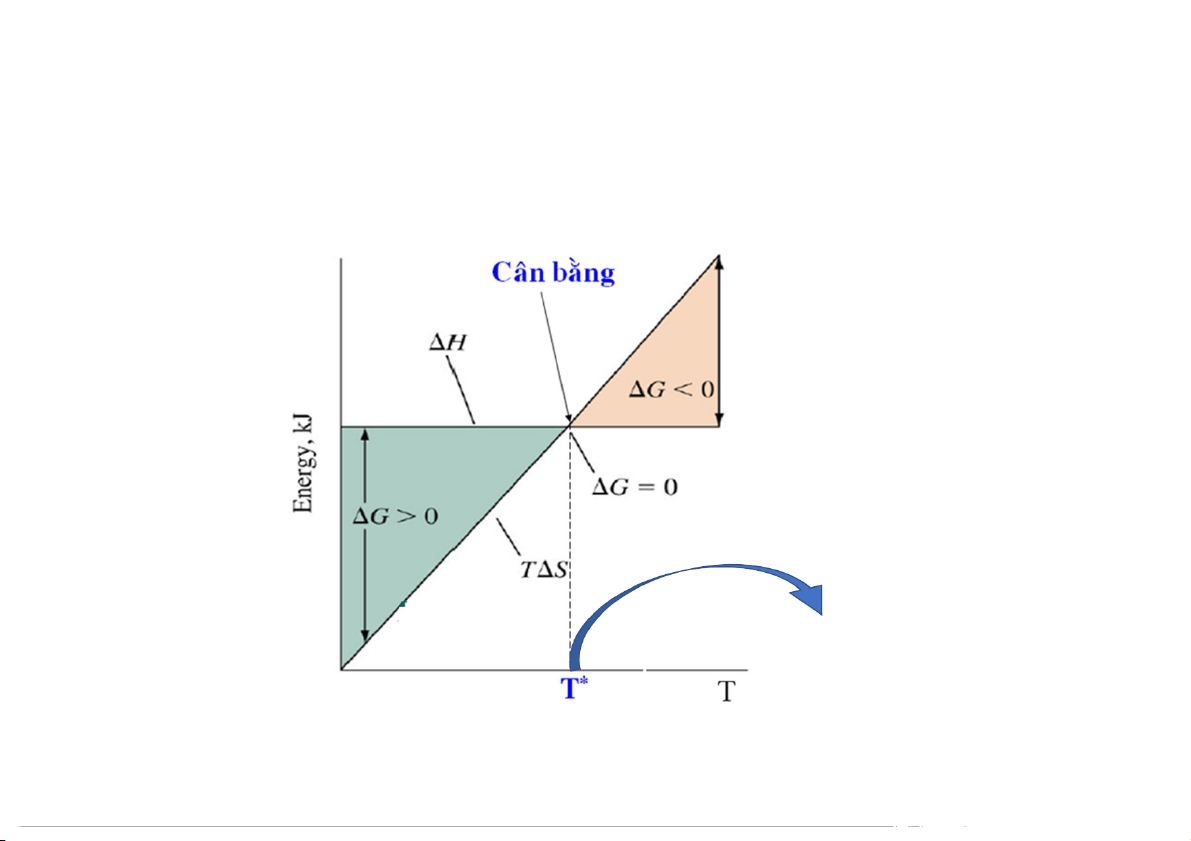
4. Năng lượng tự do Gibbs
Năng lượng tự do và trạng thái cân bằng
Phản ứng xảy ra theo chiều thuận T > T*
Phản ứng xảy ra theo chiều nghịch ∆H = T.∆S T < T* 31
4. Năng lượng tự do Gibbs
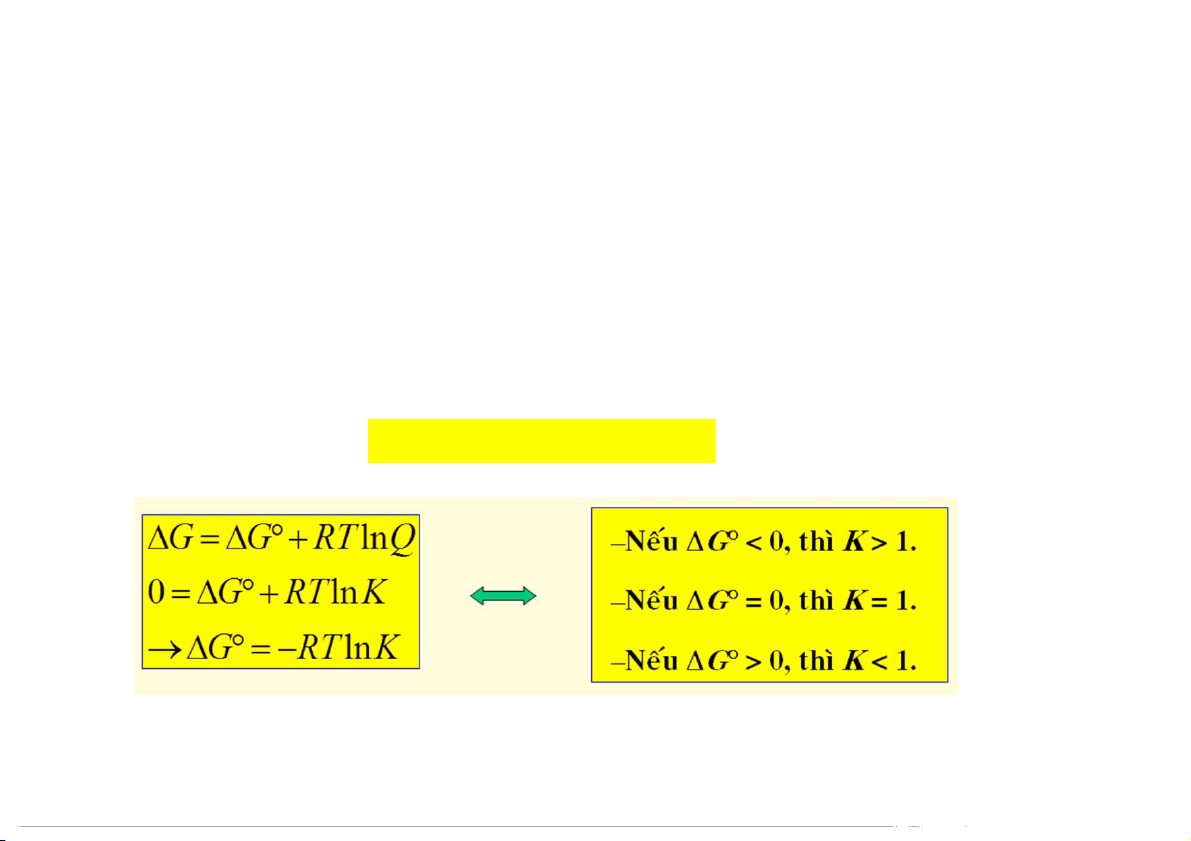
Năng lượng tự do và trạng thái cân bằng
G và K (hằng số cân bằng) áp dụng cho trạng thái chuẩn.
G và Q (tỉ lệ sản phẩm và tác chất) áp dụng cho trạng thái bất kỳ.
Để xác định phản ứng đã đạt cân bằng cần nh: G
G RT lnQ 32 33