




























































Preview text:
CHƯƠNG 3:
3.1 Khái niệm về tốc độ phản ứng, bậc phản ứng
ĐỘNG HÓA HỌC 3.2 Phương trình động học của một số phản ứng đơn giản
3.3 Tốc độ phản ứng và nhiệt độ. Năng lượng hoạt hoá 3.4 Cơ chế phản ứng 3.5 Xúc tác 1
3.1 Một vài khái niệm
Tốc độ phản ứng
Định nghĩa: là biến thiên của nồng độ chất phản
ứng (V = const) trong một đơn vị thời gian
Các yếu tố ảnh hưởng đến tốc độ của phản ứng:
Nồng độ tác chất Nhiệt độ
Tác động của xúc tác
Diện ch bề mặt
Mục đích: hiểu về phản ứng ở góc độ phân tử 2
3.1 Một vài khái niệm
Tốc độ phản ứng
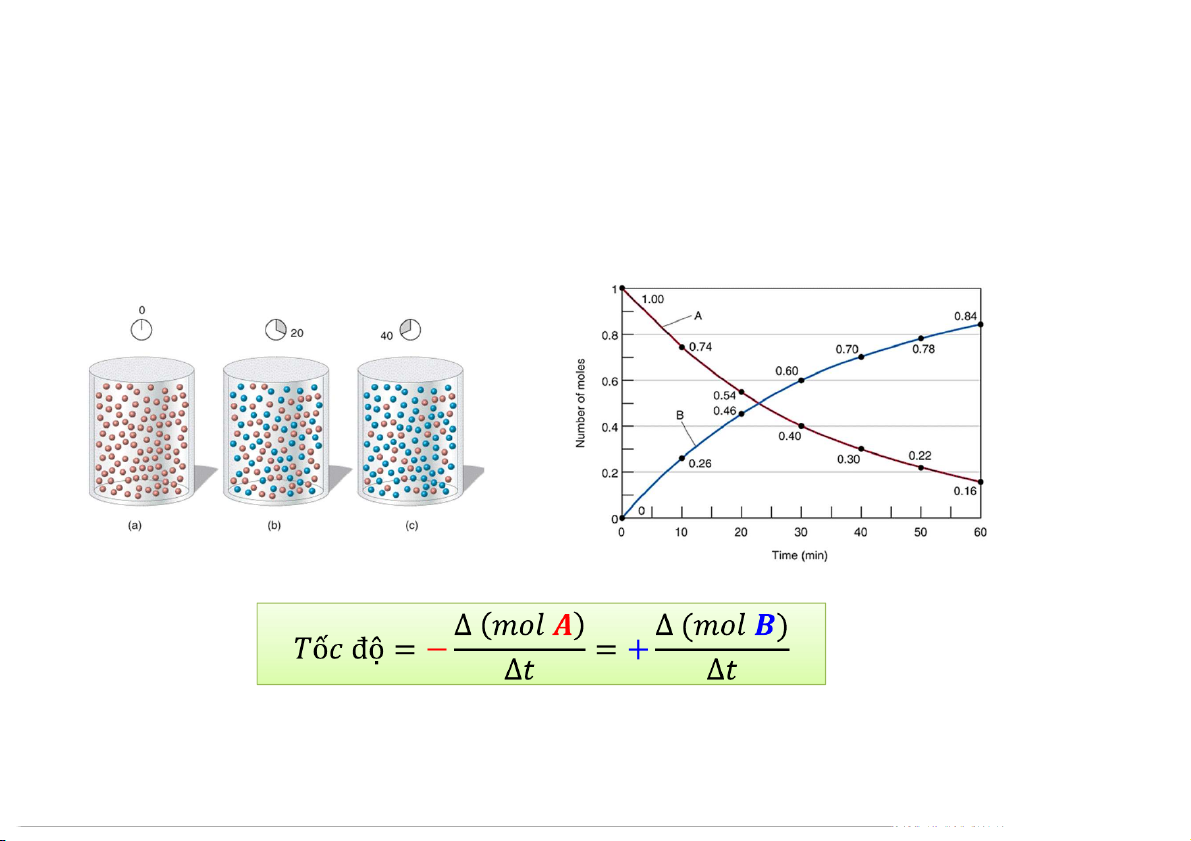
Tổng quát: A B 3
3.1 Một vài khái niệm
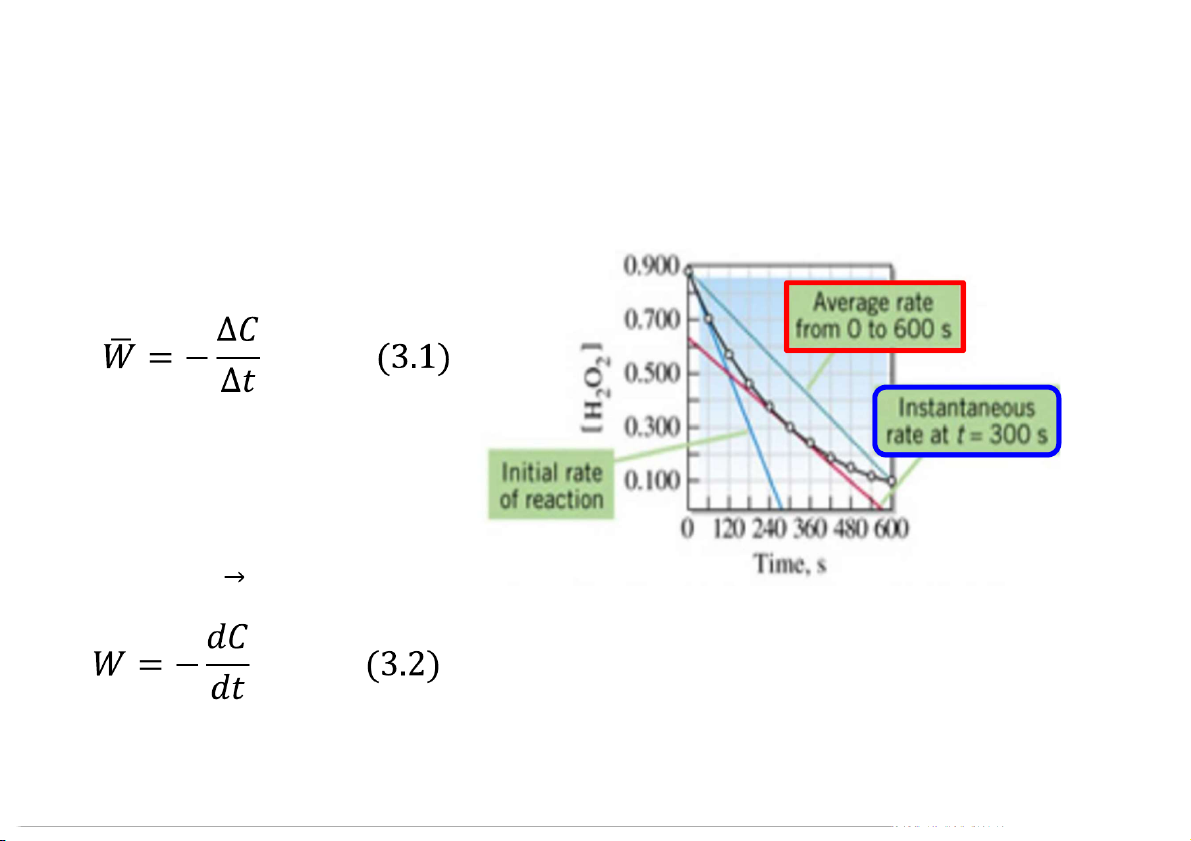
Tốc độ phản ứng Tốc độ trung bình:
Tốc độ tức thời (tốc độ phản ứng ở
thời điểm cho sẵn): là giới hạn của biểu thức (3.1) khi ∆t 0 4
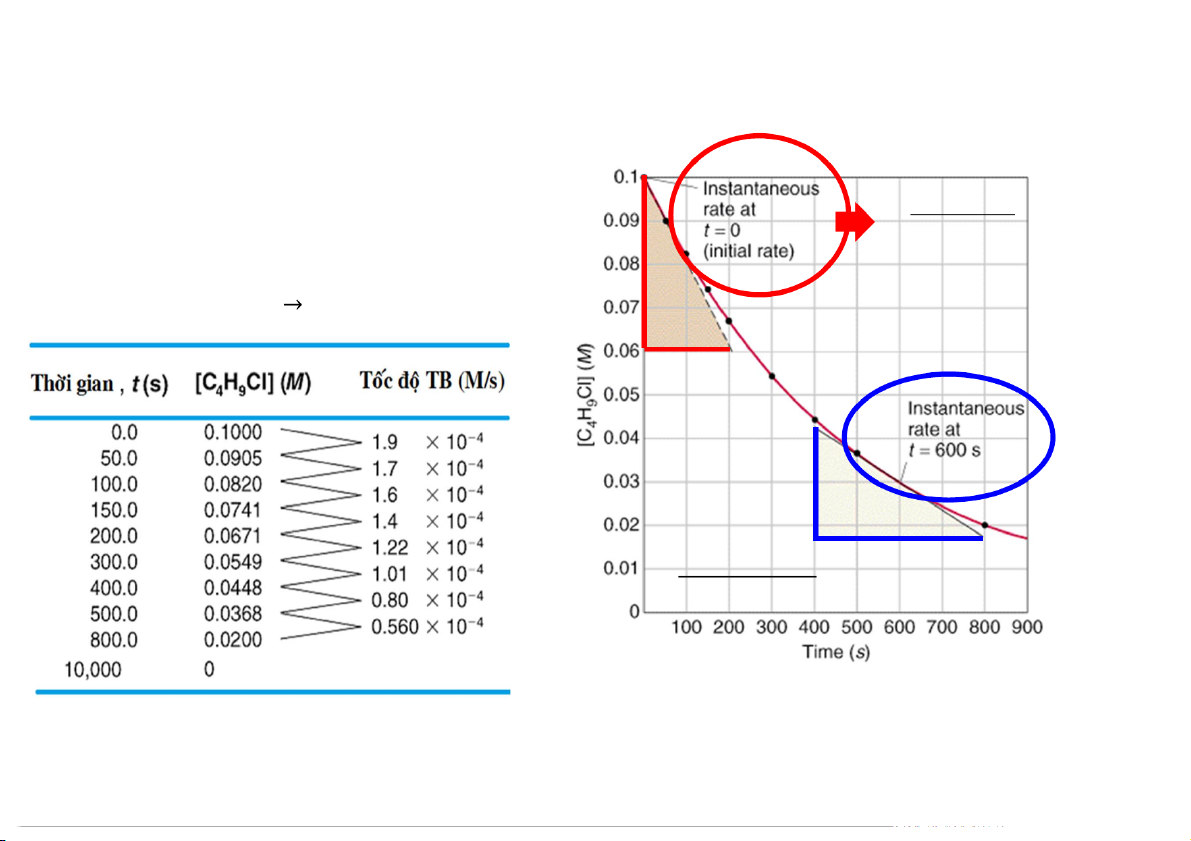
3.1 Một vài khái niệm
Tốc độ phản ứng (0.1−0.06) = 200 Xét phản ứng: C4H9Cl (dd) + H O (l) C OH (l) + HCl (dd) 2 4H9 (0.042− 0.018) = (800−400) 5
3.1 Một vài khái niệm
Tốc độ phản ứng
Biểu thức tổng quát của tốc độ phản ứng: Tổng quát: ν1A A A’ A’ 1+ ν2 2 + ... → ν’1 1 + ν’2 2 + … dn dC i i W (3.3) i Vdt dt
Các phản ứng có hệ số tỉ lượng ≠ 1
tốc độ chuyển hóa của các thành phần trong hệ không bằng nhau
Để biểu diễn tốc độ phản ứng bằng một biểu thức đơn giản cần bổ sung thêm hệ số cân bằng νi 𝒊 𝒊 6
3.1 Một vài khái niệm dn dC i i W (3.3) i
Tốc độ phản ứng Vdt dt Ví dụ: tốc độ
Biểu thức (3.3) là tốc độ chuyển hóa của một chất cụ thể.
Khi ν = 1: tốc độ phản ứng bằng tốc độ chuyển hóa
Khi ν ≠ 1: tốc độ phản ứng được nh theo biểu thức (3.4) dn dC i i W (3.4) vVdt vdt i i 7
3.1 Một vài khái niệm
Tốc độ phản ứng
Ví dụ 1: Cho phản ứng: 2 O3(k) 3 O2(k).
Giả sử tốc độ hình thành O2 là: Δ[O2]/ Δt = 6,0×10–5 M/s. Hãy nh tốc độ chuyển hóa của O3
(Δ[O3]/Δ t) tại cùng thời điểm. 8
3.1 Một vài khái niệm
Tốc độ phản ứng
Ví dụ 2: Cho phản ứng phân hủy N2O O (k) 5: 2 N2 5(k) 4 NO2(k) + O2
Giả sử tốc độ phân hủy của N2O5 tại thời điểm bất kỳ là 4,2×10–7 M/s. Hãy tính tốc độ hình
thành của O2 và NO2 tại cùng thời điểm. Đáp số: (a) 2.1 × 10–7 M/s (b) 8.4 × 10–7 M/s, 9
3.1 Một vài khái niệm
Tốc độ phản ứng
Ví dụ 3: Cho pứ: 2A + 3B → 4C + 5D, biểu thức tốc độ phản ứng theo tác chất A là: A. –ΔA/Δt B. –1/2 ΔA/Δt C. +ΔA/Δt D. +1/2 ΔA/Δt E. –2 ΔA/Δt
Ví dụ 4: Xét phản ứng cháy: CH4 (g) + 2O (g) → CO 2
2 (g) + 2H2O (g). Hãy cho biết tốc độ
chuyển hóa của tác chất nào trong phản ứng trên là lớn nhất A. CH4 B. O2 C. CO2 D. H O 2
E. Tốc độ chuyển hóa của CH4 và O2 là như nhau 10
3.1 Một vài khái niệm
Tốc độ phản ứng
Ví dụ 5: Xét phản ứng: N2 (g) + O2 (g) 2NO (g)
Giả sử nồng độ đầu của N2 là 0,500 M và nồng độ của N2 sau 0,100 s là 0,450 M. Tính tốc độ hình thành NO. A. 0,500 M/s B. 1,00 M/s C. 5,00 M/s D. 10,0 M/s E. 0,250 M/s 11
Cho biết công thức biểu diễn tốc độ trung bình của phản ứng: a.A + b.B → c.C + d.D
A. v = ∆[B]/ (∆t ×b)
B. v = –∆[A]/ (∆t)
C. v = ∆[A]/ (∆t ×a)
D. v = –∆[A]/ (∆t ×a)
E. v = –∆[C]/ (∆t ×c) 12
3.1 Một vài khái niệm
Một số phương pháp xác định tốc độ phản ứng Xét phản ứng: H (dd) H O (l) + ½ O 2O2 2 2 (k)
Theo dõi biến thiên nồng độ tác chất theo
thời gian: các phương pháp đo độ dẫn, áp suất khí, chuẩn độ …
Dựng đồ thị nồng độ (C) tác chất theo thời gian t,… 2 MnO - (dd) + 5 H + 2+ 4 2O2 (dd) + 6 H 2 Mn + 8 H O (l) + 5 O 2 2 (k) 13
3.1 Một vài khái niệm
Một số phương pháp xác định tốc độ phản ứng H2O2(dd) → H O(l) + ½ O 2 2(k) [H O ] v 2 2 t 14
3.1 Một vài khái niệm
Một số phương pháp xác định tốc độ phản ứng
Xác định tốc độ đầu (phương pháp Van’t Ho ): [ H O ] 2 2 M 32 , 2 v 10 . 7 , 1 3 o M / s t s 1360
Tính lượng chất còn lại sau 100 s.
(xem tốc độ phản ứng không đổi trong 200 giây) 15
3.1 Một vài khái niệm
Một số phương pháp xác định tốc độ phản ứng Xét phản ứng: Br ) + HCOOH ( ) 2Br ) + 2H ) + CO ) 2 (aq aq - (aq + (aq 2 (g nâu – đỏ Không màu [màu của Br2] Tốcđộ= - t Thời gian 16 393 nm Detector light [Br 2] Absorption 17 [Br [Br Tốcđộ= - 2] = - 2]cuối – [Br2]đầu t Tcuối– Tđầu 18 slope of tangent slope of tangent slope of tangent 19
3.1 Một vài khái niệm
Phương trình động học – PTĐH (Rate Law) của phản ứng Xét phản ứng: NH + (dd) + NO - (dd) 4 2 N2 (k) + 2H O (l) 2 20
3.3 Ảnh hưởng của nhiệt độ Thuyết va chạm A + B 2C 2A + 2B 4 va chạm 3A + 2B 6 va chạm Tốc độ = k.[A][B] 4A + 2B 8 va chạm 39
3.3 Ảnh hưởng của nhiệt độ
Để phản ứng có thể xảy Thuyết va chạm ra
các phân tử phải có
đủ năng lượng và phải va chạm theo một hướng nhất định
Nhiệt độ càng cao, năng lượng của các phân tử càng cao, phản ứng xảy ra càng nhanh tốc độ
phản ứng phụ thuộc vào nhiệt độ 40
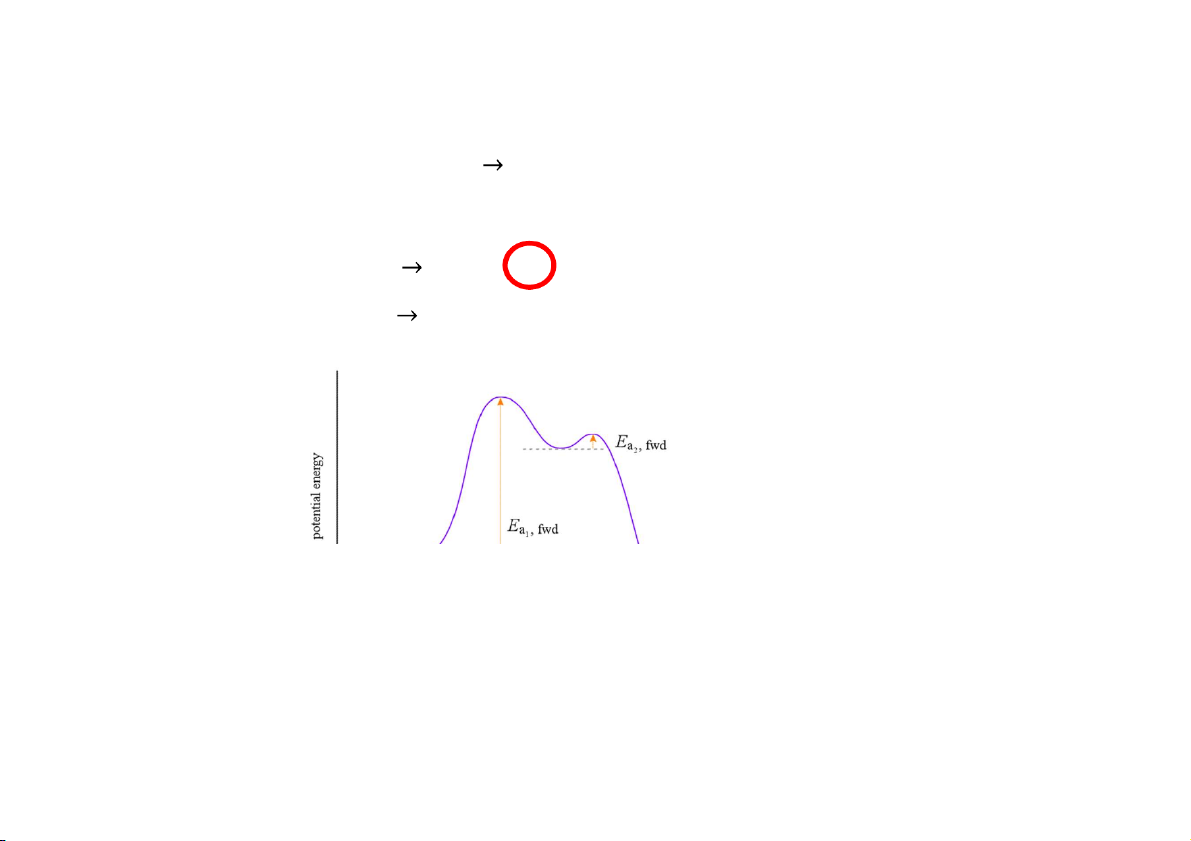
3.3 Ảnh hưởng của nhiệt độ
Năng lượng hoạt hóa (Ac va on energy)
Năng lượng hoạt hóa E :
a năng lượng tối thiểu (cao hơn động năng) mà phân tử cần có
khi va chạm để phản ứng có thể xảy ra 41
3.3 Ảnh hưởng của nhiệt độ
Năng lượng hoạt hóa
Tổng quát: A + B 2C Activation Energy Need to add energy to the system Energy is A + B released Thermodynamic driving force Energy of the Energy of Reactants the Product 42
3.3 Ảnh hưởng của nhiệt độ
Năng lượng hoạt hóa
Xét phản ứng chuyển vị của acetonitril: N H3C N C H3C H C 3C C N
Năng lượng cần thiết để vặn và bẻ gãy
liên kết gọi là năng lượng hoạt hóa - Ea
Khi liên kết C-N đứt, nhóm NC ếp tục
quay để tạo liên kết C – C N. 43
3.3 Ảnh hưởng của nhiệt độ
Năng lượng hoạt hóa Phản ứng tỏa nhiệt Phản ứng thu nhiệt Energy Energy products < Energyreactants products > Energyreactants 44
3.3 Ảnh hưởng của nhiệt độ
Năng lượng hoạt hóa
Nhiệt độ càng cao, số phân tử
có động năng > E càng nhiều a 45
3.3 Ảnh hưởng của nhiệt độ
Phương trình Arrhenius
Phần lớn các phản ứng đều tuân theo phương trình Arrhenius: Ea RT k Ae
k: hằng số tốc độ; Ea: năng lượng hoạt hóa;, R: hằng số khí (8,314 J/K.mol); T: nhiệt độ tuyệt đối (K).
A: yếu tố tần số (thừa số trước số mũ).
A đặc trưng cho xác suất xảy ra các va chạm đúng hướng.
A và E là đại lượng đặc trưng cho từng phản ứng. a 46
3.3 Ảnh hưởng của nhiệt độ Ea RT k Ae
Phương trình Arrhenius E và a
A được xác định bằng phương pháp đồ thị
dựa vào phương trình Arrhenius : E ln k a ln A RT Ngoài ra, E và a
A cũng có thể được xác định bằng phương pháp nh: k E 1 1 1 ln a k2 R 2 T 1 T 47
3.3 Ảnh hưởng của nhiệt độ
Phương trình Arrhenius
Ví dụ 1: phản ứng phân hủy N2O5 trong CCl4 tg = -Ea /R E = - R.tg a = 99,8 kJ/mol 48
3.3 Ảnh hưởng của nhiệt độ
Phương trình Arrhenius
Ví dụ 2: Cho một phản ứng có hằng số tốc độ phản ứng k = 2,21×103 s-1 ở 522 K và năng
lượng hoạt hóa E = 86,5 kJ/mol. Tính k ở 437 K a ln(k /k 2
1) = (86,5/8,314 × 10-3) × (1/522 - 1/437) ln(k /k 2 1) = -3,88 k E 1 k 1 1 ln a 2/k1 = e-3,88 k R T T k -2 2 2 1 2 = k × 2,07 × 10 1 k2 = 4,57 × 101 49
3.3 Ảnh hưởng của nhiệt độ
Phương trình Arrhenius
Ví dụ 3: phản ứng nào xảy ra nhanh hơn khi cả 2 đều được gia nhiệt như nhau ? 50
3.4 Cơ chế phản ứng
Cho biết đường đi của phản ứng.
Là một chuỗi các phản ứng sơ cấp được
đề nghị để giải thích biểu thức tốc độ phản ứng toàn phần.
Cho biết quá trình xảy ra của phản ứng:
liên kết nào đứt và liên kết nào hình
thành trong quá trình phản ứng. 51
3.4 Cơ chế phản ứng
Phản ứng sơ cấp
Phản ứng sơ cấp: là phản ứng chỉ xảy ra qua một giai đoạn
Phương trình động học phụ thuộc vào phân tử số của phản ứng.
Phản ứng đơn phân tử: (Ví dụ: O 3 O2 + O)
Tốc độ phân hủy ozon = k.[O ] 3
Phản ứng nhị phân tử: 2 phân tử hoặc nguyên tử tác chất va chạm nhau. (Ví dụ: O3 + O 2O ) 2
Tốc độ tạo thành O2 = k.[O3][O] 52
3.4 Cơ chế phản ứng
Phản ứng phức tạp – Giai đoạn tốc định
Nếu phản ứng đi qua nhiều
giai đoạn nối tiếp nhau thì
tốc độ phản ứng được quyết Gđ 1:
định bởi giai đoạn chậm Gđ 2:
nhất (giai đoạn tốc định). Gđ 3:
Giai đoạn tốc định: ở giai
đoạn này phản ứng sơ cấp
rất chậm so với các phản ứng sơ cấp khác. 53
3.4 Cơ chế phản ứng
Phản ứng phức tạp – Giai đoạn tốc định Xét phản ứng: 2NO(k) + Br ) 2(k 2NOBr(k)
Phương trình động học (PTĐH) thực nghiệm: v = k.[NO]2[Br ] 2
Cơ chế phản ứng đề nghị: 54 v = k ][NO] (*) 2[NOBr2
PTĐH không được phép xuất hiện hợp chất trung gian (các hợp chất trung gian thường không bền)
[NOBr2] phải được biểu diễn bằng [NOBr], [Br2] hay [NO]
Giả sử giai đoạn 1 đã ở trạng thái cân bằng: Vt = Vn
Thay [NOBr2] vào (*) ta có: 55 Chọn phát biểu SAI:
Cho phản ứng aA + bB = cC + dD có Bậc của phản ứng: 1) Luôn bằng (n + m) 2) Ít khi lớn hơn 3 3) Bằng (c+d) – (a+b) 4) Có thể là phân số 5) Bằng (a + b) A. 3 và 5 B. 2 và 3 C. 3 và 4 D. 2 và 4 E. 2, 3 và 5 56
Chọn phương án ĐÚNG:
Phản ứng 2A + 2B + C → D + E có các đặc điểm:
* [A], [B] không đổi, [C] tăng gấp đôi, vận tốc v không đổi.
* [A], [C] không đổi, [B] tăng gấp đôi, vận tốc v tăng gấp đôi.
* [A], [B] tăng gấp đôi, vận tốc v tăng gấp 8 lần.
Cả ba thí nghiệm đều ở cùng một nhiệt độ
Biểu thức của vận tốc theo các nồng độ A, B, C là: A. v = k[A]2[B][C] B. v = k[A][B]2[C] C. v = k[A][B][C] D. v = k[A][B]2 E. v = k[A]2[B] 57
Chọn phương án ĐÚNG:
Phản ứng N (k) + O (k) → 2NO(k) tỏa nhiệt. Tốc độ của phản ứng này sẽ 2 2 tăng lên khi áp dụng các biện pháp sau: 1) Dùng xúc tác. 2) Nén hệ. 3) Tăng nhiệt độ.
4) Giảm áp suất hệ phản ứng.
A. 1,3,4 B. 2,3,4 C. 1,2,3 D. 1,2 E. 2,4 58
Ví dụ 1: Chứng minh phương trình động học v = k.[H của phản ứng: 2].[NO]2 2NO(k) + 2H (k) 2H O(k) + N 2 2 2(k)
phù hợp với cơ chế sau: 2NO N2O2 (a): xảy ra nhanh N2O O 2 + H + H 2 N2 2 2 (b): xảy ra chậm H2O 2H 2 + H2 2O (c): xảy ra nhanh Hướng dẫn:
Tốc độ phản ứng được quyết định bởi giai đoạn chậm
Từ (a) viết biểu thức Kcb 59
Ví dụ 2: Cho phản ứng: 2NO (k) + F (k) 2NO F (k) 2 2 2
Cơ chế đề nghị như sau: 2NO NO 2 + F2 2F + F (a) NO2 + F NO2F (b)
Hãy xác định chất trung gian và giai đoạn chậm trong cơ chế đề nghị ở trên.
Biết phương trình động học: v = k[F2][NO ]2 60
Ví dụ 2: Cho phản ứng: 2NO (k) + F (k) 2NO F (k) 2 2 2
Cơ chế đề nghị như sau: 2NO NO 2 + F2 2F + F (a) Chậm NO2 + F NO2F (b) NO2F + F NO2 + F2 NO F 2 61 TÓM TẮT
Xác định tốc độ Thiết lập PTĐH Cơ chế đề nghị Xây dựng quy của phản ứng trình TN 62 3.5 Xúc tác
Từ rất lâu, ngành hóa học đã quan tâm nghiên cứu đến hiện tượng làm thay đổi tốc độ
của phản ứng khi có mặt một lượng rất bé của một chất nào đó.
Vào khoảng đầu thế kỷ 18, nhà bác học Nga M. A. Ilinski đã nghiên cứu để điều chế acid
sulfonic thơm từ hợp chất hữu cơ antraquinon. 63 3.5 Xúc tác
Hiện tượng xúc tác là gì?
Hiện tượng xúc tác là làm tăng nhanh tốc độ phản ứng
dưới tác dụng của một chất, chất đó gọi là xúc tác.
Chất xúc tác sau khi tham gia vào quá trình
không bị thay đổi về phương diện hóa học
nhưng có thể thay đổi tính chất vật lý
Chất xúc tác tạo thành hợp chất trung gian với
chất phản ứng. Cuối cùng xúc tác được hoàn
nguyên. Hiện tượng đó gọi là hiện tượng xúc
tác và phản ứng được gọi là phản ứng xúc tác.
Phân loại: xúc tác đồng thể và dị thể
Chất xúc tác làm giảm Ea 64 3.5 Xúc tác Phân loại 65 3.5 Xúc tác
Xúc tác đồng thể (Homogeneous catalysis)
Xúc tác và tác chất cùng pha (thường là pha lỏng)
Phản ứng thực hiện thông qua hợp chất trung gian và có năng lượng thấp
Thường là phản ứng phức tạp (nhiều giai đoạn) 66 3.5 Xúc tác
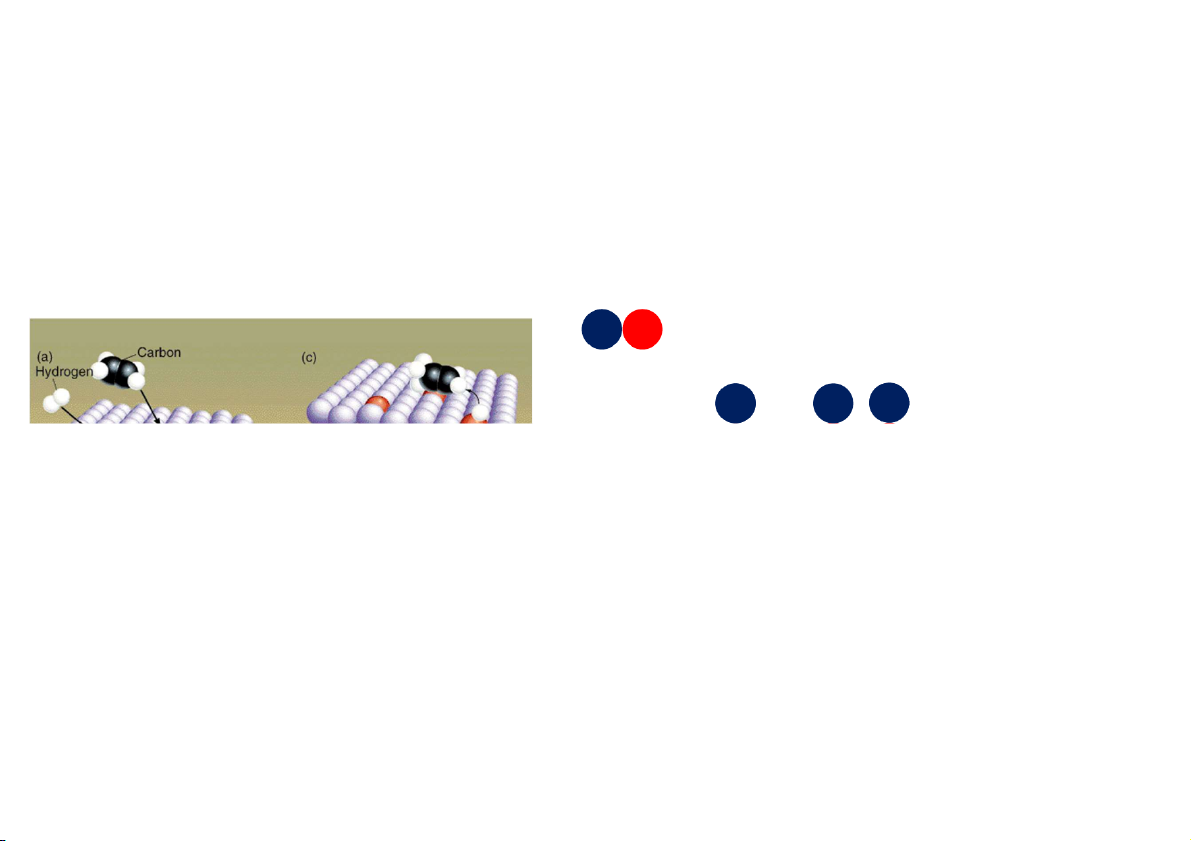
Xúc tác dị thể (Heterogeneous catalysis)
Ví dụ: C2H4(g) + H2(g) C ( 2H6 g), H = -136 kJ/mol. 67 3.5 Xúc tác
Xúc tác dị thể (Heterogeneous catalysis) • Solid phase material
• Porous on the scale of molecular dimensions – 10 – 100 Å
– Up to 1000’s m2/g surface area • Catalysis through – shape selec on – acidity/basicity
– incorpora on of metal par cles 100 Å 10 Å Zeolite (silica-aluminate) MCM-41 (mesoporous silica) 68 3.5 Xúc tác Xúc tác Enzyme
Enzyme là xúc tác sinh học.
Phần lớn enzyme là phân tử protein với phân
tử lượng lớn (10.000 - 106 amu).
Enzyme có cấu trúc đặc biệt
Phần lớn enzyme xúc tác cho các phản ứng đặc trưng.
Tác chất phản ứng các tâm hoạt động trên
enzyme → phản ứng diễn ra nhanh chóng.
Sau đó sản phẩm được tách ra khỏi enzyme.