

































Preview text:
CHƯƠNG 4
4.1 Khái niệm về cân bằng hoá học
4.2 Hằng số cân bằng CÂN BẰNG HOÁ HỌC
4.3 Tính nồng độ tại cân bằng
4.4 Sự dịch chuyển cân bằng hoá học
Nguyên lý Le Chatelier
4.1 Khái niệm về cân bằng (Equilibrium)
Là một biến đổi thuận nghịch
Quá trình cân bằng được thực hiện trong hệ thống kín
Cân bằng trong khảo sát là cân bằng động.
Thông thường có cân bằng trong vật lý và hóa học
Cân bằng trong vật lý (Physical Equilibrium) Liquid At time = 0 At time > 0 At time = ∞ At time = 0 At time > 0 At time = ∞ rate of rate of = rate of rate of dissolution precipitation = 2 vaporization condensation
4.1 Khái niệm về cân bằng
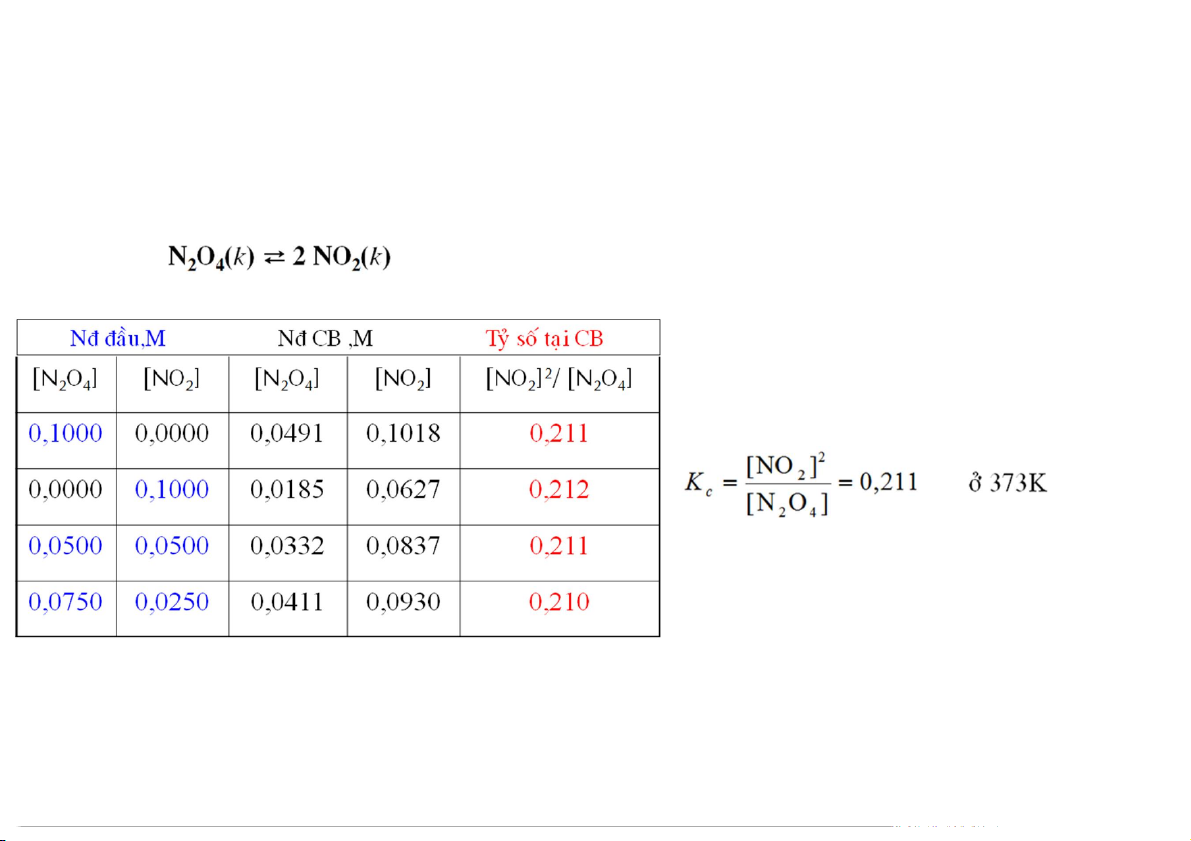
Cân bằng hóa học (Chemical Equilibrium) Xét phản ứng:
Khi đun nóng, hợp chất sẽ bị
phân huỷ: N O (k) 2NO (k) 2 4 2
Khi NO2 đạt đến mức nào đó,
phản ứng nghịch xảy ra:
2NO (k) N O (k) 2 2 4
Ở trạng thái cân bằng: có bao nhiêu N2O4 phân huỷ tạo NO2 thì có bấy nhiêu NO2 dimer hoá tạo N2O4 3
4.1 Khái niệm về cân bằng
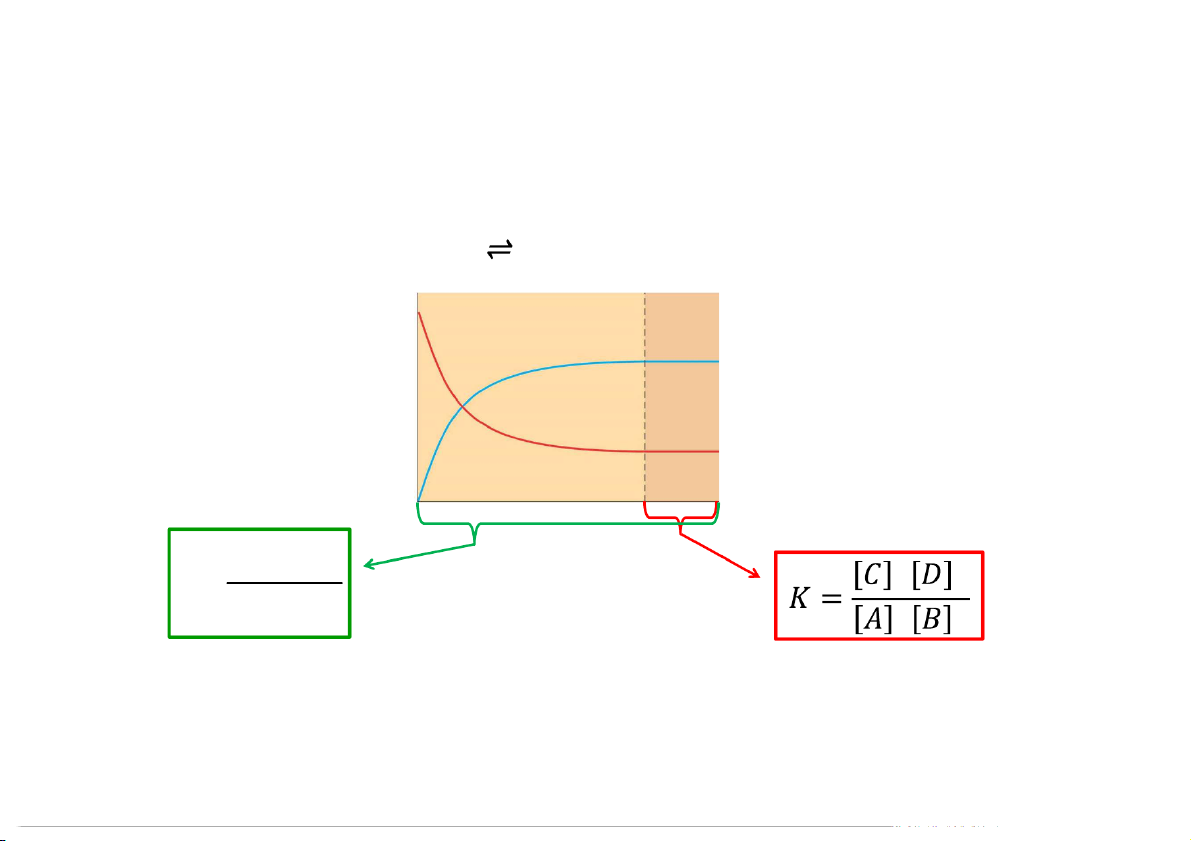
Cân bằng hóa học (Chemical Equilibrium) A B
[A] sẽ giảm đến hằng số
kt[A] sẽ giảm đến hằng số
[B] sẽ tăng từ 0 đến hằng số
kn[B] sẽ tăng từ 0 đến hằng số
Khi [A]/[B] là hằng số
Khi kt[A] = k [B] là hằng số n
phản ứng đạt cân bằng
phản ứng đạt cân bằng 4
4.2 Hằng số cân bằng
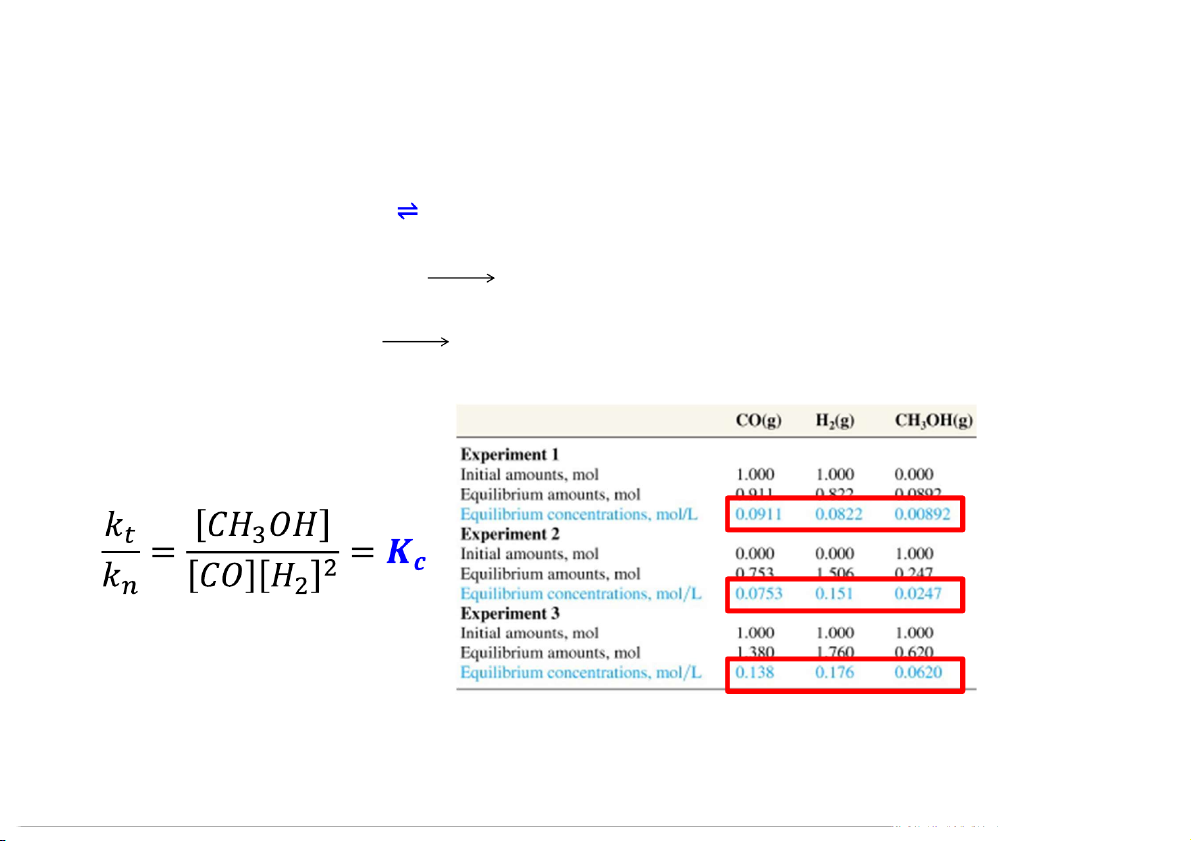
Xét phản ứng: CO (k) + 2H (k) CH OH (k) 2 3 k
Phản ứng thuận: CO (k) + 2H t 2 (k) CH3OH (k) Vt = kt[CO][H2]2 k Phản ứng nghịch: CH n 3OH (k) CO (k) + 2H2 (k) Vn = kn[CH3OH]
Tại cân bằng: Vt = Vn 5
4.2 Hằng số cân bằng
Tỉ số giữa nồng độ sản phẩm và tác chất ở trạng thái cân bằng không phụ thuộc vào thành
phần của tác chất và sản phẩm lúc đầu và được gọi là hằng số cân bằng Kc Tổng quát:
K được nh dựa trên nồng độ sản phẩm và tác chất lúc cân bằng. c
Thông thường K không có đơn vị. c 6
4.2 Hằng số cân bằng
Hằng số cân bằng và áp suất
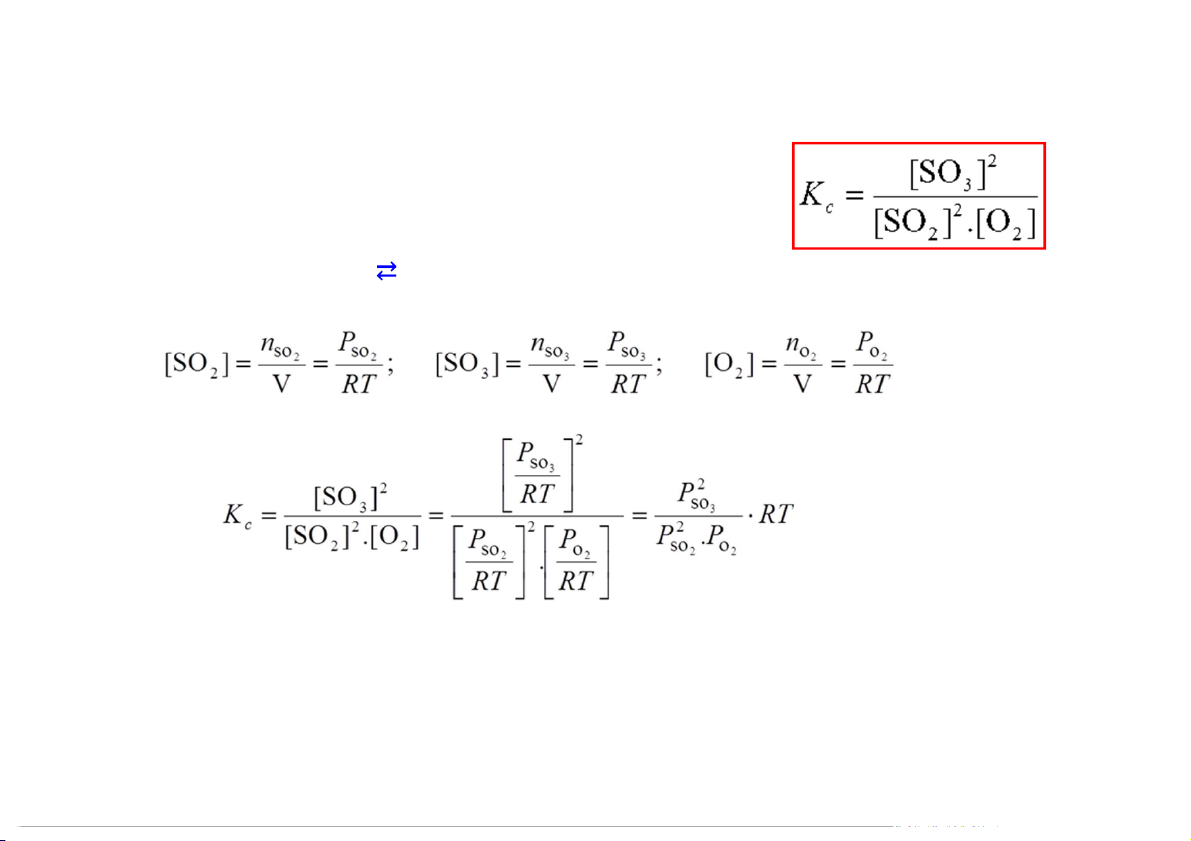
Nếu phản ứng có sự tham gia của chất khí: PP p PQ q K P PA a PB b
(K được nh từ áp suất riêng phần trong hỗn hợp khí) P Vì: PA = [A](RT) Nên: ∆𝒏 𝑷 𝒄 Trong đó: 𝒌 𝒌 7
4.2 Hằng số cân bằng
Hằng số cân bằng và áp suất Ví dụ 1: 8
4.2 Hằng số cân bằng
Hằng số cân bằng và áp suất Ví dụ 2: 2SO 2SO 2(k) + O2(k) 3(k) K n c = Kp.RT ; K = K p c(RT)-1 ; Kp = Kc(RT) 9
4.2 Hằng số cân bằng
Giá trị của hằng số cân bằng 10
4.2 Hằng số cân bằng
Mối liên hệ của hằng số cân bằng Phản ứng: N2O4(g) 2NO2(g) Phản ứng : 2NO2(g) N2O4(g)
Hằng số cân bằng của phản ứng thuận bằng nghịch đảo hằng số cân bằng
của phản ứng nghịch 11
4.2 Hằng số cân bằng
Mối liên hệ của hằng số cân bằng H O ) 1 ( 2 Phản ứng (1): H K 2 + ½ O O 2 H2 c H O 2 2 1/ 2 H O (2) 2 2 Phản ứng (2): 2 H 2 ) 1 ( 2 2 + O2 H2O K K c c H [ ] 2 O 2 2
Nhân phản ứng lên n lần
hằng số cân bằng của phản ứng sẽ luỹ thừa lên n lần. 12
4.2 Hằng số cân bằng
Mối liên hệ của hằng số cân bằng
Phản ứng (1): 2 NO + O 2 NO 2 2
Phản ứng (2): 2 NO2 N2O4
Phản ứng (3): 2 NO + O2 N2O4 (3) = (2) + (1) K = K 3 1.K2
Hằng số cân bằng của phản ứng tổng bằng ch hằng số cân bằng của các
phản ứng thành phần. 13
4.2 Hằng số cân bằng
Mối liên hệ của hằng số cân bằng Ví dụ: N (1) = ?
2O (k) + ½ O2 (k) 2 NO (k) Kc [N O] (2) 2 18 K , 2 7.10 N c 1/ 2
2 (k) + ½ O2 (k) N2O (k) [N ].[O ] 2 2 2 (3) [NO] 3 1 N K , 4 7 10 . 2 (k) + O2 (k) 2 NO (k) c [N ].[O ] 2 2 (1) = (3) – (2) 14
4.2 Hằng số cân bằng
Cân bằng dị thể
Xét phản ứng: CaCO3(s) CaO(s) + CO2(g) me 15
4.2 Hằng số cân bằng
Cân bằng dị thể 𝒄 𝟐 𝒑 𝑪𝑶𝟐
Thựcnghiệm chothấyCO2 khôngphụthuộc vàolượngCaOvàCaCO3.Tại sao?
Nồngđộcủachấtrắnvàchấtlỏngtinhkhiếtbằngkhốilượngriêngchiachophântửlượng.
Nồng độ của chất rắn trong phản ứng cân bằng dị thể là hằng số. 16
4.3 Tính hằng số cân bằng
Ví dụ 1: Tính K của phản ứng 2NO(k) + O ( ( ) cb 2 k) 2NO2 k
Biết nồng độ của các chất ở trạng thái cân bằng:
[NO] = 0,0542 M; [O2] = 0,127 M và [NO ] = 15,5 M. 2
Ví dụ 2: Tính K của phản ứng N cb 2(k) + 3H ( ( ) 2 k) 2NH3 k
Ở 200oC . Biết Kp ở nhiệt độ trên là: 4,3×10-4 n = 2 – 4 = -2 K 17 c = Kp / (RT)n
4.3 Tính hằng số cân bằng
Thương số phản ứng (Reac on Quo ent)
Xét phản ứng tổng quát: aA + bB pC + qD C + D r mbe u N A + B p q C D time Q a b A B 18
Q = K khi phản ứng đạt đến cân bằng
4.3 Tính hằng số cân bằng p q C D Q a b
Dự đoán chiều của phản ứng A B
Q > K: phản ứng nghịch xảy
ra. Nồng độ sản phẩm giảm,
nồng độ tác chất tăng đến khi Q bằng K.
Q < K: phản ứng thuận xảy ra.
Nồng độ sản phẩm tăng, nồng
độ tác chất giảm đến khi Q bằng K. 19
4.3 Tính hằng số cân bằng
Dự đoán chiều của phản ứng
Ví dụ 1: Cho phản ứng H2 (k) + I ( 2 k)
2 HI (k) với Kc = 54,3 ở 430oC. Hỗn hợp gồm 0,243 mol H
và 1,98 mol HI chứa trong bình (V = 1 lít) sẽ có biến đổi nào? 2; 0,146 mol I2
Qc > Kc : hệ thống sẽ biến đổi theo chiều nghịch 20
4.3 Tính hằng số cân bằng
Dự đoán chiều của phản ứng
Ví dụ 2: Cho phản ứng A (k)
B (k) với Kc = 0,43 ở 175oC. Hãy cho biết sẽ có biến đổi nào
trong từng giai đoạn của phản ứng (theo hình ảnh minh họa)? Hướng dẫn:
- Tính Q cho từng giai đoạn
- So sánh với Kc kết luận 21
Ví dụ 3: Cho phản ứng: H2 (k) + I2 (k)
2HI (k) với Kc = 54,3 ở 430oC. Hãy cho biết
a. Phản ứng dịch chuyển theo chiều nào ứng với nồng độ đầu của H2, I và HI lần l 2 ượt là
0,00623 M, 0,00414 M và 0,0224 M
b. Tính nồng độ các chất tại cân bằng Hướng dẫn:
a. Tính Q So sánh với Kc chiều phản ứng từ trái sang phải b. Áp dụng biểu thức: 2 [HI] 2 (0.0224 + 2x) = c K 54.3 = [H ][I ] 2 2 (0.00623 - ) x (0.00414 - x ) [H2]cb = 0,00467 M ; [I
= 0,00258 M ; [HI] = 0,0255 M 2]cb cb 22
4.3 Tính hằng số cân bằng
Mối liên hệ giữa cân bằng và năng lượng tự do Ta có: G G RT ln Q
Khi phản ứng đạt cân bằng: Q = K và cb G = 0
G G RT ln K cb 0 G RTln Kcb
Nếu G < 0, thì K > 1.
Nếu G = 0, thì K = 1.
Nếu G > 0, thì K < 1. 23
4.3 Tính hằng số cân bằng
Mối liên hệ giữa cân bằng và năng lượng tự do
G áp dụng cho trạng thái chuẩn
K áp dụng cho trạng thái cân bằng
G và Q áp dụng cho trạng thái bất kỳ 24
4.3 Tính hằng số cân bằng
Mối liên hệ giữa cân bằng và năng lượng tự do Go K 25
4.3 Tính hằng số cân bằng
Mối liên hệ giữa cân bằng và năng lượng tự do G RT ln K. Go (*) ln K RT
Phản ứng có sự tham gia của chất khí: RTlnK = - p Go
Phản ứng xảy ra trong dung dịch: RTlnK = - c Go 26
4.3 Tính hằng số cân bằng
Mối liên hệ giữa cân bằng và năng lượng tự do
Ta có: Go = Ho - TSo
Tại cân bằng: Go = - RTlnKcb Go H o So ln Kcb RT RT R K cb
H o So H o So H o 1 1 2 ln K RT R RT R R T T 1 cb 2 1 2 1
Xem Ho không phụ thuộc vào nhiệt độ 27
4.3 Tính hằng số cân bằng
Từ đại lượng nhiệt động
Thực hiện các bước sau:
Tính năng lượng tự do Gibbs chuẩn thức của tác chất và sản phẩm (có thể tra
bảng các giá trị Go, Ho , So).
Tính Gopứ , rồi suy ra K .
Ví dụ: cho phản ứng: NO (k) + O ) + O ) 3 (k) = NO2 (k 2 (k Go (NO (O (NO) - (O ) pứ= Gof 2) + Gof 2) -Gof Gof 3
= 51,29 + 0 – 86,55 – 163,2 = -198,5 kJ
LnK = 198,5×103 J/(8,314 J/mol.K × 298 K) = 80,12 _ K = 6,2.1034 28
4.3 Tính hằng số cân bằng
Nồng độ lúc cân bằng
Ví dụ: Cho phản ứng: H2 (k) + I ( 2 k) 2HI (k) Với Kc = 54,3 ở 430oC.
Hỗn hợp ban đầu: H2 = I2 = 0,5 mol/l, nhiệt độ 430oC. Tính nồng độ các chất ở cân bằng. 29 Giải: H2 (k) + I2 (k) 2HI (k) to : 0,5 0,5 0 Thay đổi: x x 2x tcb: 0,5 – x 0,5 – x 2x
Tínhlượngchấttạothànhhaytiêuthụ(x)trongquátrìnhphảnứngđểđạtđếncânbằng. HI 2 (2 x )2 K c H x x 2 I 2 54,3 (0,5 ).(0,5 ) 2 x 7,37 x 0,393 0,5 x 30
4.4 Nguyên lý Le Châtelier’s
Xét phản ứng sản xuất amoniac: N2 (k) + 3H (k) 2NH 2 3 (k) 31
4.4 Nguyên lý Le Châtelier’s
Nếu tác động lên cân bằng một yếu tố nào đó, thì cân bằng sẽ dịch
chuyển theo hướng chống lại tác động đó
Các yếu tố ảnh hưởng đến cân bằng Henry Le Châtelier (1850-1936)
Nồng độ tác chất, sản phẩm
Áp suất/thể tích Nhiệt độ Chất xúc tác 32
4.4 Nguyên lý Le Châtelier’s
Ảnh hưởng của nồng độ tác chất và sản phẩm 33
4.4 Nguyên lý Le Châtelier’s
Ảnh hưởng của nồng độ tác chất và sản phẩm 2H S + O 2S + 2H O 2 (g) 2(g) (s) 2 (g) Hãy dự đoán:
a. [H2O] tăng hay giảm khi thêm O2
b. [H2S] tăng hay giảm khi thêm O2
c. [O2] tăng hay giảm khi lấy bớt H S 2
d. [H2S] tăng hay giảm khi thêm S 34
4.4 Nguyên lý Le Châtelier’s
Ảnh hưởng của áp suất/thể ch
Cân bằng dịch chuyển theo
Cân bằng dịch chuyển theo 35 chiều tăng số mol khí. chiều giảm số mol khí.
4.4 Nguyên lý Le Châtelier’s
Ảnh hưởng của áp suất/thể ch
Biến thiên của áp suất/thể tích
Chiều dịch chuyển của phản ứng Tăng áp suất
Cân bằng dịch chuyển theo chiều tạo ra ít số mol khí hơn Giảm áp suất
Cân bằng dịch chuyển theo chiều tạo ra nhiều số mol khí hơn Tăng thể ch
Cân bằng dịch chuyển theo chiều tạo ra nhiều số mol khí hơn Giảm thể ch
Cân bằng dịch chuyển theo chiều tạo ra 36 ít số mol khí hơn
4.4 Nguyên lý Le Châtelier’s
Ảnh hưởng của áp suất/thể ch
Khí trơ (inert gas) không làm ảnh hưởng đến cân bằng cũng như thể tích của
hệ (∆V = 0) khi được thêm vào hệ.
(Tấtcả nồngđộvàápsuất riêngphầnkhôngđổi)
Sự thay đổi của áp suất (thể ch) không ảnh hưởng lên chất rắn.
Sự thay đổi của áp suất (thể ch) không ảnh hưởng đến K.
Sự thay đổi của áp suất hay thể ch sẽ không ảnh hưởng đến cân bằng khi nkhí = 0. 37
4.4 Nguyên lý Le Châtelier’s
Ảnh hưởng của áp suất/thể ch
Ví dụ: Dự đoán chiều của phản ứng trong các phản ứng sau khi:
a) tăng áp suất? b) tăng thể ch? 1) 2SO2(g) + O2(g) 2 SO3(g) 2) PCl5(g) PCl3(g) + Cl2(g) 3) CO(g) + 2H2(g) CH3OH(g) 4) N2O4(g) 2 NO2(g) 5) H2(g) + F2(g) 2 HF(g) 38
4.4 Nguyên lý Le Châtelier’s
Ảnh hưởng của nhiệt độ Ví dụ: Co(H O) 2- 2
6 (dd) + 4 Cl- (dd) CoCl ( 4 dd) + 6 H O ( ) 2 l H > 0
Phản ứng thu nhiệt: ∆H > 0 Tăng nhiệt độ phản ứng dịch chuyển sang phải Giảm nhiệt độ phản ứng dịch chuyển sang trái
Phản ứng tỏa nhiệt: ∆H < 0 Tăng nhiệt độ
pứ dịch chuyển sang trái Tăng Giảm Giảm nhiệt độ
pứ dịch chuyển sang phải Nhiệt độ Nhiệt độ 39
4.4 Nguyên lý Le Châtelier’s
Ảnh hưởng của nhiệt độ
Ví dụ: Dự đoán chiều dịch chuyển của các phản ứng dưới đây khi tăng nhiệt độ cho hệ. (a) CaO + H O Ca(OH) H° = -82 kJ (s) 2 (g) 2(aq) (b) CaCO CaO + CO H° = 178 kJ 3(s) (s) 2(g) (c) SO S + O H° = 297 kJ 2(g) (s) 2(g) 40
4.4 Nguyên lý Le Châtelier’s
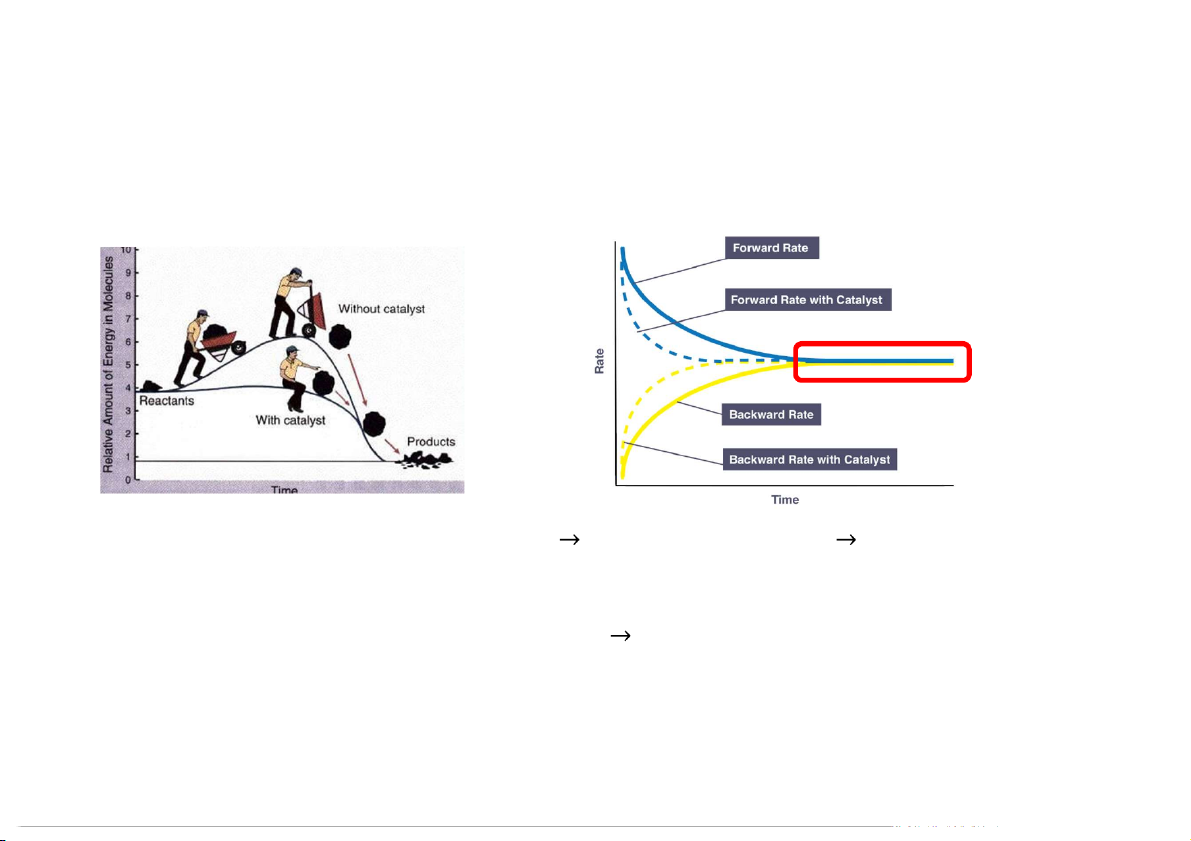
Hiệu ứng của chất xúc tác
Chất xúc tác làm giảm năng lượng hoạt hóa tăng tốc độ phản ứng nhanh đạt đến cân bằng.
Chất xúc tác không làm thay đổi hằng số cân bằng
không làm thay đổi thành phần của
tác chất và sản phẩm ở trạng thái cân bằng. 41 TÓM TẮT 42 43 Example:
Consider the following equilibrium process between dinitrogen tetra uoride (N ) and 2F4 nitrogen di uoride (NF ): N ) 2NF ) Δ ° = 38.5 kJ/mol 2 2F4(g 2(g H
Predict the changes in the equilibrium and K if:
(a) the reac ng mixture is heated at constant volume. (b) some N
gas is removed from the reac ng mixture at constant temperature and 2F4 volume.
(c) the pressure on the reac ng mixture is decreased at constant temperature.
(d) a catalyst is added to the reac ng mixture. Example:
Consider the following equilibrium process between dinitrogen tetra uoride (N ) and 2F4 nitrogen di uoride (NF ): N ) 2NF ) Δ ° = 38.5 kJ/mol 2 2F4(g 2(g H
Predict the changes in the equilibrium and K if:
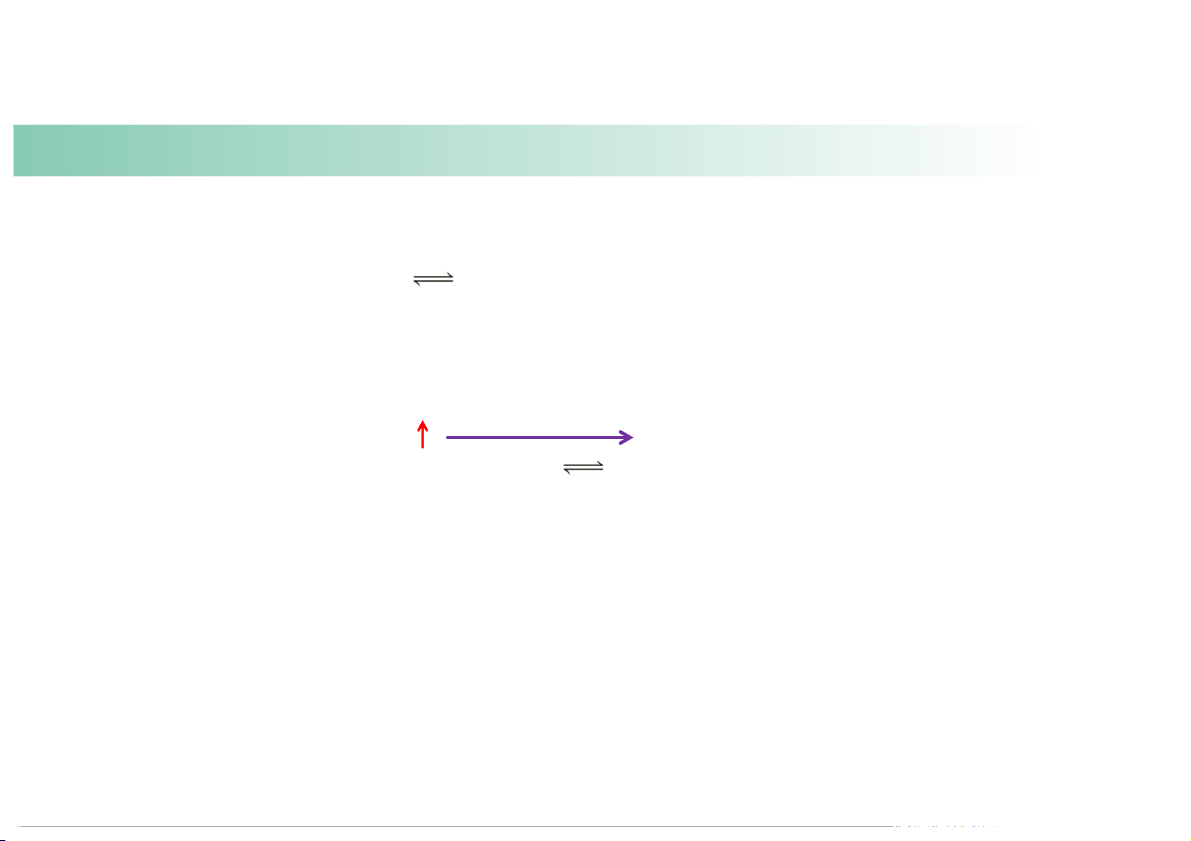
(a) the reac ng mixture is heated at constant volume. Heat + N2F4(g) 2NF2(g)
Reac on shi s right, generates more product and increase K. 45 Example:
Consider the following equilibrium process between dinitrogen tetra uoride (N ) and 2F4 nitrogen di uoride (NF ): N ) 2NF ) Δ ° = 38.5 kJ/mol 2 2F4(g 2(g H
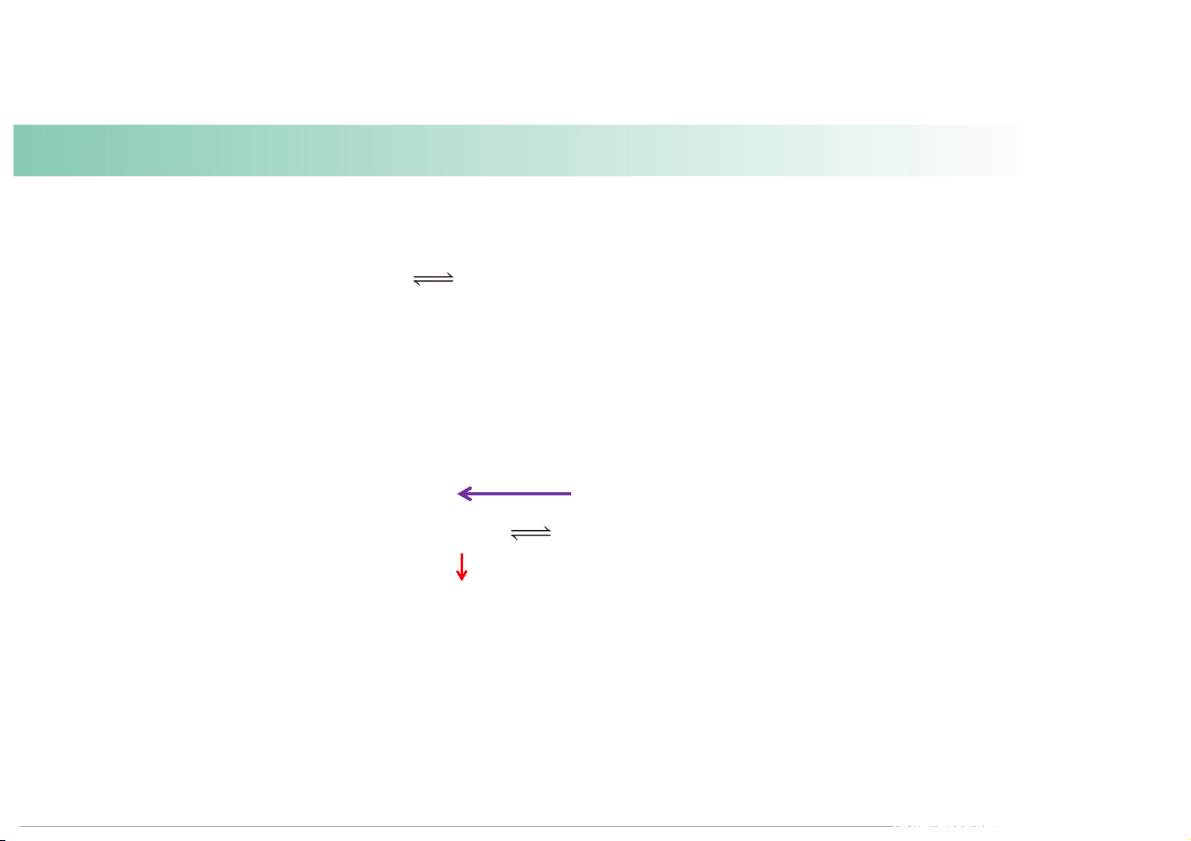
Predict the changes in the equilibrium and K if: (b) some N
gas is removed from the reac ng mixture at constant temperature and 2F4 volume. Heat + N2F4(g) 2NF2(g)
Reac on shi s le , generates more reactants and K stays the same. 46 Example:
Consider the following equilibrium process between dinitrogen tetra uoride (N ) and 2F4 nitrogen di uoride (NF ): N ) 2NF ) Δ ° = 38.5 kJ/mol 2 2F4(g 2(g H
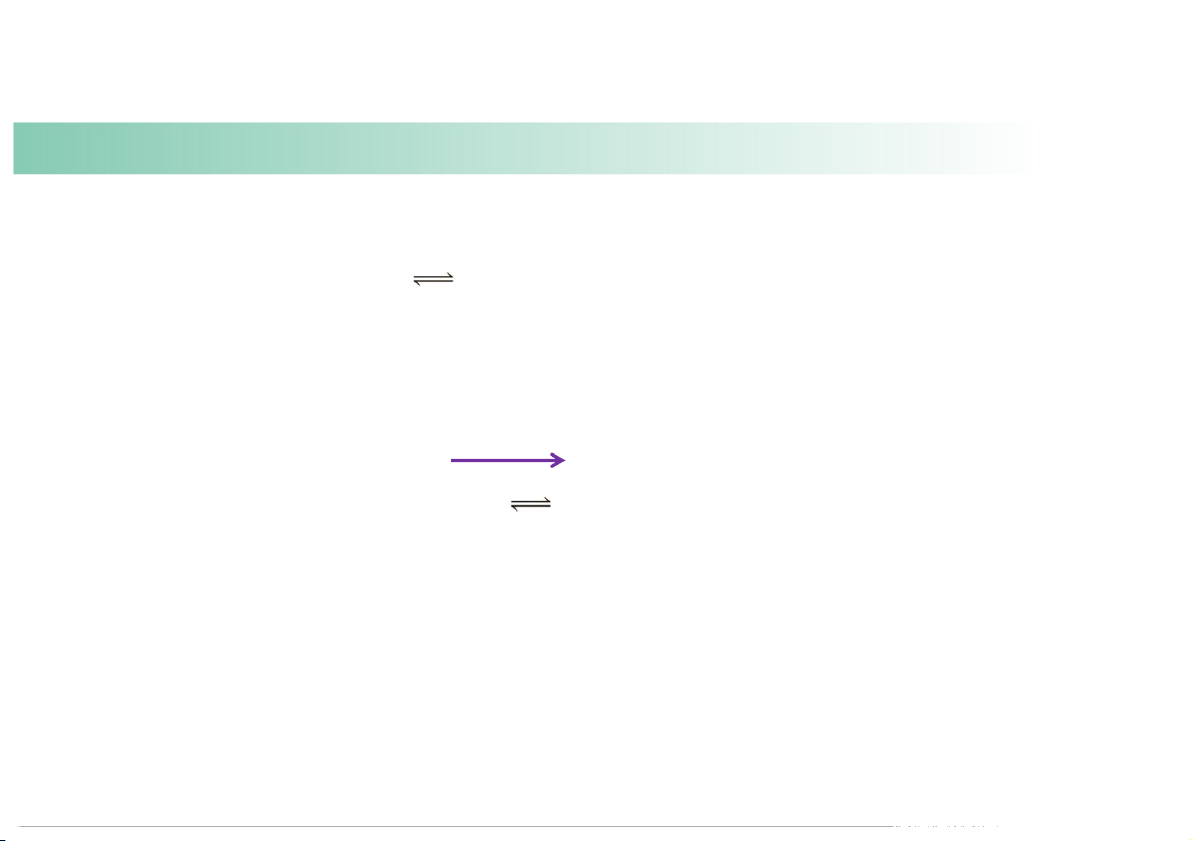
Predict the changes in the equilibrium and K if:
(c) the pressure on the reac ng mixture is decreased at constant temperature. Heat + N pressure volume 2F4(g) 2NF2(g) = decrease increase 1 gas 2 gas molecule molecules
Reac on shi s right, generates more products and K stays the same. Example:
Consider the following equilibrium process between dinitrogen tetra uoride (N ) and 2F4 nitrogen di uoride (NF ): N ) 2NF ) Δ ° = 38.5 kJ/mol 2 2F4(g 2(g H
Predict the changes in the equilibrium and K if:
(d) a catalyst is added to the reac ng mixture. Heat + N2F4(g) 2NF2(g)
A catalyst causes a reac on to reach equilibrium more quickly.
It does not change the equilibrium concentra on or K. 49