










































































































Preview text:
Chương 5: 5.1 Một vài khái niệm
5.2 Độ hòa tan - Các yếu tố ảnh hưởng
CÂN BẰNG ION TRONG DUNG DỊCH
5.3 Tính chất tập hợp của dung dịch không CÂN BẰNG ACID-BASE điện ly. 1 5.4 Dung dịch điện ly 5.1 MỘT VÀI KHÁI NIỆM
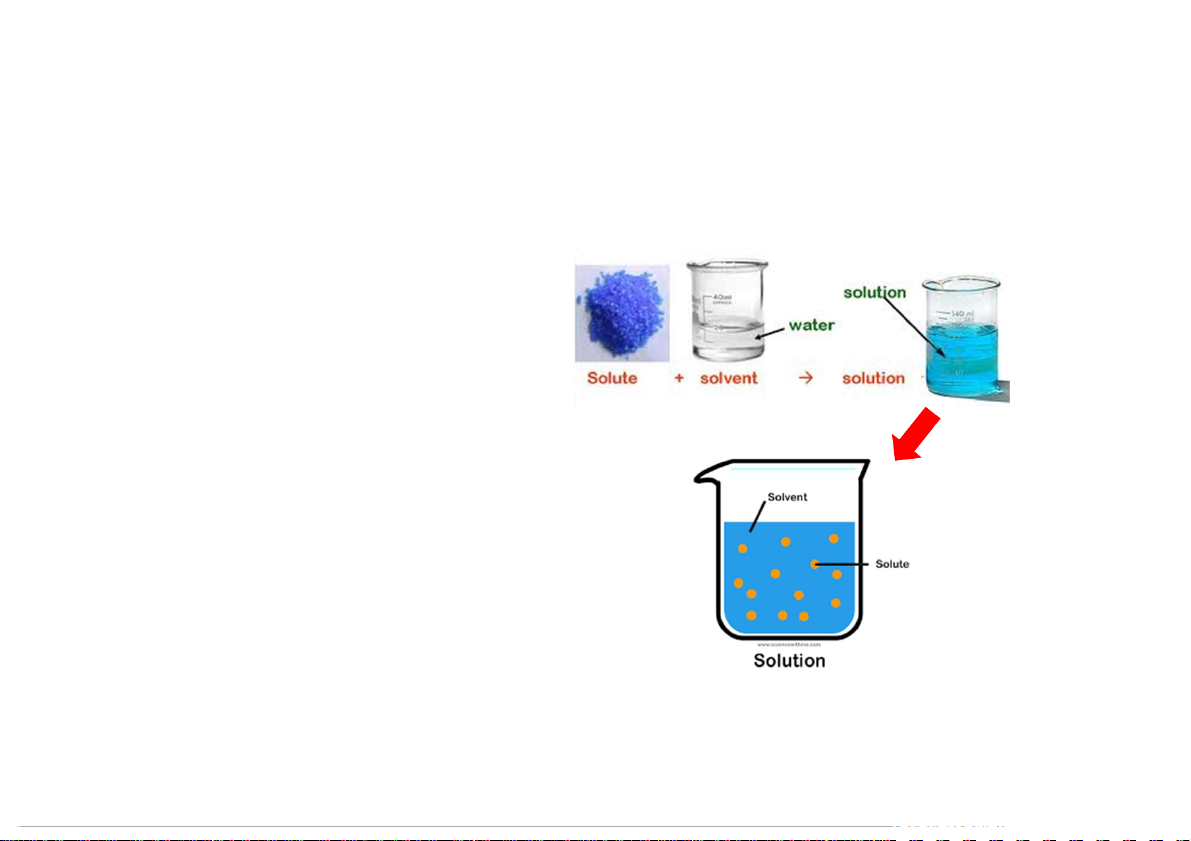
Chất tan (solute): lượng ít hơn; trạng
thái có thể khác trạng thái của dung dịch Dung môi (solvent):
Xác định dạng tồn tại của dung dịch
Cấu thành có lượng lớn nhất.
Dung dịch (solution): hỗn hợp đồng thể
gồm dung môi và chất tan (có thể nhiều). 2 5.1 MỘT VÀI KHÁI NIỆM
Một vài dung dịch thường gặp Dung dịch Thành phần Dung dịch khí Không khí
N , O , và nhiều chất khác 2 2 Khí tự nhiên
CH , C H , và nhiều chất khác 4 2 6 Dung dịch lỏng nước biển
H O, NaCl, nhiều chất khác 2 nước ngọt có gaz H O, CO , C H O ,… 2 2 12 22 11 Dung dịch rắn đồng thau Cu, Zn 3 5.1 MỘT VÀI KHÁI NIỆM
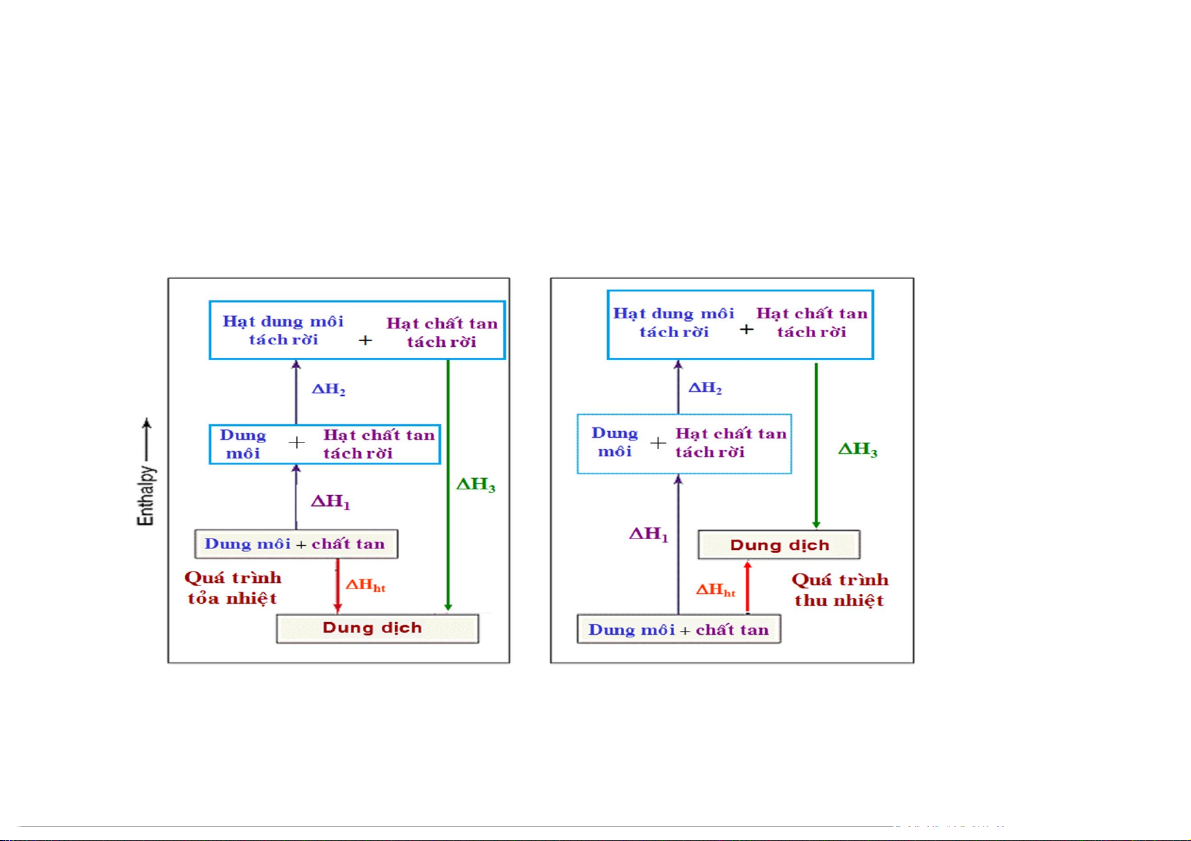
Biến đổi năng lượng trong quá trình hòa tan 3 giai đoạn:
Hht = H1 + H2 + H3
Hht có thể dương hay âm tùy thuộc vào tương tác giữa các lực liên phân tử: A-A, B-B, A-B. 4 5.1 MỘT VÀI KHÁI NIỆM
Biến đổi năng lượng trong quá trình hòa tan 3 giai đoạn:
Hht = H1 + H2 + H3
Hht có thể dương hay âm tùy thuộc vào tương tác giữa các lực liên phân tử: A-A, B-B, A-B. 5 5.1 MỘT VÀI KHÁI NIỆM
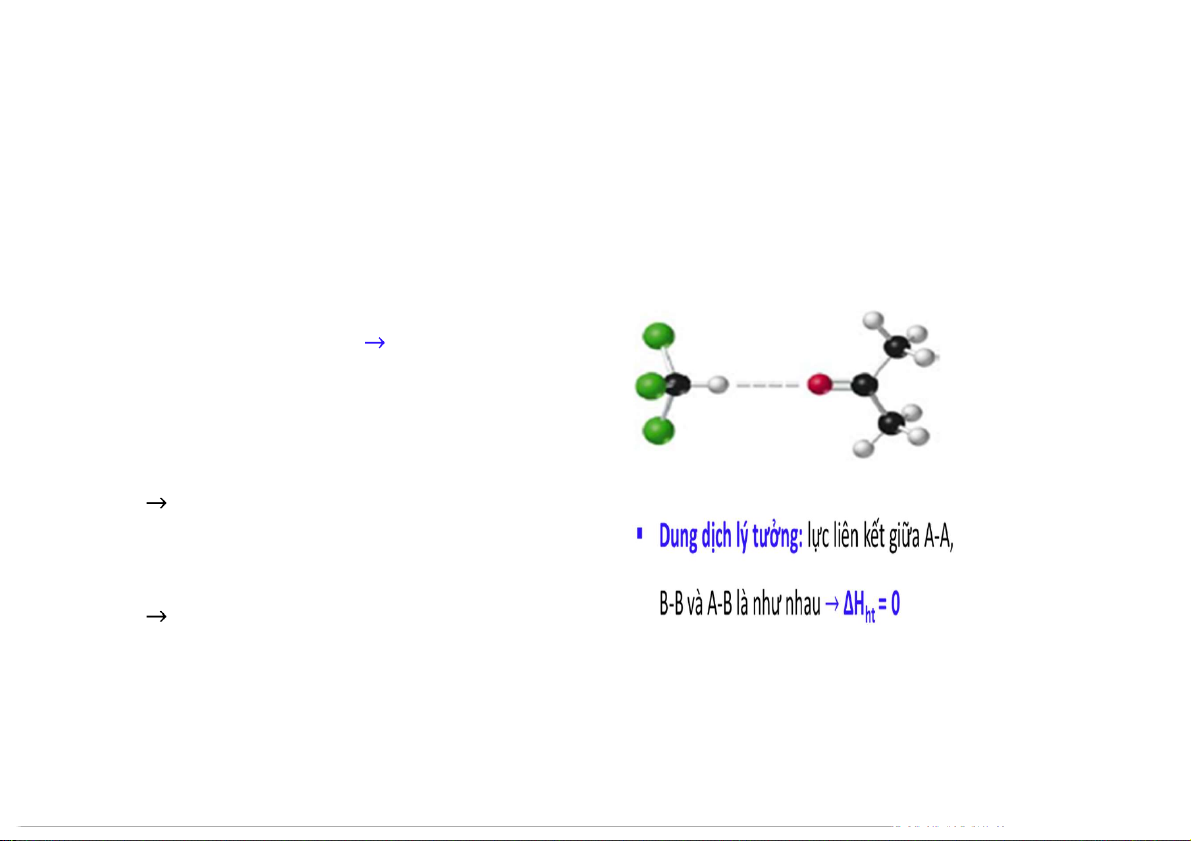
Biến đổi năng lượng trong quá trình hòa tan
Dung dịch lý tưởng: lực liên kết giữa A-A, B-B và A-B là như nhau ∆H = 0 ht
Dung dịch không lý tưởng
Nếu liên kết giữa A-A, B-B < A-B H < 0 ht
Nếu liên kết giữa A-A, B-B > A-B H > 0 ht 6 5.1 MỘT VÀI KHÁI NIỆM
Biến đổi năng lượng trong quá trình hòa tan 7 5.1 MỘT VÀI KHÁI NIỆM
Biến đổi năng lượng trong quá trình hòa tan
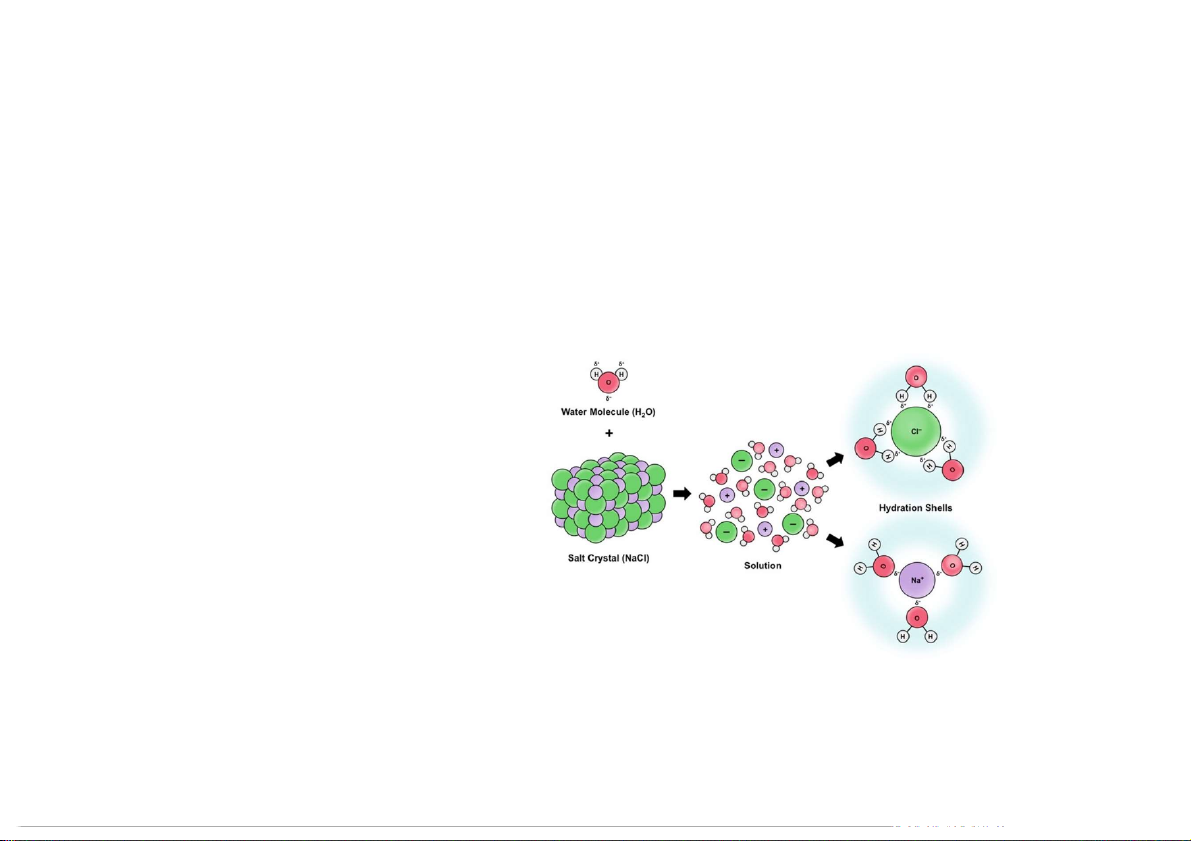
Quá trình hòa tan thường làm tăng độ mất trật tự của hệ Dung dịch ion:
• H : là biến thiên enthalpy ht
khi 1 mol hợp chất ion hòa tan hoàn toàn vào nước • Đơn vị: kJ.mol-1 • H gần như bằng 0. ht 9 5.1 MỘT VÀI KHÁI NIỆM
Các cách biểu diễn nồng độ Nồng độ %:
Nồng độ rất nhỏ: ppm, ppb, ppt (khối lượng hoặc thể tích)
ppm (part per million): g/g; L/L; mg/L
ppb (part per billion): ng/g; g/kg; nL/L; g/L
ppt (part per trillion): pg/g; ng/kg; pL/L; ng/L 10 5.1 MỘT VÀI KHÁI NIỆM
Các cách biểu diễn nồng độ n Phân mol (X, N): X A A ni
n – số mol A trong dung dịch i A
n – số mol toàn bộ các cấu tử trong dung dịch i Nồng độ mol (M): n C ( A ) A M V (lít ) dd Nồng độ Molan (m): 11
5.2 ĐỘ HÒA TAN - CÁC YẾU TỐ ẢNH HƯỞNG
Dung dịch bão hòa và độ hòa tan
Độ hòa tan (Solubility): nồng độ
chất tan trong dung dịch bão hòa
Dung dịch bão hòa (Saturated
solution): quá trình hòa tan và quá
trình kết tinh cân bằng nhau Dung dịch quá bão hòa
(Suspension): nồng độ chất tan cao
hơn nồng độ chất tan trong dung dịch bão hòa 12
5.2 ĐỘ HÒA TAN - CÁC YẾU TỐ ẢNH HƯỞNG
Các yếu tố ảnh hưởng đến độ hòa tan
Tương tác giữa chất tan và dung môi
Tổng quát: “giống nhau thì tan vào nhau”. 13
5.2 ĐỘ HÒA TAN - CÁC YẾU TỐ ẢNH HƯỞNG
Các yếu tố ảnh hưởng đến độ hòa tan
Ảnh hưởng của nhiệt độ
Chất rắn hòa tan vào chất lỏng
Chất khí hòa tan vào chất lỏng Sol. Sol. To To To , độ hòa tan To , độ hòa tan 14
5.2 ĐỘ HÒA TAN - CÁC YẾU TỐ ẢNH HƯỞNG
Độ hòa tan tăng khi nhiệt độ tăng + H (thu nhiệt) soln solute + solvent + heat solution Tăng nhiệt độ
Độ hòa tan giảm khi tăng nhiệt độ - H (tỏa nhiệt) soln solute + solvent solution + heat Tăng nhiệt độ 15 Ex: An 80 g sample of NaNO is added to 200 g 3 of H O at 20°C. Use the 2 solubility curve below to calculate how much more NaNO needs to 3 be added to make the solution saturated with NaNO at 20°C. 3
5.2 ĐỘ HÒA TAN - CÁC YẾU TỐ ẢNH HƯỞNG
Các yếu tố ảnh hưởng đến độ hòa tan
Ảnh hưởng của áp suất
Độ tan của khí tỉ lệ thuận với áp suất của khí 17
5.2 ĐỘ HÒA TAN - CÁC YẾU TỐ ẢNH HƯỞNG
Các yếu tố ảnh hưởng đến độ hòa tan
Ảnh hưởng của áp suất C : độ hoà tan của khí, k Định luật Henry: C kP k k P : áp suất riêng phần, k
k: hằng số Henry (mol/l.atm) low P high P low c high c
Ví dụ: Nồng độ hòa tan của N (k) trong nước ở 25°C và 1 atm là 2
6.8×10−4 M. Tính nồng độ của N hòa tan trong nước ở điều kiện áp 2
suất riêng phần là 0.78 atm. Hướng dẫn:
- Áp dụng biểu thức: C = k.P - [N ] = 5.3 −4 2 ×10 M 19
5.3 TÍNH CHẤT TẬP HỢP CỦA DUNG DỊCH KHÔNG ĐIỆN LY Hơi bão hòa
Các phân tử có động năng lớn
sẽ di chuyển nhanh lên bề mặt thoáng và đi vào pha khí tạo
nên pha hơi của chính chất lỏng đó hơi bão hòa
Áp suất riêng phần của chất
lỏng trong pha hơi bão hòa gọi là áp suất hơi bão hòa. 20
5.3 TÍNH CHẤT TẬP HỢP CỦA DUNG DỊCH KHÔNG ĐIỆN LY
Giảm áp suất hơi bão hòa disordred disordered strong Gas weaker driving driving force force “Ordered” Liquid less “Ordered” Solute molecule
Chất tan không bay hơi làm giảm áp suất hơi bão hòa 21
5.3 TÍNH CHẤT TẬP HỢP CỦA DUNG DỊCH KHÔNG ĐIỆN LY
Giảm áp suất hơi bão hòa
Độ giảm áp suất hơi bão hòa phụ thuộc vào nồng độ chất tan.
Định luật Raoult, 1880
P : áp suất hơi bão hòa của dung dịch 1
P x P P :ápsuấthơibãohòacủachấtlỏngtinhkhiết 1 1 1 1
x : phân mol của chất tan trong dung dịch 1 𝟏 𝟐 P = X P0 22 2 1
Ví dụ: Hòa tan 218 g glucose (PTL = 180.2 g/mol) vào 460 mL nước cất ở 30°C (PH2O
= 31.82 mmHg). Tính áp suất hơi bão hòa của dung dịch và độ giảm áp suất hơi bão hòa? Hướng dẫn:
- Tính phân mol của nước và glucose
- Áp dụng biểu thức: P x P 1 1 1 - P = 30.4 mmHg dd 23
5.3 TÍNH CHẤT TẬP HỢP CỦA DUNG DỊCH KHÔNG ĐIỆN LY Định luật Raoult Chất tan dễ bay hơi :
Ví dụ: ethanol (chất tan A) hòa tan vào H O (dung môi B) 2 Gas Liquid Solute molecule (Ethanol)
Áp suất hơi bão hòa = Tổng áp suất riêng phần của các thành phần trong hệ 24
5.3 TÍNH CHẤT TẬP HỢP CỦA DUNG DỊCH KHÔNG ĐIỆN LY Định luật Raoult Chất tan dễ bay hơi : A
Nếu A hòa tan vào B tạo dung dịch dễ bay
hơi thì dung dịch này được xem là dung B
dịch lý tưởng (ideal solution, H = 0 soln ) P = A XAP 0A P = B XBP 0B P = T PA + PB P = H T XAP0A + XBP0B soln = H1 + H2 + H3
Tương tác A - B = A - A + B - B 25
Ví dụ: Benzene và toluene tạo thành dung dịch “lý tưởng” benzene toluene (A) (B) P X A = AP 0A P X B = BP 0B P P T = A + PB P X T = AP 0A + XBP 0B
Benzene và toluene có cấu trúc gần giống nhau
Đối với các dung dịch không “lý tưởng” ???? 26
Hầu hết các dung dịch đều không lý tưởng và có sai lệch so với định luật Raoult! Sai lệch dương Sai lệch âm Force Force Force Force Force Force + > + A-B < A-A B-B A-B A-A B-B 27
5.3 TÍNH CHẤT TẬP HỢP CỦA DUNG DỊCH KHÔNG ĐIỆN LY Tăng nhiệt độ sôi
Ví dụ: khảo sát quá trình hòa tan
NaCl (chất tan không bay hơi) vào nước
Dung dịch sôi ở nhiệt độ cao hơn dung môi tinh khiết Tb T K m b b
K : hằng số nghiệm sôi, chỉ phụ thuộc vào bản chất của b dung môi. 28
m: nồng độ molan, phụ thuộc vào nồng độ của chất tan
5.3 TÍNH CHẤT TẬP HỢP CỦA DUNG DỊCH KHÔNG ĐIỆN LY
Giảm nhiệt độ đông đặc Freezing point depression
Dung dịch kết tinh ở nhiệt độ
thấp hơn dung môi tinh khiết Tkt T K m f f Boiling point
K : hằng số nghiệm lạnh, chỉ phụ f elevation
thuộc vào bản chất của dung môi.
m: nồng độ molan của chất tan 29 30
Ví dụ: Ethylene glycol (EG), CH2(OH)CH2(OH), được dùng trong một số động cơ
như là một hợp chất chống đông đặc. Dung dịch EG-H2O sôi ở 197°C. Tính nhiệt độ
đông đặc của dung dịch này chứa 651 g EG trong 2505 g H2O. Biết Kf của ethylene glycol là 1.86 oC/m. Hướng dẫn: - Áp dụng biểu thức: T K m f f - Lưu ý đơn vị - ∆T o f = 6.19 C 31
5.3 TÍNH CHẤT TẬP HỢP CỦA DUNG DỊCH KHÔNG ĐIỆN LY
Hiện tượng thẩm thấu Dd dừng tăng khi Dd muối 3% cân bằng với áp Thể tích dd suất ngoài Màng bán tăng thấm Nước cất
Hiện tượng thẩm thấu là quá trình di chuyển của dung môi từ nơi có 32
nồng độ thấp sang nơi có nồng độ cao.
5.3 TÍNH CHẤT TẬP HỢP CỦA DUNG DỊCH KHÔNG ĐIỆN LY
Hiện tượng thẩm thấu time High P Low P More out less out than in than in
Hiện tượng thẩm thấu là quá trình di chuyển của dung môi từ nơi áp
suất cao sang nơi có áp suất thấp 33
5.3 TÍNH CHẤT TẬP HỢP CỦA DUNG DỊCH KHÔNG ĐIỆN LY
Hiện tượng thẩm thấu “Higher “Lower vapor vapor pressure” pressure”
Màng bán thấm chỉ cho dung môi di chuyển qua lại nhưng chất tan thì không 34
5.3 TÍNH CHẤT TẬP HỢP CỦA DUNG DỊCH KHÔNG ĐIỆN LY Áp suất thẩm thấu
Áp suất thẩm thấu : là áp suất cần thiết để dừng thẩm thấu V nRT n RT V CRT 35
Ví dụ: Hòa tan 35,0 g hemoglobin (Hb) trong nước đủ để tạo thành 1 lít
dung dịch. Nếu áp suất thẩm thấu của dung dịch là 10,0 mmHg ở 25 °C, hãy
tính khối lượng mol của hemoglobin Hướng dẫn: n - Áp dụng biểu thức: R T V - Lưu ý đơn vị C R T - Mhb = 6.51 104 36
5.3 TÍNH CHẤT TẬP HỢP CỦA DUNG DỊCH KHÔNG ĐIỆN LY Thẩm thấu
Dd ưu trương: > 0,92% Hồng cầu bị co héo. Dd đẳng trương: 0,92%
Dd thiểu trương: < 0,92%
Hồng cầu trương nở và bị vỡ 37
5.3 TÍNH CHẤT TẬP HỢP CỦA DUNG DỊCH KHÔNG ĐIỆN LY
Ứng dụng của thẩm thấu
Thẩm thấu ngược: P > 38 TÓM TẮT
Tính chất tập hợp của dung dịch chỉ phụ thuộc vào lượng chất tan trong dung dịch.
Giảm áp suất hơi bão hòa P o 1 = X1P1
Tăng nhiệt độ sôi của dung dịch ∆T = K m b b
Giảm nhiệt độ đông đặc của dung dịch ∆T = K f f m Áp suất thẩm thấu (π) π = CRT 39 5.4 Dung dịch điện ly 1. Định nghĩa acid – baz
2. Sự ion hóa của nước. Độ pH
3. Hằng số ion hóa của acid và baz
4. Sự thủy phân. Dung dịch đệm
5. Chuẩn độ acid – baz. Chất chỉ thị pH
6. Tính acid - baz và cấu trúc phân tử
7. Cân bằng ion của hợp chất ít tan. Các yếu tố ảnh hưởng đến độ tan 40
5.4.1. Định nghĩa acid – baz Theo Arrhenius
Acid là chất có khả năng cho proton (H+)
Baz là chất có khả năng cho OH- 41 Ion H+ trong nước:
Ion H+(k) chỉ là proton.
Trong nước H+(dd) bị hydrat hóa:
Đơn giản nhất là H O+( 3 dd),
phức tạp hơn có H O + và 5 2 H O +. 9 4
Thường viết H+(dd) hay H O+( 3 dd) để chỉ proton. 42
5.4.1. Định nghĩa acid – baz Theo Bronsted - Lowry Acid cho H+; Baz nhận H+
Xét phản ứng: HCl + H O Cl- + H O+ 2 3
HCl cho proton cho nước: HCl là acid.
H O nhận proton từ HCl: H O là baz. 2 2
Nước có thể là acid, và cũng có thể là baz
Nước có tính lưỡng tính. NH + H O NH + + OH- 3 2 4 baz acid 43
5.4.1. Định nghĩa acid – baz Theo Bronsted - Lowry
Cặp Acid-Baz liên hợp:
Cặp acid-baz liên hợp khác nhau đúng một proton 44
5.4.1. Định nghĩa acid – baz Theo Lewis
Acid và baz Lewis không nhất thiết phải chứa
Acid Lewis: chất nhận đôi điện tử proton.
Baz Lewis: chất cho đôi điện tử
Acid Lewis thường có lớp điện tử chưa bão hòa Ví dụ: is. n tử
Định nghĩa của Lewis về acid và baz mang tính tổng quát nhất. 45
5.4.2. Sự ion hóa của nước 46
5.4.2. Sự ion hóa của nước
Tích số ion của nước
Quá trình phân ly của nước là quá trình cân bằng ở 25 C
H2O(l) + H2O(l) H3O+(aq) + OH-(aq) + - [H O ][OH ] 3 K c 2 [H O] 2 2 + - K [H O] [H O ] O [ H ] c 2 3 + - 14 K [H O ] O [ H ] , 1 0 1 0- w 3 47
K gọi là tích số ion của nước w 50
5.4.2. Sự ion hóa của nước Đo pH 51
5.4.2. Sự ion hóa của nước
Chất chỉ thị pH (pH indicator)
Một số chất đổi màu khi thay đổi pH. Đó là
các chất chỉ thị pH (chất chỉ thị màu).
Phần lớn các chất chỉ thị màu có màu đỏ trong môi trường acid (ngoại trừ
phenolphthalein và alizarin vàng có màu đỏ trong môi trường kiềm). Chỉ thị màu
Dùng chất chỉ thị màu mang tính tương đối pH < 1,2 < pH < 2,8
(cho biết khoảng giá trị của pH). 2,8 < pH < 10 pH 52
5.4.2. Sự ion hóa của nước
Chất chỉ thị pH (pH indicator) HIn (aq) H+ (aq) + In- (aq) Color 1 Color 2
[HIn] 10 Màu của acid (HIn) [In-]
[HIn] 10 Màu của base (In-) liên hợp [In-] 53 HIn (aq) H+ (aq) + In- (aq) Color 1 Color 2 thêm (H+) cân bằng Lấy bớt H+ cân bằng dịch chuyển sang trái dịch chuyển sang phải. -H+ +H+
Khoảng đổi màu từ đỏ (ở pH 3.1) sang cam-vàng (ở pH 4.4) 54 Phenolphthalein 55 Bromthymol Blue pH 5 pH 8 56 57
Một số chất chỉ thị pH thông dụng 58
5.4.3. Hằng số ion hóa của Acid – Baz Acid mạnh
Phân ly hoàn toàn trong dung dịch
Dùng mũi tên một chiều để biểu diễn sự phân ly của chất điện ly mạnh Ví dụ: HNO + H O H O+ + NO - 3 2 3 3 Baz mạnh
Phân ly hoàn toàn trong dung dịch
pOH (và pH) được quyết định bởi nồng độ của baz mạnh
Baz không nhất thiết phải chứa ion OH- Ví dụ: NH + H+ NH + 3 4 59
5.4.3. Hằng số ion hóa của Acid – Baz Acid yếu
Acid yếu phân ly một phần trong dung dịch
Quá trình phân ly là quá trình cân bằng
(K là hằng số phân ly của acid) a 60
5.4.3. Hằng số ion hóa của Acid – Baz Acid yếu Độ phân ly
Có thể dự đoán độ mạnh của acid dựa trên độ phân ly.
Độ phân ly càng cao, acid càng mạnh.
Độ phân ly giảm khi nồng độ acid yếu tăng.
Vd: Acid acetic: dung dịch 0,05 M α là 2,0%
trong khi với dung dịch 0,15 M α là 1,0%. 61
5.4.3. Hằng số ion hóa của Acid – Baz Acid yếu
Sử dụng K để tính pH, a
Ví dụ: Tính độ phân ly () và pH của dung dịch CH COOH 0,01M. 3 CH COOH CH COO- + H+ 3 3
Bỏ qua sự phân ly của nước, nếu dung
dịch acid acetic là chất duy nhất phân ly ra ion CH COO- và H+ thì: 3
[CH COO-] = [H+] = [CH COOH] = .C 3 3 o = (1- ).C 62 [CH COOH] 3 cb
5.4.3. Hằng số ion hóa của Acid – Baz Baz yếu
Baz nhận proton từ các chất khác.
Cân bằng phân ly của baz yếu: Baz + H O Acid liên hợp+ + OH- 2 Ví dụ: NH + H O NH + + OH- 3 2 4 Hằng số phân ly, K : b + [NH ] OH [ -] 4 K b [NH ] 3
K càng lớn, baz càng mạnh. b 63
5.4.3. Hằng số ion hóa của Acid – Baz Baz yếu
Baz phải có đôi điện tử tự do hay điện tích âm để có thể tương tác với proton.
Amin tương tự như amoniac, có một hay nhiều nhóm N-H (Td: CH NH ) là các 3 2 baz.
Anion của acid yếu là baz.
Td: OCl- là baz liên hợp của acid yếu HOCl.
ClO-(aq) + H2O(l) HClO(aq) + OH-(aq) Kb = 3.3 x 10-7
Xác định pH của dung dịch baz yếu tương tự như cho acid yếu: tính [OH-] như
tính [H+], từ đó suy ra pH. 64
5.4.3. Hằng số ion hóa của Acid – Baz Liên hệ giữa K và K a b
Mối liên hệ giữa acid và baz liên hợp Baz + H O Acid liên hợp+ + OH- 2 Acid liên hợp+ Baz + H+ từ (*) và (**): K = K w a × Kb 65
5.4.3. Hằng số ion hóa của Acid – Baz
Acid phân ly theo nhiều nấc
Acid phân ly theo nhiều nấc là acid đa chức và phân ly theo từng nấc.
Nấc đầu phân ly dễ nhất. Càng về sau càng phân ly khó..
Do đó, K > K > K ... a1 a2 a3
Phần lớn H+(dd) là do nấc đầu tiên phân ly ra (ứng với K ). a1 66
5.4.3. Hằng số ion hóa của Acid – Baz
Acid phân ly theo nhiều nấc 67
5.4.3. Hằng số ion hóa của Acid – Baz
Acid phân ly theo nhiều nấc
Acid Phosphoric: acid ba chức H PO + H O H PO - + H O+ K = 7,1×10-3 3 4 2 2 4 3 a1 H PO - + H O HPO 2- + H O+ K = 6,3 2 4 2 4 3 a2 ×10-8 HPO 2- + H O PO 3- + H O+ K = 4,2 4 2 4 3 a3 ×10-12
toàn bộ H+ hình thành do bậc phân ly thứ nhất
Hầu như H PO - không phân ly tiếp 2 4
có thể xem [H PO - ] = [H O+] 2 4 3 68
5.4.3. Hằng số ion hóa của Acid – Baz
Acid phân ly theo nhiều nấc
Hằng số ion hóa của một số acid đa chức 69 5.4.4. Sự thủy phân
Ion có thể tác dụng như một acid hoặc baz: KW K tp1 Ka KW K tp 2 Kb
Anion của acid yếu là baz. Cation của baz yếu là acid
Phản ứng của các ion với nước tạo H O+ hay OH- trong nước gọi là phản ứng 3 thủy phân [ ] HA .[ - OH ] [MOH ].[ + H ] Ktp Ktp 1 - 2 + 70 [ A ] [M ] 5.4.4. Sự thủy phân Không phản ứng Không phản ứng Thủy phân
Anion có chứa proton mang tính lưỡng tính. Td: HSO - + H O+ H SO + H O 4 3 2 4 2 HSO - + H O SO - + H O+ 4 2 4 3 71 5.4.4. Sự thủy phân
Tính chất Acid - Baz của dung dịch muối
Muối của acid mạnh và baz mạnh muối có tính trung tính
Muối của acid yếu và baz mạnh muối có tính baz 72 5.4.4. Sự thủy phân
Tính chất Acid - Baz của dung dịch muối
Muối của acid mạnh và baz yếu muối có tính acid
Muối của acid yếu và baz yếu có thể mang tính acid hoặc baz (áp dụng quy tắc cân bằng) 73 5.4.4. Sự thủy phân
pH của dung dịch muối
Ví dụ 1: NH Cl: NH + + H O NH + H O+ 4 4 2 3 3 Tính như cho acid với K + +
a Ktp ; [NH ] = C ; [NH ] = [H O ] 4 m 3 3 [H O+ 2 ] K 3 + tp (NH ) 4 Cm [H O+ ] = ( )1/2 pH 3 K .C tp m
Ví dụ 2: CH COONa: CH COO- + H O H COOH + OH- 3 3 2 3
Tính như cho baz với K K b tp 74 5.4.4. Sự thủy phân
pH của dung dịch muối
Tính pH của dung dịch NH Cl 0,050 M. Biết K = 1,8 10-5 4 b NH + + H O NH + H O+ 4 2 3 3 Đáp số: 5,28
Tính pH của dung dịch CH COOH 0,25 M. Biết K = 18,0 10-5 3 a CH COO- + H O CH COOH + OH- 3 2 3 Đáp số: 9,08 75 5.4.4. Sự thủy phân Dung dịch đệm
Thành phần và đặc điểm của dung dịch đệm
Dung dịch đệm là dung dịch gồm acid yếu (HX) và baz liên hợp (X-) hoặc dung
dịch gồm baz yếu (MOH) và acid liên hợp (M+): + - [H ][X ] + [HX] K [H ] K a a - [HX] [X ] HX(aq) H+(aq) + X-(aq) C pH pK + log m a Cacid
Vì có thể xem [HX] lúc cân bằng = Cacid và [X-] = Cmuối 76 5.4.4. Sự thủy phân Dung dịch đệm
Thành phần và đặc điểm của dung dịch đệm
Dung dịch đệm giữ độ pH ổn định khi thêm một ít acid mạnh hoặc baz mạnh. 77 5.4.4. Sự thủy phân Đệm acid và đệm baz
Muối của baz yếu và acid mạnh là 1 acid yếu, TD: NH Cl. 4
Baz tương ứng (NH OH) là baz liên hợp của acid yếu đó (NH Cl). 4 4
Hỗn hợp NH OH và NH Cl là dung dịch đệm (đệm baz) 4 4
pH của dung dịch đệm
pH của dung dịch đệm phụ thuộc vào K . a
Nếu pK <7, đệm có môi trường acid (đệm acid). a
Nếu pK >7, đệm có môi trường baz (đệm baz). a
pH còn phụ thuộc vào tỉ lệ nồng độ của acid/baz liên hợp. 78
Tính sự thay đổi pH của dung dịch đệm khi thêm acid mạnh hay baz mạnh 79 Ví dụ:
(a) Tính pH của dd đệm chứa 1.0 M CH COOH và 1.0 COONa. Biết của 3 M CH3 Ka CH COOH là 1.8 x 10-5 3 [A-] pH = pK + log p = -log a K K [HA] a a [1.0] pH = -log (1.8 x 10-5) + log = 4.74 [1.0]
(b) Giá trị pH dd đệm là bao nhiêu sau khi thêm 0.10 mol HCl vào 1.0 lít dd đệm?
Giả sử thể tích không đổi khi thêm acid vào. [0.9] pH = -log (1.8 x 10-5) + log = 4.66 80 [1.1] 5.4.4. Sự thủy phân Dung dịch đệm
Lực chọn acid yếu và baz liên hợp phù
Điều chế dung dịch đệm
hợp với giá trị pH cần pha chế.
Chọn giá trị pK gần với pH của dung a dịch cần điều chế
Tỉ lệ giữa acid và muối là 1:1.
pH của dd được hiệu chỉnh bằng cách
thêm acid hay baz mạnh cho đến khi pH đạt được yêu cầu 81
Ví dụ: Hãy mô tả cách tiến hành pha chế dung dịch “đệm phosphate” có pH là 7.40 [A-] pH = pK + log a [HA] (7.40) Tìm tỉ lệ
Chọn cặp acid/muối phù hợp giá trị pH pKa [A-] 2- [HPO ] 7.4 = -log (6.2 x 10-8) + log 4 0.19 = 10 = 1.5 [HA] - [H PO ] 2 4 82
5.4.5. Chuẩn độ (Titration)
Phương pháp: xác định nồng độ chưa biết chính xác của một chất bằng một chất biết
chính xác nồng độ (chất chuẩn) thông qua phản ứng hóa học
Một số phương pháp chuẩn độ thông thường:
Chuẩn độ oxy hóa - khử Chuẩn độ acid – baz
Chuẩn độ phức chất
Chuẩn độ acid – baz: là phương pháp trung hòa
khi thêm một lượng acid/H+ (hay baz/OH-) vào
dung dịch baz/OH- (hay acid/H+) để phản ứng tiến
đến điểm tương đương 83
5.4.5. Chuẩn độ (Titration)
Cách tiến hành chuẩn độ
Chuẩn độ acid mạnh – baz mạnh
Chuẩn độ baz mạnh – acid yếu
Chuẩn độ acid mạnh – baz yếu 84
5.4.5. Chuẩn độ acid – baz. Chất chỉ thị màu
Chuẩn độ acid mạnh bằng baz mạnh
Đường biểu diễn sự phụ thuộc của pH
thể tích chất chuẩn thêm vào được
gọi là đường cong chuẩn độ.
Điểm tương đương (equivalence
point): là điểm mà tại đó lượng acid và
baz tác dụng vừa đủ với nhau.
pH tại điểm tương đương (khi chuẩn
độ acid mạnh bằng baz mạnh) là 7,00. 85
5.4.5. Chuẩn độ acid – baz. Chất chỉ thị màu
Chuẩn độ acid mạnh bằng baz mạnh
Thêm dung dịch baz mạnh (NaOH) vào dung dịch acid mạnh (HCl) với phenolphtalein làm chỉ thị màu 86
5.4.5. Chuẩn độ acid – baz. Chất chỉ thị màu
Chuẩn độ acid yếu bằng baz mạnh
Chuẩn độ CH3COOH bằng NaOH
Ở thời điểm đầu dung dịch chỉ có acid pH của dd acid yếu
Khi thêm baz, muối của acid yếu hình thành.
Trước điểm tương đương acid vẫn còn dư,
dung dịch là dd đệm. pH tính theo dd đệm CH COOH + NaOH CH COO- + H 3 3 O + Na+ 2
Tại điểm tương đương, chỉ có muối (baz liên hợp) pH tính theo dd baz yếu 87
5.4.5. Chuẩn độ acid – baz. Chất chỉ thị màu
Chuẩn độ acid yếu bằng baz mạnh
Acid càng yếu, sự thay đổi của pH càng nhỏ.
Nếu acid quá yếu thì không thể thực hiện chuẩn độ được.
Chuẩn độ baz yếu bằng acid mạnh cũng
tương tự như chuẩn độ acid yếu bằng baz mạnh. 88
5.4.5. Chuẩn độ acid – baz. Chất chỉ thị màu
Chuẩn độ acid mạnh – baz mạnh.
Chuẩn độ acid yếu – baz mạnh
Đường cong biểu diễn pH phụ thuộc hoàn toàn vào [OH-] 89
Ví dụ: Dựa vào đường cong chuẩn độ hãy tính pH tại điểm tương đương khi 25.0 ml
dd NH 0.100 M được chuẩn độ với dd HCl 0.100 M. Biết K của NH Cl là 5.6 3 a 4 ×10-10 HCl (aq) + NH Cl 3 (aq) NH4 (aq)
Tại điểm tương đương: 1 + 1 1 0.100 mol NH 1 L 3 -3 25.0 mL × × = 2.50 × 10 mol 0.05 M 1 L NH 1000 mL 3 NH +(aq) NH ( 4 3 aq) + H+(aq) Initial (M): 0.0500 0.000 0.000 Change (M): -x +x +x Equilibrium (M): (0.0500-x) x x pH = -log (5.3 x 10-6) = 5.28 90
5.4.5. Chuẩn độ acid – baz. Chất chỉ thị màu
Chuẩn độ acid phân ly theo nhiều nấc
Acid phân ly theo từng nấc, nên khi
chuẩn độ cũng thực hiện theo từng nấc.
Đường cong chuẩn độ của phản ứng
Na CO với HCl sẽ có 2 điểm tương 2 3 đương:
Điểm đầu ứng với phản ứng tạo HCO - 3
Điểm sau ứng với phản ứng tạo H CO . 2 3 91
5.4.6. Mối liên hệ giữa tính Acid – Baz với cấu trúc hóa học
Điều kiện để H-X là acid
H-X phải là lưỡng cực H+ và X- (nếu X là kim loại thì phân cực là H-, X+ và HX là baz),
Liên kết H-X phải đủ yếu, dễ bị đứt.
Baz liên hợp X-, phải bền.
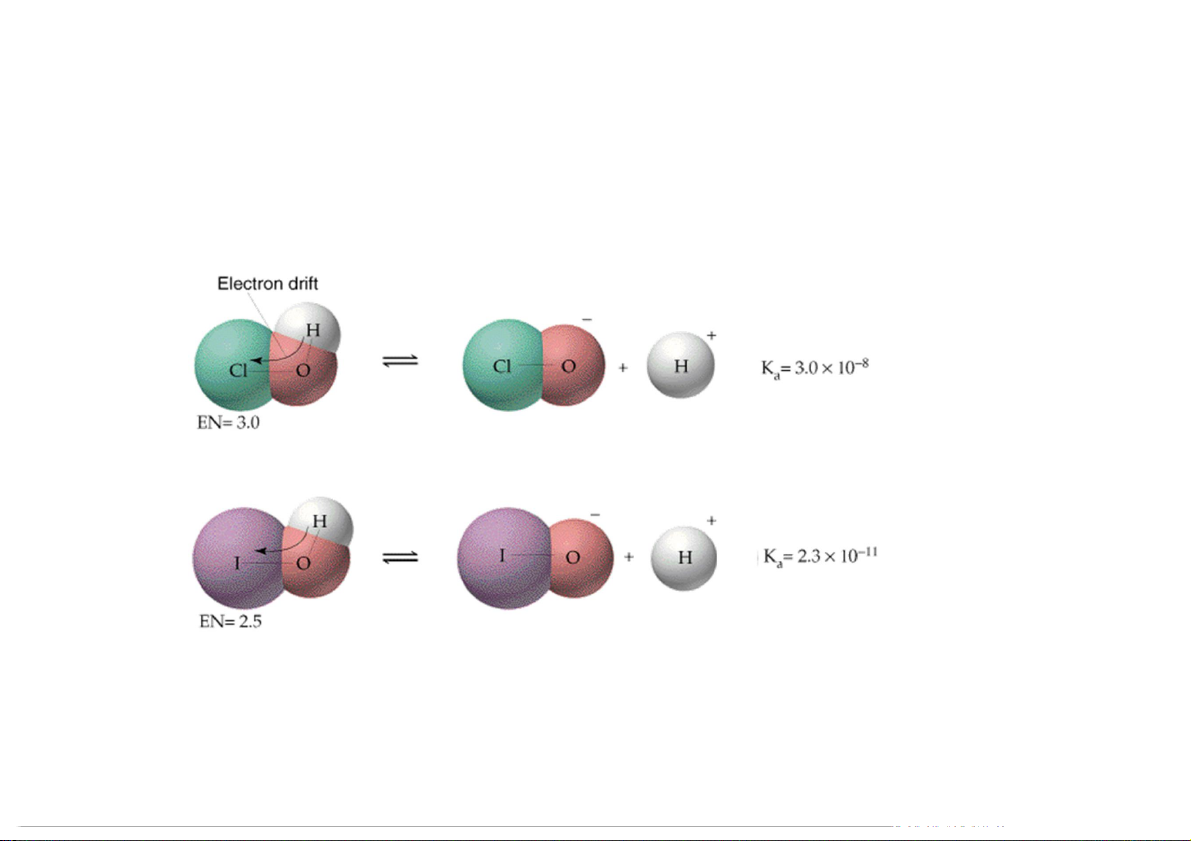
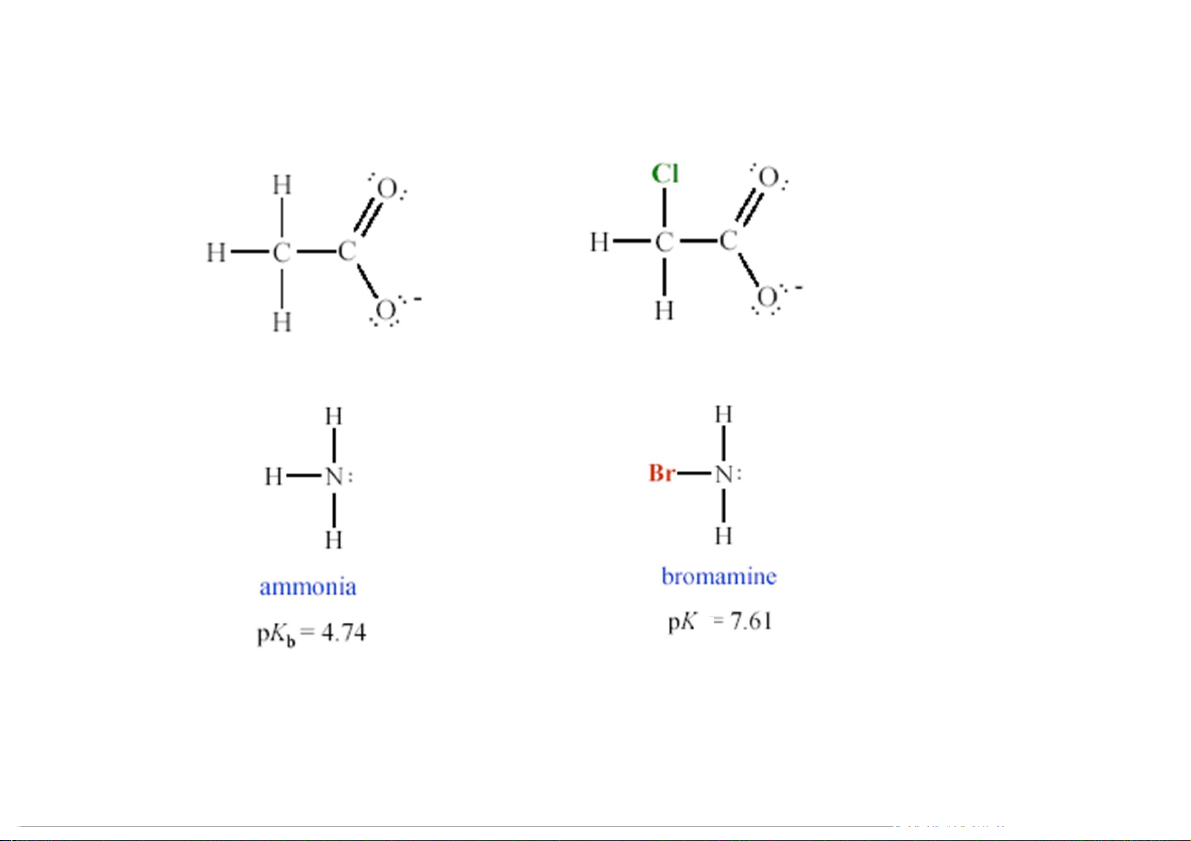
Vì sao HF lại là acid yếu trong khi HCl là acid mạnh?
Vì sao CH COOH là acid mạnh hơn C H COOH? 3 2 5
Giữa các cấu trúc phân tử và độ mạnh acid có mối liên hệ 92 HI HBr HCl HF D, pm 161 < 141 < 127 < D, kJ/mol 92 Ka 297 < 368 < 431 < 569 109 > 108 > 106 > > Cặp ion liên kết Ion tự do hydrogen 93
5.4.6. Mối liên hệ giữa tính Acid – Baz với cấu trúc hóa học Acid không chứa oxy
Tính Acid tăng trong một chu kỳ và một nhóm.
Tính Baz giảm trong một chu kỳ và một nhóm.
HF là acid yếu do liên kết cầu nối
hydro với phân tử nước mạnh.
Độ âm điện của C và H rất nhỏ
nên liên kết C-H ít phân cực và CH chẳng là acid lẫn baz. 4 94
5.4.6. Mối liên hệ giữa tính Acid – Baz với cấu trúc hóa học Acid có chứa oxy 95
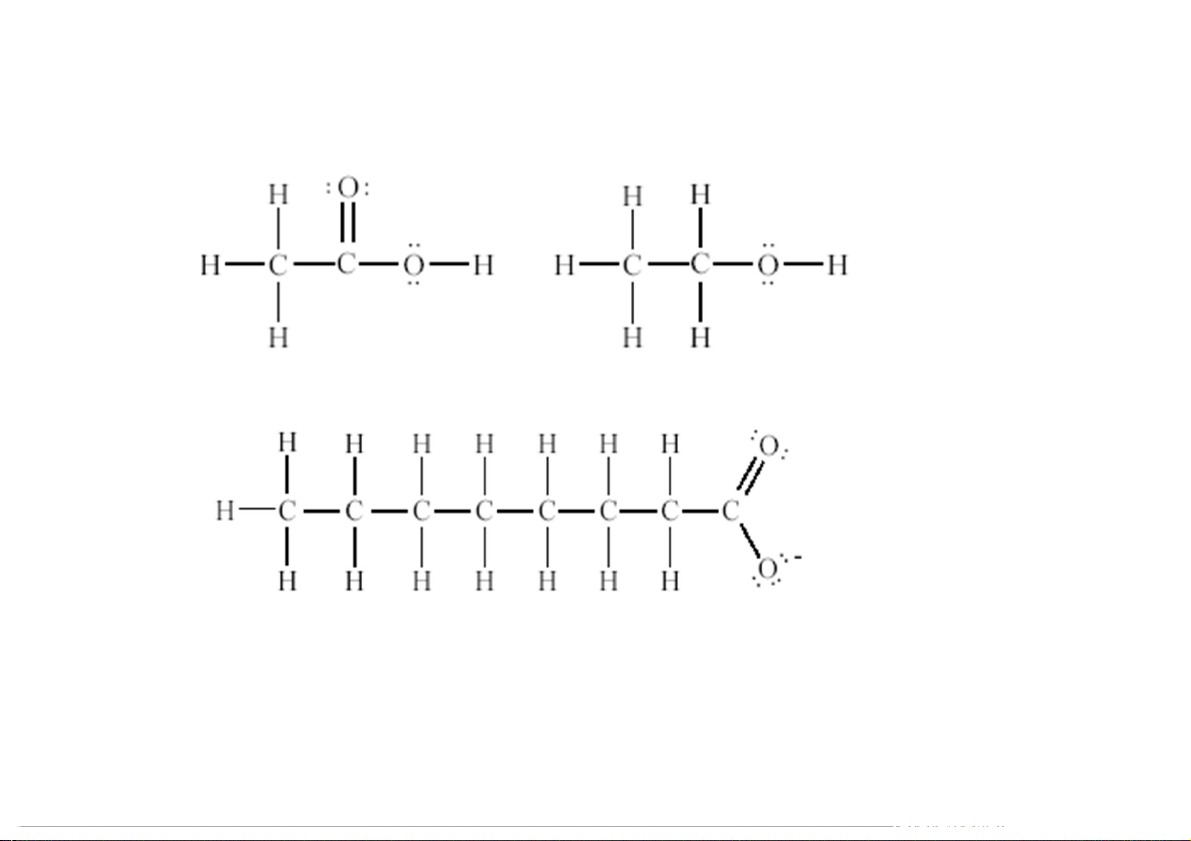
5.4.6. Mối liên hệ giữa tính Acid – Baz với cấu trúc hóa học Acid carboxylic O C R OH
• Khi proton tách ra, điện tích âm sẽ tập trung trên anion carboxylate : O O C C R O R O
• Tính acid tăng khi số nhóm chức hút điện tử trên R tăng 96 Acid acetic K = 1,8.10-5 ; Ethanol K = 1,3.10-16 a a K = 1,3.10-5 a 97 Acid K = 1,8.10-5 K = 1,4.10-3 a a Baz b 98 b 99
5.4.7. Cân bằng ion của hợp chất ít tan
Độ hòa tan – Tích số tan (K ) sp
Quá trình hòa tan của chất điện ly ít tan là quá trình cân bằng.
Td: dd bão hòa BaSO có cân bằng giữa chất tan rắn và các ion của nó trong dung 4 dịch. Với hằng số cân bằng BaSO 2- 4(s) Ba2+(aq) + SO4 (aq) K - tích số tan (T). sp 2+ 2- K [Ba ] S [ O ] sp 4
(BaSO ở pha rắn, nên không đi vào biểu thức của hằng số cân bằng) 4 100
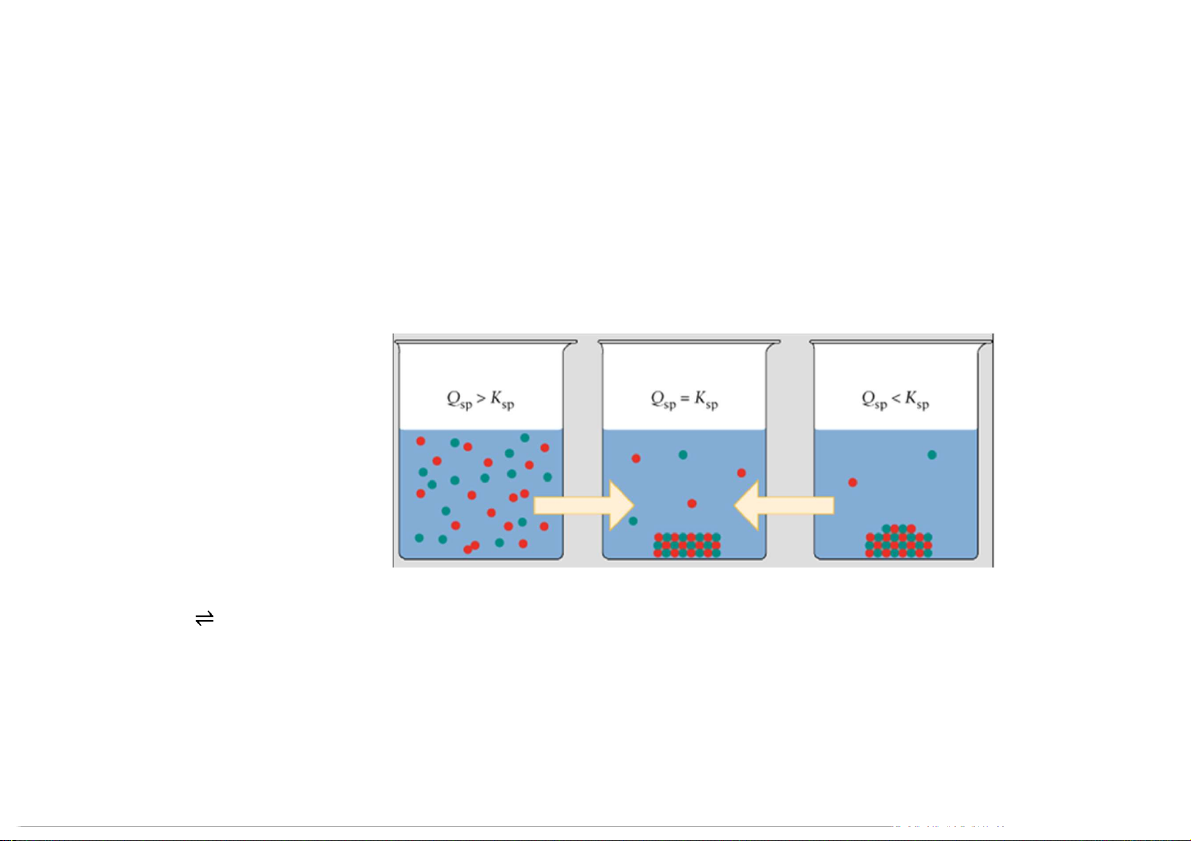
5.4.7. Cân bằng ion của hợp chất ít tan Cân bằng hòa tan
Tổng quát: Tích số tan là tích nồng độ mol của các ion trong dd Tích số ion Q
Tích nồng độ các ion đã
được lũy thừa lên với số mũ
bằng hệ số của ion trong
phương trình điện ly ở điều kiện bất kỳ Q = [Pb2+].[I-]2 Ví dụ: PbI Pb2+ + 2I- 2 K = [Pb2+].[I-]2 sp 101
5.4.7. Cân bằng ion của hợp chất ít tan Cân bằng hòa tan
Biến đổi từ độ tan thành tích số tan Ksp
Đưa độ tan về nồng độ mol;
Tìm nồng độ mol của các ion.
Đưa nồng độ mol vào biểu thức của K . và ngược lại sp 102
5.4.7. Cân bằng ion của hợp chất ít tan Cân bằng hòa tan
Ví dụ: Nhỏ 3 giọt KI 0,20 M vào 100 ml Pb(NO ) 0,01M. PbI có kết tủa không? 3 2 2
Biết 1 giọt = 0,05 ml; K (PbI ) = 7,1×10-9 sp 2 - , 0 0 m 5 l l 1 , 0 20molKI 1molI n . 3 . . . - I 1 1000ml l 1 m 1 olKI -5 - 3.10 molI [I-] = 3.10-4 mol/l ; [Pb2+] = 0,01 M
Q = [Pb2+].[I-]2 = ( 0,01) (3.10-4)2 = 3×10-10 Q < K 103 sp không kết tủa
5.4.7. Cân bằng ion của hợp chất ít tan
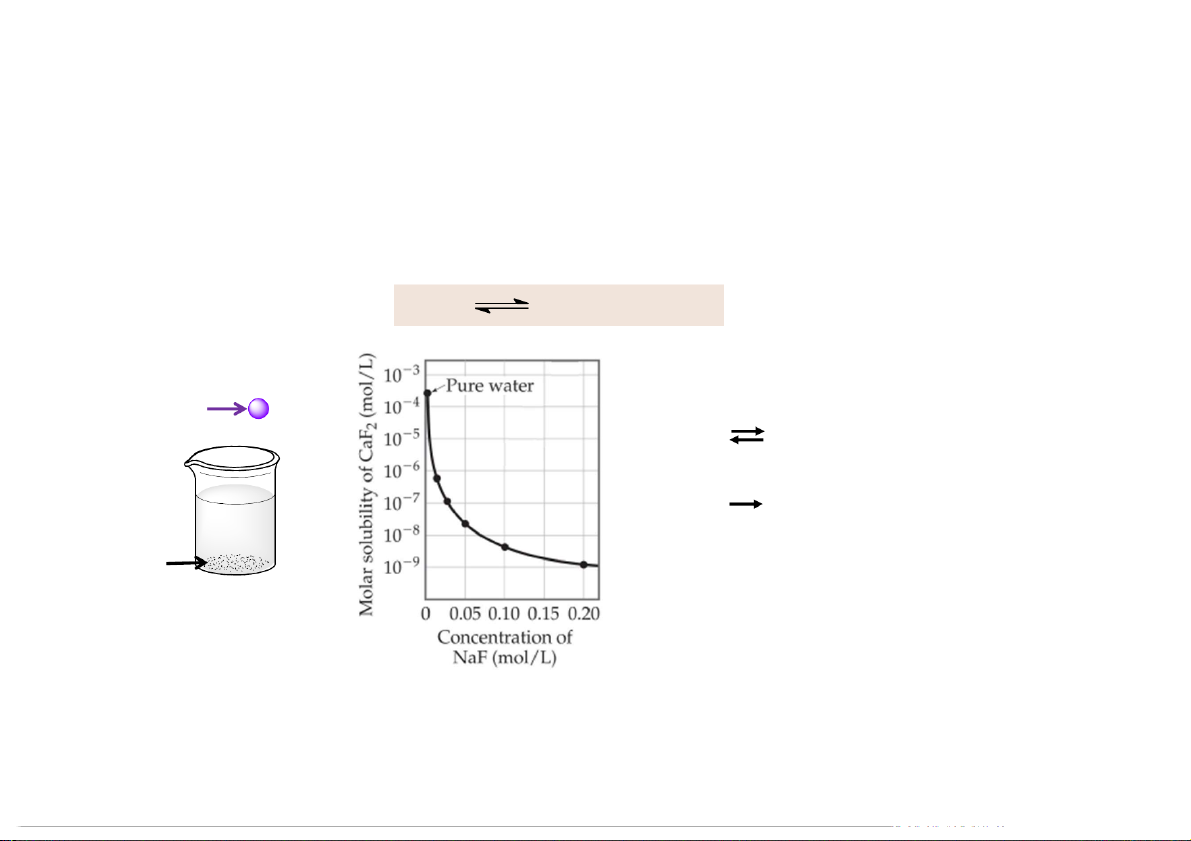
Các yếu tố ảnh hưởng đến độ tan Hiệu ứng ion chung CaF2(s) Ca2+(aq) + 2F-(aq) Add NaF CaF2(s) Ca2+(aq) + F-(aq) NaF (s) Na+(aq) + F-(aq) CaF2 104
5.4.7. Cân bằng ion của hợp chất ít tan
Các yếu tố ảnh hưởng đến độ tan Hiệu ứng ion chung CaF2(s) Ca2+(aq) + 2F-(aq) Add NaF CaF2(s) Ca2+(aq) + F-(aq) NaF (s) Na+(aq) + F-(aq) F- Ca2+ Ca2+ F- CaF2
CaF2 càng khó tan khi thêm F- vào 105
Ví dụ: Tính độ tan của AgCl (g/L) trong dung dịch AgNO 6.5×10-3 của 3 M. Biết Ksp AgCl là 1.6×10-10 Hướng dẫn: K của [Ag+] và Nồng độ Độ tan của sp AgCl [Cl-] AgCl AgCl (g/L)
• Dựa vào sơ đồ trên để tính độ tan của AgCl 1.8 x 10-3 g/L
• Áp dụng hiệu ứng ion chung cho Ag+ để tính lại [Ag+] [AgCl] trong dung dịch AgNO3
Độ tan của AgCl/dung dịch AgNO 3.6 x 10-3 g/L 3 Kết luận 106
5.4.7. Cân bằng ion của hợp chất ít tan
Các yếu tố ảnh hưởng đến độ tan Độ hòa tan và pH CaF2(s) Ca2+(aq) + 2F-(aq)
Nếu lấy bớt ion F-, thì cân bằng sẽ dịch chuyển về phía tạo F- và CaF tan ra. 2
Có thể lấy F- bằng cách thêm acid mạnh HCl: F-(aq) + H+(aq) HF(aq)
Trong trường hợp này khi pH giảm, [H+] tăng, độ tan tăng. 107
5.4.7. Cân bằng ion của hợp chất ít tan
Các yếu tố ảnh hưởng đến độ tan Hiệu ứng muối:
Thêm muối không chứa ion
chung với chất khó tan sẽ
làm tăng độ tan của chất này
Nồng độ muối thêm vào, mol/l 108
5.4.7. Cân bằng ion của hợp chất ít tan
Quá trình kết tinh và phân tích các ion Dựa vào độ tan
có thể tách từng ion ra khỏi dung dịch.
Ví dụ: có ion Zn2+ và Cu2+ trong dung dịch.
CuS (K = 6.10-37) ít tan hơn ZnS (K = 2.10-25), sp sp
CuS sẽ bị đẩy ra khỏi dung dịch trước ZnS.
Khi thổi H S vào dung dịch, CuS sẽ kết tủa trước 2
ZnS hình thành sau khi gần như toàn bộ Cu2+ kết tủa 109
5.4.7. Cân bằng ion của hợp chất ít tan
Cân bằng tạo phức chất +
Xét sự hình thành Ag(NH ) +: 3 2
Ag+(aq) + 2NH3(aq) Ag(NH3)2(aq) Ag(NH ) + : ion phức 3 2 NH (baz Lewis): ligand. 3 Hằng số bền, K :f [Ag(NH ) + ] 3 2 K f + 2 [Ag ][NH ] 3
Nghịch đảo của hằng số bền là hằng số không bền. 110
5.4.7. Cân bằng ion của hợp chất ít tan
Cân bằng tạo phức chất
Mối liên hệ giữa K và K sp f AgCl Ag+ (s) + Cl- Ksp Ag+ + 2NH + 3 Ag(NH3)2 Kf AgCl + 2NH + 3 Ag(NH3)2 + Cl- K = Ksp x Kf 111
Ví dụ: Tính nồng độ của AgCl trong dung dịch NH 1.0 3 M [Cl-] = [AgCl] + - [Ag(NH ) ][Cl ] K =K K = 3 2 sp f [NH ]2 3 -10 7 = (1.6 × 10 )(1.5 × 10 ) = 2.4 × 10-3 AgCl + 2NH + 3 Ag(NH3)2 + Cl-
Xác định nồng độ của các chất tại cân bằng [Cl-] [AgCl] = 0.045 M 112
hằng số bền của một số ion phức 113 5.5 DUNG DỊCH KEO (COLLOIDS)
Điều gì sẽ xảy ra nếu một chất tan không hòa tan hoàn toàn vào dung môi? Solution Suspension Homogeneous Heterogeneous Colloids
1 to 1000 nm (10–9 to 10–6 m)
Định nghĩa: là sự phân tán các hạt của một chất này trong môi trường phân tán của chất khác
Các hạt trong dung dịch keo chỉ lơ lửng trong dung dịch mà không sa
lắng tách khỏi dung dịch (như dung dịch huyền phù).
Kích thước hạt lớn: tạo thành dd mờ, vẩn đục, dạng sữa. 114
Kích thước hạt nhỏ: dung dịch có thể trong suốt 5.5 DUNG DỊCH KEO (COLLOIDS) 115 5.5 DUNG DỊCH KEO (COLLOIDS)
Chất hoạt động bề mặt - Surfactants (surface-active agents): bao gồm một phần
kỵ nước và một phần ưa nước. Ví dụ: xà phòng, chất tẩy rửa… Kỵ nước Ưa nước Water (polar) (nonpolar) 5.5 DUNG DỊCH KEO (COLLOIDS)
Hiệu ứng Tyndall (Tyndall Effects): dung dịch keo có thể phân tán ánh sáng khi chúng được chiếu vào
Có thể thấy ánh sáng mặt trời bị phân tán bởi bụi
Sử dụng đèn chiếu gần khi lái xe trong điều kiện sương mù. 117